Оксид азота(II) — это… Что такое Оксид азота(II)?
Оксид азота(II) (мон(о)оксид азота, окись азота, нитрозил-радикал) NO — несолеобразующий оксид азота. В нормальных условиях он представляет собой бесцветный газ, плохо растворимый в воде. Сжижается с трудом[источник не указан 301 день]; в жидком и твёрдом виде имеет голубой цвет.
Наличие неспаренного электрона обусловливает склонность NO к образованию слабосвязанных димеров N2O2. Это непрочные соединения с ΔH° димеризации около 17 кДж/моль. Жидкий оксид азота(II) на 25 % состоит из молекул N2O2, а твёрдый оксид целиком состоит из них.
Получение
Оксид азота(II) — единственный из оксидов азота, который можно получить непосредственно из свободных элементов соединением азота с кислородом при высоких температурах (1200—1300 °C) или в электрическом разряде. В природе он образуется в атмосфере при грозовых разрядах (тепловой эффект реакции −180,9 кДж):
и тотчас же реагирует с кислородом:
При понижении температуры оксид азота(II) разлагается на азот и кислород, но если температура падает резко, то не успевший разложиться оксид существует достаточно долго: при низкой температуре скорость распада невелика. Такое резкое охлаждение называется «закалкой» и используется при одном из способов получения азотной кислоты.
Такое резкое охлаждение называется «закалкой» и используется при одном из способов получения азотной кислоты.
В лаборатории его обычно получают взаимодействием 30%-ной HNO3 с некоторыми металлами, например, с медью:
Более чистый, не загрязнённый примесями NO можно получить по реакциям:
Промышленный способ основан на окислении аммиака при высокой температуре и давлении при участии Pt, Cr2O3 (как катализаторов):
Химические свойства
При комнатной температуре и атмосферном давлении происходит окисление NO кислородом воздуха:
Для NO характерны также реакции присоединения галогенов с образованием нитрозилгалогенидов, в этой реакции NO проявляет свойства восстановителя с образованием нитрозилхлорида:
В присутствии более сильных восстановителей NO проявляет окислительные свойства:
В воде NO мало растворим и с ней не реагирует, являясь несолеобразующим оксидом.
Физиологическое действие
Оксид азота (белый) в цитоплазме клеток хвойных пород деревьев через час после механического воздействия. Темно-зелёные круги в клетках — ядра, в некоторых из ядер, в свою очередь, заметны ядрышки (светло-зелёные).Как и все оксиды азота (кроме N2O), NO — токсичен, при вдыхании поражает дыхательные пути.
За два последних десятилетия было установлено, что эта молекула NO обладает широким спектром биологического действия, которое условно можно разделить на регуляторное, защитное и вредное. NO действует как посредник в передаче клеточных сигналов внутри клетки и между клетками. Оксид азота, производимый клетками эндотелия сосудов, отвечает за расслабление гладких мышц сосудов и их расширение (вазодилатацию), предотвращает агрегацию тромбоцитов и адгезию нейрофилов к эндотелию, участвует в различных процессах в нервной, репродуктивной и иммунной системах. NO также обладает цитотоксическими и цитостатическими свойствами. Клетки-киллеры иммунной системы используют оксид азота для уничтожения бактерий и клеток злокачественных опухолей.
Оксид азота может синтезироваться несколькими путями. Растения используют неферментативную фотохимическую реакцию между NO2 и каротиноидами. У животных синтез осуществляют семейство NO-синтаз (NOS). NOS-ферменты — члены гем-содержащего суперсемейства ферментов, названных монооксигеназами. В зависимости от структуры и функций, NOS могут быть разделены на три группы: эндотелиальные (eNOS), нейрональные (nNOS) и индуцибельные (iNOS). В активный центр любой из NO-синтаз входит железопорфириновый комплекс, содержащий аксиально координированный цистеин или метионин. Хотя все изоформы NOS катализируют образование NO, они являются продуктами различных генов, каждая из них имеет свои особенности как в механизмах действия и локализации, так и в биологическом значении для организма.
cNOS постоянно находится в цитоплазме, зависит от концентрации ионов кальция и кальмодулина (белок, являющийся внутриклеточным посредником переноса ионов кальция) и способствует выделению небольшого количества NO на короткий период в ответ на стимуляцию рецепторов. Индуцибельная NOS появляется в клетках только после индукции их бактериальными эндотоксинами и некоторыми медиаторами воспаления, такими как гамма-интерферон, фактор некроза опухоли и др. Количество NO, образующегося под влиянием iNOS, может варьировать и достигать больших количеств (наномолей). При этом продукция NO сохраняется длительнее.
Характерной особенностью NO является способность быстро (менее чем за 5 секунд) диффундировать через мембрану синтезировавшей его клетки в межклеточное пространство и легко (без участия рецепторов) проникать в клетки-мишени. Внутри клетки он активирует одни и ингибирует другие ферменты, участвуя в регуляции клеточных функций и фактически действуя как локальная сигнальная молекула.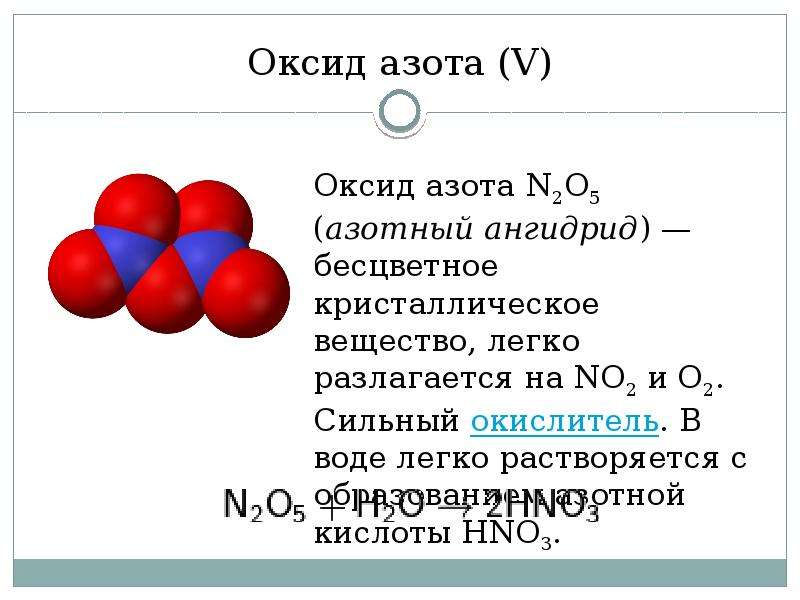
Оксид азота способен инициировать образование кровеносных сосудов. В случае инфаркта миокарда оксид азота играет положительную роль, так как индуцирует новый сосудистый рост, но при раковых заболеваниях тот же самый процесс вызывает развитие опухолей, способствуя питанию и росту раковых клеток. С другой стороны, вследствие этого улучшается доставка оксида азота в опухолевые клетки. Повреждение ДНК под действием NO является одной из причин развития апоптоза (запрограммированный процесс клеточного «самоубийства», направленный на удаление клеток, утративших свои функции). В экспериментах наблюдалось дезаминирование дезоксинуклеозидов, дезоксинуклеотидов и неповрежденной ДНК при воздействии раствора, насыщенного NO. Этот процесс ответствен за повышение чувствительности клеток к алкилирующим агентам и ионизирующему излучению, что используется в антираковой терапии.
Повреждение ДНК под действием NO является одной из причин развития апоптоза (запрограммированный процесс клеточного «самоубийства», направленный на удаление клеток, утративших свои функции). В экспериментах наблюдалось дезаминирование дезоксинуклеозидов, дезоксинуклеотидов и неповрежденной ДНК при воздействии раствора, насыщенного NO. Этот процесс ответствен за повышение чувствительности клеток к алкилирующим агентам и ионизирующему излучению, что используется в антираковой терапии.
Клиренс NO (скорость очищения крови от NO в процессе его химических превращений) происходит путем образования нитритов и нитратов и составляет в среднем не более 5 секунд. В клиренс могут быть вовлечены промежуточные ступени, связанные со взаимодействием с супероксидом или с гемоглобином с образованием пероксинитрита. Оксид азота может быть восстановлен NO-редуктазой — ферментом, тесно связанным с NO-синтазой.
В 1998 году Роберту Ферчготту, Луису Игнарро и Фериду Мураду была присуждена Нобелевская премия по физиологии и медицине с формулировкой: «За открытие роли оксида азота как сигнальной молекулы в регуляции сердечно-сосудистой системы». [1]
[1]
Применение
Получение NO является одной из стадий получения азотной кислоты.
См. также
Примечания
Оксид азота — это… Что такое Оксид азота?
Оксиды азота — соединения азота с кислородом.
Список оксидов
Азот образует несколько соединений с кислородом:
Оксид азота, N2O | Оксид азота, NO | Оксид азота , N2O3 | Оксид азота , NO2 |
Оксид азота,(NO2)2 или N2O4 | Азотный ангидрид, N2O5 |
N
2OОксид азота N2O — бесцветный газ со слабым запахом, растворим в воде. Не взаимодействует с водой, растворами кислот и щелочей.
NO
Оксид азота NO — бесветный газ, незначительно растворим в воде. Не взаимодействует с водой, растворами кислот и щелочей. Оксид азота (II) — очень реакционноспособное соединение, может вступать в реакции присоединения с рядом солей (нитрозосоли), с галогенами (напр., нитрозилхлорид NOCl), органическими соединениями. При обычной температуре NO соединяется с кислородом с образованием NO2. Оксид NO получают каталитическим окислением при производстве азотной кислоты.
N
2O3(III)Оксид N2O3 (азотистый ангидрид) неустойчив при обычных условиях, взаимодействует с водой, образуя азотистую кислоту HNO2.
NО
2, N2O4Оксид азота NО2 — бурый газ, токсичен, тяжелее воздуха, легко сжижается. При комнатной температуре NО2 находится в смеси с его бесцветным димером N2O4, приблизительно 1:1. Взаимодействует с водой:
При комнатной температуре NО2 находится в смеси с его бесцветным димером N2O4, приблизительно 1:1. Взаимодействует с водой:
2NO2 + Н2О = HNO3 + HNO2 и растворами щелочей:
2NO2 + 2NaOH = NaNO3 + NaNO2 + H2О
Сильный окислитель. Многие вещества (уголь, сера, фосфор, органические соединения) могут гореть в NО2. Этот оксид окисляет SО2 до SO3, на этой реакции основан нитрозный метод получения серной кислоты. Раздражает дыхательные пути, при больших концентрациях появляется отёк легких.
N
2O5(V)Оксид N2O5 (азотный ангидрид) — бесцветное кристаллическое вещество, легко разлагается на NО2 и О2. Сильный окислитель. В воде легко растворяется с образованием азотной кислоты HNO3.
Воздействие на организм
Все оксиды азота физиологически активны, относятся к третьему классу опасности. ПДК (оксид азота в пересчете на NO2) – 5,0 мг/м3.
ПДК (оксид азота в пересчете на NO2) – 5,0 мг/м3.
Применение
Оксиды азота зарегистрированы в качестве пищевой добавки E918.
См.также
Выхлопные газы
Wikimedia Foundation. 2010.
Ингаляция оксида азота при дыхательной недостаточности недоношенных детей
Вопрос обзора: Приводит ли ингаляция оксидом азота к повышению показателей выживаемости у недоношенных детей с заболеваниями легких, не вызывая при этом долгосрочного повреждения головного мозга или легких?
Актуальность: Дыхательная недостаточность у недоношенных новорожденных может осложняться повышенным давлением в сосудах, несущих кровь в легкие (легочная гипертензия). Для поддержки жизнедеятельности таких младенцев используется механическая вентиляция (искусственная вентиляция легких), а также могут использоваться седативные препараты. Ингаляция оксида азота (iNO) помогает регулировать мышечный тонус в артериях легких и уменьшить легочную гипертензию. Таким образом, это может снизить потребность в искусственной вентиляции легких, что приводит к уменьшению повреждения легких. Однако оксид азота оказывает воздействие на функцию тромбоцитов и, как полагают, потенциально увеличивает риск кровотечения (геморрагий), в частности, кровоизлияния в головной мозг.
Таким образом, это может снизить потребность в искусственной вентиляции легких, что приводит к уменьшению повреждения легких. Однако оксид азота оказывает воздействие на функцию тромбоцитов и, как полагают, потенциально увеличивает риск кровотечения (геморрагий), в частности, кровоизлияния в головной мозг.
Характеристика исследований: В результате поиска, обновленного в январе 2016 года, авторы обзора нашли 17 рандомизированных контролируемых испытаний, в которых изучали эффекты оксида азота у недоношенных новорожденных. В этих испытаниях изучали недоношенных детей с очень разными исходными характеристиками. Поэтому мы решили разделить их на три группы: (1) клинические испытания, в которых дети с тяжелым заболеванием легких получали лечение в первые несколько дней жизни, (2) исследования, в которых младенцы с повышенным риском развития хронического заболевания легких получали лечение спустя несколько первых дней жизни и (3) клинические испытания, в которых младенцы с перенесенным респираторным дистрессом получали стандартное раннее лечение.
Основные результаты: Ни в одной из трех групп испытаний применение оксида азота не привело к повышению выживаемости, и нет согласующихся доказательств, позволяющих предположить, что оксид азота уменьшает повреждение легких. Исследования в первой группе (раннее лечение) показали увеличение частоты тяжелых кровоизлияний в головной мозг на 20%. Этот результат был близок к статистически значимым. Качество доказательств было от среднего (умеренного) до высокого.
В этом обзоре исследований было обнаружено, что ингаляционная терапия оксидом азота не повышает шансы улучшения исходов у недоношенных детей с заболеваниями легких. Детям с тяжелыми заболеваниями применение оксида азота не помогло, а, возможно, способствовало повышению риска внутричерепных кровоизлияний
Вздохнуть свободнее. В Петербурге испытали аппарат для лечения тяжелых форм COVID-19
Разработка эффективной вакцины — приоритетная задача для мирового научного сообщества. На этой неделе число заболевших новой коронавирусной инфекцией на планете перевалило за 28 миллионов.
На этой неделе число заболевших новой коронавирусной инфекцией на планете перевалило за 28 миллионов.
Но вместе с цифрами меняются и подходы к лечению пациентов с COVID-19. Врачи, химики, биологи фактически ежедневно обмениваются новыми данными и успехами на фронтах битвы с инфекцией.
Хорошие новости на этой неделе пришли из центра Алмазова. В Петербурге первыми испытали новую российскую установку, которая заметно меняет подходы к лечению пациентов с тяжелыми формами протекания болезни.
Корреспондент телеканала «Санкт-Петербург» Александр Чуев раскроет детали.
Так выглядит реанимация центра Алмазова. Рядом с койкой — российская установка «Тианокс». Первая в мире, способная синтезировать очень важный в медицине газ — оксид азота.
С помощью дыхательной маски или аппарата искусственной вентиляции легких вещество в небольших дозах доставляют в легкие пациента. Дальше газ поступает в кровеносную систему и снижает давление в так называемом малом круге обращения, то есть в легких.
«Оксид азота является вазодилататором. То есть он снижает сопротивление — расширяет сосуды. Мы дополнительно к кислороду даем оксид азота, который увеличивает перфузию, то есть увеличивает ток крови по тем отделам, куда попадает оксид азота».
Оксид азота таким образом используют уже десятки лет. Однако единственным способом транспортировки газа все это время были только баллоны. В медучреждениях созданы специальные бригады, ответственные за эксплуатацию подобной техники.
«Вот так выглядит баллон с оксидом азота. А это установка для него. В год медицинскому центру нужно полтысячи таких баллонов, что стоит немало. Новая российская разработка может заменить всю методику. На медицинский центр нужно всего пятнадцать подобных аппаратов».
Причем стоимость новинки даже меньше, чем импортный прибор для подключения баллонов. Все, что нужно «Тианоксу» — это розетка.
«Для того, чтобы получить оксид азота, нужен азот и кислород.
И тот и другой компонент есть в окружающем нас воздухе. Необходимо провести реакцию. Аппарат реализует принцип электродного разряда. В высоковольтной дуге происходит сжигание азота с образованием оксида азота, который затем и подается из аппарата в воздухоносные пути пациента».
Как произвести такую реакцию прямо в палате — нашли решение саровские ученые из ядерного центра Всероссийского научно-исследовательского института экспериментальной физики. Центр Алмазова первым провел клинические испытания новинки.
В течение шести месяцев врачи использовали аппараты в своей работе. Заключение положительное. «Тианокс» найдет самое широкое применение в больничных палатах — от спасения новорожденных с патологиями сердца, борьбы с пневмониями и до лечения коронавируса.
«Оксид азота обладает прямым статическим воздействием на вирус, он убивает вирус. Поэтому сегодня технология применения оксида азота для вирусной пневмонии немного изменилась, и во всем мире стараются отодвинуть эту технологию на как можно ранние стадии заболевания».
В центре Алмазова сегодня принимают самых тяжелых пациентов — рожениц с сердечными патологиями. Это те мамочки, которым детстве, в 90-е годы, не сделали вовремя операцию из-за банального отсутствия средств.
С возрастом недуг приводит к необратимым и неоперабельным изменениям. Беременность тогда противопоказана. Тем не менее, женщины на свой страх и риск решаются завести детей. Обычно их привозят в Центр Алмазова на 32-й неделе в очень тяжелом состоянии.
Речь о тысячах человек в год из разных регионов. По мировой статистике, в половине случаев спасти жизнь матери не удается. Петербургским врачам смертельный исход удалось снизить до рекордных 16%. По словам специалистов, новый российский аппарат будет незаменим в этой работе.
Подписывайтесь на нас:
Фото и видео: телеканал «Санкт-Петербург»
Снижение выбросов оксидов азота | Сиб Контролс
Снижение выбросов оксидов азота в атмосферу.

Что такое оксиды азота NOx?
Термин NO относится к семейству химических веществ, загрязняющих воздух — оксидов азота. NO представляет собой семь различных соединений, хотя наиболее опасным является только одно — диоксид азота. Диоксид азота (NO2) – это опасный загрязнитель воздуха, который может вступать в реакцию с озоном. Данная реакция может приводить к образование кислотных дождей. NO2 представляет собой красновато-коричневый газ с горьким запахом, похожий на запах хлора. NO2 также обычно называют оксидом азота и дейтеоксидом азота, который обладает высокой реактивной способностью.
NO является промежуточным продуктом при производстве азотной кислоты. Азотная кислота является нитрующим реагентом при производстве химических взрывчатых веществ, отбеливателем для муки, замедлителем окисления акрилатов и окислителем в ракетном топливе. Оксид азота использовался в различных ракетных установках в многочисленных беспилотных космических исследованиях и до сих пор используется для космических путешествий в системах орбитального маневрирования космических кораблей.
Где встречается Оксид азота?
NO2 в естественном виде в окружающей среде можно встретить в дыхании бактерий, вулканах, молнии, а также в стратосфере. По оценкам ученых, каждая средняя вспышка молнии превращает около 7 кг азота в оксид азота. Каждый год во всем мире, в среднем, происходит 1,4 миллиарда вспышек молнии, что дает много естественного оксида азота, однако из этих же источников NO2, принято считать остаточным газом в атмосфере Земли, где он выполняет функцию поглощения солнечного света и регулирования химического состава тропосферы, в частности концентрацию озона. По сравнению с выбросами NO2 от естественных процессов, количество выбросов NO2 от сжигания горючего ископаемого больше, более чем в три раза.
Основной причиной образования NO2 является двигатель внутреннего сгорания. Двигатели внутреннего сгорания используются для работы автомобилей, катеров, кораблей, мотоциклов, локомотивов, вертолетов, самолетов и многого другого. Дополнительные источники образования оксида азота — печи, газовые, керосиновые обогреватели и сигаретный дым. Наиболее заметными историческими причинами образования диоксида азота были ядерные испытания, что стало причиной появления печально известных красноватых грибовидных облаков. Их образования связано с высокими температурами ядерных реакций, так как кислород и азот не реагируют между собой при температуре окружающей среды. При высоких температурах они подвергаются эндотермической реакции с образованием оксидов или диоксидов азота.
Дополнительные источники образования оксида азота — печи, газовые, керосиновые обогреватели и сигаретный дым. Наиболее заметными историческими причинами образования диоксида азота были ядерные испытания, что стало причиной появления печально известных красноватых грибовидных облаков. Их образования связано с высокими температурами ядерных реакций, так как кислород и азот не реагируют между собой при температуре окружающей среды. При высоких температурах они подвергаются эндотермической реакции с образованием оксидов или диоксидов азота.
Почему требуется снижать выбросы оксида азота?
У людей, регулярно подвергающихся воздействию NO2, повышается риск заболевания легких. Чаще всего страдают те, кто работает в сельском хозяйстве и подвергается воздействию NO2 в результате разложения растений в силосохранилищах. На самом деле, это заболевание настолько распространено, что это заболевание легких называют «болезнью силосных ям». Данное заболевание легких, вызванное NO2, может привести, в некоторых случаях, к преждевременной смерти и, в меньшей степени, к эмфиземе или бронхиту. Также известно, что NO2 может накапливаться в организме людей и приводить к сердечнососудистым заболеваниям.
Также известно, что NO2 может накапливаться в организме людей и приводить к сердечнососудистым заболеваниям.
В результате жаркой и солнечной погоды, ЛОВ (Летучие Органические Вещества) и оксид азота взаимодействуют между собой, и образуется смог. Смог (приземный озон) наносит ущерб растительности и снижает урожайность. Когда оксид азота и диоксид серы вступают в реакцию с другими составляющими воздуха, образуется кислотный дождь. Кислотный дождь наносит ущерб автомобилям, зданиям и историческим памятникам. Для окружающей среды влияние кислотных дождей наиболее заметно в водной среде, включая ручьи, реки, озера и болота, где воздействие на рыб и дикую природу может быть чрезвычайно опасным.
Когда кислотные дожди попадают в почву, они способны вытягивать соединения алюминия из глинистых пород почвы и переносить их в подземные воды. Животные, которые наиболее чувствительны к кислотным дождям и алюминию, как правило, молодые особи. При определенных уровнях pH, вызванных кислотным дождем, икринки рыб не способны к дальнейшему развитию, и даже более старые особи рыб погибают в данной среде. Животные с более высокой чувствительностью к уровням pH пострадают больше всего. Важно помнить, что экосистемы являются целостными и воздействие на один вид не будет ограничено данным видом. Кислотный дождь не только откладывает алюминий в почве, но и лишает ее минералов и питательных веществ, которые поддерживают здоровый рост растений.
Животные с более высокой чувствительностью к уровням pH пострадают больше всего. Важно помнить, что экосистемы являются целостными и воздействие на один вид не будет ограничено данным видом. Кислотный дождь не только откладывает алюминий в почве, но и лишает ее минералов и питательных веществ, которые поддерживают здоровый рост растений.
Растения, которые подвергаются воздействию кислотных дождей, не погибают сразу, сначала их листья становятся коричневого цвета, они становятся более восприимчивыми к воздействию низких температур и меньше способны поглощать солнечный свет, что в дальнейшем приводит к их гибели.
В то время как большое количество кислоты находится в жидкой форме, кислота также может находиться и в частицах пыли. Это называется сухим осаждением. Эти кислоты особенно агрессивны по отношению к металлам, краске и камню, вызывая быстрое разрушение. Часто эмоциональный ущерб, причиняемый кислотной пылью, так же велик, как и финансовый ущерб, так как различные памятники архитектуры чрезвычайно подвержены разрушению.
Все влияние оксида азота, описанное в данной статье, показывает, что уменьшение выбросов NOx, NO2 и кислотных дождей имеет важное значение для сохранения здоровья, как окружающей среды, так и всего населения Земли. При этом также важно знать, что затраты на охрану окружающей среды препятствуют получению сверх прибылей коммерческой деятельности.
Мы можем предложить решения по борьбе с выбросами, которые имеют разумные капитальные затраты, низкие эксплуатационные расходы, практически не требуют затрат на обслуживание и имеет небольшие размеры, чтобы обеспечить учет всех потребностей предприятий по защите окружающей среды.
Итак, как мы можем уменьшить выбросы оксида азота NO и появление кислотных дождей?
Существует много вариантов переработки NO в зависимости от комбинации ЛОВ. Предлагаемая системы переработки включают в себя: термоокислитель, углеродный адсорбер, систему селективного каталитического восстановления или скруббер.
Термический окислитель (также известный как камера дожига, или печь дожига, или термический окислитель прямого сжигания) — это технологическая установка для снижения выбросов ЛОВ, которая разлагает опасные газы при высоких температурах. В результате работы установки выделяется тепло (которое может быть в дальнейшем утилизировано), водяной пар и углекислый газ. Существует много различных типов технологий термоокислителей, доступных для решения конкретных задач по уничтожению опасных веществ, таких как PTO, TO, каталитические рекуперативные окислители и многие другие.
Углеродный адсорбер является одной из наиболее распространенных технологий снижения загрязнения воздуха. Углеродные адсорберы необходимы, когда Вы пытаетесь одновременно снизить выбросы ЛОВ и выбросы NO, и при этом восстановить растворитель. В углеродном адсорбере загрязненный технологический поток проходит через слой активированного угля. Углерод в активированном угле действует как адсорбер, удаляя ЛОВ из технологического потока, затем удерживая их на поверхности или в порах углерода.
При выборе углеродного адсорбера нужно учитывать состав Вашего технологического потока. Для того чтобы углеродный адсорбер был наиболее эффективен, технологический поток должен быть с низким содержанием влаги и твердых частиц, так как углерод является пористым материалом, поры которого могут легко забиться. Если в технологическом потоке слишком много влаги или слишком много твердых частиц, мы можем порекомендовать систему предварительной фильтрации и / или сушильную камеру для обеспечения большей эффективности при переработке ЛОВ.
Система селективного каталитического восстановления (СКВ) предусматривает катализатор восстановления оксида азота и систему впрыска аммиака. Каталитическая реакция аммиака через селективный каталитический восстановитель (СКВ) уменьшает выброс оксида азота путем преобразования его в основные и безвредные элементы атмосферного воздуха: азот, кислород и воду. Катализатор поставляется в различных вариантах в зависимости от применения. Система впрыска аммиака позволяет вводить аммиак в процесс, для соединения с оксидом азота и уменьшения его выбросов.
Регулятор расхода аммиака (РСА) и инъекционная решетка аммиака (ИРА) для впрыска водного раствора аммиака в газовый поток контролирует подачу безводного аммиака в соответствии с системой анализа оксида азота и аммиака (NH3). Как и в случае с углеродными адсорберами, ИРА склонны к засорению, поэтому необходимо учитывать их эффективность для обеспечения долгосрочной эксплуатации. Ключом к этой оптимальной и продолжительной производительности является конструкция системы и правильное понимание всех вопросов, связанных с воздушным потоком, для обеспечения правильного смешивания аммиака во время переработки ЛОВ и NO.
Термин «Скруббинг» часто используется неправильно для обозначения удаления ЛОВ. Важно знать, что существует много типов скрубберов, но наиболее эффективным для удаления оксида азота является влажный скруббер.
Влажный скруббер использует жидкость (в основном воду) для удаления загрязняющих веществ из воздушного потока. Жидкость забирает твердые и газообразные загрязняющие частицы из воздуха. Влажные скрубберы — это универсальное оборудование для снижения загрязнений, которое проектируется индивидуально, для достижения максимальной эффективности удаления NO и ЛОВ из воздуха, выбрасываемого в атмосферу.
Влажные скрубберы — это универсальное оборудование для снижения загрязнений, которое проектируется индивидуально, для достижения максимальной эффективности удаления NO и ЛОВ из воздуха, выбрасываемого в атмосферу.
Жидкость, содержащая ЛОВ, собирается в форме конденсата и затем может быть использована для дальнейшей переработки. Влажные скрубберы чрезвычайно эффективны в своей конструкции, так как они часто являются единственной системой, которая может использоваться для обработки, как твердых частиц, так и газов в одном устройстве контроля загрязнений.
Статьи из серии «Снижение выбросов опасных загрязнителей воздуха»:
Часть 1: БTEк — бензол, толуол, этилбензол и ксилол.
Часть 2: Переработка хлора.
Часть 3: NOx — это загрязняющие воздух оксиды азота.
Часть 4: Переработка свинца.
Часть 5: Промышленные воздушные скрубберы для переработки аммиака.
Часть 6: SOx — это соединения молекул серы и кислорода, включая моноксид серы, диоксид серы и триоксид серы.
Часть 7: Углеводороды — метан, этан, пропан, бутан, пентан, гексан.
Часть 8: Метилмеркаптан, также известный как метантиол.
Часть 9: H2S – высококоррозионноактивный сероводород.
Часть 10: Диметилсульфид – метилтиометан.
Часть 11: Серная кислота – H2SO4.
Часть 12: Оксид этилена – EtO.
Компания Сиб Контролс может предложить множество индивидуальных решений, чтобы наилучшим образом соответствовать эксплуатационным особенностям производств у своих клиентов. В некоторых случаях требуется более низкие капитальные вложения при более высоких эксплуатационных затратах для тех систем, которые не нуждаются в непрерывной работе, или могут потребоваться чуть более высокие капитальные вложения с более низкими эксплуатационными затратами для тех систем, которые действительно нуждаются в постоянной работе. Мы можем предложить комплексные интегрированные решения с разными системами очистки воздуха, такими как: термоокислители, системы адсорбции углерода или системы фильтрации.
Для отправки запроса на термические окислители, печи дожига и другие системы снижения выбросов опасных веществ в атмосферу отправьте нам, пожалуйста, письмо на электронную почту, указанную на странице «Контакты» или заполните контактную форму «Написать нам», расположенную справа на текущей странице данного сайта.
Первый в мире прибор для синтеза оксида азота из воздуха внедрят в нижегородских больницах — В стране
ТАСС, 28 августа. Власти Нижегородской области планируют внедрить в систему здравоохранения в регионе уникальный аппарат «Тианокс» для ингаляционной терапии оксидом азота, разработанный Российским федеральным ядерным центром — Всероссийским НИИ экспериментальной физики (РФЯЦ-ВНИИЭФ, Саров). Об этом сообщили журналистам в пятницу в пресс-службе правительства региона.
Оксид азота, который сейчас получают химическим способом и транспортируют в больницы в баллонах, обладает сосудорасширяющим действием и способен снижать высокое легочное давление. «Тианокс» — первый в мире медицинский прибор, который синтезирует оксид азота из окружающего воздуха и подает его в легкие пациента. Прибор прошел госэкспертизу и 22 июня 2020 года получил регистрационное удостоверение на клиническое применение. Разработку также представили на международном форуме «Армия-2020», который проходит с 23 по 29 августа в подмосковной Кубинке.
«Тианокс» — первый в мире медицинский прибор, который синтезирует оксид азота из окружающего воздуха и подает его в легкие пациента. Прибор прошел госэкспертизу и 22 июня 2020 года получил регистрационное удостоверение на клиническое применение. Разработку также представили на международном форуме «Армия-2020», который проходит с 23 по 29 августа в подмосковной Кубинке.
«Сегодня мы провели встречу разработчиков с ведущими медицинскими специалистами Нижегородской области и представителями из других регионов. Сотрудники РФЯЦ-ВНИИЭФ рассказали о возможностях аппарата и перспективах его применения в различных областях здравоохранения. Было принято решение создать организационный комитет, который займется широким распространением передовой разработки в системе здравоохранения региона», — цитирует пресс-служба первого заместителя губернатора Нижегородской области Евгения Люлина.
Курс дополнительного обучения медиков для работы с прибором будет проходить на базе Приволжского исследовательского медицинского университета.
«Тианокс» будет востребован в кардиохирургии — для лечения больных с приобретенным пороком сердца и легочной гипертензией, людей, которые ожидают пересадки сердца. Кроме того, он эффективен при лечении заразившихся коронавирусной инфекцией. «Специалисты убедились, что у пациентов, подключенных к аппаратам ИВЛ, благодаря аппарату выживаемость увеличивалась с 15-16% до 75-76%», — отметил Люлин. По оценке специалистов, его повсеместное внедрение позволит увеличить продолжительность жизни человека в среднем на 2,5 года, отмечается в сообщении.
По словам директора научно-производственного центра физики РФЯЦ-ВНИИЭФ, члена-корреспондента РАН Виктора Селемира, ядерный центр способен выпускать около 200 таких приборов в год, что удовлетворит спрос на «Тианокс» в России. «Уже к концу сентября будет изготовлена первая партия из 50 аппаратов. В первую очередь их планируется поставлять медучреждениям Нижегородской области», — приводятся в сообщении слова Селемира.
Оксид азота(IV), химические свойства, получение
1
H
1,008
1s1
2,1
Бесцветный газ
t°пл=-259°C
t°кип=-253°C
2
He
4,0026
1s2
4,5
Бесцветный газ
t°кип=-269°C
3
Li
6,941
2s1
0,99
Мягкий серебристо-белый металл
t°пл=180°C
t°кип=1317°C
4
Be
9,0122
2s2
1,57
Светло-серый металл
t°пл=1278°C
t°кип=2970°C
5
B
10,811
2s2 2p1
2,04
Темно-коричневое аморфное вещество
t°пл=2300°C
t°кип=2550°C
6
C
12,011
2s2 2p2
2,55
Прозрачный (алмаз) / черный (графит) минерал
t°пл=3550°C
t°кип=4830°C
7
N
14,007
2s2 2p3
3,04
Бесцветный газ
t°пл=-210°C
t°кип=-196°C
8
O
15,999
2s2 2p4
3,44
Бесцветный газ
t°пл=-218°C
t°кип=-183°C
9
F
18,998
2s2 2p5
3,98
Бледно-желтый газ
t°пл=-220°C
t°кип=-188°C
10
Ne
20,180
2s2 2p6
4,4
Бесцветный газ
t°пл=-249°C
t°кип=-246°C
11
Na
22,990
3s1
0,98
Мягкий серебристо-белый металл
t°пл=98°C
t°кип=892°C
12
Mg
24,305
3s2
1,31
Серебристо-белый металл
t°пл=649°C
t°кип=1107°C
13
Al
26,982
3s2 3p1
1,61
Серебристо-белый металл
t°пл=660°C
t°кип=2467°C
14
Si
28,086
3s2 3p2
1,9
Коричневый порошок / минерал
t°пл=1410°C
t°кип=2355°C
15
P
30,974
3s2 3p3
2,2
Белый минерал / красный порошок
t°пл=44°C
t°кип=280°C
16
S
32,065
3s2 3p4
2,58
Светло-желтый порошок
t°пл=113°C
t°кип=445°C
17
Cl
35,453
3s2 3p5
3,16
Желтовато-зеленый газ
t°пл=-101°C
t°кип=-35°C
18
Ar
39,948
3s2 3p6
4,3
Бесцветный газ
t°пл=-189°C
t°кип=-186°C
19
K
39,098
4s1
0,82
Мягкий серебристо-белый металл
t°пл=64°C
t°кип=774°C
20
Ca
40,078
4s2
1,0
Серебристо-белый металл
t°пл=839°C
t°кип=1487°C
21
Sc
44,956
3d1 4s2
1,36
Серебристый металл с желтым отливом
t°пл=1539°C
t°кип=2832°C
22
Ti
47,867
3d2 4s2
1,54
Серебристо-белый металл
t°пл=1660°C
t°кип=3260°C
23
V
50,942
3d3 4s2
1,63
Серебристо-белый металл
t°пл=1890°C
t°кип=3380°C
24
Cr
51,996
3d5 4s1
1,66
Голубовато-белый металл
t°пл=1857°C
t°кип=2482°C
25
Mn
54,938
3d5 4s2
1,55
Хрупкий серебристо-белый металл
t°пл=1244°C
t°кип=2097°C
26
Fe
55,845
3d6 4s2
1,83
Серебристо-белый металл
t°пл=1535°C
t°кип=2750°C
27
Co
58,933
3d7 4s2
1,88
Серебристо-белый металл
t°пл=1495°C
t°кип=2870°C
28
Ni
58,693
3d8 4s2
1,91
Серебристо-белый металл
t°пл=1453°C
t°кип=2732°C
29
Cu
63,546
3d10 4s1
1,9
Золотисто-розовый металл
t°пл=1084°C
t°кип=2595°C
30
Zn
65,409
3d10 4s2
1,65
Голубовато-белый металл
t°пл=420°C
t°кип=907°C
31
Ga
69,723
4s2 4p1
1,81
Белый металл с голубоватым оттенком
t°пл=30°C
t°кип=2403°C
32
Ge
72,64
4s2 4p2
2,0
Светло-серый полуметалл
t°пл=937°C
t°кип=2830°C
33
As
74,922
4s2 4p3
2,18
Зеленоватый полуметалл
t°субл=613°C
(сублимация)
34
Se
78,96
4s2 4p4
2,55
Хрупкий черный минерал
t°пл=217°C
t°кип=685°C
35
Br
79,904
4s2 4p5
2,96
Красно-бурая едкая жидкость
t°пл=-7°C
t°кип=59°C
36
Kr
83,798
4s2 4p6
3,0
Бесцветный газ
t°пл=-157°C
t°кип=-152°C
37
Rb
85,468
5s1
0,82
Серебристо-белый металл
t°пл=39°C
t°кип=688°C
38
Sr
87,62
5s2
0,95
Серебристо-белый металл
t°пл=769°C
t°кип=1384°C
39
Y
88,906
4d1 5s2
1,22
Серебристо-белый металл
t°пл=1523°C
t°кип=3337°C
40
Zr
91,224
4d2 5s2
1,33
Серебристо-белый металл
t°пл=1852°C
t°кип=4377°C
41
Nb
92,906
4d4 5s1
1,6
Блестящий серебристый металл
t°пл=2468°C
t°кип=4927°C
42
Mo
95,94
4d5 5s1
2,16
Блестящий серебристый металл
t°пл=2617°C
t°кип=5560°C
43
Tc
98,906
4d6 5s1
1,9
Синтетический радиоактивный металл
t°пл=2172°C
t°кип=5030°C
44
Ru
101,07
4d7 5s1
2,2
Серебристо-белый металл
t°пл=2310°C
t°кип=3900°C
45
Rh
102,91
4d8 5s1
2,28
Серебристо-белый металл
t°пл=1966°C
t°кип=3727°C
46
Pd
106,42
4d10
2,2
Мягкий серебристо-белый металл
t°пл=1552°C
t°кип=3140°C
47
Ag
107,87
4d10 5s1
1,93
Серебристо-белый металл
t°пл=962°C
t°кип=2212°C
48
Cd
112,41
4d10 5s2
1,69
Серебристо-серый металл
t°пл=321°C
t°кип=765°C
49
In
114,82
5s2 5p1
1,78
Мягкий серебристо-белый металл
t°пл=156°C
t°кип=2080°C
50
Sn
118,71
5s2 5p2
1,96
Мягкий серебристо-белый металл
t°пл=232°C
t°кип=2270°C
51
Sb
121,76
5s2 5p3
2,05
Серебристо-белый полуметалл
t°пл=631°C
t°кип=1750°C
52
Te
127,60
5s2 5p4
2,1
Серебристый блестящий полуметалл
t°пл=450°C
t°кип=990°C
53
I
126,90
5s2 5p5
2,66
Черно-серые кристаллы
t°пл=114°C
t°кип=184°C
54
Xe
131,29
5s2 5p6
2,6
Бесцветный газ
t°пл=-112°C
t°кип=-107°C
55
Cs
132,91
6s1
0,79
Мягкий серебристо-желтый металл
t°пл=28°C
t°кип=690°C
56
Ba
137,33
6s2
0,89
Серебристо-белый металл
t°пл=725°C
t°кип=1640°C
57
La
138,91
5d1 6s2
1,1
Серебристый металл
t°пл=920°C
t°кип=3454°C
58
Ce
140,12
f-элемент
Серебристый металл
t°пл=798°C
t°кип=3257°C
59
Pr
140,91
f-элемент
Серебристый металл
t°пл=931°C
t°кип=3212°C
60
Nd
144,24
f-элемент
Серебристый металл
t°пл=1010°C
t°кип=3127°C
61
Pm
146,92
f-элемент
Светло-серый радиоактивный металл
t°пл=1080°C
t°кип=2730°C
62
Sm
150,36
f-элемент
Серебристый металл
t°пл=1072°C
t°кип=1778°C
63
Eu
151,96
f-элемент
Серебристый металл
t°пл=822°C
t°кип=1597°C
64
Gd
157,25
f-элемент
Серебристый металл
t°пл=1311°C
t°кип=3233°C
65
Tb
158,93
f-элемент
Серебристый металл
t°пл=1360°C
t°кип=3041°C
66
Dy
162,50
f-элемент
Серебристый металл
t°пл=1409°C
t°кип=2335°C
67
Ho
164,93
f-элемент
Серебристый металл
t°пл=1470°C
t°кип=2720°C
68
Er
167,26
f-элемент
Серебристый металл
t°пл=1522°C
t°кип=2510°C
69
Tm
168,93
f-элемент
Серебристый металл
t°пл=1545°C
t°кип=1727°C
70
Yb
173,04
f-элемент
Серебристый металл
t°пл=824°C
t°кип=1193°C
71
Lu
174,96
f-элемент
Серебристый металл
t°пл=1656°C
t°кип=3315°C
72
Hf
178,49
5d2 6s2
Серебристый металл
t°пл=2150°C
t°кип=5400°C
73
Ta
180,95
5d3 6s2
Серый металл
t°пл=2996°C
t°кип=5425°C
74
W
183,84
5d4 6s2
2,36
Серый металл
t°пл=3407°C
t°кип=5927°C
75
Re
186,21
5d5 6s2
Серебристо-белый металл
t°пл=3180°C
t°кип=5873°C
76
Os
190,23
5d6 6s2
Серебристый металл с голубоватым оттенком
t°пл=3045°C
t°кип=5027°C
77
Ir
192,22
5d7 6s2
Серебристый металл
t°пл=2410°C
t°кип=4130°C
78
Pt
195,08
5d9 6s1
2,28
Мягкий серебристо-белый металл
t°пл=1772°C
t°кип=3827°C
79
Au
196,97
5d10 6s1
2,54
Мягкий блестящий желтый металл
t°пл=1064°C
t°кип=2940°C
80
Hg
200,59
5d10 6s2
2,0
Жидкий серебристо-белый металл
t°пл=-39°C
t°кип=357°C
81
Tl
204,38
6s2 6p1
Серебристый металл
t°пл=304°C
t°кип=1457°C
82
Pb
207,2
6s2 6p2
2,33
Серый металл с синеватым оттенком
t°пл=328°C
t°кип=1740°C
83
Bi
208,98
6s2 6p3
Блестящий серебристый металл
t°пл=271°C
t°кип=1560°C
84
Po
208,98
6s2 6p4
Мягкий серебристо-белый металл
t°пл=254°C
t°кип=962°C
85
At
209,98
6s2 6p5
2,2
Нестабильный элемент, отсутствует в природе
t°пл=302°C
t°кип=337°C
86
Rn
222,02
6s2 6p6
2,2
Радиоактивный газ
t°пл=-71°C
t°кип=-62°C
87
Fr
223,02
7s1
0,7
Нестабильный элемент, отсутствует в природе
t°пл=27°C
t°кип=677°C
88
Ra
226,03
7s2
0,9
Серебристо-белый радиоактивный металл
t°пл=700°C
t°кип=1140°C
89
Ac
227,03
6d1 7s2
1,1
Серебристо-белый радиоактивный металл
t°пл=1047°C
t°кип=3197°C
90
Th
232,04
f-элемент
Серый мягкий металл
91
Pa
231,04
f-элемент
Серебристо-белый радиоактивный металл
92
U
238,03
f-элемент
1,38
Серебристо-белый металл
t°пл=1132°C
t°кип=3818°C
93
Np
237,05
f-элемент
Серебристо-белый радиоактивный металл
94
Pu
244,06
f-элемент
Серебристо-белый радиоактивный металл
95
Am
243,06
f-элемент
Серебристо-белый радиоактивный металл
96
Cm
247,07
f-элемент
Серебристо-белый радиоактивный металл
97
Bk
247,07
f-элемент
Серебристо-белый радиоактивный металл
98
Cf
251,08
f-элемент
Нестабильный элемент, отсутствует в природе
99
Es
252,08
f-элемент
Нестабильный элемент, отсутствует в природе
100
Fm
257,10
f-элемент
Нестабильный элемент, отсутствует в природе
101
Md
258,10
f-элемент
Нестабильный элемент, отсутствует в природе
102
No
259,10
f-элемент
Нестабильный элемент, отсутствует в природе
103
Lr
266
f-элемент
Нестабильный элемент, отсутствует в природе
104
Rf
267
6d2 7s2
Нестабильный элемент, отсутствует в природе
105
Db
268
6d3 7s2
Нестабильный элемент, отсутствует в природе
106
Sg
269
6d4 7s2
Нестабильный элемент, отсутствует в природе
107
Bh
270
6d5 7s2
Нестабильный элемент, отсутствует в природе
108
Hs
277
6d6 7s2
Нестабильный элемент, отсутствует в природе
109
Mt
278
6d7 7s2
Нестабильный элемент, отсутствует в природе
110
Ds
281
6d9 7s1
Нестабильный элемент, отсутствует в природе
Металлы
Неметаллы
Щелочные
Щелоч-зем
Благородные
Галогены
Халькогены
Полуметаллы
s-элементы
p-элементы
d-элементы
f-элементы
Наведите курсор на ячейку элемента, чтобы получить его краткое описание.
Чтобы получить подробное описание элемента, кликните по его названию.
Основная информация о NO2 | Агентство по охране окружающей среды США
На этой странице:
Что такое NO
2 и как он попадает в воздух?Двуокись азота (NO 2 ) является одним из группы высокореактивных газов, известных как оксиды азота или оксиды азота (NO x ). Другие оксиды азота включают азотистую кислоту и азотную кислоту. NO 2 используется как индикатор для большей группы оксидов азота.
NO 2 в первую очередь попадает в воздух в результате сгорания топлива.NO 2 образуется в результате выбросов легковых, грузовых автомобилей и автобусов, электростанций и внедорожного оборудования.
Воздействие NO
2Воздействие на здоровье
Воздух для дыхания с высокой концентрацией NO 2 может вызывать раздражение дыхательных путей в дыхательной системе человека. Такое воздействие в течение коротких периодов времени может усугубить респираторные заболевания, особенно астму, приводя к респираторным симптомам (таким как кашель, хрипы или затрудненное дыхание), госпитализации и обращению в отделения неотложной помощи.Более длительное воздействие повышенных концентраций NO 2 может способствовать развитию астмы и потенциально повышать восприимчивость к респираторным инфекциям. Люди, страдающие астмой, а также дети и пожилые люди, как правило, подвергаются большему риску воздействия на здоровье NO 2 .
Такое воздействие в течение коротких периодов времени может усугубить респираторные заболевания, особенно астму, приводя к респираторным симптомам (таким как кашель, хрипы или затрудненное дыхание), госпитализации и обращению в отделения неотложной помощи.Более длительное воздействие повышенных концентраций NO 2 может способствовать развитию астмы и потенциально повышать восприимчивость к респираторным инфекциям. Люди, страдающие астмой, а также дети и пожилые люди, как правило, подвергаются большему риску воздействия на здоровье NO 2 .
NO 2 вместе с другими NO x вступает в реакцию с другими химическими веществами в воздухе с образованием твердых частиц и озона. Оба они также вредны при вдыхании из-за воздействия на дыхательную систему.
Воздействие на окружающую среду
NO 2 и другие NO x взаимодействуют с водой, кислородом и другими химическими веществами в атмосфере с образованием кислотных дождей. Кислотные дожди наносят вред уязвимым экосистемам, таким как озера и леса.
Кислотные дожди наносят вред уязвимым экосистемам, таким как озера и леса.
Нитратные частицы, образующиеся в результате NO x , делают воздух мутным и трудным для просмотра. Это влияет на многие национальные парки, которые мы посещаем ради просмотра.
NO x в атмосфере способствует загрязнению прибрежных вод биогенными веществами.
Что делается для уменьшения загрязнения NO
2 ?Национальные и региональные правила EPA по сокращению выбросов NO 2 и NO x помогут правительствам штатов и местным органам власти соответствовать Национальному стандарту качества окружающего воздуха (NAAQS).
EPA определяет районы, где качество воздуха не соответствует национальным стандартам NO 2 . Для этих областей правительства штатов, местных властей и племен разрабатывают планы по сокращению количества NO 2 в воздухе.
Двуокись азота | Американская ассоциация легких
Что такое диоксид азота?
Двуокись азота, или NO 2 , представляет собой газообразный загрязнитель воздуха, состоящий из азота и кислорода, и входит в группу родственных газов, называемых оксидами азота или NOx. NO 2 образуется, когда ископаемое топливо, такое как уголь, нефть, газ или дизельное топливо, сжигается при высоких температурах. NO 2 и другие оксиды азота в наружном воздухе способствуют загрязнению частицами и химическим реакциям, вызывающим образование озона.Это один из шести широко распространенных загрязнителей воздуха, для которых действуют национальные стандарты качества воздуха, ограничивающие их содержание в воздухе снаружи. NO 2 также может образовываться в помещении при сжигании ископаемого топлива, такого как древесина или природный газ.
NO 2 образуется, когда ископаемое топливо, такое как уголь, нефть, газ или дизельное топливо, сжигается при высоких температурах. NO 2 и другие оксиды азота в наружном воздухе способствуют загрязнению частицами и химическим реакциям, вызывающим образование озона.Это один из шести широко распространенных загрязнителей воздуха, для которых действуют национальные стандарты качества воздуха, ограничивающие их содержание в воздухе снаружи. NO 2 также может образовываться в помещении при сжигании ископаемого топлива, такого как древесина или природный газ.
Каковы последствия для здоровья?
Двуокись азота оказывает ряд вредных воздействий на легкие, в том числе:
- Повышенное воспаление дыхательных путей;
- Ухудшение кашля и хрипов;
- Снижение функции легких;
- Обострение приступов удушья; и
- Повышенная вероятность госпитализации в отделение неотложной помощи. 1
Новое исследование предупреждает, что NO 2 может быть причиной астмы у детей. 2
2
Новое крупное исследование обнаружило доказательства того, что люди с раком легких подвергаются большему риску из-за NO 2 , озона и других загрязнителей наружного воздуха. В исследовании 2016 года отслеживались уровни загрязнения воздуха с 1988 по 2011 год, с которыми столкнулись более 350 000 онкологических больных в Калифорнии. Исследователи обнаружили, что воздействие этих загрязнителей воздуха сокращает их выживаемость. 3
Помимо легких, более новые исследования связали NO 2 с сердечно-сосудистыми заболеваниями, более низкой массой тела при рождении у новорожденных и повышенным риском преждевременной смерти. 4
Каковы источники выбросов диоксида азота?
Легковые автомобили, грузовики и автобусы являются крупнейшими источниками выбросов, за ними следуют электростанции, тяжелая строительная техника с дизельным двигателем и другие передвижные двигатели, а также промышленные котлы. Искусственные источники в США.В 2011 году S. выбросил 14 миллионов метрических тонн оксидов азота, в основном в результате сжигания топлива. 5 Выбросы диоксида азота будут сокращаться, поскольку очистка многих из этих источников продолжится в будущие годы.
Искусственные источники в США.В 2011 году S. выбросил 14 миллионов метрических тонн оксидов азота, в основном в результате сжигания топлива. 5 Выбросы диоксида азота будут сокращаться, поскольку очистка многих из этих источников продолжится в будущие годы.
Где возникают высокие концентрации NO
2 ? Мониторыпоказывают самые высокие концентрации NO 2 вне помещений в крупных городских районах, таких как Северо-восточный коридор, Чикаго и Лос-Анджелес. 6 Уровни выше на дорогах с интенсивным движением или рядом с ними.
NO 2 может быть проблемой и в помещении. Керосиновые или газовые обогреватели и газовые плиты также производят значительное количество диоксида азота. Если воздух из этих обогревателей или печей не выведен наружу полностью, уровни NO 2 могут накапливаться в помещении.
Оксиды азота — обзор
Химия озона в стратосфере и тропосфере определяется реакциями свободных радикалов, инициированными солнцем. Самолеты выделяют ряд веществ (например, NO x , SO x , H 2 O, CO и сажу), которые участвуют в контролирующих озон реакциях свободных радикалов и предшественников свободных радикалов.Взаимосвязь между продуктами выхлопа самолетов и озоном сложна и зависит от баланса между рядом озонообразующих и разрушающих химических процессов. Эти процессы кратко описаны в следующих двух разделах вместе с данными наблюдений, указывающими на величину воздействия самолета на озон.
Самолеты выделяют ряд веществ (например, NO x , SO x , H 2 O, CO и сажу), которые участвуют в контролирующих озон реакциях свободных радикалов и предшественников свободных радикалов.Взаимосвязь между продуктами выхлопа самолетов и озоном сложна и зависит от баланса между рядом озонообразующих и разрушающих химических процессов. Эти процессы кратко описаны в следующих двух разделах вместе с данными наблюдений, указывающими на величину воздействия самолета на озон.
Атмосферная химия
Оксиды азота в UT / LS участвуют как в циклах озонообразующей, так и в озоноразрушающей реакциях. Баланс между этими процессами и их реакция на изменения в уровнях NO x в окружающей среде являются чувствительными функциями высоты.В области UT основное влияние NO x проявляется в образовании озона в результате окисления CO и CH 4 . Цикл CO включает следующие реакции:
[I] OH + CO → H + CO2
[II] H + O2 + M → HO2 + M
[III] HO2 + NO → NO2 + OH
[IV ] NO2 + Солнечный свет → NO + O
[В] O + O2 + M → O3 + M
Нетто: CO + 2O2 → CO2 + O3
(где M представляет собой третье газообразное тело, такое как N 2 или О 2 ). Аналогичный механизм, который включает реакцию между NO и CH 3 O 2 , существует для окисления CH 4 .
Аналогичный механизм, который включает реакцию между NO и CH 3 O 2 , существует для окисления CH 4 .
Общая скорость образования озона в результате окисления CO и CH 4 обычно уменьшается с высотой из-за уменьшения концентрации CO и CH в окружающей среде 4 . Однако, как видно из приведенной выше последовательности реакций, скорость производства зависит также от концентраций NO и OH в окружающей среде. Например, увеличение содержания ОН и NO приведет к увеличению скорости реакций [I] и [III], соответственно, тем самым увеличивая скорость образования озона. При достаточно высоких концентрациях NO x (> 500 pptv) скорость образования озона начинает снижаться из-за возрастающей важности реакций NO 2 , которые удаляют частицы HO x , т.е.е.,
[VI] OH + NO2 + M → HONO2 + M
[VII] HO2 + NO2 + M → HO2NO2 + M
В LS-области основное влияние NO x заключается в разрушении озон с помощью следующих радикально-катализируемых процессов:
[VIII] O + XO → X + O2
[IX] X + O3 → XO + O2
Net: O + O3 → 2O2
(где X NO, Cl и ОН). Увеличение содержания NO x в окружающей среде из-за эмиссии самолетов усилит разрушение озона в случае X NO, но уменьшит разрушение озона в случае X Cl за счет удаления ClO посредством реакции [X]:
Увеличение содержания NO x в окружающей среде из-за эмиссии самолетов усилит разрушение озона в случае X NO, но уменьшит разрушение озона в случае X Cl за счет удаления ClO посредством реакции [X]:
[X] ClO + NO2 + M → ClONO2 + M
Точный баланс между этими противоположными эффектами зависит от фоновых концентраций NO x и ClO x .В течение большей части года чистым эффектом увеличения уровней LS NO x из-за выбросов самолетов будет увеличение концентрации озона. Исключение составляют высокие широты летом, когда уровни NO x высоки. В этом случае добавление NO x уменьшит озон.
Повышение уровней NO x , вызванное воздушным судном, оказывает косвенное влияние на атмосферные концентрации CH 4 . Этот эффект инициируется образованием радикалов ОН в реакции [III].Повышенные уровни OH в коридорах воздушного движения приводят к снижению содержания окиси углерода (CO) в результате реакции [I]. Поскольку время жизни CO превышает продолжительность жизни NO x , область пониженных концентраций CO распространяется за пределы коридоров воздушного движения в гораздо большей степени, чем выбросы самолетов NO x . Возмущение CO распространяется на тропические и субтропические регионы, где большая часть глобального окисления CH 4 происходит в результате его реакции с OH:
Поскольку время жизни CO превышает продолжительность жизни NO x , область пониженных концентраций CO распространяется за пределы коридоров воздушного движения в гораздо большей степени, чем выбросы самолетов NO x . Возмущение CO распространяется на тропические и субтропические регионы, где большая часть глобального окисления CH 4 происходит в результате его реакции с OH:
[XI] OH + Ch5 → Ch4 + h3O
По мере снижения уровней CO в тропиках соответственно повышается уровень ОН.Более высокие уровни OH служат для снижения концентраций CH 4 , что, в свою очередь, приводит к дальнейшему увеличению OH. В результате сложного взаимодействия (т. Е. Цикла атмосферной обратной связи) между NO x , OH, CO и CH 4 , увеличение NO x приведет к усиленному снижению CH 4 . Коэффициент усиления составляет примерно 1,5.
Авиационные выбросы SO x , H 2 O и сажи также влияют на концентрации озона в атмосфере, выступая в качестве прекурсоров аэрозолей.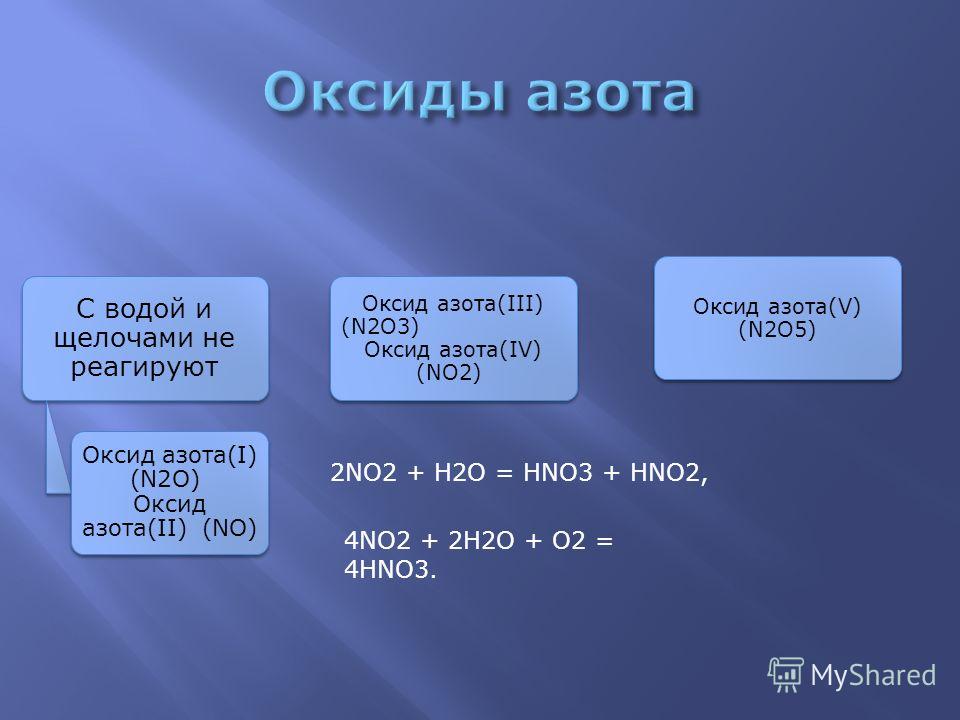 В UT аэрозоли, содержащие сульфат и водяной лед, способствуют снижению содержания озона, действуя как поверхности для гетерогенного удаления прекурсоров озона NO x и HO x . Основная выявленная гетерогенная реакция включает преобразование пентоксида азота временного резервуара NO x (N 2 O 5 ) в азотную кислоту долгосрочного резервуара (HNO 3 ).
В UT аэрозоли, содержащие сульфат и водяной лед, способствуют снижению содержания озона, действуя как поверхности для гетерогенного удаления прекурсоров озона NO x и HO x . Основная выявленная гетерогенная реакция включает преобразование пентоксида азота временного резервуара NO x (N 2 O 5 ) в азотную кислоту долгосрочного резервуара (HNO 3 ).
[XII] N2O5 + h3SO4 / h3O → 2HNO3
HNO 3 , наряду с рядом других азотных и водородных кислот и пероксидов (например,g., HNO 4 и H 2 O 2 ) абсорбируются сульфатом и водяным льдом. Поглощенные частицы могут быть удалены из UT путем осаждения.
В LS аэрозольные частицы, содержащие сульфат и водяной лед, не только удаляют частицы HO x и NO x , но также высвобождают разрушающий озон ClO x посредством гетерогенных реакций, таких как
[XIII] ClONO2 + h3O → HOCl + HNO3
Чистым эффектом гетерогенных процессов является уменьшение содержания озона в LS и UT. Однако влияние авиационных аэрозолей на озон LS / UT лишь частично компенсирует эффект выбросов NO x .
Однако влияние авиационных аэрозолей на озон LS / UT лишь частично компенсирует эффект выбросов NO x .
Гораздо меньше известно о влиянии твердых частиц сажи на озон. Озон реагирует непосредственно на поверхности сажи в лаборатории, но реакция замедляется по мере изменения поверхности. Гетерогенные реакции NO x и азотных резервуаров также происходят на поверхностях сажи — в некоторых случаях реакции приводят к более химически активным частицам, в других — к менее химически активным.Следовательно, влияние сажи самолетов на концентрацию озона в атмосфере в настоящее время плохо определено.
Согласно современным научным представлениям, общий эффект от выбросов воздушных судов в UT / LS заключается в повышении уровня озона. Модельные расчеты показывают, что воздушные суда увеличили содержание озона примерно на 6% в зонах интенсивного движения, с соответствующим увеличением общего озонового столба на 0,4%. Что касается климатических эффектов, изменения радиационного воздействия из-за увеличения содержания озона, по-видимому, в значительной степени компенсируются прогнозируемым снижением содержания метана. Однако этим расчетам присуща значительная неопределенность (см. Рисунок 2)).
Однако этим расчетам присуща значительная неопределенность (см. Рисунок 2)).
Рисунок 2. Влияние авиационной эмиссии на химический баланс в регионе UT / LS. Атмосферные химические реакции объединяют O 3 , CO, NO x и CH 4 . Среди авиационных выбросов NO x , по расчетам, оказывает наибольшее влияние на связанные частицы, повышая уровни NO x и O 3 в окружающей среде и снижая уровни CO и CH 4 .
Наблюдения за воздействием озона
Плотное воздушное движение в коридорах полетов в Северном полушарии вызовет явные географические возмущения NO x , аэрозоли и озон в двух условиях. Во-первых, крупномасштабное распространение выхлопных газов должно происходить медленнее, чем химический состав, который удаляет и / или связывает эти выбросы с озоном. Во-вторых, мощность авиационной эмиссии должна быть значительной по сравнению с другими естественными и антропогенными источниками NO x и аэрозолями.Общий объем выбросов NO x от современной глобальной авиации составляет примерно 0,5 Тг в год, из которых примерно 60% выбрасывается в верхнюю тропосферу, а 15% — в нижнюю стратосферу.
Основным источником NO x в нижней стратосфере является химическое окисление in situ закиси азота (N 2 O):
[XIV] O3 + солнечный свет → OD1 + O2
[XV] OD1 + N2O → 2NO
Глобальная скорость производства NO из N 2 O (∼12 Тг в год) намного превосходит текущие выбросы дозвуковых самолетов в нижнюю стратосферу.Следовательно, нет никаких ожиданий или наблюдательных свидетельств того, что современные самолеты значительно нарушают стратосферные уровни NO x .
В верхних слоях тропосферы к основным неавиационным источникам NO x относятся сжигание ископаемого топлива (автомобили, грузовики и т. Д.), Сжигание биомассы, выбросы в почву, молнии и окисление N 2 O. Из них только молния вносит NO x непосредственно в UT. Фракции NO x , переносимые в UT из источников на поверхности Земли или в стратосфере, невелики и происходят только во время конвективных явлений, таких как фронтальная активность или грозы, или во время событий обмена стратосферой и тропосферой, вызванных метеорологическими особенностями, такими как внетропические условия. циклоны.Оценки мощности источников для различных источников NO x приведены в таблице 2). Как показано в таблице, авиационные выбросы в UT сопоставимы по силе с другими источниками и составляют значительную часть UT NO x .
Таблица 2. Современные источники NO x в тропосфере и их приблизительная интенсивность
| Источник | Уровень выбросов (Тг год -1 ) 9 Всего Уровень выбросов (Тг год −1 ) 9–13 км полоса высот | ||
|---|---|---|---|
| Авиация | 0.5 | 0,3 | |
| Сжигание ископаемого топлива | 22 | 0,7 | |
| Сжигание биомассы | 8 | 0,2 | |
| Выбросы почвы | |||
| 0,2 | 1 | ||
| N 2 Окисление | 12 | 0,6 |
Химический отбор проб UT в коридорах и вокруг них показал, что каждый отдельный самолет нарушает окружающую среду Уровни NO x существенно на расстояниях в несколько километров позади него.В более крупных пространственных масштабах сигнатуры самолетов не были обнаружены из-за высокой изменчивости фона NO x . Точно так же не было выявлено пространственных закономерностей в концентрациях озона, которые однозначно указывали бы на производство с помощью самолетов NO x . Долгосрочные наблюдения за тенденциями изменения содержания озона на конкретных измерительных станциях (например, в Хоэнпайссенбурге, Германия и Уоллопс-Айленд, США) не коррелируют с темпами роста воздушного движения с 1970 г. по настоящее время, что указывает на то, что выбросы от самолетов не являются основным фактором наблюдаемые тенденции в верхних слоях тропосферы.
Оксид азота — обзор
Оксиды азота
Оксид азота образуется в процессах высокотемпературного горения и быстро превращается в диоксид азота. Окружающие концентрации NO 2 наиболее высоки в зимние месяцы, вблизи основных дорог, в утренние часы работы в будние дни и умеренно снижаются во второй половине дня. Наряду с CO, NO 2 является основным загрязнителем, эндогенно продуцируемым в легких и других тканях. Ожидается, что эндогенное производство будет увеличиваться при потреблении с пищей нитритов и нитратов (последний из которых встречается в значительных концентрациях в некоторых листовых овощах, таких как шпинат), а также во время иммунных реакций и воспалений.Хотя воздействие окружающей среды при нынешних концентрациях NO 2 в окружающей среде, вероятно, окажет минимальное влияние на общий баланс нитритов и нитратов вне дыхательных путей, то, как вдыхаемый NO 2 сравнивается со скоростью или количествами эндогенного образования в дыхательных путях, остается практически неизвестным. .
Двуокись азота является раздражающим газом, который вызывает окислительное повреждение легких, подобное тому, которое вырабатывается озоном. Однако NO 2 является менее сильным окислителем, чем озон, и у животных наблюдались незначительные функциональные или патологические изменения после острого воздействия NO 2 до <0.5 частей на миллион. Патологические изменения возникают в основном в терминальных бронхиолах и альвеолярной области, хотя при хроническом воздействии наблюдались изменения мукоцилиарного клиренса. Как длительное, так и кратковременное воздействие диоксида азота может повысить восприимчивость животных к респираторным инфекциям. Многие исследования с участием ряда видов животных продемонстрировали, что этот эффект включает в себя повышенную смертность, сокращение времени выживания и нарушение выведения инстиллированных патогенов. Эти результаты отражают результаты эпидемиологических исследований, которые выявили повышенную заболеваемость респираторными инфекциями в домах с газовыми приборами, но с этим источником связано множество сопутствующих загрязнителей, таких как формальдегид, CO и особенно сверхмелкозернистые частицы.Что касается воздействия окружающей среды, то остается неясным, не зависят ли эпидемиологические связи между воздействием на здоровье человека и воздействием NO 2 от других загрязнителей, связанных с дорожным движением.
Наиболее убедительные доказательства воздействия на здоровье человека кратковременного воздействия NO 2 относятся к обострению астмы. Исследования контролируемого воздействия на человека показывают, что статистически значимая часть (то есть 70% людей, страдающих астмой, подвергшихся воздействию NO 2 в состоянии покоя) испытывает повышение чувствительности дыхательных путей после 30-минутного воздействия NO 2 в диапазоне 200–300 ppb и после 60-минутной выдержки до 100 ppb.Около четверти астматиков, подвергшихся облучению в состоянии покоя, испытывают клинически значимое снижение их провокационной дозы (т. Е. Доза бронко-сужающего агента, вызывающая 100% увеличение sRaw или 20% снижение FEV 1 ) из-за НЕТ 2 экспозиции. Эти клинические данные на людях показывают, что кратковременное воздействие NO 2 может, независимо от сополлютантов, увеличивать чувствительность дыхательных путей и вызывать аллергическое воспаление. Аллергическое воспаление и чувствительность дыхательных путей являются отличительными признаками приступов астмы; Таким образом, эти клинические данные на людях подтверждают эпидемиологические результаты, которые последовательно демонстрируют связь между краткосрочным повышением концентрации NO 2 в окружающей среде и (1) увеличением количества госпитализаций и посещений отделений неотложной помощи по поводу астмы, (2) увеличением респираторных симптомов и дыхательных путей. воспаление у людей, страдающих астмой, и (3) снижение функции легких у детей с астмой.Текущий первичный национальный одночасовой стандарт США для NO 2 составляет 100 частей на миллиард, а текущее первичное национальное среднегодовое значение для NO 2 составляет 53 частей на миллиард.
Все больше данных, полученных в результате эпидемиологических исследований, установили связь между загрязнением воздуха, связанным с дорожным движением, и неблагоприятными последствиями для здоровья. Эти исследования продемонстрировали более серьезные неблагоприятные исходы у людей, живущих рядом с дорогами с интенсивным движением, чем у людей, живущих дальше (например, на расстоянии> 300 м) от дорог. Эти эпидемиологические данные были подтверждены токсикологическими исследованиями на животных и небольшими панельными клиническими исследованиями.В этих последних исследованиях люди-добровольцы подвергались воздействию загрязнения воздуха, связанного с дорожным движением (например, при ходьбе по проезжей части или езде в автомобиле), а сердечные и легочные реакции сравнивались с наблюдениями после воздействия на контрольных участках. Выявить компонент (ы) загрязнения воздуха, связанного с дорожным движением, который ответственен за наблюдаемые неблагоприятные эффекты, было сложно, но повышенные концентрации ТЧ, будь то выбросы транспортных средств или ресуспендированная дорожная пыль, и NO 2 , оба были связаны с побочные эффекты.Однако из-за относительно низкой токсичности NO 2 при соответствующих концентрациях в окружающей среде роль NO 2 в наблюдаемых побочных эффектах является спорной, и было предложено, чтобы NO 2 мог действовать как заменитель воздействия для более сильный загрязнитель, связанный с дорожным движением.
Окислы азота, кроме NO 2 , также были изучены на предмет возможных неблагоприятных последствий для здоровья. Химический анализ атмосферных аэрозолей, собранных в южной Калифорнии, показал, что нитраты вносят большой вклад в общие PM 2.Масса 5 по сравнению с другими частями США. Эти аэрозоли обычно имеют кислую природу и состоят из азотной кислоты и нитратных солей, которые образуются в результате фотохимических реакций с NO 2 и другими оксидами азота. Эти формы оксидов азота способствуют образованию кислых аэрозолей в окружающем воздухе и являются результатом взаимодействия поверхности частиц с газом, аналогичного тем, которые были описаны для образования серной кислоты. Кислотный туман, уникальный для условий прибрежных регионов Калифорнии, образуется в результате взаимодействия оксидов азота и водяных капель тумана.Оксид азота является основной формой выбросов оксидов азота автотранспортными средствами. Хотя он быстро превращается в NO 2 , оксид азота является биологически активным и естественным образом вырабатывается в организме человека. Мощный замедлитель сосудистого давления в легких, он был предложен для использования в подгруппах пациентов с заболеваниями легких. Концентрация, используемая в клинических условиях, намного выше, чем у проезжей части, и поэтому трудно оценить токсичность окружающего оксида азота.Недостаток токсикологических и эпидемиологических данных об экологически значимых концентрациях не позволяет четко оценить воздействие на здоровье частиц на основе азотной кислоты или оксида азота.
Хотя исследования ясно продемонстрировали способность оксидов азота, в частности NO 2 , иметь серьезные последствия для здоровья, наблюдается небольшое превышение NAAQS США, и в США нет областей недостижения (см. Таблицу 1). В целом исследователей больше интересуют: (1) ключевая роль оксидов азота в фотохимических реакциях, которые производят озон, и (2) присутствие оксидов азота в помещении (как на рабочем месте, так и дома).Вдали от основных дорог концентрация оксидов азота в окружающей среде обычно ниже, чем в зернохранилищах и в домах, где используются приборы, потребляющие ископаемое топливо.
Загрязнение оксидом азота (NOx) — проблемы со здоровьем
Что это такое?
Двуокись азота — раздражающий газ, который в высоких концентрациях вызывает воспаление дыхательных путей.
Когда при сгорании топлива выделяется азот, он соединяется с атомами кислорода с образованием оксида азота (NO). Далее он соединяется с кислородом с образованием диоксида азота (NO2).Оксид азота не считается опасным для здоровья при типичных концентрациях в окружающей среде, в отличие от диоксида азота. Диоксид азота и оксид азота вместе называются оксидами азота (NOx).
Газы NOx вступают в реакцию с образованием смога и кислотных дождей, а также играют центральную роль в образовании мелких частиц (ТЧ) и приземного озона, оба из которых связаны с неблагоприятными последствиями для здоровья.
Источники загрязнения NOx
NOx образуется в результате реакции азота и кислорода в воздухе во время горения, особенно при высоких температурах.В районах с интенсивным движением автотранспорта, например в крупных городах, количество оксидов азота, выбрасываемых в атмосферу в качестве загрязнения воздуха, может быть значительным. Газы NOx образуются всякий раз, когда горение происходит в присутствии азота — например, в автомобильных двигателях; они также естественным образом производятся молнией.
Выбросы NOx в ЕС — доля выбросов по отраслевым группам, 2011 г.
Приведенная ниже круговая диаграмма показывает, что автомобильный транспорт и производство энергии являются крупнейшими источниками выбросов NOx в ЕС в 2011 году.
Источник — отчет Европейского союза об инвентаризации выбросов за 1990–2011 гг. В соответствии с Конвенцией ЕЭК ООН о трансграничном загрязнении воздуха на большие расстояния (LRTAP)
Выбросы NOx в лондонском Сити
Ожидаемая относительная доля выбросов NOx от транспортных средств и газовых котлов в городе в течение 2011 года показана на круговой диаграмме ниже. Очень похожая картина прогнозируется на 2015 год.
Источник NOx в городе, 2011
Источник — «Стратегия лондонского Сити в области качества воздуха на 2011–2015 годы»
Проблемы со здоровьем, созданные NOx
NOx в основном влияет на респираторные заболевания, вызывая воспаление дыхательных путей на высоких уровнях.Длительное воздействие может снизить функцию легких, увеличить риск респираторных заболеваний и усилить реакцию на аллергены. NOx также способствует образованию мелких частиц (ТЧ) и приземного озона, оба из которых связаны с неблагоприятными последствиями для здоровья.
Воздействие диоксида азота на экосистемы
Высокий уровень NOx может оказывать негативное воздействие на растительность, включая повреждение листьев и замедление роста. Это может сделать растительность более восприимчивой к болезням и заморозкам.Изучение влияния диоксида азота и аммиака (Nh4) на среду обитания в Эппинг-Форест показало, что загрязнение, вероятно, существенно влияет на здоровье экосистемы в лесу. Исследование показало, что выбросы местного транспорта в значительной степени способствуют превышению критических уровней и критических нагрузок в этом районе. Критический уровень для защиты растительности составляет 30 мкг / м3, измеренный как среднегодовой.
NOx также вступает в реакцию с другими загрязнителями в присутствии солнечного света с образованием озона, который при высоких концентрациях может повредить растительность.
Примечания: Критический уровень — это пороговый уровень концентрации загрязняющего вещества в атмосфере, при превышении которого могут проявляться прямые вредные воздействия на среду обитания или виды. Критическая нагрузка — это пороговый уровень осаждения загрязнителя, при превышении которого могут проявляться вредные косвенные воздействия на среду обитания или виды.
Цели уровня NOx
Двенадцать европейских государств-членов превысили один или несколько пределов выбросов, установленных Директивой ЕС о национальных потолочных значениях выбросов (NEC), согласно последним официальным данным за 2010 год, представленным Европейскому агентству по окружающей среде (EEA).В некоторых случаях лимиты были превышены на значительные суммы. Загрязняющим веществом, для которого было зарегистрировано наибольшее превышение, были NOx.
Европейский Союз устанавливает предельные значения для ряда загрязнителей, которые считаются вредными для здоровья и окружающей среды. Европейская комиссия может принять меры против любого государства-члена, если качество воздуха не соответствует предельным значениям на всей его территории.
Подробнее о целевых показателях уровня NOx ….
Оксид азота — Energy Education
Рисунок 1.Двуокись азота. [1]Оксиды азота или NO x — это семейство ядовитых, высокореактивных газов, образующихся при сжигании топлива при высоких температурах. Газы NO x обычно коричневого цвета и выбрасываются транспортными средствами, а также промышленными источниками, такими как электростанции, промышленные котлы, цементные печи и турбины. Оксиды азота вступают в сложные химические реакции в атмосфере с летучими органическими соединениями. Эти реакции приводят к образованию смога в жаркие летние дни. [2] Два основных встречающихся оксида азота — это NO и NO 2 .
Уголь и нефть, два основных ископаемых топлива, содержат азот. Когда это топливо сжигается для выработки электроэнергии, образуется тип NO x , известный как топливный NO x . Также существует другой тип NO x , известный как термический NO x , который образуется, когда атмосферный азот и кислород рекомбинируют при высоких температурах (например, в пламени сгорания ископаемого топлива) с образованием NO. [3] При сжигании угля и нефти образуются как термические, так и топливные оксиды азота, в то время как при сжигании природного газа образуются только термические NO x . Кроме того, при неконтролируемом сжигании нефти или угля образуется больше оксидов азота, чем при сжигании природного газа.
Механизмы управления
Азот из угля, нефти и природного газа нельзя удалить до сжигания. Таким образом, удаление NO x возможно только во время или после того, как произошло горение. [3] Во время горения можно использовать горелку Low NO x для снижения выбросов оксидов азота. Эта горелка использует ступенчатое сгорание для сжигания топлива с правильным соотношением воздух-топливо. Это снижает количество выбросов оксидов азота, поскольку сжигание топлива в среде с высоким или низким содержанием топлива приводит к уменьшению выбросов NO x . [3] Использование LNB полезно, поскольку котлы могут быть модернизированы для включения этих устройств, и это дооснащение является относительно недорогим.Хотя это полезная технология, образование NO x снижается только на 30-55%. [3]
После сгорания для снижения выбросов оксидов азота можно использовать процессы селективного каталитического восстановления , или , селективного некаталитического восстановления . При каталитическом восстановлении аммиак вводится в каталитический реактор, через который проходит дымовой газ. Затем происходит реакция, в результате которой образуются азот и водяной пар. Используется катализатор из оксида титана.При этой реакции улетучивается только около 10-20% исходного NO x вместе с некоторым количеством непрореагировавшего аммиака. [3] Некаталитическое восстановление — это аналогичный процесс, но он происходит при более высокой температуре и устраняет необходимость в катализаторе. Также вместо аммиака используется мочевина. Эта реакция приводит к образованию азота, водяного пара и углекислого газа. Этот процесс снижает выбросы NO x на 74-90%. [3]
Побочные эффекты
Оксид азота сам по себе не токсичен.С другой стороны, диоксид азота потенциально токсичен для растений. Воздействие на достаточно высоких уровнях может повредить листья, замедлить рост и снизить урожайность. Кроме того, в сочетании с озоном или диоксидом серы диоксид азота может вызвать травму. Кроме того, NO x является парниковым газом и способствует разрушению озонового слоя в стратосфере. Оксиды азота также являются важным компонентом кислотных дождей. [4] Конечным воздействием загрязнения окиси азота на окружающую среду является эвтрофикация .Это взрывное разрастание водорослей, которые могут истощать кислород в водоемах, нанося вред экосистеме. [5] Ниже приведен анимированный GIF, показывающий, насколько на самом деле выделяется NO x . Как загрязнитель, его можно увидеть на спутниковых снимках, а на анимации ниже показано, как он концентрируется в крупных городах. Однако прогресс показывает, что количество NO x в атмосфере фактически уменьшается.
Рисунок 2. Последовательность спутниковых изображений, показывающих уменьшение NO x в воздухе. [6]Для людей кратковременное воздействие оксидов азота может вызвать увеличение числа респираторных заболеваний и инфекций. Более длительное воздействие может привести к реальным изменениям в легких. [5] Это связано с тем, что диоксид азота, основной оксид азота, является раздражителем, который является основным компонентом смога. Кроме того, оксиды азота в атмосфере могут превращаться в озон, что имеет свои собственные неблагоприятные последствия для здоровья.
Визуализация данных
На следующих визуализациях данных показаны источники выбросов NO x в Канаде.Для более подробного изучения данных о загрязнении, включая график, показывающий, как выбросы NO x менялись с течением времени, щелкните здесь.
Для дальнейшего чтения
Список литературы
Оксид азота (NOx) Загрязнение | ADEQ Arizona Department of Environmental Quality
Оксиды азота (NO x ) — это группа высокореактивных газов, включая диоксид азота, азотистую кислоту и азотную кислоту. Для установления стандартов EPA использует диоксид азота (NO 2 ) в качестве «индикаторного загрязнителя», что означает, что если в воздухе присутствует загрязнение диоксидом азота, то же самое и с другими оксидами азота.
В частности, диоксид азота обычно образуется при сгорании топлива, например, в автомобилях, электростанциях и внедорожном оборудовании. Оксиды азота, образующиеся из этих источников, соединяются с летучими органическими соединениями (ЛОС), образуя приземный озон, вредный вид озона. Наименьшие и наиболее вредные частицы загрязнения, известные как PM 2,5 , также образуются из оксидов азота в сочетании с летучими органическими соединениями, оксидами серы, аммиаком и твердыми частицами.
В конечном итоге загрязнение оксидами азота влияет на видимость, способность дышать, качество воды, кислотные дожди и температуру Земли.
Влияние на здоровье и благополучиеБыло показано, что диоксид азота сам по себе вызывает неблагоприятные респираторные эффекты, включая воспаление дыхательных путей и астму. Люди, живущие вблизи основных дорог, подвергаются высокому риску, учитывая, что выбросы NO 2 примерно на 30-100 процентов выше, чем в районах, удаленных от дорог.
Семейство оксидов азота может реагировать с аммиаком, летучими органическими соединениями и другими соединениями с образованием загрязнения PM 2,5 , которое легко проникает в чувствительные и глубокие части легких, вызывая респираторные заболевания, такие как эмфизема и бронхит.NO x также может усугубить ранее существовавшее сердечное заболевание, что приведет к преждевременной смерти.
Плохой тип озона, приземный, образуется в результате реакции NO x и ЛОС с солнечным светом и теплом. Приземный озон действует как плотный барьер, не позволяющий загрязнению выйти из верхних слоев атмосферы. Это загрязнение приближается к Земле, задерживает тепло и снижает видимость. Определенные группы, такие как дети, пожилые люди и люди с заболеваниями легких, особенно подвержены риску воздействия озона на уровне земли, который может вызвать затрудненное дыхание и другие респираторные проблемы.
Планы по производству оксидов азотаВ стране нет зон недостижения по стандартам NO x 2010 года.

 И тот и другой компонент есть в окружающем нас воздухе. Необходимо провести реакцию. Аппарат реализует принцип электродного разряда. В высоковольтной дуге происходит сжигание азота с образованием оксида азота, который затем и подается из аппарата в воздухоносные пути пациента».
И тот и другой компонент есть в окружающем нас воздухе. Необходимо провести реакцию. Аппарат реализует принцип электродного разряда. В высоковольтной дуге происходит сжигание азота с образованием оксида азота, который затем и подается из аппарата в воздухоносные пути пациента».