BCAA — Википедия
Аминокислоты с разветвлёнными боковыми цепями (англ. branched-chain amino acids, BCAA) — группа протеиногенных аминокислот, характеризующихся разветвлёнными строением алифатической боковой цепи. К таким аминокислотам относятся лейцин, изолейцин и валин. Все три аминокислоты являются незаменимыми для человека и должны поступать в организм с пищей[1]. Среднее содержание этих аминокислот в пищевых белках составляет 20-25%[2]. Хотя большая часть аминокислот метаболизируется в печени, аминокислоты с разветвлёнными боковыми цепями подвергаются катаболическим превращениям, главным образом, в других органах и тканях, включая скелетные мышцы, сердце, нейроны, жировую ткань и почки[1][2].
Помимо очевидной роли в построении молекул белков, аминокислоты c разветвлёнными боковыми цепями имеют множество других функций. Считается, что при мышечной работе они могут использоваться для синтеза промежуточных соединений цикла трикарбоновых кислот и глюконеогенеза, то есть выступают в качестве источников энергии. Кроме того, эти аминокислоты имеют регуляторные функции: выступая в качестве сигнальных молекул, они регулируют процессы синтеза и деградации белков, клеточного метаболизма и роста, а также секрецию инсулина
Роль в структуре белков
Лейцин, изолейцин и валин являются наиболее гидрофобными протеиногенными аминокислотами, это свойство определяет их роль в структуре белков. Гидрофобные аминокислотные остатки (а значит, в том числе и аминокислоты с разветвлёнными боковыми цепями) встречаются в относительно большом количестве во внутренних частях водорастворимых глобулярных белков, на поверхности доменов мембранных белков, взаимодействующих с липидами мембран, на поверхностях контактов между отдельными α-спиралями, входящими в состав фибриллярного белка. Остатки аминокислот с разветвлёнными боковыми цепями участвуют в гидрофобных взаимодействиях — слабых взаимодействиях, которые наряду с водородными связями, ионными связями и Ван-дер-Ваальсовыми взаимодействиями обеспечивают стабильность третичной структуры белка. Помимо такой общей структурной роли, аминокислоты с разветвлёнными боковыми цепями могут выполнять и специфические функции: эти аминокислоты важны для связывания молекул кислорода миоглобином и гемоглобином, а также для связывания субстрата и каталитической активности различных ферментов
Применение
BCAA применяется очень широко в ряде спортивных дисциплин, в частности в бодибилдинге. Культуристы утверждают, что BCAA помогает повысить выносливость и ускоряет восстановление мышц.[источник не указан 91 день]
Оптимальное время приема
В дни тренировок
В процессе тренировки, организм сжигает топливо бешеными темпами, и когда строительного материала не хватает, мышцы начинают «пожирать» самих себя. Чтобы не допустить этого, нужно давать подпитку непосредственно перед тренировочной сессией и после неё. Если продолжительность тренировки более 1 часа, то аминокислоты можно принять дополнительно в промежутках между упражнениями.
Каждый производитель указывает свои дозы приема. Оптимальной является 33 мг лейцина на 1 кг массы тела спортсмена. То есть, при весе 80 кг потребность в лейцине составляет 2640 мг за тренировку, это примерно 5 грамм ВСАА при стандартном соотношении 2:1:1. Благодаря несложным подсчетам, вы сами сможете рассчитать дозу, исходя из своего веса и соотношении аминокислот в применяемом вами ВСАА.
В дни отдыха
Отдых после тренировки – так же работа для организма. После сна катаболические процессы особо сильны. Расщепление белка из пищи или принятого протеина на аминокислоты происходит медленно, поэтому прием аминокислот после пробуждения – идеальный вариант для быстрого пополнения энергии. Утренний прием составляет 0,5-1 от стандартной дозы.
Исследования
Пищевая добавка ВСАА была использована клинически для помощи в восстановлении пострадавших от ожогов. Однако, в 2006 году вышел документ о том, что в применении ВСАА при ожогах, травме и сепсисе следует отказаться[5]
Некоторые исследования показали возможную связь между высоким уровнем заболеваемости боковым амиотрофическим склерозом среди профессиональных игроков в американский футбол и итальянских футболистов, т. к. игроки с боковым амиотрофическим склерозом принимали в пищу ВСАA.[6]
Деградация
Деградация аминокислот с разветвленной цепью предполагает разветвленных Альфа-кетокислот дегидрогеназы комплекса (BCKDH). Дефицит этого комплекса приводит к раскачке аминокислот с разветвленной цепью (лейцин, изолейцин и валин) и их токсических продуктов в крови и моче.
В BCKDH комплекс преобразует аминокислоты с разветвленной цепью в ацил-КоА — производные, которые после последующих реакций превращаются либо в ацетил-КоА или сукцинил-КоА , которые поступают в цикл лимонной кислоты.[7]
Примечания
- ↑ 1 2 Huang Y., Zhou M., Sun H., Wang Y. (2011). «Branched-chain amino acid metabolism in heart disease: an epiphenomenon or a real culprit?». Cardiovasc Res 90 (2): 220—223. DOI:10.1093/cvr/cvr070. PMID 21502372.
- ↑ 1 2 3 Brosnan J. T., Brosnan M. E. (2006). «Branched-chain amino acids: enzyme and substrate regulation». J. Nutr. 136 (1 Suppl): 207S—211S. PMID 16365084.
- ↑ Yoshizawa F. (2012). «New therapeutic strategy for amino acid medicine: notable functions of branched chain amino acids as biological regulators». J. Pharmacol. Sci. 118 (2): 149—155. PMID 22293293.
- ↑ BCAA оптимальное время приема (рус.). ProteinHouse. Проверено 12 августа 2018.
- ↑ Jean-Pascal De Bandt, Luc Cynober. Therapeutic Use of Branched-Chain Amino Acids in Burn, Trauma, and Sepsis (англ.) // The Journal of Nutrition. — 2006-01-01. — Vol. 136, iss. 1. — P. 308S–313S. — ISSN 1541-6100 0022-3166, 1541-6100.
- ↑ Marin Manuel, C. J. Heckman. Stronger is not always better: could a bodybuilding dietary supplement lead to ALS? // Experimental neurology. — 2011-01-01. — Т. 228, вып. 1. — С. 5–8. — ISSN 0014-4886. — DOI:10.1016/j.expneurol.2010.12.007.
- ↑ D. D. Sears, G. Hsiao, A. Hsiao, J. G. Yu, C. H. Courtney. Mechanisms of human insulin resistance and thiazolidinedione-mediated insulin sensitization (англ.) // Proceedings of the National Academy of Sciences. — 2009-11-03. — Vol. 106, iss. 44. — P. 18745–18750. — ISSN 1091-6490 0027-8424, 1091-6490. — DOI:10.1073/pnas.0903032106.
wikipedia.green
BCAA — Википедия
Аминокислоты с разветвлёнными боковыми цепями (англ. branched-chain amino acids, BCAA) — группа протеиногенных аминокислот, характеризующихся разветвлёнными строением алифатической боковой цепи. К таким аминокислотам относятся лейцин, изолейцин и валин. Все три аминокислоты являются незаменимыми для человека и должны поступать в организм с пищей[1]. Среднее содержание этих аминокислот в пищевых белках составляет 20-25%[2]. Хотя большая часть аминокислот метаболизируется в печени, аминокислоты с разветвлёнными боковыми цепями подвергаются катаболическим превращениям, главным образом, в других органах и тканях, включая скелетные мышцы, сердце, нейроны, жировую ткань и почки
Помимо очевидной роли в построении молекул белков, аминокислоты c разветвлёнными боковыми цепями имеют множество других функций. Так же способствует увеличению полового члена .Считается, что при мышечной работе они могут использоваться для синтеза промежуточных соединений цикла трикарбоновых кислот и глюконеогенеза, то есть выступают в качестве источников энергии. Кроме того, эти аминокислоты имеют регуляторные функции: выступая в качестве сигнальных молекул, они регулируют процессы синтеза и деградации белков, клеточного метаболизма и роста, а также секрецию инсулина
Роль в структуре белков
Лейцин, изолейцин и валин являются наиболее гидрофобными протеиногенными аминокислотами, это свойство определяет их роль в структуре белков. Гидрофобные аминокислотные остатки (а значит, в том числе и аминокислоты с разветвлёнными боковыми цепями) встречаются в относительно большом количестве во внутренних частях водорастворимых глобулярных белков, на поверхности доменов мембранных белков, взаимодействующих с липидами мембран, на поверхностях контактов между отдельными α-спиралями, входящими в состав фибриллярного белка. Остатки аминокислот с разветвлёнными боковыми цепями участвуют в гидрофобных взаимодействиях — слабых взаимодействиях, которые наряду с водородными связями, ионными связями и Ван-дер-Ваальсовыми взаимодействиями обеспечивают стабильность третичной структуры белка. Помимо такой общей структурной роли, аминокислоты с разветвлёнными боковыми цепями могут выполнять и специфические функции: эти аминокислоты важны для связывания молекул кислорода миоглобином и гемоглобином, а также для связывания субстрата и каталитической активности различных ферментов
Применение
Аминокислоты с разветвлёнными боковыми цепями расщепляются в мышцах, а не в печени, поэтому считается, что они играют важную роль в производстве энергии во время выполнения упражнений. BCAA применяется очень широко в ряде спортивных дисциплин, в частности в бодибилдинге. Культуристы утверждают, что BCAA помогает повысить выносливость, предотвращают разрушение и ускоряет восстановление мышечных белков.
Оптимальное время приема
В дни тренировок
В процессе тренировки, организм сжигает топливо бешеными темпами, и когда строительного материала не хватает, мышцы начинают «пожирать» самих себя. Чтобы не допустить этого, нужно давать подпитку непосредственно перед тренировочной сессией и после неё. Если продолжительность тренировки более 1 часа, то аминокислоты можно принять дополнительно в промежутках между упражнениями.
Каждый производитель указывает свои дозы приема. Оптимальной является 33 мг лейцина на 1 кг массы тела спортсмена. То есть, при весе 80 кг потребность в лейцине составляет 2640 мг за тренировку, это примерно 5 грамм ВСАА при стандартном соотношении 2:1:1. Благодаря несложным подсчетам, вы сами сможете рассчитать дозу, исходя из своего веса и соотношении аминокислот в применяемом вами ВСАА.
В дни отдыха
Отдых после тренировки – так же работа для организма. После сна катаболические процессы особо сильны. Расщепление белка из пищи или принятого протеина на аминокислоты происходит медленно, поэтому прием аминокислот после пробуждения – идеальный вариант для быстрого пополнения энергии. Утренний прием составляет 0,5-1 от стандартной дозы.[4]
Исследования
Пищевая добавка ВСАА была использована клинически для помощи в восстановлении пострадавших от ожогов. Однако, в 2006 году вышел документ о том, что в применении ВСАА при ожогах, травме и сепсисе следует отказаться[5]
Некоторые исследования показали возможную связь между высоким уровнем заболеваемости боковым амиотрофическим склерозом среди профессиональных игроков в американский футбол и итальянских футболистов, т. к. игроки с боковым амиотрофическим склерозом принимали в пищу ВСАA.[6]
Деградация
Деградация аминокислот с разветвленной цепью предполагает разветвленных Альфа-кетокислот дегидрогеназы комплекса (BCKDH). Дефицит этого комплекса приводит к раскачке аминокислот с разветвленной цепью (лейцин, изолейцин и валин) и их токсических продуктов в крови и моче.
В BCKDH комплекс преобразует аминокислоты с разветвленной цепью в ацил-КоА — производные, которые после последующих реакций превращаются либо в ацетил-КоА или сукцинил-КоА , которые поступают в цикл лимонной кислоты.[7]
Примечания
- ↑ 1 2 Huang Y., Zhou M., Sun H., Wang Y. Branched-chain amino acid metabolism in heart disease: an epiphenomenon or a real culprit? (англ.) // Cardiovasc Res (англ.)русск. : journal. — 2011. — Vol. 90, no. 2. — P. 220—223. — DOI:10.1093/cvr/cvr070. — PMID 21502372.
- ↑ 1 2 3 Brosnan J. T., Brosnan M. E. Branched-chain amino acids: enzyme and substrate regulation (англ.) // J. Nutr. (англ.)русск. : journal. — 2006. — Vol. 136, no. 1 Suppl. — P. 207S—211S. — PMID 16365084.
- ↑ Yoshizawa F. New therapeutic strategy for amino acid medicine: notable functions of branched chain amino acids as biological regulators (англ.) // J. Pharmacol. Sci. : journal. — 2012. — Vol. 118, no. 2. — P. 149—155. — PMID 22293293.
- ↑ BCAA оптимальное время приема (рус.). ProteinHouse. Дата обращения 12 августа 2018.
- ↑ Jean-Pascal De Bandt, Luc Cynober. Therapeutic Use of Branched-Chain Amino Acids in Burn, Trauma, and Sepsis (англ.) // The Journal of Nutrition. — 2006-01-01. — Vol. 136, iss. 1. — P. 308S—313S. — ISSN 1541-6100 0022-3166, 1541-6100.
- ↑ Marin Manuel, C. J. Heckman. Stronger is not always better: could a bodybuilding dietary supplement lead to ALS? // Experimental neurology. — 2011-01-01. — Т. 228, вып. 1. — С. 5—8. — ISSN 0014-4886. — DOI:10.1016/j.expneurol.2010.12.007.
- ↑ D. D. Seррнкррррролаллджжжлиичрпакрars, G. Hsiao, A. Hsiao, J. G. Yu, C. H. Courtney. Mechanisms of human insulin resistance and thiazolidinedione-mediated insulin sensitization (англ.) // Proceedings of the National Academy of Sciences. — National Academy of Sciences, 2009-11-03. — Vol. 106, iss. 44. — P. 18745—18750. — ISSN 1091-6490 0027-8424, 1091-6490. — DOI:10.1073/pnas.0903032106.
wikipedia.bio
BCAA — Википедия. Что такое BCAA
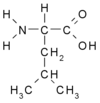
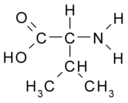
Аминокислоты с разветвлёнными боковыми цепями (англ. branched-chain amino acids, BCAA) — группа протеиногенных аминокислот, характеризующихся разветвлёнными строением алифатической боковой цепи. К таким аминокислотам относятся лейцин, изолейцин и валин. Все три аминокислоты являются незаменимыми для человека и должны поступать в организм с пищей[1]. Среднее содержание этих аминокислот в пищевых белках составляет 20-25%[2]. Хотя большая часть аминокислот метаболизируется в печени, аминокислоты с разветвлёнными боковыми цепями подвергаются катаболическим превращениям, главным образом, в других органах и тканях, включая скелетные мышцы, сердце, нейроны, жировую ткань и почки[1][2].
Помимо очевидной роли в построении молекул белков, аминокислоты c разветвлёнными боковыми цепями имеют множество других функций. Считается, что при мышечной работе они могут использоваться для синтеза промежуточных соединений цикла трикарбоновых кислот и глюконеогенеза, то есть выступают в качестве источников энергии. Кроме того, эти аминокислоты имеют регуляторные функции: выступая в качестве сигнальных молекул, они регулируют процессы синтеза и деградации белков, клеточного метаболизма и роста, а также секрецию инсулина[3].
 |  |  |
Роль в структуре белков
Лейцин, изолейцин и валин являются наиболее гидрофобными протеиногенными аминокислотами, это свойство определяет их роль в структуре белков. Гидрофобные аминокислотные остатки (а значит, в том числе и аминокислоты с разветвлёнными боковыми цепями) встречаются в относительно большом количестве во внутренних частях водорастворимых глобулярных белков, на поверхности доменов мембранных белков, взаимодействующих с липидами мембран, на поверхностях контактов между отдельными α-спиралями, входящими в состав фибриллярного белка. Остатки аминокислот с разветвлёнными боковыми цепями участвуют в гидрофобных взаимодействиях — слабых взаимодействиях, которые наряду с водородными связями, ионными связями и Ван-дер-Ваальсовыми взаимодействиями обеспечивают стабильность третичной структуры белка. Помимо такой общей структурной роли, аминокислоты с разветвлёнными боковыми цепями могут выполнять и специфические функции: эти аминокислоты важны для связывания молекул кислорода миоглобином и гемоглобином, а также для связывания субстрата и каталитической активности различных ферментов[2].
Применение
BCAA применяется очень широко в ряде спортивных дисциплин, в частности в бодибилдинге. Культуристы утверждают, что BCAA помогает повысить выносливость и ускоряет восстановление мышц.[источник не указан 91 день]
Оптимальное время приема
В дни тренировок
В процессе тренировки, организм сжигает топливо бешеными темпами, и когда строительного материала не хватает, мышцы начинают «пожирать» самих себя. Чтобы не допустить этого, нужно давать подпитку непосредственно перед тренировочной сессией и после неё. Если продолжительность тренировки более 1 часа, то аминокислоты можно принять дополнительно в промежутках между упражнениями.
Каждый производитель указывает свои дозы приема. Оптимальной является 33 мг лейцина на 1 кг массы тела спортсмена. То есть, при весе 80 кг потребность в лейцине составляет 2640 мг за тренировку, это примерно 5 грамм ВСАА при стандартном соотношении 2:1:1. Благодаря несложным подсчетам, вы сами сможете рассчитать дозу, исходя из своего веса и соотношении аминокислот в применяемом вами ВСАА.
В дни отдыха
Отдых после тренировки – так же работа для организма. После сна катаболические процессы особо сильны. Расщепление белка из пищи или принятого протеина на аминокислоты происходит медленно, поэтому прием аминокислот после пробуждения – идеальный вариант для быстрого пополнения энергии. Утренний прием составляет 0,5-1 от стандартной дозы.[4]
Исследования
Пищевая добавка ВСАА была использована клинически для помощи в восстановлении пострадавших от ожогов. Однако, в 2006 году вышел документ о том, что в применении ВСАА при ожогах, травме и сепсисе следует отказаться[5]
Некоторые исследования показали возможную связь между высоким уровнем заболеваемости боковым амиотрофическим склерозом среди профессиональных игроков в американский футбол и итальянских футболистов, т. к. игроки с боковым амиотрофическим склерозом принимали в пищу ВСАA.[6]
Деградация
Деградация аминокислот с разветвленной цепью предполагает разветвленных Альфа-кетокислот дегидрогеназы комплекса (BCKDH). Дефицит этого комплекса приводит к раскачке аминокислот с разветвленной цепью (лейцин, изолейцин и валин) и их токсических продуктов в крови и моче.
В BCKDH комплекс преобразует аминокислоты с разветвленной цепью в ацил-КоА — производные, которые после последующих реакций превращаются либо в ацетил-КоА или сукцинил-КоА , которые поступают в цикл лимонной кислоты.[7]
Примечания
- ↑ 1 2 Huang Y., Zhou M., Sun H., Wang Y. (2011). «Branched-chain amino acid metabolism in heart disease: an epiphenomenon or a real culprit?». Cardiovasc Res 90 (2): 220—223. DOI:10.1093/cvr/cvr070. PMID 21502372.
- ↑ 1 2 3 Brosnan J. T., Brosnan M. E. (2006). «Branched-chain amino acids: enzyme and substrate regulation». J. Nutr. 136 (1 Suppl): 207S—211S. PMID 16365084.
- ↑ Yoshizawa F. (2012). «New therapeutic strategy for amino acid medicine: notable functions of branched chain amino acids as biological regulators». J. Pharmacol. Sci. 118 (2): 149—155. PMID 22293293.
- ↑ BCAA оптимальное время приема (рус.). ProteinHouse. Проверено 12 августа 2018.
- ↑ Jean-Pascal De Bandt, Luc Cynober. Therapeutic Use of Branched-Chain Amino Acids in Burn, Trauma, and Sepsis (англ.) // The Journal of Nutrition. — 2006-01-01. — Vol. 136, iss. 1. — P. 308S–313S. — ISSN 1541-6100 0022-3166, 1541-6100.
- ↑ Marin Manuel, C. J. Heckman. Stronger is not always better: could a bodybuilding dietary supplement lead to ALS? // Experimental neurology. — 2011-01-01. — Т. 228, вып. 1. — С. 5–8. — ISSN 0014-4886. — DOI:10.1016/j.expneurol.2010.12.007.
- ↑ D. D. Sears, G. Hsiao, A. Hsiao, J. G. Yu, C. H. Courtney. Mechanisms of human insulin resistance and thiazolidinedione-mediated insulin sensitization (англ.) // Proceedings of the National Academy of Sciences. — 2009-11-03. — Vol. 106, iss. 44. — P. 18745–18750. — ISSN 1091-6490 0027-8424, 1091-6490. — DOI:10.1073/pnas.0903032106.
wiki.sc
BCAA — Википедия
Аминокислоты с разветвлёнными боковыми цепями (англ. branched-chain amino acids, BCAA) — группа протеиногенных аминокислот, характеризующихся разветвлёнными строением алифатической боковой цепи. К таким аминокислотам относятся лейцин, изолейцин и валин. Все три аминокислоты являются незаменимыми для человека и должны поступать в организм с пищей[1]. Среднее содержание этих аминокислот в пищевых белках составляет 20-25%[2]. Хотя большая часть аминокислот метаболизируется в печени, аминокислоты с разветвлёнными боковыми цепями подвергаются катаболическим превращениям, главным образом, в других органах и тканях, включая скелетные мышцы, сердце, нейроны, жировую ткань и почки[1][2].
Помимо очевидной роли в построении молекул белков, аминокислоты c разветвлёнными боковыми цепями имеют множество других функций. Считается, что при мышечной работе они могут использоваться для синтеза промежуточных соединений цикла трикарбоновых кислот и глюконеогенеза, то есть выступают в качестве источников энергии. Кроме того, эти аминокислоты имеют регуляторные функции: выступая в качестве сигнальных молекул, они регулируют процессы синтеза и деградации белков, клеточного метаболизма и роста, а также секрецию инсулина[3].
 |  |  |
Роль в структуре белков
Лейцин, изолейцин и валин являются наиболее гидрофобными протеиногенными аминокислотами, это свойство определяет их роль в структуре белков. Гидрофобные аминокислотные остатки (а значит, в том числе и аминокислоты с разветвлёнными боковыми цепями) встречаются в относительно большом количестве во внутренних частях водорастворимых глобулярных белков, на поверхности доменов мембранных белков, взаимодействующих с липидами мембран, на поверхностях контактов между отдельными α-спиралями, входящими в состав фибриллярного белка. Остатки аминокислот с разветвлёнными боковыми цепями участвуют в гидрофобных взаимодействиях — слабых взаимодействиях, которые наряду с водородными связями, ионными связями и Ван-дер-Ваальсовыми взаимодействиями обеспечивают стабильность третичной структуры белка. Помимо такой общей структурной роли, аминокислоты с разветвлёнными боковыми цепями могут выполнять и специфические функции: эти аминокислоты важны для связывания молекул кислорода миоглобином и гемоглобином, а также для связывания субстрата и каталитической активности различных ферментов[2].
Видео по теме
Применение
BCAA применяется очень широко в ряде спортивных дисциплин, в частности в бодибилдинге. Культуристы утверждают, что BCAA помогает повысить выносливость и ускоряет восстановление мышц.[источник не указан 91 день]
Оптимальное время приема
В дни тренировок
В процессе тренировки, организм сжигает топливо бешеными темпами, и когда строительного материала не хватает, мышцы начинают «пожирать» самих себя. Чтобы не допустить этого, нужно давать подпитку непосредственно перед тренировочной сессией и после неё. Если продолжительность тренировки более 1 часа, то аминокислоты можно принять дополнительно в промежутках между упражнениями.
Каждый производитель указывает свои дозы приема. Оптимальной является 33 мг лейцина на 1 кг массы тела спортсмена. То есть, при весе 80 кг потребность в лейцине составляет 2640 мг за тренировку, это примерно 5 грамм ВСАА при стандартном соотношении 2:1:1. Благодаря несложным подсчетам, вы сами сможете рассчитать дозу, исходя из своего веса и соотношении аминокислот в применяемом вами ВСАА.
В дни отдыха
Отдых после тренировки – так же работа для организма. После сна катаболические процессы особо сильны. Расщепление белка из пищи или принятого протеина на аминокислоты происходит медленно, поэтому прием аминокислот после пробуждения – идеальный вариант для быстрого пополнения энергии. Утренний прием составляет 0,5-1 от стандартной дозы.[4]
Исследования
Пищевая добавка ВСАА была использована клинически для помощи в восстановлении пострадавших от ожогов. Однако, в 2006 году вышел документ о том, что в применении ВСАА при ожогах, травме и сепсисе следует отказаться[5]
Некоторые исследования показали возможную связь между высоким уровнем заболеваемости боковым амиотрофическим склерозом среди профессиональных игроков в американский футбол и итальянских футболистов, т. к. игроки с боковым амиотрофическим склерозом принимали в пищу ВСАA.[6]
Деградация
Деградация аминокислот с разветвленной цепью предполагает разветвленных Альфа-кетокислот дегидрогеназы комплекса (BCKDH). Дефицит этого комплекса приводит к раскачке аминокислот с разветвленной цепью (лейцин, изолейцин и валин) и их токсических продуктов в крови и моче.
В BCKDH комплекс преобразует аминокислоты с разветвленной цепью в ацил-КоА — производные, которые после последующих реакций превращаются либо в ацетил-КоА или сукцинил-КоА , которые поступают в цикл лимонной кислоты.[7]
Примечания
- ↑ 1 2 Huang Y., Zhou M., Sun H., Wang Y. (2011). «Branched-chain amino acid metabolism in heart disease: an epiphenomenon or a real culprit?». Cardiovasc Res 90 (2): 220—223. DOI:10.1093/cvr/cvr070. PMID 21502372.
- ↑ 1 2 3 Brosnan J. T., Brosnan M. E. (2006). «Branched-chain amino acids: enzyme and substrate regulation». J. Nutr. 136 (1 Suppl): 207S—211S. PMID 16365084.
- ↑ Yoshizawa F. (2012). «New therapeutic strategy for amino acid medicine: notable functions of branched chain amino acids as biological regulators». J. Pharmacol. Sci. 118 (2): 149—155. PMID 22293293.
- ↑ BCAA оптимальное время приема (рус.). ProteinHouse. Проверено 12 августа 2018.
- ↑ Jean-Pascal De Bandt, Luc Cynober. Therapeutic Use of Branched-Chain Amino Acids in Burn, Trauma, and Sepsis (англ.) // The Journal of Nutrition. — 2006-01-01. — Vol. 136, iss. 1. — P. 308S–313S. — ISSN 1541-6100 0022-3166, 1541-6100.
- ↑ Marin Manuel, C. J. Heckman. Stronger is not always better: could a bodybuilding dietary supplement lead to ALS? // Experimental neurology. — 2011-01-01. — Т. 228, вып. 1. — С. 5–8. — ISSN 0014-4886. — DOI:10.1016/j.expneurol.2010.12.007.
- ↑ D. D. Sears, G. Hsiao, A. Hsiao, J. G. Yu, C. H. Courtney. Mechanisms of human insulin resistance and thiazolidinedione-mediated insulin sensitization (англ.) // Proceedings of the National Academy of Sciences. — 2009-11-03. — Vol. 106, iss. 44. — P. 18745–18750. — ISSN 1091-6490 0027-8424, 1091-6490. — DOI:10.1073/pnas.0903032106.
wiki2.red
Википедия — свободная энциклопедия
Избранная статья

Эдуард II, называемый также Эдуардом Карнарвонским по месту его рождения (англ. Edward II; 25 апреля 1284 — 21 сентября 1327), — король Англии в 1307—1327 годах из династии Плантагенетов, сын и преемник Эдуарда I. При жизни отца стал графом Понтье (1290 год) и первым в истории английской монархии принцем Уэльским (1301 год). Продолжил начатую Эдуардом I войну с Робертом Брюсом в Шотландии, но вёл её крайне неудачно: в 1314 году потерпел полное поражение в битве при Бэннокберне и позже был вынужден заключить тринадцатилетнее перемирие. На континенте Эдуард II вёл войну с французской короной, в результате которой потерял часть своих владений в Аквитании (1324 год).
Эдуард постоянно конфликтовал с баронами из-за своих фаворитов. В ходе гражданской войны группа баронов во главе с кузеном короля Томасом Ланкастерским взяла в плен фаворита короля Пирса Гавестона и казнила (1312 год). В 1321 году Ланкастер с другими баронами захватил земли новых союзников короля Диспенсеров, но Эдуард разбил мятежников при Боругбридже и казнил Ланкастера. На время король укрепил свою власть, но скрытая оппозиция его режиму росла. Его жена Изабелла Французская уехала на континент (1325 год) и выступила против Эдуарда. Её союзником и любовником стал изгнанник Роджер Мортимер; в 1326 году они высадились в Англии с небольшим отрядом. Режим Эдуарда пал, и король бежал в Уэльс, где был арестован. В январе 1327 года Эдуард II отрёкся от престола в пользу своего четырнадцатилетнего сына Эдуарда III. Он умер 21 сентября в замке Беркли.
Хорошая статья
Дейнохейрус (лат. Deinocheirus, от др.-греч. δεινός — страшный, ужасный, грозный и χείρ, χειρός — рука) — род гигантских динозавров из инфраотряда орнитомимозавров. Окаменелые остатки найдены в слоях верхнемелового яруса на территории Монголии. В род включают единственный типовой вид — Deinocheirus mirificus.
Дейнохейрус, намного превосходивший размерами других известных представителей семейства дейнохейрид, достигал около 11 м в длину и весил предположительно от 6,4 до 12 тонн. Это был всеядный беззубый динозавр, в рацион которого входили водные растения и рыба, а сам он в свою очередь мог становиться жертвой хищных тарбозавров. У представителей рода Deinocheirus были напоминающая утиный клюв морда, огромные передние конечности с мощными, но тупыми когтями, высокие выросты на позвонках, образующие на спине горб или «парус», и пигостиль на кончике хвоста, указывающий на возможное наличие оперения.
Изображение дня
Висячий мост через каньон Линн в Ванкувере
wiki.monavista.ru
