Важнейшие аминокислоты для человека — DPI Cosmetology
Аминокислоты — это органические соединения, которые соединяются друг с другом для образования белков. Оба элемента играют важнейшую роль для человека.
В геноме закодированы 20 аминокислот, а именно:
- аланин
- аргинин
- аспарагин
- аспартат
- цистеин
- фенилаланин
- глицин
- глутамат
- глутамин
- гистидин
- изолейцин
- лейцин
- лизин
- метионин
- пролин
- серина
- тирозин
- треонин
- триптофан
- валина
Однако человеческий организм способен производить только 11 из них. Остальные девять считаются незаменимыми аминокислотами, которые мы получаем пищей, так как наш организм не способен их синтезировать самостоятельно. В этой статье BBC вы можете ознакомиться с этими аминокислотами.
Как добиться баланса аминокислот
Проблема заключается в том, что очень трудно включить эти девять аминокислот одновременно, поскольку практически в любой пище их всех одновременно не хватает. Вот почему мы должны сочетать пищу. Полноценное и разнообразное питание играют в этом ключевую роль. Ниже вы можете ознакомиться со списком тех продуктов, которые содержат большее количество аминокислот и которые вы должны включить в свой рацион регулярно:
Вот почему мы должны сочетать пищу. Полноценное и разнообразное питание играют в этом ключевую роль. Ниже вы можете ознакомиться со списком тех продуктов, которые содержат большее количество аминокислот и которые вы должны включить в свой рацион регулярно:
- Постное мясо, яйца, молоко и производные: они содержат 9 незаменимых аминокислот, а также некоторые из других 11.
- Другое мясо и рыба, такие как курица, лосось, говядина, свинина, морской окунь, тунец и сардины: содержат 8 незаменимых аминокислот.
- Нут, соевые бобы, некоторые виды бобов, киноа, гречка, амарант и фисташки: содержат 9 незаменимых аминокислот.
Почему аминокислоты так важны?
Имейте в виду, что благодаря комбинации различных аминокислот производятся различные белки, необходимые организму. Эти белки помогают человеческому организму выполнять такие задачи, как:
- Переваривать еду
- Рост мышц и костей
- Восстановление тканей
- Обеспечение организма энергией
Типы аминокислот
Еще один важный аспект, который необходимо учесть, — это то, что аминокислоты делятся на три группы:
- Незаменимые: как мы уже упоминали, это те вещества, которые не могут вырабатываться человеческим организмом, поэтому их необходимо получать через пищу.
 Это: гистидин, изолейцин, лейцин, лизин, метионин, фенилаланин, треонин, триптофан и валин.
Это: гистидин, изолейцин, лейцин, лизин, метионин, фенилаланин, треонин, триптофан и валин. - Заменимые: все они производятся нашим телом, даже когда мы их не принимаем.
- Частично заменимые: это те аминокислоты, которые не являются незаменимыми в повседневной жизни, но их недостаток может быть причиной/следствием стресса или болезни.
Лучше всего, чтобы в нашем организме были все типы аминокислот, чтобы вести здоровый образ жизни и предотвращать болезни или другие состояния. Фактически, одним из белков, образующих аминокислоты, является коллаген. В этой статье вы узнаете, какие преимущества он приносит нашему организму и каковы его натуральные источники.
Польза для нашей кожи
Некоторые аминокислоты также важны и имеют прямое отношение к здоровью нашей кожи:
- Они активируют все обменные процессы.
- Они восстанавливают структуру дермы.
- Они улучшают и поддерживают питание всех тканей.

- Они омолаживают структуру коллагена.
- Они образуют новый коллаген, который придает коже сияние и улучшает текстуру.
Все эти преимущества также можно дополнить мезотерапией — методикой, состоящей из введения небольших количеств лекарств и таких веществ, как аминокислоты, для улучшения кровообращения и эластичности кожи. Вы можете найти дополнительную информацию об этой процедуре в этом посте.
Аминокислоты (32 показателя) сдать в Подольске и Королёве
ОписаниеАминокислоты — это органические соединения, являющиеся строительным материалом для белков и мышечных тканей. Нарушение обмена аминокислот является причиной многих заболеваний (печени и почек). Анализ аминокислот (мочи и крови) является основным средством оценки степени усвоения пищевого белка, а также метаболического дисбаланса, лежащего в основе многих хронических нарушений.
ПАланин (ALA), Аргинин (ARG), Аспарагиновая кислота (ASP), Цитруллин (CIT),
Глутаминовая кислота (GLU), Глицин (GLY),
Метионин (MET), Орнитин (ORN),
Фенилаланин (PHE), Тирозин (TYR), Валин
(VAL), Лейцин (LEU), Изолейцин (ILEU),
Гидроксипролин (HPRO), Серин (SER),
Аспарагин (ASN), a-аминоадипиновая к-та
(AAA), Глутамин (GLN), b-аланин (BALA),
Таурин (TAU), Гистидин (HIS), Треонин
(THRE), 1-метилгистидин (1MHIS),
3-метилгистидин (3MHIS), y-аминомасляная к-та (GABA), b-аминоизомасляная к-та (BAIBA), a-аминомасляная к-та (AABA),
Пролин (PRO), Цистатионин (CYST), Лизин
(LYS), Цистин (CYS), Цистеиновая кислота
(CYSA) — в крови
Аминокислоты представляют собой структурные химические единицы, образующие белки.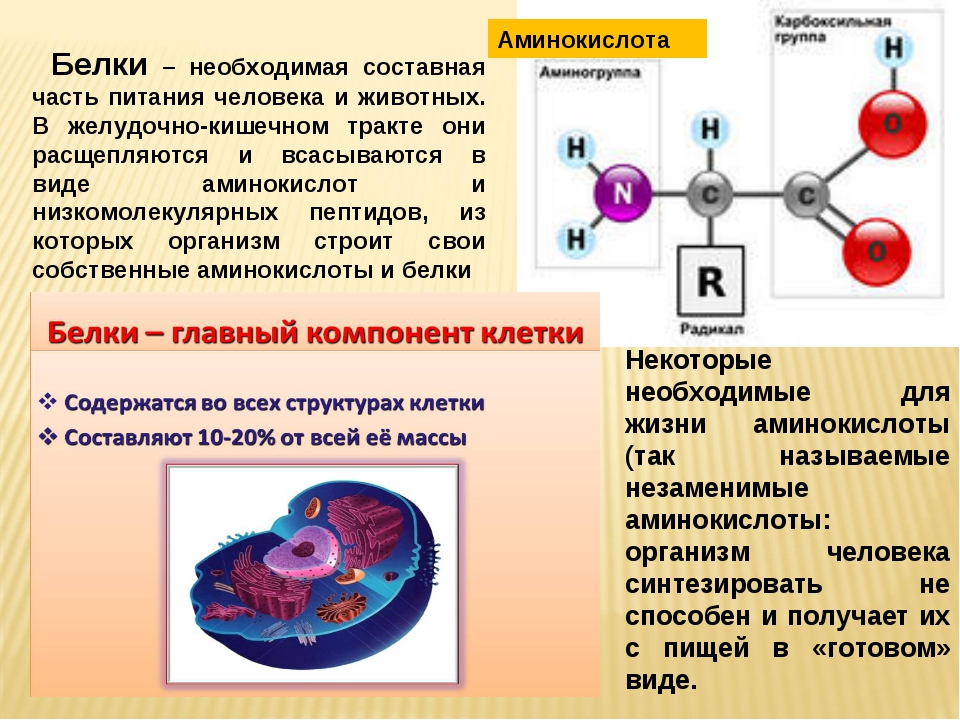





Сколько аминокислот содержит белок: виды и польза.
Знания среднестатистического человека об аминокислотах достаточно ограничены. Многие знают лишь о том, что эти органические вещества содержатся в белках и без них невозможна нормальная деятельность организма.
Что это такое?
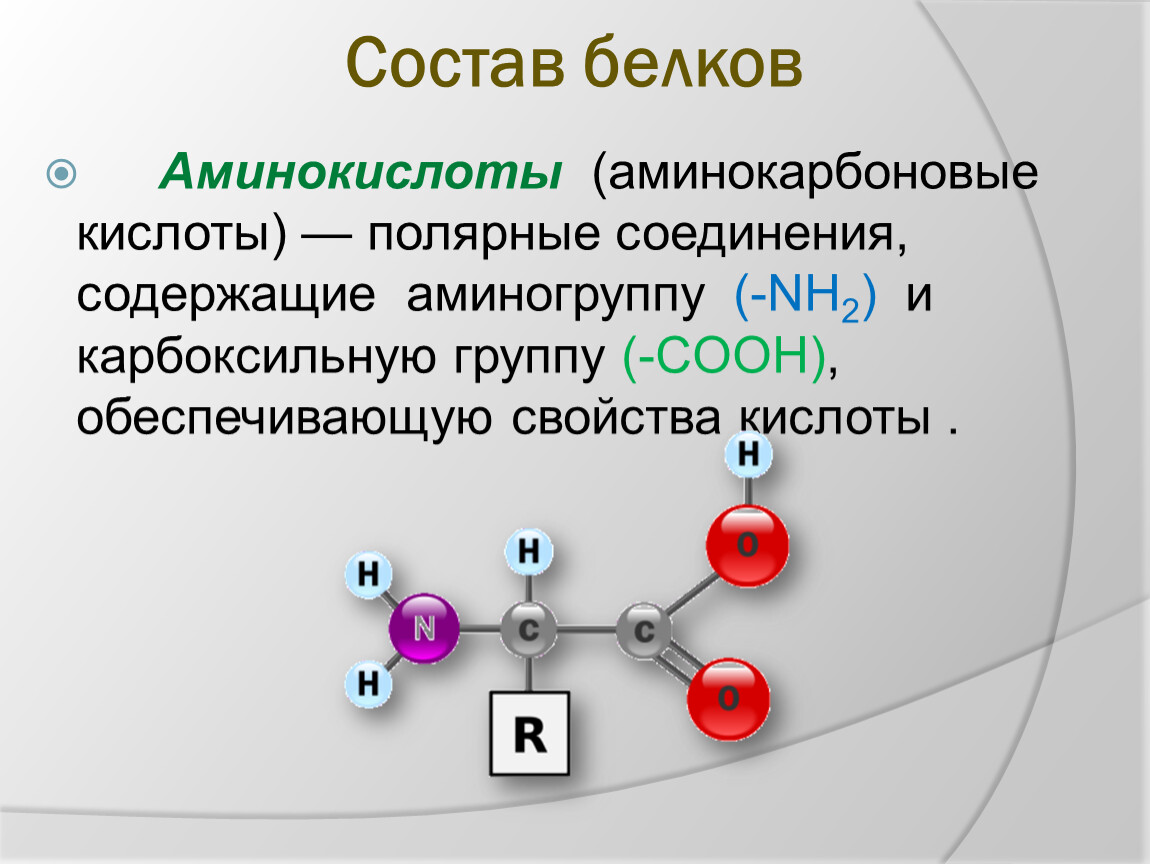
Аминокислоты (аминокарбоновые кислоты) – это стройматериал для белка, являющегося участником всех физиологических процессов, происходящих в организме. Из него состоят кости, мышцы, внутренние органы, ногти, волосы и другие составляющие человеческого тела.
Внимание! Белки имеют различный состав, поэтому не все из них одинаково полезны.
Сколько аминокислот входит в состав белка?
Белки представляют собой цепочку из аминокарбоновых кислот. Ученым потребовалось много десятилетний для поиска правильного ответа на вопрос о количестве аминокислот, входящих в состав белка.
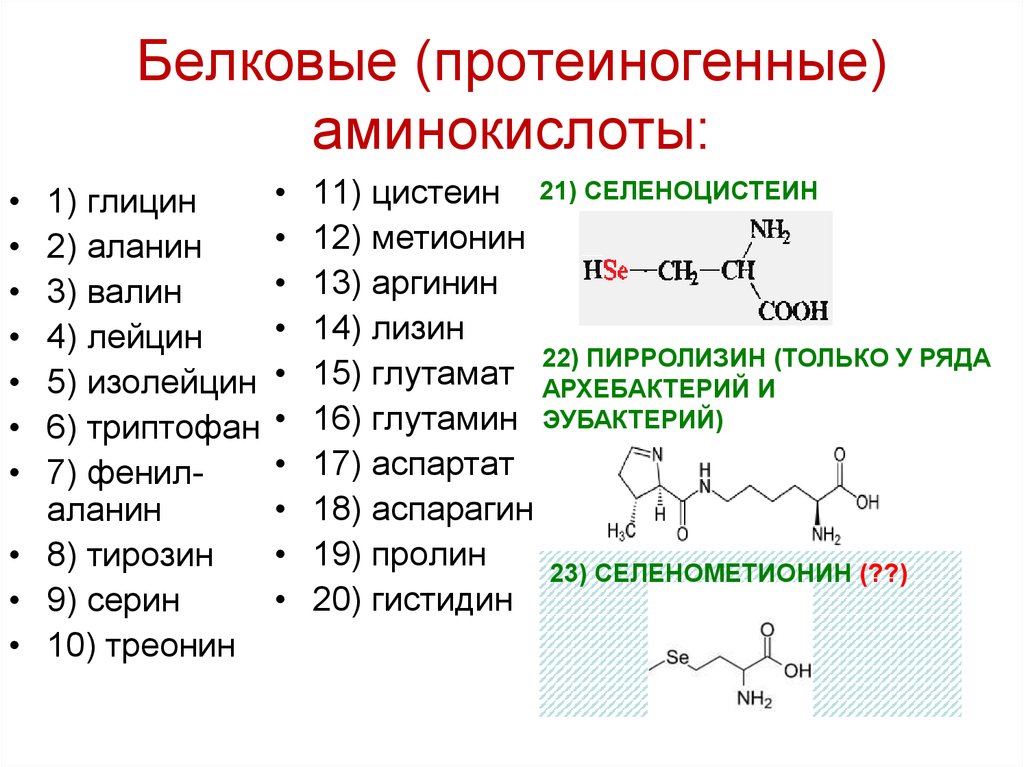
Внимание! Установлено, что для нормальной жизнедеятельности организму человека необходимо двадцать протеиногенных аминокислот, которые принято называть мажорными.
Аминокислоты бывают заменимыми и незаменимыми. Первые синтезируются в самом организме, а вторые попадают туда извне вместе с пищей. Однако есть и относящиеся и к тому, и к другому разряду.
Заменимые аминокислоты
Эти аминокислоты продуцируются путем эндогенного синтеза из других веществ, поступающих вместе с пищей, в самом организме. Всего таких веществ двенадцать. Важнейшими из них являются:
- аланин;
- аргинин;
- аспарагин;
- аспарагиновая кислота.

Незаменимые аминокарбоновые кислоты
Аминокислоты этого типа оказываются в организме, попадая туда вместе с едой. В значительных количествах они присутствуют в белках животного происхождения и бывают восьми видов.
Лейцин
Восстанавливает мышцы, кожу и кости. Он участвует в продуцировании гормона роста, стабилизирует уровень сахара в крови и помогает сжигать жиры. Этого вещества много в мясе, орехах, бобовых. Оно содержится в нешлифованном рисе и зернах пшеницы и стимулирует синтез белка.
Внимание! Обеспечение организма лейцином важно тем, кто желает нарастить мышцы.
Изолейцин
Стимулирует выработку энергии. Его значительное количество присутствует в мясе, рыбе, орехах, яйцах, горохе и сое.
Эти продукты должны присутствовать в рационе спортсменов. После многочасовых интенсивных тренировок изолейцин помогает скорейшему восстановлению мышц, снимает крепатуру, участвует в образовании гемоглобина, а также регулирует количество сахара.
После многочасовых интенсивных тренировок изолейцин помогает скорейшему восстановлению мышц, снимает крепатуру, участвует в образовании гемоглобина, а также регулирует количество сахара.
Лизин
Важен для иммунитета. Он участвует в синтезе защитных антител и выработке гормонов роста. Благодаря лизину обновляется костная ткань, и синтезируется коллаген.
Внимание! Лизин присутствует в яйцах, картофеле, мясе (за исключением белого мяса), рыбе и кисломолочных продуктах.
Фенилаланин
Содержится в орехах, грибах, курином мясе, молокопродуктах, бананах, абрикосах и топинамбуре. Оказывает влияние на деятельность центральной нервной системы.
Люди, у которых наблюдается недостаток фенилаланина в организме, подвержены депрессиям, им трудно концентрировать свое внимание, и у них наблюдаются проблемы с памятью.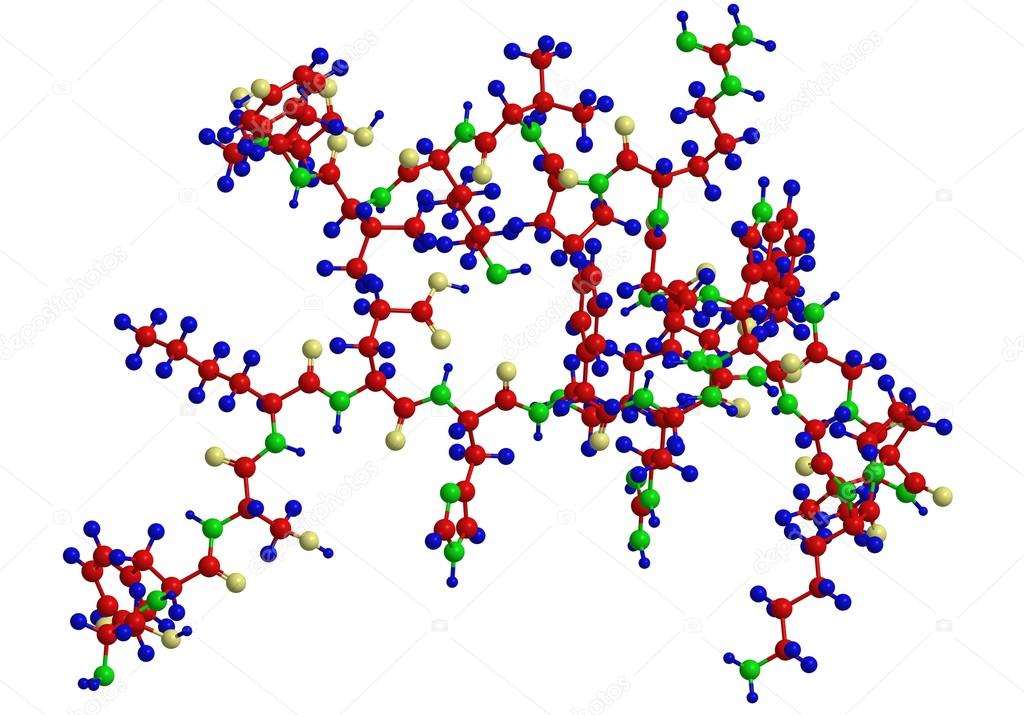
Метионин
Помогает сжигать жир, повышает выносливость и работоспособность человека. Он присутствует в мясе, рыбе, кисломолочных продуктах, семенах подсолнечника, некоторых других продуктах.
Треонин
Оказывает влияние на сердце, сосуды, а также на нервную систему и иммунитет человека. Его много в молочных продуктах, овощах, мясе, грибах, злаках.
Внимание! При недостатке треонина наблюдаются проблемы с зубами и костями.
Триптофан
Обеспечивает синтез гормона счастья серотонина, а также регулирует давление. Его применяют для устранения негативных последствий употребления алкоголя и наркосодержащих веществ.
Валин
Регулирует мышечный метаболизм, используется для восстановления организма, активизации умственной деятельности, а также смягчает последствия употребления алкоголя и наркотиков. Он присутствует в мясе, сое, грибах, молокопродуктах и арахисе.
Он присутствует в мясе, сое, грибах, молокопродуктах и арахисе.
Теперь вам известно, сколько аминокарбоновых кислот присутствует в белках, и как они влияют на здоровье человека. Старайтесь следить за своим рационом и будьте здоровы!
Amino acids | Protocol (Translated to Russian)
Аминокислоты это органические соединения, состоящие преимущественно из углерода, водорода, кислорода и азота. Хотя существуют сотни аминокислот, есть двадцать, которые функционируют как строительные блоки белков. Эти двадцать аминокислот часто называют трех-или однобуквенными аббревиатурами.
Все аминокислоты имеют центральный альфа-углерод, функционирующий как хиральный центр для большинства аминокислот. Он присоединен к аминогруппе, карбоксильной группе, атому водорода и переменной R-группе. Хиральная молекула имеет четыре отдельные группы, расположенные вокруг определенного атома, известного как хиральный центр.
Поскольку в качестве группы R глицин имеет атом водорода, он не имеет четырех отдельных групп и, следовательно, не имеет хирального центра. Эти четыре группы могут образовывать две различные конфигурации, которые являются стереоизомерами, называемыми L-и D-изомерами. Эти изомеры представляют собой зеркальные изображения, которые не накладываются друг на друга.
Аминокислоты, используемые в синтезе белка, всегда являются L-изомерами. Аминогруппа аминокислоты может действовать как основание и принимать протон, приводя к положительному заряду, тогда как карбоксильная группа может действовать как кислота и отдавать протон, приводя к отрицательному заряду. При физиологическом pH аминокислоты обычно существуют как двухзарядные и называются цвиттерионами, молекулами с равным числом положительных и отрицательных зарядов.
Каждая аминокислота имеет уникальную группу R, которая отвечает за их различные характеристики, включая их размер, растворимость и заряд. Аминокислоты широко классифицируются на две категории в зависимости от их R-групп:неполярные и полярные.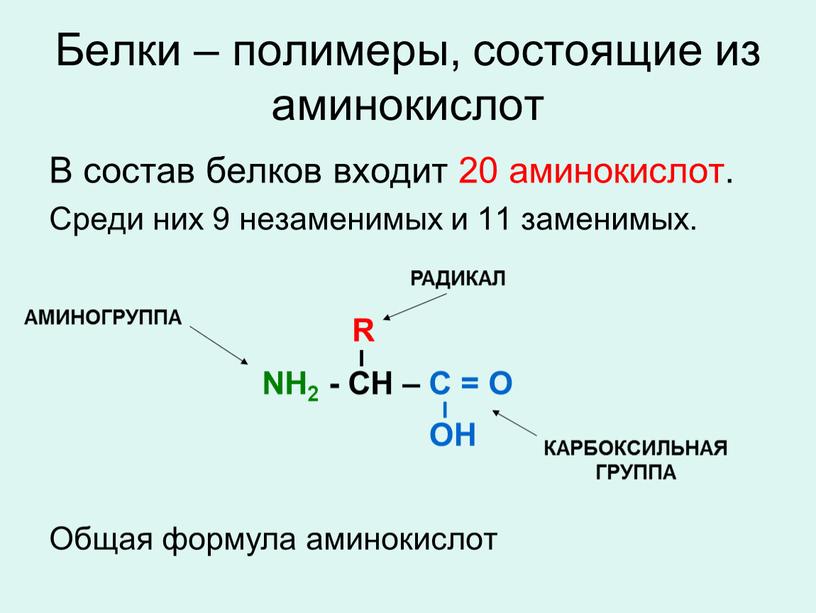 Неполярные аминокислоты можно разделить на алифатические и ароматические.
Неполярные аминокислоты можно разделить на алифатические и ароматические.
Полярные аминокислоты можно разделить на кислые, основные и незаряженные при нейтральном pH. Алифатические группы это углеводороды с одинарными связями, существующие в виде прямых, разветвленных или циклических цепей. Аминокислоты с алифатическими группами R представляют собой глицин, простейшую аминокислоту;аланин, валин, лейцин и изолейцин, которые чрезвычайно гидрофобны и связываются друг с другом с образованием стабильных ядерных структур в белках;метионин, серосодержащая аминокислота;и пролин, который имеет алифатическое кольцо.
Ароматические группы это углеводороды, существующие в виде ненасыщенных колец с чередующимися одинарными и двойными связями. Ароматические аминокислоты это фенилаланин, тирозин и триптофан, все из которых имеют большие размеры и способны участвовать в гидрофобных взаимодействиях. Кислые аминокислоты это аспартат и глутамат.
У них есть карбоксильные группы, которые отдают протон, чтобы стать отрицательно заряженной. Основные аминокислоты это лизин, аргинин и гистидин. На их боковых цепях есть аминогруппы, которые принимают протон, чтобы стать положительно заряженной.
Основные аминокислоты это лизин, аргинин и гистидин. На их боковых цепях есть аминогруппы, которые принимают протон, чтобы стать положительно заряженной.
Полярные незаряженные аминокислоты это серин, треонин, цистеин, аспарагин и глутамин. Они гидрофильны и содержат различные полярные функциональные группы:гидроксильные группы в серине и треонине, сульфгидрильную группу в цистеине и амидные группы в аспарагине и глутамине.
Почему белковая цепь находит единственно верную укладку среди многих вариантов
Перебор всех возможных вариантов укладки белковой цепи займет время, превышающее время жизни Вселенной. Однако белок успевает найти верный вариант в течение считаных минут. Отдел науки «Газеты.Ru» рассказывает о том, как российским ученым удалось разрешить этот парадокс и для чего нужно оценивать «быстродействие» белка.
Как сворачиваются белки
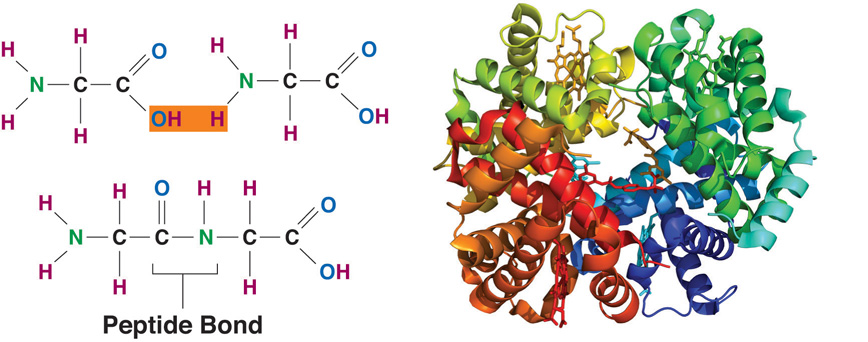
Каждая клетка нашего тела является фабрикой по производству белков. Часть из них производится для внутреннего пользования, для поддержания жизни клетки, а другая часть «идет на экспорт». Все свойства белковых молекул (в том числе способность изумительно точно катализировать превращения других молекул в клетке) зависят от пространственной структуры белка, причем структура каждого белка уникальна.
Все свойства белковых молекул (в том числе способность изумительно точно катализировать превращения других молекул в клетке) зависят от пространственной структуры белка, причем структура каждого белка уникальна.
Пространственная структура образуется уникальной укладкой белковой цепи, состоящей из разных аминокислотных остатков (бусинок разных цветов — рис. 1). Последовательность аминокислот в цепи белка определяется его геномом и синтезируется рибосомой, после чего пространственная структура цепи формируется «сама собой» в ходе сворачивания белковой цепи, которая выходит из рибосомы еще практически неупорядоченной.
close
100%
Сворачивают эту цепь взаимодействия ее аминокислот, причем в одну и ту же структуру — как в организме, так и в пробирке. Разнообразие возможных укладок одной и той же цепи невообразимо велико. Но у заданной последовательности аминокислот есть, как правило, только одна стабильная («правильная») структура, которая и придает белку его уникальные свойства. Стабильна же она потому, что именно она обладает минимальной энергией.
Стабильна же она потому, что именно она обладает минимальной энергией.
Тот же принцип действует при образовании кристаллов: вещество приобретает ту структуру, энергия связей в которой минимальна.
Что общего у белка и Вселенной
Здесь перед учеными возник вопрос: как белковая цепь может спонтанно «найти» свою единственную стабильную структуру, если перебор колоссального числа всех вариантов (порядка 10100 для цепи из 100 аминокислотных остатков) занял бы времени больше, чем время жизни Вселенной. Этот «парадокс Левинталя», сформулированный полвека назад, был решен только теперь. Для его решения пришлось привлечь методы теоретической физики.
close
100%
Ученые из Института белка Российской академии наук (ИБ РАН) создали теорию скоростей образования пространственных структур молекул белка. Результаты работы были недавно опубликованы в журналах Atlas of Science, Chem Phys Chem и «Биофизика». Работа поддержана грантом Российского научного фонда (РНФ).
Работа поддержана грантом Российского научного фонда (РНФ).
«Способность белков спонтанно формировать свои пространственные структуры за считаные секунды или минуты — давняя загадка молекулярной биологии.
В нашей работе представлена физическая теория, позволяющая оценить скорость этого процесса в зависимости от величины белков и сложности их устройства», — начинает рассказ о своей работе член-корреспондент РАН, доктор физико-математических наук, главный научный сотрудник Института белка РАН, руководитель гранта РНФ Алексей Финкельштейн.
«Давно известно, что белковая цепь приобретает свою уникальную структуру при одних условиях среды, а при других (например, при подкислении или подогреве раствора) эта структура разворачивается. На стыке этих условий уникальная структура белка находится в динамическом равновесии с развернутой формой его цепи, — продолжает он. — Процессы сворачивания и разворачивания там сосуществуют, их физика наиболее прозрачна. Поэтому мы сосредоточились именно на таких равновесных и квазиравновесных условиях — в отличие от других исследователей, которые как будто резонно (но ошибочно, как оказалось) полагали, что путь к тайне сворачивания белка надо искать там, где оно протекает наиболее быстро».
Развернуть белок — хорошее начало, но не выход
«Первый подход к проблеме Левинталя был разработан нами давно, — рассказывает Алексей Финкельштейн, — и заключался в следующем: так как теоретически проследить путь сворачивания белка очень трудно, нужно изучать процесс его разворачивания. Звучит парадоксально, но в физике существует принцип «детального равновесия», который гласит: любой процесс в равновесной системе протекает по тому же пути и с той же скоростью, что и обратный ему. И так как в динамическом равновесии скорости сворачивания и разворачивания одинаковы, мы рассмотрели более простой процесс разворачивания белка (ведь разломать проще, чем сделать) и охарактеризовали тот «барьер» (см. картинку 1), нестабильность которого определяет скорость процесса».
Следуя принципу детального равновесия, ученые из Института белка РАН оценили и «сверху», и «снизу» скорость сворачивания белков — как больших, так и маленьких, как с простой, так и со сложной укладкой цепи. Небольшие и просто устроенные белки сворачиваются быстрее (оценка скорости «сверху»), а большие и/или сложно устроенные — медленнее (оценка «снизу»). Значения всех остальных возможных скоростей сворачивания заключены между ними.
Небольшие и просто устроенные белки сворачиваются быстрее (оценка скорости «сверху»), а большие и/или сложно устроенные — медленнее (оценка «снизу»). Значения всех остальных возможных скоростей сворачивания заключены между ними.
Однако не все биологи были удовлетворены полученным решением, так как, во-первых, их интересовал путь сворачивания (а не разворачивания) белка, а во-вторых, физический «принцип детального равновесия» был, по-видимому, им плохо понятен.
И работы продолжались: на этот раз учеными из ИБ РАН были произведены расчеты сложности сворачивания белка. Давно известно, что взаимодействия в белках связаны в основном с так называемыми вторичными структурами. Вторичные структуры — это стандартные, довольно крупные локальные «строительные блоки» белковой структуры, определяемые в основном локальными аминокислотными последовательностями в них. Количество возможных вариантов укладки таких блоков в структуру свернутого белка можно подсчитать, что и было сделано учеными из ИБ РАН. Число таких вариантов огромно — порядка 1010 (но далеко не 10100!) для цепи из порядка 100 аминокислот, и белковая цепь может, согласно теоретическим оценкам, «просканировать» их за минуты или — для более длинных цепей — за часы. Так была получена самая верхняя оценка времени сворачивания белка.
Число таких вариантов огромно — порядка 1010 (но далеко не 10100!) для цепи из порядка 100 аминокислот, и белковая цепь может, согласно теоретическим оценкам, «просканировать» их за минуты или — для более длинных цепей — за часы. Так была получена самая верхняя оценка времени сворачивания белка.
close
100%
Результаты, полученные двумя способами (т.е. при анализе и разворачивания, и сворачивания белка), сходятся и подтверждают друг друга.
«Наша работа имеет фундаментальное значение для конструирования в будущем новых белков для нужд фармакологии, биоинженерии, нанотехнологии, — заключает Алексей Финкельштейн.
— Вопросы скорости сворачивания белков актуальны, когда речь идет о предсказании структуры белка по его аминокислотной последовательности, а особенно — о дизайне новых, не встречающихся в природе белков».
«Что изменилось после получения гранта РНФ? Появилась возможность закупить новое современное оборудование и реактивы для работы (ведь наша лаборатория в основном экспериментальная, хотя я здесь рассказал только о нашей теоретической работе). Но главное: грант РНФ позволил специалистам заниматься наукой, а не искать подработку на стороне или в дальних краях», — говорит Алексей Финкельштейн.
Но главное: грант РНФ позволил специалистам заниматься наукой, а не искать подработку на стороне или в дальних краях», — говорит Алексей Финкельштейн.
Текст подготовлен в сотрудничестве с проектом «Индикатор» (Indicator.Ru).
введение для айтишников / Хабр
Приятно видеть, что хабравчане регулярно интересуется другими предметными областями – например, биологией (более конкретно – структурой и функцией биологических макромолекул). Однако некоторые посты (например,
этот), вызывают у специалиста просто физическую боль из-за обилия совершенно диких фактологических ошибок. В этом посте мне хочется рассказать о структуре и функции белка. О том, что мы знаем и о том, чего не знаем, а так же об имеющихся в этой области вычислительных задачах, требующих решения и интересных IT-специалистам. Постараюсь рассказывать сжато и тезисно, чтобы информации было больше, а воды – меньше. Всех, интересующихся структурой белков, прошу под кат, там очень много букв.
1.
 Почему белки важны?
Почему белки важны?Как сказал Фридрих Энгельс, “Жизнь есть способ существования белковых тел”. В 19 веке еще не знали о роли ДНК в наследовании генетической информации, но утверждение дяди Фридриха в значительной мере справедливо до сих пор – основную работу в наших клетках совершают именно белки. Это и поддержание структуры (формы клеток), и химический катализ, и моторная функция (сокращение мышц, например), и транспорт (скажем, белок гемоглобин переносит кислород из легких в ткани и углекислый газ в обратном направлении) и сложные регуляторные функции по поддержанию постоянства внутренней среды (скажем, белковые гормоны и всякие внутриклеточные регуляторные системы) и многие другие. Словом, если в нашем организме что-то происходит, в это обязательно вовлечены белки (хотя и не только они).
2. Что такое белок?
С химической точки зрения белок – это линейный (неветвящийся) полимер, состоящий из монотонно повторяющихся одинаковых блоков «основной цепи», к которым приделаны различные «боковые группы». Так как блоки основной цепи несимметричны, вся полипептидная цепь белка имеет направление, различают N- и C-конец полипептидной цепи.
Так как блоки основной цепи несимметричны, вся полипептидная цепь белка имеет направление, различают N- и C-конец полипептидной цепи.
Длина цепи – от 70 до более чем 1000 мономеров (аминокислотных остатков), средняя длина для высших организмов – примерно 500-600 аминокислотных остатков, для бактерий эта величина будет меньше, скорее 300-400 остатков. Всего в природе существует 20 стандартных аминокислот, одинаковых и для бактерии и для человека, то есть из основной цепи могут торчать 20 разных боковых групп.
(Тут возможна поправка – некоторые химические группы могут быть модифицированны после синтеза белка, например, фосфорилированы. Однако это не рассматривается как другая аминокислота, а рассматривается как продукт модификации исходной. Так же у высших организмов возможно встраивание двух неканонических аминокислот, но это редкое событие. То есть, строго говоря, разных аминокислот 22, из них 20 основных и 2 редкие, плюс некоторые боковые группы могут быть изредка химически модифицированы).
Из поколения в поколение генетическая информация передается в виде ДНК, в ней есть так называемые «белок-кодирующие области». В этих местах ДНК однозначным образом (для ботанов – с точностью до альтернативного сплайсинга и редактирования РНК) закодирована информация о линейной последовательности аминокислот для синтеза данного белка, плюс в клетке есть соответствующие машины, способные синтезировать белок по информации, изначально закодированной в ДНК.
Так как белок – линейный полимер, собранный из 20 стандартных мономеров, его так называемую «первичную структуру» легко представить в виде строки, например так:
>small ubiquitin-related modifier 3 precursor [Homo sapiens] MSEEKPKEGVKTENDHINLKVAGQDGSVVQFKIKRHTPLSKLMKAYCERQG LSMRQIRFRFDGQPINETDTPAQLEMEDEDTIDVFQQQTGGVPESSLAGHSF
Это аминокислотная последовательность маленького человеческого белка в формате FASTA, первая строчка, начинающаяся с «>», описывает его название, после чего следует последовательность аминокислот в соответствии со стандартной кодировкой (например, М –метиони, S – серин и тд, всего 20 букв стандартного однобуквенного кода), слева – N-конец белка, справа – его С-конец.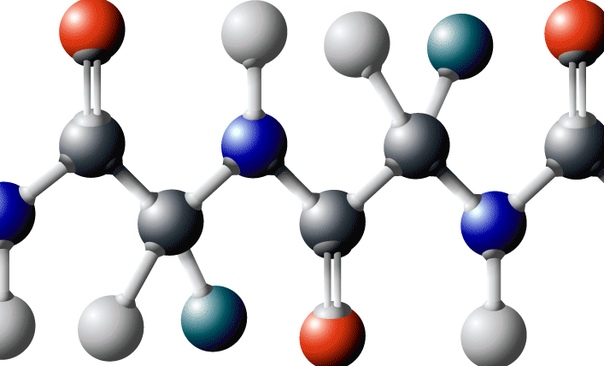 Для разных белков длина строки будет очевидно разной, так как белки имеют разную длину. Последовательности всех известных белков можно найти в открытом доступе здесь: www.ncbi.nlm.nih.gov
Для разных белков длина строки будет очевидно разной, так как белки имеют разную длину. Последовательности всех известных белков можно найти в открытом доступе здесь: www.ncbi.nlm.nih.gov
3. Структура белка
Хорошо, с первичной структурой разобрались, но разве белок работает в развернутом линейном виде? Конечно нет. Тут надо заметить, что со структурной точки зрения есть разные классы белков: глобулярные, мембранные и фибриллярные. Мембранные белки, как следует из названия, живут только в клеточных мембранах, для стабилизации их структуры нужно особое окружение мембраны, мы не будем их рассматривать в этом обзоре. Фибриллярные белки имеют простое регулярное строение, похожи на вытянутые волокна, они не растворимы в воде и выполняют структурные функции (например, из кератина состоят волосы, к фибриллярным белкам относится белок из натурального шёлка). Недавно стали выделять класс разупорядоченных белков – белков, не обладающих постоянной трехмерной структурой, либо приобретающих ее только на короткое время при взаимодействии с другими белками. Наиболее интересный с практической точки зрения класс белков, который мы и будем рассматривать – глобулярные водорастворимые белки, к этому классу относится большинство белков.
Наиболее интересный с практической точки зрения класс белков, который мы и будем рассматривать – глобулярные водорастворимые белки, к этому классу относится большинство белков.
Линейная полипептидная цепь в воде способна самопроизвольно сворачиваться в сложную трехмерную структуру (глобулу) и только в таком свернутом виде белки могут выполнять химический катализ и прочую интересную работу. Поэтому нам принципиально важно знать именно трехмерную укладку белка, так как только на этом уровне становится понятно, как белок работает.
Вопрос: сколько трехмерных структур соответствует конкретному белку?
Ответ: Одна, с точностью до небольшой подвижности маленьких «разупорядоченных» петель. Известно ровно одно исключение, когда одной последовательности соответствуют 2 достаточно разные структуры, это прионы.
Вопрос: Почему у белка только одна трехмерная структура?
Ответ: для химического катализа нам нужно расположить соответствующие химические группы строго определенным образом в пространстве.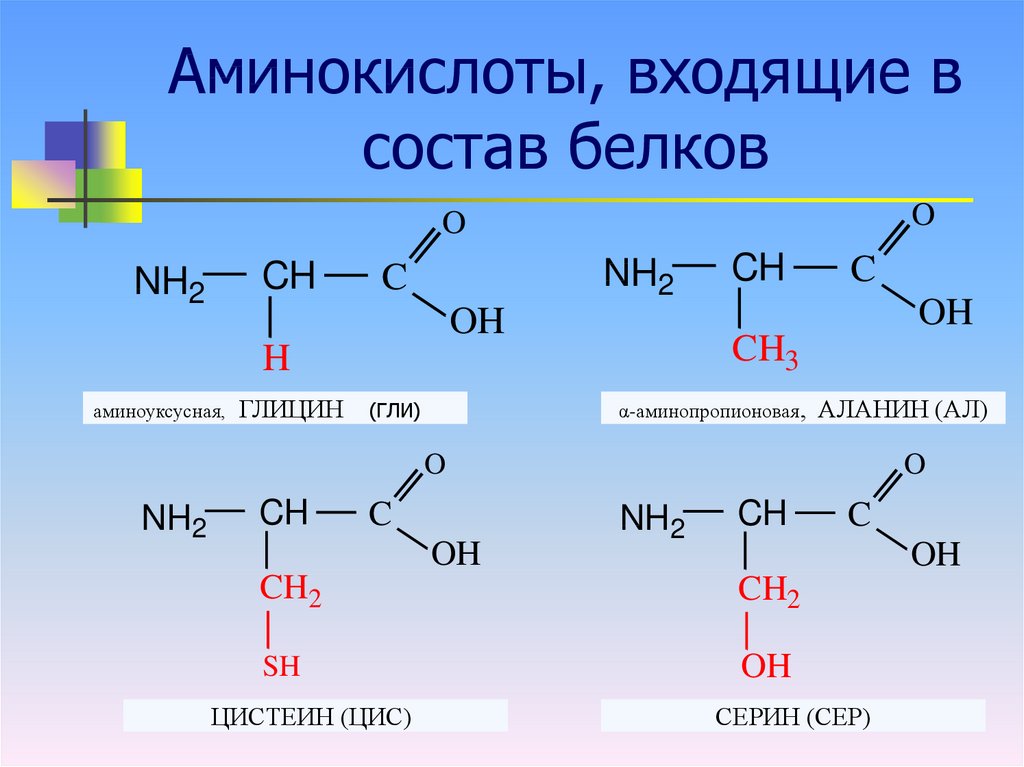 Для этого нужна жесткая структура. То есть весь белок должен быть жестким, чтобы поддерживать химические группы аминокислот активного центра в нужных местах (в реальности многие белки состоят из двух и более жестких частей, которые могут двигаться друг относительно друга, это нужно для регуляции активности белка (аллостерическая регуляция), чтобы некий сигнал мог включать и выключать химическую активность белка-фермента). Чтобы структура была жесткой и стабильной, природа позаботилась о том, чтобы структура каждого белка соответствовала энергетическому минимуму данной системы атомов и этот минимум был настолько глубоким, чтобы белок из него не «выпрыгнул». Все другие, паразитные структуры, обладают большей энергией и белок все равно сваливается в энергетический минимум, соответствующий нативной структуре.
Для этого нужна жесткая структура. То есть весь белок должен быть жестким, чтобы поддерживать химические группы аминокислот активного центра в нужных местах (в реальности многие белки состоят из двух и более жестких частей, которые могут двигаться друг относительно друга, это нужно для регуляции активности белка (аллостерическая регуляция), чтобы некий сигнал мог включать и выключать химическую активность белка-фермента). Чтобы структура была жесткой и стабильной, природа позаботилась о том, чтобы структура каждого белка соответствовала энергетическому минимуму данной системы атомов и этот минимум был настолько глубоким, чтобы белок из него не «выпрыгнул». Все другие, паразитные структуры, обладают большей энергией и белок все равно сваливается в энергетический минимум, соответствующий нативной структуре.
Вопрос: на чем держится трехмерная структура белка?
Ответ: если коротко, то в основном на большом количестве нековалентных взаимодействий. В принципе, химические группы белка могут образовывать: (1) водородную связь, эти группы есть и в основной цепи и у некоторых боковых групп, (2) ионную связь – электростатическое взаимодействие между разноименно заряженными боковыми группами, (3) Ван-дер-Ваальсово взаимодействие и (4) гидрофобный эффект, на котором держится общая структура белка. Суть в том, что в белке всегда есть гидрофобные ароматические остатки, им энергетически невыгодно контактировать с полярными молекулами воды, а выгодно «слипнуться» друг с другом. Таким образом, при сворачивании белка гидрофобные группы выталкиваются из водного окружения, «слипаясь» друг с другом и формируя «гидрофобное ядро», а полярные и заряженные группы, наоборот, стремятся в водное окружение, формируя поверхность белковой глобулы. Так же (5) боковые группы двух остатков цистеина могут образовать между собой дисульфидный мостик – полноценную ковалентную связь, жестко фиксирующую белок.
Суть в том, что в белке всегда есть гидрофобные ароматические остатки, им энергетически невыгодно контактировать с полярными молекулами воды, а выгодно «слипнуться» друг с другом. Таким образом, при сворачивании белка гидрофобные группы выталкиваются из водного окружения, «слипаясь» друг с другом и формируя «гидрофобное ядро», а полярные и заряженные группы, наоборот, стремятся в водное окружение, формируя поверхность белковой глобулы. Так же (5) боковые группы двух остатков цистеина могут образовать между собой дисульфидный мостик – полноценную ковалентную связь, жестко фиксирующую белок.
Соответственно, все аминокислоты делятся на гидрофобные, полярные (гидрофильные), положительно и отрицательно заряженные. Плюс цистеины, способные образовывать ковалентную связь между собой. Особыми свойствами обладают глицин – у него отсутствует боковая группа, сильно ограничивающая конформационную подвижность других остатков, поэтому он может очень сильно «гнуться» и находится в местах, где белковую цепь надо развернуть. У пролина же, наоборот, боковая группа образует кольцо, ковалентно связанное с основной цепью, жестко фиксируя ее конформацию. Пролины встречаются там, где надо сделать белковую цепь жесткой и негнущейся. Многие заболевания связаны с мутацией пролина на глицин, из-за чего структура белка слегка «плывет».
У пролина же, наоборот, боковая группа образует кольцо, ковалентно связанное с основной цепью, жестко фиксируя ее конформацию. Пролины встречаются там, где надо сделать белковую цепь жесткой и негнущейся. Многие заболевания связаны с мутацией пролина на глицин, из-за чего структура белка слегка «плывет».
Вопрос: откуда вообще мы знаем о трехмерных структурах белка?
Ответ: из эксперимента, это абсолютно надежные данные.
Сейчас есть 3 метода для экспериментального определения структуры белка: ядерно-магнитный резонанс (ЯМР), cryo-EM (электронная микроскопия) и рентгеноструктурный анализ кристаллов белка.
ЯМР позволяет определить структуру белка в растворе, но он работает только для очень маленьких белков (для больших невозможно сделать деконволюцию).
Этот метод был важен для общего доказательства того, что у белка только одна трехмерная структура и что структура белка в кристалле идентична структуре в растворе. Это очень дорогой метод, так как требуется получить белок с изотопными метками.
Cryo-EM заключается в простой заморозке раствора белка и микроскопии. Минус метода – низкое разрешение (видна лишь общая форма молекулы, но не видно, как она устроена внутри), плюс плотность белка близка к плотности воды/растворителя, поэтому сигнал тонет в высоком уровне шума. В этом методе активно применяются компьютерные технологии работы с картинками и статистика для вытягивания сигнала из шума.
Отбираются миллионы картинок молекул белка, проводится разделение на классы в зависимости от ориентации молекулы относительно подложки, усреднение по классам, генерация eigenimages, новый раунд усреднения и так пока не сойдется. Потом из информации из разных классов можно восстановить трехмерный вид молекулы с низким разрешением. Если же есть внутренняя симметрия частиц (например, при cryo-EM анализе вирусов), то можно еще каждую частицу поусреднять в соответствии с операторами симметрии – тогда разрешение будет еще лучше, но хуже, чем в случае рентгеноструктурного анализа.
Рентгеноструктурный анализ – основной способ определения структур белка. Главный плюс – потенциально можно получить кристаллы даже очень больших комплексов из многих десятков белков (например, именно так была определена структура рибосомы – Нобелевская премия 2009 года). Минус метода – вначале нужно получить кристалл белка, но далеко не каждый белок хочет кристаллизоваться.
Зато после того, как кристалл получен, по дифракции рентгеновского излучения можно однозначно определить положения всех (упорядоченных) атомов в молекуле белка, этот метод дает самое высокое разрешение и позволяет в лучших случаях видеть позиции отдельных атомов. Было доказано, что структура белка в кристалле однозначно соответствует структуре в растворе.
Сейчас действует конвенция – если ты определил структуру белка любым из экспериментальных физических методов, структура должна быть помещена в открытый доступ в банк данных белковых структур (Protein Data Bank – PDB, www.pdb.org ), в настоящее время там находится более 90 000 структур (впрочем, многие из них повторяющиеся, например, комплексы одного и того же белка с разными малыми молекулами, такими, как лекарственные средства). В PDB все структуры лежат в стандартном формате, называющемся, внезапно, pdb. Это текстовый формат, в котором каждому атому структуры соответствует одна строчка, в которой указан номер атома в структуре, название атома (углерод, азот и тд), название аминокислоты, в которую входит атом, название цепи белка (A, B, C и тд, если это кристалл комплекса из нескольких белков), номер аминокислоты в цепи и трехмерные координаты атома в ангстремах относительно ориджина, плюс так называемые температурный фактор и заселённость (это сугубо кристаллографические параметры).
В PDB все структуры лежат в стандартном формате, называющемся, внезапно, pdb. Это текстовый формат, в котором каждому атому структуры соответствует одна строчка, в которой указан номер атома в структуре, название атома (углерод, азот и тд), название аминокислоты, в которую входит атом, название цепи белка (A, B, C и тд, если это кристалл комплекса из нескольких белков), номер аминокислоты в цепи и трехмерные координаты атома в ангстремах относительно ориджина, плюс так называемые температурный фактор и заселённость (это сугубо кристаллографические параметры).
ATOM 1 N HIS A 17 -12.690 8.753 5.446 1.00 29.32 N ATOM 2 CA HIS A 17 -11.570 8.953 6.350 1.00 21.61 C ATOM 3 C HIS A 17 -10.274 8.970 5.544 1.00 22.01 C ATOM 4 O HIS A 17 -10.193 8.315 4.491 1.00 29.95 O ATOM 5 CB HIS A 17 -11.462 7.820 7.380 1.00 23.64 C ATOM 6 CG HIS A 17 -12.551 7.811 8.421 1.00 21.18 C ATOM 7 ND1 HIS A 17 -13.731 7.137 8.194 1.00 28.94 N ATOM 8 CD2 HIS A 17 -12.634 8.384 9.644 1.00 21.69 C ATOM 9 CE1 HIS A 17 -14.492 7.301 9.267 1.00 27.01 C ATOM 10 NE2 HIS A 17 -13.869 8.058 10.168 1.00 22.66 N ATOM 11 N ILE A 18 -9.269 9.660 6.089 1.00 19.45 N ATOM 12 CA ILE A 18 -7.910 9.377 5.605 1.00 18.67 C ATOM 13 C ILE A 18 -7.122 8.759 6.749 1.00 16.24 C ATOM 14 O ILE A 18 -7.425 8.919 7.929 1.00 18.80 O ATOM 15 CB ILE A 18 -7.228 10.640 5.088 1.00 20.22 C ATOM 16 CG1 ILE A 18 -7.062 11.686 6.183 1.00 18.52 C ATOM 17 CG2 ILE A 18 -7.981 11.176 3.889 1.00 24.61 C ATOM 18 CD1 ILE A 18 -6.161 12.824 5.749 1.00 28.
21 C ATOM 19 N ASN A 19 -6.121 8.023 6.349 1.00 15.46 N ATOM 20 CA ASN A 19 -5.239 7.306 7.243 1.00 14.34 C ATOM 21 C ASN A 19 -4.012 8.178 7.507 1.00 14.83 C ATOM 22 O ASN A 19 -3.431 8.715 6.575 1.00 18.03 O ATOM 23 CB ASN A 19 -4.825 6.003 6.573 1.00 17.71 C ATOM 24 CG ASN A 19 -6.062 5.099 6.413 1.00 21.26 C ATOM 25 OD1 ASN A 19 -6.606 4.651 7.400 1.00 26.18 O ATOM 26 ND2 ASN A 19 -6.320 4.899 5.151 1.00 31.73 N
Далее есть специальные программы, которые по данным из этого текстового файла могут графически отображать красивую трехмерную структуру молекулы белка, которую можно покрутить на экране монитора и, как говорил Гай Додсон, «дотронуться мышкой до молекулы» (например, PyMol, CCP4mg, старый RasMol). То есть смотреть на структуры белка просто – ставишь программу, загружаешь нужную структуру из PDB и наслаждаешься красотой природы.
4. Анализируем структуру
Итак, мы поняли основную идею: белок — линейный полимер, сворачивающийся в водном растворе под действием множества слабых взаимодействий в стабильную и единственную для данного белка трехмерную структуру, и способный в таком виде выполнять свою функцию. Различают несколько уровней организации белковых структур. Выше мы уже познакомились с первичной структурой – линейной последовательностью аминокислот, которую можно выписать в строчку.
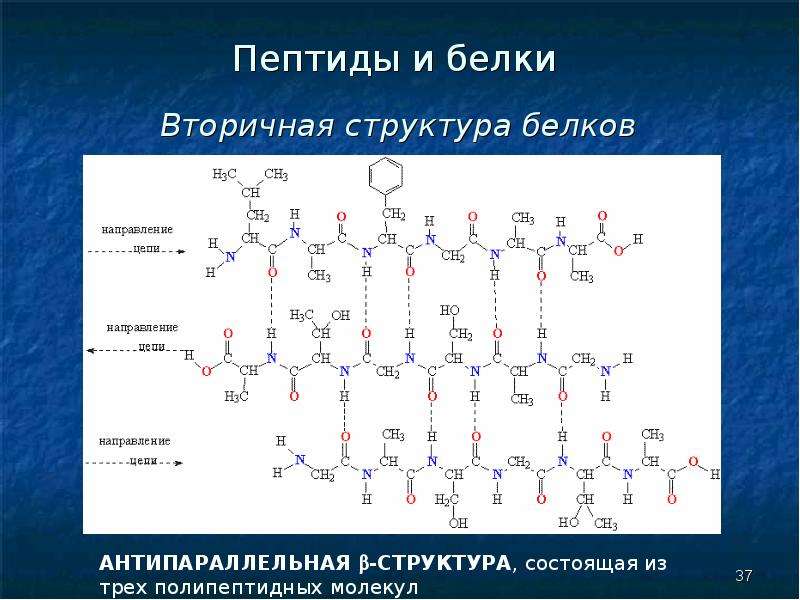
Вторичная структура белка определяется взаимодействием атомов основной цепи белка. Как уже было сказано выше, в состав основной цепи белка входят доноры и акцепторы водородной связи, таким образом, основная цепь может приобретать некоторую структуру. Точнее, несколько разных структур (детали все-таки зависят от различающихся боковых групп), так как возможно образование разных альтернативных водородных связей между группами основной цепи. Структуры бывают такие: альфа-спираль, бета-листы (состоящие из нескольких бета-тяжей), которые бывают параллельными и анти-параллельными, бета-поворот. Плюс часть цепи может и не иметь выраженной структуры, например в районе поворота петли белка. Эти типы структур имеют свои устоявшиеся схематичные обозначения – альфа-спираль в виде спирали или цилиндра, бета-тяжи в виде широких стрелок. Вторичную структуру удается достаточно достоверно предсказывать по первичной (стандартом является JPred), альфа-спирали предсказываются наиболее точно, с бета-тяжами бывают накладки.
Плюс часть цепи может и не иметь выраженной структуры, например в районе поворота петли белка. Эти типы структур имеют свои устоявшиеся схематичные обозначения – альфа-спираль в виде спирали или цилиндра, бета-тяжи в виде широких стрелок. Вторичную структуру удается достаточно достоверно предсказывать по первичной (стандартом является JPred), альфа-спирали предсказываются наиболее точно, с бета-тяжами бывают накладки.
Третичная структура белка определяется взаимодействием боковых групп аминокислотных остатков, это и есть трехмерная структура белка. Можно представить себе, что вторичная структура сформирована и теперь эти спирали и бета-тяжи хотят уложиться все вместе в компактную трехмерную структуру, чтобы все гидрофобные боковые группы спокойно «слиплись» вместе в глубине белковой глобулы, сформировав гидрофобное ядро, а полярные и заряженные остатки торчали наружу в воду, формируя поверхность белка и стабилизируя контакты между элементами вторичной структуры. Третичную структуру изображают схематически несколькими способами. Если просто отрисовать все атомы, то получится каша (хотя когда мы анализируем активный центр белка, то мы хотим смотреть как раз на все атомы активных остатков).
Если просто отрисовать все атомы, то получится каша (хотя когда мы анализируем активный центр белка, то мы хотим смотреть как раз на все атомы активных остатков).
Если мы хотим посмотреть, как устроен весь белок в общем, можно отобразить только некоторые атомы основной цепи, чтобы увидеть ее ход. Как вариант, можно нарисовать красивую схему, где поверх реального расположения атомов схематично нарисованы элементы вторичной структуры – так с первого взгляда видна укладка белка. После изучения всей структуры в общем, схематичном виде, можно отобразить химические группы активного центра и уже сосредоточиться на них. Задача предсказания третичной структуры белка – нетривиальная и в общем случае не решается, хотя может быть решена в частных случаях. Подробнее – ниже.
Четвертичная структура белка – да, есть и такая, правда не у всех белков. Многие белки работают сами по себе (мономеры, в данном случае под мономером имеется в виду одиночная свернутая полипептидная цепь, то есть белок целиком), тогда их четвертичная структура равна третичной.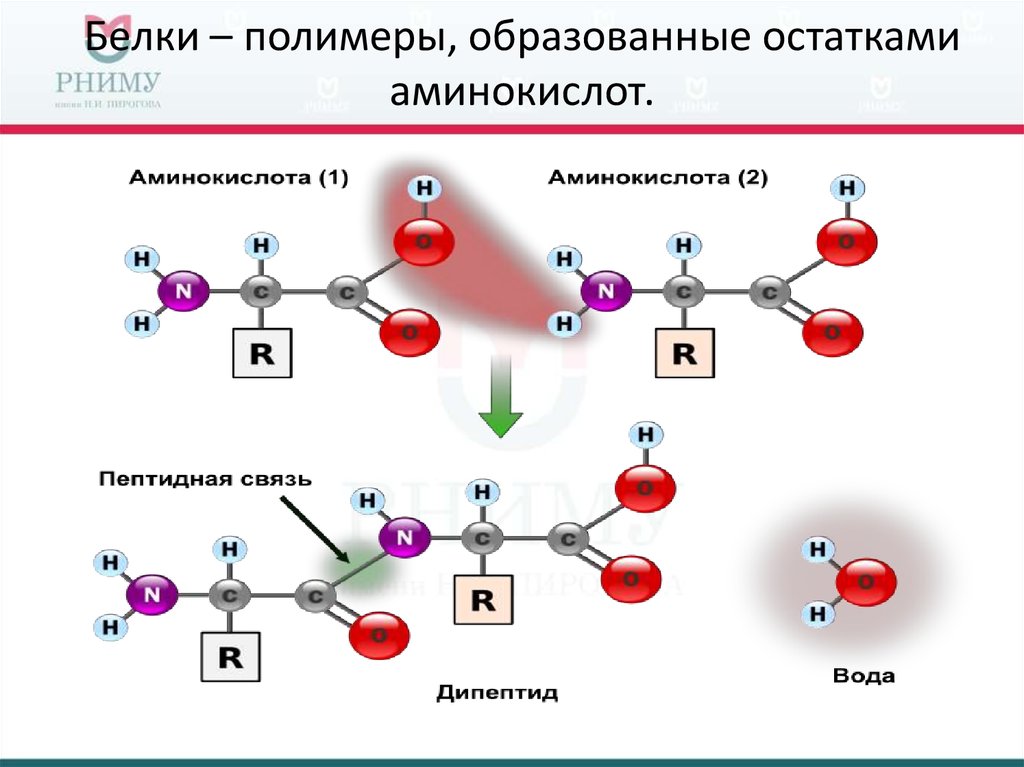 Однако достаточно много белков работает только в комплексе, состоящем из нескольких полипептидных цепей (субъединиц или мономеров — димеры, тримеры, тетрамеры, мультимеры), тогда вот такая сборка из нескольких отдельных цепей и называется четвертичной структурой. Самый банальный пример – состоящий из 4 субъединиц гемоглобин, самый красивый на мой взгляд пример – состоящий из 11 одинаковых субъединиц бактериальный белок TRAP.
Однако достаточно много белков работает только в комплексе, состоящем из нескольких полипептидных цепей (субъединиц или мономеров — димеры, тримеры, тетрамеры, мультимеры), тогда вот такая сборка из нескольких отдельных цепей и называется четвертичной структурой. Самый банальный пример – состоящий из 4 субъединиц гемоглобин, самый красивый на мой взгляд пример – состоящий из 11 одинаковых субъединиц бактериальный белок TRAP.
5. Вычислительные задачи
Белок – сложная система из тысяч атомов, поэтому без использования компьютеров в структуре белка не разобраться. Задач, как решенных на приемлемом уровне, так и совсем не решенных, множество. Перечислю наиболее актуальные:
На уровне первичной структуры – поиск белков с похожей аминокислотной последовательностью, построение по ним эволюционных деревьев и тд – классические задачи биоинформатики. Главным хабом является NCBI — The National Center for Biotechnology Information, www.ncbi.nlm.nih.gov. Для поиска белков со сходной последовательностью стандартно используется BLAST: blast. ncbi.nlm.nih.gov/Blast.cgi
ncbi.nlm.nih.gov/Blast.cgi
Предсказание растворимости белка. Речь идет о том, что если мы прочитаем геном какого-нибудь животного, определим по нему последовательности белков, переклонируем эти гены в кишечную палочку или baculovirus expression system, то окажется, что при экспрессии в этих системах примерно треть белков не будет сворачиваться в правильную структуру, и, как следствие, будет нерастворима. Тут выясняется, что большие белки на самом деле состоят из отдельных «доменов», каждый из которых представляет автономную, функциональную часть белка (несущую одну из его функций) и часто «вырезав» из гена отдельный домен, можно получить растворимый белок, определить его структуру и провести с ним опыты. Люди пытаются использовать машинное обучение (нейронные сети, SVM и прочие классификаторы), чтобы предсказывать растворимость белка, однако работает оно достаточно плохо (Гугл много чего покажет по запросу “protein solubility prediction” – есть много серверов, но по моему опыту все они работают отвратительно на моих белках). В идеале я хотел бы видеть сервис, который надежно сказал бы, где в белке находятся те самые растворимые домены, чтобы их можно было вырезать и работать с ними – такого сервиса нет.
В идеале я хотел бы видеть сервис, который надежно сказал бы, где в белке находятся те самые растворимые домены, чтобы их можно было вырезать и работать с ними – такого сервиса нет.
На уровне вторичной структуры – предсказание той самой вторичной структуры по первичной (JPred)
На уровне третичной структуры – поиск белков со сходными трехмерными структурами (DALI, en.wikipedia.org/wiki/Structural_alignment ),
Поиск структур по заданной суб-структуре. Например, у меня есть расположение трех аминокислот активного центра в пространстве. Хочу найти структуры, которые содержать такие же три аминокислоты в таком же относительном расположении, либо найти структуры белков, мутирование которых даст возможность расположить нужные аминокислоты нужным образом. (гуглить «protein substructure search»)
Предсказание потенциальной подвижности трехмерной структуры, возможных конформационных изменений – normal mode analysis, ElNemo.
На уровне четвертичной структуры – предположим, известны структуры двух белков. Известно, что они образуют комплекс. Предсказать структуру комплекса (определить, как эти два белка будут взаимодействовать посредством shape matching, например). Гуглить «protein-protein docking»
Известно, что они образуют комплекс. Предсказать структуру комплекса (определить, как эти два белка будут взаимодействовать посредством shape matching, например). Гуглить «protein-protein docking»
6. Предсказание структуры белка
Выделил эту вычислительную задачу в отдельный раздел, ибо велика она, фундаментальна и не решается в общем случае.
Экспериментально мы знаем, что если взять белок, полностью развернуть его и бросить в воду, то он свернется обратно в исходное состояние за время от миллисекунд до секунд (это утверждение справедливо по крайней мере для небольших глобулярных белков без всяких патологий). Это значит, что вся информация, необходимая для определения трехмерной структуры белка, в неявном виде содержится в его первичной последовательности, поэтому так хочется научиться предсказывать трехмерную структуру белка по последовательности аминокислот in silico! Однако эта задача в общем случае не решена до сих пор. В чем же дело? Дело в том, что в первичной последовательности отсутствует в явном виде информация, необходимая для построения структуры. Во-первых, нет информации о конформации основной цепи – а она обладает значительной подвижностью, хотя и несколько ограниченной по стерическим причинам. Плюс каждая боковая цепь каждой аминокислоты может находиться в разных конформациях, для длинных боковых групп типа аргинина, это может быть больше десятка конформаций.
Во-первых, нет информации о конформации основной цепи – а она обладает значительной подвижностью, хотя и несколько ограниченной по стерическим причинам. Плюс каждая боковая цепь каждой аминокислоты может находиться в разных конформациях, для длинных боковых групп типа аргинина, это может быть больше десятка конформаций.
Что же делать? Есть достаточно известный хабравчанам самый общий подход, называемый «молекулярная динамика» и подходящий для любых молекул и систем. Берем развернутый белок, приписываем всем атомам случайные значения скоростей, считаем взаимодействия между атомами, повторяем до тех пор, пока система не придет в стабильное состояние, соответствующее свернутому белку. Почему это не работает? Потому что современные вычислительные мощности позволяют за месяцы работы кластера считать десятки наносекунд для системы из тысяч атомов, какой является белок, помещенный в воду. Время же сворачивания белка – миллисекунды и больше, то есть вычислительных мощностей не хватает, разрыв – в несколько порядков. Впрочем, пару лет назад американцы совершили некоторый прорыв. Они использовали специальное железо, оптимизированное для векторных вычислений и после оптимизации на аппаратном уровне у них за месяцы работы машины получилось посчитать молдинамику до миллисекунд для очень маленького белка и белок свернулся, структура соответствовала экспериментально определенной ( http://en.wikipedia.org/wiki/Anton_(computer) )! Однако праздновать победу еще рано. Они взяли очень маленький (его размер раз в 5-10 меньше среднего белка) и один из самых быстросворачивающихся белков, классический модельный белок, на котором изучалось сворачивание. Для больших белков время расчетов увеличивается нелинейно и потребуются уже годы, то есть еще есть над чем работать.
Впрочем, пару лет назад американцы совершили некоторый прорыв. Они использовали специальное железо, оптимизированное для векторных вычислений и после оптимизации на аппаратном уровне у них за месяцы работы машины получилось посчитать молдинамику до миллисекунд для очень маленького белка и белок свернулся, структура соответствовала экспериментально определенной ( http://en.wikipedia.org/wiki/Anton_(computer) )! Однако праздновать победу еще рано. Они взяли очень маленький (его размер раз в 5-10 меньше среднего белка) и один из самых быстросворачивающихся белков, классический модельный белок, на котором изучалось сворачивание. Для больших белков время расчетов увеличивается нелинейно и потребуются уже годы, то есть еще есть над чем работать.
Другой подход реализован в Rosetta. Они разбивают последовательность белка на очень короткие (3-9 остатков) фрагменты и смотрят, какие конформации для этих фрагментов присутствуют в PDB, после чего запускают Монте-Карло по всем вариантам и смотрят, что получится. Иногда получается что-то годное, но в моих случаях через несколько дней работы кластера получаешь такой бублик, что возникает немой вопрос: «Кто писал их оценочную функцию, ставящую какую-то хорошую оценку вот этой загогулине?».
Иногда получается что-то годное, но в моих случаях через несколько дней работы кластера получаешь такой бублик, что возникает немой вопрос: «Кто писал их оценочную функцию, ставящую какую-то хорошую оценку вот этой загогулине?».
Есть инструменты и для моделирования вручную – можно предсказать вторичную структуру и попробовать вручную крутить ее, находя лучшую укладку. Некие гениальные люди даже выпустили игрушку FoldIt, представляющую белок схематично и позволяющую укладывать его, как-бы собирая головоломку (для интересующихся структурой – рекомендую!). Есть абсолютно официальное соревнование для предсказателей белковых структур, называемое CASP. Суть в том, что когда экспериментаторы определяют новую структуру белка, не имеющую аналогов в PDB, они могут не выкладывать ее сразу в PDB, а выставить последовательность этого белка на конкурс предсказаний CASP. Через некоторое время, когда все закончат свои предсказательные модели, экспериментаторы выкладывают свою экспериментально определенную структуру белка и смотрят, насколько хорошо сработали предсказатели. Самое интересное, что игроки FoldIt, не будучи учеными, как-то выиграли CASP у профессионалов моделирования белковых структур и предсказали структуру белка точнее. Однако даже эти успехи не позволяют утверждать, что проблема предсказания структуры белка решается – очень часто модель очень далека от реальной структуры.
Самое интересное, что игроки FoldIt, не будучи учеными, как-то выиграли CASP у профессионалов моделирования белковых структур и предсказали структуру белка точнее. Однако даже эти успехи не позволяют утверждать, что проблема предсказания структуры белка решается – очень часто модель очень далека от реальной структуры.
Все это относилось к моделированию белков ab initio, когда нет никакой априорной информации о структуре. Однако очень часто бывают ситуации, когда для некоторого белка в PDB присутствует его отдаленный родственник с уже известной структурой. Под родственником подразумевается белок с похожей первичной последовательностью. Считается, что для белков со сходством по первичной последовательности больше 30% одинаковая укладка основной цепи (хотя одинаковая укладка наблюдалась и для белков, не проявляющих никакого статистически достоверного сходства по первичной последовательности). В случае наличия гомолога (похожего белка) с известной структурой, можно сделать «гомологичное моделирование», то есть попросту «натянуть» последовательность твоего белка на известную структуру гомолога, а потом погонять минимизацию энергии, чтобы как-то все это дело утрясти.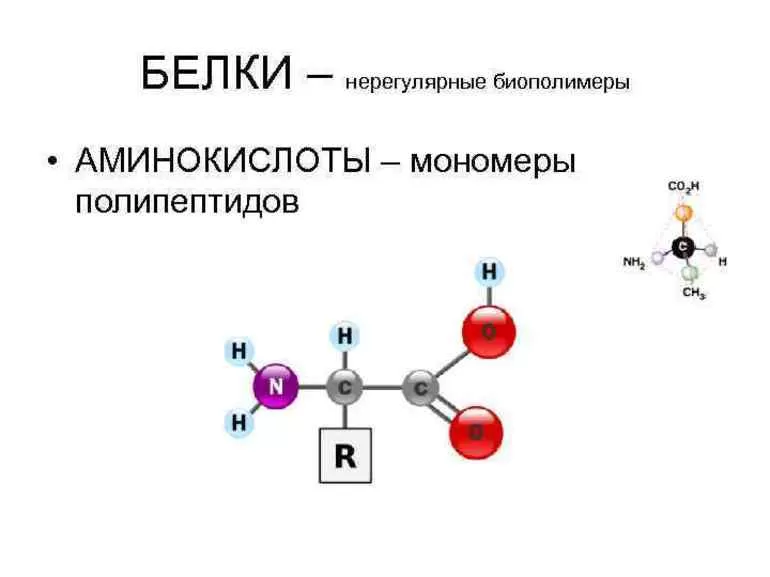 Такое моделирование показывает хорошие результаты при наличие очень близких гомологов, чем дальше гомолог – тем больше ошибка. Инструменты для гомологичного моделирования – Modeller, SwissModel.
Такое моделирование показывает хорошие результаты при наличие очень близких гомологов, чем дальше гомолог – тем больше ошибка. Инструменты для гомологичного моделирования – Modeller, SwissModel.
Можно решать и другие задачи, например, пытаться моделировать, что произойдет, если внести в белок ту или иную мутацию. Например, если заменить гидрофильную аминокислоту на поверхности белка на другую гидрофильную, то скорее всего структура белка не изменится вообще. Если заменить аминокислоту из гидрофобного ядра на другую гидрофобную, но другого размера, то скорее всего укладка белка останется той же, но слегка «съедет» на доли ангстрема. Если же заменить аминокислоту из гидрофобного ядра на заряженную, то скорее всего белок просто «взорвется» и не сможет свернуться.
Может показаться, что все не так уж и плохо и мы достаточно хорошо пониманием сворачивание белка. Да, мы понимаем кое-что, например до некоторой степени мы понимаем общие физические принципы, лежащие в основе сворачивания полипептидной цепи – они рассматриваются в замечательном учебнике Птицына и Финкельштейна «Физика белка». Однако это общее понимание не позволяет нам ответить на вопросы «Свернется ли данный белок или не свернется?», «Какая структура будет у этого белка?», «Как сделать белок с желаемой структурой?».
Однако это общее понимание не позволяет нам ответить на вопросы «Свернется ли данный белок или не свернется?», «Какая структура будет у этого белка?», «Как сделать белок с желаемой структурой?».
Вот одна из иллюстраций: мы хотим локализовать один из доменов большого белка, это стандартная задача. У нас есть фрагмент, который сворачивается и растворим, то есть это живой и здоровый белок. Мы же хотим найти его минимальную часть и начинаем методами генетической инженерии с обоих концов удалять по 2-3 аминокислоты, экспрессировать такой обрезанный белок в бактерии и смотреть его сворачиваемость экспериментально. Мы делаем десятки конструкций с такими маленькими делециями и видим такую картину – полностью растворимый и живой белок отличается от полностью мертвого и несворачивающегося на 3 аминокислоты. Повторюсь, это объективный экспериментальный результат. Проблема в том, что сейчас не существует вычислительного метода, который предсказал бы сворачиваемость белка хотя бы на уровне «да/нет» и сказал мне, где проходит граница между сворачивающимся и несворачивающимся белком, потому мы вынуждены клонировать и экспериментально проверять десятки вариантов. Это лишь одна из иллюстраций того, что наше понимание структуры белка весьма далеко от совершенства. Как говорил Ричард Фейнман, «Чего не могу воссоздать, того не понимаю».
Это лишь одна из иллюстраций того, что наше понимание структуры белка весьма далеко от совершенства. Как говорил Ричард Фейнман, «Чего не могу воссоздать, того не понимаю».
Так что, господа программисты, физики и математики, нам еще есть над чем работать.
На этой оптимистичной ноте разрешите откланяться, благодарю всех, кто осилил сей опус.
Для глубоко знакомства с предметной областью рекомендую следующий минимум:
1) «Физика белка» Птицын и Финкельштейн. Большую часть материала Алексей Витальевич Финкельштейн выложил в онлайн, чем и рекомендую с благодарностью воспользоваться: phys.protres.ru/lectures/protein_physics/index.html (а я утащил оттуда несколько картинок)
2) Патрушев, «Искусственные генетические системы», особенно часть II «Белковая инженерия». Есть на торрентах в формате Djvu
3) Для информации, опубликованной в биологических научных журналах, есть официальный поисковик PubMed ( www.pubmed.org ) — у него стоит попросить почитать про «protein engineering» и тому подобное.
Аспекты аминокислотного профиля белка | ТП Биотех2030
Автор: Архипов М. Ю., кандидат технических наук по специальности Биотехнология, ведущий специалист компании ООО «ФидИндастриз»
Идеальный аминокислотный профиль
Часто можно встретить словосочетание «идеальный белок». Под ним понимают белок, обладающий белок аминокислотным составом, идеально сбалансированным для роста и развития живого организма. На практике идеального белка с постоянным составом аминокислот не существует, т.к. соотношение аминокислот, требуемых для разных живых организмов, отличается и даже для одного и того же организма не постоянно, т.к. зависит от многих факторов: возраста и состояния организма, фазы его развития: формирование скелета, наращивание мышечной массы и др. А что же такое тогда такое «идеальный белок» и зачем нужно это понятие?
Не все аминокислоты одинаково усваиваются, недостаток одних ограничивает усваивание других. Для понимания данной ситуации существует закон Либиха, иллюстрирующий как влияет лимитирующая аминокислота. Согласно закону белок можно представить в виде бочки, сбитой из досок, если одна доска короче остальных, то вода будет уходить через неё. Доски – это аминокислоты, а самая короткая – это лимитрирующая, она будет понижать ценность всего продукта, а избыточные аминокислоты будут выведены из организма.
Согласно закону белок можно представить в виде бочки, сбитой из досок, если одна доска короче остальных, то вода будет уходить через неё. Доски – это аминокислоты, а самая короткая – это лимитрирующая, она будет понижать ценность всего продукта, а избыточные аминокислоты будут выведены из организма.
Попробуем проанализировать аминокислотные профили нескольких белков считающихся идеальными для разных животных разных возрастных групп.
Можно заметить, что при разнообразии кривых идеальных белков, прослеживается общий характер кривой, т.к. существует общая закономерность соотношения аминокислот, следовательно, можно построить аппроксимирующую кривую обобщённого Идеального белка.
Наложив на данную кривую аминокислотные профили любого белка можно судить об оптимальности его по отклонению от этого аппроксимированного профиля «идеального» белка, считая её бочкой Либиха. А существует ли в природе белковая добавка с идеальным аминокислотным профилем?
Виды источников кормового белка
Как известно источники белка могут быть классифицированы по происхождению на 3 основные группы: животные, растительные, микробные. Иногда ещё добавляют две дополнительные группы: белки синтетического происхождения и белки насекомых, но они мало распространены.
Иногда ещё добавляют две дополнительные группы: белки синтетического происхождения и белки насекомых, но они мало распространены.
Для каждой группы белков по происхождению характерен разный аминокислотный профиль.
Широко известно, что основной аминокислотой является лизин. Она является основным лимитирующим фактором в бочке Либиха. Если белок не содержит лизина, то ценность такого продукта низкая. Лидером в плане обеспеченности лизином считается белок животного происхождения, однако надо учитывать, что и животный белок может быть совершенно разным по АК профилю. Давайте посмотрим какой он бывает.
Ближе всего к идеальному белку по АК профилю располагается белок зародыша: яйцо, икра. В нём содержатся все аминокислоты в соответствии с потребностью универсального развития целостного живого организма. Такой белок оптимален для быстрого начального развития организма, но с его развитием потребность меняется. Поэтому его можно назвать базовым для развития всех живых организмов.
Из диаграммы видно, что АК профиль яичного белка вполне покрывает АК профиль идеального белка.
За ним идёт белок молока – это, прежде всего, казеин, содержание которого в коровьем молоке достигает 78-85%. Этот белок содержит полный набор незаменимых аминокислот, но имеет относительный провал по метионину и треонину.
К белкам животного происхождения также относятся другие белки, которые имеют аминокислотный профиль совсем далёкий от идеального. Они получены при переработке кожи, пуха, пера, костей и других отходов. В таких белках преобладают соединительные структурные белки – коллаген, эластин, кератин. Коллаген и эластин содержатся в коже, хрящах, костях, лёгких и кровеносных сосудах. Они содержат много глицина и пролина. В эластине больше валина и аланина и меньше глутаминовой кислоты и аргинина, чем в коллагене. Кератин — это фибриллярный белок, обладающий высокой механической прочностью. В основном из него состоят волосы, ногти, рога, перья и клюв птиц и др.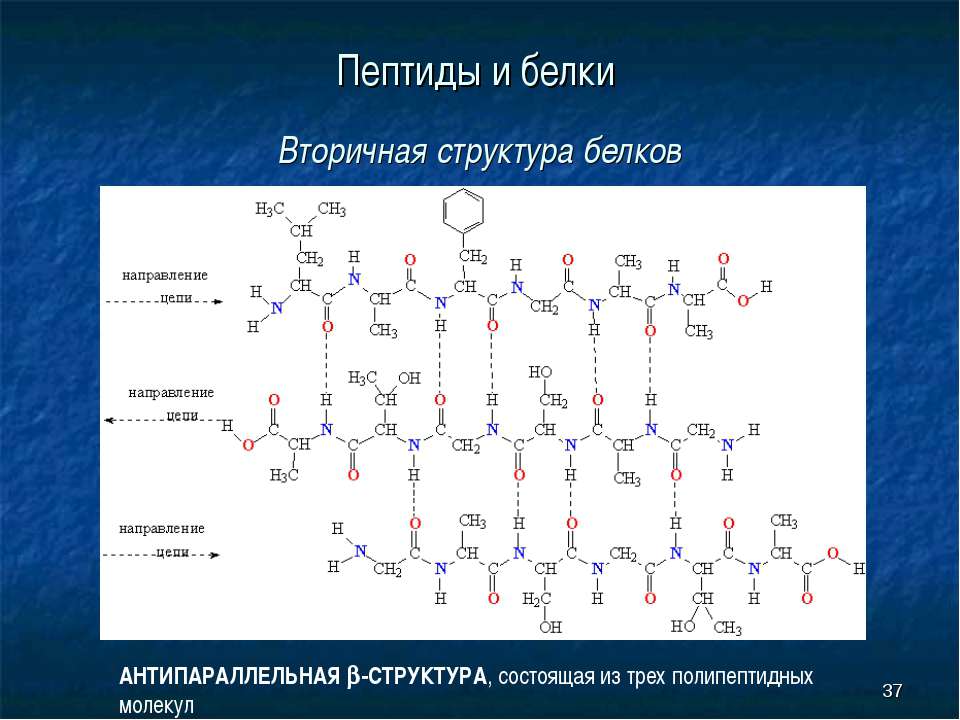
Как видно из диаграммы эти белки крайне бедны по основным незаменимым аминокислотам — лизину, метионину, гистидину, триптофану и далеко выпадают из профиля «идеального» белка. Гидролиз, ферментирование, концентрирование или изолирование таких белков не могут добавить им недостающих аминокислот, т.к. при дальнейшей переработке не меняется АК профиль.
Рыбная мука. АК профиль рыбной муки близок к профилю идеального белка, недостаток заметен только по метионину и фенилаланину. АК профиль рыбной муки также сильно колеблется, т.к. зависит из чего она сделана: из какой рыбы, из целой или из отходов, присутствия фальсифицирующих добавок.
Если же рыбная мука сделана из рыбных отходов, то аминокислотный профиль будет совсем иным – в нём будет провал по основным аминокислотам, в том числе лизину, из-за высокого содержания коллагенсодержащих вторичных рыбных ресурсов (головы, костей, плавников и др.).
Растительные белки. Растительные белки по сравнению с животными менее полноценны, так как они дефицитны по содержанию незаменимых аминокислот, прежде всего лизина и треонина.
Для белка пшеницы, кукурузы, также как и риса, пшена, подсолнечника первой лимитирующей аминокислотой является лизин, для бобовых — метионин. Среди растительных белков наиболее близка по АК профилю к идеальному соя, а все остальные культуры, включая горох, люпин, лён и другие уступают ей уступают, прежде всего, по содержанию лизина. Следует помнить, что аминокислотный профиль растительного белкового продукта будь это концентрат, гидролизат или изолят всегда сохраняет аминокислотный профиль исходного сырья, которое было использовано в производстве. Если же в готовом белковом продукте прослеживается значительное нарушение профиля, например завышенное содержание лизина, то это — фальсификат, в который добавляли синтетические аминокислоты или другие добавки. Такие добавки снижают питательность исходного природного белка и могут быть опасны, несмотря на более сбалансированный аминокислотный профиль.
Микробный белок. Микробный белок получают ферментаций микроорганизмов, целью которой является наработка биомассы. Обычно используют обычно дрожжи, как самый быстрорастущий м/о. В его биомассе накапливается обычно 45% белка. Аминокислотный профиль дрожжевого белка близок к идеальному, кроме содержания метионина.
Обычно используют обычно дрожжи, как самый быстрорастущий м/о. В его биомассе накапливается обычно 45% белка. Аминокислотный профиль дрожжевого белка близок к идеальному, кроме содержания метионина.
Минусом такого дрожжевого белка является наличие у микроорганизмов клеточной стенки, которая сложно расщепляется ферментами живого организма.
Источник: http://soyanews.info/news/aspekty_aminokislotnogo_profilya_belka.html
Биохимия, незаменимые аминокислоты — StatPearls
Введение
Незаменимые аминокислоты, также известные как незаменимые аминокислоты, представляют собой аминокислоты, которые люди и другие позвоночные не могут синтезировать из промежуточных продуктов метаболизма. Эти аминокислоты должны поступать из экзогенной диеты, потому что в организме человека отсутствуют метаболические пути, необходимые для синтеза этих аминокислот. [1] [2] В питании аминокислоты подразделяются на незаменимые и несущественные. Эти классификации явились результатом ранних исследований питания человека, которые показали, что определенные аминокислоты необходимы для роста или азотного баланса, даже когда имеется достаточное количество альтернативных аминокислот.[3] Хотя возможны вариации в зависимости от метаболического состояния человека, общее мнение состоит в том, что существует девять незаменимых аминокислот, включая фенилаланин, валин, триптофан, треонин, изолейцин, метионин, гистидин, лейцин и лизин. Мнемоническое обозначение PVT TIM HaLL («частный Тим Холл») — это широко используемое устройство для запоминания этих аминокислот, поскольку оно включает в себя первую букву всех незаменимых аминокислот. Что касается питания, девять незаменимых аминокислот можно получить из одного полноценного белка.Полноценный белок по определению содержит все незаменимые аминокислоты. Полноценные белки обычно получают из источников питания животного происхождения, за исключением сои. [4] [5] Незаменимые аминокислоты также доступны из неполноценных белков, которые обычно представляют собой продукты растительного происхождения. Термин «ограничивающая аминокислота» используется для описания незаменимой аминокислоты, присутствующей в пищевом белке в наименьшем количестве по сравнению с эталонным пищевым белком, таким как яичные белки. Термин «ограничивающая аминокислота» может также относиться к незаменимой аминокислоте, которая не отвечает минимальным требованиям для человека.[6]
Эти классификации явились результатом ранних исследований питания человека, которые показали, что определенные аминокислоты необходимы для роста или азотного баланса, даже когда имеется достаточное количество альтернативных аминокислот.[3] Хотя возможны вариации в зависимости от метаболического состояния человека, общее мнение состоит в том, что существует девять незаменимых аминокислот, включая фенилаланин, валин, триптофан, треонин, изолейцин, метионин, гистидин, лейцин и лизин. Мнемоническое обозначение PVT TIM HaLL («частный Тим Холл») — это широко используемое устройство для запоминания этих аминокислот, поскольку оно включает в себя первую букву всех незаменимых аминокислот. Что касается питания, девять незаменимых аминокислот можно получить из одного полноценного белка.Полноценный белок по определению содержит все незаменимые аминокислоты. Полноценные белки обычно получают из источников питания животного происхождения, за исключением сои. [4] [5] Незаменимые аминокислоты также доступны из неполноценных белков, которые обычно представляют собой продукты растительного происхождения. Термин «ограничивающая аминокислота» используется для описания незаменимой аминокислоты, присутствующей в пищевом белке в наименьшем количестве по сравнению с эталонным пищевым белком, таким как яичные белки. Термин «ограничивающая аминокислота» может также относиться к незаменимой аминокислоте, которая не отвечает минимальным требованиям для человека.[6]
Fundamentals
Аминокислоты являются основными строительными блоками белков, и они служат азотистыми скелетами для таких соединений, как нейротрансмиттеры и гормоны. В химии аминокислота — это органическое соединение, которое содержит функциональные группы как амино (-Nh3), так и карбоновой кислоты (-COOH), отсюда и название аминокислота. Белки — это длинные цепи или полимеры определенного типа аминокислоты, известной как альфа-аминокислота. Альфа-аминокислоты уникальны, потому что функциональные группы амино и карбоновых кислот разделены только одним атомом углерода, который обычно является хиральным углеродом.В этой статье мы сосредоточимся исключительно на альфа-аминокислотах, из которых состоят белки. [7] [8]
Белки представляют собой цепочки аминокислот, которые собираются через амидные связи, известные как пептидные связи. Разница в группе боковой цепи или R-группе определяет уникальные свойства каждой аминокислоты. Затем уникальность различных белков определяется тем, какие аминокислоты в нем содержатся, как эти аминокислоты расположены в цепи, и другими сложными взаимодействиями, которые цепь осуществляет с собой и с окружающей средой.Эти полимеры аминокислот способны производить разнообразие, наблюдаемое в жизни.
Существует около 20 000 уникальных генов, кодирующих белок, ответственных за более чем 100 000 уникальных белков в организме человека. Хотя в природе встречаются сотни аминокислот, для производства всех белков, содержащихся в организме человека и в большинстве других форм жизни, необходимо всего около 20 аминокислот. Все эти 20 аминокислот представляют собой L-изомер, альфа-аминокислоты. Все они, кроме глицина, содержат хиральный альфа-углерод.И все эти аминокислоты являются L-изомерами с R-абсолютной конфигурацией, за исключением глицина (без хирального центра) и цистеина (S-абсолютная конфигурация из-за серосодержащей R-группы). Следует упомянуть, что аминокислоты селеноцистеин и пирролизин считаются 21-й и 22-й аминокислотами соответственно. Это недавно открытые аминокислоты, которые могут включаться в белковые цепи во время синтеза рибосомных белков. Пирролойзин жизненно важен; однако люди не используют пирролизин для синтеза белка.После трансляции эти 22 аминокислоты также могут быть модифицированы посредством посттрансляционной модификации, чтобы добавить дополнительное разнообразие в генерацию белков. [8]
От 20 до 22 аминокислот, которые составляют белки, включают:
Из этих 20 аминокислот девять аминокислот являются незаменимыми:
Фенилаланин
Валин
Триптофан
Треонин
Метионин
Гистидин
Лейцин
Лизин
Изолейцин
Незаменимые, также известные как незаменимые аминокислоты, можно исключить из рациона.Организм человека может синтезировать эти аминокислоты, используя только незаменимые аминокислоты. Для большинства физиологических состояний здорового взрослого человека указанные выше девять аминокислот являются единственными незаменимыми аминокислотами. Однако такие аминокислоты, как аргинин и гистидин, можно считать условно незаменимыми, поскольку организм не может синтезировать их в достаточных количествах в течение определенных физиологических периодов роста, включая беременность, рост в подростковом возрасте или восстановление после травмы [9].
Механизм
Хотя для синтеза белка человека требуется двадцать аминокислот, люди могут синтезировать только половину этих необходимых строительных блоков.У людей и других млекопитающих есть только генетический материал, необходимый для синтеза ферментов, обнаруженных в путях биосинтеза заменимых аминокислот. Вероятно, есть эволюционное преимущество в удалении длинных путей, необходимых для синтеза незаменимых аминокислот с нуля. Потеряв генетический материал, необходимый для синтеза этих аминокислот, и полагаясь на окружающую среду, чтобы обеспечить эти строительные блоки, эти организмы могут снизить расход энергии, особенно при репликации своего генетического материала.Эта ситуация дает преимущество в выживании; однако это также создает зависимость от других организмов в отношении материалов, необходимых для синтеза белка. [10] [11] [12]
Клиническая значимость
Классификация незаменимых и заменимых аминокислот была впервые представлена в исследованиях питания, проведенных в начале 1900-х годов. Одно исследование (Rose 1957) показало, что человеческое тело способно поддерживать азотный баланс при диете, состоящей только из восьми аминокислот. [13] Эти восемь аминокислот были первой классификацией незаменимых аминокислот или незаменимых аминокислот.В это время ученые смогли идентифицировать незаменимые аминокислоты, проведя исследования кормления очищенными аминокислотами. Исследователи обнаружили, что, когда они исключили из рациона отдельные незаменимые аминокислоты, субъекты не смогли бы расти или поддерживать азотный баланс. Более поздние исследования показали, что некоторые аминокислоты являются «условно незаменимыми» в зависимости от метаболического состояния субъекта. Например, хотя здоровый взрослый может синтезировать тирозин из фенилаланина, у маленького ребенка может не развиться необходимый фермент (фенилаланингидроксилаза) для осуществления этого синтеза, и поэтому они не смогут синтезировать тирозин из фенилаланина, что делает тирозин незаменимым продуктом. незаменимая аминокислота в этих условиях.Эта концепция также появляется при различных болезненных состояниях. По сути, отклонения от стандартного метаболического состояния здорового взрослого человека могут привести организм в такое метаболическое состояние, при котором для баланса азота требуется больше, чем стандартные незаменимые аминокислоты. В целом, оптимальное соотношение незаменимых и заменимых аминокислот требует баланса, зависящего от физиологических потребностей, которые различаются у разных людей. Поиск оптимального соотношения аминокислот в общем парентеральном питании при заболеваниях печени или почек является хорошим примером различных физиологических состояний, требующих различного потребления питательных веществ.Следовательно, термины «незаменимые аминокислоты» и «заменимые аминокислоты» могут вводить в заблуждение, поскольку все аминокислоты могут быть необходимы для обеспечения оптимального здоровья. [1]
При состояниях недостаточного потребления незаменимых аминокислот, таких как рвота или низкий аппетит, могут появиться клинические симптомы. Эти симптомы могут включать депрессию, беспокойство, бессонницу, усталость, слабость, задержку роста у молодых и т. Д. Эти симптомы в основном вызваны недостаточным синтезом белка в организме из-за нехватки незаменимых аминокислот.Необходимое количество аминокислот необходимо для выработки нейромедиаторов, гормонов, роста мышц и других клеточных процессов. Эти недостатки обычно присутствуют в более бедных частях мира или у пожилых людей, которым не уделяется должного ухода [2].
Квашиоркор и маразм — примеры более серьезных клинических расстройств, вызванных недоеданием и недостаточным потреблением незаменимых аминокислот. Квашиоркор — это форма недоедания, характеризующаяся периферическими отеками, сухим шелушением кожи с гиперкератозом и гиперпигментацией, асцитом, нарушением функции печени, иммунодефицитом, анемией и относительно неизменным составом мышечных белков.Это результат диеты с недостаточным содержанием белка, но достаточным количеством углеводов. Маразм — это форма недоедания, характеризующаяся истощением, вызванным недостатком белка и недостаточным потреблением калорий в целом. [14]
Рисунок
Общая структура аминокислот. Внесен и создан Майклом Лопесом, B.S.
Ссылки
- 1.
- Hou Y, Yin Y, Wu G. Необходимость в питании «незаменимых аминокислот» для животных и людей. Exp Biol Med (Maywood).2015 август; 240 (8): 997-1007. [Бесплатная статья PMC: PMC4935284] [PubMed: 26041391]
- 2.
- Hou Y, Wu G. Adv Nutr. 01 ноября 2018 г .; 9 (6): 849-851. [Бесплатная статья PMC: PMC6247364] [PubMed: 30239556]
- 3.
- Reeds PJ. Незаменимые и незаменимые аминокислоты для человека. J Nutr. 2000 Июл; 130 (7): 1835С-40С. [PubMed: 10867060]
- 4.
- Le DT, Chu HD, Le NQ. Улучшение питательного качества растительных белков с помощью генной инженерии.Curr Genomics. 2016 июн; 17 (3): 220-9. [Бесплатная статья PMC: PMC4869009] [PubMed: 27252589]
- 5.
- Hoffman JR, Falvo MJ. Белок — какой лучше? J Sports Sci Med. 2004 сентябрь; 3 (3): 118-30. [Бесплатная статья PMC: PMC3
4] [PubMed: 24482589] - 6.
- Джуд С., Капур А.С., Сингх Р. Аминокислотный состав и химическая оценка качества белка зерновых культур при поражении насекомыми. Растительная еда Hum Nutr. 1995 сентябрь; 48 (2): 159-67. [PubMed: 8837875]
- 7.
- ЛаПелуса А., Кошик Р. StatPearls [Интернет]. StatPearls Publishing; Остров сокровищ (Флорида): 5 декабря 2020 г. Физиология, белки. [PubMed: 32310450]
- 8.
- Ву Г. Аминокислоты: метаболизм, функции и питание. Аминокислоты. 2009 Май; 37 (1): 1-17. [PubMed: 19301095]
- 9.
- de Koning TJ. Нарушения синтеза аминокислот. Handb Clin Neurol. 2013; 113: 1775-83. [PubMed: 23622400]
- 10.
- Guedes RL, Prosdocimi F, Fernandes GR, Moura LK, Ribeiro HA, Ortega JM.Пути биосинтеза аминокислот и ассимиляции азота: большая делеция генома в ходе эволюции эукариот. BMC Genomics. 2011 22 декабря; 12 Дополнение 4: S2. [Бесплатная статья PMC: PMC3287585] [PubMed: 22369087]
- 11.
- D’Souza G, Waschina S, Pande S, Bohl K, Kaleta C, Kost C. биосинтетические гены у бактерий. Эволюция. 2014 сентябрь; 68 (9): 2559-70. [PubMed: 24
8]
- 12.
- Сигенобу С., Ватанабе Х., Хаттори М., Сакаки Й., Исикава Х.Последовательность генома внутриклеточного бактериального симбионта тлей Buchnera sp. APS. Природа. 2000, сентябрь 07; 407 (6800): 81-6. [PubMed: 10993077]
- 13.
- ROSE WC. Потребности в аминокислотах взрослого человека. Nutr Abstr Rev.1957 июл; 27 (3): 631-47. [PubMed: 13465065]
- 14.
- Benjamin O, Lappin SL. StatPearls [Интернет]. StatPearls Publishing; Остров сокровищ (Флорида): 19 июля 2020 г., Квашиоркор. [PubMed: 29939653]
В чем разница между белками и аминокислотами? | Здоровое питание
Автор: Ян Анниган Обновлено 7 декабря 2018 г.
Хотя белки и аминокислоты тесно связаны, это не совсем одно и то же.Аминокислоты называются пептидами, и представляют собой небольшие субъединицы, состоящие из углерода, водорода, кислорода и других соединений. Белки также называются полипептидами, и представляют собой цепочки из связанных между собой аминокислот — цепочки, которые могут содержать тысячи и тысячи аминокислот. Ваше тело обладает способностью расщеплять белки на аминокислоты и перестраивать аминокислоты в белки, и оба процесса важны для вашего здоровья.
Основы аминокислот
Хотя все аминокислоты имеют схожую структуру, каждая из них химически различна.Когда они соединяются вместе, образуя новый белок, отдельные структуры аминокислот и то, как они взаимодействуют с соседними аминокислотами в белковой цепи, помогают определить окончательную форму и, следовательно, конечную функцию белка. Аминокислоты влияют на то, как белок используется в вашем организме, но, напротив, белки вашего тела не могут напрямую влиять на функцию аминокислот.
Синтез белка
Когда клетки вашего тела получают сообщение — например, когда иммунные клетки отправляют предупреждение о том, что вторгшийся микроорганизм проник в ваше тело и требует выработки антител для борьбы с ним — эти клетки могут начать процесс синтеза белка.Используя информацию, закодированную в вашем генетическом материале, механизмы построения белка в ваших клетках собирают аминокислоты из вашего диетического белка и собирают их в определенном порядке для создания белка, который вам нужен в данный момент. Таким образом, белки используют входящие в их состав аминокислоты, чтобы стать полнофункциональными молекулами, необходимыми вашему организму для поддержания здоровья.
Функции
После включения аминокислот в белки белки могут выполнять множество функций в организме.Они поддерживают ваш иммунитет, наращивают и восстанавливают мышцы, обеспечивают структуру ваших внутренних органов и отправляют сообщения между клетками, и они зависят от аминокислот, из которых они состоят. Однако, как отдельные молекулы, аминокислоты могут вносить вклад в работу вашего тела независимо от их неотъемлемой роли в белках. Например, часть аминокислот может превращаться в глюкозу для использования в качестве топлива, когда в вашем рационе слишком много белка, но слишком мало углеводов. Другие аминокислоты могут стать жирными кислотами для хранения в жировой ткани, если в вашем рационе больше белка и калорий, чем вам нужно.
Соображения
Хотя они разные, белки и аминокислоты обладают высокой степенью взаимозависимости. Без аминокислот ваше тело не может производить белки. Без диетического белка ваше тело не сможет получить доступ ко всем аминокислотам, необходимым для его производства. Ваши клетки способны производить некоторые аминокислоты, известные как заменимые, в то время как незаменимые аминокислоты являются необходимым компонентом вашего рациона, потому что вы не способны их синтезировать. Оба типа аминокислот необходимы для хорошего здоровья, а хорошо сбалансированная диета обеспечивает как достаточное количество белка, так и полный набор незаменимых аминокислот, которые вам необходимы каждый день.
Белки и аминокислоты | Thermo Fisher Scientific
Стандартный генетический код
U C A G U UUU Phe (F)
UUC5Gu (F)
UUC5G (F)
UUC5G (F)
UUC5 Leu (L)
UCU Ser (S)
UCC Ser (S)
UCA Ser (S)
UCG Ser (S)
UAU Tyr (Y)
UAC Tyr (Y)
UAA Stop
UAG Stop
UGU Cys (C)
UGC Cys (C)
UGA Stop
UGG Trp (W)
U
C
C
C
C
C
C CUU Leu (L)
CUC Leu (L)
CUA Leu (L)
CUG Leu (L)
CCU Pro (P)
Pro (P)CCC
CCA Pro (P)
CCG Pro (P)
CAU His (H)
CAC His (H)
CAA Gln (Q)
CAG Gln (Q)
CGU Arg (R)
CGC Arg (R)
CGA Arg (R)
CGG Arg (R)
U
C
A
G
A AA 9018
AUC Ile (I)
AUA Ile (I)
AUG Met (M)
ACU Thr (T)
ACC Thr (T)
ACA Thr (T)
ACG Thr (T)
AAU Asn (N)
AAC Asn (N)
AAA Lys (K)
AAG Lys (K)
AGU Ser (S)
AGC Ser (S)
ArgAGA Ser (S)
ArgAGA Ser (S) (R)
AGG Arg (R)
U
C
A 9000 5
G
G GUU Val (V)
GUC Val (V)
GUA Val (V)
GUG Val (V)
GCU Ala (A)
GCU Ala (A)
9000 Ala (A)GCA Ala (A)
GCG Ala (A)
GAU Asp (D)
GAC Asp (D)
GAA Glu (E)
GAG Glu (E)
GGU Gly (G)
GGC Gly (G)
GGA Gly (G)
GGG Gly (G)
U
C
A
G
Молекулярная масса аминокислот Аминокислота Трехбуквенный код Однобуквенный код Молекулярный вес (г / моль) Аланин Ala A 89.1 Аргинин Arg R 174,2 Аспарагин Asn N 132,1 Aspartate
C 121,2 Глутамат Glu E 147,1 Глютамин Gln Q 146.2 Глицин Gly G 75,1 Гистидин His H 155,2 Isoleucine 901 901 Изолейцин 901 Leu L 131,2 Лизин Lys K 146,2 Метионин Met M 149.2 Фенилаланин Phe F 165,2 Пролин Pro P 115,1 S S 9018 Серин9018 Серин Серин re ThrT 119,1 Триптофан Trp W 204,2 Тирозин Tyr Y 181.2 Валин Вал V 117.1 Приблизительный молекулярный вес белка
M.W. белка = # аминокислот x 110 Да
Расширьте свои знания о белках и аминокислотах
Все биологические организмы, включая вас, по сути, представляют собой белковые структуры, наполненные водой и иногда поддерживаемые костями. Вот как это важно. Белок — самый важный строительный блок вашего тела.Фактически, слово «белок» происходит от греческого proteios «первое качество» или от protos «первое».
По оценкам, человеческое тело содержит более двух миллионов белков. Общее количество, обнаруженное в биологических организмах на суше, вероятно, превысит 10 миллионов. Но никто не знает наверняка. Цифра огромна, потому что у каждого белка есть другой, способный его расщепить.
Структура белка
Белки — это молекулы с длинными цепями, состоящие из основных строительных блоков жизни — аминокислот.Это органические соединения с очень специфической химической структурой. Аминокислоты, содержащие аминные (молекулы с атомом азота и двумя атомами водорода) и карбоксильные (молекулы, содержащие углерод, две молекулы кислорода и одну молекулу водорода) функциональные группы. Они связаны с боковой цепью (группа R) молекул, специфичных для каждой аминокислоты.
Есть 20 хорошо известных аминокислот, которые составляют белки в вашем теле. Недавно были обнаружены две дополнительные аминокислоты.Итак, все животные и растительные белки на Земле состоят из этих 22 аминокислот.
В 1806 году французские химики Луи-Николя Воклен и Пьер Жан Робике выделили из спаржи соединение, которое впоследствии было названо аспарагином. Это была первая открытая аминокислота.
Самый длинный из известных белков, тайтин, также известен как коннектин. Он содержит 26 926 аминокислот. Титин содержится в мышцах и способствует их пассивной жесткости.
Даже при ограниченном количестве аминокислот белки могут быть очень сложными молекулами.Это потому, что большинство белков складываются в уникальные трехмерные структуры.
Биохимики часто называют четыре различных аспекта структуры белка:
- Первичная структура: линейная аминокислотная последовательность, удерживаемая связями, известными как пептидные связи.
- Вторичная структура: трехмерная форма локальных или определенных сегментов белков. Эти локальные сегменты представляют собой изгибы и повороты, стабилизированные водородными связями.
- Третичная структура: Общая форма отдельной белковой молекулы.Также синонимична термину «складка», третичная структура контролирует основную функцию белка.
- Четвертичная структура: структура, образованная несколькими белковыми молекулами (полипептидными цепями), которые функционируют как единый белковый комплекс. В этом контексте их обычно называют белковыми субъединицами.
Функция белка
Вы можете думать о белках как о строительных блоках, особенно для мышечной ткани. Но белки выполняют множество жизненно важных функций в организме. И некоторые из них могут вас удивить.Основные из них перечислены ниже.
Ферменты и гормоны
Наиболее известная роль белков в клетке — это ферменты, катализирующие химические реакции. Это может помочь вам преобразовать пищу в клеточную энергию. Пищеварительные ферменты — хороший пример этого типа белка. Эти ферменты также могут принимать форму антиоксидантов. Селенсодержащая протеин-глутатионпероксидаза — одно из важнейших антиоксидантных соединений в организме.
Половые гормоны, известные как гонадотропины, и эндокринные гормоны, такие как инсулин и глюкагон, также являются белками.
В 1955 году инсулин стал первым белком, который был полностью секвенирован. Британский биохимик Фредерик Сэнджер получил Нобелевскую премию по химии за это новаторское исследование.
Технологии рекомбинантной ДНК были использованы в 1978 году биотехнологической фирмой Genentech для производства синтетического «человеческого» инсулина, что сделало инсулин первым человеческим белком, производимым с помощью биотехнологии.
Сигнализация клетки
Многие белки участвуют в процессе передачи сигналов клетками и передачи сигналов.Некоторые белки, такие как инсулин, передают сигнал от клетки, в которой они были синтезированы, другим клеткам в отдаленных тканях.
Белки участвуют в обеих сторонах сигнального процесса. Они также действуют как рецепторы на клетки, которые связываются с сигнальной молекулой, чтобы вызвать биохимический ответ.
Антитела — это белковые компоненты иммунной системы. Их основная функция — связывать инородные вещества в организме (антигены) и нацеливать их на разрушение.
Структурные белки
Они придают форму и жесткость биологическим компонентам.Большинство структурных белков имеют волокнистую природу.
Коллаген и эластин — два прекрасных примера этих прочных волокнистых белков. Они оба являются важными компонентами соединительной ткани, например хрящом. И они выполняют основные функции в структуре кожи. Протеин-кератин обеспечивает структуру ваших волос и ногтей. В животном мире кератин помогает создавать перья, копыта и некоторые панцири животных.
Последняя категория включает глобулярные структурные белки. Они образуют длинные жесткие волокна, которые позволяют клеткам сохранять свою форму и размер.
Другие функции
Белки также играют роль в клеточной адгезии, факторах роста, транспортировке и хранении питательных веществ и многом другом. У людей небелковые аминокислоты также играют важную роль в качестве нейротрансмиттеров или предшественников других молекул. Нейротрансмиттеры — это вещества, которые помогают передавать импульсы между нервами.
- Триптофан — предшественник нейромедиатора серотонина, который влияет на настроение и многое другое.
- Тирозин (и его предшественник фенилаланин) являются предшественниками дофамина, адреналина, норадреналина и различных следов аминов.
- Глицин является предшественником важных соединений в крови, известных как порфирины (например, гем).
- Аргинин является предшественником оксида азота.
Белки и аминокислоты в рационе
Белки, которые вы едите, не всасываются в неизменном виде. Итак, вы не едите куриную грудку и не добавляете в свой организм точно такой же белок. Белки перевариваются в аминокислоты или небольшие пептиды, которые могут всасываться в кишечнике и переноситься с кровью.
Пептиды отличаются от белков тем, что они меньше по размеру и обычно содержат 50 или меньше аминокислот.Самые короткие пептиды — это дипептиды, состоящие из двух аминокислот, соединенных одной пептидной связью. Полипептид представляет собой длинную, непрерывную и неразветвленную пептидную цепь.
Переваривание белков начинается в желудке. Кислая среда и желудочный фермент пепсин начинают денатурировать (распутывать) белок. Это делает его более доступным для пищеварительных ферментов, выделяемых поджелудочной железой.
Другие специфические ферменты дополнительно расщепляют более крупные пептиды на ди- и трипептиды и свободные аминокислоты.Затем они попадают в кровь для использования другими тканями. После переваривания аминокислоты используются для синтеза белков и других биомолекул, либо они превращаются в мочевину и углекислый газ в качестве источника энергии.
Из 20 стандартных аминокислот девять называются незаменимыми, потому что ваше тело не может производить их из других соединений на уровне, необходимом для нормального роста. Значит, их нужно получать из еды. Незаменимые аминокислоты включают гистидин, изолейцин, лейцин, лизин, метионин, фенилаланин, треонин, триптофан и валин.
Качество белка
Не все пищевые белки одинаково эффективны для вашего здоровья. Ученые разработали шкалу, позволяющую узнать качество протеина. Предыдущие методы измерения качества включают PER (коэффициент эффективности белка) и BV (биологическую ценность). Но сегодня они используются редко.
В настоящее время предпочтительный метод определения качества белка известен как оценка аминокислот с поправкой на усвояемость белка (PDCAAS). PDCAAS позволяет оценивать качество пищевого белка в соответствии с вашими потребностями.Он измеряет качество белка на основе потребностей в аминокислотах (с поправкой на усвояемость) ребенка в возрасте от 2 до 5 лет (который считается наиболее требовательной к питанию возрастной группой).
Используя метод PDCAAS, рейтинг качества белка определяется путем сравнения аминокислотного профиля конкретного пищевого белка со стандартным аминокислотным профилем. Максимально возможный балл — 1,0. Этот показатель означает, что после переваривания белка он обеспечивает 100 или более процентов необходимых незаменимых аминокислот на единицу белка.
Потребность в белке
Суточная потребность в белке — это комбинация многих факторов, включая возраст, состав тела, пол, общее потребление энергии (калорий), статус тренировок и уровень тренировок спортсмена.
Рекомендации по потреблению белка основаны на массе тела. Для нормально здоровых взрослых ежедневная рекомендация составляет 0,8 грамма белка на каждый килограмм веса тела. Для нормально здоровой взрослой женщины, которая весит 150 фунтов и ведет малоподвижный образ жизни, это означает около 55 граммов белка в день.
Рекомендуемая диета (RDA) для взрослых женщин составляет 46 граммов в день, для взрослых мужчин — 56 граммов в день, а для беременных и кормящих женщин — 71 грамм в день. Это не соответствует рекомендациям по какой-то причине.
Как и RDA для микронутриентов, они предназначены для обеспечения достаточного уровня для нормального здоровья и роста практически здоровых людей. RDA — это минимальный уровень потребления, необходимый для удовлетворения основных потребностей в питании, но это не обязательно конкретное количество, которое является лучшим или оптимальным.
Белок для спортсменов
Спортсмены потребляют диетический белок для восстановления и восстановления скелетных мышц и соединительных тканей после интенсивных тренировок или спортивных мероприятий. Спортсмены обычно должны получать от 1,4 до 2,0 граммов белка на каждый килограмм веса тела в день.
Один конкретный тип аминокислот особенно важен для спортсменов — аминокислоты с разветвленной цепью (BCAA). Из девяти незаменимых аминокислот только три известны как BCAA. Но они составляют около 35 процентов белков в мышечной ткани.Также известно, что эти BCAA играют полезную роль во время аэробных упражнений, снижая скорость деградации белка и замедляя истощение мышечного гликогена.
Три BCAA — лейцин, изолейцин и валин. BCAA имеют решающее значение для синтеза и обмена белка, сигнальных путей клеток и метаболизма глюкозы. Они также играют роль в синтезе белков и нейромедиаторов в головном мозге и в производстве энергии.
Растущее количество научной литературы предполагает, что из трех BCAA лейцин, по-видимому, играет наиболее значительную роль в стимуляции синтеза белка.
Белок для пожилых людей
Старение ведет к потере мышечной массы. Нормальное старение связано с изменениями метаболизма мышечных белков и снижением реакции на аминокислоты в пище. Адекватное потребление лейцина (BCAA) во время еды может помочь преодолеть эту нечувствительность к мышечным белкам и стать полезным инструментом для предотвращения избыточной потери мышечной массы. Минимальная доза для этих преимуществ составляет от 2,0 до 2,5 граммов лейцина на порцию или прием пищи.
Также становится ясно, что лейцин, взятый как часть цельного качественного белка, вероятно, более полезен, чем добавление только BCAA.Чтобы максимизировать удержание мышечного белка у пожилых людей и обеспечить адекватный уровень лейцина, большинство экспертов предлагают планы питания, которые включают 25-30 граммов высококачественного белка на один прием пищи.
Потеря мышечной массы происходит с возрастом, но потеря больше, чем обычно (0,5–1,0% в год), известна как саркопения. Это прогрессирующее снижение массы скелетных мышц, которое приводит к снижению силы и функциональности. Саркопения встречается у 30% людей старше 60 лет и более чем у 50% людей старше 80 лет.
Веганы и вегетарианцы
Могут ли растительные белки сами по себе обеспечить достаточное количество качественного белка для поддержания здорового роста, восстановления и мышечной функции? Абсолютно.
Однако многие растительные белки обеспечивают менее чем оптимальный уровень всех незаменимых аминокислот. Для веганов или вегетарианцев просто становится более важным есть широкий выбор продуктов, включая фасоль, бобовые, орехи и семена. Как правило, разнообразная и калорийная вегетарианская диета обеспечивает много качественного белка.
Общая рекомендация
Исходя из совокупности имеющихся исследований, безопасный и полезный для здоровья диапазон белка, к которому следует стремиться, составляет примерно 15-25 процентов от общего количества диетических калорий с некоторыми поправками на уровень активности и возраст. При среднем потреблении 2000 калорий это составляет 75-125 граммов белка в день.
Источники пищи — выбор правильного белка
Белок, как и жиры и углеводы, является макроэлементом. Это означает, что вашему организму требуется относительно большое количество.Но, в отличие от жиров и углеводов, полезный белок не сохраняется в значительных количествах. Ваши запасы аминокислот постоянно используются, и их необходимо часто пополнять. Если вы не получаете достаточного количества белка с пищей, ваше тело будет получать его из вашей мышечной массы.
Не существует единственного лучшего источника белка. Хотя, безусловно, есть некоторые продукты, которые можно было бы считать лучшими источниками белка, разнообразная и смешанная диета обычно обеспечивает адекватное потребление белка. Кроме того, сосредоточение внимания на качественных цельных продуктах также поможет вам достичь адекватного потребления важных питательных веществ и белков.
Лучшими источниками протеина, исходя из содержания протеина и других питательных веществ, являются: морепродукты, нежирная птица, бобы, яйца, молочные продукты (йогурт, молоко и сыр), соя и другие бобовые, нежирная говядина и свинина. Квиноа, тыквенные семечки и фисташки также являются отличными источниками белка.
Что делать, если вам сложно удовлетворить потребность в белке или у вас нет времени на обед из дома? Качественный напиток или батончик, заменяющий еду, могут стать полезным дополнением к дневному потреблению белка.
Больше фактов о белках
- Если вы здоровы и хорошо гидратированы, высокое потребление белка не повредит здоровым почкам.
- Термины «полный» и «неполный» вводят в заблуждение по отношению к растительному белку. Получение разнообразного белка из растений обеспечивает достаточное количество всех незаменимых аминокислот, когда удовлетворяются потребности в калориях.
- Белок, как и углеводы, дает примерно четыре калории энергии на грамм. Жир обеспечивает девять калорий на грамм, а алкоголь — семь калорий на грамм.
- Белок сначала используется для роста и восстановления. Излишки можно использовать для получения энергии. Белок, не требующийся для этих функций, будет преобразован и сохранен в виде жира.
- Углеводы — не единственный стимул для секреции инсулина. Белок также может стимулировать секрецию инсулина, но в меньшей степени и без повышения уровня глюкозы в крови.
- Белок насыщает больше, чем жир или углеводы. Некоторые исследования показывают, что умеренное увеличение содержания белка и умеренное снижение гликемического индекса могут привести к улучшению соблюдения режима питания и поддержанию здорового веса.
Список литературы
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC4889822/
https://www.ncbi.nlm.nih.gov/books/NBK22600/
https://jissn.biomedcentral.com/articles/10.1186/s12970-017-0177-8
https://www.ncbi.nlm.nih.gov/books/NBK56068/table/summarytables.t4/?report=objectonly
https://www.ncbi.nlm.nih.gov/pubmed/16365098
http://www.theissnscoop.com/tag/bcaa/https://jissn.biomedcentral.com/articles/10.1186 / 1550-2783-7-7
http://journals.sagepub.com/doi/abs/10.1177/0115426506021005430
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC2760315/
https://www.ncbi.nlm.nih.gov/pmc/articles/PMC3359496/
Learn About Collagen with These Amazing Facts
Eating Bugs: The Next Block in the Food Pyramid?
In Kids’ Height, The Type of Milk Matters
Не можете найти то, что ищете? Попробуйте поискать еще раз или задайте вопрос здесь
Функция аминокислот
Подобно отдельным шарикам различной формы в цепи, аминокислоты соединяются вместе, образуя белки.Основная функция аминокислот — служить строительным материалом для белков. Белки обычно состоят из от 50 до 2000 аминокислот, соединенных встык во многих различных комбинациях.
Каждый белок имеет уникальные последовательности аминокислот в своей собственной скрученной и свернутой конфигурации. Функции белков обширны и многочисленны, потому что они практически необходимы для всех клеточных процессов нормального физиологического функционирования.
Существует 20 различных аминокислот, которые объединяются, чтобы создать впечатляющий набор химической универсальности белков.Аминокислоты могут быть незаменимыми, заменителями или условными. Они считаются незаменимыми, когда их нужно принимать с пищей, и несущественными, когда они могут быть получены организмом. Условные аминокислоты обычно требуются только при определенных обстоятельствах, таких как стресс или болезнь.
Способ или последовательность, в которой эти аминокислоты объединяются с образованием белка, определяет трехмерную структуру и функцию, уникальную для конкретного белка. Некоторые функции белков включают их роли в качестве антител, ферментов, мессенджеров, а также в транспортных / хранящих и структурных возможностях.
Антитела
Антитела — это белки, вырабатываемые иммунной системой. Они играют ключевую роль в обнаружении антигенов, которые представляют собой сложные белки, распознаваемые организмом как чужеродные и вредные. Вирусы, бактерии, грибки и паразиты, а также опасные химические вещества — все это примеры антигенов.
В некоторых неудачных случаях антитела могут также вырабатываться против здоровых тканей, когда организм ошибочно распознает их как чужеродные.Это явление известно как аутоиммунное заболевание. Антитела уникальны и обладают высокой степенью специфичности для защиты от каждого антигена, с которым сталкивается организм.
Ферменты
Белки, которые действуют как биологические катализаторы, называются ферментами. Они в первую очередь отвечают за катализ или ускорение химических реакций в организме, воздействуя на молекулы, называемые субстратами, для производства продуктов. Скорость реакции увеличивается за счет снижения энергии активации i.е. минимальное количество энергии, необходимое для инициирования реакции.
В отличие от большинства других катализаторов, ферменты представляют собой высокоспецифичные макромолекулы. Их активность может быть усилена молекулами, называемыми активаторами, и снижена молекулами, известными как ингибиторы. Более того, для правильного функционирования фермента требуются оптимальные условия по температуре и pH. Ферменты находятся в каждом органе и клетке нашего тела, в первую очередь в крови и желудочно-кишечном тракте.
Прочие функции
Белки могут демонстрировать ряд химических паттернов передачи сообщений в виде гормонов, нейротрансмиттеров и нейропептидов.Гормоны вырабатываются железами, где они впоследствии транспортируются кровеносной системой для регулирования поведения и физиологии отдаленных органов и систем.
Они считаются посланниками дальнего действия. В отличие от гормонов, нейротрансмиттеры — это мессенджеры ближнего действия, которые обеспечивают связь между нервной клеткой и другой целевой нервной, железистой или мышечной клеткой. Нейропептиды также являются посредниками на коротком расстоянии между нервными клетками, однако, в отличие от других нейронных посредников, нейропептиды не возвращаются обратно в клетку после секреции.
Белки составляют фундаментальную часть клеточной структуры и поддержки. Примеры структурных белков включают коллаген, кератин и эластин. Коллаген — основной компонент соединительной ткани и самый распространенный белок в нашем организме.
Альфа-кератин жизненно важен для формирования волос и ногтей, тогда как эластин — очень эластичный белок, который позволяет тканям восстанавливать свою форму после некоторой степени деформации (например, сокращения или растяжения). В большем масштабе белки, содержащиеся в мышцах, позволяют нашему телу двигаться.
В дополнение ко всем своим вышеупомянутым функциям белки способны связывать и переносить атомы, а также небольшие молекулы внутри клеток и по всему нашему телу. В этом качестве они функционируют как форма хранения и транспортировки. Гемоглобин с помощью железа является одним из примеров переносчика белка, используемого для переноса кислорода. Примером внутриклеточного запасного белка является ферритин, который необходим для хранения железа.
аминокислот | Спросите у биолога
Белковые части
Белки — это не то же самое, что строительные блоки Lego, но белки имеют особую форму, которую можно использовать для построения частей тела.Портрет Джонсона Ригейры Lego через Викимедиа. Щелкните изображение, чтобы увидеть его в полном размере.
Так же, как домик Lego сделан из кирпичей, белки состоят из множества крошечных строительных блоков. Эти строительные блоки называются аминокислотами.
Чтобы построить белок, сначала аминокислоты соединяются в длинные цепи. Эти цепочки аминокислотных строительных блоков затем могут складываться в любые формы. Некоторые цепочки складываются в спирали. Другие цепочки делают зигзагообразные листы и петли.
Объединение этих спиралей, листов и петель — вот как создается трехмерная форма белка.Вы также можете комбинировать несколько цепочек аминокислот, чтобы сделать белок еще большей формы.
21 — это все, что нужно
Человеческое тело использует всего 21 аминокислоту для производства всех белков, необходимых для функционирования и роста. Поскольку аминокислоты могут быть расположены во многих различных комбинациях, ваше тело может производить тысячи различных видов белков из одной и той же 21 аминокислоты. Вы можете увидеть книги, в которых говорится, что аминокислот всего 20. Не волнуйтесь, это только потому, что 21-й был обнаружен совсем недавно, а не все книги еще разошлись.
21 аминокислота. Нажмите на изображение, чтобы увидеть его в увеличенном виде.
Незаменимые аминокислоты
Есть девять аминокислот, которые ваше тело не может вырабатывать. Их называют незаменимыми аминокислотами, то есть они необходимы для жизни. Они содержатся в таких продуктах, как молоко, яйца и мясо, а также в самых разных растениях. Это одна из причин, почему вы не можете долго жить на диете, состоящей только из кукурузных чипсов. Незаменимые аминокислоты были фактически обнаружены в ходе эксперимента по тестированию чего-то очень похожего на «диету с кукурузными чипсами».
Ученые кормили крыс диетой, в которой содержался только кукурузный белок, и наблюдали за результатами. Они заметили, что крысы, соблюдающие эту диету, заболевают и в конечном итоге умирают. Однако когда больным крысам давали белок из молока, им становилось лучше. Это показало ученым, что что-то в молочном белке необходимо для здоровья крыс, что они не могут жить без него.
Откуда берутся аминокислоты?
К продуктам с высоким содержанием белка относятся мясо, рыба, яйца, орехи, шпинат, спаржа, бобы и брюссельская капуста.
Точно так же, как домик Lego, построенный из кубиков Lego, можно разобрать, а из кубиков построить что-то совершенно другое (например, действительно крутого тираннозавра), ваше тело может разобрать на части строительные блоки аминокислот, из которых состоит белок и повторно использовать их для создания новых, совершенно других белков. Даже ваше тело знает, что переработка — это действительно круто!
Но откуда берутся эти строительные блоки из аминокислот? Оказывается, ваши клетки могут производить большую часть необходимых им аминокислот из других молекул вашего тела.Однако девять из этих аминокислот он не может производить, поэтому вы должны получать их из пищи, которую вы едите. В противном случае это было бы похоже на то, что в наборе Lego не хватает девяти видов кирпичей, чтобы быть полным набором. Есть определенные вещи, которые невозможно построить без недостающих строительных блоков.
Границы | Параметры растворимости аминокислот при разделении жидкой фазы и агрегации белков
Введение
Фазовое разделение белков и характеристики аминокислот
Жидкостно-жидкое фазовое разделение (LLPS) белков — это явление, характеризующееся образованием конденсатов, состоящих из гомогенно диспергированных белков с составом, отличным от основного материала из-за воздействия или изменения окружающей среды (Uversky, 2017; Boeynaems et al. al., 2018). Предыдущие исследования сообщали, что различные биологические реакции происходят через фазовое разделение белков (Yoshizawa et al., 2020). Например, капельки, образованные LLPS, участвуют в стрессовой реакции и регуляции транскрипции и трансляции (Hnisz et al., 2017; Riback et al., 2017; Nosella and Forman-Kay, 2021). Кроме того, известно, что амилоиды, образующиеся в результате разделения жидкой и твердой фаз, участвуют в различных заболеваниях (Elbaum-Garfinkle, 2019; Wang and Zhang, 2019). Фазовое разделение белков также ценно для промышленных применений, таких как концентрация и стабилизация антител и ферментов для использования в качестве лекарств (Куриномару и др., 2014; Izaki et al., 2015; Маруяма и др., 2015; Мимура и др., 2019). Кроме того, фазовое разделение белков из диспергированного и редиспергированного состояний можно до некоторой степени контролировать с помощью небольших молекулярных добавок (Kurinomaru and Shiraki, 2017; Shiraki et al., 2020).
Недавно была создана база данных для организации взаимосвязей LLPS с биологическими реакциями (Li et al., 2020; Mészáros et al., 2020; Ning et al., 2020). Белки, склонные к LLPS, характеризуются внутренне неупорядоченными регионами (IDR) (Uversky, 2017; Kuechler et al., 2020). Склонность белков к образованию капель и агрегатов, определяемая в этой статье как «склонность к разделению фаз (PPS)», в некоторой степени можно предсказать по длине и типам аминокислот в IDR (Liu et al. , 2019; Schuster et al., 2020). В частности, заряженные или гидрофильные аминокислоты с последовательностями низкой сложности участвуют в LLPS белков (Chong et al., 2018; Das et al., 2020; Kuechler et al., 2020). Следовательно, понимание PPS на аминокислотном уровне важно для выяснения молекулярных механизмов, лежащих в основе биологических реакций белков.
Аминокислотный индекс
Различные свойства аминокислот были исследованы, чтобы выявить природу сворачивания и агрегации белков (Таблица 1). Растворимость аминокислоты (SA) — это простейший показатель сродства между аминокислотой и растворителем (Fleck, Petrosyan, 2014). Исследование, проведенное в 1930-х годах Далтоном и МакМикином по СК в воде, вероятно, первым предложило индексацию свойств аминокислот (Amend and Helgeson, 1997). После этого были утверждены концепции гидрофобности, хаотропности и космотропности (Relating et al., 1964; Бигелоу, 1967; Коллинз, 1995, 1997). В 1970-х годах Нозаки и Танфорд (1971) измерили СК в растворе денатурирующих белков, что является одним из первых исследований стабильности белка в растворителях. В экспериментах по растворимости, проведенных Фошером, измеряли перенос свободной энергии каждой аминокислоты между октанолом и водой и индексировали гидрофобность боковой цепи каждой аминокислоты путем вычитания переносимой свободной энергии Gly из таковой каждой аминокислоты ( Fauchere et al., 1988). Поскольку сродство аминокислоты к растворителю зависит от того, находится ли аминокислота внутри или на поверхности белка, Миллер проиндексировал склонность к внутреннему или внешнему присутствию аминокислоты с использованием кристаллических структур белков. (Миллер и др., 1987). После выяснения структуры белков Чоу и Фасман проиндексировали способность каждой аминокислоты образовывать вторичные структуры, исследуя аминокислоты, содержащиеся во вторичных структурах белков (Chou and Fasman, 1974).Согласно Кайту и Дулитлу (1982), гидропатия — самый важный показатель аминокислот. Гидропатия, о которой за последние 30 лет упоминалось более 20 000 раз, представляет собой практический показатель, рассчитываемый на основе SA и положения аминокислоты в структуре белка. Недавно Хирано и Камеда (2021) определили ароматичность как новый индекс для оценки сродства связывания аминокислот с ароматическими кольцами углеродных материалов. Этот индекс применим для оценки сродства аминокислоты к определенному веществу.
Таблица 1. Различные параметры аминокислот в предыдущих исследованиях.
Индексы для понимания PPS
Аминокислотные индексы, перечисленные в таблице 1, предоставляют основную информацию для прогнозирования сворачивания и растворимости белков (Bigelow, 1967; Dubchak et al., 1995; Bhandari et al., 2020). Кроме того, степень IDR, предсказанная на основе аминокислотной последовательности белка, также является важным параметром для оценки PPS (Obradovic et al., 2003; Dosztányi et al., 2005; Xue et al., 2010). Однако сложно предсказать PPS с комбинациями этих параметров, потому что наиболее важная особенность фазового разделения белков вызвана многовалентными и динамическими взаимодействиями между боковыми цепями аминокислот в водном растворе (Boeynaems et al., 2018; Murthy et al., 2019; Sahli et al., 2019). Чтобы получить более глубокое понимание PPS, в этой статье предлагается новый индекс аминокислот, который отражает взаимодействия между аминокислотами из экспериментов по растворимости.Например, известно, что, когда Arg присутствует в растворителе, растворимость молекул растворенного вещества с ароматическими кольцами увеличивается из-за взаимодействия π катиона между Arg в растворителе и ароматическими молекулами растворенного вещества (Arakawa et al., 2008 ; Hirano et al., 2010a, b; Ariki et al., 2011). Другими словами, это SA как растворенное вещество в растворителе, содержащем Arg. Таким образом, SA в аминокислотном растворителе является показателем для прогнозирования PPS, поскольку взаимодействия между аминокислотами влияют на растворимость.
Подразделы, относящиеся к теме
Материалы и методы
Все аминокислоты, NaH 2 PO 4 и Na 2 HPO 4 были получены от Wako Pure Chemical Industries Ltd. (Осака, Япония). Все химические вещества были реактивными и использовались в том виде, в котором они были получены. Для измерения растворимости использовали следующую процедуру. Для исследования взаимодействия между двумя аминокислотами ароматические аминокислоты (AAA) были приготовлены в порошкообразной форме и соответственно растворены в 50 мМ Na-фосфатном буфере (pH 7.0), содержащий 20 различных аминокислот в качестве «аминокислотных растворителей». Здесь максимальная концентрация растворителей каждой аминокислоты сильно варьировалась, поскольку растворимость каждой аминокислоты в водном растворе варьировалась. Суспензию нагревали при 50 ° C в течение 1 часа с частым встряхиванием для полного растворения порошкообразных AAA, а затем инкубировали при 25 ° C в течение 14 часов с частым встряхиванием. Затем суспензию центрифугировали при 25 ° C и 18,800 × г в течение 20 мин для получения супернатанта, насыщенного AAA.После соответствующего разбавления супернатанта 50 мМ Na-фосфатным буфером (pH 7,0) концентрации AAA определяли путем измерения оптической плотности при 260-280 нм вместе с соответствующим холостым сигналом с использованием спектрофотометра ND-1000 (NanoDrop Technologies, Wilmington. , DE, США). Затем растворимость вычисляли по стандартным кривым, определенным для каждого AAA. Преимущество этого метода заключается в том, что он позволяет точно определять концентрации аминокислот в смесях (Nishinami et al., 2018; Хирано и др., 2020).
Растворимость аминокислоты в 20 видах аминокислотных растворителей
Растворимость AAA в 20 видах аминокислотных растворителей показана на дополнительном рисунке 1A. На основе этих результатов параметры SA в аминокислотных растворителях (PSAS) были рассчитаны по простому уравнению (1):
PSAS = ΔsΔc… (1)
, где Δ s — это изменение степени растворимости AAA в аминокислотных растворителях, когда растворимость в воде равна 1, а Δ c — это изменение концентрации аминокислотного растворителя.Вкратце, уравнение (1) показывает наклон аппроксимирующей линии на дополнительном рисунке 1A. Таким образом, PSAS указывает степень, в которой аминокислота в концентрации 1 M, присутствующая в растворителе, солюбилизирует или переводит в нерастворимую форму AAA. Некоторые аминокислоты изменяли растворимость AAA при низких или высоких концентрациях. Поскольку концентрация, при которой изменяется эффект растворимости, варьируется в зависимости от аминокислот, мы установили PSAS, который не учитывал диапазон концентраций аминокислотных растворителей.Список PSAS представлен на рисунке 1A, где солюбилизированные AAA представлены как положительные значения (красный), а нерастворимые AAA — как отрицательные значения (зеленый). Растворители Arg, Pro и AAA имели положительные значения PSAS, что указывает на то, что взаимодействия между AAA и этими аминокислотами благоприятны для растворимых AAA. Однако растворители анионных аминокислот имели отрицательные значения PSAS, что указывает на то, что взаимодействия между AAA и отрицательно заряженными аминокислотами неблагоприятны для растворимых AAA. Неожиданно оказалось, что растворители Gln, Asn и гидрофобная аминокислота переводят AAA в нерастворимую форму, что указывает на то, что взаимодействия между AAA и этими аминокислотами являются благоприятными, но не способствуют солюбилизации AAA.Когда значение PSAS было близко к нулю, ни растворимые, ни нерастворимые эффекты не действовали, предполагая, что взаимодействия между аминокислотами были такими же слабыми, как взаимодействия с водой.
Рисунок 1. Параметр растворимости AAA в аминокислотных растворителях (PSAS). (A) PSAS AAA в 20 видах аминокислотных растворителей. PSAS был рассчитан по уравнению (1). PSAS отображается как положительное значение, когда растворимость AAA увеличивается, и как отрицательное значение, когда она уменьшается. (B) Связь PSAS с различными индексами, характеризующими аминокислоты. PSAS Trp сравнивается с растворимостью в воде, гидрофобностью боковых цепей и ароматичностью 20 видов аминокислот.
Сравнение PSAS с существующими индексами аминокислот
Чтобы прояснить взаимосвязь между PSAS, предложенным в этом исследовании, и аминокислотными индексами, предложенными в предыдущих исследованиях, PSAS был определен как баланс взаимодействий между аминокислотами и между аминокислотами и водой, как определено экспериментами по растворимости. .Поэтому PSAS сравнивали с некоторыми из показателей, перечисленных в таблице 1, которые отражают сродство к воде и взаимодействия между аминокислотами и ароматическими кольцами (растворимость в воде, гидрофобность боковой цепи и ароматичность). Когда PSAS сравнивали с этими индексами по строкам, порядок PSAS Trp не соответствовал растворимости в воде и гидрофобности боковой цепи, но частично соответствовал ароматичности (Рисунок 1B). PSAS Тира и Фе показал аналогичную склонность.Этот результат предполагает, что PSAS отражает аффинность связывания боковых цепей с ароматическими кольцами, а не взаимодействие между аминокислотами и водой. Однако, поскольку порядок PSAS не полностью соответствовал ароматичности, PSAS нельзя было объяснить простым сродством между боковыми цепями и ароматическими кольцами. Затем PSAS сравнивали с этими индексами по столбцам, что показало, что величина PSAS растворимых растворителей (Trp, Arg, His и Pro) была в порядке Trp> Tyr> Phe, что согласуется с величиной ароматичность (рисунок 1А и таблица 1).С другой стороны, величина PSAS нерастворимых растворителей (Gln, Asn, Glu, Asp, Val и Ile) была порядка Phe> Trp> Tyr или Trp> Phe> Tyr, что согласуется с величина растворимости в воде или гидрофобности боковой цепи (рис. 1А и таблица 1). Эти результаты предполагают, что растворимые взаимодействия отражают сродство между аминокислотами и ароматическими кольцами, в то время как нерастворимые взаимодействия отражают сродство аминокислот и воды. Следовательно, PSAS в основном отражает взаимодействия между аминокислотами как растворимое свойство и взаимодействие аминокислот и воды как нерастворимое свойство.
Свойства Gln, Asn и Pro
Gln, Asn и Pro в изобилии присутствуют в областях белков низкой сложности, которые подвергаются фазовому разделению (Budini et al., 2012; Riback et al., 2017), хотя функции этих аминокислот неясны. Gln и Asn переводят AAA в нерастворимую форму, в то время как Pro солюбилизирует AAA (рис. 1A). Согласно PSAS, Gln и Asn могут вызывать разделение фаз, взаимодействуя с AAA. Моделирование молекулярной динамики может помочь выявить взаимодействия между аминокислотами, которым до сих пор не уделялось особого внимания, путем исследования других PSAS, кроме AAA.
С другой стороны, трудно понять PSAS Pro, потому что растворитель Pro в этой экспериментальной системе может изменять свойства раствора, такие как вязкость и полярность, из-за чрезвычайно высокой растворимости Pro (Wu et al. , 2001; Zhao, 2006; Ferreira et al., 2019). Следовательно, PSAS Pro не может быть просто сопоставим с PSAS других аминокислот. Когда мы исследуем растворимость 20 растворенных аминокислот в 20 типах аминокислотных растворителей, стоит изучить разницу между изменением растворимости из-за взаимодействия между аминокислотами и изменением из-за действия растворителя.
Обсуждение
Фазовое разделение белков на основе PSAS
Новый индекс PSAS подразделяет аминокислоты на растворимые и нерастворимые взаимодействия (рис. 1А). Растворимое взаимодействие, представленное PSAS (красная область на рисунке 1A), указывает на то, что аминокислота хорошо растворима в аминокислотном растворителе. На микроскопическом уровне наблюдается привлекательное взаимодействие растворенной аминокислоты с аминокислотой-растворителем, что означает, что во взаимодействии участвуют молекулы воды.Другими словами, растворимое взаимодействие PSAS считается аналогичным межмолекулярным взаимодействиям внутри капли, образованной LLPS. Фактически, взаимодействия катион-π и π –π, которые, как известно, являются движущими силами для образования капель (например, Ddx4 и hnRNPA2) (Nott et al., 2015; Vernon et al., 2018; Dignon et al. ., 2020), представлены PSAS как растворимые взаимодействия. С другой стороны, нерастворимое взаимодействие, представленное PSAS (зеленая область на рисунке 1A), указывает на то, что растворенная аминокислота нерастворима в аминокислотном растворителе.Существует два возможных механизма, лежащих в основе нерастворимого эффекта, выраженного PSAS: (i) отталкивающие взаимодействия между растворенными аминокислотами и растворителями приводят к осаждению растворенных аминокислот, поскольку растворенные аминокислоты и аминокислоты-растворители имеют отрицательный заряд при pH 7,0 (например, , Glu и Asp) и (ii) молекулы воды не участвуют в привлекательном взаимодействии между аминокислотами растворенного вещества и растворителя, что приводит к соосаждению двух аминокислот (например, Gln, Asn и гидрофобных аминокислот).В частности, нерастворимое взаимодействие, представленное (ii), такое же, как межмолекулярное взаимодействие агрегатов, образованных разделением жидкой и твердой фаз (например, овальбумин, лизоцим и α-синуклеин) (Iwashita et al., 2018; Stephens and Kaminski) Ширле, 2019). Фактически, гидрофобные взаимодействия, которые, как известно, являются движущей силой образования агрегатов, были представлены PSAS как нерастворимые взаимодействия. Следовательно, растворимое взаимодействие, выраженное с помощью PSAS, может представлять способность образования капель, а нерастворимое взаимодействие может представлять способность образования агрегатов.
PPS белка необходимо учитывать при взаимодействии многих видов аминокислот. Однако PSAS представляет собой только взаимодействие между двумя типами аминокислот. Фактически, сообщалось, что гидрофобные взаимодействия, которые считаются движущей силой агрегации, стабилизируют капли, а также электростатические взаимодействия и взаимодействия π — π , которые считаются движущими силами образования капель, стабилизируют агрегаты (например, , тау и IgG) (Ma et al., 2010; Мацуда и др., 2018; Крайнер и др., 2021 г .; Lin et al., 2021). Следовательно, будет трудно полностью различить агрегаты и капли, сосредоточившись только на основных взаимодействиях. При различении способностей образования капель и агрегатов на основе PSAS свойства агрегатов следует рассматривать только на основе взаимодействия между двумя типами аминокислот.
Наконец, для будущих приложений, PSAS на уровне аминокислот не полностью соответствовал таковому на уровне белка.Чтобы более четко проиллюстрировать этот вывод, PSAS Trp был относительно большим, но редко присутствует в IDR белков, склонных к LLPS (Wang et al., 2014; Martin and Mittag, 2018; Martin et al., 2020). , в то время как Gly и Ser имели значения PSAS, близкие к нулю, но, как известно, их много в IDR белков, склонных к LLPS (Schuster et al., 2018; Hardenberg et al., 2021). Считается, что эти конфликты связаны с различиями в свойствах свободных аминокислот как растворенных веществ и аминокислот во время образования пептидов.Эти различия указывают на важность разделения белков жидкость-жидкость или жидкость-твердая фаза. Кроме того, было разработано несколько методов прогнозирования PPS белков (Vernon, Forman-Kay, 2019; Hardenberg et al., 2021; van Mierlo et al., 2021). Эти методы прогнозирования позволяют идентифицировать белки с высоким содержанием PPS из протеома, такие как распределение аминокислотных остатков и сложность последовательности. Ожидается, что PSAS станет важным параметром для методов прогнозирования, как правило, машинного обучения, из-за экспериментального взаимодействия между растворенными веществами и аминокислотами растворителя, включая воду.
Заявление о доступности данных
Оригинальные материалы, представленные в исследовании, включены в статью / дополнительные материалы, дальнейшие запросы можно направить соответствующему автору.
Авторские взносы
AN провел все эксперименты и написал рукопись. С.Н. руководил экспериментами. К.С. отредактировал и отредактировал рукопись. Все авторы читали и одобрили окончательный вариант рукописи.
Финансирование
Эта работа частично поддержана JSPS KAKENHI (номера грантов 18H02383 и 19K22377).
Конфликт интересов
Авторы заявляют, что исследование проводилось при отсутствии каких-либо коммерческих или финансовых отношений, которые могут быть истолкованы как потенциальный конфликт интересов.
Дополнительные материалы
Дополнительные материалы к этой статье можно найти в Интернете по адресу: https://www.frontiersin.org/articles/10.3389/fcell.2021.6
/full#supplementary-material
Список литературы
Amend, J. P., and Helgeson, H.С. (1997). Растворимость обычных L-α-аминокислот в зависимости от температуры и pH раствора. Pure Appl. Chem. 69, 935–942. DOI: 10.1351 / pac19976
35 CrossRef Полный текст | Google Scholar
Аракава Т., Кита Ю. и Кояма А. Х. (2008). Повышение растворимости глютена и органических соединений аргинином. Внутр. J. Pharm. 355, 220–223. DOI: 10.1016 / j.ijpharm.2007.12.009
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Арики, Р., Хирано, А., Аракава, Т., и Сираки, К. (2011). Аргинин увеличивает растворимость алкилгаллатов за счет взаимодействия с ароматическим кольцом. J. Biochem. 149, 389–394. DOI: 10.1093 / jb / mvr004
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Бхандари, Б. К., Гарднер, П. П., и Лим, К. С. (2020). Индекс, взвешенный по растворимости: быстрое и точное предсказание растворимости белка. Биоинформатика 36, 4691–4698. DOI: 10.1093 / биоинформатика / btaa578
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Бигелоу, К.С. (1967). О средней гидрофобности белков и связи между ней и структурой белка. J. Theor. Биол. 16, 187–211. DOI: 10.1016 / 0022-5193 (67)
-5
CrossRef Полный текст | Google Scholar
Бойнаемс, С., Альберти, С., Фаузи, Н. Л., Миттаг, Т., Полимениду, М., Руссо, Ф. и др. (2018). Фазовое разделение белков: новый этап в клеточной биологии. Trends Cell Biol. 28, 420–435. DOI: 10.1016 / j.tcb.2018.02.004
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Будини, М., Buratti, E., Stuani, C., Guarnaccia, C., Romano, V., De Conti, L., et al. (2012). Клеточная модель агрегации ДНК-связывающего белка TAR 43 (TDP-43) на основе его C-концевой области, богатой Gln / Asn. J. Biol. Chem. 287, 7512–7525. DOI: 10.1074 / jbc.M111.288720
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Чжоу П. Ю. и Фасман Г. Д. (1974). Параметры конформации аминокислот в спиральных, β-листовых и случайных областях клубков рассчитаны на основе белков. Биохимия 13, 211–222. DOI: 10.1021 / bi00699a001
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Коллинз, К. Д. (1997). Прочность гидратации и биологической структуры, зависящая от плотности заряда. Biophys. J. 72, 65–76. DOI: 10.1016 / S0006-3495 (97) 78647-8
CrossRef Полный текст | Google Scholar
Дас, С., Лин, Ю. Х., Вернон, Р. М., Форман-Кей, Дж. Д., и Чан, Х. С. (2020). Сравнительная роль заряда, π и гидрофобных взаимодействий в зависимом от последовательности фазовом разделении внутренне неупорядоченных белков. Proc. Natl. Акад. Sci. США 117, 28795–28805. DOI: 10.1073 / pnas.2008122117
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Диньон Г. Л., Бест Р. Б. и Миттал Дж. (2020). Биомолекулярное фазовое разделение: от движущих сил молекул до макроскопических свойств. Annu. Rev. Phys. Chem. 71, 53–75. DOI: 10.1146 / annurev-Physchem-071819-113553
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Dosztányi, Z., Csizmok, V., Tompa, P., and Simon, I. (2005). IUPred: веб-сервер для прогнозирования изначально неструктурированных областей белков на основе расчетного содержания энергии. Биоинформатика 21, 3433–3434. DOI: 10.1093 / биоинформатика / bti541
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Дубчак И., Мучник И., Холбрук С. Р., Ким С. Х. (1995). Прогнозирование класса сворачивания белка с использованием глобального описания аминокислотной последовательности. Proc. Natl.Акад. Sci. США 92, 8700–8704. DOI: 10.1073 / pnas.92.19.8700
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Fauchere, J. -L., Charton, M., Kier, L.B., Verloop, A., and Pliska, V. (1988). Параметры боковой цепи аминокислот для корреляционных исследований в биологии и фармакологии. Внутр. J. Pept. Protein Res 32, 269–278. DOI: 10.1111 / j.1399-3011.1988.tb01261.x
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Феррейра, Л.А., Уверский В. Н., Заславский Б. Ю. (2019). Влияние аминокислот на растворяющие свойства воды. J. Mol. Liq. 277, 123–131. DOI: 10.1016 / j.molliq.2018.12.071
CrossRef Полный текст | Google Scholar
Флек М., Петросян А. М. (2014). Соли аминокислот: кристаллизация, структура и свойства. Чам: Springer, DOI: 10.1007 / 978-3-319-06299-0
CrossRef Полный текст | Google Scholar
Харденберг, М., Хорват, А., Амбрус, В., Фуксрайтер, М., и Вендрусколо, М. (2021). Широкое распространение капельного состояния белков в протеоме человека. Proc. Natl. Акад. Sci. США 117, 33254–33262. DOI: 10.1073 / PNAS.2007670117
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Хирано А. и Камеда Т. (2021 г.). Индекс ароматичности аминокислот: моделирование молекулярной динамики аффинности связывания белков с углеродными наноматериалами. ACS Appl. Nano Mater. 4, 2486–2495.DOI: 10.1021 / acsanm.0c03047
CrossRef Полный текст | Google Scholar
Хирано А., Камеда Т., Аракава Т. и Сираки К. (2010a). Система солюбилизации с использованием аргинина для лекарственных веществ: эксперимент по растворимости и моделирование. J. Phys. Chem. B 114, 13455–13462. DOI: 10.1021 / jp101909a
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Хирано А., Нагатоиси С., Вада М., Цумото К., Малуф К. Н. и Аракава Т. (2020). Технические возможности и ограничения оптической спектроскопии и калориметрии с использованием смешивающихся с водой растворителей: на примере диметилсульфоксида, ацетонитрила и 1,4-диоксана. J. Pharm. Sci. 109, 524–531. DOI: 10.1016 / j.xphs.2019.10.056
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Хирано, А., Токунага, Х., Токунага, М., Аракава, Т., и Сираки, К. (2010b). Растворимость азотистых оснований в водных растворах аргинина. Arch. Biochem. Биофиз. 497, 90–96. DOI: 10.1016 / j.abb.2010.03.009
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Хниш, Д., Шринивас, К., Янг, Р. А., Чакраборти, А.К., Шарп, П.А. (2017). Модель разделения фаз для контроля транскрипции. Ячейка 169, 13–23. DOI: 10.1016 / j.cell.2017.02.007
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Ивашита К., Ханда А. и Шираки К. (2018). Коацерваты и коагрегаты: фазовые переходы жидкость – жидкость и жидкость – твердое тело нативными и развернутыми белковыми комплексами. Внутр. J. Biol. Макромол. 120, 10–18. DOI: 10.1016 / j.ijbiomac.2018.08.063
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Идзаки, С., Куриномару, Т., Ханда, К., Кимото, Т., и Шираки, К. (2015). Стрессоустойчивость комплексов антитело-поли (аминокислота) для повышения стабильности препаратов антител с высокой концентрацией. J. Pharm. Sci. 104, 2457–2463. DOI: 10.1002 / jps.24515
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Крайнер, Г., Уэлш, Т. Дж., Джозеф, Дж. А., Сент-Джордж-Хислоп, П., Хайман, А. А., Коллепардо-Гевара, Р. и др. (2021 г.). Входящая жидкая конденсатная фаза белков стабилизируется гидрофобными и неионными взаимодействиями. Biophys. J. 120, 28а. DOI: 10.1016 / j.bpj.2020.11.426
CrossRef Полный текст | Google Scholar
Кюхлер, Э. Р., Будзиньска, П. М., Бернардини, Дж. П., Гспонер, Дж. И Майор, Т. (2020). Отличительные особенности белков стрессовых гранул предсказывают локализацию в безмембранных органеллах. J. Mol. Биол. 432, 2349–2368. DOI: 10.1016 / j.jmb.2020.02.020
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Куриномару Т., Маруяма Т., Идзаки, С., Ханда, К., Кимото, Т., и Шираки, К. (2014). Осаждение комплекса белок-поли (аминокислота) для получения высококонцентрированного белкового препарата. J. Pharm. Sci. 103, 2248–2254. DOI: 10.1002 / jps.24025
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Куриномару, Т., и Шираки, К. (2017). Агрегативный белок-полиэлектролитный комплекс для высококонцентрированных препаратов белковых препаратов. Внутр. J. Biol. Макромол. 100, 11–17. DOI: 10.1016 / j.ijbiomac.2016.06.016
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Кайт Дж. И Дулиттл Р. Ф. (1982). Простой способ показать водный характер протеина. J. Mol. Биол. 157, 105–132. DOI: 10.1016 / 0022-2836 (82)
-0 CrossRef Полный текст | Google Scholar
Li, Q., Peng, X., Li, Y., Tang, W., Zhu, J., Huang, J., et al. (2020). LLPSDB: база данных белков, подвергающихся разделению фаз жидкость-жидкость in vitro. Nucleic Acids Res. 48, D320 – D327. DOI: 10.1093 / nar / gkz778
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Линь Ю., Фишоу Ю., Лонхини А. П., Лланес, Л. К., Инь, П., Базан, Г. С. и др. (2021 г.). Разделение жидкой и жидкой фаз тау-белка за счет гидрофобного взаимодействия способствует фибриллизации тау-белка. J. Mol. Биол. 433: 166731. DOI: 10.1016 / j.jmb.2020.166731
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Лю, Ю., Ван, X., и Лю, Б. (2019). Всесторонний обзор и сравнение существующих вычислительных методов для предсказания внутренне неупорядоченных белков и областей. Краткое. Биоинформ. 20, 1–17. DOI: 10.1093 / bib / bbx126
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Ма, М., Куанг, Ю., Гао, Ю., Чжан, Ю., Гао, П., и Сюй, Б. (2010). Ароматико-ароматические взаимодействия вызывают самосборку пентапептидных производных в воде с образованием нановолокон и супрамолекулярных гидрогелей. J. Am. Chem. Soc. 132, 2719–2728. DOI: 10.1021 / ja
64PubMed Аннотация | CrossRef Полный текст | Google Scholar
Martin, E. W., Holehouse, A. S., Peran, I., Farag, M., Incicco, J. J., Bremer, A., et al. (2020). Валентность и структура ароматических остатков определяют фазовое поведение прионоподобных доменов. Наука 367, 694–699. DOI: 10.1126 / science.aaw8653
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Мартин, Э.W., and Mittag, T. (2018). Взаимосвязь последовательности и фазового разделения в белковых областях низкой сложности. Биохимия 57, 2478–2487. DOI: 10.1021 / acs.biochem.8b00008
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Маруяма Т., Идзаки С., Куриномару Т., Ханда К., Кимото Т. и Шираки К. (2015). Преципитация протеин-поли (аминокислота) стабилизирует терапевтическую протеин-L-аспарагиназу против физико-химического стресса. J. Biosci. Bioeng. 120, 720–724.DOI: 10.1016 / j.jbiosc.2015.04.010
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Мацуда А., Мимура М., Маруяма Т., Куриномару Т., Шиухей М. и Шираки К. (2018). Жидкая капля протеин-полиэлектролитного комплекса для высококонцентрированных составов. J. Pharm. Sci. 107, 2713–2719. DOI: 10.1016 / j.xphs.2018.06.021
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Месарош, Б., Эрдош, Г., Сабо, Б., Шад, Э, Тантос, А., Абухайран, Р., и другие. (2020). PhaSePro: база данных белков, управляющих фазовым разделением жидкость-жидкость. Nucleic Acids Res. 48, D360 – D367. DOI: 10.1093 / nar / gkz848
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Миллер С., Джанин Дж., Леск А. М. и Чотиа К. (1987). Внутренняя и поверхность мономерных белков. J. Mol. Биол. 196, 641–656. DOI: 10.1016 / 0022-2836 (87)-6
CrossRef Полный текст | Google Scholar
Мимура, М., Цумура, К., Мацуда, А., Акацука, Н., и Шираки, К. (2019). Влияние добавок на жидкую каплю протеин-полиэлектролитного комплекса для высококонцентрированных составов. J. Chem. Phys. 150, 1–11. DOI: 10.1063 / 1.5063378
CrossRef Полный текст | Google Scholar
Murthy, A.C., Dignon, G.L., Kan, Y., Zerze, G.H., Parekh, S.H., Mittal, J., et al. (2019). Молекулярные взаимодействия, лежащие в основе разделения фаз жидкость-жидкость в области низкой сложности FUS. Nat.Struct. Мол. Биол. 26, 637–648. DOI: 10.1038 / s41594-019-0250-x
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Нин, В., Го, Ю., Лин, С., Мэй, Б., Ву, Ю., Цзян, П., и др. (2020). DrLLPS: информационный ресурс о разделении жидких фаз у эукариот. Nucleic Acids Res. 48, D288 – D295. DOI: 10.1093 / nar / gkz1027
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Нисинами С., Йошизава С., Аракава Т. и Сираки К.(2018). Аллантоин и гидантоин как новые супрессоры агрегации белков. Внутр. J. Biol. Макромол. 114, 497–503. DOI: 10.1016 / j.ijbiomac.2018.03.011
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Нозелла, М. Л., и Форман-Кей, Дж. Д. (2021 г.). Зависимая от фосфорилирования регуляция транскрипции, процессинга и трансляции информационной РНК в биомолекулярных конденсатах. Curr. Opin. Cell Biol. 69, 30–40. DOI: 10.1016 / j.ceb.2020.12.007
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Нотт, Т.J., Petsalaki, E., Farber, P., Jervis, D., Fussner, E., Plochowietz, A., et al. (2015). Фазовый переход неупорядоченного белка nuage генерирует экологически чувствительные безмембранные органеллы. Mol. Cell 57, 936–947. DOI: 10.1016 / j.molcel.2015.01.013
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Нодзаки Ю. и Танфорд К. (1971). Растворимость аминокислот и двух пептидов глицина в водных растворах этанола и диоксана. Установление шкалы гидрофобности. J. Biol. Chem. 246, 2211–2217. DOI: 10.1016 / S0021-9258 (19) 77210-X
CrossRef Полный текст | Google Scholar
Обрадович, З., Пенг, К., Вучетич, С., Радивояц, П., Браун, К. Дж., И Дункер, А. К. (2003). Прогнозирование внутреннего нарушения по аминокислотной последовательности. Proteins Struct. Funct. Genet. 53, 566–572. DOI: 10.1002 / prot.10532
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Relating, A. L. L. A. W., Protein, O. F., К, М., и Композиция, Т. (1964). Ограничивающий закон, связывающий размер и форму белковых молекул с их составом. Биохимия 51, 1285–1291.
Google Scholar
Рибак, Дж. А., Катански, К. Д., Кир-Скотт, Дж. Л., Пилипенко, Е. В., Ройек, А. Е., Сосник, Т. Р. и др. (2017). Фазовое разделение, вызванное стрессом, — это адаптивная, эволюционно настроенная реакция. Ячейка 168, 1028–1040. DOI: 10.1016 / j.cell.2017.02.027
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Сахли, Л., Ренар, Д., Соле-Жамо, В., Джулиани, А., и Буар, А. (2019). Роль конформации белка и слабого взаимодействия в разделении жидких фаз γ-глиадина. Sci. Rep. 9, 1–13. DOI: 10.1038 / s41598-019-49745-2
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Шустер, Б.С., Диньон, Г.Л., Танг, В.С., Келли, Ф.М., Ранганат, А.К., Янке, К.Н., и др. (2020). Выявление нарушений последовательности изначально неупорядоченного белка, которые определяют его поведение разделения фаз. Proc. Natl. Акад. Sci. США 117, 1–11. DOI: 10.1073 / pnas.2000223117
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Шустер, Б. С., Рид, Э. Х., Партхасарати, Р., Янке, К. Н., Колдуэлл, Р. М., Бермудес, Дж. Г. и др. (2018). Контролируемое разделение белковой фазы и модульное рекрутирование для формирования чувствительных безмембранных органелл. Nat. Commun. 9, 2985. DOI: 10.1038 / s41467-018-05403-1
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Шираки, К., Мимура, М., Нишинами, С., и Ура, Т. (2020). Влияние добавок на жидкие капли и агрегаты белков. Biophys. Rev. 12, 587–592. DOI: 10.1007 / s12551-020-00682-9
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Уверский В. Н. (2017). Внутренне неупорядоченные белки в перенаселенной среде: безмембранные органеллы, разделение фаз и внутреннее нарушение. Curr. Opin. Struct. Биол. 44, 18–30. DOI: 10.1016 / j.sbi.2016.10.015
PubMed Аннотация | CrossRef Полный текст | Google Scholar
ван Мирло, Г., Янсен, Дж. Р. Г., Ван, Дж., Позер, И., ван Херинген, С. Дж., И Вермёлен, М. (2021). Прогнозирование образования белкового конденсата с помощью машинного обучения. Cell Rep. 34: 108705. DOI: 10.1016 / j.celrep.2021.108705
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Вернон, Р. М., и Форман-Кей, Дж. Д. (2019). Предикторы биологического фазового разделения белков первого поколения. Curr. Opin. Struct. Биол. 58, 88–96. DOI: 10.1016 / j.sbi.2019.05.016
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Вернон Р.М. К., Чонг, П. А., Цанг, Б., Ким, Т. Х., Бах, А., Фарбер, П. и др. (2018). Контакты Pi-Pi — это игнорируемая функция белка, имеющая отношение к разделению фаз. Elife 7, 1–48. DOI: 10.7554 / eLife.31486
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Wang, J. T., Smith, J., Chen, B.C., Schmidt, H., Rasoloson, D., Paix, A., et al. (2014). Регуляция динамики гранул РНК фосфорилированием богатых серином, внутренне неупорядоченных белков у C.Elegans . Elife 3, 1–23. DOI: 10.7554 / eLife.04591
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Ван З. и Чжан Х. (2019). Фазовое разделение, переход и аутофагическая деградация белков в развитии и патогенезе. Trends Cell Biol. 29, 417–427. DOI: 10.1016 / j.tcb.2019.01.008
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Ву, Ю., Ма, П., Лю, Ю., и Ли, С. (2001). Коэффициенты диффузии L-пролина, L-треонина и L-аргинина в водных растворах при 25 ° C. Равновесие жидкой фазы. 186, 27–38. DOI: 10.1016 / S0378-3812 (01) 00355-7
CrossRef Полный текст | Google Scholar
Сюэ Б., Данбрак Р. Л., Уильямс Р. В., Дункер А. К. и Уверский В. Н. (2010). PONDR-FIT: мета-предсказатель изначально неупорядоченных аминокислот. Biochim. Биофиз. Acta Proteins Proteomics 1804, 996–1010. DOI: 10.1016 / j.bbapap.2010.01.011
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Ёсизава, Т., Нозава, Р. С., Цзя, Т. З., Сайо, Т., и Мори, Э. (2020). Биологическое разделение фаз: клеточная биология встречается с биофизикой. Biophys. Rev. 12, 519–539. DOI: 10.1007 / s12551-020-00680-x
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Чжао, Х. (2006). Коэффициенты вязкости B и стандартные парциальные молярные объемы аминокислот и их роль в интерпретации стабилизации белка (фермента). Biophys. Chem. 122, 157–183. DOI: 10.1016 / j.bpc.2006.03.008
PubMed Аннотация | CrossRef Полный текст | Google Scholar
.

 Это: гистидин, изолейцин, лейцин, лизин, метионин, фенилаланин, треонин, триптофан и валин.
Это: гистидин, изолейцин, лейцин, лизин, метионин, фенилаланин, треонин, триптофан и валин.


 551 7.811 8.421 1.00 21.18 C
ATOM 7 ND1 HIS A 17 -13.731 7.137 8.194 1.00 28.94 N
ATOM 8 CD2 HIS A 17 -12.634 8.384 9.644 1.00 21.69 C
ATOM 9 CE1 HIS A 17 -14.492 7.301 9.267 1.00 27.01 C
ATOM 10 NE2 HIS A 17 -13.869 8.058 10.168 1.00 22.66 N
ATOM 11 N ILE A 18 -9.269 9.660 6.089 1.00 19.45 N
ATOM 12 CA ILE A 18 -7.910 9.377 5.605 1.00 18.67 C
ATOM 13 C ILE A 18 -7.122 8.759 6.749 1.00 16.24 C
ATOM 14 O ILE A 18 -7.425 8.919 7.929 1.00 18.80 O
ATOM 15 CB ILE A 18 -7.228 10.640 5.088 1.00 20.22 C
ATOM 16 CG1 ILE A 18 -7.062 11.686 6.183 1.00 18.52 C
ATOM 17 CG2 ILE A 18 -7.981 11.176 3.889 1.00 24.61 C
ATOM 18 CD1 ILE A 18 -6.161 12.824 5.749 1.00 28.
551 7.811 8.421 1.00 21.18 C
ATOM 7 ND1 HIS A 17 -13.731 7.137 8.194 1.00 28.94 N
ATOM 8 CD2 HIS A 17 -12.634 8.384 9.644 1.00 21.69 C
ATOM 9 CE1 HIS A 17 -14.492 7.301 9.267 1.00 27.01 C
ATOM 10 NE2 HIS A 17 -13.869 8.058 10.168 1.00 22.66 N
ATOM 11 N ILE A 18 -9.269 9.660 6.089 1.00 19.45 N
ATOM 12 CA ILE A 18 -7.910 9.377 5.605 1.00 18.67 C
ATOM 13 C ILE A 18 -7.122 8.759 6.749 1.00 16.24 C
ATOM 14 O ILE A 18 -7.425 8.919 7.929 1.00 18.80 O
ATOM 15 CB ILE A 18 -7.228 10.640 5.088 1.00 20.22 C
ATOM 16 CG1 ILE A 18 -7.062 11.686 6.183 1.00 18.52 C
ATOM 17 CG2 ILE A 18 -7.981 11.176 3.889 1.00 24.61 C
ATOM 18 CD1 ILE A 18 -6.161 12.824 5.749 1.00 28. 21 C
ATOM 19 N ASN A 19 -6.121 8.023 6.349 1.00 15.46 N
ATOM 20 CA ASN A 19 -5.239 7.306 7.243 1.00 14.34 C
ATOM 21 C ASN A 19 -4.012 8.178 7.507 1.00 14.83 C
ATOM 22 O ASN A 19 -3.431 8.715 6.575 1.00 18.03 O
ATOM 23 CB ASN A 19 -4.825 6.003 6.573 1.00 17.71 C
ATOM 24 CG ASN A 19 -6.062 5.099 6.413 1.00 21.26 C
ATOM 25 OD1 ASN A 19 -6.606 4.651 7.400 1.00 26.18 O
ATOM 26 ND2 ASN A 19 -6.320 4.899 5.151 1.00 31.73 N
21 C
ATOM 19 N ASN A 19 -6.121 8.023 6.349 1.00 15.46 N
ATOM 20 CA ASN A 19 -5.239 7.306 7.243 1.00 14.34 C
ATOM 21 C ASN A 19 -4.012 8.178 7.507 1.00 14.83 C
ATOM 22 O ASN A 19 -3.431 8.715 6.575 1.00 18.03 O
ATOM 23 CB ASN A 19 -4.825 6.003 6.573 1.00 17.71 C
ATOM 24 CG ASN A 19 -6.062 5.099 6.413 1.00 21.26 C
ATOM 25 OD1 ASN A 19 -6.606 4.651 7.400 1.00 26.18 O
ATOM 26 ND2 ASN A 19 -6.320 4.899 5.151 1.00 31.73 N