Урок 12. аминокислоты. белки — Химия — 10 класс
Химия, 10 класс
Урок № 12. Аминокислоты. Белки
Перечень вопросов, рассматриваемых в теме: урок посвящён аминокислотам, их строению, номенклатуре, знакомству с пептидной группой и пептидной связью, химическими свойствами аминокислот, пептидам и полипептидам, знакомству с глицином как представителем аминокислот, биологической роли аминокислот, белкам, их структуре, химическим свойствам.
Глоссарий
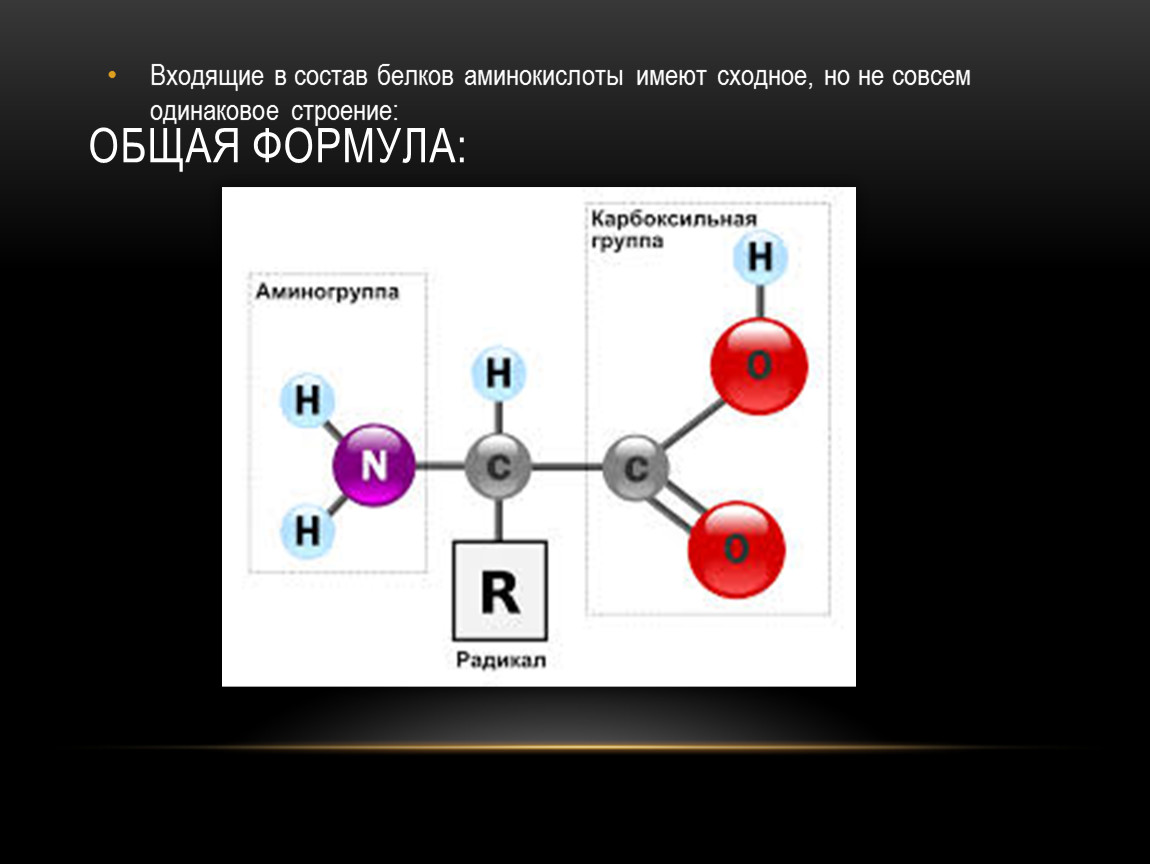
Аминокислота – это азотсодержащее органическое соединение, в составе которой есть как аминогруппа, так и карбоксильная группа.
Белки – органические полимеры, в состав которых входят остатки аминокислот, соединённые пептидной связью. Количество аминокислотных остатков в белках обычно более 50.
Биуретовая реакция – качественная цветная реакция на пептидные связи. При добавлении к белку раствора щёлочи и сульфата меди (II) раствор приобретает красно-фиолетовую окраску.
Гидролиз белка – распад белка на отдельные аминокислоты в водном растворе кислот или щелочей.
Денатурация белка – разрушение вторичной, третичной и четвертичной структуры белка при нагревании, действии растворов солей тяжёлых металлов, кислот и щелочей. При денатурации белок сворачивается и выпадает в осадок.
Ксантопротеиновая реакция – качественная цветная реакция концентрированной азотной кислоты с белками, содержащими остатки ароматических аминокислот. При добавлении концентрированной азотной кислоты к белку и нагревании сначала происходит денатурация белка, а затем появляется жёлтое окрашивание.
Олигопептиды
Пептидная группа – группа атомов в составе пептидов, состоящая из атомов углерода, кислорода, азота и водорода.
Пептидная связь – связь между атомами углерода и азота в пептидной группе.
Пептиды – органические соединения, состоящие из нескольких аминокислотных остатков, соединённых пептидной связью.
Полипептиды – макромолекулы, состоящие из 20–50 аминокислотных остатков, соединенных пептидной связью.
Основная литература:
Дополнительная литература:
1. Рябов, М.А. Сборник задач, упражнений и тестов по химии. К учебникам Г.Е. Рудзитис, Ф.Г. Фельдман «Химия. 10 класс» и «Химия. 11 класс»: учебное пособие / М.А. Рябов. – М.: Экзамен. – 2013. – 256 с.
2. Рудзитис, Г.Е. Химия. 10 класс : учебное пособие для общеобразовательных организаций. Углублённый уровень / Г.Е. Рудзитис, Ф.Г. Фельдман. – М. : Просвещение. – 2018. – 352 с.
Открытые электронные ресурсы:
- Единое окно доступа к информационным ресурсам [Электронный ресурс]. М. 2005 – 2018. URL: http://window.edu.ru/ (дата обращения: 01.06.2018).
ТЕОРЕТИЧЕСКИЙ МАТЕРИАЛ ДЛЯ САМОСТОЯТЕЛЬНОГО ИЗУЧЕНИЯ
Аминокислоты – это азотсодержащие органические соединения, в состав которых входят как аминогруппа, так и карбоксильная группа
Простейшим представителем аминокислот является глицин – аминоуксусная (аминоэтановая) кислота
По международной номенклатуре нумерация углеродных атомов начинается от углерода карбоксильной группы.
Достаточно часто в литературе можно встретить обозначения углеродных атомов в аминокислотах с помощью букв греческого алфавита. При этом атом углерода карбонильной группы не имеет обозначения.
Для некоторых аминокислот существуют тривиальные названия.
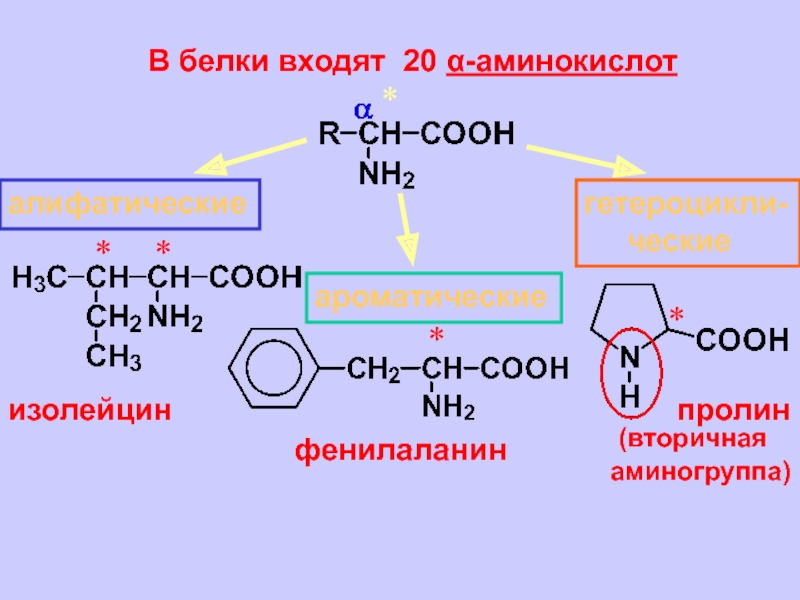
Изомеры аминокислот различаются строением углеводородного радикала и положением аминогруппы.
Все α-аминокислоты, кроме глицина, имеют в своем составе асимметрический атом, который следует сразу за карбоксильной группой. У этого атома углерода все заместители разные.
Благодаря этому атому, для α-аминокислот характерна оптическая изомерия. В природе распространены только L-α-аминокислоты.
Биологическое значение аминокислот
Из аминокислот наибольшее значение имеют α-аминокислоты, так как они входят в состав белковых молекул, из которых построено всё живое вещество.
Растения и бактерии способны самостоятельно синтезировать все необходимые для них аминокислоты. Млекопитающие, в том числе и человек, не могут синтезировать ряд аминокислот, они должны поступать в организм с пищей. К таким незаменимым аминокислотам относятся метионин, треонин, фенилаланин, лейцин, изолейцин, валин, лизин, триптофан.
К таким незаменимым аминокислотам относятся метионин, треонин, фенилаланин, лейцин, изолейцин, валин, лизин, триптофан.
α-Аминокислоты необходимы человеку для образования белков. Большую часть аминокислот для этих целей человек получает с пищей. Некоторые аминокислоты можно синтезировать. Для регулирования обменных процессов аминокислоты применяются как лекарства (например, глицин).
Получение аминокислот
В промышленности α-аминокислоты получают гидролизом белков.
Можно синтезировать аминокислоты из хлорпроизводных карбоновых кислот и аммиака.
Cl-CH2-COOH + 2NH3 → NH2-CH2-COOH + NH4Cl
Физические и химические свойства аминокислот
Аминокислоты – кристаллические вещества без цвета и запаха, сладковатые на вкус. Хорошо растворяются в воде.
Аминокислоты – амфотерные соединения, так как аминогруппа проявляет основные свойства, а карбоксильная группа – кислотные.
Карбоксильная группа в составе аминокислот позволяет им реагировать со спиртами.
Ион водорода от карбоксильной группы может переходить к аминогруппе, в результате образуется биполярный ион.
Пептиды
Аминокислоты могут реагировать друг с другом, аминогруппа одной кислоты соединяется с карбоксильной группой другой кислоты, при этом происходит выделение воды.
Группа атомов СО-NH называется пептидной (или амидной) группой, а связь между атомами углерода и азота – пептидной (амидной) связью.
Соединения, образованные из нескольких аминокислот с помощью пептидной связи, называются пептидами.
Называют пептиды перечислением тривиальных названий аминокислот, входящих в состав пептида, начиная с аминокислотного остатка со свободной аминогруппой (N-конец), заменяя в названии аминокислот окончание «ин» на «ил». Последней называют аминокислоту со свободной карбоксильной группой (С-конец), её название не изменяется. Часто название пептида записывают с помощью трёхбуквенных латинских сокращённых наименований аминокислот.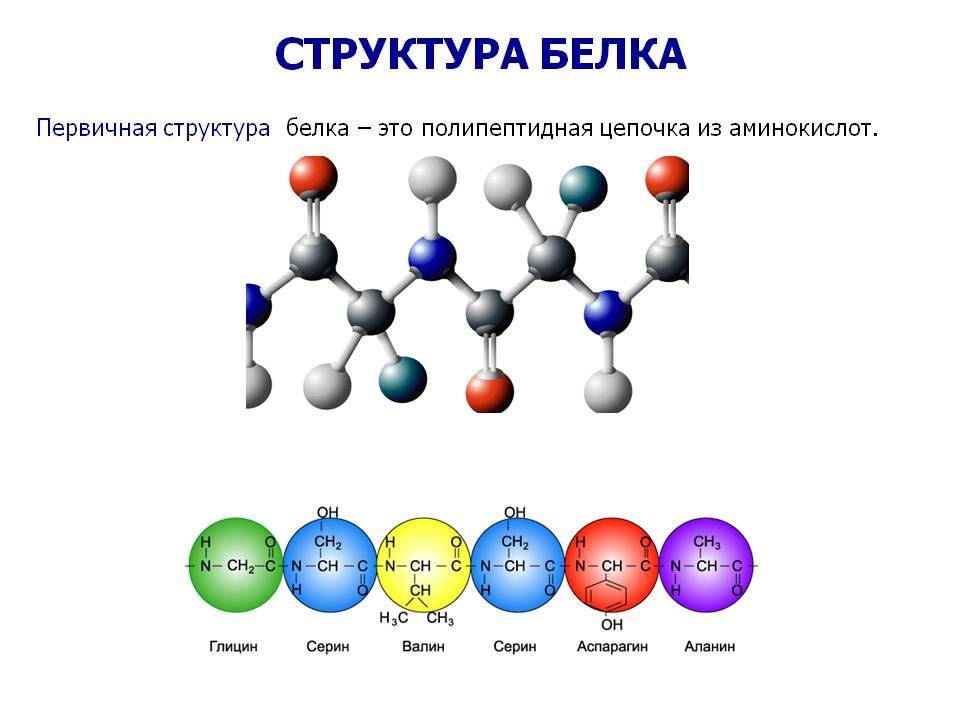
Молекулы, в состав которых входит 10–20 остатков аминокислот, называют олигопептидами.
Макромолекулы, образованные 20–50 остатками аминокислот называют полипептидами.
Полипептиды входят в состав многих гормонов. Нейропептиды регулируют работу мозга, процессы сна, обучения, обладают обезболивающим эффектом.
Белки
Полипептиды, содержащие в своём составе более 50 остатков аминокислот, называются белками. Это природные полимеры, которые образуют клетки всех живых организмов. Без белков невозможны обмен веществ, размножение и рост живых организмов.
Белки образованы атомами углерода, водорода, кислорода и азота. Кроме этих атомов, макромолекулы белков могут содержать атомы фосфора, серы, железа и других элементов.
Относительная молекулярная масса белковых молекул может быть от нескольких десятков до сотен атомных единиц массы.
Структура белков
Последовательность остатков аминокислот в молекуле белка образует первичную структуру белка.
Между атомом кислорода в группе С=О и атомом водорода в амидной группе – NH – образуется водородная связь, в результате чего макромолекула белка закручивается в спираль. Образуется вторичная структура белка.
Функциональные группы, расположенные на внешней стороне спирали, могут взаимодействовать с другими функциональными группами этой же макромолекулы. Например, между атомами серы образуется сульфидный мостик, между карбоксильной и гидроксильной группами возникает сложноэфирный мостик.
В результате образуется третичная структура белка, которая определяет специфическую биологическую активность белков. Именно благодаря уникальной третичной структуре биологические катализаторы – ферменты обладают уникальной избирательностью.
Благодаря различным функциональным группам белковые молекулы могут соединяться друг с другом, в результате формируется четвертичная структура белка.
Химические свойства белков
В зависимости от молекулярной массы и функциональных групп белки могут как хорошо растворяться в воде, так и не растворяться в ней.
Под действием температуры, растворов солей тяжёлых металлов, кислот и щелочей происходит разрушение вторичной, третичной и четвертичной структуры белка, называемое денатурацией.
При нагревании в присутствии кислоты или щёлочи белки подвергаются гидролизу, распадаясь на исходные аминокислоты.
Белки в щелочной среде в присутствии сульфата меди (II) окрашивают раствор в красно-фиолетовый цвет. Это реакция на пептидную группу (биуретовая реакция).
Концентрированная азотная кислота при нагревании окрашивает белки в жёлтый цвет, если в состав белка входят остатки ароматических аминокислот, например, фенилаланина (ксантопротеиновая реакция).
Для обнаружения в составе белка атомов серы проводят реакцию с ацетатом свинца в щелочной среде при нагревании. В результате образуется чёрный осадок (цистеиновая реакция).
Превращения белков в организме
Белки являются обязательными компонентами в пищевом рационе человека. В организме человека белки, поступившие с пищей, под действием ферментов подвергаются гидролизу и разлагаются на отдельные аминокислоты. Эти аминокислоты – строительный материал для образования новых белков, необходимых человеку. Для синтеза белков необходима энергия, которую поставляет в организме АТФ. Также энергия выделяется при распаде жиров и углеводов. Кроме синтеза белков происходит их распад с образованием углекислого газа, аммиака, мочевины и воды.
Эти аминокислоты – строительный материал для образования новых белков, необходимых человеку. Для синтеза белков необходима энергия, которую поставляет в организме АТФ. Также энергия выделяется при распаде жиров и углеводов. Кроме синтеза белков происходит их распад с образованием углекислого газа, аммиака, мочевины и воды.
Успехи в изучении и синтезе белков
В 1954 г. британский биолог Фредерик Сенгер впервые расшифровал строение белка инсулина. Каждая молекула инсулина состоит из двух полипептидов, в одном из которых 21 остаток аминокислоты, а в другом – 30 аминокислотных остатков.
В 1967 г. был создан прибор – секвенатор, позволяющий определять последовательность остатков аминокислот в макромолекуле белка.
Первый белок, синтезированный в лаборатории в 1953 г. был окситоцин.
В настоящее время развивается наука, которая занимается синтезом искусственных белков, – генная инженерия.
ПРИМЕРЫ И РАЗБОР РЕШЕНИЙ ЗАДАЧ ТРЕНИРОВОЧНОГО МОДУЛЯ
1. Решение задачи на вычисление массовой доли элемента в молекуле аминокислоты.
Решение задачи на вычисление массовой доли элемента в молекуле аминокислоты.
Условие задачи: вычислите массовую долю азота в молекуле аспаргина
. Ответ запишите с точностью до десятых долей.
Шаг первый: вычислить относительную молекулярную массу молекулы аспаргина:
М = 4·12 + 8·1 + 2·14 + 3·16 = 132 а.е.м.
Шаг второй: определить количество атомов азота в молекуле аспаргина и определить их относительную атомную массу:
2·14 = 28 а.е.м.
Шаг третий: определить массовую долю азота как отношение относительной атомной массы азота к относительной молекулярной массе аспаргина:
(28 : 132)·100 = 21,2 %.
Ответ: 21,2.
2. Решение задачи на определение количества различных олигопептидов, которые можно получить из определённого набора аминокислот.
Условие задачи: Сколько ди- и трипептидов можно составить из двух молекул аланина и одной молекулы цистеина?
Шаг первый: определить количество возможных дипептидов.
Из двух молекул аланина и одной молекулы цистеина можно составить три дипептида: Ala-Ala, Ala-Cys и Cys-Ala (два последних дипептида – разные соединения, так как в молекуле Ala-Cys карбоксильная группа аланина соединяется с аминогруппой цистеина, а в молекуле Cys-Ala карбоксильная группа цистеина соединяется с аминогруппой аланина).
Шаг второй: определить количество возможных трипептидов.
Ala-Ala-Cys, Ala-Cys-Ala, Cys-Ala-Ala – возможно составить 3 трипептида.
Ответ: 3 дипептида и 3 трипептида.
Синтетическая биология: новые аминокислоты, новые белки | Научные открытия и технические новинки из Германии | DW
Первые в истории человечества искусственные постройки были сооружены, конечно же, из природных материалов — глины, древесины, камней. Сегодня строители располагают поистине необъятным ассортиментом искусственных материалов — от бетона и стали до пластмасс и стекла. Столь широкий выбор стройматериалов и связанные с ними новые возможности предопределили и изменения в архитектуре сооружений. Похоже, сходные метаморфозы ждут нас и в биологии.
Похоже, сходные метаморфозы ждут нас и в биологии.
Новые задачи требуют новых белков
Природа создала практически все живые организмы — от бактерии до человека — по одному рецепту: наследственная информация, закодированная в генах, определяет состав и последовательность синтеза белков в клетках. Именно белки, собственно, и являются основой жизни — по крайней мере, в той форме, в которой она существует на Земле. Белки же представляют собой высокомолекулярные органические вещества, состоящие преимущественно из аминокислот. Набор аминокислот, образующих белки, невелик: их всего 20, так что все гигантское многообразие свойств белковых молекул определяется лишь различными комбинациями этих аминокислот.
Так задумала природа. Однако эти рамки представляются некоторым исследователям слишком узкими. В их числе и Недилько Будиша (Nediljko Budiša), хорватский ученый, работающий в Германии, в Институте биохимии Общества Макса Планка в Мартинсриде близ Мюнхена: «Все живые организмы используют эти 20 основных кирпичиков для синтеза белков, — поясняет ученый. — Но природа не могла предусмотреть, что мы поставим перед собой какие-то новые цели и начнем развивать биотехнологии».
— Но природа не могла предусмотреть, что мы поставим перед собой какие-то новые цели и начнем развивать биотехнологии».
Это и побудило исследователя взяться за создание новых аминокислот — с тем, чтобы использовать их в качестве составных элементов новых белков. Он начал с того, что сконструировал две не существующие в природе аминокислоты, а затем ему удалось заставить бактерии производить белки, в состав которых вошли и эти самые искусственные субстанции. Сегодня ученый уже владеет богатым ассортиментом приемов, с помощью которых он может заставить бактерии встраивать в синтезируемые ими белки самые разные химические элементы, природой там отнюдь не предусмотренные.
Фторопласты, липазы и катализаторы
«Фтор — это элемент, который природа практически никогда не использовала, или использовала крайне редко, — говорит Недилько Будиша. — Так, в организме человека фтор содержится разве что в зубной эмали. Это связано, прежде всего, с тем, что фториды — кристаллические соединения, в форме которых фтор встречается в природе, — нерастворимы в воде.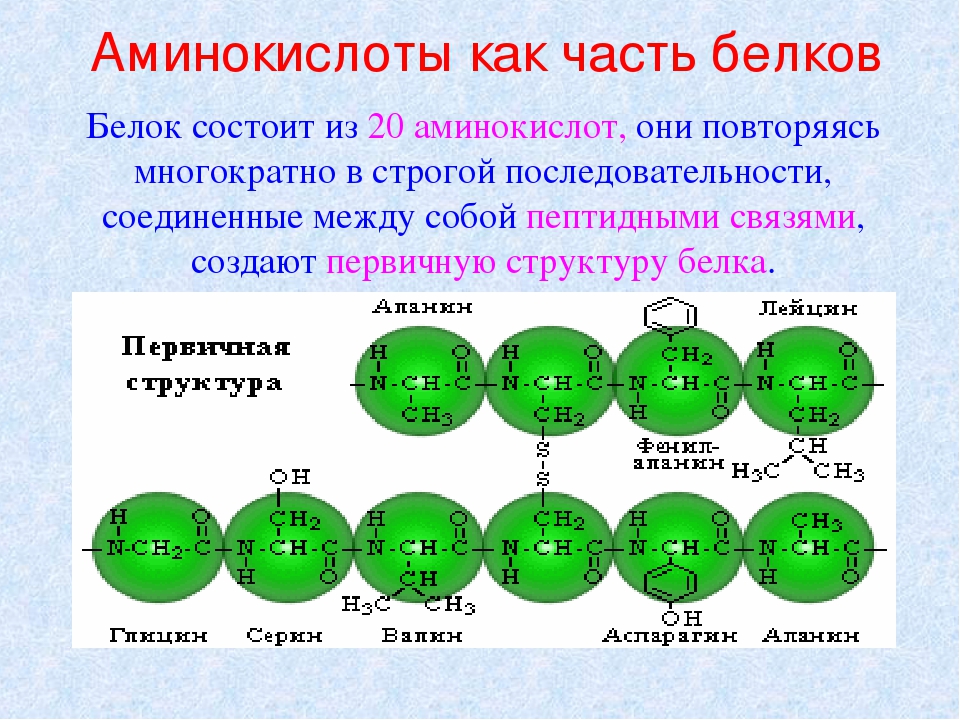 Между тем, за последние годы и десятилетия в мире сформировалось целое направление органической химии, занимающееся фторсодержащими соединениями. Это чрезвычайно перспективное направление, здесь уже имеются весьма значительные достижения. Если мы искусственно создадим фторсодержащую аминокислоту и встроим ее в белок, то такой белок может и в органических растворителях быть таким же активным, как в воде».
Между тем, за последние годы и десятилетия в мире сформировалось целое направление органической химии, занимающееся фторсодержащими соединениями. Это чрезвычайно перспективное направление, здесь уже имеются весьма значительные достижения. Если мы искусственно создадим фторсодержащую аминокислоту и встроим ее в белок, то такой белок может и в органических растворителях быть таким же активным, как в воде».
Химической промышленности такие фторсодержащие белки будут как нельзя более кстати. Ведь сегодня фторопласты, то есть полимеры, содержащие атомы фтора и обладающие поэтому высокой химической стойкостью, получают чисто химическим путем, используя метод электролиза. Между тем, в биореакторах синтез фторопластов был бы более экологичным и обходился бы дешевле, — уверен Недилько Будиша.
Еще один пример — это липазы, водорастворимые ферменты, помогающие расщеплять жиры. Они широко применяются в моющих средствах и стиральных порошках. Путем внедрения в состав этих ферментов целого ряда специальных, не существовавших ранее в природе, аминокислот исследователю удалось существенно повысить эффективность моющих средств.
«Если говорить о важных в промышленном отношении ферментах, то их эффективность — как, например, в случае с этими липазами, — можно повысить ни много ни мало в 10 раз, — подчеркивает Недилько Будиша. — Ну, скажем, в 10 раз уменьшить расход катализаторов, необходимых для поддержания технологических процессов. Ведь эти катализаторы чрезвычайно дороги, и вот появляется возможность повысить их эффективность в 10 раз».
То, что поначалу выглядело — а возможно, и было, — забавой, сегодня стало уже серьезной инновацией. Казалось бы, промышленность должна двумя руками ухватиться за эту разработку. Но не тут-то было, — сетует Недилько Будиша: «Сравнивая свою ситуацию с ситуацией моих американских коллег, я должен сказать, что немецкая промышленность не проявляет особого интереса к новым технологиям. Она берет только то, что полностью готово к внедрению и не требует никаких дополнительных капиталовложений».
Впрочем, 20-ти аминокислотам потребовалось 3,5 миллиарда лет на то, чтобы прочно занять свое место в составе белков. Ясно, что новичкам приходится туго.
Ясно, что новичкам приходится туго.
Автор: Владимир Фрадкин
Редактор: Дарья Брянцева
Растереть на аминокислоты
«Нужно обязательно употреблять белки!» — подобные рекомендации хотя бы раз в жизни слышал каждый. По идее, эти вещества мы можем спокойно получить из пищи — организм тут же займется расщеплением для дальнейшего усвоения. А что делать людям, желудочно-кишечный тракт которых не способен переработать их самостоятельно? Или любителям спорта, не успевающим «заправиться» после активных упражнений?Несбалансированное питание является важной проблемой для организма. Недостаточное или избыточное употребление белков, жиров, углеводов, микроэлементов приводит к нарушению обмена веществ и тяжелым заболеваниям: сахарному диабету, болезням сердца и сосудов. Кроме того, люди нередко испытывают значительный дефицит микронутриентов (питательных веществ) — до 80 % населения РФ, как показывают исследования Роспотребнадзора.
— Немаловажное значение в регуляции обмена веществ играют аминокислоты и олигопептиды, — рассказывает старший научный сотрудник Института химии твердого тела и механохимии СО РАН кандидат химических наук Алексей Леонидович Бычков. — Аминокислоты — это органические соединения, из которых состоят все белки, а олигопептиды — промежуточные соединения, где находится до 7—10 аминокислот.
Заменимые аминокислоты способны синтезироваться в организме, а вот незаменимые человек получает только из пищи, содержащей полноценные белки. Однако желудок не всегда может расщеплять их до более коротких молекул из-за ряда расстройств или после хирургического вмешательства. Для этого и разрабатывается питание с уже разделенными на части белками.
Чтобы получить востребованный продукт должного качества, нужны консультации экспертов из других областей. Ученые ИХТТМ СО РАН сотрудничают с двумя организациями: кафедрой технологии организации пищевых производств Новосибирского государственного технического университета и Институтом экспериментальной ветеринарии Сибири и Дальнего Востока Россельхозакадемии. Уже были проведены предварительные эксперименты: исследователи извлекли и расщепили белки из гороха, пищевики сделали супы-пюре и хлебцы, а в ИЭВСиДВ продукты испытали на животных (спойлер — всё прошло хорошо).
Ученые ИХТТМ СО РАН сотрудничают с двумя организациями: кафедрой технологии организации пищевых производств Новосибирского государственного технического университета и Институтом экспериментальной ветеринарии Сибири и Дальнего Востока Россельхозакадемии. Уже были проведены предварительные эксперименты: исследователи извлекли и расщепили белки из гороха, пищевики сделали супы-пюре и хлебцы, а в ИЭВСиДВ продукты испытали на животных (спойлер — всё прошло хорошо).
— Человек не может синтезировать все аминокислоты самостоятельно: приходится искать их в пище, — поясняет Алексей Бычков. — Есть такая научная шутка: как химику узнать, из чего состоит рояль? Нужно его растворить! Однако проблема в том, что не все вещества могут растворяться и реагировать друг с другом с нужной скоростью. В таких случаях и помогает химия твердого тела: проводя механохимическую обработку, можно добиться повышения реакционной способности материала.
Здесь прежде всего необходимо не измельчение, а более тонкие процессы, меняющие структуру объекта.
При механическом воздействии с помощью специальных мельниц-активаторов в твердом теле возникает напряжение: в результате появляется трещина и происходит разрыв, деформация. Кроме того, разрушается кристаллическая структура вещества, рвутся химические связи. «Перемешав» кристаллические решетки, какую-то часть связей легче порвать. Структура аморфизуется, и ферменты относительно легко гидролизуют субстраты. Происходит химическая реакция, итог которой — образование новых соединений (в том числе необходимых аминокислот и олигопептидов).
— Если смешать зеленый и красный пластилин и помять его, даже не измельчая, в итоге кусок станет разноцветным, — рассказывает Алексей Бычков. — То же с растительным сырьем: нам больше интересно не измельчение, а получаемая внутренняя структура: как упакованы полимеры, упорядочены они или нет, взаимодействуют они между собой.
Это во многом определяет реакционную способность.
Сибирские исследователи направляют свои разработки на тех людей, у которых есть потребность в подобных продуктах по состоянию здоровья. Другой вариант — спортивное питание, ведь в России практически нет своих производств.
— Большая часть потребителей спортпита — люди, которые ходят в тренажерный зал, — добавляет ученый. — В основном этот рынок представлен либо изолятами (белки, выделенные из сырья без расщепления), либо гидролизатами. Последние более эффективны, потому что в них молекулы расщеплены, но при этом дороже и не столь доступны обыкновенным спортсменам-энтузиастам.
На разработку ученых ИХТТМ выделен грант РНФ (в рамках президентской программы поддрежки исследований — прим. ред. сайта rscf.ru). Полученные данные позволят не только создавать компоненты продуктов функционального и лечебно-профилактического питания, но будут востребованы при решении проблем переработки других природных веществ — полимеров.
Белки / КонсультантПлюс
Белки.
Белки, или как их еще называют протеины (от греческого Protos — первый), являются основой жизни и самой незаменимой частью рациона человека. Они занимают важнейшее место в нашем организме как по содержанию в клетке, так и по значению в процессах жизнедеятельности, ведь на долю белков приходится 17% общей массы нашего организма. Это основной строительный материал необходимый для образования новых мышечных волокон, восстановления травмированных и замены отмерших тканей всех органов, именно благодаря белкам осуществляются все сокращения мышц. Кроме того, белки выполняют целый ряд жизненно важных функций — регулируют все процессы, протекающие в организме, от образования энергии, до выведения отходов. Если пища обеднена углеводами и жирами, особенно в условиях голодания, именно белки служат запасными питательными веществами и источниками энергии.
Белки состоят из аминокислот. Некоторые аминокислоты могут поступать в наш организм только в составе пищи. Они получили название незаменимых. Другие аминокислоты синтезируются в нашем организме. Поэтому полноценность белковых продуктов определяется наличием в них незаменимых аминокислот.
Они получили название незаменимых. Другие аминокислоты синтезируются в нашем организме. Поэтому полноценность белковых продуктов определяется наличием в них незаменимых аминокислот.
Чем ближе аминокислотный состав белков пищи к составу белка нашего организма, тем он ценнее. С этой точки зрения самыми ценными источниками белка являются яйца, молоко, мясо и рыба. В растительных белках часто не хватает некоторых незаменимых аминокислот, поэтому необходимо стремиться к правильному сочетанию продуктов животного и растительного происхождения, чтобы получить оптимальное соотношение аминокислот.
Норма физиологических потребностей взрослого человека, работающего в тяжелых и вредных условиях труда, в белках составляет 96 — 117 г в сутки для мужчин и 82 — 87 г — для женщин.
За один прием пищи организм может усваивать до 30 — 50 г белка, поэтому суточное количество белка лучше распределять равномерно на 4 — 6 приемов пищи, так как меньшие количества продукта лучше усваиваются и более эффективно используются организмом.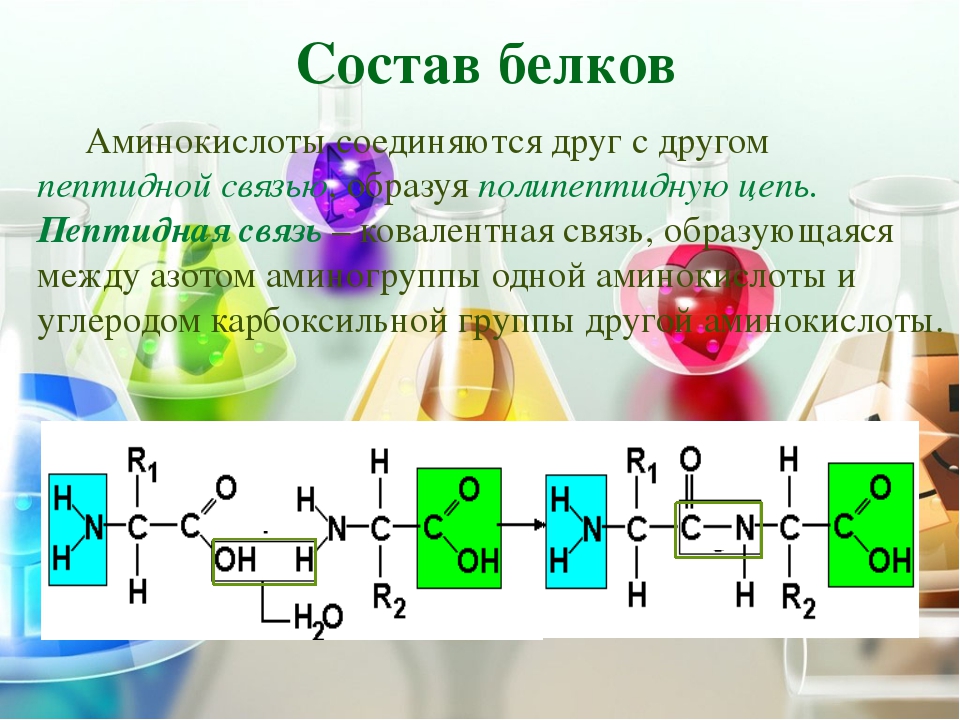
По скорости переваривания пищевые белки располагаются в следующей последовательности: сначала яичные и молочные, затем рыбные и мясные, и наконец, растительные. Кулинарная обработка в большинстве случаев делает белки более легко усвояемыми. Но следует заметить, что способы сохранения белковых продуктов, в первую очередь мясных, снижают пищевую ценность этого продукта. Чтобы избавиться от большого количества жиров, которые имеются в мясе, его рекомендуют варить, сливая жирный бульон, или готовить на пару, а также в аэрогриле.
Белки — наиважнейший компонент пищи. Кратко перечислим основные белковые продукты. Во-первых, это мясо — высокоценный пищевой продукт богатый полноценными животными белками, содержащий все незаменимые аминокислоты в значительных количествах и в наиболее благоприятных соотношениях.
Наиболее богаты белками, до 20%, говядина, свинина, мясо кролика и птицы.
Говядина содержит наиболее полноценные белки, в состав которых входят все необходимые организму заменимые и незаменимые аминокислоты.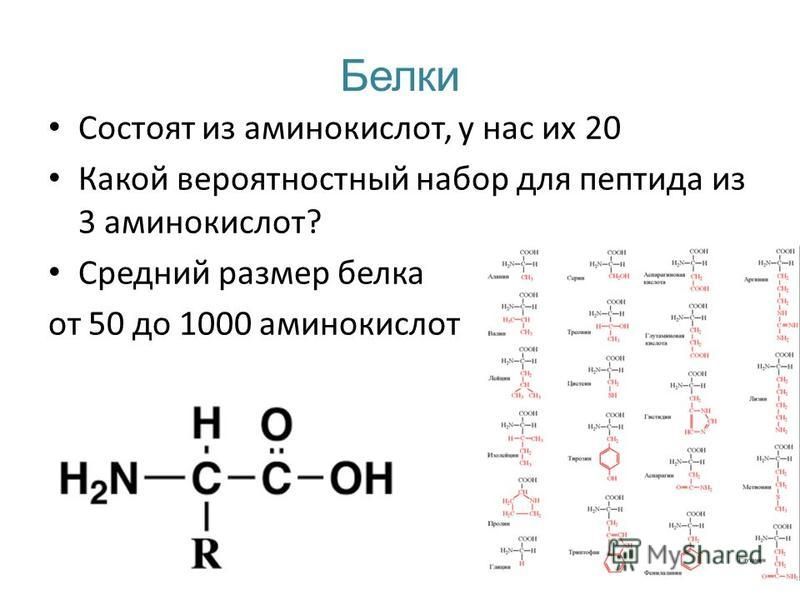
Телятина более нежная, чем говядина, включает больше полноценных белков и легче усваивается организмом. Телятина 1-й и 2-й категорий содержит около 20% белка и 1 — 2% жира.
Свинина по сортам делится на беконную, мясную и жирную. В питании при физических нагрузках лучше использовать мясную свинину так, как она содержит в среднем 14% белка и 33% жира.
Для сравнения, беконная — 3% белка и 63% жира, жирная соответственно 12% и 50%. При этом важно учесть, что вырезка свинины содержит 19% белка и 7% жира.
Мясо кролика — прекрасный диетический продукт, отличающийся очень высоким содержанием белка — 21%.
Субпродукты представляют большую ценность, так как характеризуются высоким содержанием минеральных веществ, особенно железа. Печень богата железом, витаминами A и B, содержит большое количество витамина C. Язык является диетическим продуктом и очень хорошо усваивается. Сердце богато белками, минеральными солями, железом и имеет невысокий процент жира.
Колбасные изделия в основном готовят из свинины и говядины, но представляют собой высокожировой продукт. Различные виды копченых и полукопченых колбас, содержащие до 40% жира и более, не рекомендуется тем, кто не хочет набрать лишний вес. Также не рекомендуется часто употреблять такие мясные продукты как ветчина, грудинка, окорок, корейка, они отличаются очень высоким содержанием жира — До 50 — 60%.
Различные виды копченых и полукопченых колбас, содержащие до 40% жира и более, не рекомендуется тем, кто не хочет набрать лишний вес. Также не рекомендуется часто употреблять такие мясные продукты как ветчина, грудинка, окорок, корейка, они отличаются очень высоким содержанием жира — До 50 — 60%.
Белки куриного мяса имеют оптимальный набор незаменимых аминокислот. Количество жира в мясе кур и цыплят довольно велико, но жир этот легко усваивается организмом, так как включает в себя ненасыщенные жирные кислоты.
Рыба является источником высококачественного белка. Белок рыбы содержит все необходимые для организма незаменимые аминокислоты. В отличие от мяса в белках рыбы присутствует очень важная для нашего организма незаменимая аминокислота — метионин.
Еще одним преимуществом белка рыбы является его быстрая и полная усвояемость — на 93 — 98%, тогда как белки мяса усваиваются на 87 — 89%. Содержание белка в рыбе зависит от ее вида. Например, в тунце — 24%, макрурусе — 7%, хек, камбала, треска, карп и многие другие виды рыб имеют в среднем 16% белка.
Икра рыбы является ценным пищевым продуктом с высоким содержанием белка — до 30% и более и жира около 15%. Икра богата фосфором и калием, водо- и жирорастворимыми витаминами.
Во время снижения веса не рекомендуем включать в свой рацион питания соленые и копченые рыбные изделия. Они, как правило, из-за особенностей их переработки, имеют белок, который плохо переваривается и усваивается. Также не рекомендуется широко применять в питании рыбные консервы. Из-за длительного хранения и процесса приготовления многие ценные качества рыбы просто теряются.
Куриное яйцо по сравнению с другими животными продуктами содержит самый полноценный белок, практически полностью усваивающийся организмом. Яйца содержат в наиболее оптимальных соотношениях все незаменимые аминокислоты. Но из-за большого количества жира и высокой калорийности не рекомендуется употреблять яйца тем, кто хочет снизить свой вес или поддерживать его постоянным. В среднем оптимальным считается употребление трех яичных желтков в неделю, яичный белок можно есть и в большем количестве.
Наилучшим способом приготовления яиц является их непродолжительное отваривание. Яйца недаром называют «маленькой кладовой», особенно белок. В своем составе они имеют множество полезных веществ: водо- и жирорастворимые витамины — B, B2, B6, B12, A, D, K, E; пантотеновую и фолиевую кислоты; минеральные вещества — фосфор, серу, цинк, железо, медь, кобальт.
Бобовые также используются как источник белка, но содержат меньше незаменимых аминокислот и усваиваются всего на 50 — 70%. Кроме того, бобовые содержат вещества, блокирующие работу некоторых пищеварительных ферментов, что может нарушить переваривание пищи и оказать повреждение стенок тонкого кишечника. Среди бобовых особое место занимает соя. Но потребление этого продукта имеет некоторые недостатки. Во-первых, в соевом белке не хватает самой необходимой нашему организму незаменимой аминокислоты — метионина; во-вторых, если не проводить длительную термическую обработку, а при этом, как известно, теряются все важные вещества, то можно нарушить процесс переваривания пищи; в-третьих, соевый белок может оказывать повреждающее действие на стенки кишечника.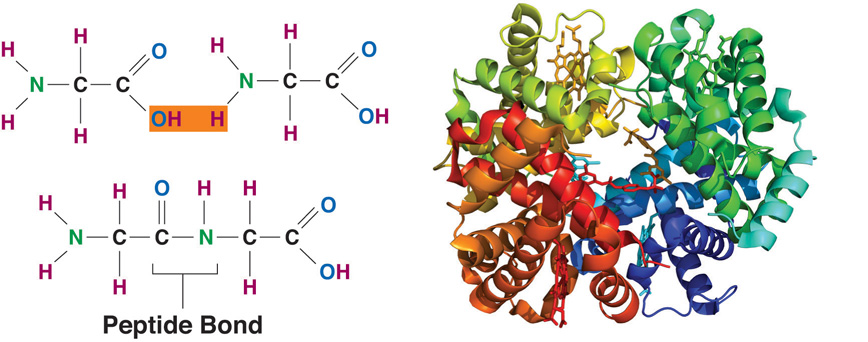
Аминокислоты или белок. Что лучше для выносливости?
Автор: Патрисиа Роузен – доктор медицинских наук, член Научного Совета First Endurance
Я думаю, нам всем известно, что простой глюкозы недостаточно для достижения оптимальной выносливости. Ранние исследования показывают, что добавление белка в питание, используемое во время соревнований, значительно отодвигает время наступления истощения и уменьшает повреждение мышц после тренировки. Употребление белков помогает поддерживать запасы гликогена. Однако поедание гамбургера или крылышек чили во время прохождения IRONMAN не есть хорошо. Я упоминаю это, поскольку знаю, что один из первых гонщиков IRONMAN (Джон Коллинз) действительно использовал чили в качестве топлива на велосипеде и дополнял его пивом во время бега! И он финишировал — что удивительно! Таким образом, белки имеют некоторые преимущества, но усваивать эти сложные молекулы во время тренировки может быть затруднительно и даже вредно.
Поэтому возникает вопрос, как получить все преимущества белков без побочных эффектов для ЖКТ?
Мы должны изучить основы, что такое аминокислоты и белки.
Аминокислоты являются строительными блоками белков и мышечных волокон. Много физиологических процессов, касающихся движения, энергии, восстановления, укрепления мышц и сжигания жиров, а также настроения и функций мозга связаны с аминокислотами, поэтому организм нуждаются в них. Эти 23 (или около того) аминокислоты являются молекулярными строительными блоками белков. Девять из них называют незаменимыми аминокислотами, потому что они могут быть получены только из пищи или добавок; другие, которые ранее классифицировались как несущественные, могут быть синтезированы самим организмом.
Важным фактором является способность организма синтезировать незаменимые аминокислоты, когда они метаболизируются или истощаются во время тренировки. В частности, глютамин, который используется во время длительных физических упражнений или стресса, требует восполнения, если его количество уменьшается при активной тренировке или сильном стрессе любого рода. Несмотря на то, что это самая распространенная аминокислота в организме, телу трудно справляться с ее нехваткой при сильном стрессе. Когда концентрация аминокислот в плазме снижается, что случается у спортсменов при тяжелой нагрузке, иммунная система также подавляется (снижается иммунитет), это делает спортсмена более восприимчивым к болезням.
Когда концентрация аминокислот в плазме снижается, что случается у спортсменов при тяжелой нагрузке, иммунная система также подавляется (снижается иммунитет), это делает спортсмена более восприимчивым к болезням.
Хотя глютамин, как было доказано, увеличивается после краткосрочных упражнений с высокой интенсивностью, долгосрочные упражнения способствуют его уменьшению. Это связано с утомлением после длительных тренировок (марафонских и длительных) и синдромом перетренированности. Спортсмен чувствует усталость, обнаруживает нарушения сна и затруднения в выполнении упражнений. Вырастает пульс. Усиливается развитие респираторных заболеваний. Но добавки с разветвленной цепью аминокислот помогают с этим бороться.
Аминокислоты с разветвленной цепью включают лейцин, изолейцин и валин. Это простые аминокислоты, имеющие разветвленную структуру. Исследования показали, что использование эффективной дозы BCAA помогает поддерживать уровень мышечной массы и предотвращать перетренированность.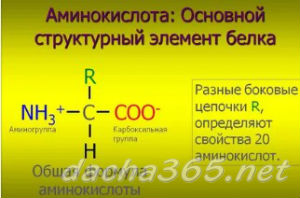 На ее симптомы может влиять изменения соотношения аминокислот. Аминокислотный триптофан, предшественник серотонина, повышается при перетренированности, что приводит к дисбалансу аминокислот с разветвленной цепью (BCAA). Это приводит к усталости и депрессии. Данное физиологическое отклонение известно как общая усталость. Добавление BCAA предотвращает увеличение серотонина и появление общей усталости.
На ее симптомы может влиять изменения соотношения аминокислот. Аминокислотный триптофан, предшественник серотонина, повышается при перетренированности, что приводит к дисбалансу аминокислот с разветвленной цепью (BCAA). Это приводит к усталости и депрессии. Данное физиологическое отклонение известно как общая усталость. Добавление BCAA предотвращает увеличение серотонина и появление общей усталости.
Содержание и баланс аминокислот, а также соотношение заменимых и незаменимых, помогает определить ценность качества белка. Однако потребность использования этих аминокислот требует, чтобы они были удобоваримыми, абсорбируемыми и биодоступными. Это означает, что аминокислоты должны быть доставлены в ткани, очень быстро.
Донна Фелан – ПРО-атлет First Endurance
Употребление качественной пищи — лучший способ получить аминокислоты в рацион через постное мясо, молочные продукты, овощи и бобовые. Однако, в отличие от Джона Коллинза во время первого IRONMAN, большинство спортсменов не хотят есть чили на велосипеде.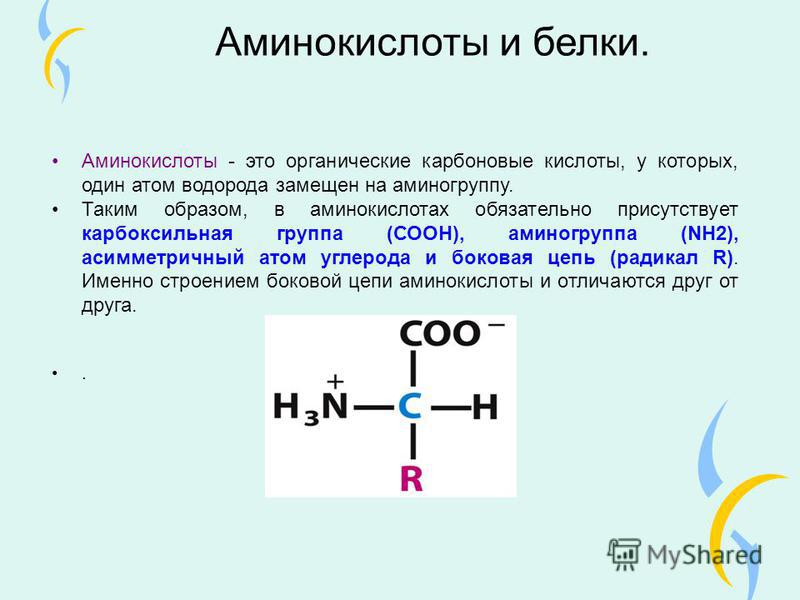 Когда вы едите продукты, высококачественные или нет, аминокислоты перевариваются и метаболизируются печенью. Таким образом, большая часть белка не используется, поскольку она превосходит способность печени усваивать ее. Использование обычного питания во время и сразу после интенсивных упражнений просто непрактично и не так эффективно, даже если основные питательные компоненты для мышечного восстановления легко доступны.
Когда вы едите продукты, высококачественные или нет, аминокислоты перевариваются и метаболизируются печенью. Таким образом, большая часть белка не используется, поскольку она превосходит способность печени усваивать ее. Использование обычного питания во время и сразу после интенсивных упражнений просто непрактично и не так эффективно, даже если основные питательные компоненты для мышечного восстановления легко доступны.
Отметим также, что природные пищевые белки содержат от 4% до 8% аминокислот в виде глутамина.
Он также легко разрушается при приготовлении пищи. Сырые овощи могут быть хорошим источником глутамина, хотя глутамин из обычных продуктов питания сложно всасывается через кишечнике.
Биодоступность важна для того, чтобы вы могли получить питание именно в то время, когда оно нужно больше всего, и не испытали расстройства ЖКТ. Ранее обсуждалось, что белки просто не доставляют аминокислоты также быстро и в полном объеме, как это делают свободные аминокислоты.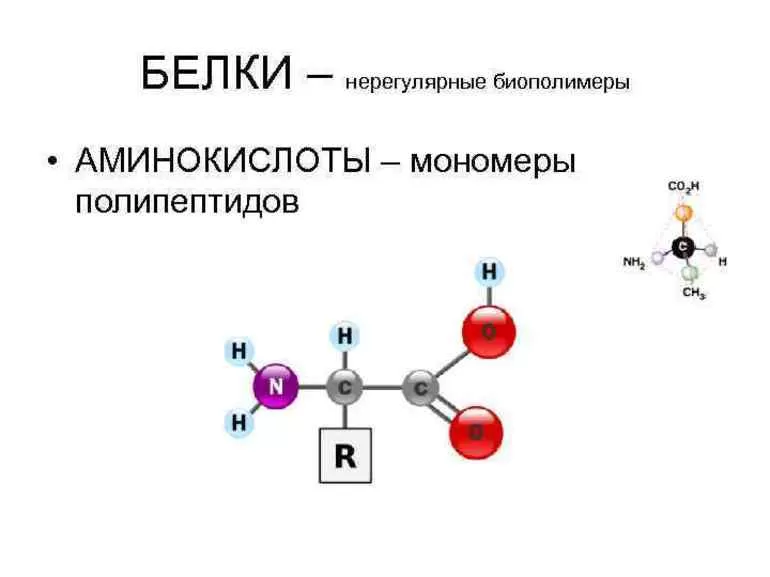 Многие спортсмены испытывают проблемы с ЖКТ, пытаясь потреблять белки во время физических упражнений. Ценность свободных аминокислот в том, что они не требуют переваривания. Их наличие в напитке не только более приемлемо, но и более практично. Недавнее исследование показывает, что употребление белкового гидролизата (предварительно расщепленного белка), в отличие от его полностью интактного белка, ускоряет не только его переваривание и абсорбцию кишечника, но также увеличивает доступность постпрандиальной аминокислоты и увеличивает включение пищевых аминокислот в скелетную мышцу.
Многие спортсмены испытывают проблемы с ЖКТ, пытаясь потреблять белки во время физических упражнений. Ценность свободных аминокислот в том, что они не требуют переваривания. Их наличие в напитке не только более приемлемо, но и более практично. Недавнее исследование показывает, что употребление белкового гидролизата (предварительно расщепленного белка), в отличие от его полностью интактного белка, ускоряет не только его переваривание и абсорбцию кишечника, но также увеличивает доступность постпрандиальной аминокислоты и увеличивает включение пищевых аминокислот в скелетную мышцу.
Лучший способ доставки аминокислот – вводить их в виде порошка для перорального применения. Свободные формы аминокислот способны проникать в процесс циркуляции в течение 15 минут. Таким образом, использование аминокислот с разветвленной цепью во время тренировки помогает бороться с усталостью и позволяет мышцам восстанавливаться после нагрузок. Кроме того, новые данные свидетельствуют о том, что добавление белка во время физических упражнений может обеспечить прекурсоры для промежуточных продуктов цикла Кребса.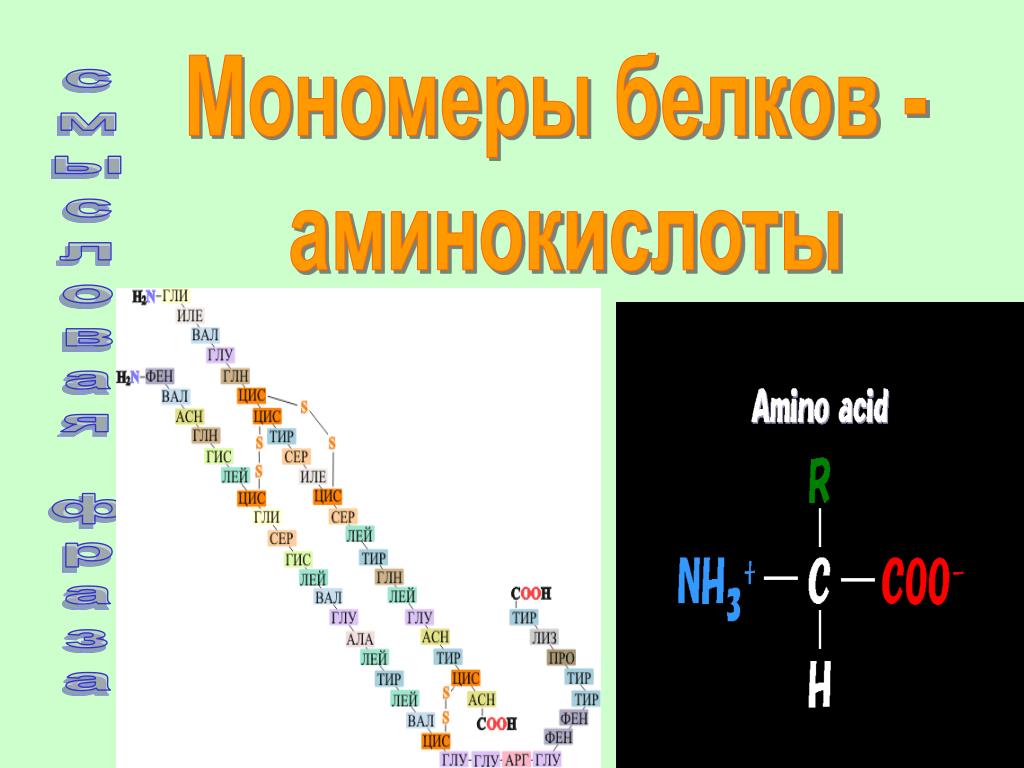 Эти промежуточные продукты уменьшаются во время физических упражнений и уменьшают производство энергии. Хотя считается, что углеводные добавки способствуют этому процессу, но это не так эффективно без добавления аминокислот. Другими словами, употребление аминокислот вместе с углеводами позволяет последним работать лучше.
Эти промежуточные продукты уменьшаются во время физических упражнений и уменьшают производство энергии. Хотя считается, что углеводные добавки способствуют этому процессу, но это не так эффективно без добавления аминокислот. Другими словами, употребление аминокислот вместе с углеводами позволяет последним работать лучше.
Поэтому мой выбор прост. Мне нравится чили так же, как и другим людям, но он бесполезен, пока мы бежим, плывем, едем на велосипеде и т.д. Исследование подтверждает пользу аминокислот BCAA в свободной форме. Мне нравится электролитный напиток EFS Drink и EFS Liquid Shop для использования на вело и беге. И хотя мы в First Endurance ясно верим, что для выносливости на дистанции необходимы углеводы, электролиты и жидкость, потребление аминокислот в свободной форме дает небольшое дополнительное преимущество.
Электролитный комплекс EFS содержит 2,000 мг аминокислот BCAA. Они усваиваются организмом за 5 минут.
Ultragen – напиток для восстановления, содержит изолят сывороточного белка и гидролизат сывороточного белка, который быстро абсорбируется. Ultragen также обогащен 6г глутамина и 4,5 г аминокислот с разветвленной цепью BCAA. После гонки эти белки доставляются в критически важные для восстановления первые 30 минут, когда мышцы наиболее открыты для поглощения питательных веществ и белка, который можно абсорбировать во время восстановления и строительства волокон.
Ultragen также обогащен 6г глутамина и 4,5 г аминокислот с разветвленной цепью BCAA. После гонки эти белки доставляются в критически важные для восстановления первые 30 минут, когда мышцы наиболее открыты для поглощения питательных веществ и белка, который можно абсорбировать во время восстановления и строительства волокон.
Практически говоря, способ получить белок и повысить выносливость заключается в использовании свободных форм аминокислот в начале гонки, во время и в ее конце для восстановления, что позволит повысить производительность на следующей тренировке. Рекомендую посмотреть блоги на веб-сайте First Endurance, чтобы узнать, как профессионалы используют этот метод.
Источники:
www.youtube.com/watch?v=kCYCPaDXT90
Ivy, J: Res Pt, Sprague RC, Widzer MO
Effect of a carbohydrate-protein supplement on endurance performance during exercise of varying intensity.
International journal of sport nutrition and exercise metabolism, 2003; 13; 388-401
MJ Saunders, MD Kane, MK Todd
Effects of a carbohydrate-protein beverage on cycling endurance and muscle damage
Medicine and Science in Sports and Exercise, 2004; 36: 1233-1238
M Parry-Billings, R, Budgettt, Y Koutedakis, E Blomstrand, S Brooks, C Williams, PC Calder, S Pilling, R Bainrie, EA Newsholme
Plasma amino acid concentrations in the overtraining syndrome: Possible effects on the immune system
Medicine and Science in Sports and Exercise: 1992; 24: 1353-1358
Armstrong, L. , VanHeest, J.
, VanHeest, J.
The unknown mechanism of the overtraining syndrome: clues from depression and psychoneuroimmunology. Sports Medicine, 2002; 32: 185-209.
R Koopman, N Crombach, A P Gisen, S Walrand, J Fauguant, A K Kies, S Leomsquet, WHM Saris, Y Boirie, LJC van Loon
Ingestion of a protein hydrolysate is accompanied by an accelerated in vivo digestion and absorption rate when compared with its intact protein.
American Journal of Clinical Nutrition, 2009; 90:06-115
Вся правда о растительном белке
Белки – это основа основ нашего организма. Они участвуют в росте клеток и мышечной ткани, влияют на правильную работу иммунной, нервной и обменной систем. Поэтому получать протеин мы должны в необходимом количестве. В зависимости от веса женщине требуется от 46 г белков в день, а мужчине от 56 г.
Что такое белки и какими они бывают?
Белки – совокупность аминокислот. Когда мы говорим о том, чем полезен белок, в действительности мы говорим о пользе аминокислот. Белок для них лишь упаковка. Для нормальной жизнедеятельности человеку постоянно необходимы 20 различных аминокислот. Они бывают незаменимые – те, которые организм сам не вырабатывает и которые попадают в него только с пищей. Их 8: фенилаланин, лизин, треонин, метионин, валин, лейцин, триптофан, изолейтин. Есть еще гистидин, но эта аминокислота незаменимая только у детей, с возрастом организм начинает синтезировать ее самостоятельно. Поэтому часто ее называют условно-незаменимой.
Белок для них лишь упаковка. Для нормальной жизнедеятельности человеку постоянно необходимы 20 различных аминокислот. Они бывают незаменимые – те, которые организм сам не вырабатывает и которые попадают в него только с пищей. Их 8: фенилаланин, лизин, треонин, метионин, валин, лейцин, триптофан, изолейтин. Есть еще гистидин, но эта аминокислота незаменимая только у детей, с возрастом организм начинает синтезировать ее самостоятельно. Поэтому часто ее называют условно-незаменимой.
Заменимые аминокислоты организм синтезирует самостоятельно или усваивает из продуктов питания. Их 11: аланин, аргинин, аспарагин, глутамат, глутамин, карнитин, глицин, орнитин, пролин, серин и таурин.
Протеомика – научное направление в биологии, которое изучает белки. Термин протеин ввел в 1928 году шведский химик Йёнс Якоб Берцелиус. Это производное от греческого слова proteos, что в переводе означает «самое важное».
Белки бывают животного и растительного происхождения. На протяжении ХХ века в научных кругах не утихали споры, не навредит ли человеку отказ от животной пищи. Один лагерь утверждал, что отказаться никак невозможно. Потому что именно белки животного происхождения считаются полноценными: в их составе можно найти все незаменимые аминокислоты.
На протяжении ХХ века в научных кругах не утихали споры, не навредит ли человеку отказ от животной пищи. Один лагерь утверждал, что отказаться никак невозможно. Потому что именно белки животного происхождения считаются полноценными: в их составе можно найти все незаменимые аминокислоты.
Второй лагерь приводил в доказательство пример самых сильных животных на земле: носорогов, бегемотов и слонов. Они питаются только растительной пищей, а значит, получают исключительно растительные протеины. Согласитесь, выглядят они абсолютно здоровыми существами.
Да, в растительной пище сразу все незаменимые аминокислоты не найти, но если рацион разнообразный, в нем сочетаются бобовые, злаки, овощи и фрукты, то человек будет обеспечен всем необходимым.
Важно! Незаменимыми аминокислоты называются потому, что они не синтезируются организмом. А не потому, что их нельзя заменить.
Наверняка, как это обычно и бывает, истина где-то посередине.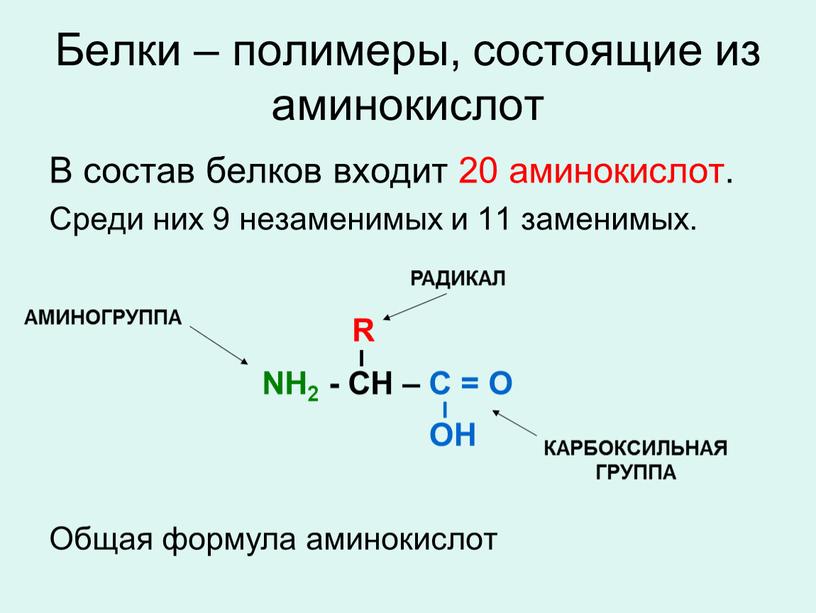 И для полноценного функционирования надо употреблять оба вида белка. Но бывает, что человек по каким-то причинам полностью или частично отказывается от животного белка. Сознательно, если переходит на вегетарианский или веганский тип питания. Или вынужденно, если этого требуют медицинские показания. И, конечно, многие не употребляют животный белок во время Поста.
И для полноценного функционирования надо употреблять оба вида белка. Но бывает, что человек по каким-то причинам полностью или частично отказывается от животного белка. Сознательно, если переходит на вегетарианский или веганский тип питания. Или вынужденно, если этого требуют медицинские показания. И, конечно, многие не употребляют животный белок во время Поста.
В чем польза растительного белка?
– В растительных продуктах, содержащих большое количество протеинов, также много и клетчатки. Она влияет на работу кишечника и состав его микрофлоры, выводит токсины и холестерин, нормализует уровень глюкозы, создает чувство сытости.
– Растительные белки усваиваются быстрее и легче, чем животные, и не перегружают организм. Знакомо чувство, когда на обед вы съели сочный стейк и вам хочется поспать? Это ваш организм бросил все силы на переваривание мяса, для чего нужно четыре часа. Организму все равно, что до окончания рабочего дня еще далеко.
– Растительная пища богата витаминами, микро и макроэлементами, некоторых из которых в продуктах животного происхождения даже попросту нет.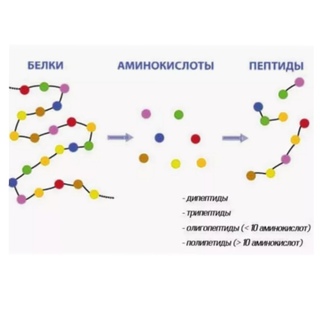
– В растительной пище нет насыщенных жиров и холестерина, которые особо опасны для людей с избыточным весом и болезнями сердечно-сосудистой системы.
В чем вред растительного белка?
Переход полностью на постный белок далеко не всегда бывает безопасным для организма. Не стоит забывать, что большинство из нас живет в бешеном ритме и бесконечно испытывает стресс. Часто отказ от продуктов животного происхождения вызывает анемию. Кожа и волосы тоже могут пострадать. Конечно, бывает аллергия и на определенные продукты, содержащие растительный белок.
Откуда получать растительный белок?
Чемпион по содержанию растительного белка (36% на 100 г) и практически всего списка аминокислот – это соя. Из незаменимых в ней отсутствует только метионин. Не зря тофу, сыр из соевого молока, называют мясом без костей. Добавляйте его в салаты, гарниры и в выпечку.
На втором месте прочно утвердились бобовые. Так же, как и соя, они считаются наиболее полноценной заменой мясу. В арахисе – 25 г, в красной фасоли, маше и желтой чечевице его 24 г, в зеленой чечевице и в черной фасоли – 22 г, в горохе и в красной чечевице – 20 г, в нуте – 19 г. Бобовые популярны в блюдах всех кухонь мира. Вы тоже можете совершить увлекательное кулинарное путешествие, приготовив марокканский суп, итальянскую лазанью из цукини с чечевицей и эстрагоном, закуску из красной фасоли по-грузински, мексиканское гуакомоле с красной фасолью на кукурузных чипсах или карпатские голубцы с картопляниками, фасолью и грибами в томатном соусе.
В арахисе – 25 г, в красной фасоли, маше и желтой чечевице его 24 г, в зеленой чечевице и в черной фасоли – 22 г, в горохе и в красной чечевице – 20 г, в нуте – 19 г. Бобовые популярны в блюдах всех кухонь мира. Вы тоже можете совершить увлекательное кулинарное путешествие, приготовив марокканский суп, итальянскую лазанью из цукини с чечевицей и эстрагоном, закуску из красной фасоли по-грузински, мексиканское гуакомоле с красной фасолью на кукурузных чипсах или карпатские голубцы с картопляниками, фасолью и грибами в томатном соусе.
Бернард Шоу был вегатарианцем. Когда ему исполнилось 70 лет, в интервью его спросили, как он себя чувствует. Он ответил, что прекрасно и было бы еще лучше, если бы ему не докучали врачи, которые обещали ему скорую смерть, если он не будет есть мяса. На аналогичный вопрос журналиста через двадцать лет обладавший великолепным чувством юмора писатель ответил: «Чувствую себя превосходно! Вы знаете, все врачи, которые утверждали, что я умру, если не буду есть мяса, — сами давно уже умерли, так что меня теперь никто уже не беспокоит!»
На одной строчке с бобовыми находятся и орехи – в них белка не меньше. В кешью и миндале – 20 г, в грецких – 12 г. В них много витаминов и минералов, и они подходят диабетикам, так как имеют низкий гликемический индекс. Но надо помнить, что можно поправиться, если есть орехи, не зная меры: они весьма калорийны. Несколько орехов утром в кашу или днем в салат будут отличным источником протеина. А еще орехи можно употреблять в качестве перекуса в течение дня.
В кешью и миндале – 20 г, в грецких – 12 г. В них много витаминов и минералов, и они подходят диабетикам, так как имеют низкий гликемический индекс. Но надо помнить, что можно поправиться, если есть орехи, не зная меры: они весьма калорийны. Несколько орехов утром в кашу или днем в салат будут отличным источником протеина. А еще орехи можно употреблять в качестве перекуса в течение дня.
Злаковые и продукты из них: овсянка, гречка, рис, перловка, киноа, булгур, кус-кус – награждаются бронзой за третье место. В них 10-12 г белка. И здесь же с 9 г кукуруза. Также из злаковых организм получает медленные углеводы и клетчатку.
Зеленые овощи, конечно, не могут тягаться с бобовыми и орехами по содержанию белков, однако белки в них есть – и для овощей вполне в хорошем количестве. Зеленый горошек – 5 г, брокколи и шпинат – 3 г, авокадо и спаржа – 2 г. Ну а витаминами, если будете есть много зеленых овощей, вы обогатитесь по полной.
Чтобы получить больше белка, готовьте блюда, где используется два и более представителя зеленых овощей. Например, шпинат с брокколи, булгур со спаржей и зеленым горошком, теплый салат из дикого риса, брокколи, авокадо и кедровыми орехами.
Например, шпинат с брокколи, булгур со спаржей и зеленым горошком, теплый салат из дикого риса, брокколи, авокадо и кедровыми орехами.
Что еще надо знать о белке
Суточная доза белка может быть получена из разных продуктов. Не стоит съедать килограмм брокколи. Как минимум это скучно. Человеку важно получить не просто определенное количество протеинов. Нам требуется именно аминокислоты. Питайтесь разнообразно – и тогда вы получите идеальный комплекс аминокислот. Допустим отсутствующие аминокислоты в рисе вы найдете в бобовых. Диетологи вообще советуют соединять в блюде бобовые и злаки – так они лучше усваиваются.
Исторически индейцы питались маисом, бобовыми и рисом, кавказские народы – фасолью и мамалыгой (кукурузной кашей), а японцы и китайцы – рисом и соей. И все эти народы славились прекрасной физической формой.
Сколько белков нужно вашему организму и откуда их лучше брать
- Джессика Браун
- BBC Future
Автор фото, iStock
Некоторые эксперты заявляют, что покупать продукты с повышенным содержанием белков (и по повышенной цене) — это все равно, что спускать деньги в унитаз. Правы ли они?
Правы ли они?
Сколько белков нам на самом деле нужно? Помогают ли они избавиться от лишнего веса? И кому они вообще помогают?
В начале ХХ века канадский исследователь Арктики, этнограф и писатель Вильялмур Стефанссон принял решение в течение пяти лет есть только мясо. Соответственно, его рацион в те годы состоял примерно на 80% из жиров и на 20% из белков.
Двадцать лет спустя, в 1928 году, он повторил эксперимент под наблюдением специалистов из знаменитой нью-йоркской больницы Бельвью, но ограничился одним годом.
Стефанссон хотел опровергнуть мнение, что на одном мясе человек не выживет.
Но в ходе обоих экспериментов ему быстро становилось плохо, если он какое-то время потреблял только нежирное мясо.
У него развивалось так называемое белковое отравление, которое прозвали «истощением от крольчатины».
Симптомы исчезали, когда он изменял рацион — начинал есть меньше белков и больше жиров.
После тех экспериментов, живя в Нью-Йорке и потребляя типичный американский рацион со средним содержанием белков, Стефанссон начал жаловаться на ухудшение здоровья.
Он вернулся к своей диете — с ограничением углеводов и высоким содержанием жиров и белков — и прожил на ней до 83 лет.
Так или иначе, его первые эксперименты — одни из немногих формальных научных доказательств того, что высокобелковая диета может быть очень вредной.
Автор фото, Getty Images
Подпись к фото,Производители протеиновых добавок советуют выпивать после тренировки протеиновый коктейль, чтобы мышечные ткани восстанавливались и росли
Несмотря на большую популярность протеиновых пищевых добавок, многие из нас до сих пор точно не знают, сколько белков нам нужно, как именно их потреблять и чем грозит их дефицит или избыток в организме.
Белки на авансцене
За последние двадцать лет уровень ожирения среди британцев повысился вдвое, и многие начинают более сознательно подходить к питанию. Мы заменяем белый хлеб черным и цельнозерновым, а обычное молоко — обезжиренным.
Мы заменяем белый хлеб черным и цельнозерновым, а обычное молоко — обезжиренным.
В маркетинговом шоу о здоровом образе жизни белки исполняют главную роль: полки супермаркетов пестрят протеиновыми батончиками, протеиновыми шариками и повседневными продуктами, обогащенными белками — от зерновых хлопьев до супов.
В 2016 году объем глобального рынка протеиновых пищевых добавок составлял примерно 12,4 млрд долларов. Очевидно, нас убедили, что чем больше белков — тем лучше.
А сколько их надо?
Впрочем, некоторые эксперты сейчас заявляют, что покупать продукты с повышенным содержанием белков (и по повышенной цене) — это выбрасывать деньги на ветер.
Давайте разберемся. Белки необходимы для роста и восстановления клеток тела. Белковая пища — мясо, рыба, яйца, молочные продукты и бобовые — в желудке расщепляется на аминокислоты и поглощается тонким кишечником; потом печень решает, какие из аминокислот нужны организму.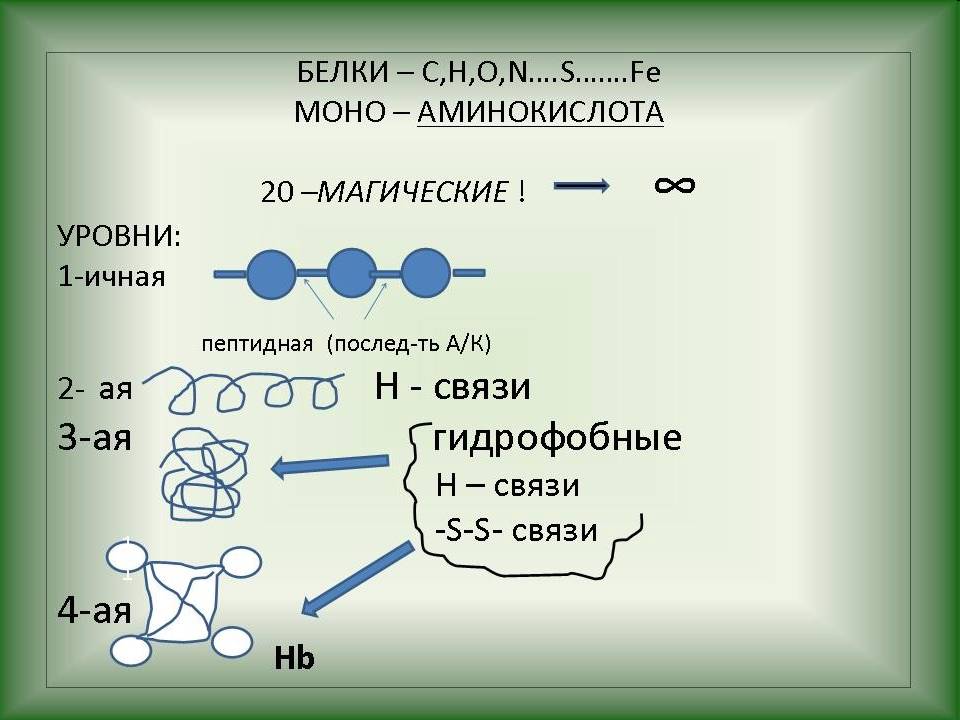 Остальные вымываются с мочой.
Остальные вымываются с мочой.
Автор фото, iStock
Подпись к фото,Покупаете белковые добавки? Рискуете выбросить деньги на ветер
Взрослым, чей образ жизни не особо активен, советуют ежедневно потреблять примерно 0,75 г белков на килограмм массы тела.
В среднем это 55 г для мужчин и 45 г для женщин. Их можно получить из двух порций (размером в ладонь) таких продуктов как мясо, рыба, тофу, орехи или бобовые.
Если белков недостаточно, у человека могут выпадать волосы, появляться сыпь на коже или снижаться вес из-за потери мышечной массы.
Но такие побочные эффекты встречаются очень редко, в основном у тех, кто страдает от пищевых расстройств.
Белки для шварценеггеров
Для большинства из нас белки ассоциируются с бодибилдингом. Так и есть.
Силовые упражнения приводят к расщеплению белков в мышцах. Чтобы мышцы крепли, белки должны возобновляться.
Особенно важную роль в запуске процессов синтеза белков играет аминокислота под названием лейцин.
Автор фото, Getty Images
Подпись к фото,Многие потребляют продукты спортивного питания, например, протеиновые батончики и коктейли
Некоторые специалисты даже считают, что, если не поесть после тренировки богатой белками пищи или специальных добавок, мышцы не вырастут.
Производители добавок советуют выпивать после тренировки протеиновый коктейль — обычно на основе богатого лейцином сывороточного белка, побочного продукта производства сыра.
Потребители, судя по всему, соглашаются. Согласно отчету, опубликованному в 2017 году исследовательской компанией Mintel, 27% британцев потребляют продукты спортивного питания — такие как протеиновые батончики и коктейли.
Эта цифра возрастает до 39% среди тех, кто тренируется чаще одного раза в неделю.
Но более половины (63%) из тех, кто потребляет упомянутые продукты, не могут точно сказать, есть ли от них польза.
Так помогают или нет?
Исследования того, насколько протеиновые добавки помогают нарастить мышцы, показывают неоднозначные результаты.
В частности, в 2014 году ученые проанализировали 36 научных статей на эту тему и пришли к выводу: протеиновые добавки не влияют на нежировую массу тела и силу мышц в течение первых нескольких недель силовых тренировок у людей, которые ранее не занимались спортом.
Со временем, когда тренировки становятся интенсивнее, добавки действительно могут способствовать наращиванию мышц. Однако авторы отмечают, что такие изменения не исследовались в долгосрочной перспективе.
Другое исследование за 2012 год говорит, что протеин «улучшает результативность тренировок, способствует восстановлению и увеличивает нежировую массу тела», но в нем отмечается: для лучших результатов белки следует потреблять вместе с быстрыми углеводами.
Обычные сладкие батончики?
И — внимание! — если спортсменам и посетителям тренажерных залов полезно быстрое «вливание» белков в организм сразу после тренировки, это не значит, что обязательно употреблять добавки и коктейли.
Большинство людей и так получает основную часть рекомендованного дневного количества белков из обычной пищи, говорит Кевин Типтон, преподаватель физической культуры из Университета Стерлинга.
«В добавках нет необходимости. Это удобный способ получить протеин, но в них нет ничего такого, чего не получишь из обычной еды. Протеиновые батончики — это обычные сладкие батончики с несколько большим содержанием белков».
Автор фото, Getty Images
Подпись к фото,В 2016 году объем всемирного рынка протеиновых пищевых добавок составлял 12,4 млрд долларов
Типтон добавляет, что даже для культуристов сывороточный белок и другие подобные вещества не столь важны, как это нам пытаются подать.
«Внимание слишком смещено на то, какие добавки употреблять, но на самом деле важнее идти в зал и тренироваться. Важное значение для результата имеют и другие переменные, такие как сон, диета и уровень стресса», — подчеркивает он.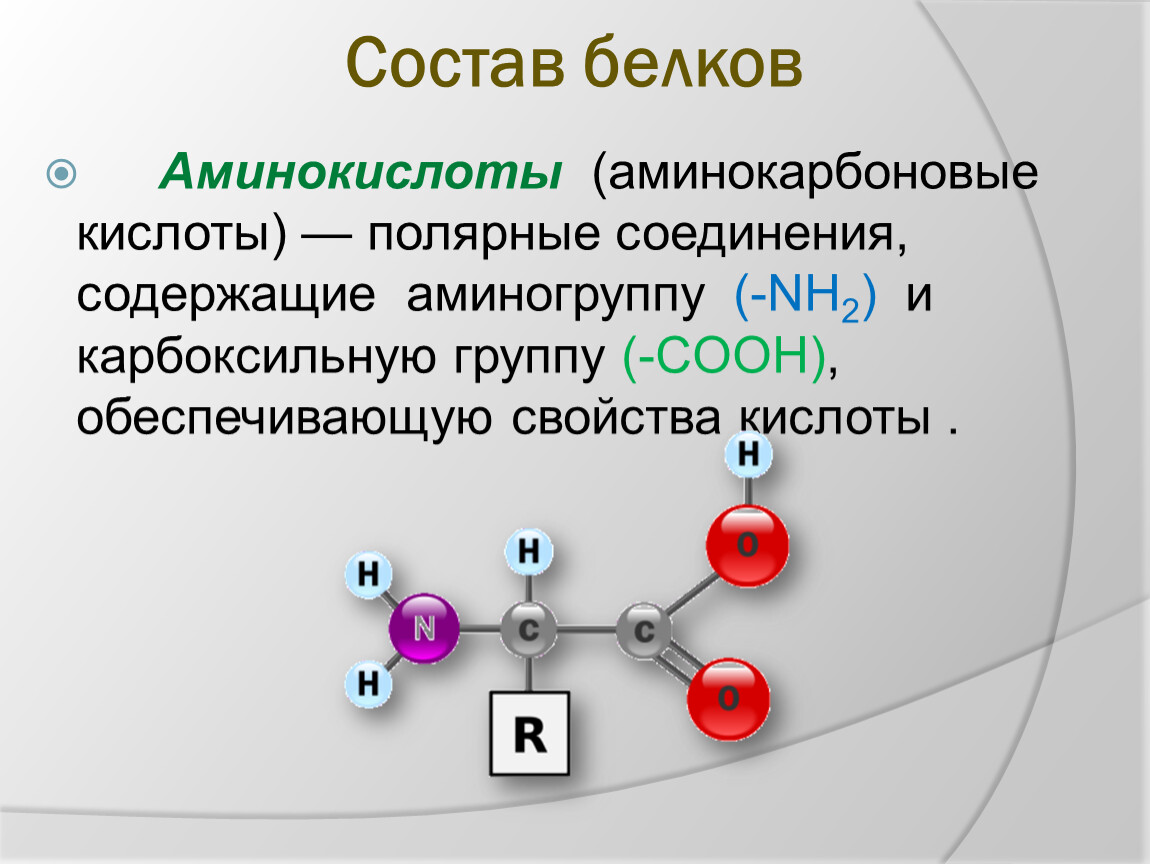
Большинство экспертов согласно с Типтоном: белки лучше получать из пищи, а не из добавок. Но есть определенные исключения — в частности, спортсмены, которым трудно достигать ежедневной цели в потреблении белков, отмечает Грэм Клоуз, профессор физиологии Ливерпульского университета имени Джона Мурса.
«По моему мнению, потребности большинства из них превышают рекомендованную дневную норму, и этому есть доказательства», — говорит он. В таком случае коктейль может быть полезным.
Кому еще необходимы белки?
Какой еще демографической группе не помешают дополнительные белки? Пожилым людям. Потому что с возрастом мы нуждаемся в большем количестве белков для поддержания той же мышечной массы.
В то же время пожилые люди склонны потреблять меньше белков, потому что их вкусы часто сдвигаются в сторону расположения к сладкому.
Автор фото, Getty Images
Подпись к фото,Мы как правило получаем большую часть рекомендованного дневного количества белка из своего обычного рациона
Эмма Стивенсон, профессор физической культуры с Ньюкаслского университета, пытается договориться с производителями продуктов питания о повышении содержания белков в изделиях, которые часто покупают пожилые люди, например, в печенье.
«С возрастом нам нужно особенно тщательно сохранять свою мышечную массу, ведь мы становимся слабыми и менее активными», — говорит она.
Клоуз утверждает, что пожилые люди должны повысить потребление белков до 1,2 г на килограмм массы тела.
Можно ли их переесть?
К счастью, употребить слишком много белков очень сложно. Хотя верхний лимит существует, его «практически невозможно» достичь, считает Типтон.
«Некоторые диетологи обеспокоены, что высокобелковая диета может навредить почкам и костям, но доказательств тому очень мало, если речь идет о вполне здоровых людях».
«Возможно, проблемы и возникнут, если человек с больными почками будет есть большое количество белков; но любые плохие последствия очень маловероятны».
Впрочем, хотя белки сами по себе не вредны, белковые добавки часто содержат значительное количество углеводов из группы FODMAP, а те в свою очередь вызывают расстройства пищеварения: вздутие живота, метеоризм, боль в желудке.
Стивенсон советует внимательно читать информацию на этикетках пищевых добавок, батончиков и шариков.
«Часто они очень калорийны и содержат огромное количество углеводов, нередко в форме сахара. Не следует думать, что «высокое содержание протеина» автоматически означает здоровую пищу», — говорит она.
Помогают ли они похудеть?
Белки давно связывают с похудением; высокобелковые и низкоуглеводные диеты (например, палеодиета или диета Аткинса) обещают продлить ощущение сытости.
Людям часто не удается похудеть, потому что они чувствуют голод и едят. Как показали исследования с использованием МРТ, высокобелковый завтрак способствует уменьшению аппетита в течение дня.
Есть достаточно доказательств того, что белки хорошо утоляют голод, говорит Алекс Джонстоун с Абердинского университета. Если вы пытаетесь похудеть, то важнее есть высокобелковые завтраки (например, тост с фасолью или молочный коктейль), чем принимать добавки.
Но она не защищает диету Аткинса и обнаружила в своем исследовании, что исключение из рациона углеводов негативно сказывается на здоровье кишечника (а мы знаем, что здоровый кишечник критически важен для многих аспектов нашего здоровья и благополучия).
Автор фото, Getty Images
Подпись к фото,Протеиновые шарики часто высококалорийны и содержат огромное количество углеводов
Джонстоун рекомендует людям с избыточным весом поддерживать рацион, богатый белками и умеренно богатый углеводами: 30% белков, 40% углеводов и 30% жиров.
Для сравнения: людям без лишнего веса рекомендуют потреблять в среднем 15% белков, 55% углеводов и 30% жиров.
Конечно же, вы не похудеете, если только увеличите потребление белков. Важный ключ к успеху — есть курятину, другое нежирное мясо или рыбу.
Есть ли риски и как их избежать?
Исследования также показывают, что потребление большого количества животных белков способствует набору веса, а красное мясо повышает риск рака и сердечных заболеваний.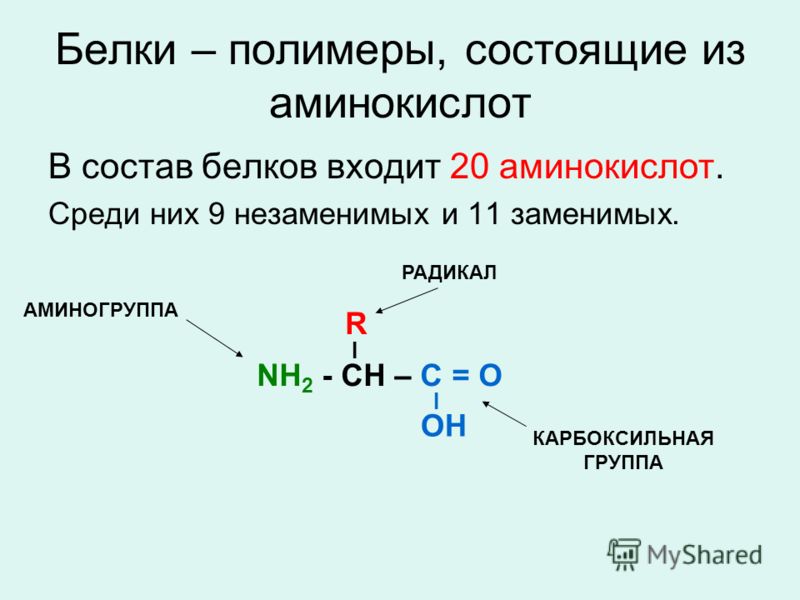
Однако существуют полезные белки не мясного происхождения, например, микопротеин — грибной белок.
На его основе в Британии выпустили заменитель мяса под маркой Quorn — в нем много не только белков, но и клетчатки. Сейчас исследователи изучают, как эта уникальная комбинация влияет на ощущение сытости и уровень инсулина, связанный с диабетом второго типа.
Автор фото, iStock
Подпись к фото,Употребить слишком много белков трудно. Но нужно ли это вам вообще?
Одна исследовательская группа сравнила микопротеиновую диету с диетой на основе курятины и установила: у тех, кто ел Quorn, контроль над содержанием сахара был такой же, но при этом от поджелудочной железы требовалось производить меньше инсулина.
Риск употребить избыточное количество белков небольшой. Но лучше не обольщаться эффективностью продуктов с завышенной ценой, в которых предлагается больше белков, чем нам нужно.
«Некоторые продукты, обозначенные как «высокобелковые», на самом деле таковыми не являются, но стоят довольно дорого», — говорит Джонстоун.
«Как бы там ни было, потреблять больше белков, чем вам нужно, — это расточительство. Это все равно, что спускать деньги в унитаз».
Прочитать оригинал этой статьи на английском языке можно на сайте BBC Future.
Структура белка | Изучайте науку в Scitable
Строительными блоками белков являются аминокислоты, которые представляют собой небольшие органические молекулы, состоящие из альфа (центрального) атома углерода, связанного с аминогруппой, карбоксильной группы, атома водорода и вариабельного компонента, называемого боковой цепью (см. Ниже ). Внутри белка несколько аминокислот связаны между собой пептидными связями , тем самым образуя длинную цепь. Пептидные связи образуются в результате биохимической реакции, которая извлекает молекулу воды, поскольку она соединяет аминогруппу одной аминокислоты с карбоксильной группой соседней аминокислоты.Линейная последовательность аминокислот в белке считается первичной структурой белка.
Белки состоят из набора всего из двадцати аминокислот, каждая из которых имеет уникальную боковую цепь. Боковые цепи аминокислот имеют разный химический состав. Самая большая группа аминокислот имеет неполярные боковые цепи. Некоторые другие аминокислоты имеют боковые цепи с положительными или отрицательными зарядами, в то время как другие имеют полярные, но незаряженные боковые цепи. Химический состав боковых цепей аминокислот имеет решающее значение для структуры белка, потому что эти боковые цепи могут связываться друг с другом, чтобы удерживать длину белка в определенной форме или конформации.Боковые цепи заряженных аминокислот могут образовывать ионные связи, а полярные аминокислоты способны образовывать водородные связи. Гидрофобные боковые цепи взаимодействуют друг с другом посредством слабых ван-дер-ваальсовых взаимодействий. Подавляющее большинство связей, образованных этими боковыми цепями, нековалентны. Фактически, цистеины — единственные аминокислоты, способные образовывать ковалентные связи, что они и делают со своими конкретными боковыми цепями.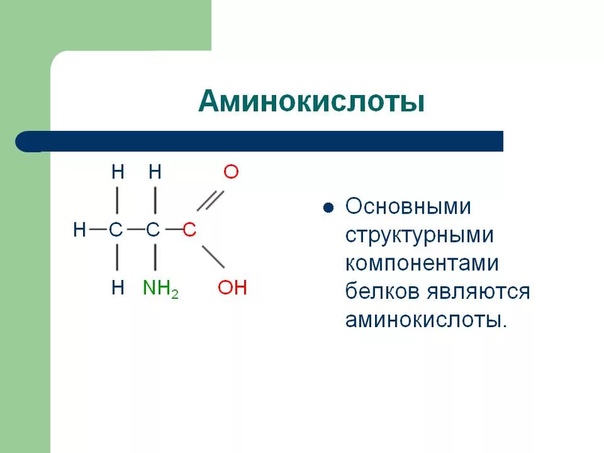 Из-за взаимодействий боковых цепей последовательность и расположение аминокислот в конкретном белке определяют, где в этом белке происходят изгибы и складки (рис. 1).
Из-за взаимодействий боковых цепей последовательность и расположение аминокислот в конкретном белке определяют, где в этом белке происходят изгибы и складки (рис. 1).
Рис. 1: Взаимосвязь между боковыми цепями аминокислот и конформацией белка
Определяющим признаком аминокислоты является ее боковая цепь (вверху, синий кружок; внизу, все цветные кружки). Когда аминокислоты соединяются серией пептидных связей, они образуют полипептид, другое слово для обозначения белка. Затем полипептид сворачивается в определенную конформацию в зависимости от взаимодействий (пунктирные линии) между его боковыми аминокислотными цепями.
Рисунок 2: Структура белка бактериородопсина
Бактериородопсин — это мембранный белок бактерий, который действует как протонный насос. Его форма важна для его функции. Общая структура белка включает как альфа-спирали (зеленый), так и бета-листы (красный).
Первичная структура белка — его аминокислотная последовательность — управляет складыванием и внутримолекулярным связыванием линейной аминокислотной цепи, что в конечном итоге определяет уникальную трехмерную форму белка. Водородная связь между аминогруппами и карбоксильными группами в соседних областях белковой цепи иногда вызывает определенные паттерны сворачивания. Эти стабильные паттерны сворачивания, известные как альфа-спирали и бета-листов , составляют вторичную структуру белка.Большинство белков содержат несколько спиралей и листов в дополнение к другим, менее распространенным паттернам (рис. 2). Совокупность образований и складок в единой линейной цепи аминокислот — иногда называемой полипептидом — составляет третичную структуру белка. Наконец, четвертичная структура белка относится к тем макромолекулам с множеством полипептидных цепей или субъединиц.
Водородная связь между аминогруппами и карбоксильными группами в соседних областях белковой цепи иногда вызывает определенные паттерны сворачивания. Эти стабильные паттерны сворачивания, известные как альфа-спирали и бета-листов , составляют вторичную структуру белка.Большинство белков содержат несколько спиралей и листов в дополнение к другим, менее распространенным паттернам (рис. 2). Совокупность образований и складок в единой линейной цепи аминокислот — иногда называемой полипептидом — составляет третичную структуру белка. Наконец, четвертичная структура белка относится к тем макромолекулам с множеством полипептидных цепей или субъединиц. Окончательная форма, принятая вновь синтезированным белком, обычно является наиболее энергетически выгодной.Когда белки сворачиваются, они тестируют множество конформаций, прежде чем достичь своей окончательной формы, которая является уникальной и компактной. Сложенные белки стабилизируются тысячами нековалентных связей между аминокислотами. Кроме того, химические силы между белком и его непосредственным окружением способствуют формированию и стабильности белка. Например, белки, растворенные в цитоплазме клетки, имеют на своей поверхности гидрофильные (водолюбивые) химические группы, тогда как их гидрофобные (водоотталкивающие) элементы имеют тенденцию скрываться внутри.Напротив, белки, которые вставлены в клеточные мембраны, имеют на своей поверхности некоторые гидрофобные химические группы, особенно в тех областях, где поверхность белка подвергается воздействию липидов мембран. Однако важно отметить, что полностью свернутые белки не принимают форму. Скорее, атомы в этих белках остаются способными совершать небольшие движения.
Кроме того, химические силы между белком и его непосредственным окружением способствуют формированию и стабильности белка. Например, белки, растворенные в цитоплазме клетки, имеют на своей поверхности гидрофильные (водолюбивые) химические группы, тогда как их гидрофобные (водоотталкивающие) элементы имеют тенденцию скрываться внутри.Напротив, белки, которые вставлены в клеточные мембраны, имеют на своей поверхности некоторые гидрофобные химические группы, особенно в тех областях, где поверхность белка подвергается воздействию липидов мембран. Однако важно отметить, что полностью свернутые белки не принимают форму. Скорее, атомы в этих белках остаются способными совершать небольшие движения.
Несмотря на то, что белки считаются макромолекулами, они слишком малы, чтобы их можно было визуализировать даже в микроскоп.Итак, ученые должны использовать косвенные методы, чтобы выяснить, как они выглядят и как сложены. Наиболее распространенным методом исследования структуры белков является рентгеновская кристаллография .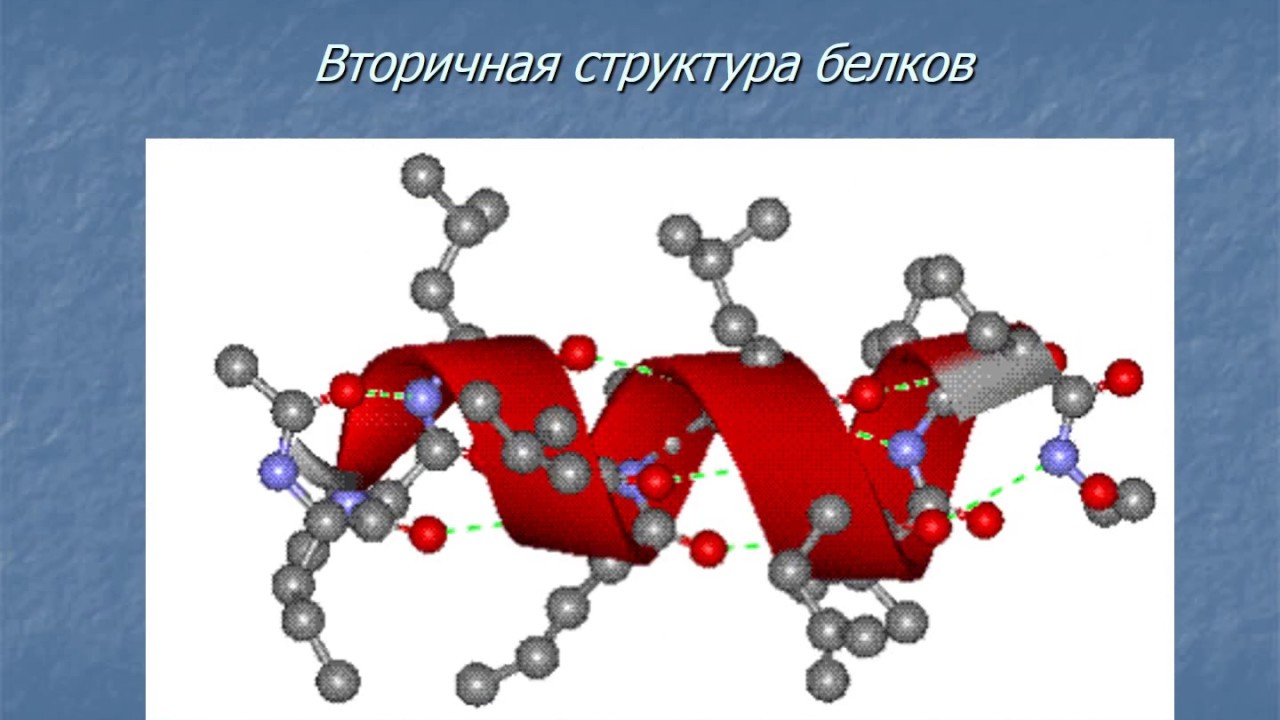 С помощью этого метода твердые кристаллы очищенного белка помещаются в пучок рентгеновских лучей, и картина отклоненных рентгеновских лучей используется для прогнозирования положений тысяч атомов в кристалле белка.
С помощью этого метода твердые кристаллы очищенного белка помещаются в пучок рентгеновских лучей, и картина отклоненных рентгеновских лучей используется для прогнозирования положений тысяч атомов в кристалле белка.
20 аминокислот, входящих в состав белков | Улучшение жизни с помощью аминокислот | О нас | Глобальный веб-сайт Ajinomoto Group
Как известно, различные аминокислоты являются основными компонентами, из которых состоят белки.Аминокислоты составляют важную часть человеческого тела и диеты. Они чрезвычайно важны для правильного функционирования человеческого тела; следовательно, важно понимать, сколько аминокислот составляют белки. Давайте перейдем к выяснению, сколько аминокислот действительно составляют белки.
Сколько аминокислот помогает вырабатывать белки?
В природе идентифицировано около 500 аминокислот, но только 20 аминокислот составляют белки, обнаруженные в организме человека. Давайте узнаем обо всех этих 20 аминокислотах и типах различных аминокислот.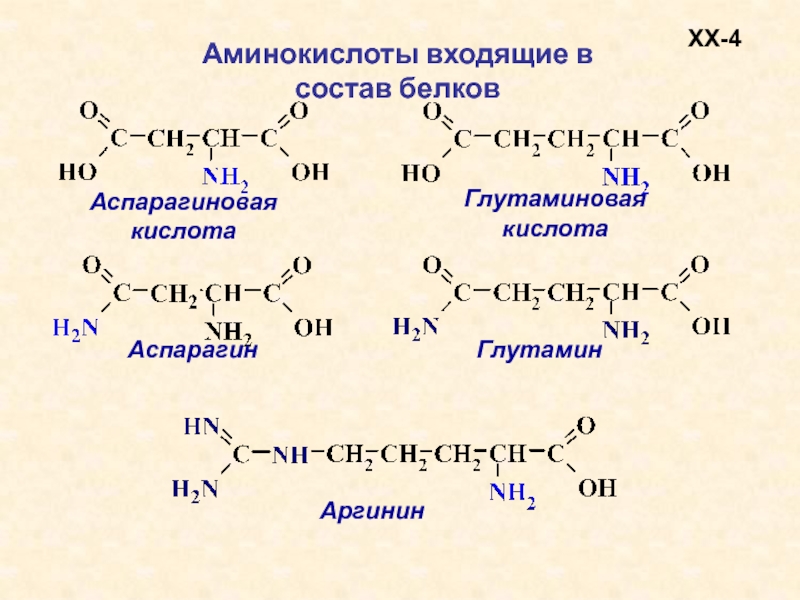
Типы всех аминокислот
Все 20 аминокислот подразделяются на две разные аминокислотные группы. Незаменимые и заменимые аминокислоты вместе составляют 20 аминокислот. Из 20 аминокислот 9 являются незаменимыми аминокислотами, а остальные — заменимыми аминокислотами. Давайте посмотрим на каждую аминокислоту в соответствии с их классификацией.
Незаменимые аминокислоты
BCAA (валин, лейцин и изолейцин)
Аминокислоты с разветвленной цепью (BCAA) представляют собой группу из трех аминокислот (валин, лейцин и изолейцин), которые имеют молекулярную структуру с разветвлением.BCAA богаты мышечными белками, стимулируют рост мышц в организме и обеспечивают энергию во время упражнений.
Лизин
Лизин — одна из наиболее часто упоминаемых незаменимых аминокислот. Такие продукты, как хлеб и рис, как правило, содержат мало лизина. Например, по сравнению с идеальным аминокислотным составом в пшенице мало лизина. Университет Организации Объединенных Наций провел исследование людей в развивающихся странах, которые зависят от пшеницы как источника белка, и обнаружил нехватку лизина в их рационе. Недостаток лизина и других аминокислот может привести к серьезным проблемам, таким как задержка роста и тяжелые заболевания.
Недостаток лизина и других аминокислот может привести к серьезным проблемам, таким как задержка роста и тяжелые заболевания.
Треонин
Незаменимая аминокислота, которая используется для создания активного центра ферментов.
фенилаланин
Незаменимая аминокислота, которая используется для производства многих типов полезных аминов.
метионин
Незаменимая аминокислота, которая используется для производства множества различных веществ, необходимых организму.
Гистидин
Незаменимая аминокислота, используемая для производства гистамина.
Триптофан
Незаменимая аминокислота, используемая для производства многих типов полезных аминов.
Незаменимые аминокислоты
Глютамин
Глютамин — одна из самых распространенных аминокислот в организме. Глютамин защищает желудок и желудочно-кишечный тракт. В частности, глутамин используется для выработки энергии в желудочно-кишечном тракте. Глютамин способствует метаболизму алкоголя для защиты печени.
Глютамин способствует метаболизму алкоголя для защиты печени.
Аспартат
Аспартат — одна из аминокислот, наиболее пригодных для получения энергии.Аспартат — одна из аминокислот, наиболее близко расположенных к циклу трикарбоновой кислоты (ТСА) в организме, который производит энергию. Цикл TCA подобен двигателю, который приводит в движение автомобили. Каждая клетка нашего тела производит энергию.
Глутамат
Бульон комбу, используемый в японской кулинарии, содержит глутамат. Глутамат является основой умами, а свободный глутамат содержится в комбу, помидорах и сыре. Внутри организма глутамат используется как важный источник незаменимых аминокислот.
Аргинин
Аргинин играет важную роль в открытии вен для улучшения кровотока. Оксид азота, открывающий вены, сделан из аргинина. Аргинин — полезная аминокислота для удаления избытка аммиака из организма. Аргинин повышает иммунитет.
Аланин
Аланин поддерживает функцию печени. Аланин используется для производства глюкозы, необходимой организму. Аланин улучшает метаболизм алкоголя.
Аланин используется для производства глюкозы, необходимой организму. Аланин улучшает метаболизм алкоголя.
Proline
Пролин — одна из аминокислот, содержащихся в коллагене, который составляет ткань кожи.Пролин — одна из важнейших аминокислот естественного увлажняющего фактора (NMF), который сохраняет кожу влажной.
Цистеин
Цистеин уменьшает количество производимой черной пигментации меланина. Цистеин много в волосах на голове и теле. Цистеин увеличивает количество желтого меланина, производимого вместо черного меланина.
Аспарагин
Аминокислота, обнаруженная из спаржи. И аспарагин, и аспартат расположены близко к циклу трикарбоновой кислоты (TCA), который производит энергию.
Серин
Аминокислота, используемая для производства фосфолипидов и глицериновой кислоты.
Глицин
Незаменимая аминокислота, вырабатываемая в организме. В организме много глицина. Он действует как передатчик в центральной нервной системе и помогает регулировать такие функции организма, как движение и сенсорное восприятие.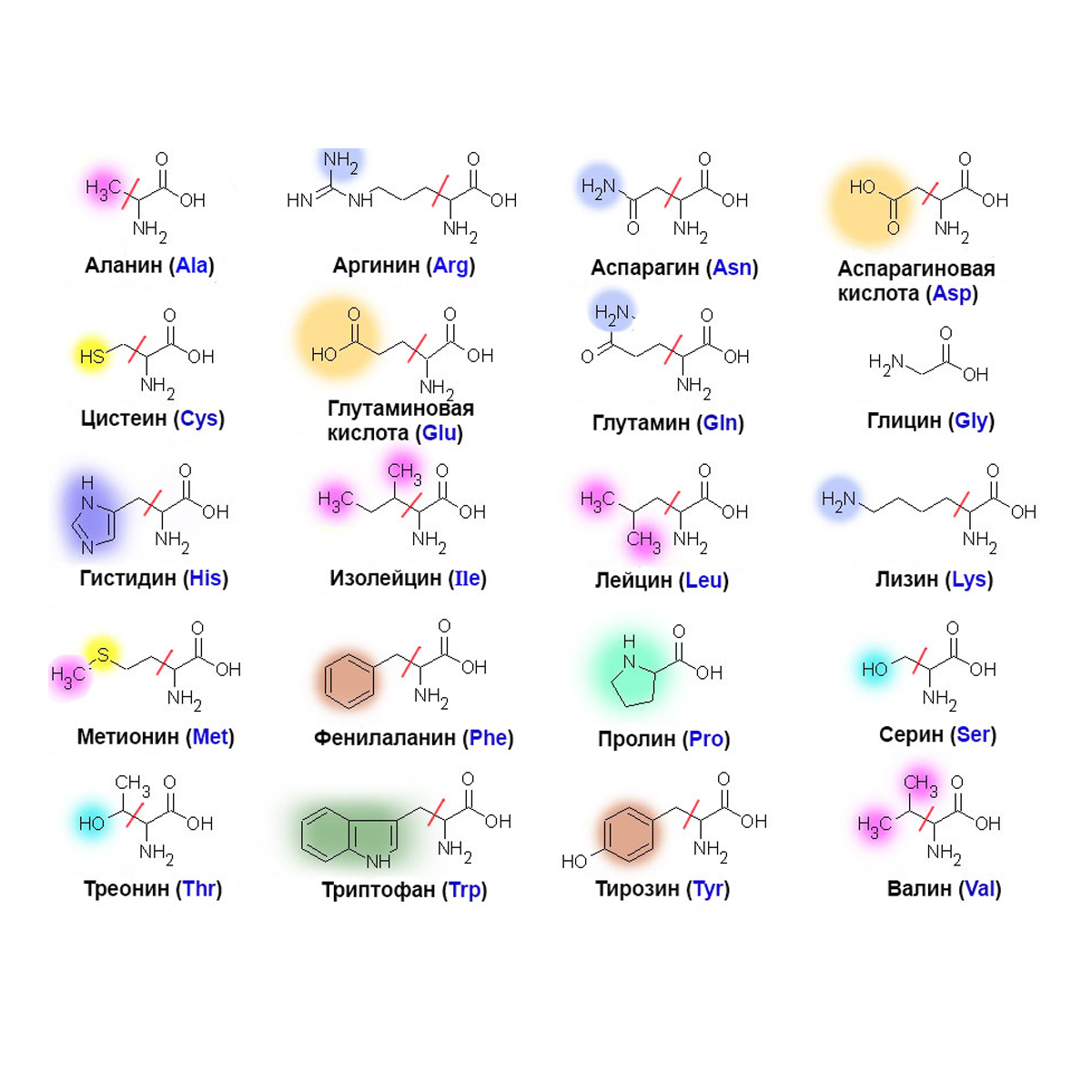 Глицин составляет одну треть коллагена.
Глицин составляет одну треть коллагена.
Тирозин
Тирозин используется для получения многих типов полезных аминов. Тирозин относится к группе ароматических аминокислот вместе с фенилаланином и триптофаном.
Контент, который может вам понравиться
Что такое аминокислоты?
Аминокислоты — незаменимые соединения, общие для всех живых существ, от микробов до человека. Все живые тела содержат одни и те же 20 типов аминокислот. Что такое …
Факты об аминокислотах
Часто задаваемые вопросы об аминокислотахОбщие вопросы об аминокислотахВ чем разница между аминокислотой и пептидом? Белки состоят из сотен…
Базовый
Структура Гли к Leu Asp к Gln Ала к Трп Тест
себя Автор
из 1 буквенных кодов | The Химия аминокислот Введение Аминокислоты играют центральную роль как строительные блоки белков, так и
как промежуточные звенья в метаболизме. 20 аминокислот, которые содержатся в
белки обладают широким спектром химической универсальности. В
точное содержание аминокислот и последовательность этих аминокислот
конкретный белок, определяется последовательностью оснований в
ген, кодирующий этот белок.Химические свойства аминокислот
белков определяют биологическую активность белка. Белки
не только катализируют все (или большую часть) реакций в живых клетках, они
контролировать практически все клеточные процессы. Кроме того, белки содержат
в их аминокислотных последовательностях необходимая информация для определения
как этот белок сворачивается в трехмерную структуру, и
устойчивость полученной конструкции. Когда мы узнаем об аминокислотах, важно помнить, что из наиболее важных причин для понимания структуры и свойств аминокислот уметь понимать структуру и свойства белка.Мы будем увидеть, что чрезвычайно сложные характеристики даже небольшого, относительно Простые белки — это совокупность свойств аминокислот, которые содержат белок. Верх 10 аминокислот, которые мы можем производить, это аланин, аспарагин, аспарагиновая кислота.
кислота, цистеин, глутаминовая кислота, глутамин, глицин, пролин, серин и
тирозин. Тирозин вырабатывается из фенилаланина, поэтому при дефиците в рационе
в фенилаланине также потребуется тирозин.Незаменимая аминокислота
кислоты — аргинин (необходим молодым, но не взрослым), гистидин,
изолейцин, лейцин, лизин, метионин, фенилаланин, треонин, триптофан,
и валин. Эти аминокислоты необходимы в рационе. Растения, конечно,
должен уметь производить все аминокислоты. С другой стороны, люди делают
не иметь всех ферментов, необходимых для биосинтеза всех
аминокислоты. Зачем изучать эти структуры
и свойства? | Атомы
в аминокислотах |
Незаменимые аминокислоты: таблица, сокращения и структура
Аминокислота Ala Аланин, обнаруженный в белке в 1875 году, составляет 30% остатков в шелке.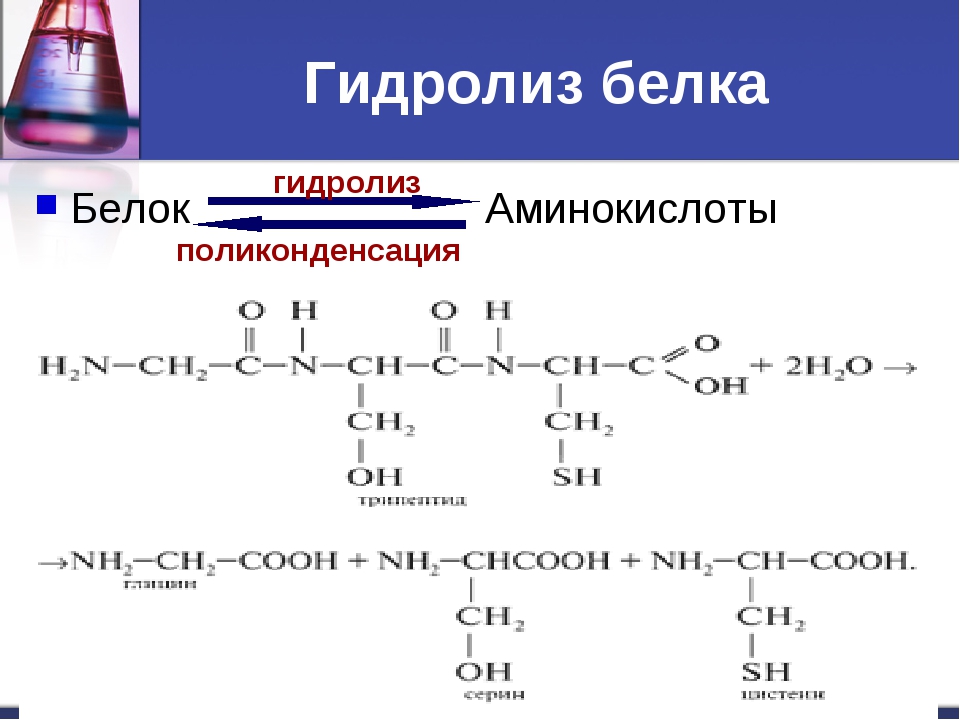 Его низкая реакционная способность способствует простой, удлиненной структуре шелка с небольшим количеством поперечных связей, что придает волокнам прочность, сопротивление растяжению и гибкость. В биосинтезе белков участвует только l-стереоизомер.
Его низкая реакционная способность способствует простой, удлиненной структуре шелка с небольшим количеством поперечных связей, что придает волокнам прочность, сопротивление растяжению и гибкость. В биосинтезе белков участвует только l-стереоизомер.
У человека аргинин вырабатывается при переваривании белков. Затем он может быть преобразован человеческим организмом в оксид азота, химическое вещество, которое, как известно, расслабляет кровеносные сосуды.
Благодаря своему сосудорасширяющему действию аргинин был предложен для лечения людей с хронической сердечной недостаточностью, высоким уровнем холестерина, нарушением кровообращения и высоким кровяным давлением, хотя исследования по этим направлениям все еще продолжаются.Аргинин также может быть произведен синтетически, и родственные аргинину соединения можно использовать для лечения людей с дисфункцией печени из-за их роли в стимулировании регенерации печени. Хотя аргинин необходим для роста, но не для поддержания организма, исследования показали, что аргинин имеет решающее значение для процесса заживления ран, особенно у людей с плохим кровообращением.
В 1806 году аспарагин был очищен из сока спаржи, что сделало его первой аминокислотой, выделенной из природного источника.Однако только в 1932 году ученые смогли доказать, что аспарагин присутствует в белках. Только l-стереоизомер участвует в биосинтезе белков млекопитающих. Аспарагин важен для удаления токсичного аммиака из организма.
Аминокислота AspОбнаруженная в белках в 1868 году аспарагиновая кислота обычно содержится в белках животных, однако только l-стереоизомер участвует в биосинтезе белков. Растворимость этой аминокислоты в воде обусловлена наличием рядом с активными центрами ферментов, таких как пепсин.
Аминокислота CysЦистеин особенно богат белками волос, копыт и кератином кожи, который был выделен из мочевого камня в 1810 году и из рога в 1899 году. Впоследствии он был химически синтезирован. и структура решена в 1903–1904 гг.
Серосодержащая тиоловая группа в боковой цепи цистеина является ключевой для его свойств, обеспечивая образование дисульфидных мостиков между двумя пептидными цепями (как в случае с инсулином) или образование петли в одной цепи, влияя на окончательную структуру белка. Две молекулы цистеина, связанные между собой дисульфидной связью, составляют аминокислоту цистин, которая иногда указывается отдельно в общих списках аминокислот. Цистеин вырабатывается в организме из серина и метионина и присутствует только в l-стереоизомере в белках млекопитающих.
Две молекулы цистеина, связанные между собой дисульфидной связью, составляют аминокислоту цистин, которая иногда указывается отдельно в общих списках аминокислот. Цистеин вырабатывается в организме из серина и метионина и присутствует только в l-стереоизомере в белках млекопитающих.
Люди с генетическим заболеванием цистинурия не могут эффективно реабсорбировать цистин в кровоток. Следовательно, в их моче накапливается высокий уровень цистина, где он кристаллизуется и образует камни, которые блокируют почки и мочевой пузырь.
Аминокислота Gln Глутамин был впервые выделен из свекольного сока в 1883 году, выделен из белка в 1932 году и впоследствии химически синтезирован в следующем году. Глютамин — самая распространенная в нашем организме аминокислота, которая выполняет несколько важных функций. У человека глутамин синтезируется из глутаминовой кислоты, и этот этап преобразования жизненно важен для регулирования уровня токсичного аммиака в организме, образуя мочевину и пурины.
Глутаминовая кислота была выделена из пшеничного глютена в 1866 году и химически синтезирована в 1890 году.Обычно встречается в белках животных, только l-стереоизомер встречается в белках млекопитающих, которые люди способны синтезировать из обычного промежуточного соединения α-кетоглутаровой кислоты. Мононатриевая соль l-глутаминовой кислоты, глутамат натрия (MSG) обычно используется в качестве приправы и усилителя вкуса. Карбоксильная боковая цепь глутаминовой кислоты может действовать как донор и акцептор аммиака, который токсичен для организма, обеспечивая безопасную транспортировку аммиака в печень, где он превращается в мочевину и выводится почками.Свободная глутаминовая кислота также может разлагаться до диоксида углерода и воды или превращаться в сахара.
Аминокислота Gly
Глицин был первой аминокислотой, выделенной из белка, в данном случае желатина, и единственной, которая не является оптически активной (без d- или l-стереоизомеров). ). Структурно простейшая из α-аминокислот, она очень инертна при включении в белки. Тем не менее, глицин играет важную роль в биосинтезе аминокислоты серина, кофермента глутатиона, пуринов и гема, жизненно важной части гемоглобина.
). Структурно простейшая из α-аминокислот, она очень инертна при включении в белки. Тем не менее, глицин играет важную роль в биосинтезе аминокислоты серина, кофермента глутатиона, пуринов и гема, жизненно важной части гемоглобина.
His-аминокислота
Гистидин был выделен в 1896 году, и его структура была подтверждена химическим синтезом в 1911 году. Гистидин является прямым предшественником гистамина, а также важным источником углерода в синтезе пуринов. При включении в белки боковая цепь гистидина может действовать как акцептор и донор протонов, передавая важные свойства при объединении с ферментами, такими как химотрипсин, и ферментами, участвующими в метаболизме углеводов, белков и нуклеиновых кислот.
Для младенцев гистидин считается незаменимой аминокислотой, взрослые могут в течение короткого времени обходиться без диетического питания, но по-прежнему считается незаменимой.
Иле-аминокислота
Изолейцин был выделен из сахарной патоки свеклы в 1904 году.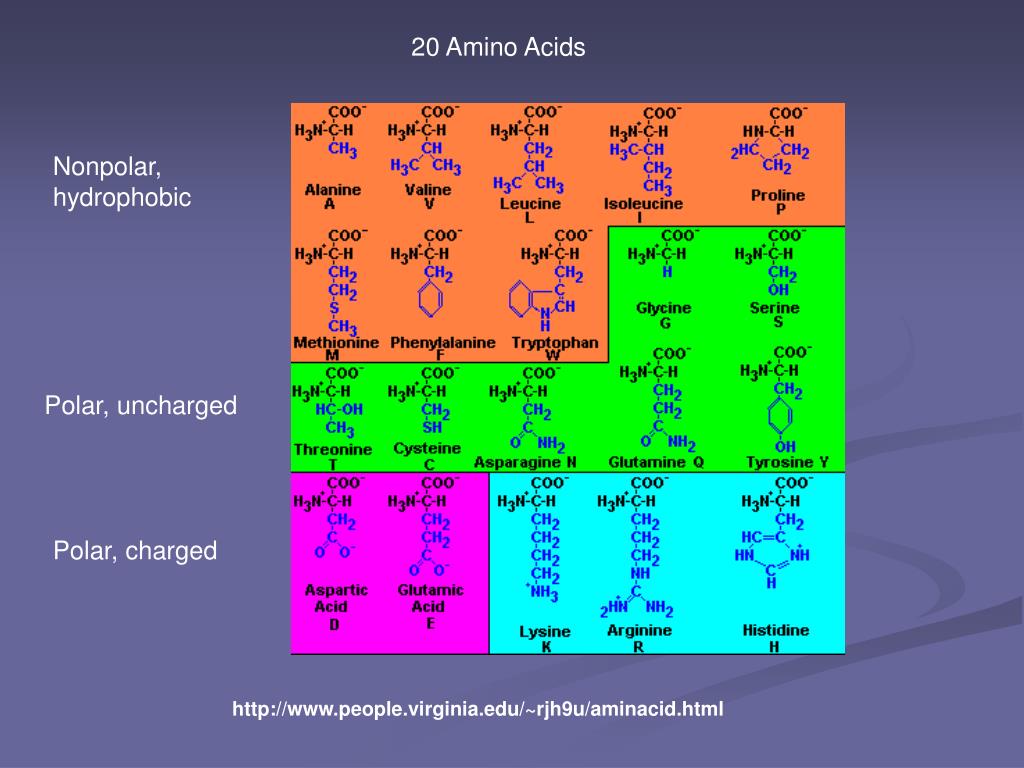 Гидрофобная природа боковой цепи изолейцина важна для определения третичной структуры белков, в которые он включен.
Гидрофобная природа боковой цепи изолейцина важна для определения третичной структуры белков, в которые он включен.
У тех, кто страдает редким наследственным заболеванием, называемым болезнью мочи кленового сиропа, есть дефектный фермент в пути разложения, который является общим для изолейцина, лейцина и валина.Без лечения метаболиты накапливаются в моче пациента, вызывая характерный запах, который и дал название состоянию.
Аминокислота Leu
Лейцин был выделен из сыра в 1819 году и из мышц и шерсти в кристаллическом состоянии в 1820 году. В 1891 году он был синтезирован в лаборатории.
Только l-стереоизомер присутствует в белке млекопитающих и может расщепляться на более простые соединения ферментами организма.Некоторые связывающие ДНК белки содержат области, в которых лейцины расположены в конфигурации, называемые лейциновыми застежками-молниями.
Аминокислота Lys
Лизин был впервые выделен из казеина молочного белка в 1889 году, а его структура была выяснена в 1902 году.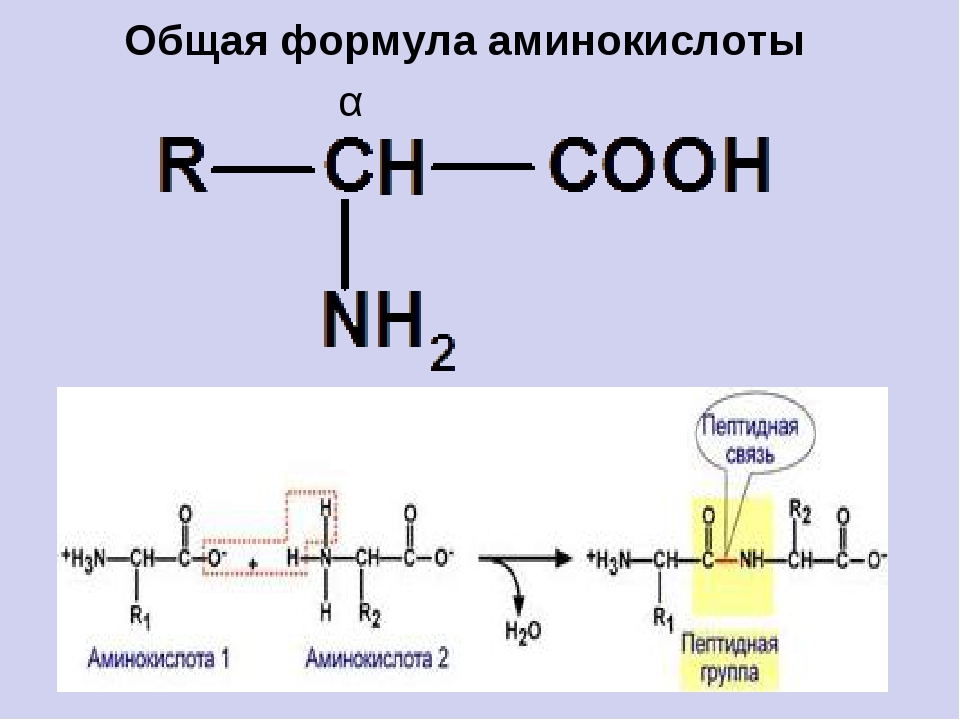 Лизин важен для связывания ферментов с коферментами и играет важную роль в способ функционирования гистонов.
Лизин важен для связывания ферментов с коферментами и играет важную роль в способ функционирования гистонов.
Многие зерновые культуры содержат очень мало лизина, что привело к его дефициту у некоторых групп населения, которые сильно зависят от них в продуктах питания, а также у вегетарианцев и людей, сидящих на низкожирной диете.Следовательно, были предприняты усилия по разработке штаммов кукурузы, богатых лизином.
Аминокислота Met
Метионин был выделен из казеина молочного белка в 1922 году, и его структура была решена путем лабораторного синтеза в 1928 году. Метионин является важным источником серы для многих соединений в организме, включая цистеин и таурин. Благодаря содержанию серы метионин помогает предотвратить накопление жира в печени и помогает выводить токсины и шлаки метаболизма.
Метионин — единственная незаменимая аминокислота, которая не присутствует в значительных количествах соевых бобов и поэтому производится коммерчески и добавляется во многие продукты из соевого шрота.
Аминокислота Phe
Фенилаланин был впервые выделен из природного источника (ростки люпина) в 1879 году и впоследствии химически синтезирован в 1882 году. Человеческое тело обычно способно расщеплять фенилаланин до тирозина, однако У людей с наследственной фенилкетонурией (ФКУ) фермент, который выполняет это преобразование, неактивен.Если не лечить, фенилаланин накапливается в крови, вызывая задержку умственного развития у детей. Примерно 10 000 детей рождаются с этим заболеванием, поэтому диета с низким содержанием фенилаланина в раннем возрасте может облегчить его последствия.
Pro аминокислота
В 1900 году пролин был синтезирован химическим путем. На следующий год он был выделен из казеина из молочного белка, и его структура оказалась такой же. Люди могут синтезировать пролин из глутаминовой кислоты, которая присутствует только как l-стереоизомер в белках млекопитающих.Когда пролин включается в белки, его особая структура приводит к резким изгибам или перегибам в пептидной цепи, что в значительной степени способствует окончательной структуре белка. Пролин и его производное гидроксипролин составляют 21% аминокислотных остатков волокнистого белка коллагена, необходимого для соединительной ткани.
Пролин и его производное гидроксипролин составляют 21% аминокислотных остатков волокнистого белка коллагена, необходимого для соединительной ткани.
Аминокислота Ser
Серин был впервые выделен из белка шелка в 1865 году, но его структура не была установлена до 1902 года.Люди могут синтезировать серин из других метаболитов, включая глицин, хотя только l-стереоизомер присутствует в белках млекопитающих. Серин важен для биосинтеза многих метаболитов и часто важен для каталитической функции ферментов, в которые он включен, включая химотрипсин и трипсин.
Нервные газы и некоторые инсектициды действуют путем объединения с остатком серина в активном центре ацетилхолинэстеразы, полностью подавляя фермент. Активность эстеразы важна для расщепления нейромедиатора ацетилхолина, в противном случае повышается опасно высокий уровень, что быстро приводит к судорогам и смерти.
Аминокислота Thr
Треонин был выделен из фибрина в 1935 году и синтезирован в том же году.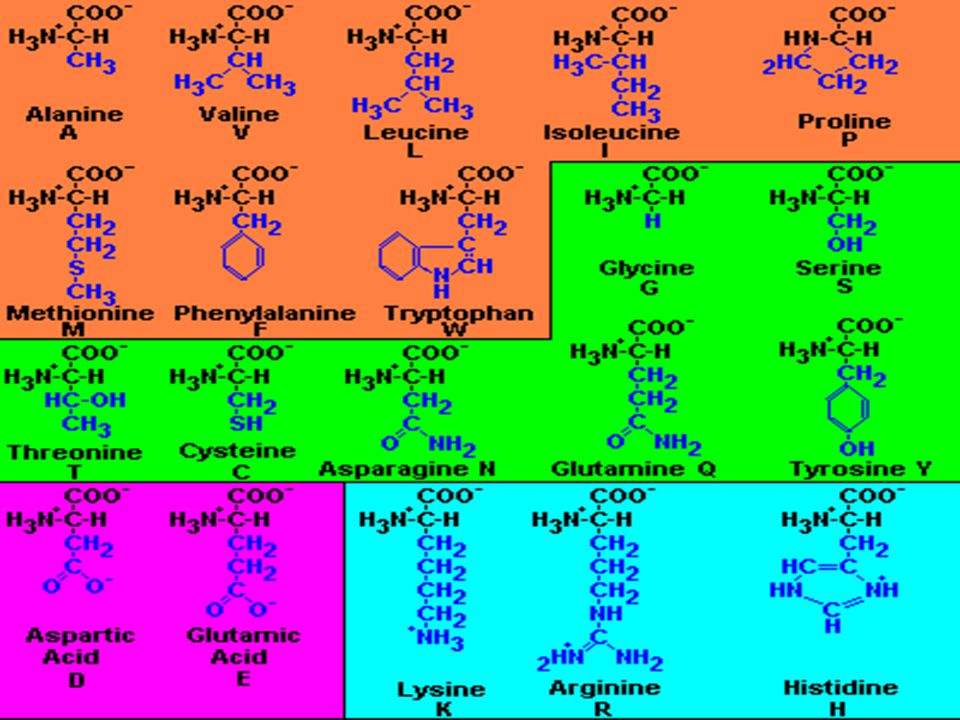 Только l-стереоизомер появляется в белках млекопитающих, где он относительно инертен. Хотя он играет важную роль во многих реакциях бактерий, его метаболическая роль у высших животных, включая человека, остается неясной.
Только l-стереоизомер появляется в белках млекопитающих, где он относительно инертен. Хотя он играет важную роль во многих реакциях бактерий, его метаболическая роль у высших животных, включая человека, остается неясной.
Аминокислота Trp
Структура триптофана, выделенная из казеина (молочного белка) в 1901 году, была установлена в 1907 году, но только l-стереоизомер присутствует в белках млекопитающих.В кишечнике человека бактерии расщепляют пищевой триптофан, выделяя такие соединения, как скатол и индол, которые придают фекалиям неприятный аромат. Триптофан превращается в витамин B3 (также называемый никотиновой кислотой или ниацином), но не в достаточной степени, чтобы поддерживать наше здоровье. Следовательно, мы также должны принимать витамин B3, несоблюдение этого правила приводит к его дефициту, называемому пеллагрой.
Аминокислота Tyr
В 1846 году тирозин был выделен в результате разложения казеина (сырного белка), после чего он был синтезирован в лаборатории и его структура была определена в 1883 году. Присутствующий только в l-стереоизомере в белках млекопитающих, люди могут синтезировать тирозин из фенилаланина. Тирозин является важным предшественником гормонов надпочечников адреналина и норадреналина, гормонов щитовидной железы, включая тироксин, а также пигмента волос и кожи меланина. В ферментах остатки тирозина часто связаны с активными центрами, изменение которых может изменить специфичность фермента или полностью уничтожить активность.
Присутствующий только в l-стереоизомере в белках млекопитающих, люди могут синтезировать тирозин из фенилаланина. Тирозин является важным предшественником гормонов надпочечников адреналина и норадреналина, гормонов щитовидной железы, включая тироксин, а также пигмента волос и кожи меланина. В ферментах остатки тирозина часто связаны с активными центрами, изменение которых может изменить специфичность фермента или полностью уничтожить активность.
Страдающие тяжелым генетическим заболеванием фенилкетонурия (ФКУ) неспособны превращать фенилаланин в тирозин, в то время как у пациентов с алкаптонурией метаболизм тирозина нарушен, и моча становится характерной, темнея на воздухе.
Val аминокислота
Структура валина была установлена в 1906 году после его первого выделения из альбумина в 1879 году. В белке млекопитающих присутствует только l-стереоизомер. Валин может разлагаться в организме на более простые соединения, но у людей с редким генетическим заболеванием, называемым болезнью мочи кленового сиропа, неисправный фермент прерывает этот процесс и может оказаться фатальным при отсутствии лечения.
Строительные блоки белка в организме
Есть два типа аминокислот: незаменимые и заменимые.Человеческое тело не производит эти белки, хотя они жизненно важны для поддержания жизни человека. Это означает, что вы должны получать их с белком, содержащимся в растительной и животной пище.
Восемь незаменимых аминокислот:
- Изолейцин
- лейцин
- Лизин
- метионин
- Фенилаланин
- Треонин
- Триптофан
- Валин
В дополнение к этим восьми существует гистидин .Технически он принадлежит к списку незаменимых аминокислот. Однако детский организм не вырабатывает достаточного количества гистидина и поэтому должен получать добавки с пищей.
Продукты, богатые изолейцином Молоко и молочные продукты
Яйца
Курица
Говядина
Свинина
Орехи и семена
Бобовые, горох, фасоль и арахисовое масло
Сыр Пармезан
Соевые бобы
Куриная грудка
Тунец
Говядина
Орехи
Соевые бобы
Постная говядина
Свинина
Сыр пармезан
Индейка и курица
Тунец, приготовленный
Яйца
Белая фасоль
Рыба и моллюски
Сыр Пармезан
Белая фасоль
Яйца
Индейка и курица
Постная говядина
Баранина
Сыр пармезан
Молочные продукты
Постная говядина и баранина
Яйца
Бобы пинто
Соевые бобы
Белые бобы
Индейка и курица
Сыр Пармезан
Постная говядина и баранина
Рыба и моллюски
Орехи
Белая фасоль
Соевые бобы
Семена и орехи
Баранина
Курица и индейка
Рыба и крабы
Фасоль
Говядина
Соевые бобы
Молочные продукты, сыр и яйца
Семена и орехи
Рыба
Свинина
Говядина
Фасоль
Курица и индейка
Рыба
Свинина
Фасоль
Яйца и молочные продукты
Семена и орехи
Индейка и курица
Соевые бобы
Не все эти источники равны.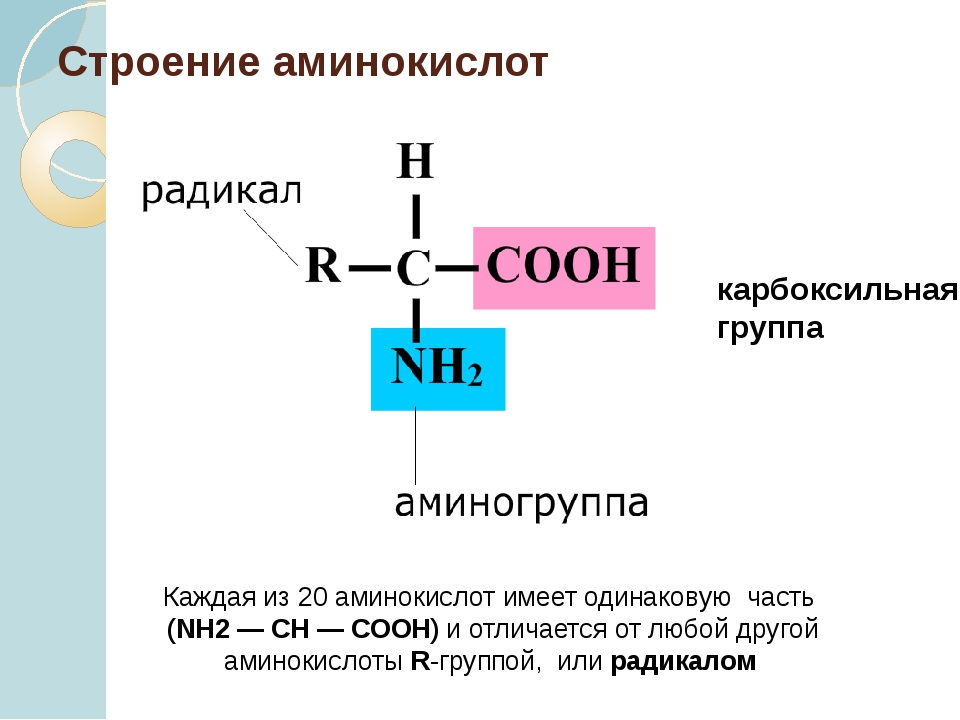 Некоторые содержат большее количество белка с более высокой биологической ценностью, особенно белки животных. Конечно, это не означает, что вы не можете получить необходимые белки и аминокислоты из вегетарианской диеты. Это означает, что вам нужно комбинировать разные источники, которые дополняют друг друга. Например, фасоль и тосты дополняют друг друга, помогая вашему организму более эффективно усваивать белки, содержащиеся в фасоли.
Некоторые содержат большее количество белка с более высокой биологической ценностью, особенно белки животных. Конечно, это не означает, что вы не можете получить необходимые белки и аминокислоты из вегетарианской диеты. Это означает, что вам нужно комбинировать разные источники, которые дополняют друг друга. Например, фасоль и тосты дополняют друг друга, помогая вашему организму более эффективно усваивать белки, содержащиеся в фасоли.
Аминокислоты с разветвленной цепью и синтез мышечного белка у человека: миф или реальность? | Журнал Международного общества спортивного питания
В общей сложности мышечный белок состоит из двадцати аминокислот.Девять из двадцати считаются незаменимыми аминокислотами (EAA), что означает, что они не могут вырабатываться организмом в физиологически значимых количествах и, следовательно, являются важными компонентами сбалансированной диеты. Мышечный белок находится в постоянном состоянии обмена, что означает, что синтез белка происходит непрерывно, чтобы заменить белок, потерянный в результате распада белка. Для синтеза нового мышечного белка все EAA вместе с одиннадцатью незаменимыми аминокислотами (NEAA), которые могут вырабатываться в организме, должны присутствовать в адекватных количествах.Аминокислоты с разветвленной цепью лейцин, изолейцин и валин являются тремя из девяти EAA. Лейцин является не только предшественником синтеза мышечного белка, но также может играть роль регулятора внутриклеточных сигнальных путей, которые участвуют в процессе синтеза белка (например, [1]).
Для синтеза нового мышечного белка все EAA вместе с одиннадцатью незаменимыми аминокислотами (NEAA), которые могут вырабатываться в организме, должны присутствовать в адекватных количествах.Аминокислоты с разветвленной цепью лейцин, изолейцин и валин являются тремя из девяти EAA. Лейцин является не только предшественником синтеза мышечного белка, но также может играть роль регулятора внутриклеточных сигнальных путей, которые участвуют в процессе синтеза белка (например, [1]).
Идея о том, что BCAA могут обладать уникальной способностью стимулировать синтез мышечного белка, выдвигалась более 35 лет. Данные, подтверждающие эту гипотезу, были получены при изучении ответов крыс.В 1981 г. Бузе [2] сообщил, что у крыс BCAA могут ограничивать скорость синтеза мышечного белка. Дополнительные исследования подтвердили концепцию уникального воздействия BCAA на синтез мышечного белка у крыс, хотя лишь немногие изучали реакцию на пероральное употребление только BCAA. Гарлик и Грант показали, что введение смеси BCAA крысам увеличивает скорость синтеза мышечного белка в ответ на инсулин [3], но они не измеряли эффекты только BCAA. Введение крысам только BCAA Kobayashi et al.[4], как было показано, вызывает увеличение синтеза мышечного белка, но ответ был временным. Предположительно скорость синтеза быстро стала ограничиваться доступностью других EAA.
Введение крысам только BCAA Kobayashi et al.[4], как было показано, вызывает увеличение синтеза мышечного белка, но ответ был временным. Предположительно скорость синтеза быстро стала ограничиваться доступностью других EAA.
Исследования синтеза мышечного белка у крыс имеют ограниченное отношение к реакции человека. Скелетные мышцы составляют гораздо меньший процент от общей массы тела у крыс по сравнению с людьми, и регулирование синтеза мышечного белка во многих отношениях отличается. Так, в своей знаменательной книге по метаболизму белков Уотерлоу и его коллеги на основании имеющихся данных пришли к выводу, что пищевые аминокислоты не стимулируют синтез мышечного белка у крыс [5].Хотя недавняя работа ставит под сомнение это утверждение, ограниченный стимулирующий эффект пищевых аминокислот на синтез белка у крыс отражает тот факт, что в нормальных постабсорбтивных условиях имеются избыточные эндогенные аминокислоты, позволяющие увеличить синтез белка, если активность внутриклеточных факторы, участвующие в инициации синтеза белка, стимулируются. Выражаясь по-другому, синтез мышечного белка у крысы, по-видимому, ограничивается скорее процессом инициации, чем процессом трансляции.Напротив, как будет показано ниже, у людей этого не происходит. Еще одно важное различие между исследованиями, изучающими влияние аминокислот на синтез мышечного белка у людей и крыс, связано с обычно используемыми методологиями. В исследованиях на крысах обычно использовался метод «доза затопления» [6]. Эта процедура включает измерение включения индикатора аминокислот в мышечный белок в течение очень короткого промежутка времени, часто всего 10 минут. Этот подход не делает различий между кратковременной и устойчивой стимуляцией синтеза белка.Физиологически значима только длительная стимуляция синтеза. Потребление несбалансированной смеси аминокислот, такой как BCAA, может временно стимулировать синтез белка за счет использования эндогенных запасов других предшественников синтеза белка. Однако эндогенные запасы аминокислот, например, в плазме и свободных внутриклеточных пулах, весьма ограничены и могут быстро истощиться. Если стимуляция синтеза белка не может быть продолжена, это не имеет большого физиологического значения.Следовательно, метод дозирования наводнения, обычно используемый для измерения синтеза мышечного белка у крыс, дает результаты с неопределенным отношением к питанию человека. Поскольку пищевые добавки BCAA предназначены для употребления в пищу человеком, в центре внимания этого краткого обзора будут исследования на людях.
Продажа BCAA в качестве пищевых добавок превратилась в многомиллионный бизнес. В основе маркетинга этих продуктов лежит широко распространенное мнение о том, что потребление BCAA стимулирует синтез мышечного белка и, как следствие, вызывает анаболический ответ.BCAA также можно употреблять с целью улучшения «умственной сосредоточенности», но мы не будем рассматривать это применение. Основная цель этой статьи — оценить утверждение, что только BCAA являются анаболическими, — адекватно подтверждена теоретически или эмпирически исследованиями на людях. Неявным в нашей оценке будет исследование того, играет ли состояние фосфорилирования эукариотических факторов инициации роль регулятора скорости в регуляции синтеза мышечного белка у людей.
Оборот мышечного белка и потребление белка с пищей
Мышечный белок находится в постоянном состоянии оборота, что означает, что новый белок постоянно вырабатывается, в то время как старые белки расщепляются. Анаболическое состояние не имеет конкретного определения, но обычно относится к обстоятельствам, при которых скорость синтеза мышечного белка превышает скорость распада мышечного белка. Результат — набор мышечной массы. Обычно считается, что анаболическое состояние вызывается стимуляцией синтеза мышечного белка, но теоретически оно также может быть результатом ингибирования распада мышечного белка.
Основная метаболическая цель приема добавок BCAA — максимизировать анаболическое состояние. Широко распространено мнение, что BCAA вызывают анаболическое состояние, стимулируя синтез мышечного белка. Обильная доступность всех EAA является необходимым условием для значительной стимуляции синтеза мышечного белка [7]. Синтез мышечного белка будет ограничен из-за отсутствия каких-либо EAA, тогда как нехватка NEAA может быть компенсирована увеличением de novo продукции дефицитных NEAA [7].В постпрандиальном состоянии после приема пищи, содержащей белок, все предшественники EAA, необходимые для синтеза нового мышечного белка, могут быть получены либо из повышенных концентраций в плазме, возникающих в результате переваривания потребленного белка, либо в результате его рециркуляции в результате распада белка. В этом случае обильной доступности EAA скорость синтеза мышечного белка превышает скорость распада, что приводит к анаболическому состоянию. В постабсорбционном состоянии уровни EAA в плазме падают ниже постпрандиальных значений, потому что аминокислоты больше не всасываются.В результате EAA больше не поглощаются мышцами, а высвобождаются мышцами в плазму [8]. Это катаболическое состояние мышечного белка в состоянии после абсорбции обеспечивает постоянную доступность EAA для других тканей для поддержания скорости синтеза белка за счет мышечного белка, который можно рассматривать как резервуар EAA для остальных. тела, чтобы опираться.
Так как EAA не могут продуцироваться в организме и происходит чистое высвобождение EAA из мышц, в постабсорбтивном состоянии единственным источником предшественников EAA для синтеза мышечного белка являются внутриклеточные EAA, полученные в результате распада мышечного белка [8].Помимо того, что они повторно включаются в мышечный белок посредством синтеза, некоторые EAA, высвобождаемые в результате распада мышечного белка, могут частично окисляться в мышцах, что делает их недоступными для повторного включения в мышечный белок. EAA, высвобождаемые в результате распада мышечного белка, которые не включаются в мышечный белок или не окисляются в мышечной ткани, высвобождаются в плазму, после чего они могут либо поглощаться другими тканями в качестве предшественников для синтеза белка, либо необратимо окисляться [9].Таким образом, скорость синтеза мышечного белка всегда будет ниже, чем скорость распада мышечного белка в постабсорбтивном состоянии из-за чистого потока EAA от распада белка в плазму и окислительных путей. Другими словами, синтез мышечного белка не может превысить скорость распада мышечного белка, когда предшественники полностью получены из распада белка, и, таким образом, анаболическое состояние не может возникнуть в отсутствие потребления экзогенных аминокислот.
Являются ли BCAA анаболическими в состоянии после абсорбции?
Теоретические соображения
Все предшественники EAA для синтеза мышечного белка в постабсорбирующем состоянии являются производными от распада мышечного белка.Постоянно сообщалось, что у нормальных людей после абсорбции скорость распада мышечного белка превышает скорость синтеза мышечного белка примерно на 30% [10]. Потребление только BCAA (то есть без других EAA) может только увеличить синтез мышечного белка в постабсорбтивном состоянии за счет повышения эффективности рециркуляции EAA из расщепления белка обратно в синтез белка, в отличие от их высвобождения в плазму или окисленный. Это связано с тем, что все 9 EAA (а также 11 NEAA) необходимы для производства мышечного белка, а EAA не могут производиться в организме.Если потребляются только 3 EAA, как в случае с BCAA, то распад белка является единственным источником оставшихся EAA, необходимых в качестве предшественников для синтеза мышечного белка. Следовательно, потребление только BCAA теоретически невозможно для создания анаболического состояния, при котором синтез мышечного белка превышает распад мышечного белка. Если сделать щедрое предположение, что потребление BCAA повышает эффективность рециркуляции EAA от распада мышечного белка до синтеза мышечного белка на 50%, то это приведет к увеличению скорости синтеза мышечного белка на 15% (30% рециркулируется в базовом режиме). состояние X 50% улучшение рециркуляции = 15% увеличение синтеза).Кроме того, снижение на 50% высвобождения ЕАА в плазму из мышц также уменьшило бы плазменный и внутриклеточный пулы свободных ЕАА. Рисунок Рис. 1 схематично иллюстрирует эти принципы. Поскольку повышение эффективности рециркуляции на 50% будет примерно разумным максимальным пределом, это означает, что максимальная стимуляция синтеза мышечного белка не может превышать 15%. Это соответствовало бы увеличению фракционной скорости синтеза мышцы от базального значения около 0,050% / ч в базовом состоянии до 0.057% / час, и эту разницу во фракционной скорости синтеза (FSR) белка трудно точно измерить [11].
Рис. 1Схематическое изображение рециркуляции незаменимых аминокислот (EAA) из распада мышечного белка в синтез мышечного белка в постабсорбтивном состоянии. Произвольные единицы используются для простоты и основаны на измеренных скоростях каждого пути у людей после абсорбции [10]. a Нормальное состояние после абсорбции.Примерно 70% EAA, образующихся при распаде мышечного белка, перерабатываются в синтез белка [10]. В результате распада белка происходит чистый отток примерно 85% EAA, которые могут либо поглощаться и включаться в белок в других тканях, либо окисляться. Около 15% EAA от распада белка частично окисляются в мышцах и недоступны для синтеза белка. Показатели внешнего потока и внутриклеточного окисления ЕАА являются средними, поскольку некоторые ЕАА, такие как фенилаланин, совсем не окисляются в мышцах. b Представление 50% увеличения эффективности рециркуляции EAA от распада мышечного белка до синтеза белка. В этом примере синтез увеличится с 70 до 80 единиц, или на 20%. Синтез белка никогда не может превышать распад белка в постабсорбционном состоянии, поскольку расщепление белка является единственным источником EAA
.Эмпирические результаты
BCAA вводили внутривенно в единственных исследованиях, определяющих реакцию метаболизма мышечных белков у людей только на BCAA.Хотя вливание BCAA не является общепринятым способом употребления пищевой добавки, было показано, что вводимые внутривенно и перорально аминокислоты вызывают сопоставимые эффекты на синтез мышечного белка в других случаях [12]. Следовательно, есть смысл оценить статьи, в которых описывается реакция синтеза мышечного белка на внутривенное вливание BCAA у людей.
Louard et al. [13] использовали метод баланса предплечий для количественной оценки реакции на внутривенное вливание смеси BCAA в течение 3 часов у 10 субъектов после абсорбции.Метод баланса предплечья включает измерение поглощения и высвобождения индивидуальных EAA (в данном случае лейцина и фенилаланина) и их изотопно-меченых аналогов. Рассчитаны скорости исчезновения (Rd) и появления (Ra) фенилаланина и лейцина. Предполагая, что баланс лейцина и фенилаланина в мышцах является репрезентативным для всех EAA, Rd. Считается, что фенилаланин отражает синтез мышечного белка, поскольку синтез белка — это единственная судьба фенилаланина, поглощаемого мышцами из плазмы.Rd. лейцина нельзя интерпретировать с точки зрения синтеза белка, поскольку лейцин, поглощаемый мышцами, может окисляться, а также включаться в белок. Трехчасовая инфузия BCAA увеличила плазменные концентрации всех 3 BCAA в четыре раза, в то время как концентрации других EAA снизились [13]. Синтез мышечного белка снизился с 37 +/- 3 до 21 +/- 2 нмоль / мин / 100 мл ноги (статистически значимо, p <0,05) [13], вместо того, чтобы стимулироваться инфузией BCAA. Не было значительных изменений в чистом балансе фенилаланина, что указывает на то, что распад мышечного белка также уменьшился на величину, аналогичную сокращению синтеза мышечного белка.Баланс между синтезом и распадом мышечного белка оставался отрицательным, что означало, что катаболическое состояние сохранялось, а анаболическое состояние не возникало. Одновременное снижение синтеза и распада мышечного белка во время инфузии BCAA можно охарактеризовать как снижение оборота мышечного белка.
Аналогичные результаты были получены теми же исследователями, когда они увеличили продолжительность инфузии BCAA до 16 часов у 8 нормальных добровольцев и определили, стимулирует ли хроническое повышение BCAA синтез мышечного белка [14].Для расчета синтеза и распада мышечного белка использовалась та же методика баланса предплечий, что и в предыдущем исследовании. 16-часовая инфузия увеличивает концентрацию BCAA от 5 до 8 раз [14], что почти вдвое превышает уровни, достигаемые при пероральном приеме нормальной дозы BCAA [15]. Как и в предыдущем исследовании, синтез мышечного белка (отраженный фенилаланином Rd) был снижен у субъектов, получавших BCAA, по сравнению с инфузией физиологического раствора с 36 +/- 5 до 27 +/- 2 нмоль / мин / 100 мл. также снизился, а это означает, что оборот мышечного белка также снизился, и катаболическое состояние сохранялось.
Из этих двух исследований можно сделать вывод, что инфузия BCAA не только не увеличивает скорость синтеза мышечного белка у людей, но фактически снижает скорость синтеза мышечного белка и скорость обмена мышечного белка. Катаболическое состояние не было обращено в анаболическое ни в одном исследовании. Кроме того, можно ожидать, что устойчивое снижение скорости оборота мышечного белка будет иметь пагубный эффект на мышечную силу, даже если мышечная масса сохраняется. Оборот мышечного белка обновляет мышечные волокна и приводит к увеличению эффективности сокращения на уровне отдельных волокон [16], что отражается в увеличении силы in vivo, независимо от мышечной массы [17, 18].
Неспособность синтеза мышечного белка значительно увеличиться в ответ на инфузию только BCAA, как и ожидалось в соответствии с теоретическими соображениями, обсужденными выше и проиллюстрированными на рис. 1, в отношении требования для всех EAA поддерживать увеличение. Вместо этого, поскольку распад мышечного белка уменьшился, доступность EAA также упала, что, в свою очередь, фактически снизило скорость синтеза мышечного белка.
Ограничивают ли анаболические сигнальные факторы скорость в постабсорбционном состоянии?
Утверждение о том, что синтез мышечного белка стимулируется BCAA, по крайней мере частично, связано с наблюдением усиления внутриклеточной анаболической передачи сигналов, включая состояние активации ключевых факторов, участвующих в инициации синтеза белка [1].Теория о том, что активация внутриклеточных анаболических сигнальных факторов вызывает повышенную скорость синтеза мышечного белка, прочно вошла в современные концепции регуляции синтеза мышечного белка. Повышенная анаболическая передача сигналов в ответ на BCAA была приведена в качестве доказательства стимуляции синтеза мышечного белка даже в отсутствие измерения синтеза мышечного белка (например, [1]). Однако активация анаболических сигнальных путей может совпадать с повышенным синтезом мышечного белка только при наличии достаточного количества EAA, обеспечивающего необходимые предшественники для производства полноценного белка.
Диссоциация состояния фосфорилирования сигнальных факторов и синтеза мышечного белка у людей была показана в различных обстоятельствах, когда доступность всех EAA ограничена. Например, повышение концентрации инсулина (например, в результате приема глюкозы) является мощным активатором анаболических сигнальных путей, но это не может увеличить мышечный FSR из-за дефицита EAA [19]. И наоборот, потребление небольшого количества (3 г) EAA стимулирует синтез мышечного белка, не влияя на активность фактора инициации e.g., Akt, киназа S6 и 4E – BP1 [20]. Небольшое увеличение концентрации ЕАА в плазме не имело бы никакого эффекта, если бы синтез белка ограничивался состоянием активации факторов инициации. В упомянутых выше исследованиях, в которых BCAA вводили внутривенно, разумно предположить, что такое большое увеличение концентрации BCAA могло бы активировать сигнальные факторы, однако синтез мышечного белка фактически снизился из-за отсутствия EAA в результате снижения расщепление белков.Таким образом, у людей введение ЕАА может увеличить синтез мышечного белка при отсутствии каких-либо изменений в активации факторов инициации, а активация факторов инициации при отсутствии потребления всех ЕАА не влияет на синтез мышечного белка. Эти результаты можно интерпретировать только как демонстрацию того, что ограничивающий скорость контроль синтеза базальных мышечных белков у людей — это доступность всех EAA, а не активность анаболического сигнального фактора. Этот вывод ставит под сомнение роль пищевых добавок, содержащих только BCAA, как стимуляторов синтеза мышечного белка.
Когда все доказательства и теории рассматриваются вместе, можно сделать вывод об отсутствии достоверных доказательств того, что прием одной только пищевой добавки с BCAA приводит к физиологически значимой стимуляции мышечного белка. Фактически, имеющиеся данные указывают на то, что BCAA действительно снижают синтез мышечного белка. Все EAA должны быть доступны в изобилии, чтобы усиление анаболической передачи сигналов приводило к ускоренному синтезу мышечного белка.
Одновременное употребление BCAA с другими питательными веществами
В центре внимания этого обзора была реакция на только BCAA, поскольку это логическая цель пищевых добавок BCAA.Как и в случае потребления только BCAA, существует ограниченное количество исследований совместного приема BCAA с другими питательными веществами. Когда BCAA или изоназотная смесь треонина, метионина и гистидина вводились людям вместе с углеводами, скорость синтеза мышечного белка снижалась одинаково в обеих группах, что указывает на отсутствие уникальной роли BCAA [21]. Точно так же потребление смеси BCAA с углеводами после упражнений с отягощениями не увеличивало анаболические сигнальные факторы в большей степени, чем одни углеводы [22].Таким образом, имеющиеся данные не поддерживают идею об особом анаболическом эффекте BCAA при приеме с углеводами.
В отличие от отсутствия взаимодействия между BCAA и углеводами, BCAA могут усиливать анаболический эффект белковой пищи. Например, добавление 5 г BCAA к напитку, содержащему 6,25 г сывороточного протеина, увеличивало синтез мышечного протеина до уровня, сопоставимого с уровнем, вызываемым 25 г сывороточного протеина [23]. Этот результат предполагает, что один или несколько BCAA могут ограничивать скорость стимуляции синтеза мышечного белка сывороточным белком или что дополнительные BCAA индуцируют больший потенциал анаболического ответа мышц на сывороточный белок за счет активации факторов инициации.В любом случае реакция BCAA в сочетании с интактным белком — это другая проблема, чем эффект только BCAA, поскольку интактный белок обеспечивает все EAA, необходимые для производства интактного белка.
Индивидуальные эффекты лейцина, валина и изолейцина
В этой статье мы рассмотрели только реакцию на смеси BCAA. Ответы на отдельные BCAA (например, лейцин, валин или изолейцин) могут отличаться от комбинации этих трех по нескольким причинам.Доказательства указывают на то, что лейцин сам по себе может вызывать анаболический ответ (например, [24]), в то время как таких данных не существует для изолейцина или валина. Таким образом, можно было ожидать, что один лейцин будет более эффективным, чем комбинация всех BCAA. Однако есть два существенных ограничения пищевой добавки, содержащей только лейцин. Во-первых, те же проблемы, которые ограничивают степень стимуляции синтеза мышечного белка одними только BCAA в отношении доступности других EAA, необходимых для производства неповрежденного мышечного белка, также ограничивают ответ на один лейцин.Во-вторых, повышение концентрации лейцина в плазме активирует метаболический путь, который окисляет все BCAA. В результате прием одного лейцина приводит к снижению плазменных концентраций валина и изолейцина. Следовательно, доступность валина и изолейцина может стать ограничивающей для синтеза мышечного белка, когда потребляется только лейцин. Возможно, поэтому долгосрочные исследования результатов с добавлением лейцина в рацион не дали положительных результатов [25].Основным аргументом в пользу диетической добавки, содержащей все BCAA, а не только лейцина, является преодоление снижения концентраций валина и изолейцина в плазме, которое могло бы произойти при приеме только лейцина.
В то время как пищевая добавка со всеми BCAA преодолевает снижение концентрации, вызванное потреблением только лейцина, добавление валина и изолейцина, тем не менее, может ограничивать эффективность одного лейцина из-за конкуренции за перенос в мышечные клетки.Все BCAA активно транспортируются в клетки, включая мышечные, с помощью одной и той же транспортной системы. Следовательно, при совместном использовании BCAA конкурируют друг с другом за транспортировку в клетки. Если один из BCAA (например, лейцин) ограничивает скорость синтеза белка, добавление двух других BCAA может ограничить стимуляцию синтеза белка из-за снижения проникновения лейцина в клетку. BCAA также конкурируют с другими аминокислотами за транспорт, включая фенилаланин, и эта конкуренция может повлиять на внутримышечную доступность других EAA.В результате конкуренции за переносчики, возможно, что один лейцин, например, может оказывать временное стимулирующее действие на синтез мышечного белка (например, [21]), когда BCAA не вызывают такой реакции [13, 14].
аминокислот — Classroom Partners
Знайте, что такое аминокислота. Знайте, сколько там аминокислот.
Знайте, что разные белки имеют разные аминокислоты (например, яичный альбумин — один из немногих «полных» белков).
Привет всем, сегодня мы собираемся узнать о строительных блоках, структурах и ролях белков.Особое внимание уделяется аминокислотам.
Белки являются одними из самых распространенных органических молекул в живых системах и гораздо более разнообразны по структуре и функциям, чем другие классы макромолекул. Одна клетка может содержать тысячи белков, каждый из которых выполняет уникальную функцию. Хотя их структуры, как и их функции, сильно различаются, все белки состоят из одной или нескольких цепочек аминокислот.
(потяните цифру аминокислоты, которая ниже)
Аминокислоты — это мономеры, из которых состоят белки.Белок состоит из одной или нескольких линейных цепочек аминокислот, каждая из которых называется полипептидом. В белках обычно встречаются 20 типов аминокислот.
Мы вернемся к аминокислотам и полипептидам, я просто хотел, чтобы вы на секунду задумались о них и узнали, что их 20 обычно встречаются.
Сейчас мы быстро перейдем к ферментам и гормонам,
Ферменты действуют как катализаторы биохимических реакций, то есть ускоряют их.Каждый фермент распознает один или несколько субстратов, молекул, которые служат исходным материалом для реакции, которую он катализирует. Различные ферменты участвуют в разных типах реакций и могут разрушать, связывать или перестраивать свои субстраты.
Одним из примеров фермента, обнаруженного в вашем организме, является амилаза слюны, которая расщепляет амилозу (разновидность крахмала) на более мелкие сахара. Амилоза не очень сладкая, поэтому крахмалистые продукты часто становятся слаще, если пережевывать их дольше: вы даете амилазе слюны время, чтобы приступить к работе.
Еще один пример фермента — лактаза. Люди с непереносимостью молочных продуктов или лактозы не могут переваривать лактозу, потому что их организм не вырабатывает фермент, лактазу. — Примечание. Если у вас есть эта проблема, есть безрецептурные добавки, которые можно принимать перед употреблением молочных продуктов с добавлением лактазы, что позволяет употреблять молочные продукты без побочных эффектов.
Теперь перейдем к гормонам. Гормоны — это химические сигналы на дальние расстояния, посылаемые эндокринными клетками (например, клетками гипофиза).Они контролируют определенные физиологические процессы, такие как рост, развитие, обмен веществ и размножение. В то время как некоторые гормоны основаны на стероидах, другие представляют собой белки, обычно называемые пептидными гормонами.
Например, инсулин — важный пептидный гормон, который помогает регулировать уровень глюкозы в крови. Когда уровень глюкозы в крови повышается (например, после еды), специализированные клетки поджелудочной железы выделяют инсулин. Инсулин связывается с клетками печени и других частей тела, заставляя их поглощать глюкозу.Этот процесс помогает вернуть сахар в крови к его нормальному уровню покоя.
Форма белка имеет решающее значение для его функции, многие различные типы химических связей могут быть важны для поддержания этой формы. Изменения температуры и pH, а также присутствие определенных химикатов могут нарушить форму белка и привести к потере его функциональности — процесс, известный как денатурация.
Аминокислоты имеют центральный асимметричный углерод, к которому присоединены аминогруппа, карбоксильная группа, атом водорода и боковая цепь (R-группа).Возвращаясь к аминокислотам, когда вы смотрите на этот рисунок, знайте, что это основная структура аминокислоты, состоящая из центрального атома углерода, также известного как альфа (α) углерод, связанного с аминогруппой (Nh3), карбоксильная группа (COOH), а также атом водорода.
На самом деле это не то состояние, в котором обычно находится аминокислота. При физиологическом pH, который составляет (7,2-7,4), аминогруппа обычно протонирована и несет положительный заряд, в то время как карбоксильная группа обычно депротонирована и несет отрицательный заряд.Каждая аминокислота имеет другой атом или группу атомов, связанных с центральным атомом, известную как R-группа. Это определяет идентичность аминокислоты.
(вот цифра, на которую можно быстро взглянуть, чтобы вспомнить пронацию и депротонацию)
Difference Between Protonation and Deprotonation
Одним из примеров аминокислоты является то, что если группа R представляет собой атом водорода, тогда аминокислота представляет собой глицин, а если это метильная группа (Ch4), аминокислота представляет собой аланин.В этой таблице показаны 20 распространенных аминокислот.
21 протеиногенная α-аминокислота, обнаруженная у эукариот, сгруппированная в соответствии со значениями pKa их боковых цепей и зарядами, переносимыми при физиологическом pH (7,4)Свойства боковой цепи определяют химическое поведение аминокислоты (то есть, считается ли она кислотной, основной, полярной или неполярной). Например, аминокислоты, такие как валин и лейцин, неполярны и гидрофобны, тогда как аминокислоты, такие как серин и глутамин, имеют гидрофильные боковые цепи и являются полярными.Некоторые аминокислоты, такие как лизин и аргинин, имеют боковые цепи, которые имеют положительный заряд при физиологическом pH и считаются основными аминокислотами. С другой стороны, аспартат и глутамат имеют отрицательный заряд при физиологическом pH и считаются кислотными.
Теперь мы переходим к пептидным облигациям. Каждый белок в ваших клетках состоит из одной или нескольких полипептидных цепей. Каждая из этих полипептидных цепей состоит из аминокислот, связанных вместе в определенном порядке. Полипептид — это что-то вроде длинного слова, которое само по себе «записано» аминокислотными буквами.Химические свойства и порядок аминокислот являются ключевыми в определении структуры и функции полипептида и белка, частью которого он является. Но как на самом деле аминокислоты связаны друг с другом в цепи, спросите вы? -Хан / добавлено слов
Аминокислоты полипептида связаны со своими соседями ковалентными связями, известными как пептидные связи. Каждая связь образуется в реакции дегидратационного синтеза или (конденсации). Во время синтеза белка, о котором пойдет речь в другой лекции, карбоксильная группа аминокислоты на конце растущей полипептидной цепи реагирует с аминогруппой входящей аминокислоты, высвобождая молекулу воды.Образовавшаяся связь между аминокислотами представляет собой пептидную связь
.Здесь вы увидите, как молекула воды, выделенная красным, связывает две аминогруппы, образуя показанное соединение.
По-прежнему нужна подпись (и правильная цитата) .
 Здесь прежде всего необходимо не измельчение, а более тонкие процессы, меняющие структуру объекта.
Здесь прежде всего необходимо не измельчение, а более тонкие процессы, меняющие структуру объекта. Это во многом определяет реакционную способность.
Это во многом определяет реакционную способность. О. Dayhoff
О. Dayhoff  Поле сворачивания белка и
стабильность была критически важной областью исследований в течение многих лет,
и остается сегодня одной из величайших неразгаданных загадок. Однако это
активно исследуются, и прогресс наблюдается каждый день.
Поле сворачивания белка и
стабильность была критически важной областью исследований в течение многих лет,
и остается сегодня одной из величайших неразгаданных загадок. Однако это
активно исследуются, и прогресс наблюдается каждый день.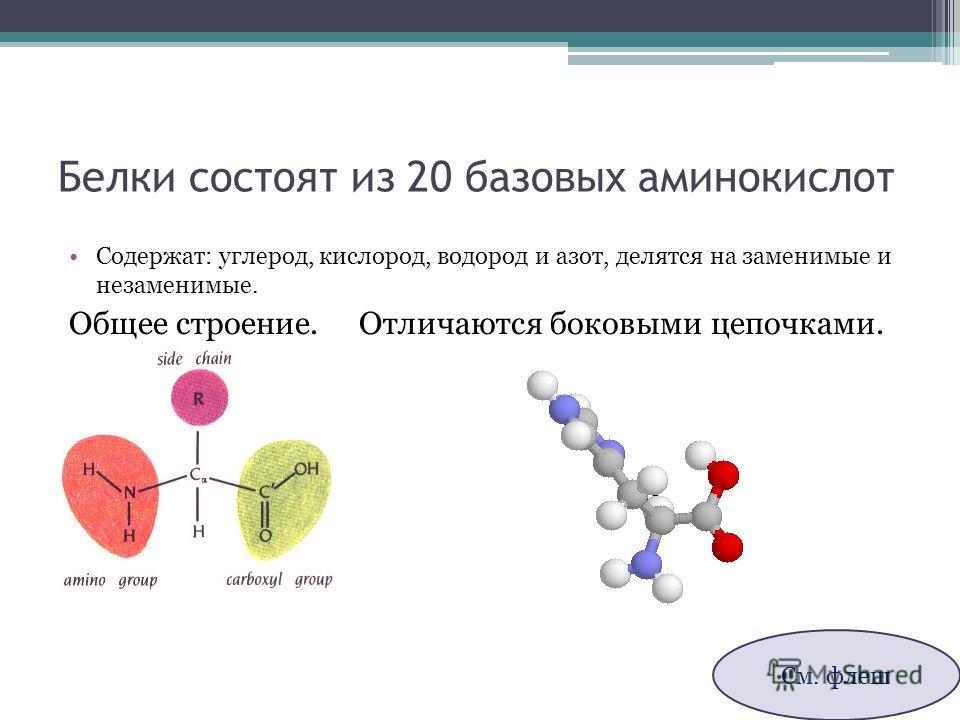 д. — для получения одной аминокислоты
это необходимо.В отличие от жира и крахмала, человеческий организм не накапливает излишки
аминокислоты для последующего использования — аминокислоты должны присутствовать в пище каждый
день.
д. — для получения одной аминокислоты
это необходимо.В отличие от жира и крахмала, человеческий организм не накапливает излишки
аминокислоты для последующего использования — аминокислоты должны присутствовать в пище каждый
день.