Натриевая соль
Натриевая соль п-толуолсульфомочевины — кристаллическое вещество белого цвета. Хорошо растворима в воде. Не растворяется в хлороформе, гексане.[ …]
Свойства солей КМЦ. Наиболее важной в практическом отношении является натриевая соль КМЦ. Свойства этой соли будут подробно освещены ниже. Калиевая соль во многих отношениях сходна с натриевой: она хорошо растворяется в воде. Свойства ее растворов также аналогичны свойствам растворов -КМЦ. Аммониевая соль КМЦ интересна в том отношении, что она не является стабильной и теряет аммиак при нагревании от 323 до 333 К. Свинцовые, ртутные и алюминиевые соли КМЦ — бесцветные вещества, нерастворимые в воде. Медные и никелевые соли окрашены в голубой цвет, железные — в красный. Соли многовалентных металлов, как правило, не растворимы в воде, другие металлические соли в основном являются растворимыми. Все соли КМЦ могут быть получены при обработке Н-КМЦ или -КМЦ раствором соли требуемого металла. В некоторых случаях для выделения нужной соли требуется провести реакцию при определенных концентрациях и значениях pH.[ …]
Свойства натриевой соли КМЦ. Как уже отмечалось, -КМЦ является важнейшим производным целлюлозы, имеющим большое техническое применение. По внешнему виду чистый продукт представляет собой белое волокнистое или порошкообразное вещество, хорошо растворяющееся в воде при всех температурах. -КМЦ является весьма гигроскопичным веществом.[ …]
Одним из полимеров натриевой соли метафосфорной кислоты является гексаметафосфат натрия, представляющий собой стекловидную гигроскопическую соль, способную с течением времени расплываться во влажном воздухе.[ …]
Состоит из натриевых солей — продуктов нитрования алкилофенолов, выделенных из смол полукоксования сланцев или углей, воды — не более 40% и 2,5% смачивателя ОП-7 или ОП-Ю.[ …]
Применяется в медицине; натриевая соль называется м е д и н а л.[ …]
У осины при опрыскивании ее натриевой солью й бутиловым эфиром 2,4-Д через 5 суток после опрыскивания влажность побегов достигла уровня влажности необработанных растений и на протяжении последующих 15—20 дней оставалась без существенных изменений.[ …]
Он растворим в разбавленной щелочи. Раствор называют вискозой (вискозным раствором). Из этого раствора формуют Волокна или пленку.[ …]
Наиболее эффективными дозами натриевой соли 2,4-Д являются 1,5—2 кг/га, аминной соли 2,4-Д — 1 —1,5 кг/га и эфиров 2,1-Д — 0,3-0.6 кг/г?..[ …]
Карбоксиметипцеллюлоза (КМЦ) является натриевой солью простого эфира целлюлозы и гликолевой кислоты. Промышленность поставляет высоковязкие (КМЦ-500, КМЦ-600) и низковязкие (КМЦ-300, КМЦ-250) реагенты. Цифры в обозначении указывают степень полимеризации, т. е. число элементарных звеньев в цепочке макромолекулы высокомолекулярного соединения. КМЦ представляет собой беловатое волокнистое вещество, медленно растворимое в воде с образованием вязкого коллоидного раствора.[ …]
Мы провели опыт, в котором испытывали следующие дозы натриевой соли 2,4-Д: 0,75; 1,0 и 1,5 кг действующего вещества на 1 га без аммиачной селитры и те же дозы, но с добавлением аммиачной селитры — 4 и 8 кг на 1 га. Посев кукурузы сорта Краснодарская 1/49 был проведен 26—28 мая по зяби. Опрыскивание гербицидом провели 24—27 июня в фазу 4—5 листьев (табл. 2).[ …]
Следующей стадией является реакция монохлоруксусной кислоты с натриевой солью 2,4-ДХФ. В пробе конденсированной массы содержание ПХДД/Ф увеличивается до 51,3 ТЭ нг/г. Согласно технологическому регламенту, реакция происходит в щелочных условиях (pH = 8,5-9,5), температура на этой стадии поддерживается в интервале 130-160 °С с подачей пара 2-3 атм. Известно, что эти условия благоприятны для образования ПХДД/Ф.[ …]
Показано [45, 46], что в умеренно концентрированных растворах (1—3%-ные) натриевой соли карбоксиметилцеллюлозы в воде находятся гель-частицы. Отт и Эллиотт [46] отнесли их к плохо растворимым кристаллическим остаткам целлюлозы, которые связывают сравнительно большое количество растворимого полимера с образованием сетки. Полагают, что неоднородность замещения также приводит к ассоциации макромолекул вследствие образования водородных связей между гидроксильными группами отдельных цеией и к образованию геля. Натриевая соль карбоксиметилцеллюлозы, полученная в условиях равномерного алкилирования макромолекул, не образует гелей в водных растворах. При растворении таких препаратов остается лишь незначительное количество устойчивых кристаллических областей исходной целлюлозы (если они вообще остаются), и однородность алкилирования является стерическим фактором, уменьшающим вероятность образования водородных связей между отдельными цепями. В этом случае, так же как и в других случаях, неоднородность распределения заместителей по цепи является, по-видимому, основным условием образования геля. Реологические свойства водных растворов натриевой соли карбоксиметилцеллюлозы обоих типов существенно различны. Эти свойства будут рассмотрены ниже. Имеются доказательства [47, 48] агрегации молекул натриевой соли карбоксиметилцеллюлозы в разбавленных водных растворах, содержащих хлористый натрий, если ионная сила превышает 0,2 М. По-видимому, этот процесс имеет место и в концентрированных растворах.[ …]
Препараты избирательного действия и рекомендуются для борьбы с сорняками в посевах сои, фасоли, табака, огурцов, бахчевых. Хорошо подавляют щирицу обыкновенную, марь белую, мышей и некоторые другие. Применяется для опрыскивания почвы в дозах 5—7 кг/га. Гектарная норма гербицида растворяется в 400—600 л воды. Однако при работе с ним нужно принимать меры предосторожности. К аланапу из культурных растений чувствительны томаты, свекла.[ …]
Поскольку механизм взаимодействия целлюлозы с моиохлор-уксусной кислотой или ее натриевой солью является промежуточным между Бм! и Бк2, то в качестве растворителей при проведении реакции используют спирты с разветвленными алифатическими цепями. При этом возникает необходимость регенерации этих спиртов, однако сообщений о методах ее проведения нет.[ …]
В посадках картофеля. При довсходовом внесении: натрофен в дозах 10—15 кг/га препарата, натриевую соль 2,4-Д—1,5—2 кг/га, аминную соль 2,4-Д — 1—1,5 кг/га, эфиры 2,4-Д — 0,8—1 кг/га.[ …]
Одним из первых препаратов производных 2,4-Д, используемых для уничтожения сорняков, была натриевая соль. Выпускается она в виде порошка розоватого оттенка, содержащего 65—70% действующего вещества, имеет резкий запах карболовой кислоты. Натриевая соль не ядовита для человека и животных, невзрывоопасна и не вызывает коррозии металлов.[ …]
При производстве капролактама образуется побочный продукт и «щелочные стоки» — растворы натриевых солей моно- и дикар-боновых кислот. При их разложении получают плав соды, содержащий обычно более 85 % Na2C03. Так, отход Щекинского ПО «Азот» имеет следующий состав, масс. %: 95,43 — Na2C03; 2,51 — Na2S04; 0,57 — NaOH; 1,69 — NaCI; 0,017 — Fe203; 0,03 — A1203.[ …]
Таким путем нами были найдены значения W для флокуляции положительного золя FeO(OH) добавками натриевых солей карбокси-метилцеллюлозы [128]. Полученные зависимости W(С) (см. рис. 5.3) свидетельствуют о том, что с ростом заряда а флокулирующего иона (оКмщ5б/25о> °кмц 83/327) область начала быстрой коагуляции смещается в сторону меньших концентраций полиэлектролита. При этом фактор замедления резко меняется в узком интервале концентраций реагента. Порог коагуляции (флокуляции) золя КМЦ в пересчете на число диссоциированных групп ПЭ соизмерим с таковым для трехзарядного противо-иона. Это говорит о схожести процесса агрегации золя, в том числе и его кинетики, трехзарядными ионами и полиэлектролитом.[ …]
Его молекулярный вес равен 112,09, а точка плавления с разложением —300—310°. Практическое использование находят соли ГМК — натриевая, аммониевая, диэтаноламиновая и триэтанол-аминовая. Наименее токсичной и наиболее удобной для применения является натриевая соль гидразида малеиновой кислоты.[ …]
Многолетние опыты показали, что эфиры 2,4-Д являются более активными гербицидами избирательного действия, чем натриевая соль 2,4-Д, особенно в борьбе с корнеотпрысковыми сорняками.[ …]
При производстве фтора вырабатываются следующие продукты: фтористоводородная кислота (£№), ее алюминиевые и натриевые соли, двойная натриево-алюминиевая соль (синтетический криолит), а также «флюаты» (металлические соли кремнефтористоводородной кислоты) [1]. Исходным сырьем чаще всего является природный минерал — плавиковый шпат (СаРя).[ …]
Этот катализатор представляет собой натриевую соль полифталоцианина кобальта с примесью гидроксида натрия. Выпускается он в виде порошка с фиолетовым оттенком и в виде пасты влажностью 65…80%. Катализатор в виде порошка растворим в растворах щелочей, плохо растворим в воде и не растворим в эфире, ацетоне и низших спиртах. Он относится к малотоксичным соединениям (3 класс опасности) [26].[ …]
Последний вид загрязнений свойственен в основном бытовым сточным водам. Производственные сточные воды, содержащие нафтеновые кислоты, натриевые соли нафтеновых кислот, а также серную и соляную кислоты (обычные для сточных вод нефтяной промышленности загрязнения), в большинстве своем являются бактерицидными, т. е. обладают свойством убивать микробы [18].[ …]
За последнее время лабораторией гербицидов Всесоюзного научно-исследовательского института удобрений и агропочвоведения получены интересные данные о последействии натриевой соли 2,4-Д, внесенной в пар, занятый картофелем, а также о влиянии сочетания последействия и действия указанного гербицида на засоренность и урожай последующей культуры — озимой пшеницы (табл. 2).[ …]
В колхозах и совхозах Черниговской области сравнительно широко применяют гербициды для борьбы с сорняками на посевах зерновых и других культур. В колхозе «Жовтень» в 1959 г. обработали натриевой солью 2,4-Д в дозе 1 кг на 1 га 50 га посевов проса. В результате было уничтожено около 95% сорняков. Прибавка урожая от применения гербицида составила 3,5 ц с 1 га. На химическую прополку затратили в 15 раз меньше трудодней, чем на ручную. Повышение урожая проса от применения гербицидов подтверждается примерами других колхозов той же области (табл. 1).[ …]
В последние годы получили распространение синтетические моющие препараты MJI, «Лабомид», MC и др. Препараты МЛ-51 и МЛ-52 представляют собой смесь поверхностно-активных веществ с электролитами: натриевыми солями кремниевой и фосфорной кислот. Эти препараты выпускают в виде порошка или гранул белого и светло-желтого цвета. Препарат МЛ-51 используют для струйной очистки отложений при концентрации раствора в воде 10-20 г/л, препарат МЛ-52 — для очистки деталей вываркой от смолистых отложений при концентрации 25 — 35 г/л с температурой растворов 70-80 °С. Моющая способность препаратов МЛ в 2-3 раза выше растворов на основе каустической соды.[ …]
Содержание примесей достигало 27%, теплота сгорания сточной воды — 2800 кДж/л, потребление кислорода — 220 г Ог/л. Циклонный реактор имел водоохлаждаемую гарниссажную футеровку с кирпичной головной частью. Дутьевой воздух не подогревался.[ …]
В нашей стране в конце 40-х годов также было начато изучение антибиотических свойств лишайников. В результате этих исследований в Ботаническом институте АН СССР в Ленинграде был получен новый медицинский препарат — натриевая соль усниновой кислоты, или «Бинан». Основой для получения препарата явилась усниновая кислота. Исследование антимикробных свойств препарата показало, что он активен против грамположи-тельной бактериальной флоры — золотистого стафилококка, различных стрептококков, пневмококков, анаэробов и туберкулезной палочки. Препарат представляет собой эффективное наружное антимикробное средство для лечения нагноительных процессов в раневых поверхностях. В настоящее время это лекарство широко продается в аптеках в нескольких формах: в водно-спиртовых новокаиновых растворах, в касторовом масле с анестезином, в пихтовом бальзаме и в виде порошка. Препарат «Бинан» нашел применение в хирургической практике при лечении свежих посттравматических и послеоперационных раневых поверхностей, при лечении варикозных и трофических язв, острого гнойного воспалительного процесса мягких тканей, травматических остеомиелитов, при пластических операциях, при лечении ожогов II и III степени. Его применяют также в гинекологии.[ …]
Присутствие колофеновых кислот и других подобных продуктов окисления канифоли существенно изменяет ее свойства. Все они окрашены в темный цвет и поэтому сообщают канифоли более темную окраску. Они способны также вызвать потемнение натриевых солей смоляных кислот («загар» мыла).[ …]
Несмотря на несостоятельность химической теории для объяснения явлений процесса размола волокон целлюлозы, ее прогрессивное значение заключается в предопределении этой теорией положительной роли гидрофильных добавок (крахмала и его модификаций, натриевой соли карбоксиметилцеллюлозы и др.), использование которых при размоле волокон способствует ускорению процесса размола и увеличению механической прочности изготовляемой бумаги.[ …]
Величина пылеуноса из циклонного реактора определялась двумя способами — по количеству вытекающего расплава из летки и по запыленности отходящих газов, а теоретической выход расплава ■— путем прокаливания сухого остатка сточной воды при температуре 860° С в атмосфере двуокиси углерода. При этом все натриевые соли сточной воды превращались в карбонат натрия .[ …]
Усиление дыхания при опрыскивании растений арборици-дами сопровождалось значительным увеличением влажности побегов. У ольхи влажность побегов увеличилась в большей степени (150%), чем у березы (135%). У осины существенное увеличение влажности имело место при опрыскивании ее бутиловым эфиром 2,4-Д (125%), при опрыскивании же натриевой солью 2,4-Д влажность побегов увеличилась незначительно.[ …]
Если почва засорена осотом полевым, щавелем кислым, просом куриным, мышеем сизым и зеленым и др., дозировки спма-зина необходимо увеличить. Вьюнок полевой, бодяк полевой, хвощ полевой к гербициду довольно устойчивы. Хорошие результаты получаются от применения симазина в дозах 2—3 кг/га до всходов и от препаратов 2,4-Д после появления всходов кукурузы— натриевой соли 2,4-Д (0,7 — 1,0 кг/га), аминных солей (0,6—0,8 кг/га) и эфиров 2,4-Д (0,3 кг/га).[ …]
Предложенная классификация позволяет разделить сточные воды на сравнительно ограниченное число типов, для каждого из которых может быть выбрана наиболее рациональная технологическая схема огневого обезвреживания. В ней содержатся как легколетучие (циклогексан), так и высококипящие органические вещества (натриевые соли органических кислот), т. е. по наличию легколетучих веществ эта сточная вода должна быть отнесена к группе Б. Экспериментальное исследование огневого обезвреживания показало, что температура отходящих газов, равная 980— 1000° С, является рабочей. При этом натриевые соли органических кислот превращаются в карбонат натрия, а едкий натр подвергается карбонизации, т. е. конечным минеральным продуктом процесса обезвреживания является карбонат натрия, имеющий температуру плавления 850° С, близкую к рабочей температуре процесса. В связи с этим сточная вода входит в подгруппу 1. Известно, что при температуре 980—1000°С карбонат натрия частично возгоняется, поэтому рассматриваемую сточную воду следует отнести к подгруппе в. Таким образом, в соответствии с предложенной классификацией щелочной сток производства капролактама представляет сточные воды типа ПБ1в. Предложенная классификация сточных вод распространяется и на жидкие горючие отходы, в составе которых могут быть минеральные вещества и органические соединения некоторых металлов.[ …]
Наиболее злостными засорителями посевов проса являются щирица и щетинник. Щирица характеризуется высокой плодовитостью (одно растение способно дать тысячи семян). При достаточном прогреве почвы и выпадении осадков массовые всходы ее появляются одновременно с просом. В наших опытах количество щирицы на 1 м2 доходило до 280—300 шт., что составляло 79% от общего числа сорняков. Щирица полностью не уничтожается натриевой солью 2,4-Д. В опытах 1963 г. при опрыскивании целатоксом, ранкотексом и аминной солью 2,4-Д стебли щирицы искривлялись, вес их снижался на 62%, но растения полностью не погибали и дали семена.[ …]
Реакция протекает при условии, что концентрация щелочи невелика (несколько меньше 4%)- В присутствии раствора щелочи более высокой концентрации увеличивается скорость обратной реакции (т. е. регенерация целлюлозы и акриламида и/или образование продуктов его гидролиза), а также происходит гидролиз амидных групп в полученном эфире целлюлозы. Обработка целлюлозы ак-риламидом в присутствии 20—40%-ного раствора едкого натра является хорошим методом получения натриевой соли карбоксиэтил-целлюлозы [70, 71].[ …]
В результате производственных процессов в сточных водах бумажной фабрики могут содержаться: а) неиспользованные белильные растворы с хлором или хлорноватистокислым натрием, перекисью водорода, соляной кислотой или едким натром, применяемым для нейтрализации; б) вещества для наполнения бумаги, как фарфоровая глина, баритовые белила, сернокислый барий, глинозем и т. д.; в) вещества, неиспользованные для про-клеивания бумаги, как, например, сернокислый алюминий, смоляные кислоты, их натриевые соли и другие производные; г) красители как природные, так и органические, главным образом анилиновые и сернистые.[ …]
Исследования, проведенные в Финляндии, показали, что спрессованная в кипах еще теплая беленая целлюлоза при ее хранении заметно снижает свою белизну. Поэтому рекомендуется целлюлозу перед упаковкой охладить. Наличие в целлюлозе следов тяжелых металлов, в первую очередь железа и меди, также является причиной пожелтения целлюлозы, так как они образуют с карбонильными группами беленой целлюлозы неустойчивые комплексы, которые каталитически ускоряют ход окисления при отбелке. Обработкой целлюлозы натриевой солью этилендиаминтетрауксусной кислоты (трилон Б) или полифосфатами можно связать следы тяжелых металлов.[ …]
В связи с тем, что хлоруксусная кислота является твердым, кристаллическим веществом и для получения низкозамещенных продуктов она требуется в небольшом количестве по сравнению с целлюлозой, особенное значение имеет равномерное распределение реагирующих компонентов смеси. В одном из способов [116, 117 ] реакция была осуществлена путем обработки воздушносухой целлюлозы раствором натриевой соли монохлоруксусной кислоты в 17.5—18%-ном растворе NaOH при жидкостном модуле, равном 5 (отношение количества жидкости в мл к массе целлюлозы в г). Раствор соли приготавливался перед реакцией путем растворения соответствующей навески монохлоруксусной кислоты в щелочи такой концентрации, чтобы после нейтрализации она оставалась в пределах указанной величины.[ …]
Эти препараты представляют собой густую жидкость темного цвета с содержанием 50—60% действующего вещества. В состав препарата входит смачиватель-растекатель. Для авиационной обработки бутиловый эфир 2,4-Д выпускается без смачивателя или же с небольшим процентом его содержания в препарате. Эфиры 2,4-Д, так же как и предыдущие препараты, являются гербицидами избирательного действия и применяются в посевах злаковых культур для уничтожения двудольных сорняков. Эфиры 2,4-Д по эффективности превосходят натриевую соль в 2—2,5 раза, поэтому они применяются в значительно меньших дозах — 0,3—0,4 кг действующего вещества на 1 га.[ …]
Однолетние растения из семейства сложноцветных. Наиболее распространенными видами являются дурнишник калифорнийский, обыкновенный и колючий. Они не только сильно засоряют шерсть, но и являются опасными сорняками для пропашных культур особенно на юге страны. Благодаря высокой чувствительности дурнишников к действию многих гербицидов химические средства являются наиболее действенными в борьбе с ними. Опрыскивание можно проводить в течение всето- вегетационного периода, начиная с появления первой пары больших листьев вплоть до образования молодых незрелых соцветий. Для этой цели используют натриевую соль в дозе 1 кг/га действующего вещества. Эффект от этого препарата заметно увеличивается при добавлении в качестве активатора 5—10 кг/га аммиачной селитры. Доза кротшшна и бутилового эфира колеблется от 0,6 до 0,8 кг действующего вещества на 1 га, а аминной соли — 1,5 кг/га. Если дурнишник был подкошен, а отросшая отава еще настолько низкая, что косить ее больше не представляется возможным, то для уничтожения сорняка используют кротилин в дозе 1 кг/га и сульфамат аммония 150 кг/га действующего вещества. На посевах пропашных культур (кукуруза) дурнишник легко уничтожить внесением в почву атразина в дозе 2—4 кг/га.[ …]
Пищевая соль – натриевая и калиевая. Чем полезна и вредна соль?
Общий рейтинг статьи/Оценить статью
[Всего голосов: 6 Общая оценка статьи: 5]Пищевая соль с давних времен прочно вошла в нашу жизнь и продолжает удерживать лидирующие позиции. Без нее не обходится практически ни одно блюдо, ее добавляют даже в сдобное тесто для усиления вкуса. Пищевая соль имеет простую химическую формулу, и тем не менее участвует в весьма сложных химических реакциях. Интересно, что в организме человека она не синтезируется, то есть единственный вариант получения соли – с продуктами питания. Но при некоторых болезнях человек вынужден от нее отказаться. Для таких случаев даже разработали специальные бессолевые диеты, которые рекомендуются при ряде заболеваний. Почему так происходит и чем можно заменить пищевую соль – читайте в этой статье.
Чем полезна пищевая соль
В нашем организме содержится около 300 г соли. Вы только представьте себе, это почти треть стандартной упаковки! Пищевая соль имеет простую химическую формулу – натрий хлор (NaCl).
Мы знаем, что соль хорошо растворима в воде. При растворении она распадается на заряженные частички – ионы (натрий Na+ и хлор Cl—). Эти ионы выполняют несколько жизненно важных функций в организме человека – помогают провести воду и питательные вещества в клетки, а также вывести ненужные продукты обмена из клеток. Кроме того, натрий, который входит в состав пищевой соли принимает участие в проведении импульсов (сигналов) нервными клетками, в регуляции артериального давления и водно-минерального баланса.
Как же обычная соль может выполнять так много разных жизненно важных функций? Давайте рассмотрим механизм ее действия в деталях.
Организм человека на 70-80% состоит из воды, а это прекрасный растворитель. Растворяясь в пищеварительном тракте соль распадается на ионы натрия и хлора, и в таком виде попадает в кровь, которая приносит в клетки организма воду, питательные вещества и минералы. Клетки находятся в межклеточной жидкости, куда все эти компоненты переходят из крови. А дальше необходимо сделать так, чтобы они зашли в клетку.
Все клетки имеют оболочку (мембрану). И для того, чтобы все полезное попало внутрь клетки, а все ненужное ее покинуло, оказывается нужна пищевая соль. А вернее, ее компоненты.
Итак, наша соль попала из крови в межклеточную жидкость, которая естественно стала более соленой. Соль обладает уникальным свойством — она может “вытягивать” на себя воду. Таким образом, вода из клетки начинает выходить наружу. Это – химический процесс, который называется осмос.
Если внеклеточная жидкость очень соленая, то клетка теряет много воды. При этом уменьшается ее объем, и она сморщивается. Вместе с водой могут выйти и продукты обмена клетки.
Если же жидкость снаружи клетки менее соленая, чем внутри, то происходит обратный процесс. Межклеточная жидкость заходит в клетку “прихватив” с собой минералы и питательные вещества.
В тот момент, когда концентрация соли в клетке и за ее пределами выравнивается, транспорт воды, питательных веществ, минералов и продуктов обмена через клеточную мембрану прекращается.
Это один из пассивных способов питания и получения воды клеткой. Он назван так потому, что не требует затрат энергии.
Схематически этот процесс можно изобразить так:


Пищевая соль играет важную роль в питании клетки и выведении продуктов обмена из клетки.
Пищевая соль играет важную роль в питании клетки и выведении продуктов обмена из клетки.
Кроме того, натрий (Na+), вместе с калием (K+) участвует в передаче нервного импульса. Казалось бы, какое отношение к этому процессу может иметь пищевая соль? Дело в том, что натрий и калий представляют собой заряженные частички – ионы Na + и K+. Для того, чтобы получить электрический заряд натрий должен выйти из клетки, а калий зайти в нее. При этом механизм так устроен, что при выходе 3 ионов Na +, в клетку заходит только 2 иона K +, благодаря чему на поверхности оболочки (мембраны) клетки формируется потенциал – электрический заряд, который дает возможность для проведения нервного импульса или сигнала.
Благодаря соли происходит передача сигнала с мышечной ткани на нервную и наоборот.
Это был краткий обзор процессов, которые происходят с помощью пищевой соли на клеточном уровне. Какова же роль соли NaCl для организма в целом?
Натрий регулирует артериальное давление. При повышении уровня натрия в организме вырабатывается гормон вазопрессин (антдиуретический гормон). Он вызывает сужение кровеносных сосудов и задержку жидкости в организме. Это свойство соли важно для людей, которые страдают от пониженного давления. Натрий, который содержится в соли повышает артериальное давление, улучшая общее состояние. А вот людям, болеющим гипертонией, потребление поваренной соли нужно максимально урезать, чтобы не усугубить свое состояние.
Натрий и хлор содержится в поджелудочном соке и желчи, принимает участие в расщеплении жиров и переваривании белка.
Хлор входит в состав соляной кислоты желудочного сока принимая участие в важном этапе переработки пищи и в уничтожении большинства вредных вирусов и бактерий.
Соль поддерживает водно-электролитный баланс, то есть равновесие воды и микроэлементов в организме.
Виды пищевой соли
Пищевая соль бывает разных видов – каменная соль, соль экстра, розовая, черная и морская.
Каменная соль более крупная, добывается в солевых шахтах, и имеет примеси глину, окись железа, органические вещества.
Соль экстра – очищенная каменная соль, имеет белый цвет и более соленая на вкус. Такая пищевая соль имеет чистый состав — 100% NaCl.
Розовая гималайская пищевая соль имеет розовый цвет благодаря высокому содержанию окиси железа. Помимо хлорида натрия, она содержит еще около 80 микроэлементов,
Вред, виды и польза соли
Кто-нибудь задумывался о пользе и вреде соли, да и в целом, какие виды соли существуют, и функции которые они выполняют? В этой статье мы предлагаем подробно рассмотреть наиболее значимые разновидности соли и влияние каждого из них на наш организм.
Кроме как усилитель вкуса, в пищевой промышленности она также применяется для консервации и хранения рыбы и мяса.
В науке пищевых продуктов и питания — соленый — считается одним из пяти основных вкусов, распознаваемых рецепторами во рту. Остальные четыре: сладкий, горький, кислый и «безвкусный» (послевкусие глутаминовой кислоты).
Натриевая соль (NaCl)
Натриевая соль (NaCl) — это обычная пищевая соль, которую мы используем в повседневной жизни. Хотя, в настоящее время, в приправу включают смесь различных видов.
Польза: обогащает организм натрием, участвует в регулировании количества жидкости.
Вред: чрезмерное употребление хлорида натрия приводит к повышенной жажде и, как следствие, удержанию воды в клетках. А это чревато отеками и увеличением артериального давления.
Доказано, что при интенсивных занятиях физическими упражнениями из тела через пот выводится на 50% больше соли. Новейшие исследования указывают на прямую связь соли с метаболическими реакциями.
Рекомендуемая дозировка:
- До 5 граммов в день. Токсичной для взрослых считается доза более 11 г в сутки.
Калиевая соль (KCl)
Встречающуюся в овощах, калиевую соль используют в сочетании с натриевой. Это делается для того, чтобы сбалансировать водный баланс.
Польза: Выполняет функцию обогащения калием, который, в свою очередь, балансирует количество натрия и кальция.
Смешение калиевой и натриевой солей в пище исключает возникновение приступов жажды, контролируя количество жидкости. Обладает мочегонным эффектом, т. е. приводит к потере воды и кальция с мочой.
Вред: передозировка кальцием, чтоможет привести к таким последствиям, как обезвоживание, мышечные спазмы и, даже, к инфаркту.
Рекомендуемая дозировка:
- Средняя в день: 0,2 г
- Максимум: 1 г
Йодированная соль (KI/NaI)
Йодированная соль полезна для профилактики йододефицитных заболеваний. Дефицит йода приводит к проблемам щитовидной железы и нарушению метаболизма.
Польза: восполняет недостаток в йоде, калие и натрие.
Дозировка:
- Дети: 15-35 мг
- Взрослые: 130 мг
Фторированная соль (KF/NaF)
Этот тип используется в Европе, где не фторируют питьевую воду. Часто фтор используется в составе зубной пасты. Таким образом, в большинстве стран с нефторированной питьевой водой, добавление фторида калия или фторида натрия в соль является частой практикой.
Пока не существует единой точки зрения по поводу пользы фторированной соли.
Более того, есть исследования, доказывающие ее однозначный вред.
В связи с этим, мы воздержимся от публикации точных данных.
Цитрат натрия — Википедия
Материал из Википедии — свободной энциклопедии
Текущая версия страницы пока не проверялась опытными участниками и может значительно отличаться от версии, проверенной 4 мая 2017; проверки требуют 14 правок. Текущая версия страницы пока не проверялась опытными участниками и может значительно отличаться от версии, проверенной 4 мая 2017; проверки требуют 14 правок.| Цитрат натрия | |
|---|---|
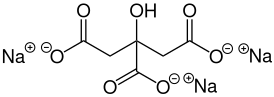 ( {{{картинка}}}) | |
| Хим. формула | Na3C6H5O7 |
| Состояние | белый кристаллический порошок |
| Молярная масса | 258,07 г/моль |
| Плотность | 1,7 г/см³ |
| Температура | |
| • плавления | 310 °C |
| Рег. номер CAS | 68-04-2 |
| PubChem | 6224 |
| Рег. номер EINECS | 200-675-3 |
| SMILES | |
| InChI | |
| Кодекс Алиментариус | E331iii |
| RTECS | GE8300000 |
| ChEBI | 53258 |
| ChemSpider | 5989 |
| NFPA 704 |  |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |
Цитра́т на́трия (лат. Natrii citras) — натриевая соль лимонной кислоты Na3C6H5O7. Цитрат натрия имеет средневыраженный солёно-кислый вкус. За эту особенность цитратов щелочных и щелочноземельных элементов (например цитратов натрия и кальция) они известны как «кислые соли» (иногда так ошибочно называют и лимонную кислоту). Цитрат натрия применяется в основном как специя (приправа), придающая особый вкус, или как консервант (пищевая добавка E331).
- Как вкусовая добавка входит в состав множества газированных напитков со вкусом лимона или лайма, а также в состав энергетических напитков.
- Цитрат может использоваться как буферное соединение, предотвращающее изменение pH.
- Применяется для управления кислотностью некоторых блюд, например желатиновых десертов.
- Является солью-плавителем, используемой при производстве плавленого сыра с самого момента его изобретения в 1911 году.
- Применяется для регулирования кислотности в кофе-машинах.
- Цитрат натрия образуется при растворении в воде множества «быстрорастворимых лекарств», таких как (антацид — от изжоги).
- Используется для уменьшения дискомфорта при инфекциях мочеполовой системы, таких как цистит, он уменьшает кислотность при периферических почечных ацидозах, и также применяется как регулятор осмоса (слабительное).
- В виде раствора является одним из компонентов среды для размораживания спермы животных при искусственном осеменении.
- В виде 5 % раствора используется при определении скорости оседания эритроцитов методом Панченкова.
- Используется в аналитической химии как компонент при определении ионов аммония[1].
- В виде 4 % раствора используется при аппаратной сдаче компонентов крови доноров как антикоагулянт.
- Может использоваться в стеклоочистительных жидкостях.
- Является одним из компонентов в лекарствах от обезвоживания.
- Используется в качестве замедлителя в гипсо-цементных растворах при цементировании скважин
В 1914 бельгийский врач Альбер Юстен[2] и аргентинский физик-исследователь Луис Аготе[3] успешно использовали цитрат натрия как антикоагулянт при переливании крови. Он до сих пор используется в медицине при взятии анализов крови и в банках крови (для переливания). Цитрат-ион образует комплексы с кальцием в крови, прерывая таким образом процесс свёртывания крови.
В 2003 году Оупик (V. Oöpik) и др. показали[4], что приём цитрата натрия в количестве примерно 37 грамм улучшает результат в забеге на 5 километров на 30 секунд.
В организме человека цитрат натрия и лимонная кислота существуют в основном в виде цитрат-иона. Цитрат-ион является одним из метаболитов цикла трикарбоновых кислот, образуется соединением оксалоацетата и ацетил-КоА под действием фермента цитратсинтазы в матриксе митохондрий. Именно этот процесс позволяет вступать ацетил-КоА в цитратный цикл, где он используется для получения энергии. Количество цитрата в митохондриях может изменяться в зависимости от энергозатрат организма и отдельных его органов, а также функционального состояния отдельных клеток. Так, в условиях голодания в гепатоцитах большая часть оксалоацетата занята в глюконеогенезе и количество образующегося цитрата резко сокращается.
Также цитрат-ион участвует в опосредованном транспорте ацетил-КоА из митохондрий в цитоплазму для нужд синтеза, например, жирных кислот. При этом цитрат переносится из матрикса митохондрии в цитоплазму, где под действием фермента АТФ-цитратлиазы расщепляется на ацетил-КоА и оксалоацетат. Следует отметить, что подобный транспорт осуществляется только в случае избытка цитрата в митохондриях, то есть когда клетка в полной мере обеспечивается энергией, и не протекает в случае его дефицита. Таким образом обеспечивается опосредованная регуляция транспорта ацетил-КоА и синтеза жирных кислот из митохондрий в зависимости от функционального состояния клеток.
- ↑ Standard Methods for the Examination of Water and Wastewater. Method 4500Nh4-F Архивная копия от 11 марта 2010 на Wayback Machine
- ↑ Albert Hustin (1882—1967), бельгийский врач. Был вторым, кто успешно применил при непрямом переливании крови цитрат натрия в качестве антикоагулянта.
- ↑ Luis Agote (22 сентября, 1868-12 ноября, 1954), — аргентинский физик-исследователь. Обучался в Национальном колледже Буэнос-Айреса, и Университете Буэнос-Айреса, где впоследствии и преподавал. Был одним из первых (оспаривается, первым или вторым) кто применил при непрямом переливании крови цитрат натрия в качестве антикоагулянта. Считается, что он первым применил этот метод в Латинской Америке, а бельгийский врач Альбер Юстен был первым «в мировой практике». Процедура была произведена в госпитале Роусона (Rawson hospital) в Буэнос-Айресе 9 ноября 1914 года.
- ↑ V Oöpik, I Saaremets, L Medijainen, K Karelson, T Janson, S Timpmann. Effects of sodium citrate ingestion before exercise on endurance performance in well trained college runners (англ.) // Br J Sports Med (англ.)русск. : journal. — 2003. — Vol. 37. — P. 485—489. (англ.)
Раствор Натрия Хлорид: инструкция по применению, что это такое, ингаляции, цена
Закрыть- Болезни
- Инфекционные и паразитарные болезни
- Новообразования
- Болезни крови и кроветворных органов
- Болезни эндокринной системы
- Психические расстройства
- Болезни нервной системы
- Болезни глаза
- Болезни уха
- Болезни системы кровообращения
- Болезни органов дыхания
- Болезни органов пищеварения
- Болезни кожи
- Болезни костно-мышечной системы
- Болезни мочеполовой системы
- Беременность и роды
- Болезни плода и новорожденного
- Врожденные аномалии (пороки развития)
- Травмы и отравления
- Симптомы
- Системы кровообращения и дыхания
- Система пищеварения и брюшная полость
- Кожа и подкожная клетчатка
- Нервная и костно-мышечная системы
- Мочевая система
- Восприятие и поведение
- Речь и голос
- Общие симптомы и признаки
- Отклонения от нормы
- Диеты
- Снижение веса
- Лечебные
- Быстрые
- Для красоты и здоровья
- Разгрузочные дни
- От профессионалов
- Монодиеты
- Звездные
- На кашах
- Овощные
- Детокс-диеты
- Фруктовые
- Модные
- Для мужчин
- Набор веса
- Вегетарианство
- Национальные
- Лекарства
- Антибиотики
- Антисептики
- Биологически активные добавки
- Витамины
- Гинекологические
- Гормональные
- Дерматологические
- Диабетические
- Для глаз
- Для крови
- Для нервной системы
- Для печени
- Для повышения потенции
- Для полости рта
- Для похудения
- Для суставов
- Для ушей
- Желудочно-кишечные
- Кардиологические
- Контрацептивы
- Мочегонные
- Обезболивающие
- От аллергии
- От кашля
- От насморка
- Повышение иммунитета
- Противовирусные
- Противогрибковые
- Противомикробные
- Противоопухолевые
- Противопаразитарные
- Противопростудные
- Сердечно-сосудистые
- Урологические
- Другие лекарства
- Врачи
- Клиники
- Справочник
- Аллергология
- Анализы и диагностика
- Беременность
- Витамины
- Вредные привычки
- Геронтология (Старение)
- Дерматология
- Дети
- Женское здоровье
- Инфекция
- Контрацепция
- Косметология
- Народная медицина
- Обзоры заболеваний
- Обзоры лекарств
- Ортопедия и травматология
- Питание
- Пластическая хирургия
- Процедуры и операции
- Психология
- Роды и послеродовый период
- Сексология
- Стоматология
- Травы и продукты
- Трихология
- Другие статьи
- Словарь терминов
- [А] Абазия .. Ацидоз
- [Б] Базофилы .. Булимия
- [В] Вазектомия .. Выкидыш
- [Г] Галлюциногены .. Грязи лечебные
- [Д] Дарсонвализация .. Дофамин
- [Е] Еюноскопия
- [Ж] Железы .. Жиры
- [З] Заместительная гормональная терапия
- [И] Игольный тест .. Искусственная кома
- [К] Каверна .. Кумарин
- [Л] Лапароскоп .. Люмбальная пункция
- [М] Магнитотерапия .. Мутация
Формула и свойства поваренной соли. Применение поваренной соли :: SYL.ru
Поваренная соль, формула которой NaCl, является пищевым продуктом. В неорганической химии данное вещество называют хлоридом натрия. В измельченном варианте поваренная соль, формула которой приведена выше, представляет собой белые кристаллы. Несущественные серые оттенки могут появляться при наличии иных минеральных солей в качестве примесей.
Производят ее в различных видах: неочищенном и очищенном, мелком и крупном, йодированном.

Биологическое значение
Кристалл поваренной соли, имеющий ионную химическую связь, необходим для полноценной жизни и деятельности человека, иных живых организмов. Хлорид натрия принимает участие в регулировании и поддержании водно-солевого баланса, щелочного обмена. Биологические механизмы контролируют постоянство концентрации хлористого натрия в различных жидкостях, например, в крови.
Разность концентраций NaCl внутри клетки и снаружи – основной механизм для попадания внутрь питательных веществ, а также вывода продуктов жизнедеятельности. Аналогичный процесс применяется в генерации и передаче нейронами импульсов. Также анион хлора в данном соединении – основной материл для образования соляной кислоты, важнейшего компонента желудочного сока.
Дневная потребность в этом веществе составляет от 1,5 до 4 граммов, а для жаркого климата доза хлорида натрия возрастает в несколько раз.
Организм нуждается не в самом соединении, а в катионе Na+ и анионе Cl-. При недостаточном количестве этих ионов происходит разрушение мышечной и костной тканей. Появляются депрессии, психические и нервные заболевания, нарушения в деятельности сердечно-сосудистой системы и процессах пищеварения, спазмы мускулатуры, анорексия, остеопороз.
Хроническая нехватка ионов Na+ и Cl- приводит к смерти. Биохимик Жорес Медведев отмечал, что при полном отсутствии в организме соли можно продержаться не больше 11 суток.
Племена скотоводов и охотников еще в древности для удовлетворения потребности организма в соли, употребляли в сыром виде мясопродукты. Земледельческие племена потребляли растительную пищу, в которой незначительное количество хлористого натрия. В качестве признаков, сигнализирующих о нехватке соли, выделяют слабость и головную боль, тошноту, головокружение.

Особенности производства
В далеком прошлом добыча соли осуществлялась путем сжигания в кострах определенных растений. Образующуюся золу применяли в виде приправы.
Очистка поваренной соли, полученной путем выпаривания морской воды, не проводилась, полученное вещество сразу же употреблялось в пищу. Такая технология возникла в странах с жарким и сухим климатом, где подобный процесс происходил без вмешательства человека, а затем, когда его переняли иные страны, морская вода стала подогреваться искусственным путем.
На берегах Белого моря строились солеварни, в которых путем выпаривания и замораживания получали концентрированный рассол и пресную воду.

Природные месторождения
Среди мест, характеризующихся большими запасами поваренной соли, выделим:
- Артемовское месторождение, расположенное в Донецкой области. Здесь осуществляется добыча соли шахтовым способом;
- озеро Баскунчак, перевоз ведется по специально построенной железной дороге;
- калийные соли в большом количестве обнаружены в Верхнекамском месторождении, где шахтовым способом идет добыча этого полезного ископаемого;
- в Одесских лиманах велась добыча до 1931 года, в настоящее время месторождение не используется в промышленных объемах;
- в Сереговском месторождении проводится выпаривание рапы.
Соляная шахта
Биологические свойства поваренной соли сделали ее важным экономическим объектом. На 2006 год на российском рынке использовалось порядка 4,5 миллионов тонн данного минерала, причем 0,56 млн тонн шло на пищевые расходы, а оставшиеся 4 миллиона тонн уходили на нужды химической промышленности.

Физические характеристики
Рассмотрим некоторые свойства поваренной соли. Данное вещество достаточно хорошо растворяется в воде, причем на процесс влияет несколько факторов:
- температура;
- наличие примесей.
Кристалл поваренной соли содержит примеси в виде катионов кальция, магния. Именно поэтому хлорид натрия впитывает воду (сыреет на воздухе). Если такие ионы не входят в состав поваренной соли, такое свойство отсутствует.
Температура плавления поваренной соли — 800,8 °С, что свидетельствует о прочной кристаллической структуры данного соединения. При смешивании мелкого порошка хлорида натрия с измельченным льдом получают охладитель высокого качества.
Например, 100 г льда и 30 г поваренной соли могут снижать температуру до −20 °C. Причина подобного явления в том, что раствор поваренной соли замерзает при температуре ниже 0 °C. Лед, для которого это значение является температурой плавления, плавится в подобном растворе, поглощая тепло окружающей среды.
Высокая температура плавления поваренной соли объясняет ее термодинамические характеристики, а также высокую диэлектрическую проницаемость – 6,3.

Получение
Учитывая, насколько важны биологические и химические свойства поваренной соли, ее существенные природные запасы, нет необходимости разрабатывать вариант промышленного производства данного вещества. Остановимся на лабораторных вариантах получения хлорида натрия:
- Данное соединение можно получить в качестве продукта при взаимодействии сульфата меди (2) с хлоридом бария. После удаления осадка, в качестве которого выступает сульфат бария, выпаривания фильтрата, можно получить кристаллы поваренной соли.
- При экзотермическом соединении натрия с газообразным хлором также образуется хлористый натрий, причем процесс сопровождается выделением существенного количества тепла (экзотермический вид).
Взаимодействия
Каковы химические свойства поваренной соли? Данное соединение образовано сильным основанием и сильной кислотой, поэтому гидролиз в водном растворе не протекает. Нейтральность среды и объясняет применение поваренной соли в пищевой промышленности.
При электролизе водного раствора данного соединения на катоде выделяется газообразный водород, а на аноде идет процесс образования хлора. В межэлектродном пространстве накапливается гидроксид натрия.
Учитывая, что получаемая щелочь – вещество, востребованное в различных производственных процессах, это также объясняет применение поваренной соли в промышленных масштабах на химическом производстве.
Плотность поваренной соли составляет 2,17 г/см3. Кубическая гранецентрированная кристаллическая решетка характерна для многих минералов. Внутри ее преобладают ионные химические связи, образуемые за счет действия сил электростатического притяжения и отталкивания.

Галит
Так как плотность поваренной соли в этом соединении достаточно высока (2,1—2, 2 г/см³), галит – твердый минерал. Процентное содержание катиона натрия в нем составляет 39,34 %, аниона хлора – 60, 66%. Помимо этих ионов, в составе галита есть в виде примесей ионы брома, меди, серебра, кальция, кислорода, свинца, калия, марганца, азота, водорода. Этот прозрачный бесцветный минерал, имеющий стеклянный блеск, образуется в замкнутых водоемах. Галит является продуктом сгона на кратерах вулканов.
Каменная соль
Он представляет собой горную осадочную породу из группы эвапоритов, которая состоит более чем на 90 процентов из галита. Для каменной соли характернее белоснежный цвет, лишь в исключительных случаях присутствие глины дает минералу серый оттенок, а наличие оксидов железа придает соединению желтый, оранжевый цвет. В каменной соли присутствует не только хлорид натрия, но и множество иных химических соединений магния, кальция, калия:
- иодиды;
- бораты;
- бромиды;
- сульфаты.
В зависимости от условий формирования, основные месторождения каменной соли подразделяют на несколько видов:
- подземные соляные воды;
- рассолы современных бассейнов;
- залежи минеральных солей;
- ископаемые месторождения.
Морская соль
Она является смесью сульфатов, карбонатов, хлоридов калия и натрия. В процессе ее испарения при диапазоне температур от +20 до +35 °C первоначально происходит кристаллизация менее растворимых солей: карбонатов магния и кальция, а также сульфата кальция. Далее в осадок выпадают растворимые хлориды, а также сульфаты магния и натрия. Последовательность кристаллизации этих неорганических солей может меняться с учетом температурного показателя, скорости процесса испарения, иных условий.
В промышленных объемах морская соль получается из воды морей путем выпаривания. Она существенно отличается по микробиологическим и химическим показателям от каменной соли, имеет большое процентное содержание йода, магния, калия, марганца. Из-за различного химического состава есть отличия и в органолептических показателях. Применяют морскую соль в медицине в качестве средства при лечении кожных заболеваний, например, псориаза. Среди распространенных продуктов, предлагаемых в аптечной сети, выделим соль Мертвого моря. Также морская соль в очищенном виде предлагается и в пищевой промышленности как йодированная.
Обычная поваренная соль имеет слабые антисептические свойства. При процентном содержании данного вещества в диапазоне 10-15 процентов можно предотвратить появление гнилостных бактерий. Именно для этих целей хлорид натрия добавляют в виде консерванта к пище, а также иным органических массам: древесине, клею, коже.

Злоупотребление солью
По информации Всемирной организации здравоохранения, избыточное потребление хлорида натрия приводит к существенному повышению кровяного давления, в результате чего нередко развиваются болезни почек и сердца, желудка, формируется остеопороз.
Вместе с другими солями натрия хлорид натрия является причиной появления заболеваний глаз. Поваренная соль задерживает внутри организма жидкость, что приводит к повышению внутриглазного давления, формированию катаракты.
Вместо заключения
Хлорид натрия, называемый в повседневной жизни поваренной солью, является широко распространенным в природе неорганическим минералом. Этот факт существенно упрощает его применение в пищевой, химической промышленности. Нет необходимости тратить временные и энергетические ресурсы на промышленное получение данного вещества, что сказывается на его стоимости. Для того чтобы не допускать переизбытка данного соединения в организме, необходимо контролировать ежедневное употребление соленых продуктов.
Глауберова соль — Википедия
Глауберова соль (мирабилит) — Na2SO4·10H2O, десятиводный кристаллогидрат (декагидрат) сульфата натрия. Впервые обнаружена химиком И. Р. Глаубером в составе минеральных вод, а впоследствии синтезирована действием серной кислоты на хлорид натрия. Применяется в стекольном и содовом производстве, в медицине.
Другие названия: Sal glauberi, мирабилит, сибирская соль, гуджир, сернокислый натрий.
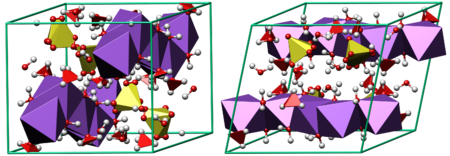 Кристаллическая структура мирабилита
Кристаллическая структура мирабилитаПредставляет собой большие прозрачные кристаллы в форме призм. Имеет горький солёный вкус и тает на языке. Не имеет запаха. Хорошо растворима в воде. Не горит, в огне не трещит. При длительном нахождении на воздухе или нагревании выветривается (выпаривается) и теряет массу. При полном выветривании становится обычным сульфатом натрия — порошком белого цвета. Кроме само́й десятиводной глауберовой соли известны ромбические кристаллы семиводного кристаллогидрата Na2SO4·7H2O и одноводная соль Na2SO4·H2O.
Природный минерал глауберовой соли называется мирабилит. Его плотность составляет всего 1,49 г/см³, что делает его одним из самых лёгких минералов.
Залежи порядка 100 млн тонн мирабилита обнаружены близ провинции Саскачеван в центральной части Канады.
В Грузии в XIX веке мирабилит был обнаружен в 30 км от г. Тбилиси. Эти залежи представляли собой высохшее солёное озеро площадью около 55 тыс. м². Пласт мирабилита толщиной порядка 5 метров был сверху покрыт пластом песчаной глины толщиной от 30 см до 4,5 м.
В зимнее время, в период примерно с 20 ноября по 15 марта, когда температура воды Каспийского моря опускается до 5,5−6 °C, мирабилит выпадает в больших количествах из вод залива Кара-Богаз-Гол в Туркмении, оседая бесцветными кристаллами на дне и берегах залива.
Мирабилит также содержится в озере Кучук в Западной Сибири, в соляных озёрах Томской области, в Алтайском крае (оз. Большое Яровое и Бурлинское оз.)).
В других месторождениях, например, в Калифорнии (США), Сицилии, Германии, в Большом Малиновском озере (Астраханская область), мирабилит встречается с примесями других минералов — астраханита Na2Mg(SO4)2 · 4H2O, левеита Na2Mg(SO4)2 · 2,5H2O, вантгоффита Na6Mg(SO4)4, глауберита Na2Ca(SO4)2, глазерита Na2K6(SO4)4.
В растворённом виде глауберова соль в значительном количестве присутствует в морской воде и во многих минеральных водах, например, курортов Карловы Вары, Мариенбад в Чехии. Карловарская соль, получаемая из минеральных вод Карловых Вар, на 44% состоит из сульфата натрия (глауберовой соли), на 36% из гидрокарбоната натрия (пищевой соды), на 18% из хлорида натрия (поваренной соли) и на 2% из сульфата калия.
Также мирабилит встречается в виде налёта и корок на залежах гипса и каменной соли.
Очень редко в природе встречается безводный сульфат натрия — минерал тенардит, названный в честь французского химика Л. Ж. Тенара. Для его сохранения в безводном виде необходимы засушливые пустынные зоны. Поэтому такие залежи обнаружены в Чили, в Центральной Азии, в штате Аризона (США), а также в Испании в долине реки Эбро.
Открытие глауберовой соли датировано зимой 1626 года и непосредственно связано с перенесённой в 1625 году Глаубером болезнью — сыпным тифом, в то время именуемого «венгерской лихорадкой». Вот как сам Глаубер описывал это:
Несколько оправившись от болезни, я прибыл в Неаполис (латинизированное название Нойштадта, по-немецки — «нового города»; в Германии несколько городов имеют такое название). Там у меня снова начались приступы, и я должен был остаться в этом городе. Болезнь настолько ослабила мой желудок, что он не мог ни принимать, ни переваривать никакую еду. Местные жители посоветовали мне пойти к источнику, находящемуся вблизи виноградника в часе ходьбы от города. Они сказали, что вода источника вернет мне аппетит. Следуя их совету, я взял с собой большой кусок хлеба; мне сказали, что должен буду весь его съесть, но я мало верил в то, что это мне как-то поможет. Придя к источнику, я намочил хлебный мякиш в воде и съел его — причём с большим удовольствием, хотя перед этим не мог смотреть без отвращения на самые изысканные лакомства. Взяв оставшуюся от хлеба корку, я зачерпнул ею воды из источника и выпил её. Это настолько возбудило мой аппетит, что в конце концов я съел и «чашку» из хлеба, которой черпал воду. Домой я возвратился значительно окрепшим и поделился своими впечатлениями с соседями. Я чувствовал, что если буду и дальше лечиться этой водой, функции моего желудка полностью восстановятся. Я спросил, что это за вода. Мне сказали, что в ней содержится селитра, чему тогда, не будучи искушён в подобных вопросах, я поверил.
Глаубер заинтересовался химическим составом воды источника и посвятил этому изучению всю следующую зиму. Он подружился с местным аптекарем Айснером и использовал его лабораторию для опытов. В ходе исследований он выпаривал минеральную воду и анализировал осадки. Вместо селитры в осадке оказалась ранее неизвестная соль, которую он назвал «чудесной» — по латыни «sal mirabile». В частности, название природного минерала мирабилита происходит именно из латинского названия.
Спустя много лет, в 1648 году, Глаубер проводил опыты с кислотами, а точнее получал соляную кислоту путём нагревания обычной каменной соли с серной кислотой. При слабом нагревании шла реакция образования гидросульфата натрия: NaCl + H2SO4 = NaHSO4 + HCl, а при сильном — сульфата натрия: 2NaCl + H2SO4 = Na2SO4 + 2HCl. Каково же было удивление Глаубера, когда он обнаружил, что большие прозрачные кристаллы, выпавшие в осадок, оказались той самой «чудесной солью», с которой он познакомился в молодости. В результате одной реакции Глаубер открыл и способ получения соляной кислоты, и синтеза сульфата натрия.
Используется при производстве соды, гипосульфата, ультрамарина; кроме того, в стекольной промышленности, в холодильном деле, в медицине. Глауберова соль применяется в медицине при запорах, как слабительное средство внутрь по 15—30 г на приём.
Мирабилит в художественной литературе[править | править код]
В 1932 году в Советском Союзе публикуется производственная повесть Константина Паустовского «Кара-Бугаз». Это произведение рассказывает о непростой добыче глауберовой соли в заливе Кара-Богаз-Гол и о тех богатствах природы, которые должен освоить человек. После публикации этого произведения коллеги по писательскому цеху стали называть Паустовского «мирабилит нашей литературы».[1]
- ↑ Литературоведческие заметки о К. Г. Паустовским или его же автобиографическая «Повесть о жизни».
- Илья Леенсон. Чудесная соль Иоганна Глаубера. // Энциклопедия для детей. Том 17. Химия. М.: Аванта+, 2000, с. 457; 2-е изд, перераб., 2006, с.463.
- Химический словарь школьника / Б. Н. Кочергин, Л. Я. Горностаева, В. М. Макаревский, О. С. Аранская. — Мн.: Народная асвета, 1990. — 255 с. — 75 000 экз. — ISBN 5-341-00127-3.
