31)Фолиевая кислота. Строение и биологическая роль. Биохимические функции тгфк в транспорте одноуглеродных соединений. Суточная потребность.
Фолиевая кислота (витамин Вc, витамин B9)
Фолиевая кислота состоит из трёх структурных единиц: остатка птеридина (I), парааминобензойной (II) и глутаминовой (III) кислот.
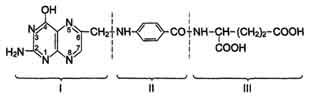
Витамин, полученный из разных источников, может содержать 3-6 остатков глутаминовой кислоты. Фолиевая кислота была вьщелена в 1941 г. из зелёных листьев растений, в связи с чем и получила своё название (от лат. folium — лист).
Источники. Значительное количество этого витамина содержится в дрожжах, а также в печени, почках, мясе и других продуктах животного происхождения.
Суточная потребность в фолиевой кислоте колеблется от 50 до 200 мкг; однако вследствие плохой всасываемости этого витамина рекомендуемая суточная доза — 400 мкг.
Биологическая роль фолиевой кислоты определяется тем, что она служит субстратом для синтеза коферментов, участвующих в реакциях переноса одноуглеродных радикалов различной степени окисленности: метальных, оксиметильных, формильных и других. Эти коферменты участвуют в синтезе различных веществ: пуриновых нуклеотидов, превращении с!УМФ в сПГМФ, в обмене глицина и серина (см. разделы 9, 10).
Наиболее характерные признаки авитаминоза фолиевой кислоты — нарушение кроветворения и связанные с этим различные формы малокровия (макроцитарная анемия), лейкопения и задержка роста. При гиповитаминозе фолиевой кислоты наблюдают нарушения регенерации эпителия, особенно в ЖКТ,обусловленные недостатком пуринов и пиримидинов для синтеза ДНК в постоянно делящихся клетках слизистой оболочки. Авитаминоз фолиевой кислоты редко проявляется у человека и животных, так как этот витамин в достаточной степени синтезируется кишечной микрофлорой. Однако использование сульфаниламидных препаратов для лечения ряда заболеваний может вызвать развитие авитаминозов. Эти препараты — структурные аналоги парааминобензойной кислоты, ингибирующие синтез фолиевой кислоты у микроорганизмов (см. раздел 2). Некоторые производные птеридина (аминоптерин и метотрексат) тормозят рост почти всех организмов, нуждающихся в фолиевой кислоте. Эти препараты находят применение в лечебной практике для подавления опухолевого роста у онкологических больных.
Доказано, что коферментные функции ТГФК непосредственно связаны с переносом одноуглеродных групп, первичными источниками которых в организме являются β-углеродный атом серина, α-углеродный атом глицина,углерод метальных групп метионина, холина, 2-й углеродный атом индольного кольца триптофана, 2-й углеродныйатом имидазольного кольца гистидина, а также формальдегид, муравьиная кислота и метанол.
32) Витамин В12. Общие представления о структуре. Авитаминоз и причины его возникновения. Внутренний фактор Касла (транскоррин), его роль в усвоении витамина В
Витамин В12 (кобаламин)
Витамин В12 был выделен из печени в кристаллическом виде в 1948 г. В 1955 г. Витамин В12 — единственный витамин, содержащий в своём составе металл кобальт (рис. 3-2).
Источники. Ни
животные, ни растения не способны
синтезировать витамин В12.
Это единственный витамин, синтезируемый
почти исключительно микроорганизмами:
бактериями, актиномицетами и сине-зелёными
водорослями. Из животных тканей наиболее
богаты витамином В
Суточная потребность
Витамин В12 служит источником образования двух коферментов: метилкобаламина в цитоплазме и дезоксиаденозилкобаламина в митохондриях (рис. 3-2).
Метил-В12 — кофермент, участвующий в образовании метионина из гомоцистеина. Кроме того, метил-В12 принимает участие в превращениях производных фолиевой кислоты, необходимых для синтеза нуклеоти-дов — предшественников ДНК и РНК.
Дезоксиаденозилкобаламин в качестве кофермента участвует в метаболизме жирных кислот с нечётным числом углеродных атомов и аминокислот с разветвлённой углеводородной цепью (см. разделы 8, 9).
Основной признак авитаминоза В12 — макроцитарная (мегалобластная) анемия. Для этого заболевания характерны увеличение размеров эритроцитов, снижение количества эритроцитов в кровотоке, снижение концентрации гемоглобина в крови. Нарушение кроветворения связано в первую очередь с нарушением обмена нуклеиновых кислот, в частности синтеза ДНК в быстроделящихся клетках кроветворной системы. Помимо нарушения кроветворной функции, для авитаминоза В12 специфично также расстройство деятельности нервной системы, объясняемое токсичностью метилмалоновой кислоты, накапливающейся в организме при распаде жирных кислот с нечётным числом углеродных атомов, а также некоторых аминокислот с разветвлённой цепью.
Недостаток кобаламина может возникать при заболеваниях желудка, в котором вырабатывается внутренний фактор Касла (транскоррин), необходимый для всасывания витамина В12.
Витамины-коферменты В12, фолиевая кислота участие в метаболических процессах, биохимические проявления гиповитаминозов
ФОЛИЕВАЯ КИСЛОТА (ВИТАМИН ВС, ВИТАМИН B9)
Структура. Фолиевая кислота состоит из трёх структурных единиц: остатка птеридина, парааминобензойной и глутаминовой кислот. Витамин, полученный из разных источников, может содержать 3—6 остатков глутаминовой кислоты.
Фолиевая кислота была выделена в 1941г. из зелёных листьев растений, в связи, с чем и получила своё название (от лат.
Физико-химические свойства.
Источники.Значительное количество этого витамина содержится в дрожжах, печени, почках, мясе и других продуктах животного происхождения. Этот витамин в достаточной степени синтезируется кишечной микрофлорой.
Суточная потребностьв фолиевой кислоте колеблется от 0,05-0,4мг; однако, вследствие плохой всасываемости этого витамина рекомендуемая суточная доза — 400 мкг.
Активация.Активная форма фолиевой кислоты – ТГФК. Она образуется в печени при восстановлении фолиевой кислоты с участием фолатредуктазы и дигидрофолатредуктазы, коферментом которых служит НАДФН
Биологическая роль.ТГФК принимает от АК одноуглеродные фрагменты: серин и глицин дают метиленовый фрагмент (-СН2-), гистидин – формимино- и формильный фрагменты.
В составе ТГФК одноуглеродные фрагменты могут подвергаться взаимопревращениям: метиленовая группа превращаться в метенильную (-СН=), формильную (-НС=О), метильную (-СН3) и формиминогруппу (-CH=NH).
Затем ТГФК отдает одноуглеродные фрагменты на:
· синтез пуриновых оснований
· синтез тимидиловой кислоты
· регенерацию метионина
· превращение дУМФ в дТМФ;
· превращение глицина в серина и т.д.
Нарушение обмена.Гиповитаминоз фолиевой кислоты возникает редко, его вызывает использование сульфаниламидных препаратов. Сульфаниламиды — структурные аналоги парааминобензойной кислоты, они ингибируют синтез фолиевой кислоты у микроорганизмов, вызывая их гибель. Некоторые производные птеридина (аминоптерин и метотрексат) тормозят рост почти всех организмов, нуждающихся в фолиевой кислоте, их используют для подавления опухолевого роста у онкологических больных.
Гиповитаминоз фолиевой кислоты приводит к:
1. мегалобластической (макроцитарной) анемии. Она характеризуется уменьшением количества эритроцитов, снижением содержания в них гемоглобина, что вызывает увеличение размера эритроцитов. Причина — нарушение синтеза ДНК и РНК из-за недостатка тимидиловой кислоты и пуриновых нуклеотидов.
2. лейкопении;
3. задержке роста.
4. нарушению регенерации эпителия, особенно в ЖКТ (связано с недостатком нуклеотидов для синтеза ДНК в постоянно делящихся клетках слизистой оболочки).
ВИТАМИН В12 (КОБАЛАМИН)
Структура. Витамин В12 — единственный витамин, содержащий в своём составе металл кобальт.
Физико-химические свойства.
Источники.Витамин В12 синтезируют только микроорганизмы: бактерии, актиномицеты и сине-зелёные водоросли. Из животных тканей наиболее богаты витамином В
Суточная потребностьв витамине В12 крайне мала и составляет всего 0,001-0,002мг.
Активация.Из витамина В12 образуются 2 кофермента: метилкобаламин в цитоплазме и дезоксиаденозилкобаламин в митохондриях.
Биологическая роль. Метилкобаламин участвует: в образовании метионина из гомоцистеина и в превращениях одноуглеродных фрагментов в составе ТГФК, необходимых для синтеза нуклеотидов.
Дезоксиаденозилкобаламин участвует: в метаболизме ЖК с нечётным числом углеродных атомов и АК с разветвлённой углеводородной цепью.
Нарушение обмена.Гиповитаминоз возникает при нарушении всасывании В12 из-за дефицита фактора Касла. Фактор Касла — гликопротеин с молекулярной массой 93000Да, который синтезируется обкладочными клетками желудка. В ЖКТ фактор Касла соединяется с витамином B12 при участии Ca2+, защищает его от разрушения и обеспечивает всасывание. Дефицит фактора Касла возникает при пониженной кислотности желудочного сока (может быть результатом повреждения слизистой оболочки желудка), после тотального удаления желудка при хирургических операциях.
Гиповитаминоз В12 сопровождается:
1. макроцитарной (мегалобластической) анемией: снижение числа эритроцитов, гемоглобина, увеличение размера эритроцитов. Причина — нарушение синтеза нуклеиновых кислот в быстроделящихся клетках кроветворной системы.
2. расстройствами деятельности нервной системы. При катаболизме жирных кислот с нечетным количеством атомов С и разветвленных АК из-за дефицита В12 накапливается нейротоксичная метилмалоновая кислота.
Фолиевая кислота, ее производные как коферменты
Процессы метилирования теснейшим образом связаны с метаболизмом метионина, который синтезируется из гомоцистеина путем переноса на него метиЛьной группы. Источниками метильной группы при биосинтезе метионина могут быть одноуглеродные фрагменты глицина, серина, треонина. Этот процесс осуществляется с помощью коферментов — производных фолиевой кислоты и витамина Bij. [c.113]Молекула фолиевой кислоты (I) и ее производных, осуществляющих функции кофакторов в процессах метаболизма, таких, как 5,6,7,8-тетрагидро-птероил- -глутаминовая кислота, 5-N-фopмил-5,6,7,8-тeтpaгидpoптepoил-L-глутаминовая кислота (фолиновая кислота) и др. (см. раздел Птериновые коферменты ), в основной своей части высокоспецифична. Так, для проявления витаминных свойств обязательна птериновая структура, [c.485]
Дигндробиоптерин, являющийся производным фолиевой кислоты, играет роль кофермента при гидроксилировании фенилаланина. [c.209]
Некоторым витаминам принадлежит особо важная роль в азотистом обмене. Подвергаясь в организме фосфорилированию, а в некоторых случаях более сложным превращениям, они дают начало образованию небелковых компонентов ферментов, катализирующих реакции превращения аминокислот. Витамин Ва (флавин) является составной частью кофермента оксидазы О- и .-аминокислот и аминооксидаз. Пантотеновая кислота входит в состав кофермента ацилирования, играющего важную роль в обмене безазотистых соединений, образующихся из аминокислот (а-кетокислот и др.) и ряда азотистых веществ. Фолиевая кислота и ее производные участвуют в процессах, приводящих к использованию метильных групп метионина, формильных, оксиметильных групп (остатков муравьиной кислоты и формальдегида), возникающих при превращении ряда аминокислот (серина, глицина, гистидина, триптофана). Особо важное место в азотистом обмене занимает витамин В( (пиридоксаль). В виде своего фосфорного эфира Вд служит коферментом ряда ферментов, участвующих в превращениях аминокислот. В частности, ферменты, катализирующие переаминирование аминокислот, содержат в виде кофермента пиридоксальфосфат. Авитаминоз В сопровождается, особенно у микроорганизмов, ослаблением и даже прекращением реакций переаминирования. Пиридоксальфосфат является также коферментом декарбоксилаз аминокислот. Вместе с этим тшридоксальфосфат входит (в виде кофермента) в состав ряда других ферментов, участвующих в превращениях определенных аминокислот (триптофана, серина, серусодержащих аминокислот). [c.433]
Все фолиевые коферменты, участвующие в переносе и взаимопревращении одноуглеродных групп атомов со степенью окисления уровня муравьиной кислоты, формальдегида и метанола, являются производными 5,6,7,8-тетрагидрофолиевой кислоты (50). [c.603]
Пиразино[2,3-г/]пиримидины известны как птеридины [197], поскольку впервые природные соединения с подобной бициклической системой были обнаружены в пигментах, таких, как ксантоптерин (желтый), содержащийся в крыльях бабочек (Ьер1йор1ега). Впоследствии птеридиновая циклическая система была обнаружена в коферментах, использующих тетрагидрофолиевую кислоту (производное витамина фолиевой кислоты), кофакторах оксомолибдоферментах [198] и родственных ферментах, содержащих вольфрам. Птеридиновая система также присутствует в противоопухолевом препарате метотрексате. [c.294]
N , N -метилентетрагидрофолат принадлежит к семейству коферментов, представляющих собой производные фолиевой кислоты подобно S-аденозилме-тионину и коферменту эти про- [c.658]
Как уже указывалось, п-аминобензойная кислота является веществом, необходимым для роста многих бактерий, в том числе патогенных пневмококков (возбудители пневмонии, или воспаления легких), менингококков (возбудители менингита), гонококков (возбудители гонореи), дизентерийных бактерий и ряда других. В средах, не содержащих п-аминобензойной кислоты, все эти патогенные микроорганизмы размножаться не могут. По-видимому, п-аминобензойная кислота играет роль кофермента в каких-то важных ферментных системах бактерий. Вероятно, она необходима для синтеза этими микроорганизмами фолиевой кислоты и ее производных. [c.179]
В состав ТГФ входят восстановленный птеридин, /г-аминобензойная кислота и L-глутаминовая кислота. Полиглутаминовые производные ТГФ, содержащие до семи остатков глутаминовой кислоты, связанных посредством у-глута-мильных пептидных связей, также встречаются в биологических системах и осуществляют те же биологические функции, что и ТГФ. После того как обнаружилось, что фолиевая кислота является фактором роста для молочнокислых бактерий, начались исследования по выяснению биохимической роли ТГФ-коферментов. Зависимость роста молочнокислых бактерий от фолиевой кислоты была использована в качестве теста при очистке и выделении этого вещества, что дало возможность исследовать его структуру. В ранних работах удавалось выделить только фолиевую кислоту, что объясняется легким окислением ТГФ. Фолиевая кислота может быть ферментативно восстановлена до ТГФ. Для дигидрофолата возможны три структурных изомера (7,8-, 5,6- и 5,8-) однако как при химических, так и при ферментативных реакциях был однозначно идентифицирован только 7,8-изомер. [c.226]
Большую роль в процессах метаболизма, в частности в синтезе нук-леопротеидов, играют коферменты, относящиеся к производным фолиевой кислоты. Строение тетрагидрофолиевой кислоты показано ниже [c.77]
Аналоги витаминов, способные замещать витамины в ферментах, по химической структуре, как правило, являются производными витаминов, но не способны выполнять их функции в реакциях ферментативного катализа. Такие соединения называются антивитаминами. Примерами антивитаминов могут служить сульфаниламидные препараты, которые включаются вместо ПАБК в структуру фолиевой кислоты, синтезирующейся в микроорганизмах, и блокируют функции фолатзависимых коферментов. В итоге прекращается размножение чувствительных к сульфаниламидам микроорганизмов. На антивитаминном действии сульфаниламидных препаратов основано их применение в медицинской практике для лечения инфекционных заболеваний. Для лечения лейкозов и других форм рака применяют птеридин и его производные, которые вытесняют фолиевую кислоту из фолатзависимых ферментативных реакций, блокируя тем самым синтез нуклеиновых кислот, что проявляется в торможении деления клеток. Таким образом, специфическое действие антивитаминов позволило использовать их в медицинской практике для лечения бактериальных инфекций и опухолевых заболеваний.
Фолиевая кислота
Фолиевая кислота плохо растворима в воде и органических растворителях, но хорошо в щелочных растворах. Разрушается под действием света, при обработке и консервировании овощей.
Метаболизм. Витамин В9 , всасываясь в тонком кишечнике, восстанавливается в энтероцитах до тетрагидрофолиевой кислоты (ТГФК) и N5-метил-ТГФК. В крови основное количество витамина входит в состав эритроцитов. Депонируется он в печени, почках и слизистой оболочке кишечника.
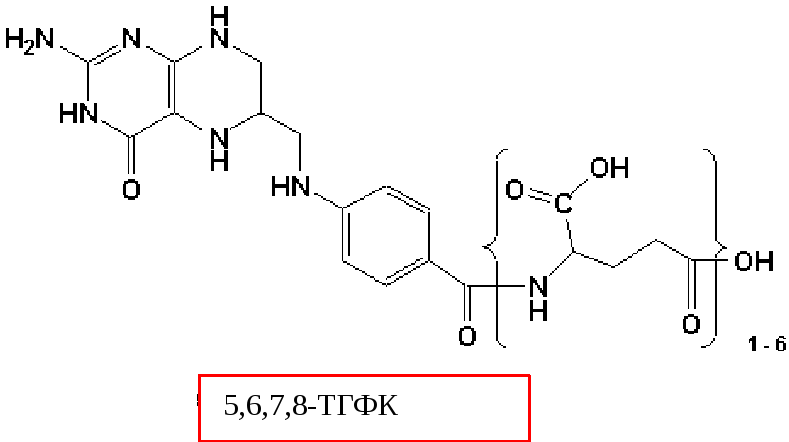
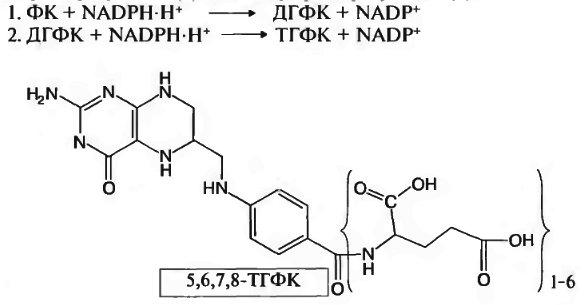
В клетках организма фолиевая кислота восстанавливается в активную форму – ТГФК – с помощью NADPH.H+ -зависимых ферментов: фолатредуктазы (1) и дигидрофолатредуктазы (2): 1. ФК + НАДФH.H+ ДГФК + НАДФ+
2. ДГФК+ НАДФH.H+ ТГФК + НАДФ+
Оба фермента нуждаются в антиоксидантной (препятствующей окислительному разрушению) защите. Эту функцию выполняет витамин С. Отсюда становится понятным, почему проявления фолиевой недостаточности могут быть ослаблены назначением аскорбиновой кислоты.
Активность дигидрофолатредуктазы блокируется конкурентными аналогами фолата – аминоптерином и метотрексатом , широко применяющимися в онкологической практике с целью угнетения размножения раковых клеток.
Избыток фолацина выводится с мочой, калом и потом.
Биохимические функции.
Коферментная форма фолиевой кислоты – ТГФК – необходима для мобилизации и использования в реакциях метаболизма одноуглеродных функциональных групп: метильной (- СН3), метиленовой (- СН2 -), метенильной (-СН =), формильной – СНО) и формиминогруппы (СН=NH). Присоединение этих групп к 5-му или 10-му атому азота ТГФК осуществляется ферментативно.
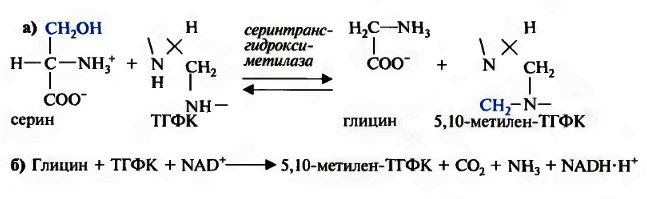
ТГФК может приобрести одноуглеродную единицу из различных источников. Например, 5-формимино-ТГФК может образоваться при распаде гистидина. Однако более типичной является активация одноуглеродных групп из серина (a), который далее трансформируется в митохондриях витамин В6-зависимой системой ферментов (б):
серингидроксиметилтрансфераза
 а)Серин + ТГФК
глицин + 5,10-метилен-ТГФК
а)Серин + ТГФК
глицин + 5,10-метилен-ТГФК
 б)Глицин ТГФК + НАД+ 5,10-метилен-ТГФК
+ СО2+NH3 +НАДН.Н+
б)Глицин ТГФК + НАД+ 5,10-метилен-ТГФК
+ СО2+NH3 +НАДН.Н+
Помимо основного своего значения – образования одноуглеродного метиленового фрагмента, эти две реакции служат как для синтеза глицина (реакция а), так и его распада (реакция б).
Метиленовая группа в составе 5,10-метилен-ТГФК может превращаться в другие одноуглеродные фрагменты:
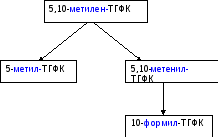
Метилен-тгфк- Метилен-тгфк-
редуктаза дегидрогеназа
метенил-ТГФК-
циклогидролаза
Важнейшими реакциями с участием одноуглеродных фрагментов, связанных с ТГФК, являются:
5,10-метенил-ТГФК и 10-формил ТГФК служат донорами соответствующих одноуглеродных радикалов при синтезе пуриновых нуклеотидов.
5-метил-ТГФК вместе с витамином В12 участвуют в переносе метильной группы в реакциях синтеза дТМФ и метионина
ТГФК вовлекается в метаболизм аминокислот: серина, глицина (см. выше) и метионина
Гиповитаминоз. Поскольку одноуглеродные группы играют исключительно важную роль в биосинтезе нуклеиновых кислот, моно- и динуклеотидов, а также в биосинтезе белков, становятся понятными те глубокие нарушения, которые наблюдаются при фолатном гиповитаминозе.
Основным клиническим проявлением недостатка фолиевой кислоты является заболевание анемией. Анемия называется мегалобластической, макроцитарной. В крови появляются большие незрелые кроветворные клетки — мегалобласты. Снижается количество эритроцитов и гемоглобина в крови, причём эритропения выражена в большей степени, чем снижение уровня гемоглобина (в отличие от железодефицитной анемии). Характерно появление в крови гиперсегментированных многоядерных лейкоцитов с большим числом тяжей между сегментами ядер.
В эритроцитарном, миелоидном и мегакариоцитарном ростках костного мозга отмечаются выраженные мегалобластические изменения. Клетки костного мозга отличаются высокой скоростью деления, поэтому они особо чувствительны к нарушению синтеза нуклеиновых кислот, возникающему при дефиците витамина В9. Схожие симптомы отмечаются и при недостатке витамина В12, так как обмен обоих витаминов взаимосвязан.
При недостаточности фолатов отмечаются слабость, головная боль, обмороки, бледность кожи, красный саднящий язык, диарея. Больные раздражительны, враждебны, у них плохая память, паранойя.
Врождённые нарушения обмена фолиевой кислоты.
Мегалобластическая анемия, сочетающаяся с нарушением психического развития, может обнаруживаться у младенцев вследствие врождённого нарушения всасывания фолатов в тонком кишечнике. Хороший клинический эффект достигается парэнтеральным введением максимальных лечебных доз витамина.
Мегалобластическая анемия вследствие дефекта фолатредуктазы. В такой ситуации нарушается превращение фолиевой кислоты в её коферментную форму – 5-формил-ТГФК. Заболевание прогрессирует медленно, неврологические нарушения обычно отсутствуют, коррегируется повышенными дозами фолиевой кислоты.
Мегалобластическая анемия из-за недостаточности формиминотрансферазы – фермента, необходимого для образования 5-формимино-ТГФК из гистидина. Заболевание обнаруживается в течение первого года жизни ребёнка и характеризуется задержкой умственного и физического развития, аномальными изменениями электроэнцефалографии. Обнаруживается по аномально высокому содержанию фолатов в крови (задержка превращения их в активную фрму) и увеличения выведения метаболитов витамина при нагрузке гистидином.
Другие разновидности анемии затрагивают иные пути метаболизма фолатов, в частности, описана мегалобластическая анемия вследствие дефекта 5,10-метилен-ТГФК-редуктазы (фермент восстанавливает 5,10-метилен-ТГФК в 5-метил-ТГФК), особую роль в заболевании мегалобластической анемией играет недостаточность витамина В12 (см. далее).Гипервитаминоз не описан. Даже при приёме доз, в 20-40 раз превышающих физиологические, токсических эффектов не отмечалось (в клинических испытаниях больные атеросклерозом принимали до 80 мг/сутки витамина В9).
Оценка обеспеченности организма фолацином. Об обеспеченности организма фолиевой кислотой можно судить по содержанию её в крови (лучше – в плазме крови). Содержание фолацина в моче, как правило, не является достоверным критерием обеспеченности организма этим витамином. Быстрое удаление витамина из крови при внутривенном его введении может указывать на недостаточную потребность организма в этом витамине (активный «захват» тканями).
Нередко об обеспеченности организма витамином Вс судят по косвенным показателям: морфологическим изменениям крови и костного мозга, а также по уровню выведения некоторых продуктов обмена витамина с мочой (формиминоглутаминовой или уроканиновой кислот).
Суточная потребность. Пищевые источники. Витамина много в лиственных овощах, например, в шпинате. Он содержится в салате, капусте, томатах, землянике. Богаты им печень и мясо, яичный желток.
При скудном питании рекомендуемая доза составляет 150- 200 мкг фолиевой кислоты ежедневно, лечебная доза – до 2 мг в сутки.
Особое значение приобретает достаточная обеспеченность фолиевой кислотой в ранние сроки беременности: на 2-й неделе (начало развития головного мозга) даже кратковременный дефицит этого витамина может привести к появлению врождённых уродств, нарушению физического и психического развития новорождённого.
Однако дефицит фолата имеет другие недавно изученные биологические последствия, включая ненормально высокий уровень урацила в ДНК. Последнее, как указывалось выше, является следствием лимита биосинтеза тиминовых нуклеотидов. Этот феномен ведёт к хромосомным поломкам, обуславливающим в значительной степени дефект нервной трубки в период эмбриогенеза. Уже не вызывает сомнений, что появление таких врождённых пороков развития, как spina bifida и анэнцефалия, патогенетически связано с дефицитом фолата. Их предупреждение, как показывает мировой опыт, достигается назначением фолиевой кислоты на протяжении всего периода беременности в дозе не менее 400 мкг в сутки, особенно важно это делать в раннем сроке, когда нервная система плода развивается особенно быстро.
Витамин В12 (кобаламин), антианемический витамин
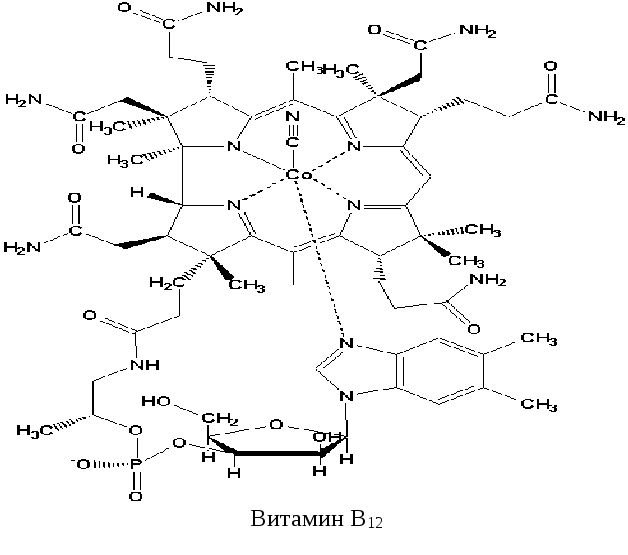
Химическое строение и свойства.Злокачественная анемия (болезнь Аддисон-Бирмера) оставалась смертельным заболеванием до 1926 г., когда впервые для её лечения применили сырую печень. Поиски содержащегося в печени антианемического фактора привели к успеху, и в 1955 г. Дороти Ходжкин расшифровала структуру этого фактора и его пространственную конфигурацию с помощью метода рентгеноструктурного анализа.
Структура витамина В12 отличается от строения всех других витаминов своей сложностью и наличием в его молекуле иона металла – кобальта. Кобальт связан кооординационной связью с 4 атомами азота, входящими в состав порфириноподобной структуры (называемой корриновым ядром), и с атомом азота 5,6-диметилбензимидазола. Кобальтсодержащее ядро молекулы представляет собой плоскостную структуру, с перпендикулярно расположенным к ней нуклеотидом. Последний, помимо 5,6-диметилбензимидазола, содержит рибозу и фосфорную кислоту (циановая группа, связанная с кобальтом, присутствует только в очищенных препаратах витамина, в клетке она замещается водой или гидроксильной группой). Из-за присутствия в молекуле витамина кобальта и амидного азота это соединение получило название «кобаламин».
Метаболизм. Содержащийся в пище витамин В12 в желудочном соке связывается с вырабатываемым обкладочными клетками слизистой желудка белком — гликопротеином, получившим название внутреннего фактора Касла. Одна молекула этого белка избирательно связывает одну молекулу витамина; далее в подвздошной кишке этот комплекс взаимодействует со специфическими рецепторами мембран энтероцитов и всасывается путём эндоцитоза
Затем витамин освобождается в кровь воротной вены. При пероральном назначении высоких доз цианкобаламина он может абсорбироваться в тонком кишечнике путём пассивной диффузии без участия внутреннего фактора, но это медленный процесс. При заболеваниях желудка, сопровождающихся нарушением синтеза внутреннего фактора, всасывания кобаламина не происходит.
Цианкобаламин, используемый в медицинской практике, в энтероцитах превращается в оксикобаламин, являющийся транспортной формой витамина. Транспорт оксикобаламина кровью осуществляется двумя специфическими белками: транскобаламином I (α-глобулин с молекулярной массой ̴120000) и транскобаламином II (β-глобулин с молекулярной массой 35000). Второй из этих белков в транспорте витамина играет главную роль, а транскобаламин I служит своеобразным циркулирующим депо витамина. В печени и почках оксикобаламин превращается в свои коферментные формы: метилкобаламин (метил-В12) и дезоксиаденозинкобаламин (д-аденозин-В12). Коферменты с током крови разносятся по всем тканям организма.
Выводится из организма витамин с мочой.
Биохимические функции. К настоящему времени известно ~ 15 различных В12-регулируемых реакций, но только две из них протекают в клетках млекопитающих: 1/. синтез метионина из гомоцистеина (явно не удовлетворяющий потребностям организма) и 2/. изомеризация D-метилмалонил-КоА в сукцинил-КоА. Рассмотрим эти реакции.
1. В первой реакции участвует метил-В12, являющийся коферментом метионинсинтазы (гомоцистеинметилтрансферазы).. Фермент переносит метильную группу с 5-метил-ТГФК на гомоцистеин с образованием метионина:
ТГФК 5-метил-ТГФК

S
CH3-B12
H S- Ch4| В12 |
CH2 Ch3
| |
|
CH2 Ch3
| |
CH – NH2 CH – Nh3
| |
|
COOH метионинсинтаза COOH
Гомоцистеин Метионин
При уменьшении содержания в диете витамина В12 синтез метионина метионинсинтазой снижается, но поскольку при полноценном питании метионин поступает с пищей, метаболизм белков нарушается не сразу. Вместе с тем, падение активности метиоинсинтазы приводит к накоплению 5-метил-ТГФК (см. схему), который образуется при восстановлении 5,10-метилен-ТГФК, т.е. исчерпывается пул других коферментов ТГФК. Таким образом, даже при условии вполне достаточного общего уровня фолатов создаётся их функциональный дефицит – уменьшается содержание формил- и метилен-производных ТГФК. Как раз эти производные, а точнее приносимые ими одноуглеродные радикалы, необходимы для синтеза предшественников нуклеиновых кислот. Этот феномен получил название «секвестрация» пула ТГФК.
Описанная реакция служит примером тесной взаимосвязи межу двумя витаминами- фолиевой кислотой и кобаламином. Не удивительна поэтому и схожесть симптомов заболевания при дефиците какого-либо из них. При недостаточности витамина В9, а также при снижении активности метионинсинтазы – В12-зависимого фермента, функциональный пул ТГФК может быть легко исчерпан путём «секвестрации», что влечёт за собой избыточное накопление субстрата метионинсинтазной реакции – гомоцистеинаметионин. Таким образом, коферментная функция ТГФК в переносе метильной группы (ключевая реакция) зависит от доступности фолата, т.е. от адекватного его поступления в организм.
Отмечена прямая корреляция между показателями тромбоэмболических осложнений, смертностью от ишемической болезни сердца и уровнем гомоцис-теинемии у этих больных. Увеличенный уровень гомоцистеина в крови постулируется в настоящее время как независимый фактор риска развития ИБС и её тромбоэмболических осложнений. Роль гипергомоцистеинурии как пускового фактора атерогенеза связана с прооксидантным действием гомоцистеина, со способностью этой аминокислоты угнетать рост эндотелиальных клеток, оказывать митогенный эффект на гладкомышечные клетки, стимулировать адсорбцию белков в холестериновой бляшке и интенсифицировать биосинтез коллагена. Принципиально важными являются индуцированное гомоцистеином гиперкоагуляционное состояние, снижение мощности систем антиоксидантной защиты тканей, активация биосинтеза NO-синтазы.
2. Вторая реакция требует участия другой коферментной формы витамина – д-аденозин-В12. Кофермент входит в состав метималонил-КоА-мутазы. Особенностями катализа этого фермента является образование свободнорадикальных промежуточных продуктов реакции и изменение валентности кобальта. Субстратом для его действия является метилмалонил-КоА, образующийся при карбоксилировании пропионил-КоА (реакция рассматривалась в разделе «Биотин»).
О О
║ ║
С~ S KoA С ~S KoA
│ метилмалонил-КоА-мутаза │
C H2 – CH
CH2
H2 – CH
CH2
│ │
COOH CH2
│
COOH
Метилмалонил~ SKoA Сукцинил~ SkoA
Эта реакция является весьма важной в метаболизме пропионовой кислоты (точнее, пропионил~SКoA), которая образуется при окислении жирных кислот с нечётным числом атомов углерода, боковой цепи холестерина, окислительном распаде аминокислот: изолейцина, метионина и серина.
Гиповитаминоз. Недостаточность кобаламинов возникает вследствие низкого содержания их в пище при вегетарианской диете и тем более – при голодании. Но большее значение имеет нарушение всасывания витамина при гастритах с пониженной кислотностью (в случаях нарушения образования внутреннего фактора Касла), оперативном удалении желудка или подвздошной кишки.
Гиповитаминоз проявляется злокачественной мегалобластической анемией, или анемией Аддисон-Бирмера. Болезнь также называется пернициозной анемией. Нарушения кроветворной функции аналогичны наблюдаемой при недостатке фолиевой кислоты. Помимо этого, поражаются задние и боковые столбы спинного мозга вследствие нарушения синтеза миелина; дегенеративные изменения отмечаются также в периферической нервной системе и головном мозге. Неврологическая симптоматика сводится к парастезиям, ощущению онемения кистей и стоп, неустойчивости походки, ослаблению памяти вплоть до спутанности сознания.
Нарушения кроветворения при кобаламиновом гиповитаминозе трудно увязать непосредственно с дефектом коферментных функций витамина В12. Однако если учесть тесное «сотрудничество» этого витамина с фолиевой кислотой, патогенез злокачественной анемии становится более понятным. Как уже указывалось, при недостаточности витамина В12 нарушается использование 5-метил-ТГФК в реакции синтеза метионина, вследствие чего вся фолиевая кислота попадает постепенно в своеобразную ловушку («секвестируется»), создающую функциональный дефицит её коферментных производных. Это объясняет нарушение биосинтеза нуклеиновых кислот и, следовательно, угнетение костно-мозгового кроветворения.
Врождённые нарушения всасывания, транспорта и обмена витамина В12.
Анемия при врождённом дефекте образования внутреннего фактора Касла. При этом нарушается всасывание витамина. В крови его концентрация значительно снижается. Эффективно парентеральное введение препаратов витамина.
Мегалобластическая анемия при нарушении всасывания витамина В12 в кишечнике. Нарушение обусловлено врождённым дефектом механизма высвобождения витамина в кровоток и связывания его с транскортином (транскобал-амином) II. Интересно, что всасывание липидов и углеводов при этом не нарушено. Характерны стойкая протеинурия и увеличение экскреции аминокислот (валина, изолейцина, треонина и метионина).
Анемия, обусловленная врождённым дефектом транскобаламинов. При отсутствии в крови транскобаламина II развивается тяжёлая анемия с первых недель жизни ребёнка. Терапевтический эффект достигается введением мегадоз витамина В12, в 1000 раз превышающих физиологическую. Очевидно, при таких концентрациях кобаламина транспортную функцию берут на себя другие белки.
Врождённые метилмалонатацидемии. При этой патологии отмечается высокий уровень метилмалоновой кислоты в крови и повышенная экскреция её с мочой. Метилмалонатацидемия может вызываться как недостаточным поступлением с пищей витамина В12 , так и врождённым нарушением его метаболизма.
Врождённая метилмалонатацидемия проявляется в первый год жизни ребёнка упорной рвотой, кетоацидозом, нейтропенией и тромбоцитопенией, задержкой психомоторного развития, сниженной сопротивляемостью к инфекционным заболеваниям. Мегалобласты в крови тем не менее обычно не обнаруживаются. Диагноз ставится на основании обнаружения высокой концентрации метилмалоновой кислоты в моче, плазме крови или спинномозговой жидкости; уровень витамина в крови остаётся нормальным, что у
казывает на врождённый дефект его утилизации (но не всасывания). Заболевание носит выраженный семейный характер.
Метаболические нарушения при метилмалонатацидемии могут затрагивать разные аспекты функции кобаламинов, а именно:
может быть нарушено образование коферментной формы витамина – дезоксиаденозин-кобаламина, вследствие чего затрудняется превращение метилмалонил-КоА в сукцинил-КоА и метилмалоновая кислота в избыточном количестве появляется в крови.
Может нарушаться образование апофермента метилмалонил-КоА-мутазы, что также блокирует превращение метилмалонил-КоА в сукцинил-КоА.
Сочетанный дефект может затрагивать обе коферментные формы витамина – метил-В12 и д-аденозин-В12. Это сопровождается дополнительными метаболическими расстройствами, т.е. помимо нарушения обмена метилмалоновой кислоты блокируется также биосинтез метионина из гомоцистеина, следствием чего являются гомоцистинурия и снижение содержания метионина в крови и тканях. В крови обнаруживаются мегалобласты, отмечаются дегеративные изменения в нервной ткани.
Накопление метилмалоновой кислоты и метилмалонил-КоА тормозит синтез присущих клетке жирных кислот. Использование ацилсинтазой метилмалонил-КоА (вместо малонил-КоА) приводит к появлению жирных кислот необычной структуры с разветвлённой цепью; кроме того, накопление в тканях пропионил-КоА (предшественника не используемого метилмалонил-КоА) приводит к увеличению образования жирных кислот с нечётным числом атомов углерода. Всё это нарушает биосинтез сложных липидов в нервной ткани, приводит к её демиэлинизации и развитию соответствующих тяжёлых неврологических синдромов..
Лечение заключается в снижении доли принимаемого с пищей белка (либо диеты с низким содержанием изолейцина, треонина и метионина) и дополнительным назначением гомоцистеина и холина, а также высоких доз кобаламина.
Гипервитаминоз. Введение витамина даже в тысячекратной, по сравнению с физиологической, дозе не оказывало токсического эффекта.
Оценка обеспеченности организма витамином В12. Для этой цели служит определение содержания витамина в сыворотке крови, либо определение суточной экскреции метилмалоновой кислоты, которая возрастает при низкой обеспеченности организма кобаламином в десятки и сотни раз. Иногда применяется также метод нагрузки с помощью парэнтерального введения меченного по кобальту витамина В12.
Суточная потребность. Пищевые источники. Синтез кобаламинов в природе осуществляется исключительно микроорганизмами. Животные и растительные клетки такой способностью не обладают. Основные пищевые источники витамина – печень, мясо (в нём кобаламина 20 раз меньше, чем в печени), морские продукты (крабы, лососевые, сардины), молоко, яйца. У строгих вегетарианцев, исключающих из пищи не только мясные, но и молочные продукты, рано или поздно развивается В12-дефицитная анемия.
Суточная потребность – 3 мкг.
|
|
Фолиевая (птероилглутаминовая) кислота (фолацин) в зависимости от вида животных или штамма бактерий, нуждающихся для нормального роста в присутствии этого пищевого фактора, называлась по-разному: фактор роста L. casei; витамин М, необходимый для нормального кроветворения у обезьян; витамин Вс, фактор роста цыплят (индекс «с» от англ. chicken – цыпленок). В 1941 г. фолиевая кислота была выделена из зеленых листьев растений, в связи с чем и получила свое окончательное название (от лат. folium – лист). Еще до установления химического строения фолиевой кислоты было показано, что для роста некоторых бактерий необходимо присутствие в питательной среде парааминобензойной кислоты. Добавление структурных аналогов ее, в частности сульфаниламидных препаратов, наоборот, оказывало тормозящее действие на рост бактерий. В настоящее время установлено, что это ростстимулирующее действие парааминобен-зойной кислоты обусловлено включением ее в состав более сложно построенной молекулы фолиевой кислоты. Фолиевая кислота состоит из трех структурных единиц: остатка 2-амино-4-окси-6-метилптеридина (I), парааминобензойной (II) и L-глута-миновой (III) кислот и имеет следующую структуру: Фолиевая кислота ограниченно растворима в воде, но хорошо растворима в разбавленных растворах спирта; имеет характерные спектры поглощения в УФ-области спектра. Недостаточность фолиевой кислоты трудно вызвать даже у животных без предварительного подавления в кишечнике роста микроорганизмов, которые синтезируют ее в необходимых количествах; авитаминоз обычно вызывают введением антибиотиков и скармливанием животным пищи, лишенной фолиевой кислоты. У обязьян фо-лиевая недостаточность сопровождается развитием специфической анемии; у крыс сначала развивается лейкопения, а затем анемия. У человека наблюдается клиническая картина макроцитарной анемии, очень похожая на проявления пернициозной анемии – следствия недостаточности витамина В12, хотя нарушения нервной системы отсутствуют. Иногда отмечается диарея. Имеются доказательства, что при недостаточности фолиевой кислоты нарушается процесс биосинтеза ДНК в клетках костного мозга, в которых в норме осуществляется эритропоэз. Как следствие этого в периферической крови появляются молодые клетки – мегалобласты – с относительно меньшим содержанием ДНК. Биологическая роль. Коферментные функции фолиевой кислоты связаны не со свободной формой витамина, а с восстановленным его птеридиновым производным. Восстановление сводится к разрыву двух двойных связей и присоединению четырех водородных атомов в положениях 5, 6, 7 и 8 с образованием тетрагидрофолиевой кислоты (ТГФК). Оно протекает в 2 стадии в животных тканях при участии специфических ферментов, содержащих восстановленный НАДФ. Сначала при действии фолатредук-тазы образуется дигидрофолиевая кислота (ДГФК), которая при участии второго фермента – дигидрофолатредуктазы – восстанавливается в ТГФК: Доказано, что коферментные функции ТГФК непосредственно связаны с переносом одноуглеродных групп, первичными источниками которых в организме являются β-углеродный атом серина, α-углеродный атом глицина, углерод метальных групп метионина, холина, 2-й углеродный атом индольного кольца триптофана, 2-й углеродный атом имидазольного кольца гистидина, а также формальдегид, муравьиная кислота и метанол. К настоящему времени открыто шесть одноуглеродных групп, включающихся в разнообразные биохимические превращения в составе ТГФК: формильная (—СНО), метильная (—СН3), метиленовая (—СН2—), метенильная (—СН=), оксиметильная (—СН2ОН) и формими-новая (—CH=NH). Выяснено, что присоединение этих фрагментов к ТГФК является ферментативной реакцией ковалентного связывания их с 5-м или 10-м атомом азота (или с обоими атомами вместе). В качестве примера приводим отдельные функциональные группы в активных участках ТГФК: Имеются данные, что производные ТГФК участвуют в переносе одно-углеродных фрагментов при биосинтезе метионина и тимина (перенос метильной группы), серина (перенос оксиметильной группы), образовании пуриновых нуклеотидов (перенос формильной группы) и т.д. (см. главы 12 и 13). Перечисленные вещества играют исключительно важную, ключевую, роль в биосинтезе белков и нуклеиновых кислот, поэтому становятся понятными те глубокие нарушения обмена, которые наблюдаются при недостаточности фолиевой кислоты. В медицинской практике (в частности, в онкологии) нашли применение некоторые синтетические аналоги (антагонисты) фолиевой кислоты. Так, 4-аминоптерин используется в качестве препарата, тормозящего синтез нуклеиновых кислот, и рекомендуется в качестве лечебного препарата при опухолевых поражениях, в частности при острых и хронических формах лейкозов у детей и взрослых. Распространение в природе и суточная потребность. Вещества, обладающие активностью фолиевой кислоты, широко распространены в природе. Богатыми источниками их являются зеленые листья растений и дрожжи. Эти вещества содержатся также в печени, почках, мясе и других продуктах. Многие микроорганизмы кишечника животных и человека синтезируют фолиевую кислоту в количествах, достаточных для удовлетворения потребностей организма в этом витамине. Суточная потребность в свободной фолиевой кислоте для взрослого человека составляет 1-2 мг. Предыдущая страница | Следующая страница СОДЕРЖАНИЕ Еще по теме: |
Фолиевая кислота (фолацин, витамин B9, витамин Bc, фактор роста, птероилглутаминовая кислота)
Химическое строение и свойства: водорастворимый, состоит из трех компонентов: гетероциклического остатка птеридина, парааминобензойной кислоты (ПАБК) и глутаминовой кислоты (несколько остатков). Плохо растворима в воде и органических растворителях, хорошо в щелочных растворах. Разрушается под действием света, при обработке и консервировании овощей.
Биохимические функции:
Коферментная форма фолиевой кислоты – ТГФК – необходима для мобилизации и использования в реакциях метаболизма одноуглеродных функциональных групп: метильной (- СН3), метиленовой (- СН2 -), метенильной (-СН =), формильной (– СНО) и формиминогруппы (СН=NH).
Важнейшими реакциями с участием одноуглеродных фрагментов, связанных с ТГФК, являются:
1) N5,N10-метенил-ТГФК и N10-формил ТГФК служат донорами соответствующих одноуглеродных радикалов при синтезе пуриновых нуклеотидов;
2) N5-метил-ТГФК вместе с витамином В12 участвуют в переносе метильной группы в реакциях синтеза дезокси-ТМФ и метионина;
3) ТГФК вовлекается в метаболизм аминокислот: серина, глицина и метионина.
Гиповитаминоз.
Основное проявление – мегалобластическая, макроцитарная анемия. В крови появляются большие незрелые кроветворные клетки – мегалобласты. Снижается количество эритроцитов и гемоглобина, причем эритропения выражена в большей степени, чем снижение уровня гемоглобина (в отличие от железодефицитной анемии). Характерно появление в крови гиперсегментированных многоядерных лейкоцитов с большим числом тяжей между сегментами ядер.
При недостаточности фолатов отмечаются слабость, головная боль, обмороки, бледность кожи, красный саднящий язык, диарея. Больные раздражительны, враждебны, у них плохая память, паранойя.
Пищевые источники: много в лиственных овощах (шпинате), салате, капусте, томатах, землянике, в печени и мясе, яичном желтке.
Суточная доза: 150– 200 мкг, лечебная доза – до 2 мг в сутки.
Метаболизм фолиевой кислоты
Витамин В9, всасываясь в тонком кишечнике, восстанавливается в энтероцитах до тетрагидрофолиевой кислоты (ТГФК) и N5-метил-ТГФК. В крови основное количество витамина входит в состав эритроцитов. Депонируется он в печени, почках и слизистой оболочке кишечника.
В клетках организма фолиевая кислота восстанавливается в активную форму — ТГФК — с помощью NADPH-H+ -зависимых ферментов: фолатредуктазы (1) и дигидрофолатредуктазы (2):
Оба фермента нуждаются в антиоксидантной (препятствующей окислительному разрушению) защите. Эту функцию выполняет витамин С. Отсюда становится понятным, почему проявления фолиевой недостаточности могут быть ослаблены назначением аскорбиновой кислоты.
Активность дигидрофолатредуктазы блокируется конкурентными аналогами фолата — аминоптерином и метотрексатом, широко применяющимися в онкологической практике с целью угнетения размножения раковых клеток.
Избыток фолацина выводится с мочой, калом и потом.
Биохимические функции и свойства витамина b9
Коферментная форма фолиевой кислоты — ТГФК — необходима для мобилизации и использования в реакциях метаболизма одноуглеродных функциональных групп: метильной(-СН3), метиленовой (- СН2-), метенильной (-СН=), формальной (-СНО) и формиминогруппы (CH=NH). Присоединение этих групп к 5-му или 10-му атому азота ТГФК осуществляется ферментативно.
ТГФК может приобрести одноуглеродную единицу из различных источников. Например, 5-формимино-ТГФК может образоваться при распаде гистидина. Однако более типичной является активация одноуглеродных групп из серина (а), который далее трансформируется в митохондриях витамин В6-зависимой системой ферментов (б):
Помимо основного своего значения — образования одноуглерод-ного метиленового фрагмента, эти две реакции служат как для синтеза глицина (реакция а), так и для его распада (реакция 6). Метиленовая группа в составе 5,10-метилен-ТГФК может превращаться в другие одноуглеродные фрагменты:
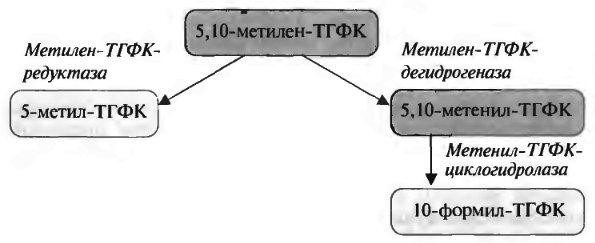
Важнейшими реакциями с участием одноуглеродных фрагментов, связанных с ТГФК, являются:
5,10-метенил-ТГФК и 10-формил ТГФК служат донорами соответствующих одноуглеродных радикалов при синтезе пуриновых нуклеотидов.
5-метил-ТГФК вместе с витамином В12 участвуют в переносе метильной группы в реакциях синтеза дТМФ и метионина.
ТГФК вовлекается в метаболизм аминокислот: серина, глицина и метионина.
Гиповитаминоз фолацина
Поскольку одноуглеродиые группы играют исключительно важную роль в биосинтезе нуклеиновых кислот, моно- и динуклеотидов, а также в биосинтезе белков, становятся понятными те глубокие нарушения, которые наблюдаются при фолатном гиповитаминозе. Основным клиническим проявлением недостатка фолиевой кислоты является заболевание анемией — мегалобластической, макроцитарной. В крови появляются большие незрелые кроветворные клетки — мегалобласты. Снижается количество эритроцитов и гемоглобина в крови, причем эритропения выражена в большей степени, чем снижение уровня гемоглобина (в отличие от железодефииитной анемии). Характерно появление в крови гиперсегментированных многоядерных лейкоцитов с большим числом тяжей между сегментами ядер.
В эритроцитарном, миелоидном и мегакариоцитарном ростках костного мозга отмечаются выраженные мегалобластические изменения. Клетки костного мозга характеризуются высокой скоростью деления, поэтому они особо чувствительны к нарушению синтеза нуклеиновых кислот, возникающему при дефиците витамина В9. Схожие симптомы отмечаются и при недостатке витамина В12, так как обмен обоих витаминов взаимосвязан.
При недостаточности фолатов отмечаются слабость, головная боль, обмороки, бледность кожи, красный саднящий язык, диарея. Больные раздражительны, враждебны, у них плохая память, паранойя.
