Гамма-аминомасляная кислота — Википедия
| Гамма-аминомасляная кислота | |||
|---|---|---|---|
| |||
| Систематическое наименование | 4-аминобутановая кислота | ||
| Хим. формула | C4H9O2N | ||
| Состояние | твёрдое | ||
| Молярная масса | 103,120 г/моль | ||
| Плотность | 1,11 г/см³ | ||
| Температура | |||
| • плавления | 203 °C | ||
| • кипения | 247,9 °C | ||
| Константа диссоциации кислоты pKa{\displaystyle pK_{a}} | 4,05 | ||
| Растворимость | |||
| • в воде | 130 г/100 мл | ||
| Рег. номер CAS | 56-12-2 | ||
| PubChem | 119 | ||
| Рег. номер EINECS | 200-258-6 | ||
| SMILES | |||
| InChI | |||
| RTECS | ES6300000 | ||
| ChEBI | 16865 | ||
| ChemSpider | 116 | ||
| ЛД50 | 12 680 мг/кг (мыши, перорально) | ||
| Токсичность | слаботоксичное вещество, ирритант | ||
| Пиктограммы ECB |  | ||
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |||
 Медиафайлы на Викискладе Медиафайлы на Викискладе | |||
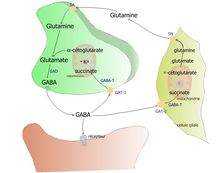 Метаболизм ГАМК, вовлечение глиальных клеток
Метаболизм ГАМК, вовлечение глиальных клеток 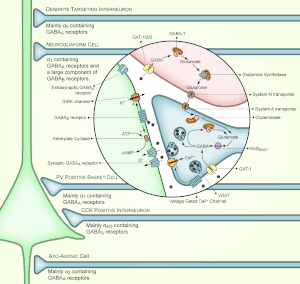
γ-Аминомасляная кислота (сокр. ГАМК, GABA) — органическое соединение, непротеиногенная аминокислота, важнейший тормозной нейромедиатор центральной нервной системы (ЦНС) человека и других млекопитающих. Аминомасляная кислота является биогенным веществом. Содержится в ЦНС и принимает участие в нейромедиаторных и метаболических процессах в мозге.
Гамма-аминомасляная кислота в организме образуется из другой аминокислоты — глутаминовой с помощью фермента глутаматдекарбоксилазы.
В нервной системе[править | править код]
γ-Аминомасляная кислота выполняет в организме функцию ингибирующего медиатора центральной нервной системы. При выбросе ГАМК в синаптическую щель происходит активация ионных каналов ГАМКA— и ГАМКC-рецепторов, приводящая к ингибированию нервного импульса. Лиганды рецепторов ГАМК рассматриваются как потенциальные средства для лечения различных расстройств психики и центральной нервной системы, к которым относятся болезни Паркинсона и Альцгеймера, расстройства сна (бессонница, нарколепсия), эпилепсия.
Установлено, что ГАМК является основным нейромедиатором, участвующим в процессах центрального торможения.
Вместе с тем, ГАМК не связана исключительно с синаптическим торможением в ЦНС. На ранних этапах развития мозга ГАМК опосредует преимущественно синаптическое возбуждение[2]. В незрелых нейронах ГАМК проявляет возбуждающие и деполяризующие свойства в синергичном взаимодействии с глутаматом. Возбуждающее поведение ГАМК обусловлено высокой внутриклеточной концентрацией ионов хлора, накапливаемого при помощи транспортного белка NKCC, таким образом, открытие ГАМК-рецепторов приводит к потере этих анионов и возникновению ВПСП на мембране нейрона. Во взрослом мозге возбуждающая функция ГАМК сохраняется лишь частично, уступая место синаптическому торможению
Под влиянием ГАМК активируются также энергетические процессы мозга, повышается дыхательная активность тканей, улучшается утилизация мозгом глюкозы, улучшается кровоснабжение.
Действие ГАМК в ЦНС осуществляется путём её взаимодействия со специфическими ГАМКергическими рецепторами, которые в последнее время подразделяют на ГАМКA— и ГАМКB-рецепторы и др. В механизме действия целого ряда центральных нейротропных веществ (снотворных, противосудорожных, судорожных и др.) существенную роль играет их агонистическое или антагонистическое взаимодействие с ГАМК-рецепторами. Бензодиазепины потенцируют действие ГАМК.
Наличие ГАМК в ЦНС было обнаружено в середине 1950-х годов, в 1963 году осуществлён её синтез (Krnjević K., Phillis J. W.[4][5]). В конце 1960-х годов под названием «Гаммалон» ГАМК была предложена для применения в качестве лекарственного средства за рубежом, затем — под названием «Аминалон» — в России.
По экспериментальным данным, ГАМК при введении в организм плохо проникает через гематоэнцефалический барьер, однако есть свидетельства того, что ГАМК транспортируется в мозг с помощью специфических мембранных транспортеров GAT2 и BGT-1[6].
За пределами нервной системы[править | править код]
В 2007 году была впервые описана ГАМКергическая система в эпителии дыхательных путей. Система активируется под воздействием аллергенов и может играть роль в механизмах астмы
Другая ГАМКергическая система описана в яичках, она может влиять на работу клеток Лейдига[8].
Исследователи больницы St. Michael, Торонто, Канада, установили в июле 2011 года, что ГАМК играет роль в предотвращении и, возможно, обратном развитии сахарного диабета у мышей[9].
ГАМК обнаружена в бета-клетках поджелудочной железы в концентрациях, сопоставимых с таковыми в ЦНС. Секреция ГАМК в бета-клетках происходит совместно с секрецией инсулина. ГАМК опосредованно ингибирует секрецию глюкагона, связанную с повышением концентрации глюкозы в крови.
ГАМК в виде пищевых добавок применяется при умственной отсталости, после инсульта и травм мозга, для лечения энцефалопатии и ДЦП.[11] Нет достаточных доказательств эффективности таких препаратов.[12]
- ↑ Popp A., Urbach A., Witte O.W., Frahm C. Adult and embryonic GAD transcripts are spatiotemporally regulated during postnatal development in the rat brain (англ.) // PLoS ONE (англ.)русск. : journal / Reh, Thomas A.. — 2009. — Vol. 4, no. 2. — P. e4371. — DOI:10.1371/journal.pone.0004371. — Bibcode: 2009PLoSO…4.4371P. — PMID 19190758.
- ↑
- ↑ Frontiers | Excitatory actions of GABA during development (неопр.). www.frontiersin.org. Дата обращения 13 декабря 2018.
- ↑ Krnjević K., Phillis J. W. Iontophoretic studies of neurones in the mammalian cerebral cortex // The Journal of Physiology. — 1963. — Vol. 165(2). — P. 274—304. — PMID 14035891.
- ↑ Krnjević Krešimir. From ‘soup physiology’ to normal brain science // The Journal of Physiology. — 2005. — Vol. 569. — P. 1—2. — DOI:10.1113/jphysiol.2005.096883. [исправить]
- ↑ Diegel J. G., Pintar M. M. A possible improvement in the resolution of proton spin relaxation for the study of cancer at low frequency (англ.) // J. Natl. Cancer Inst. — 1975. — Vol. 55, no. 3. — P. 725—726. — PMID 1159850.
- ↑ Xiang Y. Y. et al. A GABAergic system in airway epithelium is essential for mucus overproduction in asthma (англ.) // Nat. Med. — 09 июля 2007. — Vol. 13, no. 7. — P. 862—867. — DOI:10.1038/nm1604. — PMID 17589520.
- ↑ Mayerhofer A. Neuronal Signaling Molecules and Leydig Cells // The Leydig cell in health and disease (англ.) / Eds.: Payne A. H., Hardy M. P. — Humana Press, 2007. — P. 299. — (Contemporary Endocrinology). — ISBN 1-58829-754-3, 978-1-58829-754-9. — DOI:10.1007/978-1-59745-453-7.
- ↑ Soltani N. et al. GABA exerts protective and regenerative effects on islet beta cells and reverses diabetes (англ.) // Proceedings of the National Academy of Sciences. — 2011. — Vol. 108. — P. 11692—11697. — DOI:10.1073/pnas.1102715108. [исправить]
- ↑ P. Rorsman, P. O. Berggren, K. Bokvist, H. Ericson, H. Möhler. Glucose-inhibition of glucagon secretion involves activation of GABAA-receptor chloride channels (англ.) // Nature. — 1989-09-21. — Vol. 341, iss. 6239. — P. 233—236. — ISSN 0028-0836. — DOI:10.1038/341233a0.
- ↑ Машковский М.Д. «Лекарственные средства» (16-е изд.),Новая волна, 2012, ISBN: 978-5-7864-0218-7, стр. 117
- ↑ Gaba (Gamma-Aminobutyric Acid) Effectiveness, Safety, and Drug Interactions on RxList (англ.) (недоступная ссылка). RxList. Дата обращения 14 января 2019. Архивировано 15 января 2019 года.
ru.wikipedia.org
Гамма-аминомасляная кислота (лекарственное средство) — Википедия
Материал из Википедии — свободной энциклопедии
Текущая версия страницы пока не проверялась опытными участниками и может значительно отличаться от версии, проверенной 5 ноября 2018; проверки требуют 3 правки. Текущая версия страницы пока не проверялась опытными участниками и может значительно отличаться от версии, проверенной 5 ноября 2018; проверки требуют 3 правки.Гамма-аминомасляная кислота (аминалон) — ноотропное лекарственное средство.
Гамма-аминомасляную кислоту открыли в 1950 году[1]. Впервые она стала продаваться в 1960-е годы в Японии в качестве лекарственного средства под названием гаммалон (яп. ガンマロン)[1]. Предполагалось, что данный препарат способен улучшать мозговые метаболические процессы, оказывать седативный эффект, способствовать восстановлению функций мозга после нарушений мозгового кровообращения и травм[1]. В СССР препарат появился в 1970-е годы под названием аминалон[1].
Изначально аминалон широко применялся при умственной отсталости и в геронтологической практике, однако впоследствии оказалось, что данный препарат не обладает высокой эффективностью (предположительно из-за плохого проникновения через гематоэнцефалический барьер)[1].
Ноотропное средство, восстанавливает процессы метаболизма в головном мозге, способствует утилизации глюкозы мозгом[2] и удалению из него токсичных продуктов обмена. Повышает продуктивность мышления, улучшает память, благоприятно влияет на восстановление движений и речи после нарушения мозгового кровообращения, оказывает лёгкое психостимулирующее действие[2]. Обладает лёгким гипотензивным действием, снижает исходно повышенное артериальное давление и выраженность обусловленных гипертонией симптомов (головокружение, бессонница), незначительно урежает частоту сердечных сокращений. Оказывает умеренное антигипоксическое и противосудорожное действие. У больных сахарным диабетом снижает содержание глюкозы, при нормальном содержании глюкозы в крови оказывает обратный эффект (за счёт гликогенолиза).
Применяется при сосудистой патологии головного мозга с целью повышения психической и двигательной активности, алкогольных энцефалопатиях и полиневритах, умственной отсталости[1]. Показанием также являются энцефалопатические и церебрастенические проявления из-за стойких и динамических нарушений мозгового кровообращения (гипертоническая болезнь, посттравматический период, атеросклероз, инсульт)[2]. Имеются данные об эффективности гамма-аминомасляной кислоты при эндогенных депрессиях с затруднениями умственной деятельности и преобладанием астено-ипохондрических явлений[1].
Применяется при умственной отсталости и снижении психической активности у детей[2].
Абсорбция — быстрая, достаточно полная. Cmax — 1 час[1]. TCmax — 60 мин, затем концентрация быстро снижается, через 24 ч в плазме не определяется.[источник не указан 1227 дней]
Гиперчувствительность.
Гамма-аминомасляная кислота малотоксична. Хорошо переносится больными разного возраста. В отдельных случаях возможны диспепсические явления, нарушение сна, ощущение жара, колебания артериального давления (в первые дни лечения)[2]. При уменьшении дозы эти явления обычно быстро проходят.
Хранение: в сухом, защищённом от света месте.
- ↑ 1 2 3 4 5 6 7 8 Машковский М. Д. Лекарственные средства. — 16-е изд. — М.: Новая волна, 2012. — С. 117. — 1216 с. — ISBN 978-5-7864-0218-7.
- ↑ 1 2 3 4 5 Ю. И. Губский, В. А. Шаповалова, И. И. Кутько, В. В. Шаповалов. Лекарственные средства в психофармакологии. — К.: Здоров’я, 1997. — С. 249. — 288 с. — ISBN 5-311-00922-5.
ru.wikipedia.org
Никотиноил гамма-аминомасляная кислота — Википедия
Материал из Википедии — свободной энциклопедии
Никотиноил гамма-аминомасляная кислота, торговое название Пикамилон (англ. Picamilonum), N-Никотиноил-g-аминомасляной кислоты натриевая соль (никотиноил-ГАМК) — сосудорасширяющий препарат, действующий на сосуды головного мозга. Производители позиционируют Пикамилон в качестве ноотропного препарата.
Препарат синтезирован в 1970 году во Всесоюзном научно-исследовательском институте витаминов (Москва, СССР) В. М. Копелевичем, Л. М. Шмуйловичем и В. И. Трубниковым. Введён в медицинскую практику в 1986 году. Является первым оригинальным отечественным ноотропом. В настоящее время права на препарат принадлежат фармацевтической компании «НПК ЭХО», Москва, Россия.
В химическом отношении может рассматриваться как сочетание молекулы ГАМК и никотиновой кислоты. Фармакологически препарат также сочетает в основном свойства этих двух компонентов.
Препарат стимулирует окислительно-восстановительные процессы, повышает потребление нервной тканью кислорода и глюкозы, после ишемии способствует восстановлению процессов утилизации энергетических субстратов, предотвращает нарастание концентрации молочной кислоты в ткани мозга.
Пикамилон обладает выраженными сосудорасширяющими свойствами в сочетании с ноотропным и транквилизирующим действием[2]. Увеличение мозгового кровотока под влиянием пикамилона обусловлено понижением тонуса сосудов мозга в системе каротидных и позвоночных артерий, пиальных артериол, увеличением объёмной скорости мозгового кровотока, выраженным центральным депримирующим воздействием на рефлекторные сократительные реакции мозговых сосудов и соматосимпатические рефлексы[3].
Эндотелиопротективные эффекты пикамилона обусловлены включением в структуру молекулы ГАМК никотиновой кислоты, оказывающей прямое миорелаксирующее действие на стенку сосудов и улучшающей фармакокинетические свойства ГАМК[4]. Доказано, что пикамилон предотвращает развитие системной эндотелиальной дисфункции и обладает эндотелио- и кардиопротективным действием[5].
Выраженные вазоактивные свойства препарата, наряду с транквилизирующим и ноотропным эффектом, делают его назначение больным с сосудистым поражением головного мозга более предпочтительным, чем назначение пирацетама и аминалона[6].
В сухом виде вещество белого цвета, возможно, с лёгким кремовым оттенком[7]. Водный раствор прозрачный бесцветный или слегка окрашенный[8].
Препарат выпускается в виде таблеток[7] и раствора для инъекций[8].
Фармакокинетика[править | править код]
Улучшает кровообращение в сосудах головного мозга, сетчатки глаза и зрительного нерва[7][8].
Фармакодинамика[править | править код]
Быстро полностью всасывается и на длительное время задерживается в тканях организма. Биодотупность 50-88% Период полувыведения 0,51 ч. Не метаболизируется, выводится в неизменном виде, в основном — почками[7][8].
Механизм действия[править | править код]
Улучшает функциональное состояние головного мозга за счёт улучшения мозгового кровообращения и нормализации метаболизма в его тканях[7][8].
Применяют пикамилон (у взрослых) как ноотропное и сосудистое средство при нарушениях мозгового кровообращения лёгкой и средней тяжести, при вегетососудистой дистонии, при состояниях тревоги, страха, повышенной раздражительности, при абстиненции у больных алкоголизмом, а также для повышения устойчивости к физическим и умственным нагрузкам.
Используют препарат самостоятельно или в комплексной терапии. Назначают внутрь независимо от приёма пищи.
В 2015 году группа учёных из Университета Миссисипи и Гарвардской медицинской школы провела исследование препаратов никотиноил-ГАМК. Анализ 31 образца показал, что в одном действущее вещество отсутствовало, в 30 его было от 99,6% до 157.9% от написанного на упаковке[9]. После публикации результатов исследования FDA признала Пикамилон сфальсифицированным препаратом и исключила его из списка БАД. Через месяц он был изъят из продажи в США[10].
- ↑ 1 2 РЛС.
- ↑ Методические подходы для количественной оценки развития эндотелиальной дисфункции при L-NAME-индуцированной модели дефицита оксида азота в эксперименте / М. В. Покровский [и др.] // Кубанский научный медицинский вестник. — Краснодар, 2006. — № 10. — С. 72-77.
- ↑ Марута Н. А. Пикамилон — ноотропный и вазоактивный препарат широкого спектра действия снова на фармацевтическом рынке Украины // Провизор. — 2002 № 20.
- ↑ Белова Е. И. Основы нейрофармакологии: Учеб. пособие для студентов вузов. — М.: Аспект Пресс, 2006. — 176 с., Тюренков И. Н., Перфилова В. Н. Экспериментальная и клиническая фармакология. — 2001. — № 6. — С. 68-72.
- ↑ Исследование эндотелио- и кардиопротективных эффектов ламотриджина, пикамилона и вальпроатов при экспериментальной эндотелиальной дисфункции И. Н. Ершов, Е. В. Лучкина, М. В. Покровский, Т. Г. Покровская \\ Кубанский научный медицинский вестник. № 3 (108). 2009. с. 50-53.
- ↑ Пятницкий А. Н., Панченко Г. В., Хиониди К. П. Пикамилон — новый цереброваскулярный и ноотропный препарат. Результаты эксперим. и клинич. изучения // Тез. Всес. конф. г. Уфа. ВНИИСЭНТИ.— М., 1989.— С. 214—217.
- ↑ 1 2 3 4 5 Пикамилон, инструкция (таблетки), 2008.
- ↑ 1 2 3 4 5 Пикамилон, инструкция (раствор для инъекций), 2010.
- ↑ Avula, Bharathi. Identification and quantification of vinpocetine and picamilon in dietary supplements sold in the United States : [англ.] / Bharathi Avula, Amar G. Chittiboyina, Satyanarayanaraju Sagi … []. — Drug Testing and Analysis. — 2016. — Vol. 8, no. 3−4. — P. 334–343. — ISSN 1942-7611. — DOI:10.1002/dta.1853. — PMID 26426301.
- ↑ Daniells, Stephen FDA sends five warning letters over supplements containing picamilon (англ.). NutraIngredients-USA (2 December 2015). Дата обращения 14 апреля 2019.
- Пикамилон® (Picamilonum) (неопр.). Энциклопедия лекарств. Регистр лекарственных средств России®. Дата обращения 26 ноября 2019.
ru.wikipedia.org
Рецепторы ГАМК — Википедия
Материал из Википедии — свободной энциклопедии
Рецепторы ГАМК — группа клеточных рецепторов, эндогенным агонистом которых является γ-аминомасляная кислота (ГАМК), основной тормозной медиатор в нервной системе позвоночных. Обычно выделяют три класса рецепторов ГАМК: ионотропные ГАМКA и ГАМКC и метаботропные ГАМКB.
Рецепторы ГАМКА и ГАМКС принадлежат к суперсемейству пентамерных лиганд-зависимых ионных каналов с цистеиновой петлёй (англ. Cys-loop receptors), включающему также никотиновый ацетилхолиновый рецептор, глициновый рецептор и серотониновый рецептор 5-HT3[en].
Рецепторы ГАМКB относятся к классу рецепторов, сопряжённых с G-белками.
Классификация рецепторов ГАМК изначально основана на их сродстве к селективным лигандам. Рецепторы, обладающие сродством к бикукуллину[en], были изначально отнесены к классу А, а рецепторы, обладающие сродством к баклофену, — к классу B. Впоследствии были обнаружены рецепторы «ни-A, ни-B», которые не обладали сродством ни к одному из этих лигандов, затем отнесённые к классу C. Селективным антагонистом рецепторов ГАМКC является TPMPA[en].
ru.wikipedia.org
Глутаминовая кислота — Википедия
| Глутаминовая кислота | |||
|---|---|---|---|
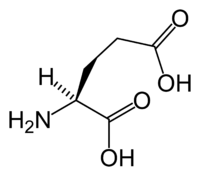 ( ({{{картинка2}}}) | |||
| Систематическое наименование | 2-Аминопентандиовая кислота | ||
| Сокращения | «глутамат», «Глу», «Glu», «E» | ||
| Традиционные названия | Аминоглутаровая кислота, глутаминовая кислота, глутамат | ||
| Хим. формула | C5H9NO4 | ||
| Рац. формула | C 40,82 %, H 6,17 %, N 9,52 %, O 43,5 % | ||
| Состояние | белый кристаллический порошок | ||
| Молярная масса | 147,1293 ± 0,006 г/моль | ||
| Плотность | 1,4601 1,538 (25° С) | ||
| Температура | |||
| • плавления | 160 °C | ||
| • кипения | 205 °C | ||
| • разложения | свыше 205 °C | ||
| Константа диссоциации кислоты pKa{\displaystyle pK_{a}} | 2,16, 4,15, 9,58 | ||
| Растворимость | |||
| • в воде | 7.5 г/л[1] | ||
| Изоэлектрическая точка | 3,22 | ||
| Рег. номер CAS | 56-86-0 | ||
| PubChem | 611 | ||
| Рег. номер EINECS | 200-293-7 | ||
| SMILES | |||
| InChI | |||
| Кодекс Алиментариус | E620 | ||
| ChEBI | 18237 | ||
| ChemSpider | 591 | ||
| NFPA 704 |  | ||
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |||
 Медиафайлы на Викискладе Медиафайлы на Викискладе | |||
Глутами́новая кислота́ (2-аминопентандио́вая кислота) — органическое соединение, алифатическая двухосновная аминокислота, входящая в состав белков всех известных живых организмов.
В биохимической литературе вместо громоздкого полного названия часто используют более компактные конвенциональные обозначения: «глутамат», «Glu», «Глу» или «E». Вне научной литературы термин «глутамат» также часто употребляется для обозначения широко распространённой пищевой добавки глутамата натрия.
В живых организмах остаток молекулы глутаминовой кислоты входит в состав белков, полипептидов, в некоторые низкомолекулярные вещества и присутствует в свободном виде. При биосинтезе белка включение остатка глутаминовой кислоты кодируется кодонами GAA и GAG.
Глутаминовая кислота играет важную роль в метаболизме азотсодержащих биохимических веществ[источник не указан 201 день]. Она также является нейромедиаторной аминокислотой, одной из важных представителей класса «возбуждающих аминокислот»[2].
Связывание глутаминовой кислоты со специфическими рецепторами нейронов приводит к их возбуждению[источник не указан 201 день].
Глутаминовая кислота относится к группе заменимых аминокислот, в человеческом организме cинтезируется.
Соли и сложные эфиры глутаминовой кислоты называются глутаматы.
Впервые глутаминовую кислоту получил в чистом виде в 1866 г. немецкий химик Карл Генрих Риттгаузен при обработке клейковины пшеничной муки серной кислотой[3], описал её свойства и дал ей название, от латинского слова «gluten» — «клейковина» + «амин».
Глутаминовая кислота при нормальных условиях представляет собой белое кристаллическое вещество, плохо растворимое в воде, этаноле, нерастворимое в ацетоне и диэтиловом эфире.▼ Чрезмерное потребление глутамата в эксперименте на крысах приводило к подавлению синтеза белка и резкому снижению его концентрации в сыворотке крови.
Глутамат натрия — натриевая соль глутаминовой кислоты — наиболее важный возбуждающий нейротрансмиттер в биохимических процессах в нервной системе позвоночных[4]. В химических синапсах глутамат запасается в пресинаптических пузырьках (везикулах). Нервный импульс активирует высвобождение иона глутаминовой кислоты из пресинаптического нейрона.
На постсинаптическом нейроне ион глутаминовой кислоты связывается с постсинаптическими рецепторами, такими, как, например, NMDA-рецепторы, и активирует их. Благодаря участию последних в синаптической пластичности ион глутаминовой кислоты участвует в таких функциях высшей нервной деятельности как обучение и память[5].
Одна из форм приспособляемости синапсов, называемая долговременной потенциацией, имеет место в глутаматергических синапсах гиппокампа, неокортекса и в других частях головного мозга человека.
Глутамат натрия участвует не только в классическом проведении нервного импульса от нейрона к нейрону, но и в объёмной нейротрансмиссии, когда сигнал передаётся в соседние синапсы путём кумулятивного эффекта глутамата натрия, высвобожденного в соседних синапсах (так называемая экстрасинаптическая или объёмная нейротрансмиссия)[6] В дополнение к этому, глутамат играет важную роль в регуляции конусов роста и синаптогенеза в процессе развития головного мозга, как это было описано Марком Мэтсоном[где?].
Транспортёры[7] глутамата натрия обнаружены на нейрональных[прояснить] мембранах и мембранах нейроглии. Они быстро удаляют[прояснить] глутамат из внеклеточного пространства. При повреждении мозга или заболеваниях они могут работать в противоположном[прояснить] направлении, вследствие чего глутамат натрия может накапливаться в межклеточном пространстве. Этот накопление приводит к поступлению большого количества ионов кальция в клетку через каналы NMDA-рецепторов, что, в свою очередь, вызывает повреждение и даже гибель клетки — это явление получило название эксайтотоксичности. Пути гибели клеток при этом включают:
- повреждение митохондрий избыточно высокой концентрацией внутриклеточных ионов кальция,
- Glu/Ca2+-опосредованной промоцией[прояснить] факторов транскрипции проапоптотических[прояснить] генов или снижением транскрипции анти-апоптотических генов. Эксайтотоксичность[прояснить], обусловленная повышенным высвобождением глутамата или его сниженным обратным захватом, возникает при ишемическом каскаде[прояснить][8] и ассоциирована с инсультом, а также наблюдается при таких заболеваниях, как боковой амиотрофический склероз, латиризм, аутизм, некоторые формы умственной отсталости, болезнь Альцгеймера[9].[10] В противоположность этому, снижение высвобождения глутамата наблюдается при классической фенилкетонурии, приводящей к нарушению экспрессии[прояснить] глутаматных рецепторов[11]
Глутаминовая кислота участвует биохимии эпилептического припадка. Естественная диффузия глутаминовой кислоты в нейроны вызывает спонтанную деполяризацию[прояснить], и этот паттерн[прояснить] напоминает пароксизмальную деполяризацию[прояснить][12] во время судорог. Эти изменения в эпилептическом очаге[прояснить] приводят к открытию вольтаж-зависимых[прояснить][13] кальциевых каналов, что снова стимулирует выброс глутамата и дальнейшую деполяризацию.
Роли глутаматной системы[прояснить] в настоящее время отводится большое место в патогенезе таких психических расстройств, как шизофрения и депрессия. Одной из наиболее активно изучаемых теорий этиопатогенеза шизофрении в настоящее время является гипотеза снижение функции NMDA-рецепторов: при применении антагонистов NMDA-рецепторов, таких, как фенциклидин, у здоровых добровольцев в эксперименте появляются симптомы шизофрении. В связи с этим предполагается, что снижение функции NMDA-рецепторов является одной из причин нарушений в дофаминергической[прояснить] передаче у больных шизофренией. Были также получены данные о том, что поражение NMDA-рецепторов иммунно-воспалительным механизмом («антиNMDA-рецепторный энцефалит») имеет наблюдается как острая шизофрения[источник не указан 460 дней].
Глутаматные рецепторы[править | править код]
Существуют ионотропные и метаботропные (mGLuR1-8) глутаматные рецепторы.
Ионотропными рецепторами являются NMDA-рецепторы, AMPA-рецепторы и каинатные рецепторы.
Эндогенные лиганды глутаматных рецепторов — глутаминовая кислота и аспарагиновая кислота. Для активации NMDA-рецепторов также необходим глицин. Блокаторами NMDA-рецепторов являются PCP, кетамин, и другие вещества. AMPA-рецепторы также блокируются CNQX, NBQX. Каиновая кислота является активатором каинатных рецепторов.
«Круговорот» глутамата[править | править код]
При наличии глюкозы в митохондриях нервных окончаний происходит дезаминирование глутамина до глутамата при помощи фермента глутаминазы. Также при аэробном окислении глюкозы глутамат обратимо синтезируется из альфа-кетоглутарата (образуется в цикле Кребса) при помощи аминотрансферазы.
Синтезированный нейроном глутамат закачивается в везикулы. Этот процесс является протон-сопряжённым транспортом. В везикулу с помощью протон-зависимой АТФазы закачиваются ионы H+. При выходе протонов по градиенту в везикулу поступают молекулы глутамата при помощи везикулярного транспортера глутамата (VGLUTs).
Глутамат выводится в синаптическую щель, откуда поступает в астроциты, там трансаминируется до глутамина. Глутамин выводится снова в синаптическую щель и только тогда захватывается нейроном. По некоторым данным, глутамат напрямую путём обратного захвата не возвращается.[14]
Роль глутаминовой кислоты в кислотно-щелочном балансе[править | править код]
Дезаминирование глутамина до глутамата при помощи фермента глутаминазы образует аммиак, который, в свою очередь, связывается со свободным ионом водорода и экскретируется в просвет почечного канальца, приводя к снижению ацидоза.
При превращении глутамата в α-кетоглутарат также образуется аммиак. Далее α-кетоглутарат распадается на воду и углекислый газ. Последние, при помощи карбоангидразы через угольную кислоту, превращаются в свободный ион водорода и гидрокарбонат. Ион водорода экскретируется в просвет почечного канальца за счёт совместной транспортировки с ионом натрия, а бикарбонат натрия попадает в плазму крови.
Глутаматергическая система[править | править код]
В ЦНС находится порядка 106 глутаматергических нейронов. Тела нейронов лежат в коре головного мозга, обонятельной луковице, гиппокампе, чёрной субстанции, мозжечке. В спинном мозге — в первичных афферентах дорзальных корешков.
В ГАМКергических нейронах глутамат является предшественником тормозного медиатора, гамма-аминомасляной кислоты, образующейся с помощью фермента глутаматдекарбоксилазы.
Повышенное содержание глутамата в синапсах между нейронами может перевозбудить и даже убить эти клетки, что в эксперименте приводит к заболеванию, клинически сходному с боковым амиотрофическим склерозом. Установлено, что для воспрепятствования глутаматной интоксикации нейронов глиальные клетки астроциты поглощают избыток глутамата. Он транспортируется в эти клетки с помощью транспортного белка GLT1, который присутствует в клеточной мембране астроцитов. Будучи поглощённым клетками астроглии, глутамат больше не приводит к повреждению нейронов.
Глутаминовая кислота относится к условно незаменимым аминокислотам. Глутамат в норме синтезируется организмом. Присутствие в пище свободного глутамата придаёт ей так называемый «мясной» вкус, для чего глутамат используют как усилитель вкуса.
Содержание натуральных глутаматов в пищевых продуктах:
| Продукт | Свободный глутамат[15][неавторитетный источник?] (мг/100 г) |
|---|---|
| Молоко коровье | 2 |
| Сыр пармезан | 1200 |
| Яйца птицы | 23 |
| Мясо цыплёнка | 44 |
| Мясо утки | 69 |
| Говядина | 33 |
| Свинина | 23 |
| Треска | 9 |
| Макрель | 36 |
| Форель | 20 |
| Зелёный горошек | 200 |
| Кукуруза | 130 |
| Свекла | 30 |
| Морковь | 33 |
| Лук | 18 |
| Шпинат | 39 |
| Томаты | 140 |
| Зелёный перец | 32 |
В промышленности глутаминовую кислоту получают используя штаммы культурных микроорганизмов.
В воде вещество растворяется плохо. Поэтому в пищевкусовой промышленности используют хорошо растворимую соль глутаминовой кислоты — глутамат натрия.
Фармакологический препарат глутаминовой кислоты оказывает умеренное психостимулирующее, возбуждающее и отчасти ноотропное действие.[уточнить]
Глутаминовая кислота (пищевая добавка E620) и её соли (глутамат натрия Е621, глутамат калия Е622, диглутамат кальция Е623, глутамат аммония Е624, глутамат магния Е625) используются как усилитель вкуса во многих пищевых продуктах[16].
Глутаминовую кислоту и её соли добавляют в полуфабрикаты, различные продукты быстрого приготовления, кулинарные изделия, концентраты бульонов. Она придаёт пище приятный мясной вкус.
В медицине применение глутаминовой кислоты оказывает незначительное психостимулирующее, возбуждающее и ноотропное действие, что используют в лечении ряда заболеваний нервной системы. В середине 20 века врачи рекомендовали применение глутаминовой кислоты внутрь в случае мышечно-дистрофических заболеваний. Также её назначали спортсменам с целью увеличения мышечной массы.
Глутаминовая кислота используется в качестве хирального строительного блока в органическом синтезе[17], в частности, дегидратация глутаминовой кислоты приводит к её лактаму ― пироглутаминовой кислоте (5-оксопролину), которая является ключевым предшественником в синтезах неприродных аминокислот, гетероциклических соединений, биологически активных соединений и т. д.[18][19][20][21].
- ↑ L-Glutamic acid (англ.). Chemical book.
- ↑ Moloney M. G. Excitatory amino acids. // Natural Product Reports. 2002. P. 597―616.
- ↑ R. H. A. Plimmer. The Chemical Constitution of the Protein (неопр.) / R.H.A. Plimmer; F.G. Hopkins. — 2nd. — London: Longmans, Green and Co., 1912. — Т. Part I. Analysis. — С. 114. — (Monographs on biochemistry).
- ↑ Meldrum, B. S. (2000). «Glutamate as a neurotransmitter in the brain: Review of physiology and pathology». The Journal of nutrition 130 (4S Suppl): 1007S-1015S.
- ↑ McEntee, W. J.; Crook, T. H. (1993). «Glutamate: Its role in learning, memory, and the aging brain». Psychopharmacology 111 (4): 391—401. DOI:10.1007/BF02253527 PMID 7870979
- ↑ Okubo, Y.; Sekiya, H.; Namiki, S.; Sakamoto, H.; Iinuma, S.; Yamasaki, M.; Watanabe, M.; Hirose, K.; Iino, M. (2010). «Imaging extrasynaptic glutamate dynamics in the brain». Proceedings of the National Academy of Sciences 107 (14): 6526. DOI:10.1073/pnas.0913154107.
- ↑ Shigeri, Y.; Seal, R. P.; Shimamoto, K. (2004). «Molecular pharmacology of glutamate transporters, EAATs and VGLUTs». Brain Research Reviews 45 (3): 250—265. DOI:10.1016/j.brainresrev.2004.04.004 PMID 15210307
- ↑ Discovery Could Help Scientists Stop ‘Death Cascade’ Of Neurons After A Stroke (англ.). ScienceDaily. Дата обращения 5 января 2020.
- ↑ Robert Sapolsky (2005). «Biology and Human Behavior: The Neurological Origins of Individuality, 2nd edition». The Teaching Company. «see pages 19 and 20 of Guide Book»
- ↑ Hynd, M.; Scott, H. L.; Dodd, P. R. (2004). «Glutamate-mediated excitotoxicity and neurodegeneration in Alzheimer?s disease». Neurochemistry International 45 (5): 583—595. DOI:10.1016/j.neuint.2004.03.007 PMID 15234100
- ↑ Glushakov, AV; Glushakova, O; Varshney, M; Bajpai, LK; Sumners, C; Laipis, PJ; Embury, JE; Baker, SP; Otero, DH; Dennis, DM; Seubert, CN; Martynyuk, AE (2005 Feb). «Long-term changes in glutamatergic synaptic transmission in phenylketonuria». Brain : a journal of neurology 128 (Pt 2): 300-7. DOI:10.1093/brain/awh454 PMID 15634735
- ↑ Vassiliki Aroniadou-Anderjaska, Brita Fritsch, Felicia Qashu, Maria F.M. Braga. Pathology and Pathophysiology of the Amygdala in Epileptogenesis and Epilepsy // Epilepsy research. — 2008-2. — Т. 78, вып. 2-3. — С. 102–116. — ISSN 0920-1211. — DOI:10.1016/j.eplepsyres.2007.11.011.
- ↑ James O. McNamara, Yang Zhong Huang, A. Soren Leonard. Molecular signaling mechanisms underlying epileptogenesis // Science’s STKE: signal transduction knowledge environment. — 2006-10-10. — Т. 2006, вып. 356. — С. re12. — ISSN 1525-8882. — DOI:10.1126/stke.3562006re12.
- ↑ Ашмарин И. П., Ещенко Н. Д., Каразеева Е. П. Нейрохимия в таблицах и схемах. — М.: «Экзамен», 2007
- ↑ If MSG is so bad for you, why doesn’t everyone in Asia have a headache? | Life and style | The Observer
- ↑ Садовникова М. С., Беликов В. М. Пути применения аминокислот в промышленности. //Успехи химии. 1978. Т. 47. Вып. 2. С. 357―383.
- ↑ Coppola G. M., Schuster H. F., Asymmetric synthesis. Construction of chiral moleculs using amino acids, A Wiley-Interscience Publication, New York, Chichester, Brisbane, Toronto, Singapore, 1987.
- ↑ Smith M. B. Pyroglutamte as a Chiral Template for the Synthesis of Alkaloids. Chapter 4 in Alkaloids: Chemical and Biological Perspectives. Vol. 12. Ed. by Pelletier S. W. Elsevier, 1998. P. 229―287.
- ↑ Nájera C., Yus M. Pyroglutamic acid: a versatile building block in asymmetric synthesis. //Tetrahedron: Asymmetry. 1999. V. 10. P. 2245―2303.
- ↑ Panday S. K., Prasad J., Dikshit D. K. Pyroglutamic acid: a unique chiral synthon. // Tetrahedron: Asymmetry. 2009. V. 20. P. 1581―1632.
- ↑ A. Stefanucci, E. Novellino, R. Costante, and A. Mollica. PYROGLUTAMIC ACID DERIVATIVES: BUILDING BLOCKS FOR DRUG DISCOVERY // HETEROCYCLES, 2014, V. 89, No. 8, pp. 1801―1825.
ru.wikipedia.org
Дофамин — Википедия
| Дофамин | |||
|---|---|---|---|
| |||
| Систематическое наименование | 2-(3,4-дигидроксифенил)-этиламин | ||
| Хим. формула | C8H11NO2 | ||
| Состояние | твёрдое, белое порошкообразное с характерным запахом | ||
| Молярная масса | 153,1784 ± 0,008 г/моль | ||
| Плотность | 1,26 г/см³ | ||
| Температура | |||
| • плавления | 128 °C | ||
| Константа диссоциации кислоты pKa{\displaystyle pK_{a}} | 8,93 | ||
| Растворимость | |||
| • в воде | 60 г/100 мл воды | ||
| Рег. номер CAS | 51-61-6 | ||
| PubChem | 681 | ||
| Рег. номер EINECS | 2 EC | ||
| SMILES | |||
| InChI | |||
| ChEBI | 18243 | ||
| ChemSpider | 661 | ||
| ЛД50 | 2859 (крысы, перорально) | ||
| Токсичность | слабо токсичен, ирритант | ||
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |||
 Медиафайлы на Викискладе Медиафайлы на Викискладе | |||
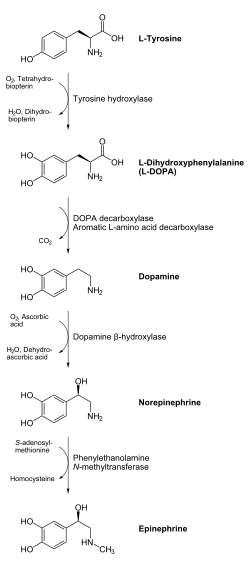
Дофами́н (допами́н[1], DA) — нейромедиатор, вырабатываемый в мозге человека, локализация выработки — гипоталамус. Дофамин синтезируется из аминокислоты тирозина через последующую стадию L-диоксифенилаланина. В дальнейшем из дофамина может вырабатываться норадреналин (также в гипоталамусе). Искусственно синтезированный дофамин, введенный в кровь инъекционно, действует как активатор сердечно-сосудистой деятельности наряду с норадреналином[2], но в ЦНС из крови этот гормон почти не проникает вследствие наличия гематоэнцефалического барьера.
Чувство удовлетворения[править | править код]
Дофамин является одним из химических факторов внутреннего подкрепления (ФВП) и служит важной частью «системы вознаграждения» мозга, поскольку вызывает чувство удовольствия (или удовлетворения), чем влияет на процессы мотивации и обучения[3][4]. Дофамин естественным образом вырабатывается в больших количествах во время положительного, по субъективному представлению человека, опыта — к примеру: секса, приёма вкусной пищи, приятных телесных ощущений[5]. Нейробиологические эксперименты показали, что даже воспоминания о поощрении могут увеличить уровень дофамина[6][3][4][7], поэтому данный нейромедиатор используется мозгом для оценки и мотивации, закрепляя важные для выживания и продолжения рода действия[8].
Чувство любви и привязанности[править | править код]
Дофамин (а также окситоцин) имеет важное значение и для формирования чувства любви, в том числе материнской[9]:136—138. В экспериментах на серых полёвках вида Microtus ochrogaster, для которого характерны моногамные семьи, было показано, что дофамин (в частности, D2-рецепторы) лежит в основе чувства привязанности к партнёру и супружеской верности у этих грызунов. По-видимому, сходную роль дофамин играет и у человека[9]:197—198.
Когнитивные функции[править | править код]
Дофамин играет немаловажную роль в обеспечении когнитивной деятельности. Активация дофаминергической передачи необходима при процессах переключения внимания человека с одного этапа когнитивной деятельности на другой. Таким образом, недостаточность дофаминергической передачи приводит к повышенной инертности больного, которая клинически проявляется замедленностью когнитивных процессов (брадифрения) и персеверациями. Данные нарушения являются наиболее типичными когнитивными симптомами болезней с дофаминергической недостаточностью — например, болезни Паркинсона[10]. Дофамин участвует в процессах обучения; как показали германские нейробиологи (Klein и др., 2007) в эксперименте на людях, дофамин обеспечивает возможность эффективно учиться на своих ошибках, и нехватка дофамина может приводить к игнорированию негативного опыта[9]:208—209.
Синтетические аналоги. Влияние наркотиков на уровень дофамина[править | править код]
Как и у большинства нейромедиаторов, у дофамина существуют синтетические аналоги, а также стимуляторы его выделения в мозге. В частности, многие наркотики увеличивают выработку и высвобождение дофамина в мозге в 5—10 раз, что позволяет людям, которые их употребляют, получать чувство удовольствия искусственным образом[11][12]. Так, амфетамин напрямую стимулирует выброс дофамина, воздействуя на механизм его транспортировки[13]. Другие наркотики, например кокаин и некоторые иные психостимуляторы, блокируют естественные механизмы обратного захвата дофамина, увеличивая его концентрацию в синаптическом пространстве[14]. Морфий и никотин имитируют действие натуральных нейромедиаторов[14], а алкоголь блокирует действие антагонистов дофамина[15]. Если пациент продолжает чрезмерно стимулировать свою «систему поощрения», постепенно мозг адаптируется к искусственно повышаемому уровню дофамина, производя меньше гормона и снижая количество рецепторов в «системе поощрения»[16]. Это один из факторов, побуждающих наркомана увеличивать дозу для получения прежнего эффекта. Дальнейшее развитие химической толерантности может постепенно привести к метаболическим нарушениям в головном мозге, а в долговременной перспективе потенциально нанести серьёзный ущерб здоровью мозга[17].
Биосинтез[править | править код]
Предшественником дофамина является L-тирозин (он синтезируется из фенилаланина), который гидроксилируется ферментом тирозингидроксилазой с образованием L-ДОФА, которая, в свою очередь, декарбоксилируется с помощью фермента L-ДОФА-декарбоксилазы и превращается в дофамин. Этот процесс происходит в цитоплазме нейрона.
Рецепторы[править | править код]
Постсинаптические дофаминовые рецепторы относятся к семейству GPCR. Существует по меньшей мере пять различных подтипов дофаминовых рецепторов — D1—5. Рецепторы D1 и D5 обладают довольно значительной гомологией и сопряжены с белком GS, который стимулирует аденилатциклазу, вследствие чего их обычно рассматривают совместно как D1-подобные рецепторы. Остальные рецепторы подсемейства подобны D2 и сопряжены с Gi-белком, который ингибирует аденилатциклазу, вследствие чего их объединяют под общим названием D-2-подобные рецепторы. Таким образом, дофаминовые рецепторы играют роль модуляторов долговременной потенциации[18].
Участие во «внутреннем подкреплении» принимают D2 и D4 рецепторы.
В больших концентрациях дофамин также стимулирует α- и β-адренорецепторы. Влияние на адренорецепторы связано не столько с прямой стимуляцией адренорецепторов, сколько со способностью дофамина высвобождать норадреналин из гранулярных пресинаптических депо, то есть оказывать непрямое адреномиметическое действие.
«Круговорот» дофамина[править | править код]
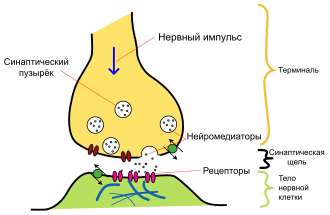 Основные элементы синапса
Основные элементы синапсаСинтезированный нейроном дофамин накапливается в дофаминовых везикулах (т. н. «синаптическом пузырьке»). Этот процесс является протон-сопряжённым транспортом. В везикулу с помощью протон-зависимой АТФ-азы закачиваются ионы H+. При выходе протонов по градиенту концентрации, в везикулу поступают молекулы дофамина.
Далее дофамин выводится в синаптическую щель. Часть его участвует в передаче нервного импульса, воздействуя на клеточные D-рецепторы постсинаптической мембраны, а часть возвращается в пресинаптический нейрон с помощью обратного захвата. Ауторегуляция выхода дофамина обеспечивается D2 и D3 рецепторами на мембране пресинаптического нейрона. Обратный захват производится транспортёром дофамина. Вернувшийся в клетку медиатор расщепляется с помощью моноаминооксидазы (МАО) и, далее, альдегиддегидрогеназы и катехол-О-метил-трансферазы до гомованилиновой кислоты.
Участие в системе поощрения[править | править код]
 Лабораторная крыса в специальном ящике нажимает рычаг. К голове животного прикреплены стимуляторы
Лабораторная крыса в специальном ящике нажимает рычаг. К голове животного прикреплены стимуляторыИсследование Олдса и Милнера на крысах[править | править код]
В фундаментальном исследовании 1954 года канадские учёные Джеймс Олдс и его коллега Питер Милнер обнаружили, что если имплантировать электроды в определённые участки мозга, особенно в средний узел переднего мозга, то крысу можно приучить нажимать рычаг в клетке, включающий стимуляцию низковольтными разрядами электричества[19]. Когда крысы научились стимулировать этот участок, они нажимали рычаг до тысячи раз в час[19]. Это дало основание предположить, что стимулируется центр наслаждения. Один из главных путей передачи нервных импульсов в этом участке мозга — дофаминовый, поэтому исследователи выдвинули версию, что главное химическое вещество, связанное с удовольствием, — это дофамин. В дальнейшем это предположение было подтверждено радионуклидными томографическими сканерами и открытием антипсихотиков (лекарственных средств, подавляющих продуктивные симптомы шизофрении)[20].
Эксперимент Шульца на обезьяне[править | править код]
Однако в 1997 году было показано, что дофамин играет более тонкую роль. В эксперименте Шульца у обезьяны создавали условный рефлекс по классической схеме Павлова: после светового сигнала в рот обезьяне впрыскивали сок. Было установлено, что:
- Когда сок впрыскивали неожиданно (не предваряя его сигналом), активность дофаминовых нейронов увеличивалась.
- На этапе обучения активность дофаминовых нейронов увеличивалась по-прежнему в ответ на впрыскивание сока.
- Когда условный рефлекс был сформирован, активность дофаминовых нейронов увеличивалась после подачи сигнала (до впрыскивания сока). Само впрыскивание сока на активности этих нейронов больше не отражалось (что противоречит гипотезе, согласно которой дофамин связан просто с получением удовольствия).
- Если в момент, когда ожидалось получение сока, сок не впрыскивали, активность дофаминовых нейронов снижалась.
Это позволило предположить, что дофамин участвует в формировании и закреплении условных рефлексов при положительном подкреплении и в гашении их, если подкрепление прекращается. Другими словами, если наше ожидание награды оправдывается, мозг сообщает нам об этом выработкой дофамина. Если же награда не последовала, снижение уровня дофамина сигнализирует, что модель разошлась с реальностью. В дальнейших работах показано, что активность дофаминовых нейронов хорошо описывается известной моделью обучения автоматов: действиям, быстрее приводящим к получению награды, приписывается большая ценность. Таким образом происходит обучение методом проб и ошибок[21].
Дофаминергическая система[править | править код]
Известно несколько дофаминовых ядер, расположенных в мозге. Это дугообразное ядро (лат. nucleus arcuatus), дающее свои отростки в срединное возвышение гипоталамуса. Дофаминовые нейроны чёрной субстанции посылают аксоны в стриатум (хвостатое и чечевицеобразное ядро). Нейроны, находящиеся в области вентральной покрышки, дают проекции к лимбическим структурам и коре.
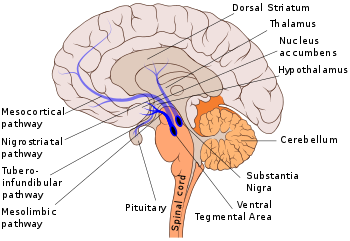 Основные дофаминовые пути
Основные дофаминовые путиОсновными дофаминовыми путями являются:
Тела нейронов нигростриарного, мезокортикального и мезолимбического трактов образуют комплекс нейронов чёрной субстанции и вентрального поля покрышки. Аксоны этих нейронов идут вначале в составе одного крупного тракта (медиального пучка переднего мозга), а далее расходятся в различные мозговые структуры. Некоторые авторы объединяют мезокортикальную и мезолимбическую подсистемы в единую систему, однако более обоснованно выделение мезокортикальной и мезолимбической подсистем соответственно проекциям в лобную кору и лимбические структуры мозга[22].
В экстрапирамидной системе дофамин играет роль стимулирующего нейромедиатора, способствующего повышению двигательной активности, уменьшению двигательной заторможенности и скованности, снижению гипертонуса мышц. Физиологическими антагонистами дофамина в экстрапирамидной системе являются ацетилхолин и ГАМК.
Отдел мозга, называемый чёрной субстанцией (чёрным веществом), является важнейшей составной частью дофаминергической системы награды. Кроме того, он имеет ключевое значение для мотивации и эмоциональной регуляции материнского поведения[9]:141. Вентральная часть покрышки среднего мозга, вентромедиальная часть префронтальной коры и миндалина, также относящиеся к дофаминергическим областям мозга, тоже играют очень важную роль в системе вознаграждения[9]:143—144.
Другие подсистемы[править | править код]
Выделяют также тубероинфундибулярный путь (лимбическая система — гипоталамус — гипофиз), инцертогипоталамический, диенцефалоспинальный и ретинальный[22] (иногда, вдобавок к этому, перивентрикулярную и ольфакторную системы[23]). Данная дифференциация не является абсолютной, поскольку проекции дофаминергических нейронов разных трактов «перекрываются»; кроме того, в мозге отмечается и диффузное распределение дофаминергических элементов (отдельных клеток с отростками)[22].
В гипоталамусе и гипофизе дофамин играет роль естественного тормозного нейромедиатора, угнетающего секрецию ряда гормонов. При этом угнетающее действие на секрецию разных гормонов реализуется при разных концентрациях дофамина, что обеспечивает высокую специфичность регуляции. Наиболее чувствительна к тормозящему действию дофаминергических сигналов секреция пролактина, в меньшей степени — секреция соматолиберина и соматотропина, в ещё меньшей — секреция кортиколиберина и кортикотропина и в совсем малой степени — секреция тиролиберина и тиротропина. Секреция гонадотропинов и гонадолиберина не угнетается дофаминергическими сигналами.
Ввиду чувствительности некоторых гормональных подсистем к уровню дофамина препараты-дофаминомиметики, усиливающие его синтез, могут применяться в качестве терапии при гормональных заболеваниях. Например, дофаминомиметики назначают при гиперпролактинемии и при болезни Паркинсона.
Дофамин и другие нейромедиаторы[править | править код]
Дофаминергические подсистемы находятся под контролем или сами контролируют норадренергические, серотонинергические, ГАМК-ергические, холинергические, мелатонинергические, глутаматергические, пептидергические системы. ГАМК-ергические и серотонинергические системы находятся в антагонистических отношениях с дофаминергической системой, а норадренергическая и дофаминергическая системы в различных функциональных состояниях функционируют однонаправленно: как в период бодрствования, так и в период сна. Взаимодействия дофаминергической и холинергической систем сложны, в условиях патологических процессов активность этих систем неоднозначна[23].
Дофамин обладает рядом физиологических свойств, характерных для адренергических веществ.
Влияние на сердце, сосуды[править | править код]
Дофамин вызывает повышение сопротивления периферических сосудов (менее сильное, чем под влиянием норадреналина). Он повышает систолическое артериальное давление в результате стимуляции α-адренорецепторов. Также дофамин увеличивает силу сердечных сокращений в результате стимуляции β-адренорецепторов. Увеличивается сердечный выброс. Частота сердечных сокращений увеличивается, но не так сильно, как под влиянием адреналина.
Потребность миокарда в кислороде под влиянием дофамина повышается, однако в результате увеличения коронарного кровотока обеспечивается повышенная доставка кислорода.
Влияние на почки[править | править код]
В результате специфического связывания с дофаминовыми рецепторами почек дофамин уменьшает сопротивление почечных сосудов, увеличивает в них кровоток и почечную фильтрацию. Наряду с этим повышается натрийурез. Происходит также расширение мезентериальных сосудов. Этим действием на почечные и мезентериальные сосуды дофамин отличается от других катехоламинов (норадреналина, адреналина и др.). Однако в больших концентрациях дофамин может вызывать сужение почечных сосудов.
Дофамин ингибирует также синтез альдостерона в коре надпочечников, понижает секрецию ренина почками, повышает секрецию простагландинов тканью почек.
Влияние на пищеварение[править | править код]
Дофамин тормозит перистальтику желудка и кишечника, вызывает расслабление нижнего пищеводного сфинктера и усиливает желудочно-пищеводный и дуодено-желудочный рефлюкс. В ЦНС дофамин стимулирует хеморецепторы триггерной зоны и рвотного центра и тем самым принимает участие в осуществлении акта рвоты.
Влияние на нервную систему[править | править код]
Через гематоэнцефалический барьер дофамин мало проникает, и повышение уровня дофамина в плазме крови оказывает малое влияние на функции ЦНС, за исключением действия на находящиеся вне гематоэнцефалического барьера участки, такие как триггерная зона.
Повышение уровня дофамина[править | править код]
Повышение уровня дофамина в плазме крови происходит при шоке, травмах, ожогах, кровопотере, стрессовых состояниях, при различных болевых синдромах, тревоге, страхе. Дофамин играет роль в адаптации организма к стрессовым ситуациям, травмам, кровопотере и др.
Также уровень дофамина в крови повышается при ухудшении кровоснабжения почек или при повышенном содержании ионов натрия, а также ангиотензина или альдостерона в плазме крови. По-видимому, это происходит вследствие повышения синтеза дофамина из ДОФА в ткани почек при их ишемии или при воздействии ангиотензина и альдостерона. Вероятно, этот физиологический механизм служит для коррекции ишемии почек и для противодействия гиперальдостеронемии и гипернатриемии.
Наиболее известными патологиями, связанными с дофамином, являются шизофрения и паркинсонизм, а также обсессивно-компульсивное расстройство. Различные независимые исследования показали, что многие лица, страдающие шизофренией, имеют повышенную дофаминергическую активность в некоторых структурах мозга[24][25][26], пониженную дофаминергическую активность в мезокортикальном пути[27][28][29][30] и префронтальной коре[27][28][24]. Для лечения шизофрении применяются антипсихотики — препараты, которые блокируют рецепторы дофамина преимущественно D2-типа и варьируются в степени аффинности к другим значимым нейромедиаторным рецепторам[31]. Типичные высокопотентные антипсихотики (такие, как галоперидол, трифтазин) в основном подавляют рецепторы D2, а большинство атипичных антипсихотиков (например, клозапин, оланзапин) и типичные низкопотентные (такие, как аминазин) воздействуют одновременно на целый ряд нейромедиаторных рецепторов: дофамина, серотонина, гистамина, ацетилхолина и других[31].
Предполагается, что снижение уровня дофамина в мезокортикальном пути связано с негативными симптомами шизофрении[27] (сглаживание аффекта, апатия, бедность речи, ангедония, уход из общества[28]), а также с когнитивными расстройствами[27] (дефициты внимания, рабочей памяти, исполнительных функций[28]). Антипсихотическое действие нейролептиков, то есть их способность редуцировать продуктивные нарушения — бред, галлюцинации, психомоторное возбуждение — связывают с угнетением дофаминергической передачи в мезолимбическом пути[30]. Нейролептики также угнетают дофаминергическую передачу и в мезокортикальном пути[32], что при длительной терапии часто приводит к усилению негативных нарушений[33] (см. Нейролептический дефицитарный синдром).
Длительная блокада нейролептиками дофаминовых рецепторов приводит к компенсаторным процессам; в связи с этим дофаминовая гипотеза шизофрении подвергается критике: утверждается, что чрезмерная активность в дофаминовой системе (увеличение концентрации дофамина, повышение чувствительности дофаминовых рецепторов или увеличение их плотности) может быть обусловлена не самой болезнью, а длительным применением нейролептиков[34]:89—90.
Паркинсонизм связан с пониженным содержанием дофамина в нигростриарном пути. Наблюдается при разрушении чёрной субстанции, патологии D1-подобных рецепторов. С угнетением дофаминергической передачи в нигростриарной системе связывают и развитие экстрапирамидных побочных эффектов при приёме антипсихотиков[30]: лекарственного паркинсонизма, дистонии, акатизии, поздней дискинезии и др. Для лечения болезни Паркинсона часто используют агонисты дофаминовых рецепторов (то есть аналоги дофамина: прамипексол, бромокриптин, перголид и др.): на сегодняшний день это самая многочисленная группа противопаркинсонических средств[35]. Некоторые из антидепрессантов также обладают дофаминергической активностью[36].
С нарушением дофаминергической системы связывают и такие расстройства, как ангедония, депрессия, деменция, патологическая агрессивность, фиксация патологических влечений, синдром персистирующей лактореи-аменореи, импотенция, акромегалия, синдром беспокойных ног и периодических движений в конечностях[23].
Снижение в результате мутаций количества дофаминовых рецепторов второго типа (D2) в некоторых участках мозга повышает риск импульсивного поведения, алкогольной и наркотической зависимостей. Для людей с пониженным количеством D2-рецепторов характерен также повышенный риск ожирения (поскольку эти люди нередко склонны к обжорству), других вредных привычек — в частности, страсти к азартным играм. Причиной того, что люди с пониженным количеством D2-рецепторов склонны к поиску экстремальных способов получения удовольствия от жизни, является, по всей видимости, нехватка положительных эмоций у этих людей; кроме того, причиной может являться сниженная способность этих людей учиться на собственных ошибках, делать правильные выводы из отрицательного опыта[9]:207—208.
Со снижением уровня дофамина в подкорковых образованиях и передних отделах головного мозга связывают также процесс нормального старения[37]. По данным исследований, процесс старения проявляется уменьшением объёма и массы головного мозга и уменьшением числа синаптических связей; кроме уменьшения числа церебральных рецепторов, имеет место и медиаторная церебральная недостаточность. С возрастом уменьшается количество и плотность дофаминовых D2-рецепторов стриатума, снижается концентрация дофамина в подкорковых образованиях головного мозга. Клиническими проявлениями этих изменений являются обеднение мимики, некоторая общая замедленность, сгорбленная, старческая поза, укорочение длины шага.
«Дофамин-чувствительные» изменения отмечаются также в когнитивной сфере: с возрастом снижается быстрота реакции, становится труднее усваивать и реализовывать новую программу действия, снижается уровень внимания, объём оперативной памяти. При отсутствии органической патологии возрастные когнитивные изменения не приводят к дезадаптации пожилых людей и позволяют поддерживать привычный ритм социальной активности[37].
- ↑ В русской терминологии принято название «дофамин». Вариант «допамин» представляет собой прямую транслитерацию принятого в англоязычной литературе термина dopamine и отсутствует в русских словарях. Различие объясняется разницей в сокращениях, возникшей из-за соответствия ph = ф: dihydroxyphenylalanine = DOPA, дигидроксифенилаланин = ДОФА.
- ↑ Дубынин В. А. Лекции по нейрофизиологии для биофака МГУ. — Москва: МГУ им. Ломоносова, 2015.
- ↑ 1 2 It’s all about dopamine (неопр.). Архивировано 22 августа 2011 года.
- ↑ 1 2 Biology of Happiness (неопр.). Архивировано 22 августа 2011 года.
- ↑ Ваш мозг во время секса (неопр.). Архивировано 22 августа 2011 года.
- ↑ Удовольствие: дофамин (неопр.).
- ↑ Кокаиновые наркоманы могут получать удовольствие только от одного ожидания этого удовольствия (неопр.).
- ↑ Dopamine and desire (неопр.). Архивировано 22 августа 2011 года.
- ↑ 1 2 3 4 5 6 Марков А. Эволюция человека. Книга 2. Обезьяны, нейроны и душа. — Corpus, 2011. — Т. 2. — 512 с. — (Династия). — 5000 экз. — ISBN 978-5-271-36294-1, 978-5-17-078089-1, 978-5-17-078089-1.
- ↑ Захаров В.В., Яхно Н.Н. Когнитивные расстройства в пожилом и старческом возрасте: Методическое пособие для врачей. — Москва, 2005.
- ↑ Your Brain on Drugs: Dopamine and Addiction (неопр.). Архивировано 22 августа 2011 года.
- ↑ Dopamine — A Sample Neurotransmitter (неопр.). Архивировано 22 августа 2011 года.
- ↑ A Mechanism for Amphetamine-Induced Dopamine Overload (неопр.).
- ↑ 1 2 HOW DRUGS AFFECT NEUROTRANSMITTERS (неопр.). Архивировано 22 августа 2011 года.
- ↑ Беловешкин А., к. м. н. Не жмите на педальку, или Величайший дофаминовый обман мозга
- ↑ Addiction and Dopamine (D2) Receptor Levels (2006) (неопр.). Архивировано 22 августа 2011 года.
- ↑ The Science Behind Drug Use and Addiction (неопр.). Архивировано 22 августа 2011 года.
- ↑ Mehta M.A., Riedel W.J. Dopaminergic Enhancement of Cognitive Function. // Curr. Pharm. Des. 2006. v. 12. pp. 2487—2500.
- ↑ 1 2 Британская энциклопедия, см. раздел «Reward and punishment» (неопр.). Архивировано 3 февраля 2012 года.
- ↑ The Functional Neuroanatomy of Pleasure and Happiness (неопр.). Архивировано 3 февраля 2012 года.
- ↑ К. Фрит, Мозг и душа. М.: Астрель: Corpus, 2012. C. 148—153
- ↑ 1 2 3 Орловская Д. Д. Нейрохимические системы мозга // Общая психиатрия / Под ред. А. С. Тиганова. — Москва, 2006.
- ↑ 1 2 3 Левин Я.И. Нейрохимическая медицина. Часть 1. Церебральные дофаминергические системы // Современная терапия психических расстройств. — 2008. — № 1.
- ↑ 1 2 The Dopamine Hypothesis of Schizophrenia: Version III—The Final Common Pathway (неопр.). Архивировано 23 августа 2011 года.
- ↑ Increased Striatal Dopamine Transmission in Schizophrenia: Confirmation in a Second Cohort (неопр.). Архивировано 23 августа 2011 года.
- ↑ Dysconnection in Schizophrenia: From Abnormal Synaptic Plasticity to Failures of Self-monitoring (неопр.). Архивировано 23 августа 2011 года.
- ↑ 1 2 3 4 Abi-Dargham A., Moore H. Prefrontal DA transmission at D1 receptors and the pathology of schizophrenia (англ.) // Neuroscientist : journal. — 2003. — October (vol. 9, no. 5). — P. 404—416. — DOI:10.1177/1073858403252674. — PMID 14580124.
- ↑ 1 2 3 4 Abi-Dargham A. The Dopamine Hypothesis of Schizophrenia (неопр.). Schizophrenia Research Forum (5 декабря 2005). Дата обращения 26 сентября 2011. Архивировано 3 февраля 2012 года. Перевод: Дофаминовая гипотеза шизофрении (неопр.) (15 августа 2008). Архивировано 3 февраля 2012 года.
- ↑ Lieberman J.A. Dopamine partial agonists: a new class of antipsychotic (англ.) // CNS Drugs (англ.)русск. : journal. — 2004. — Vol. 18, no. 4. — P. 251—267. — PMID 15015905.
ru.wikipedia.org
ГАМК-оперон — Википедия
Материал из Википедии — свободной энциклопедии
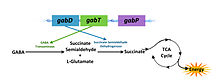 Механизм деградации ГАМК
Механизм деградации ГАМКГАМК-оперон несет ответственность за превращение γ-аминобутирата (ГАМК) в сукцинат. ГАМК -оперон включает три структурных гена — gabD , gabT и gabP , которые кодируют сукцинат полуальдегида дегидрогеназы, ГАМК-трансаминазы и ГАМК-пермеазы соответственно. Существует регулирующий ген csiR, ниже оперона, который кодирует предполагаемый репрессор транскрипции[1] и активируется при ограничении азота.
ГАМК-оперон был выявлен в кишечной палочке и значимые гомологи для ферментов были обнаружены в организмах, таких как Saccharomyces cerevisiae, крысы и человека[2].
Ограничение азота — условие активации генов ГАМК. Ферменты, полученные этими генами преобразуют ГАМК в сукцинат, который затем входит в ЦТК, чтобы использоваться в качестве источника энергии. ГАМК-оперон также известен содействием гомеостазу полиаминов в течение роста при ограничении азота и поддержанию высоких концентраций внутреннего глутамата в условиях стресса. [3]
ГАМК-оперон состоит из трех структурных генов:
- gabT : кодирует ГАМК-трансаминазу, которая производит янтарный полуальдегид.
- gabD : кодирует НАДФ-зависимую дегидрогеназу янтарного полуальдегида, который окисляет янтарный полуальдегид до сукцината.
- gabP : кодирует ДНК-специфическую пермеазу.
Ген GabT кодирует ГАМК-трансаминазу , фермент, который катализирует превращение ГАМК и 2-оксоглутарат в полуальдегид сукцината и глутамата. Полуальдегид сукцината затем окислятся в сукцинат с помощью полуальдегида дегидрогеназы сукцината (который кодируется геном gabP), тем самым вводя в ЦТК в качестве полезного источника энергии. ГАМК-оперон способствует гомеостазу полиаминов, таких как путресцин в ходе роста при ограниченнии азота. Известно также о его роли в поддержании высоких концентраций внутреннего глутамата в условиях стресса.
Дифференцированное регулирование промоторов[править | править код]
Экспрессия генов в опероне управляется тремя дифференциально регулируемыми промоторами, [4] два из которых управляются RpoS, кодирующим сигма-фактор σS.
- csiDp : — σS-зависимый и активируется исключительно углеродным голоданием, потому что действие цАМФ-CRP существенную активирует σS, содержащую РНК-полимеразу в промоторе csiD.
- gabDp1: — σ70-зависимый и индуцируется многочисленными стрессами.
- gabDp2: — σ70 зависимый и управляется Nac (управляющими усвоением азота) регуляторными белками, экспрессированными в соответствии с ограничением азота.
Механизм регулирования[править | править код]
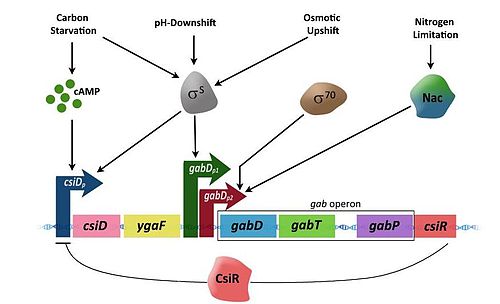 Структура и регуляторный механизм ГАМК-оперона.
Структура и регуляторный механизм ГАМК-оперона.Активация[править | править код]
Промотор csiD (csiDp) имеет важное значение для экспрессии csiD (генов, индуцированных углеродным голоданием), ygaF и ГАМК-генов. СsiDp активирован только в условиях углеродного голодания и стационарной фазы, в течение которой цАМФ накапливается в высоких концентрациях в клетке. Связывание цАМФ с белком рецептора цАМФ (CRP) вынуждает CRP жестко связываться с определенным сайтом ДНК в промоторе ‘csiDp, таким образом, активируя транскрипцию генов ниже промотора.
gabDp1 оказывает дополнительное управление gabDTP в регионе. gabDp1 активирует σS вызывая условия, такие как гиперосмотические и кислые сдвиги, кроме голодания и стационарной фазы. Промотор gabDp2, с другой стороны, является σ70-зависимым и активируется при ограничении азота. В условиях ограничения азота, регулятор азота Nac связывается с участком, расположенного чуть выше промотора, экспрессирующего гены ГАМК. Гены ГАМК при активации вырабатывают ферменты, которые превращают ГАМК в сукцинат.
Репрессия[править | править код]
Наличие азота активирует ген csiR, расположенный ниже гена gabP . Ген csiR кодирует белок, который действует как репрессор транскрипции для csiD-ygaF-ГАМК оперонов, следовательно, отключая деградацию пути ГАМК.
Деградации путей ГАМК существует почти во всех эукариотических организмах и происходит под действием аналогичных ферментов. Хотя, ГАМК в кишечной палочке в основном используется в качестве альтернативного источника энергии, ГАМК в высших эукариотических организмах выступают в качестве тормозящего нейромедиатора , а также в качестве регулятора мышечного тонуса. Пути деградации ГАМК у эукариот несут ответственность за инактивацию ГАМК.
- ↑ Schneider, Barbara L.; Ruback, Stephen; Kiupakis, Alexandros K.; Kasbarian, Hillary; Pybus, Christine; Reitzer, Larry. The Escherichia coli gabDTPC Operon: Specific γ-Aminobutyrate Catabolism and Nonspecific Induction (англ.) // Journal of Bacteriology (англ.)русск. : journal. — 2002. — Vol. 184, no. 24. — P. 6976—6986. — DOI:10.1128/JB.184.24.6976-6986.2002. — PMID 12446648.
- ↑ Bartsch, Klaus; Von Johnn-Marteville, Astrid; Schulz, Arno. Molecular Analysis of Two Genes of the Escherichia coli gab Cluster: Nucleotide Sequence of the Glutamate:Succinic Semialdehyde Transaminase Gene (gabT) and Characterization of the Succinic Semialdehyde Dehydrogenase Gene (gabD) (англ.) // Journal of Bacteriology (англ.)русск. : journal. — 1990. — Vol. 172, no. 12. — P. 7035—7042. — PMID 2254272.
- ↑ Metzner, Martin; Germer, Jens; Hengge, Regine. Multiple stress signal integration in the regulation of the complex σS-dependent csiD-ygaF-gabDTP operon in Escherichia coli (англ.) // Molecular Microbiology : journal. — 2003. — Vol. 51, no. 3. — P. 799—811. — DOI:10.1046/j.1365-2958.2003.03867.x. — PMID 14731280.
- ↑ Joloba, Moses L.; Clemmer, Katy M.; Sledjeski, Darren D.; Rather, Philip N. Activation of the gab Operon in an RpoS-Dependent Manner by Mutations That Truncate the Inner Core of Lipopolysaccharide in Escherichia coli (англ.) // Journal of Bacteriology (англ.)русск. : journal. — 2004. — Vol. 186, no. 24. — P. 8542—8546. — DOI:10.1128/JB.186.24.8542-8546.2004. — PMID 15576807.
ru.wikipedia.org

 (
(

 (
(
 (
(