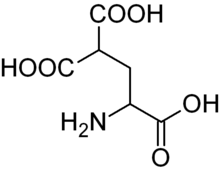
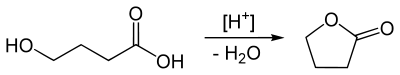карбоксиглутаминовая кислота — Carboxyglutamic acid
 | |
| имена | |
|---|---|
| название IUPAC 3-аминопропан-1,1,3-трикарбоновая кислота | |
| Другие имена гамма-карбоксиглутамат | |
| Идентификаторы | |
| 3D модель ( JSmol ) | |
| ChemSpider | |
| ИКГВ InfoCard | 100.054.607 |
| UNII | |
| |
| |
| свойства | |
| С 6 Н 9 NO 6 | |
| Молярная масса | 191,14 г / моль |
| плотность | 1,649 г / мл |
| Точка кипения | 418 ° С (784 ° F, 691 К) |
| За исключением случаев, когда указано иное, данные приведены для материалов в их стандартном состоянии (при 25 ° C [77 ° F], 100 кПа). | |
| ссылки Infobox | |
Синтез
В биосинтезе -carboxyglutamic кислоты, то -proton на глутаминовой кислоте реферируется, и СО 2 затем добавляют. Промежуточный продукт реакция представляет собой глутамили карбанион.
γ
{\ Displaystyle \ гамма}
γ
{\ Displaystyle \ гамма}
Эта реакция катализируется карбоксилазы, требующей витамина К как кофактора его. Это точно не известно , как витамин К участвует, но она выдвинута гипотеза , что свободный остаток цистеина в карбоксилазы преобразует витамин К в качестве активного сильного основания , что , в свою очередь абстрагируется водород из глутаминовой кислоты в -carbon. Затем СО 2 добавляют к -carbon с образованием -carboxyglutamic кислоты.
γ
{\ Displaystyle \ гамма}
Рисунок 1.
Гамма-карбоксиглутаминовый кислота богатых (ГЛК) домен
Ряд гамма-карбоксиглутамат остатков присутствуют в гамма-карбокси гл utamic в чид богатых ( «GLA») домена. Этот домен ГЛК , как известно, можно найти в более чем дюжины известных белков, в том числе факторы свертывания крови X, VII, IX и XIV, витамин К-зависимый белок S и Z, протромбина , транстиретин , остеокальцина , матрица Gla — белок (MGP), интер ингибитор трипсина -альфа тяжелой цепи Н2 , и рост сердца-специфический белок 6 (Gas6). Домен Gla несет ответственность за высокую аффинность связывания ионов кальция (Ca
Роль в свертывании
Остатки гамма-карбоксиглутаминовой кислоты играют важную роль в свертывании. С высоким сродством сайтами связывания кальция в домене GLA фактора IX, который представляет собой серин — протеазы свертывающей системы, были найдены частично опосредовать связывание фактора IXa с тромбоцитами и в активации фактора X-. Кроме того, при механической травме стенки кровеносных сосудов, фактор ткани клетки-ассоциированной обнажается и инициирует серию ферментативных реакций , локализованных на поверхности мембраны , как правило , представленную клетками и аккумулирующие тромбоцитами. Gla остатки частично регулируют активацию и связывание циркулирующего свертывания крови ферментов и зимогены к этой открытой поверхности клеточной мембраны. В частности, остатки GLA необходимы связывания кальция и обнажая гидрофобную мембрану области связывание с клеточным бислой. Отсутствие этих GLA остатков приводит к нарушению коагуляции или даже антикоагулянтов, что может привести к кровотечению диатез или тромбоза. Кроме того, удаление ионов кальция из этих белков с органическим хелатирующим агентом, таким как цитрат ион, вызывает их дисфункцию, а также предотвращает коагуляцию крови. Таким образом, добавление к цитрат крови является наиболее распространенным способом хранения его в жидком состоянии между урожаем и трансфузии.
Смотрите также
Рекомендации
<img src=»https://en.wikipedia.org/wiki/Special:CentralAutoLogin/start?type=1×1″ alt=»» title=»»>Гамма-глутамилкарбоксилаза — Gamma-glutamyl carboxylase — qwe.wiki
Гамма-глутамилкарбоксилазы представляет собой фермент , который у человека кодируется GGCX гена , расположенного на хромосоме 2 в 2p12.
функция
Гамма-глутамилкарбоксилаза представляет собой фермент , который катализирует посттрансляционную модификацию из витамина К — зависимых белков. Многие из этих витаминов К-зависимых белков участвуют в коагуляции , так что функция кодированного фермента имеет важное значение для гемостаза. Большинство GLA домена отработанных белки зависят от этой реакции карбоксилирования для посттрансляционной модификации . В организме человека, гамма-глутамил карбоксилазы фермент наиболее выражены в печени.
Каталитическая реакция
Гамма-глутамилкарбоксилаза окисляет витамин K гидрохинон витамин K 2,3 эпоксида, при одновременном добавлении CO 2 с белком глутаминовой кислоты (аббревиатура = Glu) , чтобы сформировать гамма-карбоксиглютаминовой кислоту (также называемый гамма- карбоксиглутамат , аббревиатура = GLA). Реакция карбоксилирования будет протекать только тогда , когда карбоксилаза фермент способен окислять витамин K гидрохинон витамин K эпоксид в то же время; карбоксилирования и эпоксидирования реакции , как говорят, в сочетании реакции.
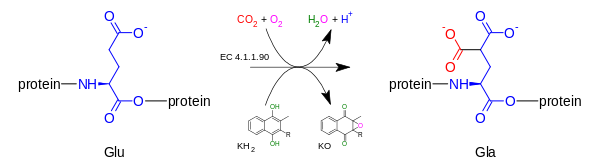 а [белок] -α-L-глутамат (Glu) + phylloquinol ( КН
а [белок] -α-L-глутамат (Glu) + phylloquinol ( КН2 ) +СО
2 + кислород → а [белок] 4-карбокси-L-глутамата (GLA) + витамин К 2,3-эпоксид (КО) +Н +
+ Н
2 O
Клиническое значение
Мутации в этом гене связаны с витамином К-зависимой коагуляцией дефектом и PXE -подобного расстройством с дефицитом множественного фактора свертывания крови.
Смотрите также
Рекомендации
дальнейшее чтение
- Bandyopadhyay PK (2008). «Витамин К-зависимые гамма-glutamylcarboxylation: древняя посттрансляционная модификация». Vitam. Horm . 78 : 157-84. DOI : 10.1016 / S0083-6729 (07) 00008-8 . PMID 18374194 .
- Беркнер KL (2008). «Витамин K-зависимых карбоксилирования». Vitam. Horm . 78 : 131-56. DOI : 10.1016 / S0083-6729 (07) 00007-6 . PMID 18374193 .
- Ольденбург Дж, Маринова М, Мюллер-Reible С, Watzka М (2008). «Витамин K цикл». Vitam. Horm . 78 : 35-62. DOI : 10.1016 / S0083-6729 (07) 00003-9 . PMID 18374189 .
- Беркнер KL (2005). «Витамин К-зависимые карбоксилазы». Annu. Rev. Nutr .
- Чжан B, D Гинзбург (сентябрь 2004). «Семейные несколько недостатков факторов свертывания: новая биологическая проницательность от редких заболеваний генетического кровотечения». J. Thromb. Haemost . 2 (9): 1564-72. DOI : 10.1111 / j.1538-7836.2004.00857.x . PMID 15333032 .
- Wallin R, Хутсон SM (июль 2004). «Варфарин и витамин К-зависимый система гамма-карбоксилирования». Тенденции Mol Med . 10 (7): 299-302. DOI : 10.1016 / j.molmed.2004.05.003 . PMID 15242675 .
- Беркнер KL (август 2000). «Витамин К-зависимые карбоксилазы» . J. Nutr . 130
- Presnell SR, Стаффорд DW (июнь 2002). «Витамин К-зависимые карбоксилазы». Thromb. Haemost . 87 (6): 937-46. PMID 12083499 .
- Bender, David A. (2003). Пищевая биохимия витаминов . Cambridge, UK: Cambridge University Press. ISBN 0-521-80388-8 .
- Болл, Джордж Э. (2004). Витамины: их роль в организме человека . Oxford: Blackwell Science. ISBN 0-632-06478-1 .
- Гребенки, Gerald F. (1998). Витамины: основные аспекты в области питания и здоровья . Boston: Academic Press. ISBN 0-12-183492-1 .
внешняя ссылка
Эта статья включает в себя текст из Национальной библиотеки США медицины , которая находится в общественном достоянии .
Остаток глутаминовой кислоты Остаток γ-карбоксиглутаминовой кислоты
Фермент удалось очистить до гомогенного состояния (белковая цепь содержит 758 аминокислот с пробладанием гидрофобных) и определить его структурный ген (он включает 15 экзонов).
При взаимодействии восстановленной формы витамина К-Н2 с γ-глута-маткарбоксилазой в присутствии кислорода образуется сильное основание (алк-оксид), способное отнять от γ-С атома глутаминовой кислоты водород, на место которого присоединяется СО2 – при этом образуется γ-карбоксиглутаминовая кислота. В ходе реакции появляются коротко живущие и высоко токсичные промежуточные соединения (свободные радикалы витамина К), которые превращаются в нетоксичный эпоксид витамина К в присутствие глутамата. Эпоксид витамина К снова восстанавливается в витамин К-Н2 с помощью ферментов редуктаз. Следовательно, при дефиците глутаминовой кислоты в клетке затрудняется обезвреживание токсичных свободных радикалов витамина К.
γ-карбоксиглутаминовая кислота является Са++ -связывающей аминокислотой, которая необходима для функционирования кальций-связывающих белков. К таковым относятся:
факторы свёртывающей системы крови: IX, VII, X и протромбин.
регуляторные белки (протеин С и протеин S), нуждающиеся в γ-карбоксиглутаминовой кислоте для Са-индуцированного взаимодействия с поверхностью клеточной мембраны.
белки минерализации костной ткани (костный γ-карбокси-глутаминовый протеин и другие). Поскольку при дефекте синтеза костного γ-карбоксиглутаминового белка кальцифицируются артерии и хрящи, возможно, что его функцией является также контроль за внекостной кальцификацией.
витамин К-зависимый белок Gas 6, активирующий рост гладкомышечных клеток; витамин К-зависимый сократительный белок хвостика сперматозоида.
некоторые нейротоксины (например, содержащиеся в яде улитки).
Общей особенностью всех витамин К-зависимых белков является формирование белковой сеточки, образованной γ-карбоксиглутаминовой кислотой, связанной с кальцием. Такая сеть впервые была описана для протромбина. Протромбин в присутствие Са++ связывается с биомембраной, что является необходимым условием для реализации процесса свёртывания крови.
Витамин К-зависимые белки синтезируются в эндоплазматическом ретикулуме в виде белков-предшественников, содержащих сигнальный участок и «участок узнавания» для γ-карбоксилирования. После отщепления сигнального пептида белок с помощью «участка узнавания» связывается с витамин К-зависимой карбоксилазой, локализующейся в мембранах эндоплазматического ретикулума. В результате этого связывания γ-карбоксиглутаматкарбоксилаза переходит из неактивного состояния в активное и начинает осуществлять каталитическое превращение остатка глутаминовой кислоты в γ-карбокси-глута-миновую кислоту в витамин К-зависимом пробелке. Карбоксилированный пробелок перемещается в сетчатый аппарат Гольджи, где расщепляется и зрелая белковая молекула секретируется клеткой в межклеточное пространство (см. рис.). На N-конце зрелого протромбина и других К-зависимых белков содержится 10-12 остатков γ-карбоксиглутаминовой кислоты. Домены с таким участками высоко структурированы и заключают в себе линейно расположенные ионы кальция.
Гиповитаминоз. Признаком недостаточности витамина К является повышенная кровоточивость, особенно при травмах. У взрослого человека гиповитаминоз К встречается довольно редко, так как этот витамин имеется во мно-
гих пищевых продуктах; кроме того, он синтезируется микрофлорой кишечника. У новорождённых недостаточность витамина К (геморрагическая болезнь новорождённных) – явление нередкое из-за низкого его содержания в материнском молоке и недостаточно развитой микрофлоры кишечника. Гиповитаминоз жирорастворимых витаминов может развиваться при нарушении выделения желчи, панкреатитах, дисбактериозах кишечника и некоторых других заболеваниях желудочно-кишечного тракта.
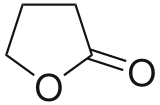
гамма — бутиролактон — gamma-Butyrolactone
 | |
 | |
| имена | |
|---|---|
| Предпочтительное название IUPAC | |
| Другие имена Дигидрофуран-2 (3 Н ) -он | |
| Идентификаторы | |
| 3D модель ( JSmol ) | |
| ChEBI | |
| ChEMBL | |
| ChemSpider | |
| DrugBank | |
| ИКГВ InfoCard | 100.002.282 |
| KEGG | |
| номер RTECS | LU3500000 |
| UNII | |
| |
| свойства | |
| С 4 Н 6 О 2 | |
| Молярная масса | 7001860900000000000 ♠86,090 г · моль -1 |
| Внешность | Бесцветная жидкость |
| плотность | 1,1286 г / мл (15 ° С), 1,1296 г / мл (20 ° С) |
| Температура плавления | -43,53 ° С (-46,35 ° F, 229,62 К) |
| Точка кипения | 204 ° С (399 ° F, 477 К) |
| смешивающийся | |
| Растворимость | растворим в CCl 4 , метанол , этанол , ацетон , бензол , этиловый эфир |
| войти P | -0,76 |
| Кислотность (р К ) | 4.5 |
| 1,435, 1,4341 (20 ° С) | |
| вязкость | 1,7 сП (25 ° С) |
| опасности | |
| Основные опасности | вредный |
| h418 , h402 , h436 | |
| Р264 , Р270 , Р280 , Р301 + 312 , P305 + 351 + 338 , P403 + 233 , P501 | |
| точка возгорания | 98 ° С (208 ° F, 371 К) (закрытые чашки) |
| Смертельная доза или концентрация ( LD , LC ): | |
| 17.2 мл / кг (перорально, крыса) | |
| За исключением случаев, когда указано иное, данные приведены для материалов в их стандартном состоянии (при 25 ° C [77 ° F], 100 кПа). | |
 Y проверить ( что ?) Y проверить ( что ?)  Y Y N N | |
| ссылки Infobox | |
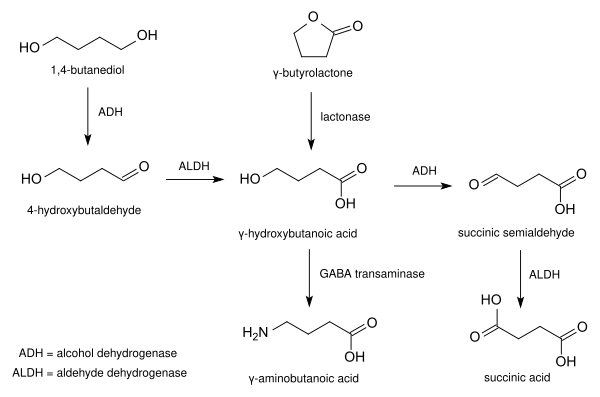
гамма-бутиролактон ( ГБЛ ) представляет собой гигроскопичный бесцветный, смешивающиеся с водой жидкость со слабым характерным запахом . Это самый простой 4-углерод лактон. Он в основном используется в качестве промежуточного продукта в производстве других химических веществ, например , метил-2-пирролидон . В организме человека ГБЛ действует в качестве пролекарства для гамма-гидроксимасляной кислоты (ГОМК), и он используется в качестве рекреационного интоксиканта с эффектами , похожими на барбитуратов .
Вхождение
GBL был найден в экстрактах из образцов чистейшего вина. Это открытие указывает на то, что ГБЛ является естественным компонентом в некоторых вин и могут присутствовать в аналогичных продуктах. Концентрация обнаружена была приблизительно 5 мкг / мл , и было легко наблюдать с помощью простой методики экстракции с последующим ГХ / МС анализа. ГБЛ можно найти в сырных ароматизаторов , но , как правило , приводит к содержанию 0,0002% ГБЛ в конечном пищевом продукте.
подготовка
ГБЛ производится в промышленности дегидрированием 1,4-бутандиол . Этот маршрут проходит через дегидратацию ГОК.
В лаборатории, он также может быть получен с помощью окисления тетрагидрофурана (ТГФ), например , с помощью водного раствора бромата натрия . Альтернативный путь исходит из ГАМК с помощью реакции Зандмейера .
Реакции
В лактон , ГБЛ является гидролизуют в соответствии с основными условиями, например , в гидроксида натрия раствора в натрий гамма — гидроксибутират , с натриевой солью из гамма — -hydroxybutyric кислоты . В кислой воде, смесь лактонов и кислотных форм сосуществуют в равновесии . Эти соединения могут затем перейти к форме в полимерную поли (4-гидроксибутират) . При обработке с ненуклеофильным основанием, таким как диизопропиламид лития , ГБЛ подвергается депротонированию альфа к карбонильному. Родственное соединение капролактон может быть использован для изготовления сложного полиэфира таким же образом.
полимеризация
Полимеризации с раскрытием цикла из бутиролактона дает polybutyrolactone. В результате чего возвращается к мономера путем термического крекинга . Утверждается , что поли (ГБЛ) является конкурентоспособным по сравнению с коммерческим биоматериала поли (4 — гидроксибутират ), или P4HB. Он также утверждал , что поли (ГБЛ) дешевле , чем сделать P4HB, хотя оба био происхождения.
Пользы
Битуролактон является главным предшественником других химических веществ. Взаимодействие с метиламина дает NMP. Аммиак дает пирролидон . Он также используется в качестве растворителя в лосьонах и некоторых полимеров.
Бутиролактон, с широким диапазоном жидкости, химической стабильностью и высокими диэлектрическими постоянная , используется в некоторых батареях , но , прежде всего , находится в электролитических конденсаторах в качестве органического растворителя. В этом качестве он часто смешивают с небольшим отношением этиленгликоля, «9: 1» является общим, для изменения внутреннего сопротивления .
Фармакология
GBL не активен в своем собственном праве; механизм его действия проистекает из его идентичности как пролекарства ГОК.
Снотворный эффект ГОМК усиливается сочетании с алкоголем. Эта комбинация является особенно токсична , как правило , приводит к тошноте / рвоте и угнетению дыхания. В 2003 году исследование показало , что крысы ГБЛ в комбинации с этанолом показали потенциируют гипнотический эффект, так как мера сна времени было больше , чем оба из отдельных компонентов , вместе взятых.
Фармакокинетика
ГБЛ быстро превращается в ГОМК по параоксоназа (lactonase) ферментов, найденных в крови. Животные , которые испытывают недостаток этих ферментов не проявляют никакого эффекта от ГБЛ. ГБЛ является более липофильный (жирорастворимый) , чем ГОМК, и так поглощается быстрее и имеет более высокую биологическую доступность . Из — за этих различий фармакокинетических, ГБЛ имеет тенденцию быть более сильным и быстрее , чем действия ГОМК, но имеет меньшую длительность; в то время как родственное соединение 1,4-бутандиол (1,4-B) , как правило, несколько менее сильное, медленнее вступил в силу , но длительное действие , чем GHB.
Уровни lactonase фермента могут варьироваться между отдельными людьми, а это означает, что пользователи в первый раз могут показать непредсказуемые результаты, даже от малых доз. Во многом это проявляется как медленное начало эффектов, а затем головных болями, пол-сознание, которое отличается от ГБЛ сна в обычных пользователях. Если пользователь решает повторить попытку позже, они появляются, чтобы иметь возможность пользоваться эффектами обычно.
Пищевая добавка
Благодаря своему свойству быть пролекарством из ГОК , который увеличивает секрецию связанных сна гормона роста (GH), GBL был продан в качестве пищевой добавки после планирования ГОК под названиями Revivarant и Renewtrient в США , по крайней мере до конца 1999 года ,
рекреационные наркотики
ГБЛ является пролекарством из GHB и его рекреационное использование происходит полностью в результате этого. Для того, чтобы обойти законы рестрикции ГОК, комплекты домашнего синтеза были введены для преобразования GBL и / или 1,4-B в GHB.
 Кувшины изъятого ГБЛ.
Кувшины изъятого ГБЛ.  предупреждение FDA против продуктов, содержащих GHB и его пролекарства, такие как ГБЛ.
предупреждение FDA против продуктов, содержащих GHB и его пролекарства, такие как ГБЛ.Передозировка GBL может вызвать иррациональное поведение, тяжелую болезнь, кома и смерть . ГБЛ имеет характерный вкус и запах, описанный как сравнимо с пресной водой, синтетическим или дыней аромата горелого пластика. Это существенно отличается от GHB, который описан как имеющий явно «соленый» вкус.
В связи с тем, что можно легко найти в компонентах, используемых в повседневных продуктах и их низкой стоимости, «стоит дозы около семи центов», по словам Патрика Ниссе, больничный врач, GBL стал весьма популярным среди молодых людей в ночных клубах во Франции.
Опасности
Если принимать в неразбавленном виде через рот, GBL может привести к пищевода и желудочно-кишечного раздражения. Вполне возможно, для орального проглатывания ГБЛ, чтобы вызвать тошноту и другие подобные проблемы, возможно, в большей степени, чем с GHB.
ГОМК имеет двухфазные эффекты, эффект эйфории при низких дозах (причина для жидкого экстази термина) и седативный эффект при более высоких дозах. В результате этого седации может привести к потере сознания. В сочетании с алкоголем повышенного седативного эффекта и риском рвоты приводит к высокому риску смертельного исхода. Многие организации снижения вреда не предполагают и не смешивание двух препаратов в качестве результата.
Там было новости сообщения о гибели нескольких людей, связанных с ГБЛ, как правило, в сочетании с алкоголем или другими депрессантами.
Привыкания и зависимости
Частое использование GHB / ГБЛ, даже если принимать долгосрочные и в умеренных дозах, как представляется, не вызывают значительную физическую зависимость в большинстве своих пользователей. У многих людей, прекративших или временно, которые воздерживаются от использования препаратов достигается при минимальной или каких-либо трудностей. Тем не менее, когда потребляется в чрезмерных количествах с высокой частотой дозирования, физическая и психологическая зависимость может развиваться. Управление ГБЛ зависимости предполагает, учитывая возраст человека, сопутствующую патологию и фармакологические пути ГБЛ.
GHB / GBL пользователи могут принять ’24 / 7′ режим дозирования. Это где пользователь становится толерантным к воздействию препарата, увеличение дозы и частота дозировки просто, чтобы избежать симптомов отмены.
Для тех пользователей , которые сообщают о абстинентных при выходе использования GHB / ГБЛ, кажется , что симптомы зависят от дозы и продолжительности времени , был использован препарат. Свет умерить пользователь часто испытывают бессонницу и проблемы со сном , связанными, в то время как тяжелое, длительное применение может вызвать серьезные симптомы абстиненции , похожие на синдром отмены бензодиазепина (BWS).
доза
Миллилитр чистого ГБЛА метаболизируется до эквивалента 1,65 г NaGHB , в общей форме, так что дозы измеряются в одном диапазоне миллилитра, либо принимать все сразу или потягивали в течение ночи.
Правовой статус
Австралия: GBL не классифицируется как лекарственное средство , но и как вредных для здоровья веществ. Хотя законодательство вступит в силу 1 апреля 2011 года позволит справиться с наркотиками для промышленных целей позволят GBL и 1,4-бутандиол, должны классифицироваться в качестве регулируемых веществ.
Канада: GBL является Контролируемым веществом под Schedule VI из «контролируемых наркотиков и веществ» в Канаде. График VI из «контролируемых средств и веществ Закон» требует поставщиков с целью сбора информации о закупках ГБЛ. Закон также запрещает ввоз и вывоз ГБЛ в или из Канады классификации его в качестве либо уголовного преступления , наказуемого до 10 лет лишения свободы или наказуемого в порядке суммарного карается лишением свободы на срок до восемнадцати месяцев. Это не является незаконным для человека , чтобы иметь GBL в Канаде.
Германия: GBL не указан в законе наркотиков, но его распределение контролируется. Обладание не является незаконным, но может быть наказано в соответствии с Законом о лекарственных препаратах, когда они предназначены для продажи для потребления человека или синтеза GHB. В последние годы наблюдается рост потребления GBL наблюдается вследствие запрещения GHB.
Гонконг: GBL является опасным наркотиком под контролем в соответствии с Перечнем 1 Dangerous Drugs постановления, Cap.134 (с пунктом освобождения в пункте 16D). Любой человек , который нашел , чтобы иметь в своем распоряжении его не в соответствии с настоящим Указом может нести ответственность, в случае осуждения по обвинительному акту, штраф в размере HK $ 1,000,000 и к лишению свободы сроком на 7 лет.
Израиль: GBL был классифицирован как запрещенное вещество с 2007 года.
Нидерланды : GBL был помещен в список 1 Opiumwet . Таким образом, экспорт и импорт, хранение, производство, продажа и перевозка запрещены. Тем не менее, использование лекарственных средств , запрещенных Opiumwet не считается незаконным, но в основном рассматриваться как проблема общественного здравоохранения.
Польша: GBL классифицируется как наркотик. Лицензия является обязательным для производства, переработки, переработку, импорт, распределение ГБЛ.
Россия : GBL классифицирован как психотропное вещество с 22 февраля 2012 года его оборот ограничен, и не лицензированы продавать, покупать или любое другое использование наказывается лишением свободы на срок до 20 лет.
Швеция: GBL не классифицируется как лекарственное средство , но и как вредных для здоровья веществ. Хотя недавно был принят закон , чтобы вступить в силу 1 апреля 2011 года позволит справиться с наркотиками для промышленных целей позволит GBL и 1,4-бутандиол, должны классифицироваться в качестве регулируемых веществ.
Великобритания: Из — за их законных целей, регулирование 4В правил 2001 делает правомерным импорт, экспорт, производство, поставку, предложение питания или обладать GBL и 1,4-BD . За исключением случаев, когда человек делает это , зная , или полагая , что они будут использоваться для целей человеческого употребления.
США: GBL регулируется в Список I контролируемых химических веществ. Как аналог GHB, он также рассматриваются в качестве регулируемого вещества Списка I из контролируемых веществ , если предназначенные для потребления человека.
Смотрите также
Рекомендации
внешняя ссылка
пироглутаминова кислота — Pyroglutamic acid
 | |
| имена | |
|---|---|
| Предпочтительное название IUPAC | |
| Систематическое название IUPAC 5-оксопирролидин-2-карбоновая кислота | |
Другие имена
| |
| Идентификаторы | |
| 3D модель ( JSmol ) | |
| 3DMet | B01555 |
| Сокращения | Glp |
| 82134 | |
| ChEBI | |
| ChEMBL | |
| ChemSpider | |
| DrugBank | |
| ИКГВ InfoCard | 100.021.578 |
| Номер EC | 205-748-3 |
| 1473408 | |
| KEGG | |
| MeSH | Пирролидонкарбоновой + кислота |
| номер RTECS | TW3710000 |
| UNII | |
| |
| |
| свойства | |
| С 5 Н 7 Н О 3 | |
| Молярная масса | 7002129115000000000 ♠129,115 г · моль -1 |
| Температура плавления | 184 ° С (363 ° F, 457 К) |
| войти P | -0,89 |
| Кислотность (р К ) | -1,76, 3,48, 12,76 |
| Базисность (р К б ) | 15,76, 10,52, 1,24 |
| изоэлектрической точки | 0,94 |
| За исключением случаев, когда указано иное, данные приведены для материалов в их стандартном состоянии (при 25 ° C [77 ° F], 100 кПа). | |
 N проверить ( что ?) N проверить ( что ?)  Y Y N N | |
| ссылки Infobox | |
Пироглутаминовая кислота (также известная как PCA , 5-оксопролины , pidolic кислота ) является повсеместно , но мало изучен естественной аминокислотой , производной , в котором свободная аминогруппа кислоты глутаминовой или глутамин циклизации с образованием лактама . Имена пироглутаминовой кислоты сопряженного основания , анион , солей и сложных эфиров являются пироглутамат , 5-oxoprolinate или pidolate.
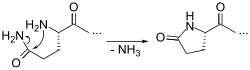 Формирование пироглутаминовой кислоты из N-концевого глутамина.
Формирование пироглутаминовой кислоты из N-концевого глутамина.Это является метаболитом в цикле глутатиона , который превращается в глутамат на 5-oxoprolinase. Пироглутамат встречается во многих белках , включая бактериородопсин . N — терминальном кислота и глутамин остатки глутаминовая может спонтанно циклизацию , чтобы стать пироглутаматом, или ферментативно превращают глутаминили циклазы . Это одна из нескольких форм блокированного N -termini , которые представляют собой проблему для N — терминального секвенирования с использованием Эдманом химии , которая требует свободной первичной аминогруппы , не присутствующую в пироглутаминовой кислоте. Фермент пироглутамат аминопептидаза может восстановить свободную N -terminus путем отщепления остатка пироглутаматного.
Пироглутаминова кислота существует в виде двух отдельных энантиомеров :
- (2 R ) или D , который происходит с (+) или d
- (2 S ) или L , которое случается (-) или л
метаболизм
Как впервые обнаружено в 1882 году, пироглутаминова кислота может быть образована путем нагрева глутаминовой кислоты при 180 ° С, что приводит к потере молекулы воды. В живых клетках, он является производным от глутатиона под действием фермента, гамма-глутамил cyclotransferase . Пироглутаминова кислота может функционировать при хранении глутамата, и действует , чтобы противостоять действию глутамата, в том числе в головном мозге. Он также воздействует на мозг холинергической системы ; Амилоида β , содержащие пироглутаминовой кислоты повышается при болезни Альцгеймера ; это может быть частью процесса заболевания. Повышение уровней пироглутаминовой кислоты в крови, или 5-oxoprolinuria , может произойти после передозировки парацетамола , а также в некоторых врожденных нарушений обмена веществ , что приводит к ацидозу , известный как высокий анионом разрыв метаболического ацидоза .
Пользы
Натрий соль из пироглутаминовой кислоты — известная либо как пироглутамат натрия, PCA натрия, или pidolate натрия — используется для сухих кожи и волос продуктов, так как это увлажнитель . Он имеет низкую токсичность и не раздражает кожу, но его использование в продуктах ограничивается высокой ценой.
L -пироглюматиновой кислота продается в Интернете в качестве ноотропного пищевой добавки .
Магний pidolate , соль магния пироглутаминовой кислоты, встречается в некоторых минеральных добавок .
Рекомендации
<img src=»https://en.wikipedia.org//en.wikipedia.org/wiki/Special:CentralAutoLogin/start?type=1×1″ alt=»» title=»»>Карбоксиглутаминовая кислота — Повторно опубликована в Википедии // WIKI 2
 | |
| Имена | |
|---|---|
| Название ИЮПАК 3-аминопропан-1,1,3-трикарбоновая кислота | |
| Другие названия γ-Карбоксиглутамат | |
| Идентификаторы | |
| ChemSpider | |
| Инфокарта ECHA | 100.054,607 |
| UNII | |
| |
| |
| Жилье | |
| C 6 H 9 НЕТ 6 | |
| Молярная масса | 191.14 г / моль |
| Плотность | 1,649 г / мл |
| Температура кипения | 418 ° С (784 ° F, 691 К) |
| Если не указано иное, данные приведены для материалов в их стандартном состоянии (при 25 ° C [77 ° F], 100 кПа). | |
| Ссылки Infobox | |
Карбоксиглутаминовая кислота (или основание конъюгата, карбоксиглутамат ) представляет собой необычную аминокислоту, введенную в белки путем посттрансляционного карбоксилирования остатков глутаминовой кислоты.Эта модификация обнаруживается, например, в факторах свертывания и других белках каскада свертывания. Эта модификация привносит сродство к ионам кальция. В каскаде свертывания крови витамин К необходим для введения гамма-карбоксилирования факторов свертывания крови II, VII, IX, X и белка Z. [1]
Синтез
В биосинтезе γ {\ displaystyle \ gamma} -карбоксиглутаминовая кислота, γ {\ displaystyle \ gamma} -протон на глутаминовой кислоте отводится, а затем добавляется CO 2 .Промежуточный продукт реакции представляет собой γ {\ displaystyle \ gamma} -глутамилкарбанион.
Эта реакция катализируется карбоксилазой, которой необходим витамин К в качестве кофактора. Точно не известно, как витамин К участвует, но есть гипотеза, что свободный остаток цистеина в карбоксилазе превращает витамин К в активное сильное основание, которое, в свою очередь, отводит водород от глютаминовой кислоты. γ {\ displaystyle \ gamma} -углерод. Затем CO 2 добавляется к γ {\ displaystyle \ gamma} -углерод для образования γ {\ displaystyle \ gamma} -карбоксиглутаминовая кислота. [2]
Рис. 1. [ постоянное мертвое звено ]
Домен, богатый гамма-карбоксиглутаминовой кислотой (GLA)
Ряд остатков гамма-карбоксиглутамата присутствует в гамма-карбокси gl утаминовом a cid-богатом («GLA») домене. Этот домен GLA, как известно, содержится в более чем дюжине известных белков, включая факторы свертывания крови X, VII, IX и XIV, витамин K-зависимый белок S и Z, протромбин, транстиретин, остеокальцин, матричный белок Gla (MGP), межклеточный белок. -альфа-трипсин ингибитор тяжелой цепи h3 и белок 6, специфичный для остановки роста (Gas6).Домен Gla отвечает за высокоаффинное связывание ионов кальция (Ca 2+ с белками Gla, что часто необходимо для их конформации и всегда необходимо для их функции. [3]
Роль в коагуляции
Остатки гамма-карбоксиглутаминовой кислоты играют важную роль в коагуляции. Было обнаружено, что высокоаффинные сайты связывания кальция в домене GLA фактора IX, который представляет собой сериновую протеазу системы свертывания крови, частично опосредуют связывание фактора IXa с тромбоцитами и активацию фактора X. [4] Кроме того, при механическом повреждении стенки кровеносного сосуда тканевый фактор, связанный с клетками, подвергается воздействию и инициирует серию ферментативных реакций, локализованных на поверхности мембраны, обычно обеспечиваемой клетками и накапливающими тромбоциты. Остатки Gla частично регулируют активацию и связывание циркулирующих ферментов свертывания крови и зимогенов с этой открытой поверхностью клеточной мембраны. В частности, остатки gla необходимы для связывания кальция и для экспонирования областей связывания гидрофобных мембран двухслойной клетке.Недостаток этих остатков gla приводит к нарушению коагуляции или даже антикоагуляции, что может привести к кровоточащему диатезу или тромбозу. [5] Кроме того, удаление иона кальция из этих белков с помощью органического хелатора, такого как ион цитрата, вызывает их дисфункцию и предотвращает свертывание крови. Таким образом, добавление цитрата к крови является наиболее распространенным методом хранения ее в жидком состоянии между сбором крови и переливанием.
См. Также
Список литературы
- ^ Дж. Стенфло и Дж. В. Сатти (1977). Kalafatis, M .; Egan, J. O .; van’t Veer, C .; Манн, К. Г. (1996-01-01). «Регулирующая и регулирующая роль гамма-карбоксиглутаминовой кислоты, содержащей факторы свертывания». Критические обзоры экспрессии эукариотических генов . 6 (1): 87–101. DOI: 10.1615 / critreveukargeneexpr.v6.i1.60. ISSN 1045-4403. PMID 8882309.
 Эта страница последний раз была отредактирована 13 июля 2020 в 17:34
.
Эта страница последний раз была отредактирована 13 июля 2020 в 17:34
.гамма-карбоксиглутаминовая кислота Википедия
| Имена | |
|---|---|
| наименование IUPAC 3-аминопропан-1,1,3-трикарбоновая кислота | |
| Другие названия γ-Карбоксиглутамат | |
| Идентификаторы | |
| ChemSpider | |
| ECHA InfoCard | 100.054,607 |
| UNII | |
| |
| |
| Жилье | |
| C 6 H 9 НЕТ 6 | |
| Молярная масса | 191.14 г / моль |
| Плотность | 1,649 г / мл |
| Температура кипения | 418 ° С (784 ° F, 691 К) |
| Если не указано иное, данные приведены для материалов в их стандартном состоянии (при 25 ° C [77 ° F], 100 кПа). | |
| Ссылки Infobox | |
Карбоксиглутаминовая кислота (или основание конъюгата, карбоксиглутамат ) представляет собой необычную аминокислоту, введенную в белки путем посттрансляционного карбоксилирования остатков глутаминовой кислоты.Эта модификация обнаруживается, например, в факторах свертывания и других белках каскада свертывания. Эта модификация привносит сродство к ионам кальция. В каскаде свертывания крови витамин К необходим для введения гамма-карбоксилирования факторов свертывания крови II, VII, IX, X и белка Z. [1]
Синтез []
В биосинтезе γ {\ displaystyle \ gamma} -карбоксиглутаминовая кислота, γ {\ displaystyle \ gamma} -протон на глутаминовой кислоте отводится, а затем добавляется CO 2 .Промежуточный продукт реакции представляет собой γ {\ displaystyle \ gamma} -глутамилкарбанион.
Эта реакция катализируется карбоксилазой, которой необходим витамин К в качестве кофактора. Точно не известно, как витамин К участвует, но есть гипотеза, что свободный остаток цистеина в карбоксилазе превращает витамин К в активное сильное основание, которое, в свою очередь, отводит водород от глютаминовой кислоты. γ {\ displaystyle \ gamma} -углерод.Затем CO 2 добавляется к γ {\ displaystyle \ gamma} -углерод для образования γ {\ displaystyle \ gamma} -карбоксиглутаминовая кислота. [2]
Рис. 1. [ постоянное мертвое звено ]
Домен, богатый гамма-карбоксиглутаминовой кислотой (GLA) []
Ряд остатков гамма-карбоксиглутамата присутствует в гамма-карбокси gl утаминовой кислоты a cid-rich («GLA») домене.Этот домен GLA, как известно, содержится в более чем дюжине известных белков, включая факторы свертывания крови X, VII, IX и XIV, витамин K-зависимый белок S и Z, протромбин, транстиретин, остеокальцин, матричный белок Gla (MGP), межклеточный белок. -альфа-трипсин ингибитор тяжелой цепи h3 и белок 6, специфичный для остановки роста (Gas6). Домен Gla отвечает за высокоаффинное связывание ионов кальция (Ca 2+ с белками Gla, что часто необходимо для их конформации и всегда необходимо для их функции. [3]
Роль в коагуляции []
Остатки гамма-карбоксиглутаминовой кислоты играют важную роль в коагуляции. Было обнаружено, что высокоаффинные сайты связывания кальция в домене GLA фактора IX, который представляет собой сериновую протеазу системы свертывания крови, частично опосредуют связывание фактора IXa с тромбоцитами и активацию фактора X. [4] Кроме того, при механическом повреждении стенки кровеносного сосуда тканевый фактор, связанный с клетками, подвергается воздействию и инициирует серию ферментативных реакций, локализованных на поверхности мембраны, обычно обеспечиваемой клетками и накапливающими тромбоциты.Остатки Gla частично регулируют активацию и связывание циркулирующих ферментов свертывания крови и зимогенов с этой открытой поверхностью клеточной мембраны. В частности, остатки gla необходимы для связывания кальция и для экспонирования областей связывания гидрофобных мембран двухслойной клетке. Недостаток этих остатков gla приводит к нарушению коагуляции или даже антикоагуляции, что может привести к кровоточащему диатезу или тромбозу. [5] Кроме того, удаление иона кальция из этих белков с помощью органического хелатора, такого как ион цитрата, вызывает их дисфункцию и предотвращает свертывание крови. Kalafatis, M .; Egan, J. O .; van’t Veer, C .; Манн, К. Г. (1996-01-01). «Регулирующая и регулирующая роль гамма-карбоксиглутаминовой кислоты, содержащей факторы свертывания». Критические обзоры экспрессии эукариотических генов . 6 (1): 87–101. DOI: 10.1615 / critreveukargeneexpr.v6.i1.60. ISSN 1045-4403. PMID 8882309. .
Wikizero — Карбоксиглутаминовая кислота
 | |
| Наименования | |
|---|---|
| Название IUPAC 3-Аминопропан-1,1,3-трикарбоновая кислота 9000 9000 9000 других названий Карбоновая кислота 9000 | |
| Идентификаторы | |
| ChemSpider | |
| ECHA InfoCard | 100.054.607 |
| UNII | |
| |
| |
| Свойства | |
| C 6 H 9 NO 6 | |
| Молярная масса | 191.14 г / моль |
| Плотность | 1,649 г / мл |
| Точка кипения | 418 ° C (784 ° F; 691 K) |
| Если не указано иное, данные приведены для материалов в их стандартное состояние (при 25 ° C [77 ° F], 100 кПа). | |
| Ссылки Infobox | |
Карбоксиглутаминовая кислота (или сопряженное основание, карбоксиглутамат ), представляет собой необычную аминокислоту, введенную в белки посттрансляционной карбоксильной группой. .Эта модификация обнаруживается, например, в факторах свертывания и других белках каскада свертывания. Эта модификация привносит сродство к ионам кальция. В каскаде свертывания крови витамин К необходим для введения гамма-карбоксилирования факторов свертывания крови II, VII, IX, X и белка Z. [1]
Синтез [править]
В биосинтезе γ {\ displaystyle \ gamma} -карбоксиглутаминовая кислота, γ {\ displaystyle \ gamma} -протон на глутаминовой кислоте отводится, а затем добавляется CO 2 .Промежуточный продукт реакции представляет собой γ {\ displaystyle \ gamma} -глутамилкарбанион.
Эта реакция катализируется карбоксилазой, которой необходим витамин К в качестве кофактора. Точно не известно, как витамин К участвует, но предполагается, что свободный остаток цистеина в карбоксилазе превращает витамин К в активное сильное основание, которое, в свою очередь, отводит водород из γ {\ displaystyle \ gamma} -углерода глутаминовой кислоты.Затем к γ {\ displaystyle \ gamma} -углероду добавляют CO 2 с образованием γ {\ displaystyle \ gamma} -карбоксиглутаминовой кислоты. [2]
Рис. 1. [ постоянная мертвая связь ]
Домен, богатый гамма-карбоксиглутаминовой кислотой (GLA) [править]
Ряд остатков гамма-карбоксиглутамата присутствует в гамма- карбокси gl утаминовый богатый cid доменом («GLA»).Этот домен GLA, как известно, содержится в более чем дюжине известных белков, включая факторы свертывания крови X, VII, IX и XIV, витамин K-зависимый белок S и Z, протромбин, транстиретин, остеокальцин, матричный белок Gla (MGP), межклеточный белок. -альфа-трипсин ингибитор тяжелой цепи h3 и белок 6, специфичный для остановки роста (Gas6). Домен Gla отвечает за высокоаффинное связывание ионов кальция (Ca 2+ с белками Gla, что часто необходимо для их конформации и всегда необходимо для их функции. [3]
Роль в коагуляции [редактировать]
Остатки гамма-карбоксиглутаминовой кислоты играют важную роль в коагуляции. Было обнаружено, что высокоаффинные сайты связывания кальция в домене GLA фактора IX, который представляет собой сериновую протеазу системы свертывания крови, частично опосредуют связывание фактора IXa с тромбоцитами и активацию фактора X. [4] Кроме того, при механическом повреждении стенки кровеносного сосуда тканевый фактор, связанный с клетками, подвергается воздействию и инициирует серию ферментативных реакций, локализованных на поверхности мембраны, обычно обеспечиваемой клетками и накапливающими тромбоциты.Остатки Gla частично регулируют активацию и связывание циркулирующих ферментов свертывания крови и зимогенов с этой открытой поверхностью клеточной мембраны. В частности, остатки gla необходимы для связывания кальция и для экспонирования областей связывания гидрофобных мембран двухслойной клетке. Недостаток этих остатков gla приводит к нарушению коагуляции или даже антикоагуляции, что может привести к кровоточащему диатезу или тромбозу. [5] Кроме того, удаление иона кальция из этих белков с помощью органического хелатора, такого как ион цитрата, вызывает их дисфункцию и предотвращает свертывание крови. Kalafatis, M .; Egan, J. O .; van’t Veer, C .; Манн, К. Г. (1996-01-01). «Регулирующая и регулирующая роль гамма-карбоксиглутаминовой кислоты, содержащей факторы свертывания». Критические обзоры экспрессии эукариотических генов . 6 (1): 87–101. DOI: 10.1615 / critreveukargeneexpr.v6.i1.60. ISSN 1045-4403. PMID 8882309. .
Wikizero — Карбоксиглутаминовая кислота
 | |
| Наименования | |
|---|---|
| Название IUPAC 3-Аминопропан-1,1,3-трикарбоновая кислота 9000 9000 9000 других названий Карбоновая кислота 9000 | |
| Идентификаторы | |
| ChemSpider | |
| ECHA InfoCard | 100.054.607 |
| UNII | |
| |
| |
| Свойства | |
| C 6 H 9 NO 6 | |
| Молярная масса | 191.14 г / моль |
| Плотность | 1,649 г / мл |
| Точка кипения | 418 ° C (784 ° F; 691 K) |
| Если не указано иное, данные приведены для материалов в их стандартное состояние (при 25 ° C [77 ° F], 100 кПа). | |
| Ссылки Infobox | |
Карбоксиглутаминовая кислота (или сопряженное основание, карбоксиглутамат ), представляет собой необычную аминокислоту, введенную в белки посттрансляционной карбоксильной группой. .Эта модификация обнаруживается, например, в факторах свертывания и других белках каскада свертывания. Эта модификация привносит сродство к ионам кальция. В каскаде свертывания крови витамин К необходим для введения гамма-карбоксилирования факторов свертывания крови II, VII, IX, X и белка Z. [1]
Синтез [править]
В биосинтезе γ {\ displaystyle \ gamma} -карбоксиглутаминовая кислота, γ {\ displaystyle \ gamma} -протон на глутаминовой кислоте отводится, а затем добавляется CO 2 .Промежуточный продукт реакции представляет собой γ {\ displaystyle \ gamma} -глутамилкарбанион.
Эта реакция катализируется карбоксилазой, которой необходим витамин К в качестве кофактора. Точно не известно, как витамин К участвует, но предполагается, что свободный остаток цистеина в карбоксилазе превращает витамин К в активное сильное основание, которое, в свою очередь, отводит водород из γ {\ displaystyle \ gamma} -углерода глутаминовой кислоты.Затем к γ {\ displaystyle \ gamma} -углероду добавляют CO 2 с образованием γ {\ displaystyle \ gamma} -карбоксиглутаминовой кислоты. [2]
Рис. 1. [ постоянная мертвая связь ]
Домен, богатый гамма-карбоксиглутаминовой кислотой (GLA) [править]
Ряд остатков гамма-карбоксиглутамата присутствует в гамма- карбокси gl утаминовый богатый cid доменом («GLA»).Этот домен GLA, как известно, содержится в более чем дюжине известных белков, включая факторы свертывания крови X, VII, IX и XIV, витамин K-зависимый белок S и Z, протромбин, транстиретин, остеокальцин, матричный белок Gla (MGP), межклеточный белок. -альфа-трипсин ингибитор тяжелой цепи h3 и белок 6, специфичный для остановки роста (Gas6). Домен Gla отвечает за высокоаффинное связывание ионов кальция (Ca 2+ с белками Gla, что часто необходимо для их конформации и всегда необходимо для их функции. [3]
Роль в коагуляции [редактировать]
Остатки гамма-карбоксиглутаминовой кислоты играют важную роль в коагуляции. Было обнаружено, что высокоаффинные сайты связывания кальция в домене GLA фактора IX, который представляет собой сериновую протеазу системы свертывания крови, частично опосредуют связывание фактора IXa с тромбоцитами и активацию фактора X. [4] Кроме того, при механическом повреждении стенки кровеносного сосуда тканевый фактор, связанный с клетками, подвергается воздействию и инициирует серию ферментативных реакций, локализованных на поверхности мембраны, обычно обеспечиваемой клетками и накапливающими тромбоциты.Остатки Gla частично регулируют активацию и связывание циркулирующих ферментов свертывания крови и зимогенов с этой открытой поверхностью клеточной мембраны. В частности, остатки gla необходимы для связывания кальция и для экспонирования областей связывания гидрофобных мембран двухслойной клетке. Недостаток этих остатков gla приводит к нарушению коагуляции или даже антикоагуляции, что может привести к кровоточащему диатезу или тромбозу. [5] Кроме того, удаление иона кальция из этих белков с помощью органического хелатора, такого как ион цитрата, вызывает их дисфункцию и предотвращает свертывание крови. Kalafatis, M .; Egan, J. O .; van’t Veer, C .; Манн, К. Г. (1996-01-01). «Регулирующая и регулирующая роль гамма-карбоксиглутаминовой кислоты, содержащей факторы свертывания». Критические обзоры экспрессии эукариотических генов . 6 (1): 87–101. DOI: 10.1615 / critreveukargeneexpr.v6.i1.60. ISSN 1045-4403. PMID 8882309. .