Человек генно-модифицированный / Homo genere mutatio
Статья на конкурс «био/мол/текст»: Когда Олдос Хаксли писал «Дивный новый мир», думал ли он, что на самом деле может наступить эра детей, созданных по заказу? «Дети здесь не рождаются. Их выращивают в специальных инкубаторах и делят на альфы, беты, гаммы, дельты и эпсилоны в зависимости от умственных способностей». На сегодняшний день вряд ли найдется более рьяно обсуждаемая в СМИ тема биомедицины, чем CRISPR/Cas. СМИ готовят общество к появлению в будущем фабрик по производству детей на заказ, ученые — к возможности создания генетической панацеи. Исследования на человеческих эмбрионах с применением генетических модификаций лишь подливают масла в огонь. Общественность строит догадки, какие перспективы дает этот инструмент генного редактирования в руках ученых. Ждет ли мир появление «отредактированных» людей? Станет ли Homo genere mutatio в эволюционный ряд после Homo sapiens sapiens? К чему бы ни привела технология CRISPR/Cas, несомненно, что это шаг в бездну новых возможностей.

Эта работа опубликована в номинации «Биомедицина сегодня и завтра» конкурса «био/мол/текст»-2017.

Генеральный спонсор конкурса — компания «Диаэм»: крупнейший поставщик оборудования, реагентов и расходных материалов для биологических исследований и производств.

Спонсором приза зрительских симпатий и партнером номинации «Биомедицина сегодня и завтра» выступила фирма «Инвитро».

«Книжный» спонсор конкурса — «Альпина нон-фикшн»
Что такое CRISPR/Cas9 и с чем его едят
Хотя система CRISPR известна с 1980-х, активно о ней заговорили лишь несколько лет назад [1]. Повышенное внимание к технологии генной модификации связано с перспективами, которые она открывает. В частности, лечение генетических заболеваний. Это может изменить медицину. Освоение CRISPR/Cas9 в рамках человеческого тела подобно первым шагам в космосе.
Технология CRISPR (от англ.
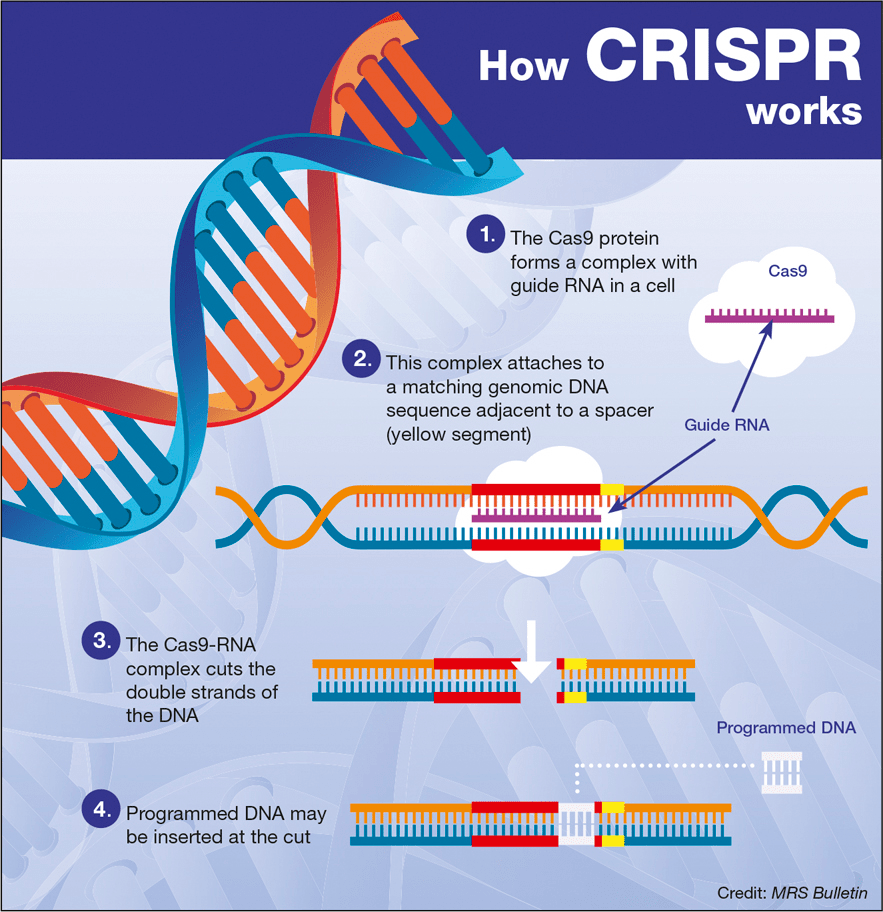
Рисунок 1. Схема работы CRISPR/Cas9.
Это позволяет не просто добавлять новую ДНК-последовательность в ген, а встраивать ее направленно, заменяя конкретный непригодный участок новым. CRISPR/Cas9 может стать мостиком над пропастью наследственных заболеваний. Сейчас известны тысячи генетических патологий, не подвластных лечению . Больным можно оказать только симптоматическую или паллиативную помощь. Вылечить генетический дефект врачам не под силу. А CRISPR как инструмент модификации дает шанс людям с генетическими патологиями. Становится возможным «ремонтировать» мутации, вызвавшие болезни.
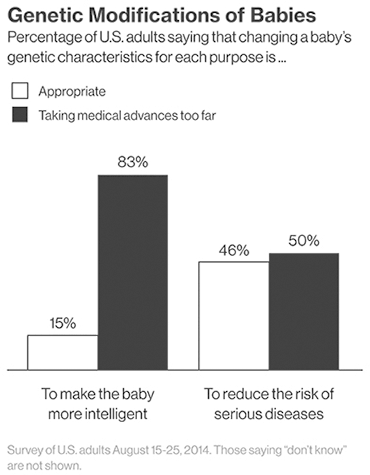
Рисунок 2. Общественное мнение относительно технологии CRISPR/Cas9.
Другой стороной медали может стать использование технологии не по задуманному назначению. Общество страшится появления «дизайнерских» детей, сделанных на заказ родителями. Проведенный опрос среди американцев говорит о том, что люди еще не готовы принять возможности генной терапии. Так, 83% респондентов не хотят использовать технологию для совершенствования детей (рис 2).
Еще один шаг к совершенству
Однако технология генного «ремонтирования» не без изъянов. Она не доведена до совершенства. CRISPR/Cas9 — это не волшебная палочка, призванная исправлять любой генетический дефект. Генетический скальпель не отличается высоким уровнем точности. Эндонуклеаза может совершить разрезы и в нецелевых участках. При этом система CRISPR/Cas9 может не исправлять мутации, как задумывалось, а создавать новые.
Отсутствие стопроцентной точности в работе эндонуклеазы Cas9 делает технологию небезопасной и ненадежной. Пока система не станет более точной, она не получит широкое распространение в практической медицине. Однако маленькие шаги в сторону реальности метода совершаются. Работа ученых из Массачусетского технологического института выводит технологию CRISPR на новый уровень посредством создания улучшенной версии фермента — eSpCas9.
eSpCas9 имеет повышенную специфичность, что снижает вероятность побочных эффектов при редактировании генома. Разрезы этого фермента более точные. Это позволило снизить риск вероятных ошибок примерно в 10 раз. Несомненно, такое открытие — настоящий прорыв для генного редактирования. Оно стало более специфичным и точным, а значит, стало ближе к практической медицине, чем когда-либо [3].
Первый блин комом
В апреле 2015 года мир должен был ахнуть от удивления: впервые ученым удалось не просто прочитать, а еще и отредактировать геном человека (рис. 3). Удивительно, но это событие не привлекло к себе много внимания. Такие авторитетные издания, как Nature и Science, не пожелали публиковать данные об исследовании ввиду его неэтичности. Связано это с тем, что впервые методику генного редактирования CRISPR/Cas9 проверили на человеческих эмбрионах [4].
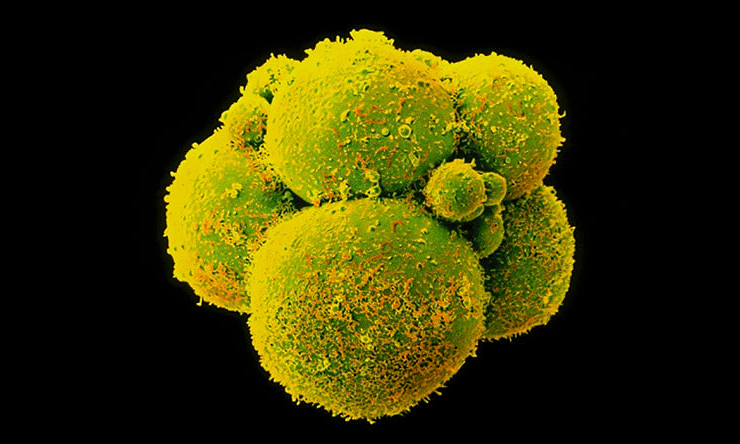
Рисунок 3. Человеческие эмбрионы с отредактированным геномом.
Китайские ученые из университета Гуанчжоу использовали нежизнеспособные эмбрионы. Их получили посредством ЭКО. На этапе их образования произошел сбой, который привел к формированию трипронуклеарных эмбрионов, которые содержат не два пронуклеуса — материнский и отцовский, — а три. Такие зародыши обычно погибают еще до имплантации и нежизнеспособны: они содержат аномальный тройной набор хромосом (69 шт.), тогда как в норме кариотип составляют 46 [5]. Лишние 23 хромосомы не дают плоду развиваться нормально, что приводит к его гибели [6].
Перед учеными не стояла задача продлить время жизни трипронуклеарных эмбрионов. Их целью было осуществить генный нокаут бета-талассемии, которой страдали эмбрионы. Задумку не вполне удалось реализовать. Из 86-и лишь полсотни эмбрионов удалось протестировать. Генная модификация произошла в 28 зародышах, но почти во всех случаях — не такая, как надо, или в неправильном месте. Дефектный ген бета-талассемии был успешно удален из клеток лишь четырех эмбрионов.
Эксперимент не только не принес ожидаемого эффекта, но и создал новые непредвиденные мутации в геноме множества клеток. По словам лидера научной группы, использованная технология пока слишком «сырая». Она не может быть использована на нормальных эмбрионах. Чтобы приступить к ее клиническому использованию, процент успеха должен приближаться к 100.
Модификация людей одобрена законом
Официальное разрешение от вневедомственного органа Министерства здравоохранения Соединенного Королевства — HFEA (Human fertilisation and embryology authority) — на редактирование человеческих эмбрионов с помощью технологии CRISPR/Cas9 в 2016 году получила исследовательская группа из Института Фрэнсиса Крика в Великобритании под руководством биолога Кэти Ниакан. В качестве объекта исследования будут использоваться лишние эмбрионы, которые получают при ЭКО, — те, что оказались не нужны семьям ввиду свершившегося успешного подсаживания других зародышей. Раньше такой материал просто утилизировали за ненадобностью.
Это первое разрешение на подобную деятельность в Великобритании, и ученых не ждет полная свобода действий. Эмбрионы могут быть использованы лишь для определенных целей, которые будут оценены экспертной комиссией (рис. 4). Применять можно семидневные эмбрионы. Срок жизни объектов исследования после начала эксперимента — 14 дней. После этого они должны быть утилизированы. Подсаживание их к суррогатной матери исключено. Пролонгировать беременность генномодифицированными эмбрионами запрещено [7].
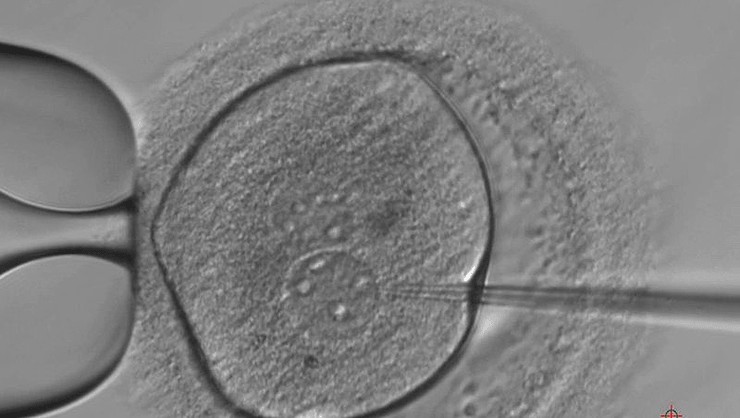
Рисунок 4. Человеческому эмбриону вводят отредактированную ДНК в лондонской лаборатории Института Фрэнсиса Крика.
Успех CRISPR/Cas9
Первые полосы научных журналов в августе 2017 года вновь украшала аббревиатура CRISPR/Cas9. На этот раз новостями об успешном эксперименте спешили поделиться ученые из Орегонского университета здоровья и науки (OHSU). Группа ученых во главе с уроженцем Казахстана Шухратом Миталиповым применили технологии редактирования генов CRISPR/Cas9, чтобы изменить ДНК больных человеческих эмбрионов [8].
Среди безумного моря наследственных патологий выбор объекта исследования пал на гипертрофическую кардиомиопатию. Это серьезное генетическое заболевание сердца с аутосомно-доминантным типом наследования. Это значит, что патология проявится при наличии хотя бы одной дефектной копии гена. При этом данный ген не сцеплен с половой хромосомой, поэтому встречается как у мужчин, так и у женщин.
Каждый год гипертрофическая кардиомиопатия уносит жизни 50% больных ей. Мутации в гене MYBPC3, отвечающем за сокращение кардиомиоцитов (клеток сердца), приводят к хаотичному расположению мышечных волокон и их утолщению. Возникает нарушение ритма, сердечная недостаточность и как следствие — смерть.
Особенно часто заболевание поражает молодых спортсменов [9]. Технология CRISPR/Cas9 позволила группе ученых отредактировать дефектный ген. В исследовании использовали 12 здоровых яйцеклеток и сперму, несущую мутантный ген MYBPC3. С помощью CRISPR/Cas9 из ДНК сперматозоидов удалось вырезать дефект, словно ножницами (рис. 5) [10].
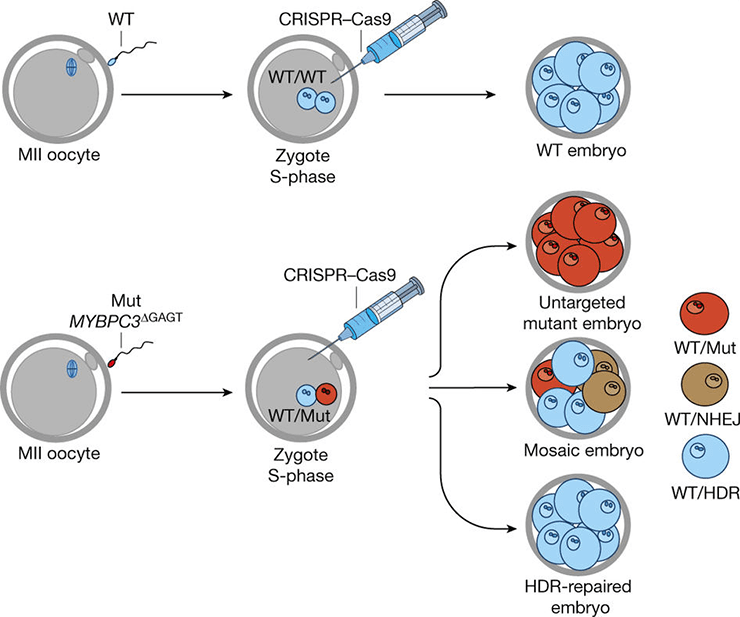
Рисунок 5. Схема воздействия CRISPR/Cas9 на ген MYBPC3.
В результате получили 42 здоровых эмбриона из 58-и. Это составило 72,4% потомства без патологии. Такие результаты оказались довольно успешными по сравнению с полученными ранее при других исследованиях с CRISPR/Cas9 на эмбрионах с генетическими заболеваниями. Улучшение показателей, их приближение к ста процентам, дает надежду на лечение наследственных болезней в ближайшем будущем.
«Мы продемонстрировали возможность исправлять мутации в человеческом эмбрионе безопасным способом и с заметной степенью эффективности», — говорит один из руководителей проекта, Хуан Карлос Бельмонте.
Что может предложить миру CRISPR/Cas9
Каждое крупное открытие в истории человечества встречало сопротивление. С этим столкнулись и Галилео Галилей, и Джордано Бруно, и Парацельс, и Игнац Земмельвейс, осмеянный за свое предложение мыть врачам руки перед осмотром больных. Мир с трудом принимает новые открытия. Сотни известных имен стали признанными лишь после смерти и были гонимы за свои убеждения при жизни.
Инквизиция и научное невежество остались далеко позади. Сегодня медицина развивается очень быстро — в сравнении с минувшими столетиями она движется семимильными шагами. Несомненно, CRISPR/Cas9 станет одним из важнейших биотехнологических открытий XXI века. Что же может предложить миру эта технология?
- Лечение наследственных заболеваний. Реальным на данный момент представляется избавить мир от моногенных патологий — болезней, вызванных мутацией в одном гене. В техническом плане это осуществить проще, чем редактировать дефект нескольких генов (рис. 6) [11], [12].
- Борьба с ретровирусными инфекциями, в том числе с ВИЧ [13].
- Лечение рака может стать возможным при определении роли генов, отвечающих за перерождение нормальных клеток в атипичные. Если ученые откроют мутацию, которая запускает процесс злокачественной пролиферации, то появится возможность исправить дефект с помощью генетического редактирования [14].
- Исследования, которые помогут пополнить библиотеку знаний о развитии человека. В частности, технология CRISPR будет полезна для выяснения процессов формирования здорового эмбриона (рис. 7). В перспективе это поможет предотвращать выкидыши и сделать процедуру ЭКО более эффективной. В настоящее время из 100 оплодотворенных яйцеклеток лишь половина способна достигнуть стадии бластоцисты, из них только 25 имеют шанс на имплантацию в материнской утробе и лишь 13 могут развиваться в течение минимум трех месяцев. Комментирует Кэти Ниакан, руководитель проекта в Великобритании: «Именно поэтому эти исследования так важны. Выкидыши и бесплодие имеют чрезвычайное распространение, а мы до сих пор не владеем полной картиной того, как устроены все механизмы» [15].
- Ксенотрансплантация — пересадка органов от животных к людям — станет возможной благодаря системе CRISPR/Cas9. Многообразие травм и заболеваний нередко требует трансплантации. Не всегда пациент может получить требуемый орган. Использование органов животных могло бы спасти многие жизни (рис. 8). Свиньи имеют приближенные по характеристикам к человеческим органы, однако их геном содержит особые эндогенные ретровирусы — PERV, которые могут привести к опасным для пациента последствиям при пересадке. Инактивация этих вирусов открывает дверь к безопасному источнику органов и тканей для трансплантации больным людям органов от животных [16].
- ГМ-животные и пища, которые с помощью генной модификации могут получить полезные свойства и потерять неблагоприятные (рис. 9) [17].
- Создание «дизайнерских детей» у многих ассоциируется с технологией CRISPR/Cas9. Хотя такие исследования не проводили и ни один из ученых не ставил перед собой такую цель, именно возможность создания ГМ-детей по своему вкусу вызывает наибольшие опасения у общественности (рис. 10). Однако биологи считают, что на данном этапе освоения технологии это неподвластно человеку. Цитата профессора Хуана Карлоса Бельмонте: «Никто из нас пока не думает об этом [имеется в виду редактирование геномов людей — прим. ред.], потому что на данный момент это невозможно реализовать на практике. Пока исследования CRISPR/Cas9 относятся к области фундаментальной науки. Я уже не говорю о том, что мы рассуждаем о системах, которые природа создавала миллионы лет».
Рисунок 6. Руками врача буквально лечится геном.
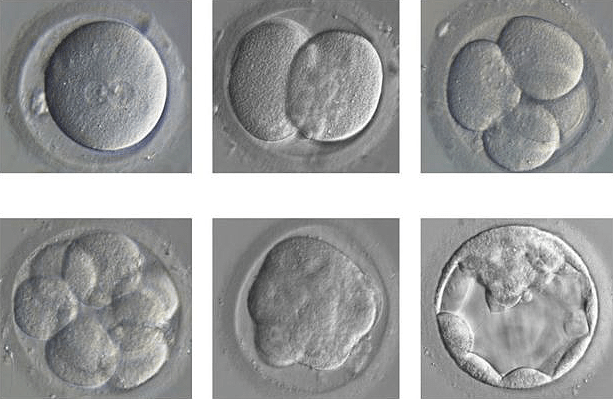
Рисунок 7. Развитие эмбриона из одного оплодотворенного яйца до бластоцисты.
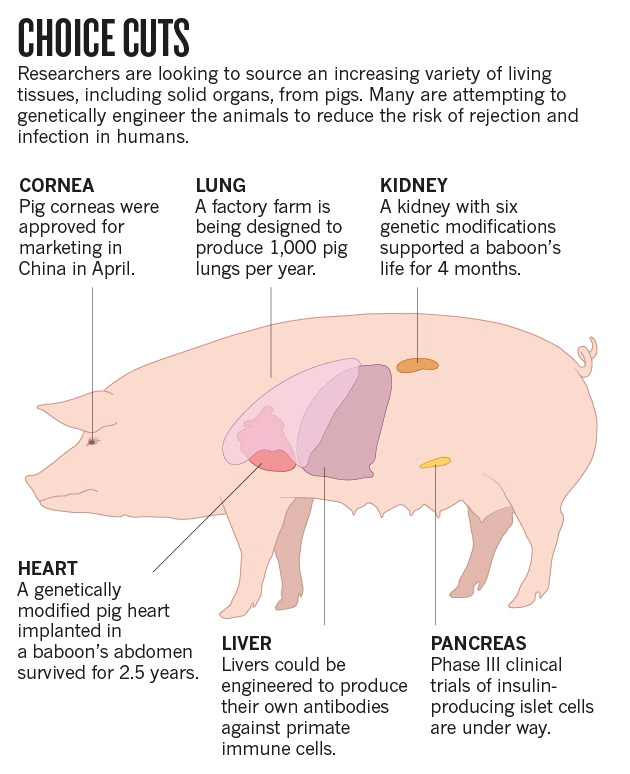
Рисунок 8. Схема возможного использования органов свиней.

Рисунок 9. ГМ-пища.
Рисунок 10. Схематичное изображение «дизайнерского» ребенка.
Тем не менее случайные мутации, которые ненароком могут появиться при редактировании генома, потенциально могут быть еще опаснее, чем имеющиеся (рис. 11).

Рисунок 11. Схематичное изображение гена с опасной мутацией.
Этично ли редактировать людей?
CRISPR/Cas9 предстоит преодолеть не только технические трудности, которые требуют приближенного к ста процентам результата для внедрения в практическую медицину, но и этические (рис. 12). Насколько нравственно редактировать геном человека, данный ему при рождении? Можем ли мы вмешиваться в работу природы и модифицировать ее по своему усмотрению?

Рисунок 12. Обложка книги профессора Калифорнийского университета Пола Кнопфлера — GMO sapiens.
Международный мораторий на опыты над людьми говорит сам за себя. А проведенные на данный момент исследования имели четкие рамки, закрепленные законодательно. Вынашивание и рождение «редактированного ребенка» в таких условиях невозможно.
В противовес широким возможностям CRISPR/Cas9 выступают и ее непредсказуемые долговременные последствия. Ввиду этого директор национальной разведки США Джеймс Клэппер объявил, что технологию CRISPR теперь можно рассматривать как угрозу национальной безопасности: «Редактирование генома — это оружие массового уничтожения. Его легко использовать и трудно контролировать» [18].
По мнению биоэтика из Университета Висконсина в Мэдисоне Альты Чаро, «дизайнерские дети» — сомнительная перспектива для CRISPR/Cas9. Исследовав положение дел с технологией генной модификации, она сделала заявление: «Озабоченность по поводу проведенных экспериментов раздута. Это увлекательный, важный и достаточно внушительный шаг к изучению правильного редактирования эмбрионов. Независимо от беспокойных предположений, это не начало эпохи „дизайнерских детей“. Наследование таких признаков, как интеллект или атлетизм, определено множеством генов. Разгадать каждый из них и спроектировать ребенка не представляется возможным» [19].
Что же принесет миру технология генного редактирования CRISPR/Cas9 — пользу или вред? Однозначного ответа на этот вопрос не даст никто. Хотя практической пользы от технологии пока получено не было, то будущее, которое рисует CRISPR/Cas9 в рамках биомедицины, рано или поздно наступит. И нам откроется возможность узреть и понять этот новый и смелый отредактированный мир (рис. 13).

Рисунок 13. Безграничные возможности CRISPR/Cas9.
- CRISPR-системы: иммунизация прокариот;
- Просто о сложном: CRISPR/Cas;
- I. M. Slaymaker, L. Gao, B. Zetsche, D. A. Scott, W. X. Yan, F. Zhang. (2016). Rationally engineered Cas9 nucleases with improved specificity. Science. 351, 84-88;
- Puping Liang, Yanwen Xu, Xiya Zhang, Chenhui Ding, Rui Huang, et. al.. (2015). CRISPR/Cas9-mediated gene editing in human tripronuclear zygotes. Protein Cell. 6, 363-372;
- Миньженкова М.Е. Метафазная сравнительная геномная гибридизация в диагностике хромосомного дисбаланса: дис…..канд. мед. наук. — Москва, 2014. — 131 с.;
- Байкошкарова С.Б., Сабырбек Ж.Б., Садыбекова Л.С., Махамбетова А.М., Уморбекова Г.А., Курманалиев С.К. (2016). Морфологические характеристики раннего эмбриогенеза триплоидных эмбрионов человека. Сайт Казахского национального университета;
- Gallagher J. (2016). Kathy Niakan: Scientist makes case to edit embryos. BBC News;
- Connor S. (2017). First human embryos edited in U.S. MIT Technology Review;
- Джанашия П.Х., Круглов В.А., Назаренко В.А., Николенко С.А. Кардиомиопатии и миокардиты. М.: Российский государственный медицинский университет, 2000. — 128 с;
- Hong Ma, Nuria Marti-Gutierrez, Sang-Wook Park, Jun Wu, Yeonmi Lee, et. al.. (2017). Correction of a pathogenic gene mutation in human embryos. Nature. 548, 413-419;
- Lu Xiao-Jie, Xue Hui-Ying, Ke Zun-Ping, Chen Jin-Lian, Ji Li-Juan. (2015). CRISPR-Cas9: a new and promising player in gene therapy. J Med Genet. 52, 289-296;
- Смирнихина С.А. и Лавров А.В. (2016). Генная терапия наследственных заболеваний с использованием технологии CRISPR/Cas9 in vivo. Медицинская генетика. 9, 3–11;
- CRISPR/Cas9 как помощник в борьбе с ВИЧ;
- Cyranoski D. (2016). CRISPR gene-editing tested in a person for the first time. Nature News;
- Devlin H. (2017). DNA editing in human embryos reveals role of fertility ‘master gene’. The Guardian: Genetics;
- Dong Niu, Hong-Jiang Wei, Lin Lin, Haydy George, Tao Wang, et. al.. (2017). Inactivation of porcine endogenous retrovirus in pigs using CRISPR-Cas9. Science. 357, 1303-1307;
- Еще раз про ГМО;
- . (2016). Gene intelligence. Nature. 531, 140-140;
- Cha A.E. (2017). First human embryo editing experiment in U.S. ‘corrects’ gene for heart condition. The Washington Post.
biomolecula.ru
Человек будущего-генетически модифицированный человек? : sofyapremudraya — LiveJournal
В будущем богатые люди смогут вносить изменения в макромолекулы, отвечающие за реализацию генетической программы, отмечал ученый в своей последней книге, которая будет опубликована 16 октября.
Английский физик-теоретик Стивен Хокинг, который умер семь месяцев назад в возрасте 76 лет, предсказывал появление в будущем суперлюдей с измененными ДНК, которые могут стать реальной угрозой человечеству. Как пишет в воскресенье газета The Sunday Times, такое опасение Хокинга содержится в его последней книге, которая будет опубликована 16 октября.
В своем труде под названием «Короткие ответы на серьезные вопросы» физик предположил, что богатые люди смогут в довольно близкой перспективе вносить изменения в макромолекулы, отвечающие за реализацию генетической программы. Модифицируя свою ДНК и своих детей, они, писал Хокинг, смогли бы улучшить свою память, сопротивляемость болезням, продолжительность жизни и повысить уровень интеллекта.
«Уверен, что в течение этого века люди откроют для себя возможность модифицировать как свои интеллектуальные способности, так и инстинкты, например, агрессию, — пишет ученый в книге, выдержки из которой приводит издание. — Возможно, против генной инженерии на людях будут приняты законы, однако некоторые не смогут побороть искушение улучшить человеческие характеристики, такие как память, сопротивляемость болезням, продолжительность жизни».
Подобное развитие ситуации, опасался ученый, несет в себе риски тем людям, которые не пройдут улучшение на генетическом уровне. «Появление суперлюдей сразу приведет к появлению серьезных политических проблем с неулучшенными людьми, которые не будут в состоянии с ними конкурировать. По-видимому, они вымрут или станут малозначимыми. Вместо этого мы получим расу людей, которые сами себя проектируют, все больше и больше улучшаясь», — предположил физик-теоретик.
Генетически модифицированные люди будут иметь IQ от 1000 и выше
Генетически модифицированные люди могут иметь IQ на уровне 1000 и выше. По крайней мере, согласно научной теории профессора Стивена Хсу.
Хсу можно считать глубоким эрудитом. Его работы касаются квантовой физики, темной энергии, финансов, информационной безопасности, геномики и биоинформатики. Он официально является вице-президентом по научным исследованиям Университета штата Мичиган, где возглавляет кафедру теоретической физики.
Профессор Хсу считает, что изменив геном человека, можно резко повысить его интеллектуальные способности. Подробное описание теории приводится в журнале ArXiv e-prints. Ее популярное изложение дает Nautilus.
Возможность появления сверхразума является прямым результатом генетической основы интеллекта. Такие характеристиками как рост и познавательные способности контролируют тысячи генов, и каждый их них оказывает свое небольшое воздействие, — пишет Хсу.
Опираясь на предыдущие исследования генома, Хсу считает, что с интеллектом связано около 10 000 генетических вариантов. Если путем настройки каждого из них нам удастся получить нужную версию, то, по его словам, мы сможем создать человеческих существ с показателем умственного развития в 100 раз выше среднего. Это соответствует IQ в более чем 1000 баллов.
Хсу является научным консультантом BGI (бывший Пекинский институт геномики), а также одним из основателей его Лаборатории когнитивной геномики. По слухам, которые появились в прошлом году, BGI секвенирует геномы 2000 самых умных людей планеты с целью вывода сверхразумного поколения, которое сможет поднять IQ нации.
Хсу и BGI не единственные, кто прогнозирует появление сверхразума посредством генетических улучшений. В своей недавно опубликованной книге «Superintelligence» директор созданного в Оксфорде Института будущего человечества Ник Бостром соглашается с тем, что генетика является ключом к появлению сверхразумных людей. Генетический скрининг эмбрионов перед имплантацией мог бы помочь родителям найти и выбрать эмбрионы с аллелями, определяющими высокий уровень интеллекта. Бостром надеется, что дальнейшее развитие генной инженерии сделает возможным синтез геномов в спецификацию, что сильно упростит поставленную задачу.
По словам Бострома, в будущем технология позволит наделять эмбрион предпочтительной комбинацией генов, передаваемых от каждого из родителей, и генов, им не присущих, которыми обладает лишь небольшое количество людей в мире. Такой микс сможет оказать серьезный положительный эффект на познавательные способности детей.
Хсу считает, что таким способом можно развить способности выше, чем у любого из 100 миллиардов человек, когда-либо живших на Земле:
Представьте себе, что способности самых великих умов человечества в своем максимальном виде будут присутствовать у одного индивидуума. Это практически идеальное воспроизведение изображений и речи, сверхбыстрое мышление и расчеты, сильная геометрическая визуализация, даже в более высоких измерениях; способность параллельно и одновременно решать множество аналитических и мыслительных задач. Этот список можно продолжить.
Перспектива того, что на одной планете с обычными людьми будут жить «сверхчеловеки», чье величие так воспевал философ Фридрих Ницше в своем произведении «Так говорил Заратустра», пугает. Пристального внимания заслуживают соответствующие нравственные вопросы, которые придется решить до того, как такие возможности станут реальностью.
Некоторые страны могут узаконить генную модификацию детей раньше других. Очевидно, что первой доступ к технологии получит элита, которая сможет наделить сверхразумом себя и своих детей. Но будем надеяться, что плодами генной инженерии сможет воспользоваться каждый желающий, иначе нас ждет такое неравенство, которого еще никогда не было в истории человечества.
Какой он, «человек будущего» — генно-модифицированный человек?
Национальная академия наук США заявила, что в ближайшее время приступит к работам по изменению генома человека.
Чем грозит такой научный прорыв?
Наука уже не просто идет семимильными шагами, она передвигается со скоростью времени. Кто бы из нас мог предположить хотя бы 10 лет назад, что скоро появится возможность побороть любую болезнь путем изменения генома человека. Такое можно было увидеть только в фантастических фильмах! — СЕГОДНЯ ЭТО УЖЕ РЕАЛЬНОСТЬ!!!
Многие годы ученые разных стран бились над геномом человека. И вот, 21 мая 2010 года Крейг Вентер, американский ученый, гентик заявил о создании им искусственной клетки. Это был прорыв в генной инженерии. И спустя всего 7 лет, ученые утверждают, что готовы к созданию генетически модифицированного человека.
По утверждению ученых, таким образом они смогут побороть любую болезнь.
В США данные работы стали возможны применительно к людям, больных ВИЧ, онкологическими заболеваниями и болезнью Альцгеймера.
По сообщению Национальной академии наук США, речь о работах по созданию людей с исключительными возможностями, не идет.
Но эксперименты на людях и животных уже идут полным ходом во всем мире:
В Китае, создали генетически модифицированных свиней, внедрив им 3 гена человека. И теперь свиное сердце или легкое можно без опаски отторжения пересаживать человеку
В США и Тайланде уже широко используются генные вакцины – они предотвращают сердечно-сосудистые заболевания и глаукому.
Многие крупные фармацевтические компании начали закрывать проекты по исследованию химических препаратов, перенаправляя средства в генную инженерию.
Какие гены можно внедрить в человека, чтобы сделать его совершенным?
По заявлению ученых, человеческий организм на столько не совершенен, что с помощью генной инженерии человеку могут открыться новые горизонты:
- Ген пятнистой акулы. Иммунитет против всех существующих у человека болезней, в том числе и рака
- Ген сокола-сапсана. Острота зрения человека может увеличится в 15 раз!
- Ген кошки. Расширит диапазон слуха человека в 6 раз (с 10 до 60 Гц)
- Ген бабочки семейства Saturniidae (павлиноглазка), сообщает newsli.ru. Увеличит обоняние человека в 50 раз
- Ген кролика. У человека никогда не будут болеть зубы, и они будут расти всю жизнь
- Ген аквариумной рыбки Danio rerio. У человека будут регенерироваться внутренние органы и ткани
- Ген свиньи. Человек сможет испытывать оргазм в течении 30 мин
- Ген черепахи. Человек сможет побороть старость
Но, как всегда это «палка о двух концах». Ведь этим можно воспользоваться не только для лечения, но и для управления людьми, вживляя им с рождения гены безвольных и слабохарактерных… Склонных к насилию и убийствам… Не ощущающих боли и страха… — УНИВЕРСАЛЬНЫХ СОЛДАТ!
Как будет называться данная особь млекопитающего? – человек ли?
Тем временем:Первый в мире генно-модифицированный человек — Элизабет Пэрриш
Идея вечной молодости или хотя бы более долгой и здоровой жизни волновала человечество на всех этапах развития цивилизации. Ученых всегда интересовала возможность увеличения продолжительности жизни человека, и вот, когда достижения в области правильного питания и активного образа жизни были исчерпаны, они обратили свой взор в сторону генных изменений.
Когда мы видим сюжеты о том, что генетики проводят эксперименты на лабораторных животных, изменяют геном, например, с целью замедлить старение клеток, нам кажется, что все это из области фантастики и отдаленного будущего. Но, оказывается, что фантастика стала реальностью. На Земле уже живет человек с искусственно измененными генами.
Это американка Элизабет Пэрриш, которая согласилась на вмешательство генетиков ради того, чтобы остановить старение своего организма, ну и, разумеется, чтобы принести пользу миру.
На самом деле она еще и является одним из руководителей научно-медицинской компании BioViva, которая и проводит этот смелый эксперимент.
Чтобы понять суть искусственных изменений, необходимо немного осветить проблему старения с точки зрения генетики. Сам процесс старения заложен в нашей ДНК, а начинается он с процесса уменьшения концевых отростков хромосом, так называемых теломер.
Чем старше биологический возраст человека, тем короче его теломеры. В процессе роста клеток происходит деление ДНК, что сопровождается укорачиванием теломер и в конечном итоге приводит к старению и гибели клетки.
В конце 2015 года Элизабет Пэрриш ввели генетический материал, который, проникнув внутрь ядра каждой клетки ее организма, должен был запустить изменения, и способствовать увеличению длины теломер. Таким образом, по предположению ученых, будет остановлен процесс старения и произойдет общее омоложение организма.
Принимая во внимание то, что результаты такого эксперимента могут быть самыми непредсказуемыми, вплоть до летального исхода, Элизабет даже записала обращение, в котором подтверждала свое согласие на инъекцию и озвучила понимание серьезности генетического вмешательства. Для введения генетического материала ей даже пришлось ехать в Колумбию, так как на территории Соединенных Штатов подобные опыты с людьми запрещены законодательно.
И вот ученые уже обнародовали первые результаты эксперимента. Пока все выглядит более чем оптимистично: биологический возраст женщины уменьшился примерно на 20 лет. Это выражается в состоянии лейкоцитов ее крови, а также в теломерах хромосом, которые удлинились, вместо того, чтобы дальше разрушаться.
Во внешности 45 летней женщины также произошли некоторые изменения. Ее кожа стала более упругой и улучшилось состояние волос.
Видео:ГМО мутанты биороботы уже реальность. Люди ИКС не фантастика. Чудеса генетики и генной инженерии
► ►
►
sofyapremudraya.livejournal.com
Редактирование генов человека: начало – Зожник
С помощью CRISPR прямо сейчас происходит грандиозный прорыв в генной инженерии: ученые планируют скоро научиться избавлять нас навсегда от любых болезней, с перспективой любых контролируемых мутаций и вечной жизни.
На публикацию этого поста нас натолкнуло видео “CRISPR: редактирование генов изменит все и навсегда”, в котором рассказывается о переднем крае науки в части генной модификации человека: речь идет не просто об избавлении от болезней типа СПИД, рак и многие другие, но и о создании безупречного нового вида людей, людей со сверхспособностями и бессмертии. И это происходит прямо сейчас на наших глазах.
Все эти перспективы открываются благодаря недавнему революционному открытию белка CRISPR–Cas9, но обо всем по порядку.
Раньше считалось, что ДНК в каждой нашей клетке – абсолютно идентичны и содержат нашу точную и неизменную копию – какую клетку бы ни взять, но оказалось, что это не так: ДНК в разных клетках немного разные и они меняются в зависимости от разных обстоятельств.
Открытию белка CRISPR – Cas9 помогли наблюдения за выжившими после атаки вирусов бактериями.
Древнейшая война на земле
Бактерии и вирусы соперничают с начала жизни: вирусы-бактериофаги охотятся на бактерии. В океане они убивают 40% от общего числа бактерий каждый день. Вирус делает это, вставляя свой генетический код в бактерию и использует её в качестве фабрики.
Бактерии пытаются безуспешно сопротивляться, но в большинстве случаев их защитные механизмы оказываются слишком слабыми. Но иногда бактерии выживают. Тогда они могут активировать свою самую эффективную противовирусную систему. Они сохраняют часть ДНК вируса в своём генетическом коде, ДНК-архиве “CRISPR”. Здесь она хранится до необходимого момента.
Когда вирус снова атакует, бактерия создает РНК-копию из ДНК архива и
заряжает секретное оружие – белок Cas9. Этот протеин сканирует бактерию на предмет вмешательства вируса, сравнивая каждую часть найденного ДНК с архивом. Когда находится 100% соответствие, он активируется и отрезает ДНК вируса, делая его бесполезным, таким образом защищая бактерию.
Белок Cas9 сканирует ДНК клетки на предмет внедрения вируса и заменяет испорченную часть здоровым фрагментом.
Что характерно, Cas9 очень точен, словно ДНК хирург. Переворот произошел, когда ученые поняли, что система CRISPR программируема – можно просто дать копию ДНК, которую нужно изменить, и поместить систему в живую клетку.
Помимо точности, дешевизны и простоты использования, CRISPR позволяет включать и выключать гены живых клеток и изучать конкретные последовательности ДНК.
Этот метод также работает с любыми клетками, микроорганизмами, растениями, животными или людьми.
Ученые выяснили, что Cas9 можно программировать на любые замены в любой части ДНК – и это открывает практически безграничные возможности для человечества.
Болезням конец?
В 2015-м ученые использовали CRISPR для удаления вируса ВИЧ из клеток пациентов,
и доказали, что это возможно. Годом позже они провели более амбициозный эксперимент с крысами с вирусом ВИЧ в практически всех их клетках.
Учёные просто ввели CRISPR в их хвосты, и смогли удалить более 50% вируса из клеток по всему телу. Возможно, через несколько десятилетий CRISPR поможет избавиться от ВИЧ и других ретровирусов – вирусов, которые прячутся внутри человеческой ДНК, вроде герпеса. Возможно CRISPR сможет победить нашего худшего врага, рак.
Рак является результатом появления клеток, отказывающихся умирать и продолжающих делиться, попутно прячась от иммунной системы. CRISPR дает нам средство редактировать наши иммунные клетки и делать их лучшими охотниками на раковые клетки.
Возможно через некоторое время лечение от рака будет всего лишь парой уколов с несколькими тысячами ваших собственных клеток, созданных в лаборатории, чтобы вылечить вас навсегда.
Возможно через некоторое время вопрос лечения рака – вопрос пары уколов модифицированных клеток.
Первое клиническое испытание такой терапии на пациентах-людях было одобрено в начале 2016-го в США. Менее чем через месяц китайские ученые объявили, что будут лечить пациентов с раком легких иммунными клетками, модифицированными по этой же технологии, в августе 2016. Дело быстро набирает обороты.
А еще есть генетические заболевания, тысячи их. Они разнятся от слегка раздражающих до крайне смертельных или приносящих годы страданий. С мощными инструментами вроде CRISPR однажды мы сможем покончить с этим.
Более 3000 генетических заболеваний вызываются единственной заменой в ДНК.
Мы уже создаем модифицированную версию Cas9, которая исправляет такие ошибки и избавляет клетку от заболевания. Через пару десятилетий мы может быть сможем навсегда уничтожить тысячи заболеваний. Однако у всех эти медицинских применений один недостаток – они ограничены одним пациентом и умрут вместе с ним, если мы не используем их на репродуктивных клетках или на ранней стадии развития плода.
CRISPR вероятно будет использоваться куда шире. Например для создания модифицированного человека, спроектированного ребенка. Это принесет плавные но необратимые изменения в человеческом генофонде.
Спроектированные дети
Средства изменения ДНК человеческого плода уже существуют,
но технология находится на раннем этапе развития. Однако, ее применяли уже дважды. В 2015-м и 2016-м эксперименты китайских ученых с человеческими эмбрионами достигли частичного успеха на второй попытке.
Они выявили гигантские трудности в редактировании генов эмбрионов, но множество ученых уже работают над решением этих проблем. Это то же самое, что и компьютеры 70-х: в будущем они станут лучше.
Вне зависимости от ваших взглядов на генную инженерию, она коснётся всех. Модифицированные люди могут изменить геном всего нашего вида, потому что их привитые качества будут переданы их детям, и через поколения медленно распространятся, медленно меняя генофонд человечества. Это начнется постепенно.
Первые спроектированные дети не будут сильно отличаться от нас. Скорее всего, их гены будут изменены для избавления от смертельных наследственных заболеваний.
По мере развития технологий все больше людей начнут думать, что неиспользование генетической модификации неэтично, потому что это обрекает детей
на страдание и смерть, которые можно предотвратить.
Как только первый такой ребенок родится, откроется дверь, которую уже не удастся закрыть. Сначала некоторые черты никто не будет трогать, но по мере роста одобрения технологии и наших знаний о генетическом коде, будет расти будет и соблазн.
Если вы сделаете свое потомство иммунным к болезни Альцгеймера, почему бы вдобавок не дать им улучшенный метаболизм? Почему бы до кучи не наградить их отличным зрением? Как насчет роста или мускул? Пышных волос? Как насчет дара исключительного интеллекта для вашего ребенка?
Огромные перемены придут как результат накопления личных решений миллионов людей.
Это скользкий склон, и модифицированные люди могут стать новой нормой. Пока генная инженерия становится все более привычной, а наши знания улучшаются, мы можем подойти к искоренению главной причины смертности – старения.
2/3 из примерно 150 000 человек, умерших сегодня, умерли по причинам, связанным со старением.
Сегодня считается, что старение вызывается накоплением повреждений в наших клетках
вроде разрывов ДНК или износа систем, ответственных за исправление этих повреждений.
Но есть также и гены, которые напрямую влияют на наше старение.
Генная инженерия и прочая терапия могли бы остановить или замедлить старение. Возможно даже обратить его вспять.
Типичная реакция на возможность вечной жизни (как и любой другой привычной сейчас, но революционной несколько сотен лет назад технологии).
Вечная жизнь и “люди икс”
Мы знаем, что в природе есть животные, которые не стареют. Может, мы могли бы занять у них пару генов. Некоторые ученые считают что однажды старение будет искоренено. Мы все равно будем умирать, но только не в больнице в 90 лет, а через пару тысяч лет, прожитых в окружении наших любимых.
Вызов огромен и, возможно, цель недостижима, но можно допустить, что люди, живущие сегодня, могут оказаться первыми, кто вкусит плоды анти-возрастной терапии. Возможно, нужно всего лишь убедить смышленого миллиардера в необходимости помочь решить эту большую проблему.
Если смотреть на это шире, мы могли бы решить множество задач с помощью специально измененных людей, например которые могли бы лучше справляться с высококалорийной едой, и избавиться от таких недугов цивилизации как ожирение.
Владея модифицированной иммунной системой с перечнем потенциальных угроз,
мы могли бы стать неуязвимыми для большинства заболеваний, преследующих нас сегодня. Ещё позже мы смогли бы создать людей для длительных космических перелетов и для адаптации к различным условиям на других планетах, что было бы крайне полезно для поддержания нашей жизни во враждебной вселенной.
Несколько щепоток соли
Есть несколько главных препятствий, технологических и этических. Многие почувствуют страх перед миром, где мы отсеиваем несовершенных людей, а потомство выбираем на основе того, что считается здоровым.
Но мы уже живем в таком мире. Тесты на десятки генетических заболеваний или осложнений стали нормой для беременных женщин во многих странах. Часто одно подозрение на генетический дефект может привести к прерыванию беременности.
Возьмем для примера синдром Дауна, один из самых распространенных генетических дефектов: в Европе около 90% беременностей с установленным наличием этого отклонения прерываются.
Генетический отбор в действии: уже сейчас синдром Дауна диагностируется на ранней стадии развития эмбриона и 90% беременности с этим диагнозом прерывается.
Решение о прерывании беременности является очень личным, но важно понимать, что мы уже сегодня отбираем людей, основываясь на состоянии здоровья. Нет смысла притворяться, что это изменится, поэтому нам необходимо действовать осторожно и этично, несмотря на растущую свободу выбора благодаря дальнейшему развитию технологий.
Однако, все это перспективы отдаленного будущего. Несмотря на мощность CRISPR, метод не лишен недостатков. Могут случиться ошибки при редактировании, неизвестные ошибки могут произойти в любой части ДНК и остаться незамеченными.
Изменение гена может достичь нужного результата и вылечить от заболевания, но вместе с этим спровоцировать нежелательные изменения. Мы попросту недостаточно знаем о сложных взаимосвязях наших генов, чтобы избежать непредсказуемых последствий.
Работа над точностью и методами наблюдения очень важна в предстоящих клинических испытаниях. И раз уж мы обсудили возможное светлое будущее, также стоит упомянуть и более мрачное видение. Представьте, что может страна вроде Северной Кореи сделать с таким уровнем технологий?
Важно, чтобы технология генной модификации не попала в руки тоталитарным режимам, которые гипотетически могут использовать ее во вред человечеству – например, создать армию генетически модифицированных солдат.
Может она навечно продлить свое правление с помощью принудительной инженерии? Что остановит тоталитарный режим от создания армии модифицированных суперсолдат?
Ведь это в теории возможно. Сценарии вроде этого лежат в далеком будущем, если они вообще возможны, но подтверждение работоспособности концепции такой инженерии уже существует. Технология и правда настолько могущественна.
Подобное может стать поводом для запрета инженерии и связанных с ней исследований, но это определенно было бы ошибкой. Запрет на генную инженерию человека только приведёт науку в области с такими правилами и законами, с которыми нам было бы не по себе. Только участвуя в процессе, мы сможем быть уверены, что исследование ведется с осторожностью, разумом, контролем и прозрачностью.
Мы можем исследовать и внедрять в человека любые генные модификации.
Заключение
Чувствуете беспокойство? Почти в каждом из нас есть какое-то несовершенство. Позволили бы нам существовать в подобном новом мире? Технология несколько устрашает, но нам есть что выиграть, да и генная инженерия может быть очередной ступенью в эволюции разумных видов жизни.
Возможно мы покончим с болезнями, увеличим продолжительность жизни на века и отправимся к звездам. Не стоит мелко мыслить, говоря о такой теме. Каким бы ни было ваше мнение о генной инженерии, будущее наступает несмотря ни на что.
То, что раньше было научной фантастикой, вскоре станет нашей новой реальностью.
Реальностью, полной возможностей и препятствий.
Вы можете также посмотреть непосредственно само видео:
Источник: Kurzgesagt
Перевод: Amara.org
Смотрите также на Зожнике:
Карма — новые деньги
9 шагов на пути к вечной жизни. Наука о том, как дожить до бессмертия
Джейн Фонда о революции долголетия
Рэй Курцвейл: «Будьте готовы к гибридному мышлению»
9 самых странных секретов долголетия от тех, кто прожил более 100 лет
Расскажите друзьям:
zozhnik.ru
Комфортная антиутопия: как мир примиряется с генной модификацией людей | Статьи
Двойняшки, которым запрограммировали иммунитет к ВИЧ на генетическом уровне, родились пять месяцев назад. Тогда научное сообщество раскритиковало подобные исследования. Теперь Всемирная организация здравоохранения призывает ученых поделиться опытом. За тем, как из антиутопии генная инженерия превращается в норму, наблюдают «Известия».
В ноябре 2018 Хэ Цзянькуй (He Jiankui), китайский ученый из Южного университета науки и технологий в Шэньчжэне, рассказал о рождении близняшек с измененным геномом. Чтобы защитить детей от ВИЧ, он был отредактирован во время беременности.
Задачей ученого было «отключить» ген CCR5, который связан с формированием белка, позволяющего вирусу попасть в клетку. Хэ работал с парами, в которых ВИЧ-положительными были только мужчины. Они принимали препараты и потому были незаразны. Геном был изменен в 16 эмбрионах, из них 11 были использованы для искусственного оплодотворения. Одна женщина в результате забеременела. Обе копии гена CCR5 удалось изменить лишь у одной из близняшек. У второй отредактирована одна копия, так что она может в будущем заразиться ВИЧ. Позже Хэ заявил, что еще одна женщина ждет ребенка с отредактированным геномом.
Об этой работе ученый рассказал на Втором международном саммите по генетическому редактированию человека в Гонконге. И хотя отдельные коллеги поддержали его исследования, большинство отнеслось к ним негативно.
Фото: Getty Images/Luke Chan
Отредактированные дети
Ведущий конференции в Гонконге нобелевский лауреат Дэвид Балтимор (David Baltimore) назвал эксперимент безответственным. «Отключение» гена CCR5 повышает опасность заражения лихорадкой Западного Нила и другими вирусными заболеваниями, а также увеличивает вероятность смерти от гриппа. «Я не думаю, что в этом была медицинская необходимость. Список заболеваний [к которым в результате эксперимента снизилась сопротивляемость двойняшек], который был озвучен во время дискуссий, вызывает гораздо больше опасений», — заявил Балтимор.
Неприемлемым назвала эксперимент и Дженнифер Дудна (Jennifer Doudna), одна из создательниц технологии редактирования генома CRISPR/Cas9, которую, предположительно, использовал Хе. Коллега Дудны Фэн Чжан также поддержал мораторий на имплантацию отредактированных эмбрионов.
Фото: Getty Images/zorazhuang
Вскоре от исследований Хэ открестился его университет. На сайте появилось объявление о том, что он не ставил руководство в известность о своей работе. И вообще с февраля 2018 года по январь 2021-го находится в неоплачиваемом отпуске. Раздел, посвященный работе с детьми, на сайте лаборатории самого Хэ недоступен. И он не выпустил ни одной статьи об исследовании в рецензируемом научном журнале, хоть и говорил на конференции, что статья передана в одну из редакций. Так что все сведения об успехе эксперимента основаны на выступлении в Гонконге и интервью Associated Press. В университете, как и в больнице, которая якобы одобрила исследования, отметили, что шокированы произошедшим и проводят собственные расследования.
Непонятно и на чьи деньги проводился эксперимент. На саммите Хэ отказался отвечать на этот вопрос. Позже в одном из интервью сказал, что работа финансировалась на частные средства.
Финалом скандала стало заявление правительства Китая о запрете редактирования генома эмбрионов. Подобный запрет до этого был введен во многих странах. Из-за этого Китай и был выбран местом эксперимента Хэ и его бывшим научным руководителем, физиком и биоинженером Майклом Димом (Michael Deem) из Университета Райса в Хьюстоне.
Сюй Нанпин, вице-министр Китая по науке и технологиям
Эксперимент перешел грань морали и этики, которых придерживается академическое сообщество, и оказался шокирующим и неприемлемым.
Ген на милость
За пять месяцев, прошедших с тех пор, отношение к редактированию генома в научном сообществе изменилось. Резкое осуждение превратилось в острожный интерес.
Сторонники китайских опытов были с самого начала, пусть и в меньшинстве. Например, гарвардский генетик Джордж Черч (George Church), обративший внимание на то, что ВИЧ — растущая угроза для человечества. Или заведующий лабораторией эпигенетики развития Института цитологии и генетики СО РАН Сурен Закиян. По его словам, если заявления Хэ правда, «то это колоссальный прорыв для фундаментальной науки».
Тут надо отметить, что вопрос о том, реально ли Хэ достиг успеха, остается открытым. Все личные данные участников эксперимента конфиденциальны.
Больше того, вскоре после скандала выяснилось, что подобными исследованиями занимаются ученые во многих странах. В том числе в России с 2017 года в Национальном медицинском исследовательском центре имени Кулакова.
Фото: Depositphotos
Денис Ребриков, заведующий лабораторией редактирования генома Национального медицинского исследовательского центра имени Кулакова
В рамках нашей исследовательской работы, продолжающейся с начала 2017 года, мы вносим в геном зиготы такую же модификацию, что и Хэ, с той лишь разницей, что мы не подсаживаем полученные эмбрионы пациенткам.
Отказ от выращивания эмбрионов с отредактированным геномом заведующий лабораторией редактирования генома Денис Ребриков объяснил тем, что побочные эффекты не изучены. И этически эта технология оправдана только для планирующих беременность ВИЧ-положительных женщин с плохим ответом на антиретровирусную терапию.
В феврале 2019 года в американском рецензируемом журнале Cell вышла статья о позитивном побочном эффекте редактирования генома. Тесты показали, что удаление у мышей того самого гена CCR5 улучшает их когнитивные (познавательные) функции. Также ученые выяснили, что люди, у которых CCR5 отсутствует из-за естественной мутации, быстрее восстанавливаются после инсульта.
Одна из авторов статьи, Альчино Сильва (Alcino Silva) из Калифорнийского университета в Лос-Анджелесе, подчеркнула, что последствия от такого воздействия известны пока только для мышей. Так что ученые сконцентрировались на разработке препаратов, которые смогут блокировать этот ген у пациентов, проходящих реабилитацию после инсульта.
В апреле авторы другого исследования побочных эффектов редактирования генома отозвали статью из британского научного журнала Nature Methods. За год с момента публикации ее несколько раз критиковали за некорректную постановку эксперимента. Ученые из Стэнфордского и Колумбийского университетов сравнивали мышей с отредактированным геномом с другими мышами той же линии (так называют группы искусственно выведенных мышей). И пришли к выводу, что мутацию, приводящую к слепоте, можно вылечить с минимальным количеством побочных эффектов. Научное сообщество, среди прочего, указало на то, что сравнивать подопытных нужно было с их родителями. В таком случае в геноме после тестов обнаруживается более 100 крупных мутаций. В новой публикации ученые признают, что их начальные выводы ошибочны. Однако с отзывом статьи согласились только двое из шести авторов.
Фото: Depositphotos
Редактирование генома отдельных клеток с помощью системы CRISPR/Cas9 по всему миру продолжается. В Китае, где запретили менять геном эмбриона, пациентам вводят модифицированные лимфоциты в качестве иммунотерапии рака. Тестировать технологию по борьбе с этим заболеванием на 18 добровольцах начали в США еще в январе 2018 года. А на 2019 год в Соединенных Штатах и Европе запланировано начало клинических испытаний по редактированию стволовых клеток крови для лечения бета-талассемии и серповидноклеточной анемии (связанных с гемоглобином заболеваний).
Кстати, в Великобритании, где в 2016 году было разрешено в исследовательских целях редактировать геном эмбрионов человека, запрет после истории с китайскими двойняшками так и не был введен. И там в том же 2016 году на свет появился ребенок, родителями которого можно считать трех человек. Исследования, которые к этому привели, очевидно, велись до официального разрешения.
Российские ученые планируют заняться редактированием генома у живого человека в ближайшие три-четыре года, сообщила в августе прошлого года «РИА Новости» сотрудник лаборатории мутагенеза ФГБНУ «Медико-генетический научный центр», кандидат медицинских наук Светлана Смирнихина.
В феврале этого года Минобрнауки вместе с РАН разработали проект программы развития генетических технологий на 2019–2027 годы. Сделать это распорядился в ноябре 2018 года президент Владимир Путин. Тогда отмечалось, что программа нужна для ускорения развития генетических технологий и предупреждения чрезвычайных ситуаций биологического характера. А издание «Хайтек» отмечало, что в рамках этой программы откроют лаборатории по развитию технологии генетического редактирования.
Экономика против этики
Через несколько дней после того, как правительство Китая запретило редактировать геном эмбрионов, глава Всемирной организации здравоохранения Тедрос Адханом Гебрейесус призвал обсудить возможные последствия использования генной инженерии. И отметил, что надо начать обсуждение с того, стоит ли вообще подобное обсуждать, так как «есть большая часть населения, которая говорит: «Не надо это трогать».
И вот несколько дней назад эксперты ВОЗ пришли к выводу, что обсуждать, как и трогать, нужно. Они призвали создать регистр проводимых в мире исследований в сфере редактирования генов человека. И надеются на дискуссию с учеными, чтобы «лучше понять технические условия и нынешние мероприятия в сфере управления» исследованиями. Также ВОЗ будет проводить консультации с общественниками, группами пациентов, специалистами по этике и учеными в области социальных отношений.
По мнению профессора юриспруденции в Стэнфорде Хэнка Грили (Henry T. Greely), вопрос, когда ученым позволят улучшать людей, связан не столько с этикой, сколько с экономикой. Общественное мнение может измениться, если какая-нибудь крупная фармацевтическая компания начнет работать в этой сфере. И достаточно будет нескольких ярких маркетинговых кампаний под лозунгом «Мы изменим ваших детей», а также социологических опросов, посвященных праву родителей убирать возможные наследственные заболевания у потомков.
Фото: Depositphotos
Правда, Грили полагает, что произойдет это нескоро. Пока технология CRISPR слишком сложна. И крупные игроки не будут заниматься незаконными исследованиями, чтобы спрогнозировать возможную выгоду.
Способствовать популяризации генной модификации могут и компании, не связанные с медициной. В декабре 2017 года Управление перспективных исследовательских проектов Минобороны США (DARPA) вложило $100 млн в разработку генетического оружия для борьбы с малярийными комарами, грызунами и другими видам животных, несущими угрозу человеку и окружающей среде. В ООН выступили с критикой этого проекта, так как уничтожение одних видов может оказать негативное воздействие на другие.
Есть успехи с CRISPR и у сельского хозяйства. Так, в Китае удалось создать свиней с пониженным содержанием жира после замены части генов генами мышей. А американская компания Monsanto планирует использовать CRISPR, чтобы вывести новые сорта растений, более урожайные и устойчивые к экстремальным условиями среды.
Справка «Известий»CRISPR, или короткие палиндромные повторы, регулярно расположенные группами, обнаружили в Японии еще в 1980-е годы. Но догадались, как использовать особенности генома этой бактерии, только в 2010-е французские генетики Филипп Хорват (Philippe Horvath), Эммануэль Шарпентье (Emmanuelle Marie Charpentier) и их американская коллега Дженнифер Дудна (Jennifer Doudna).
Отличие CRISPR/Cas9 от других способов генного редактирования в том, что изменения ДНК можно четко направлять. Раньше конструкцию клетки изменяли, не имея возможности предсказать, куда встанет новая последовательность. К тому же невозможно было изменить существующие свойства организма — только добавить новые.
В CRISPR/Cas9 есть специальный фермент, который разрывает нужно место в геноме. Cas в названии — это белок, участвующий в разрушении клеток. Когда организм начинает восстанавливать клетку, он ищет для этого нужные последовательности в соседних геномах. По технологии, клетка должна найти ее в ферментах, которые ввели в организм генетики.
ЧИТАЙТЕ ТАКЖЕ
iz.ru
Модификация человеческих генов — это почти реальность / Habr
Главный редактор MIT Technology Review Антонио Регаладо пообщался с сотрудниками Гарвардской медицинской школы, которые специализируются на разработке способов генных модификаций. Главный вывод, к которому он пришёл, таков: вмешательство в ДНК человека — это уже скорее вопрос этики, чем научная проблема. Какие вмешательства допустимы и к чему они могут привести? Готово ли общество к тому, что человека можно будет конструировать ещё до его рождения? И как скоро сюжет фильма «Гаттака» станет обыденной реальностью?Молодой сотрудник Гарварда доктор Лухан Янг (Luhan Yang), одна из ключевых фигур в разработке метода генетической манипуляции CRISPR-Cas9, недавно основала биотехнологическую компанию, которая занимается изменением геномов крупного рогатого скота. Он говорит, что этот же метод может быть использован для модификации генов человека. Например, сейчас ничто не мешает учёным заменить дефектный ген, ответственный за появление у человека серповидно-клеточной анемии или болезни Альцгеймера.
Несмотря на имеющиеся недостатки, CRISPR уже успешно применяется не только для домашних животных, а и для приматов. Например, гены пары макак были изменены в прошлом году с целью регуляции их метаболизма и производства стволовых клеток. Обезьянки родились здоровыми, но для проверки успешности генной модификации должно пройти три года, прежде чем они достигнут половой зрелости. Сейчас, как говорят генетики Гарварда, в их распоряжении находятся примерно 20 эмбрионов обезьян, так что ожидаемое время таких же манипуляций с ДНК человека они оценивают в 10-20 лет.
Именно при помощи CRISPR-Cas9 совсем недавно группа учёных под руководством профессора института Солка (США) Хуана Бельмонте (Juan Carlos Izpisua Belmonte) провела успешный эксперимент по удалению фрагментов вируса иммунодефицита из ДНК человека. В вирусной ДНК были установлены специальные маркеры в виде молекул РНК, отмечающие фрагменты для удаления. Этот метод протестировали на лимфоцитах и прочих клетках иммунной системы, зараженных ВИЧ. Первая версия РНК-маркеров смогла удалить вирус и его следы в 72% клеток. Уничтожены были как «свежие» ДНК вируса, так и его «спящие» копии.
Недавнее социологическое исследование в США показало, что современное общество в целом готово к подобным манипуляциям. Взрослым задавали вопрос — согласны ли они на то, что с генами их ребёнка будет выполнена генетическая модификация с тем, чтобы он стал «умнее» и был бы менее подвержен серьёзным заболеваниям. Значительное число респондентов высказались положительно:
habr.com
Американка стала первым в мире генетически модифицированным человеком. И все ради вечной молодости

Ребята, мы вкладываем душу в AdMe.ru. Cпасибо за то,
что открываете эту
красоту. Спасибо за вдохновение и мурашки.
Присоединяйтесь к нам в Facebook и ВКонтакте
Уже не раз художественные выдумки фантастов воплощались учеными в реальность. Телефон, подводная лодка, ракета и многое-многое другое. И вот снова идея фантастических романов обрела реальную основу — на этот раз в области генной инженерии. Вполне возможно, что мифический «источник молодости» найден, и это как раз заслуга генетиков. Ведь пока неизвестны точные механизмы старения, но доказано, что процессы увядания напрямую зависят от состояния теломер — концевых участков хромосом: чем они длиннее, тем дольше живет человек.
Директор BioViva USA Inc. Элизабет Пэрриш утверждает, что ее команда разработала новый метод, позволяющий быстро, эффективно и безопасно увеличить длину теломер. AdMe.ru за новые научные открытия, и поэтому мы хотим поделиться с вами новым прорывом в области генной терапии.
В 2016 году 45-летняя директор BioViva USA Inc. Элизабет Пэрриш (Elizabeth Parrish) утверждала, что успешно прошла курс генной терапии против старения. Терапия предполагала устранение двух основных эффектов от процесса старения: укорачивание теломер и потеря мышечной массы.
Теломеры — это участки хромосом, которые отвечают за количество делений клетки до ее уничтожения. Хотя длина теломер у каждого человека индивидуальна, рождается человек с длиной теломер 15–20 тыс. пар нуклеотидов, а умирает с длиной 5–7 тыс. Длина их постепенно уменьшается за счет процесса, называемого пределом Хейфлика, — это количество делений клеток, примерно равное 50. После этого в клетках начинается процесс старения. В ходе исследований выяснили, что ДНК может восстанавливаться за счет фермента теломераза, который взаимодействует с теломерами и «возвращает» их изначальную длину.
Процесс восстановления теломер на данный момент запускает модифицированная РНК, которая несет в себе ген обратной теломеразной транскриптазы (TERT). После того как РНК была введена в теломеру, она повышает активность теломеразы на 1−2 дня. За это время она активно удлиняет теломеры и после этого распадается. Полученные в итоге клетки ведут себя аналогично «молодым» и делятся во много раз интенсивнее, чем клетки контрольной группы.
Благодаря такому способу удалось удлинить теломеры более чем на 1 000 нуклеотидов, что примерно равно нескольким годам человеческой жизни. Этот процесс безопасен для здоровья и не приводит к ненужным модификациям и мутациям клеток, так как иммунная система не успевает отреагировать на введенную в организм РНК.
Лаборатория SpectraCell подтвердила, что успех терапии возможен. В 2015 году перед началом терапии у Элизабет взяли кровь на анализ: длина теломер лейкоцитов составила 6,71 тыс. пар нуклеотидов. В 2016 году после окончания терапии кровь Пэрриш снова взяли на анализ: длина теломер лейкоцитов увеличилась до 7,33 тыс. пар. И это означает, что лейкоциты крови испытуемой «помолодели» примерно на 10 лет. Процедуру Пэрриш проходила в Колумбии, поскольку в США такие эксперименты запрещены.
Результаты исследования были подтверждены двумя независимыми организациями — бельгийской некоммерческой организацией HEALES (HEalthy Life Extension Company) и британским Исследовательским фондом биогеронтологии (Biogerontology Research Foundation). Результаты пока не подвергались экспертным оценкам.
www.adme.ru
Генетически модифицированные люди // Игорь Лалаянц ≪ Scisne?
Генетическое модифицирование человечества — совсем не новая опасность, генетические эксперименты над собой человечество ставило всегда. Гигантское генетическое разнообразие человеческих популяций — а человек ничем не хуже любого другого вида — всегда таило в себе множество рецессивных мутаций, никак не проявляющихся у большинства их гетерозиготных носителей. Человек может нормально жить с довольно большим количеством вредных аллелей в геноме — норма на одного человека — в среднем 3 — 4 летальные мутации, находящиеся в геноме в количестве всего одной копии, а потому не проявленные. Другое дело, если организм получает мутантный вариант гена от обоих родителей — такая мутация проявится обязательно. Но вероятность встречи двух носителей редкой мутации очень мала — вряд ли они познакомятся и поженятся, ведь выбор партнёров в современном обществе широк и становится всё шире.
Но так было далеко не всегда. Проще всего двум вредным копиям оказаться в одном геноме — это не искать партнёра далеко, а вступить в брак с родственником. Тогда вероятность для мутации оказаться у потомства в гомозиготе прямо пропорциональна степени родства жениха и невесты. Уходящие в глубь веков традиции экзогамии — выбора брачного партнёра из другого племени — отражают инстинктивное понимание человечеством опасности сочетания в одном генотипе двух мутантных копий одного и того же гена, это своего рода первые «правила техники безопасности» для генетических экспериментов.
Недаром люди издревле убоялись близкородственных браков. Ещё в пустыне Синайской Моисей среди своих заповедей провозгласил «не возжелай жены ближнего своего», поскольку в тесных сообществах того времени она могла оказаться если не родной, то двоюродной сестрой. А это было чревато тем, что во чреве та понесёт нежелательные генетические комбинации, которые приводят к самого разного рода неприятным последствиям для потомства.
Примером древнему миру служили египетские фараоны, которые женились на собственных сёстрах и дочерях. Династия за династией в долине Нила сменяли друг друга в силу генетического вырождения. Птолемеи, пришедшие в Египет вслед за Александром Македонским, тоже переняли этот обычай фараонов. Хватило всего лишь 15 поколений, чтобы мужская линия птолемеевской династии полностью деградировала, и венцом её стала прекрасная Клеопатра, сменившая Цезаря на Антония и последнего — на чёрного египетского аспида.
То же мы видим и в Европе. В своём великолепном романе «Рэгтайм» Э. Доктороу писал о путешествии финансового магната П. Моргана в Старый Свет: «В Европе он обедал с банкирами, премьерами и королями. В этой последней группе он отметил нарастающую деградацию. Они все переженились за долгие столетия и породили в своей новой генерации невежество и идиотизм». Заметим, что сам Морган страдал каким-то аутоиммунным заболеванием, в результате чего его нос превратился в большую «спелую» клубнику. Ещё Доктороу отмечал большой живот Моргана, написав затем, что избыточный вес впоследствии стал болезнью бедных (в силу потребления большого количества дешёвой и высококалорийной пищи)!
Нарушения аппетита, например, бывают самой разной природы. Известно, что принцесса Диана, столкнувшись со стрессами Букингемского дворца, который в самом начале июля открыл в Гайд-парке пруд в её честь, страдала попеременно то анорексией, то булимией, то есть полным отсутствием аппетита и состоянием, когда человек готов «быка сожрать». Отнюдь не все люди, однако, не могут справиться со своим аппетитом, только попав во дворец.
Аппетит вызывается нейропептидом Y («игрек»), который синтезируется в гипоталамусе, управляющем нашими основными инстинктами. Пептид называют ещё «орексигенным» от латинского «ор» — рот (отсюда такие слова, как «оральный» и «пероральный»). Его полным антагонистом является белковый гормон лептин, синтезируемый под «командой» инсулина адипоцитами, или клетками белой жировой ткани (подкожной клетчатки).
 Мышь без лептина перевешивает двух с нормальным геном |
Лептин был открыт 10 лет назад. На обложке журнала «Нейчур», увидевшего свет 1 декабря 1994 года, были показаны весы, на которых мутантная по гену лептина разожравшаяся мышь перевешивает двух обычных. Учёные назвали новый гормон, использовав греческое слово «лептос», — тонкий, изящный, красивый (оно входит в наши слова «лепота» и «великолепный», знаменитая лептонная оболочка, а также «лепта» — наименьшая медная греческая монетка).
Лептин легко проходит в мозг и поступает с кровотоком в гипоталамус, где и «гасит» аппетит, вызывая появление субъективного чувства насыщения. Так в норме регулируется потребление пищи. Однако при «выключении» гена лептина или его белкового рецептора на поверхности нейронов люди начинают страдать булимией, что приводит к ожирению, диабету, атеросклерозу и тому подобным мало приятным вещам.
Чревоугодие является седьмым смертным грехом. Люди всегда отрицательно относились к тем, кто неумерен в еде. Можно вспомнить вавилонского Молоха и Гаргантюа Франсуа Рабле, а также коварную Цирцею, которая пыталась с помощью обильной еды превратить спутников Одиссея в свиней.
Выше уже говорилось о пагубности близкородственных браков, резко повышающих вероятность «встречи» в геноме ребёнка двух мутантных генов родителей. Недаром основные нейропатии — такие как дальтонизм и паркинсонизм, а также хорея Гентингтона — описаны в Англии с её разрешёнными браками между кузинами и кузенами (кузенные браки). Не так давно журнал «Сайенс» описал паркинсонизм в двух больших семьях из Сицилии и центральной Италии (одна из них большое семейство Контурси), имеющих общие корни, а также в испанской семье с кузенными браками.
 Американские дети турецкого происхождения, страдающие «безлептиновым» ожирением. Слева — до лечения. Справа — после введения в организм человеческого рекомбинаторного лептина. |
Болезнь возникла в результате мутации гена особого белка синуклеина, представляющей собой замену одной буквы ген-кода (в результате чего шедевр Л. Толстого превратился в «Война и мор»). В одном случае мутация привела к замене аминокислоты в белке, а в другом — к возникновению «стоп»-кодона, в результате чего в белке «недоставало» 150 аминокислот.
Но вернёмся к диабету II типа, возникающему на фоне «безлептинового» ожирения. У членов большой пакистанской семьи с кузенными браками мутация в гене лептина была представлена делецией — нехваткой цитозина (C) — буквы ген-кода в 399-м положении, в результате чего дальнейшее считывание гена пошло «наперекосяк».
Делеция — это выпадение одного или нескольких нуклеотидов. Для иллюстрации можно привести фразу «дом кино», которая в результате «делеции» букв превращается в «домино». Естественно, что смысл текста при этом нарушается. Нарушение генетического «текста» — это мутация, которая ведёт к нарушению кодируемого геном белка со всеми вытекающими последствиями в виде генетического заболевания.
В большой же турецкой семье мутация в гене лептина представляет собой замену цитозина в 315-м положении на тимин. Это изменение приводит к смене аминокислоты аргинин в 105-м положении от начала белковой цепи на триптофан, в результате чего лептин теряет свои биологические свойства. Излишне говорить, что подобные мутации в гене лептина, оказываясь из-за близкородственных браков в гомозиготном состоянии, не украшают жизнь своим носителям — такие люди полнеют буквально «от воздуха», а есть-то им хочется.
Люди встречаются, люди влюбляются, женятся
Так пел в далёкие теперь уже 70-е годы популярный певец из развалившейся как карточный домик Югославии. Никакие запреты не мешают близким родственникам вступать в кузенный брак, порождая генетически отягощённое или даже больное потомство. Некоторые такие «кузенные» патологии представлены в таблице. Страна показывает происхождение семьи, члены которой чаще всего проживают в США, Англии или других странах Европы, где и проводился генетический анализ.
Родословная алопеции в семье с близкородственными браками  |
Алопеция в данном случае означает «тотальное» облысение, при котором в результате полного отсутствия волосяных мешочков нет не только скальпа и бровей, но даже и ресниц.
 Так выглядит лицо человека, страдающего тотальной алопецией. |
А нет их вследствие мутации в гене специфического транскрипционного фактора, который «запускает» считывание генов, отвечающих за формирование волосяных фолликулов.
Нечто похожее, но в менее выраженной степени происходит при короткопалости, или брадидактилии. Она выявлена в двух случаях в Германии. В одном примере мутантным оказался ген ВМР белка, участвующего в образовании кости, в другом же мутацией был затронут ген фермента тирозин-киназы (поясним в скобках, что фермент «кинирует», или переносит фосфорные группы на аминокислоту тирозин в других белках, чем и запускается сигнальный каскад, доходящий до ядра. В ядре пришедший сигнал активирует транскрипционные факторы генов-«мишеней», и клетка тем самым отвечает на внешний стимул).
Гемохроматоз представляет собой аномальное накопление железа в клетках и тканях, которое происходит при мутации в гене рецептора белка трансферина, переносящего железо. А гипогонадизм — это недоразвитие гонад, или половых желёз.
В приведённом конкретном случае у 21-летнего мужчины был вдвое уменьшен объём тестикулов и размер пениса, рост составляет всего лишь полтора метра, а плотность костей — как у 15-летнего подростка. У его сестры первая менструация случилась лишь в 16 лет. Генетическая патология вызвана мутацией в гене так называемого «релизера» — гормона, который стимулирует выделение-релизинг гормона гонадотропина, необходимого для развития гонад.
Близкородственный брак, приведший к клиническому проявлению гипогонадизма у потомков  |
Инфаркт довольно часто возникает в результате повышения свёртываемости крови, за что ответственен витамин K и его клеточный белок-рецептор. Мутация в этом рецепторе вызывает резистентность — сопротивляемость — к «разжижающему» кровь варфарину (производному кумарина), что и ведёт к повышению свёртываемости.
Далее речь идёт о микрогирии, или недоразвитию и «измельчению» извилин лобной и теменной коры. Происходит это при мутации в гене рецептора, который также участвует в передаче сигнала извне к ядру. Мутация другого гена приводит к недостаточному размеру всего мозга, то есть микроцефалии.
В этом случае изменение затрагивает ген ASPM — a-spindle mitosis, ответственный за нормальное деление клеток в митозе и мейозе. В результате этой мутации нервные стволовые клетки как бы «застывают» и дальше не делятся в силу отсутствия возможности «развести» хромосомы по полюсам. Естественно, что рост мозга затормаживается.
Катепсин C, ген которого мутирует при периодонтите, представляет собой фермент, расщепляющий белки в цитоплазме. Этот фермент крайне важен для функции макрофагов. Неудивительно, что мутация гена катепсина C проявляется в виде воспаления дёсен, утери зубов, артрита и повышенного кератоза стоп и ладоней.
Хорошо известно, что наша нервная система «перекрещена», поэтому при инсульте в правом полушарии отказывает левая половина тела и наоборот. Перекрёст осуществляется в эмбриональном состоянии с помощью белка ROBO (Roundabout). Это английское слово означает поворот за угол. Белок же RОВО привлекает на другую сторону растущие аксоны нейронов.
В 10 семьях разного происхождения при кузенных браках обнаружено 10 самых разных мутаций в гене указанного протеина, которые ведут, в частности, к ярко выраженному сколиозу и другим аномалиям развития нервной системы. Нечто подобное видно при выключении одного из генов мышиной модели сколиоза, что хорошо видно на иллюстрации «сопоставления».
Мутации в генах RP — хорошо известный офтальмологам «ретинитис пигментозум» (пигментозный ретинит) — и AIPL, кодирующем «интерактивный» протеин, взаимодействующий с арильным углеводородом (так расшифровывается аббревиатура), выявлены при кузенных браках в США, Голландии и в семье пакистанского происхождения.
Ещё один ген — NR отвечает за синтез ядерного («нуклеарного») рецептора, на который приходит сигнал через цитоплазму. При мутации в этом гене развивается ретинопатия, проявляющаяся в повышенной чувствительности колбочек сетчатки к коротковолновому синему свету, в результате чего люди теряют зрение к 20 годам.
Что делать?
Кто виноват — ясно. Это прежде всего люди, не желающие сдерживать свои сердечные порывы, чтобы не страдало их потомство. Однако всё не так просто. Раньше люди были вынуждены в силу обстоятельств вступать в близкородственные браки, пусть и в экстремальных ситуациях. Можно вспомнить библейский сюжет Лота с дочерьми, жена которого обратилась в соляной столп, оборотившись из женского любопытства, чтобы посмотреть на горящие в серном огне Содом и Гоморру.
Сейчас же выходцы из других стран оказываются в генетической изоляции, о чём писал в своём романе «Милый бо-пэр» венгерский писатель Тибор Дери: «За границей выходцы из одной нации лепятся обычно друг к другу, как слова хорошо написанной фразы; они полагают, что только вместе имеют какой-то смысл».
Можно вспомнить и тесный мирок пяти нью-йоркских мафиозных «семей», так хорошо описанный Марио Пьюзо в его «Крёстном отце». Всё это приводит к заключению кузенных браков, следствием чего являются описанные патологии.
При этом получается, что люди пусть и бессознательно, но активно модифицируют свои гены, превращаясь в ГМ-людей. Сегодня наука уже может в достаточном числе случаев поставить точный диагноз, что вселяет надежду на скорое нахождение соответствующих методов лечения путём «обратной» ген-модификации.
Но это в будущем. Сегодня же мы можем засвидетельствовать пока единственный пример успешного излечения генетической патологии в близкородственной семье. Речь идёт о членах семьи турецкого происхождения, проживающих в США, которые страдают от излишнего веса.
Открытие лептина, о чём говорилось в самом начале, позволило наладить его биотехнологическое производство. Специалисты Калифорнийского университета в Лос-Анджелесе в течение полутора лет делали инъекции человеческого рекомбинантного лептина членам этой семьи, страдающим от ожирения.
Клинические испытания прошли на ура (при введении долей или целых миллиграммов лептина на килограмм веса вес тела у таких людей сократился в 2 раза, что произошло главным образом за счёт «сжигания» подкожных запасов жира). Испытуемые стали проявлять значительно большую физическую активность, у них сам собой «разрешился» диабет II типа, наладились эндокринная функция и обмен, «исправилось» поведение и обратился вспять гипогонадизм.
Отчёт об успешных испытаниях лептина был опубликован журналом «Труды АН США» (PNAS). Вполне возможно, что им придётся вводить себе лептин так же, как и диабетики (колят) вводят себе инсулин. Хочется надеяться, что, излечившись, они расскажут своим детям о вреде постановки на себе опытов по ген-модификации.
И на Марсе будут яблони цвести
А вот это вряд ли, причём наше вечное пребывание в колыбели Земли обусловлено эволюцией, препятствующей межвидовому гибридизированию. А больше взять новые гены неоткуда, наши же собственные гены могут мутировать, однако чаще это неблагоприятные мутации, примеры которых приведены выше. Никаких ресурсов Земли не хватит для того, чтобы переправить в марсианские колонии, одна из которых показана в знаменитом фильме Арнольда Шварценнегера и Шарон Стоун «Вспомнить всё» (или «Полное восстановление памяти»), золотой миллиард людей. Да и вряд ли на нашей планете найдётся столько смельчаков и просто достаточно здоровых людей, чтобы перенести двухлетний перелёт (обратно корабль будет возвращаться целых пять лет!)
Но даже миллиард людей довольно быстро столкнётся с проблемой близкородственного скрещивания и кузенных браков. Поэтому в далёком антиутопическом будущем можно представить себе отдельные крайне малочисленные экспедиции к Красной планете, где вполне в духе футуристического фильма будут жить трёхгрудые девицы, но не более того. Ведь есть сменные «вахтовые» экспедиции в Антарктиде, но никому в здравом уме не придёт в голову идея создать на Южном полюсе производство и постоянные поселения при нём.
Гены наши, как выяснилось, крайне малочисленны, и крайне далеки они от нужд здорового народонаселения, потомство которого довольно быстро «портится» при «сближении» родителей ко-сангвиников, или сородичей по крови (от латинского «сангве» — кровь). Поэтому законодательства всех стран запрещают подобные браки.
Ведь об этом писал ещё Софокл в своей трагедии «Царь Эдип»:
Отцу — соложник сын и детям брат,
Что с матерью преступное общенье
и с ней детей рожу я
На отвращенье смертным племенам,
Я ль не порочней всех во Ойкумене?
«Знание-сила»
scisne.net
