Антрополог назвал генную модификацию человека в будущем неизбежной
https://ria.ru/20190118/1549546818.html
Антрополог назвал генную модификацию человека в будущем неизбежной
Антрополог назвал генную модификацию человека в будущем неизбежной — РИА Новости, 03.03.2020
Антрополог назвал генную модификацию человека в будущем неизбежной
Генная модификация человека неизбежна в будущем, несмотря на сегодняшние протесты общественных организаций, сообщил в интервью РИА Новости доцент кафедры… РИА Новости, 03.03.2020
2019-01-18T11:43
2019-01-18T11:43
2020-03-03T13:26
наука
россия
/html/head/meta[@name=’og:title’]/@content
/html/head/meta[@name=’og:description’]/@content
https://cdnn21.img.ria.ru/images/148641/75/1486417561_0:300:5760:3540_1920x0_80_0_0_f21d150d573dcec622984b082629398e.jpg
МОСКВА, 18 янв — РИА Новости. Генная модификация человека неизбежна в будущем, несмотря на сегодняшние протесты общественных организаций, сообщил в интервью РИА Новости доцент кафедры антропологии биологического факультета МГУ имени М. В. Ломоносова, кандидат биологических наук Станислав Дробышевский.В этом году кафедре антропологии биологического факультета МГУ исполняется 100 лет.Как отметил Дробышевский, сейчас во всем мире подобные опыты под запретом, но китайские ученые заявили о рождении ребенка, чей геном удалось модифицировать таким образом, что он не сможет болеть СПИДом.»Мы уже сейчас находимся в состоянии, близком к вымиранию, полезные ресурсы Земли уходят в минус, пики добычи угля и нефти уже пройдены. Решить проблему численности населения планеты можно разными способами, в том числе — с помощью генной инженерии, то, что она будет использоваться – очевидно», — сказал Дробышевский.По словам ученого, в противном случае человечество вновь окажется в средневековье.Читайте полный текст интервью >>
В. Ломоносова, кандидат биологических наук Станислав Дробышевский.В этом году кафедре антропологии биологического факультета МГУ исполняется 100 лет.Как отметил Дробышевский, сейчас во всем мире подобные опыты под запретом, но китайские ученые заявили о рождении ребенка, чей геном удалось модифицировать таким образом, что он не сможет болеть СПИДом.»Мы уже сейчас находимся в состоянии, близком к вымиранию, полезные ресурсы Земли уходят в минус, пики добычи угля и нефти уже пройдены. Решить проблему численности населения планеты можно разными способами, в том числе — с помощью генной инженерии, то, что она будет использоваться – очевидно», — сказал Дробышевский.По словам ученого, в противном случае человечество вновь окажется в средневековье.Читайте полный текст интервью >>
https://ria.ru/20181229/1548869899.html
https://ria.ru/20181018/1530949087.html
https://ria.ru/20180821/1526890023.html
россия
РИА Новости
7 495 645-6601
ФГУП МИА «Россия сегодня»
https://xn--c1acbl2abdlkab1og. xn--p1ai/awards/
xn--p1ai/awards/
2019
РИА Новости
7 495 645-6601
ФГУП МИА «Россия сегодня»
https://xn--c1acbl2abdlkab1og.xn--p1ai/awards/
Новости
ru-RU
https://ria.ru/docs/about/copyright.html
https://xn--c1acbl2abdlkab1og.xn--p1ai/
РИА Новости
7 495 645-6601
ФГУП МИА «Россия сегодня»
https://xn--c1acbl2abdlkab1og.xn--p1ai/awards/
https://cdnn21.img.ria.ru/images/148641/75/1486417561_320:0:5440:3840_1920x0_80_0_0_f5ff8689b94bc3426a65498f4fa6d40a.jpgРИА Новости
7 495 645-6601
ФГУП МИА «Россия сегодня»
https://xn--c1acbl2abdlkab1og.xn--p1ai/awards/
РИА Новости
7 495 645-6601
ФГУП МИА «Россия сегодня»
https://xn--c1acbl2abdlkab1og.xn--p1ai/awards/
россия
МОСКВА, 18 янв — РИА Новости. Генная модификация человека неизбежна в будущем, несмотря на сегодняшние протесты общественных организаций, сообщил в интервью РИА Новости доцент кафедры антропологии биологического факультета МГУ имени М.В. Ломоносова, кандидат биологических наук Станислав Дробышевский.
Генная модификация человека неизбежна в будущем, несмотря на сегодняшние протесты общественных организаций, сообщил в интервью РИА Новости доцент кафедры антропологии биологического факультета МГУ имени М.В. Ломоносова, кандидат биологических наук Станислав Дробышевский.
В этом году кафедре антропологии биологического факультета МГУ исполняется 100 лет.
29 декабря 2018, 08:00НаукаСмерть по наследству. Как судьба родителей влияет на здоровье детей«Ученые научились на генетическом уровне модифицировать сельскохозяйственные культуры и продукты питания. Следующий шаг – генная модификация самого человека. Генная инженерия позволяет «подвинтить» необходимые гены и получить свойства особи, которые нам нужны, причем не в перспективе десятилетий, а гораздо быстрее… Проблема таких манипуляций с геномом человека в том, что этим экспериментам сопротивляются общественные организации, особенно – религиозные. Но, несмотря на эти протесты, генная инженерия в ближайшем будущем станет частью нашей жизни. Ведь человечество ставит перед собой цель выжить, а при неконтролируемом размножении и истощении природных ресурсов это невозможно», — сказал он.
Ведь человечество ставит перед собой цель выжить, а при неконтролируемом размножении и истощении природных ресурсов это невозможно», — сказал он.
Как отметил Дробышевский, сейчас во всем мире подобные опыты под запретом, но китайские ученые заявили о рождении ребенка, чей геном удалось модифицировать таким образом, что он не сможет болеть СПИДом.
18 октября 2018, 12:00НаукаВ России созданы эмбрионы, неуязвимые для действия ВИЧ«Мы уже сейчас находимся в состоянии, близком к вымиранию, полезные ресурсы Земли уходят в минус, пики добычи угля и нефти уже пройдены. Решить проблему численности населения планеты можно разными способами, в том числе — с помощью генной инженерии, то, что она будет использоваться – очевидно», — сказал Дробышевский.
По словам ученого, в противном случае человечество вновь окажется в средневековье.
21 августа 2018, 08:00НаукаСекс или деньги? Ученые поняли, почему на Земле рождается больше мальчиков«В режиме средневековья оно сможет существовать до бесконечности, но продолжительность жизни сократится до 30 лет и резко упадет ее уровень. Зато, к примеру, мало кто будет иметь проблемы с сердечно-сосудистой системой, так как до возраста связанных с ней болезней люди просто не смогут доживать», — добавил Дробышевский.
Зато, к примеру, мало кто будет иметь проблемы с сердечно-сосудистой системой, так как до возраста связанных с ней болезней люди просто не смогут доживать», — добавил Дробышевский.
Генная инженерия: что это, методы, примеры, достижения
Современная генная инженерия позволяет «включать» и «выключать» отдельные гены, программируя новый генотип, в том числе, и человеческий. Это вызывает немало опасений, хотя многие открытия уже принесли человечеству пользу
Генная инженерия — это современное направление биотехнологии, объединяющее знания, приемы и методики из целого блока смежных наук — генетики, биологии, химии, вирусологии и так далее — чтобы получить новые наследственные свойства организмов.
Перестройка генотипов происходит путем внесения изменений в ДНК (макромолекулу, обеспечивающую хранение, передачу из поколения в поколение и реализацию генетической программы развития и функционирования живых организмов) и РНК (одну из трех основных макромолекул, содержащихся в клетках всех живых организмов).
История развития
Истоки
Основы классической генетики были заложены в середине XIX века благодаря экспериментам чешского-австрийского биолога Грегора Менделя. Открытые им на примере растений принципы передачи наследственных признаков от родительских организмов к их потомкам в 1865 году, к сожалению, не получили должного внимания у современников, и только в 1900 году Хуго де Фриз и другие европейские ученые независимо друг от друга «переоткрыли» законы наследственности.
Параллельно с этим шел процесс формирования знаний о ДНК. Так, в 1869 году швейцарский биолог Фридрих Мишер открыл факт существования макромолекулы, а в 1910 году американский биолог Томас Хант Морган обнаружил на основе характера наследования мутаций у дрозофил, что гены расположены линейно на хромосомах и образуют группы сцепления. В 1953 году было сделано важнейшее открытие — американец Джон Уотсон и британец Фрэнсис Крик установили молекулярную структуру ДНК.
В 1953 году было сделано важнейшее открытие — американец Джон Уотсон и британец Фрэнсис Крик установили молекулярную структуру ДНК.
На подъеме
К концу 1960-х годов генетика активно развивалась, а ее важными объектами стали вирусы и плазмиды. Были разработаны методы выделения высокоочищенных препаратов неповрежденных молекул ДНК, плазмид и вирусов, а в 1970-х годах был открыт ряд ферментов, катализирующих реакции превращения ДНК.
Генная инженерия как отдельное направление исследовательской работы зародилась в США в 1972 году, когда в Стэнфордском университете ученые Пол Берг, Стэнли Норман Коэн, Герберт Бойер и их научная группа внедрили новый ген в бактерию кишечной палочки (E. coli), то есть создали первую рекомбинантную ДНК.
Техника ПЦР была впервые разработана в 1980-х годах американским биохимиком Кэри Маллисом. Будущий лауреат Нобелевской премии по химии (1993 года), обнаружил в специфический фермент — ДНК-полимеразу, который участвует в репликации ДНК.
Новая эра
В 1996 году методом пересадки ядра соматической клетки в цитоплазму яйцеклетки на свет появилось первое клонированное млекопитающее — овца Долли. Это событие стало революционным в истории развития генной инженерии, потому что впервые стало возможным серьезно говорить о создании клонов и выращивании живых организмов на основе молекул.
Технологии генной инженерии
Генная инженерия за короткий срок оказала огромное влияние на развитие различных молекулярно-генетических методов и позволила существенно продвинуться на пути познания генетического аппарата.
Так, появилась технология CRISPR — инструмент редактирования генома. В 2014 году MIT Technology Review назвал его «самым большим биотехнологическим открытием века». Он основан на защитной системе бактерий, которые производят специальные ферменты, позволяющие им защищаться от вирусов.
«Каждый раз, когда бактерия убивает вирус, она разрезает остатки его генома, будь то ДНК или РНК, и сохраняет их внутри последовательности CRISPR, как в архив. Как только вирус атакует снова, бактерия использует информацию из «архива» и быстро производит защитные белки Cas9, в которых заключены фрагменты генома вируса. Если вдруг эти фрагменты совпадают с генетическим материалом нынешнего атакующего вируса, Cas9 как ножницами разрезает захватчика, и бактерия снова в безопасности», — поясняет Алевтина Федина, медицинский директор Checkme.
Уникальное открытие состоялось в 2011 году, когда биологи Дженнифер Дудна и Эммануэль Шарпантье обнаружили, что белок Cas9 можно обмануть. Если дать ему искусственную РНК, синтезированную в лаборатории, то он, найдя в «архиве» соответствие, нападет на нее. Таким образом, с помощью этого белка можно резать геном в нужном месте — и не просто резать, а еще и заменять другими генами.
Теоретически, технология CRISPR может позволить редактировать любую генетическую мутацию и излечивать заболевание, которое она вызывает. Но практические разработки CRISPR в качестве терапии еще только в начальной стадии, и многое еще непонятно.
Но практические разработки CRISPR в качестве терапии еще только в начальной стадии, и многое еще непонятно.
Есть и другие методы генной инженерии, например, ZFN и TALEN.
- ZFN разрезает ДНК и вставляет туда заготовленный заранее новый фрагмент с помощью белков с ионами цинка (отсюда название — Zinc Finger Nuclease).
- TALEN делает то же самое, только используя TAL-белки. Для обеих технологий приходится создавать отдельные белки, а это очень долгая работа, поэтому пока два этих метода особого применения не нашли.
Где и как применяется генная инженерия
Медицина
Уже сейчас активно применяется инсулин человека (хумулин), полученный посредством рекомбинантных ДНК. Клонированные гены человеческого инсулина были введены в бактериальную клетку, где начался синтез гормона, который природные микробные штаммы никогда не синтезировали. С 1982 года компании США, Японии, Великобритании и других стран производят генно-инженерный инсулин.
Кроме того, несколько сотен новых диагностических препаратов уже введены в медицинскую практику. Среди лекарств, находящихся в стадии клинического изучения, препараты, потенциально лечащие артрозы, сердечно-сосудистые заболевания, онкологию и СПИД. Среди нескольких сотен генно-инженерных компаний 60% заняты именно разработкой и производством лекарственных и диагностических средств.
«В медицине среди достижений генной инженерии сегодня можно выделить терапию рака, а также другие фармакологические новинки — исследования стволовых клеток, новые антибиотики, прицельно бьющие по бактериям, лечение сахарного диабета. Правда, пока все это на стадии исследований, но результаты многообещающие», — говорит Алевтина Федина.
Сельское хозяйство
В сельском хозяйстве одна из важнейших задач генной инженерии — получение растений и животных, устойчивых к вирусам. В настоящее время уже есть виды, способные противостоять воздействию более десятка различных вирусных инфекций.
Еще одна задача связана с защитой растений от насекомых-вредителей. Путем генетической модификации растений можно уменьшить интенсивность обработки полей пестицидами. Например, трансгенные растения картофеля и томатов стали устойчивы к колорадскому жуку, растения хлопчатника — к разным насекомым, в том числе и к хлопковой совке.
Использование генной инженерии позволило сократить применение инсектицидов (препаратов для уничтожения насекомых) на 40–60%.
Благодаря генной инженерии зерновые культуры стали более устойчивы к климатическим условиям, кроме того появилась возможность увеличить количество витаминов и полезных веществ в продукте. Например, можно обогатить рис витамином «А» и выращивать его в тех регионах, где люди имеют массовую нехватку этого элемента.
С помощью генной инженерии пытаются решить и экологические проблемы. Так, уже созданы особые сорта растений с функцией очистки почвы. Они поглощают цинк, никель, кобальт и иные опасные вещества из загрязненных промышленными отходами почв.
Скотоводство
В Кемеровской области работа генетиков позволила получить устойчивое к вирусу лейкоза племенное поголовье высокопродуктивных животных. Для проведения эксперимента кузбасские ученые отобрали здоровых коров черно-пестрой породы массой до 500 кг. Животным трансплантировали модифицированные эмбрионы, устойчивые к вирусу лейкоза. В середине сентября 2020 года родилось 19 телят с измененными генами.
«В месячном возрасте была проведена оценка, которая показала, что телята отличаются от своих сверстников только устойчивостью к вирусу. Пять особей отобрали для дальнейшей селекционной работы. Это позволит закрепить наследственные признаки устойчивости к вирусу лейкоза у последующих поколений», — пояснила руководитель проекта, доктор биологических наук, профессор кафедры зоотехнии Кузбасской ГСХА Татьяна Зубова.
По словам Зубовой, лейкоз крупного рогатого скота — вирусная хронически неизлечимая болезнь, при которой возникают поражение кроветворной системы и новообразования. Данное заболевание наносит значительный ущерб генофонду пород и мясной промышленности в целом, потому что мясо зараженных животных запрещено употреблять в пищу. Единственным доступным методом борьбы с лейкозом ранее было только уничтожение зараженного скота.
Данное заболевание наносит значительный ущерб генофонду пород и мясной промышленности в целом, потому что мясо зараженных животных запрещено употреблять в пищу. Единственным доступным методом борьбы с лейкозом ранее было только уничтожение зараженного скота.
Этот успех позволяет говорить о том, что в дальнейшем будет возможно редактировать гены крупного рогатого скота и от других болезней.
С прицелом на человека
В 2009 году группа ученых под руководством молодого исследователя Джея Нейтца из Вашингтонского университета сумели с помощью генной терапии вернуть обезьянам способность различать оттенки зеленого и красного, которой они были лишены от рождения.
В область сетчатки глаза двух подопытных обезьян был введен безвредный вирус, несущий недостающий ген фоточувствительного рецептора. Вскоре после процедуры обе обезьяны начали различать оттенки красного и зеленого на сером фоне. Два года наблюдения не выявили у них каких-либо нарушений, поэтому ученые не исключают, что данную методику уже вскоре можно будет применять у людей, страдающих дальтонизмом.
Ученые шагнули еще дальше и уже пробуют выращивать в теле животных органы для трансплантации людям. Для минимизации риска отторжения тканей животным вводят специальные гены. Этими опытами занимается научная лаборатория Рослинского института в Великобритании, которая представила миру овцу Долли.
В 2019 году британские ученые вывели кур, яйца которых содержат два вида человеческих белков, способных противодействовать артриту и некоторым видам онкологических заболеваний. В яйцах содержится человеческий белок под названием IFNalpha2a, обладающий мощными противовирусными и противораковыми свойствами, а также человеческий и свиной вариант белка под названием макрофаг-CSF, который планируют использовать для создания препарата, стимулирующего самостоятельное заживление поврежденных тканей.
Изменение ДНК человека
Первые клинические испытания методов генной терапии были предприняты 22 мая 1989 года с целью генетического маркирования опухоль-инфильтрующих лимфоцитов в случае прогрессирующей меланомы.
14 сентября 1990 года в Бетесде (США) четырехлетней девочке, страдающей наследственным иммунодефицитом, обусловленным мутацией в гене аденозиндезаминазы (АDA), были пересажены ее собственные лимфоциты.
Работающая копия гена ADA была введена в клетки крови с помощью модифицированного вируса, в результате чего клетки получили возможность самостоятельно производить необходимый белок. Через шесть месяцев количество белых клеток в организме девочки поднялось до нормального уровня.
После этого область генной терапии получила толчок к дальнейшему развитию. С 1990-х годов сотни лабораторий ведут исследования по использованию генной терапии для лечения различных заболеваний. Уже сегодня с помощью генной терапии можно лечить диабет, анемию и некоторые виды онкологии.
Генная терапия
Генная терапия — введение, удаление или изменение генетического материала, в частности ДНК или РНК, в клетке пациента для лечения определенного заболевания.
Существует три основных стратегии использования генной терапии:
- Замена мутировавшего гена, вызывающего заболевание, здоровой копией.

- Инактивация или «выбивание» мутировавших генов, которые функционируют неправильно.
- Введение нового гена в организм, помогающего бороться с болезнью.
Наиболее часто применяемый метод включает вставку «терапевтического» гена для замены «ненормального» или «вызывающего болезнь».
В 2015 году впервые была проведена процедура изменения ДНК человека с целью продления молодости клеток, когда американке Элизабет Пэрриш 44 лет ввели в организм препарат, влияющий на ДНК, а в 2018 году китайский ученый Хэ Цзянькуй заявил, что с его помощью у двух детей-близнецов якобы изменены гены для выработки у них иммунитета к вирусу ВИЧ, носителем которого являлся их отец.
Все это, с одной стороны, выглядит грандиозно и обнадеживает, но с другой, — вызывает опасения, ведь генетические манипуляции, теоретически, возможно использовать не только в благих и мирных целях.
После эксперимента с ДНК близнецов в Китае, ЮНЕСКО выступила с инициативой о запрете изменения генов у новорожденных до того момента, пока достоверно не будет доказана безопасность таких манипуляций.
Этическая сторона вопроса
В 1997 году ЮНЕСКО выпустила Всеобщую декларацию о геноме человека и его правах, рекомендовав мораторий на генетическое вмешательство в зародышевую линию человека, а в декабре 2015 года на международном саммите по геномному редактированию человека изменение гаметоцитов и эмбрионов для генерации наследственных изменений у людей было объявлено безответственным.
Российское сообщество генетиков в большинстве своем считает, что такие эксперименты на данный момент преждевременны и требуют более глубокого исследования и обсуждений.
«Вопрос клонирования уже давно стоит на горизонте. Этично ли выращивать клонов, чтобы потом забирать их органы для трансплантации человеку… Большой вопрос. Само собой, это абсолютно нормально, что нет единой точки зрения, ведь смысл подобных дискуссий как раз в том, чтобы найти правильные формулировки и отрегулировать потенциально спасительное, но при этом очень опасное знание», — говорит Алевтина Федина.
Страх неизвестности
Вариантов развития событий в области генной инженерии существует множество, и далеко не все они изучены и, в принципе, известны. Поэтому они должны быть последовательно зафиксированы и регламентированы.
Естественно, больше всего опасений вызывают плохие сценарии развития событий. Как правило, все начинается с помощи людям и изобретения новых лекарств. Но потом человек может прийти к желанию сделать своего ребенка светловолосым и зеленоглазым или создать армию универсальных солдат, не боящихся боли и не ведающих страха.
Олег Долгицкий, социальный философ, отмечает, что современное общество настолько неоднородно в культурном и экономическом плане, что любые методы, способные существенно изменить геном, могут создать условия не только для классового, но и видового расслоения, где представители «первого мира» смогут существенно продлевать свою жизнь и не бояться никаких болезней, в отличие от менее богатых людей. Это является серьезнейшей почвой для конфликтов и столкновений.
Эксперты убеждены, что генная инженерия — это будущее медицины. Возможность избавить младенца от пожизненного гнета заболевания, излечить людей от рака, найти лекарство против ВИЧ — за всем этим будет стоять генная инженерия. При этом желание человека изменить, например, цвет глаз или предотвратить наследственное заболевание, несмотря на все риски, будет только расти. И похоже, что остановить этот процесс уже не представляется возможным.
Что такое ГМО: плюсы, минусы, мифы
В новом видео РБК Трендов биолог Ирина Голденкова-Павлова из Группы функциональной геномики Института физиологии растений им. К.А. Тимирязева объясняет, что такое ГМО и почему вокруг них так много мифов
Что такое ГМО?
ГМО — генетически модифицированные организмы — это организмы, в ДНК которых были целенаправленно внесены изменения при помощи методов генной инженерии. То есть им были переданы отдельные гены от другого организма, не обязательно родственного. Обычно таким способом улучшают свойства растений и микроорганизмов, реже — животных или придают им совершенно новые характеристики.
То есть им были переданы отдельные гены от другого организма, не обязательно родственного. Обычно таким способом улучшают свойства растений и микроорганизмов, реже — животных или придают им совершенно новые характеристики.
Почему вокруг ГМО так много заблуждений?
По данным ВЦИОМ, больше 80% россиян настроены против ГМО. Подобные опросы проводились также в США, Франции и Германии. В этих странах около 90% населения также негативно относятся к искусственной модификации генома. Один из главных аргументов противников ГМО — какое-либо вмешательство в ДНК противоестественно. А значит, употребление в пищу ГМО-растений и продуктов может вызвать у человека опасные мутации и, как следствие, болезни.
При этом, согласно исследованию британских ученых, ярые противники ГМО гораздо хуже, чем их оппоненты, разбираются в базовых биологических понятиях, не говоря о генетике. По этой причине большинство респондентов неверно представляют себе, что вообще такое вмешательство в геном. На самом деле наука занимается этим достаточно давно. Еще в XVI веке первые агрономы-испытатели, не зная законов генетики, создавали растения-гибриды, отбирая для посева те сорта, которые были устойчивы к вредителям и приносили больше урожая. Это называется селекцией. С развитием науки были изобретены более совершенные методы — в частности, генная инженерия. Она позволила ученым в три раза ускорить процесс выведения новых сортов, или новых полезных свойств растений. Впрочем, даже используя такие современные и точные методы генетики, как, например, CRISPR/Cas9, невозможно создать такой генно-модифицированный продукт, который через кишечник человека смог бы встроиться в его ДНК. Более того, механизма, который позволил бы осуществить перенос генов таким образом, попросту не существует.
По этой причине большинство респондентов неверно представляют себе, что вообще такое вмешательство в геном. На самом деле наука занимается этим достаточно давно. Еще в XVI веке первые агрономы-испытатели, не зная законов генетики, создавали растения-гибриды, отбирая для посева те сорта, которые были устойчивы к вредителям и приносили больше урожая. Это называется селекцией. С развитием науки были изобретены более совершенные методы — в частности, генная инженерия. Она позволила ученым в три раза ускорить процесс выведения новых сортов, или новых полезных свойств растений. Впрочем, даже используя такие современные и точные методы генетики, как, например, CRISPR/Cas9, невозможно создать такой генно-модифицированный продукт, который через кишечник человека смог бы встроиться в его ДНК. Более того, механизма, который позволил бы осуществить перенос генов таким образом, попросту не существует.
Ситуацию усугубляют и псевдонаучные публикации, которые содержат некорректные данные о ГМО, или же неверно их трактуют. Например, в феврале 2019-го в журнале Food and Chemical Toxicology вышел обзор о том, как генно-модифицированные продукты усваиваются человеческим организмом. В кратком содержании авторы пишут: «Убедительные свидетельства показывают наличие ДНК из еды (также генно-модифицированной еды) в крови и тканях человека и животных».
Например, в феврале 2019-го в журнале Food and Chemical Toxicology вышел обзор о том, как генно-модифицированные продукты усваиваются человеческим организмом. В кратком содержании авторы пишут: «Убедительные свидетельства показывают наличие ДНК из еды (также генно-модифицированной еды) в крови и тканях человека и животных».
Однако если вчитаться в текст обзора, становится понятно, что на самом деле исследователи не нашли никаких тревожных признаков: в крови испытуемых не было повышенной концентрации трансгенной ДНК.
Наконец, мифы о ГМО успешно распространяются и на государственном уровне. К примеру, авторы сайта Центра гигиены и эпидемиологии при Роспотребнадзоре пишут об опасности ГМ-продуктов, ничем не подкрепляя эти заявления.
Одно из очевидных объяснений подобных предрассудков — банальная научная безграмотность противников ГМО или работа с некорректными источниками информации.
Правда ли, что ГМО — это вредно?
Существует множество исследований, которые доказывают, что ГМ-продукты безопасны. Например, доклад Национальных академий наук, техники и медицины США от 2016 года свидетельствует, что такие продукты не только не вредны, но даже полезны для человека. Авторы изучили более 900 научных работ, опросили 80 экспертов из различных областей, еще 26 привлекли к рецензированию доклада. В основном все проанализированные исследования касались двух типов ГМ-растений: устойчивых к насекомым и к химическим удобрениям. Данные за последние 20 лет показали, что эти сельхозкультуры никак не повлияли на людей и животных, которые ими питались.
Например, доклад Национальных академий наук, техники и медицины США от 2016 года свидетельствует, что такие продукты не только не вредны, но даже полезны для человека. Авторы изучили более 900 научных работ, опросили 80 экспертов из различных областей, еще 26 привлекли к рецензированию доклада. В основном все проанализированные исследования касались двух типов ГМ-растений: устойчивых к насекомым и к химическим удобрениям. Данные за последние 20 лет показали, что эти сельхозкультуры никак не повлияли на людей и животных, которые ими питались.
Прежде, чем вывести ГМ-продукт на рынок, ученые проводят многолетние испытания. Они наблюдают, как ведут себя трансгены и продукты генной экспрессии, не вызывают ли они аллергии или отравления. Международное законодательство требует, чтобы каждый такой товар проходил жесткую проверку на безопасность для людей, животных и окружающей среды. Кроме того, в ЕС такие продукты отслеживают еще и годы спустя, чтобы выявить возможные отложенные риски.
Пока существует только два вероятных риска, связанных с применением ГМО, о которых, в частности, говорит ВОЗ:
- ГМ-растения могут передавать устойчивость к антибиотикам. Однако компании, разрабатывающие ГМО, уже сейчас используют для переноса гены, которые не передают такое свойство;
- ГМ-растения могут вытеснять другие, менее выносливые виды. Тем не менее неконтролируемое распространение трансгенных растений в сельском хозяйства также жестко регулируется.
Как ГМО двигает науку и медицину
Сегодня ГМО используют в двух главных сферах: сельское хозяйство и медицина.
Практически все продукты растительного происхождения на нашем столе — с измененными генами. Благодаря этому они дают больше урожая, приспосабливаются к суровому климату и недостаткам почвы, противостоят вредителям. Но главное — они становятся лучше на вкус, содержат больше полезных веществ и приобретают новые ценные свойства. Например, золотой рис — генетически модифицированный сорт риса с повышенным содержанием витамина А. Существует также особый сорт моркови, который содержит вакцину от туберкулеза.
Существует также особый сорт моркови, который содержит вакцину от туберкулеза.
Какое будущее у ГМО?
Несмотря на все сложности с разработкой и проверкой на безопасность, ученые уверены: в будущем человечеству не обойтись без трансгенных растений и продуктов. Мы сможем предотвращать голод или массовый неурожай, а также минимизировать вред для экологии: ГМО-растения можно реже поливать и возделывать беспахотным способом. Это позволит не только экономить воду, но и уменьшать парниковый эффект за счет снижения теплового излучения пашни. Кроме того меньшее количество сельхозтехники на полях поможет контролировать выбросы углекислого газа в атмосферу.
Вот несколько примеров того, на что способна генная инженерия:
- Выведение растений, которые чаще плодоносят, нуждаются в минимальном возделывании и даже поглощают СО2. Это помогло бы заметно сократить парниковый эффект и улучшить экологическую обстановку во всем мире;
- Генно-модифицированные животные растут быстрее и более устойчивы ко всем распространенным инфекциям.
 Это поможет снизить затраты на их разведение и откорм, а также защитить нас от новых эпидемий вроде птичьего или свиного гриппа. Кроме того, для таких животных не понадобятся антибиотики, которыми часто злоупотребляют фермеры.
Это поможет снизить затраты на их разведение и откорм, а также защитить нас от новых эпидемий вроде птичьего или свиного гриппа. Кроме того, для таких животных не понадобятся антибиотики, которыми часто злоупотребляют фермеры.
Александр Панчин: «С точки зрения политиков, вколоть в кровь ГМО не страшно, а съесть — страшно»
Что такое ГМО, почему люди боятся генной инженерии и что с этим делать
«Страшилки» о ГМО занимают заслуженное место в мире околонаучных фейков и находятся в топе этого «антихит-парада» — где-то рядом с антипрививочной кампанией и ВИЧ-диссидентством. Александр Панчин, известный российский биолог, писатель и научный журналист, поговорил с «Реальным временем» о генно-модифицированных организмах. Выяснилось: каждый из нас — это ГМО, вакцина от коронавируса — тоже ГМО, а маркировка «без ГМО» на бутылке молока — чистой воды маркетинг.
«Мы все — мутанты»— Что же такое эти страшные и ужасные ГМО?
— Генно-модифицированный организм — это скорее юридический термин, нежели что-то осмысленное с точки зрения биологии. Биология подразумевает, что мы все — мутанты, все мы подвергаемся генной модификации в процессе размножения. Дело в том, что в каждом поколении у животных и растений возникают мутации. Это генетические изменения, которые могут приводить впоследствии к тем или иным отличиям организма.
Биология подразумевает, что мы все — мутанты, все мы подвергаемся генной модификации в процессе размножения. Дело в том, что в каждом поколении у животных и растений возникают мутации. Это генетические изменения, которые могут приводить впоследствии к тем или иным отличиям организма.
Так вот, генная инженерия позволяет нам вносить точечные генетические особенности в будущий организм в лаборатории. Такой организм и будет с юридической точки зрения называться генно-модифицированным.
До этого тысячи лет человек выводил новые породы и сорта растений и животных, искусственно влияя на формирование генома — это называется селекцией. Если проводить аналогию, то методы селекции можно сравнить с кувалдой, которой мы грубо били по геному и смотрели, что получится. Теперь у нас есть своеобразные маникюрные ножницы, благодаря которым мы можем внести изменения аккуратнее — технологии генной инженерии.
В конечном итоге важнее не то, каким образом мы редактируем ДНК, а то, какая конкретная мутация произошла в организме. Допустим, мы получили папайю, устойчивую к вирусам. Или бактерию, производящую инсулин. Или картошку, устойчивую к вредителям. Это все разные организмы с разными мутациями.
Допустим, мы получили папайю, устойчивую к вирусам. Или бактерию, производящую инсулин. Или картошку, устойчивую к вредителям. Это все разные организмы с разными мутациями.
Но и в рамках селекции мы тоже получаем организмы с определенными особенностями. Просто это происходит дольше, и вместе с желаемым признаком развиваются сопутствующие. Генная инженерия — метод более точный и аккуратный.
— С чего началась индустрия ГМО?
— Изменения в геном бактерий ученые вносят уже несколько десятилетий. И в геном растений — тоже. Первыми ГМО, нацеленными на то, чтобы использовать их в пищевой промышленности, были помидоры, из которых изготавливали томатную пасту, это было в начале 1990-х годов. И что любопытно, эти самые томаты с гордостью маркировали как ГМО, как продукт высокой технологии. Изначально это так и воспринималось людьми: генная инженерия — это что-то современное и крутое.
— А потом что-то пошло не так.
— А потом началась информационная кампания против этого как против чего-то противоестественного, неприродного, страшного. Появились некорректные ассоциации между ГМО и какими-нибудь ядами, химикатами, которые якобы добавляют в пищу. Я как-то был на одной телепередаче, там был противник ГМО, эксперт, который думал, что ГМО — это пестициды. То есть люди часто просто не понимают, что такое ГМО. А это просто живые организмы, они размножаются, просто у них есть определенные генетические особенности, целенаправленно внесенные в лаборатории.
Появились некорректные ассоциации между ГМО и какими-нибудь ядами, химикатами, которые якобы добавляют в пищу. Я как-то был на одной телепередаче, там был противник ГМО, эксперт, который думал, что ГМО — это пестициды. То есть люди часто просто не понимают, что такое ГМО. А это просто живые организмы, они размножаются, просто у них есть определенные генетические особенности, целенаправленно внесенные в лаборатории.
Люди часто просто не понимают, что такое ГМО. А это просто живые организмы, они размножаются, просто у них есть определенные генетические особенности, целенаправленно внесенные в лаборатории«Ни на каком гене не написано, что он принадлежит определенному организму»
— Чтобы получить определенную желаемую мутацию, в ген исходного организма встраивается геном другого организма?
— Необязательно, но есть и такая технология. В природе такое тоже происходит и называется «горизонтальным переносом генов». В результате получаются так называемые трансгенные организмы. Но на самом деле ни на каком гене не написано, что он принадлежит какому-то определенному организму. Это всего лишь последовательность буковок из нуклеотидной последовательности, которые кодируют наш геном. Сами буквы одинаковы у человека, у рыбы, у бактерии и различаются только порядком расположения.
В результате получаются так называемые трансгенные организмы. Но на самом деле ни на каком гене не написано, что он принадлежит какому-то определенному организму. Это всего лишь последовательность буковок из нуклеотидной последовательности, которые кодируют наш геном. Сами буквы одинаковы у человека, у рыбы, у бактерии и различаются только порядком расположения.
Как вы можете из одних и тех же букв составлять разные слова и предложения, так и генетическая последовательность любого организма составлена из одних и тех же нуклеотидов.
Если проводить аналогии — например, если бы вы взяли цитату из Пушкина и вставили ее в книгу Толстого — у вас получится генно-модифицированный, в данном случае — трансгенный текст. А могли бы просто одну букву у Толстого поменять, это была бы точечная мутация.
— В природе такое встречается? Или трансгенные организмы могут появиться только в лаборатории?
— В природе горизонтальный перенос генов встречается, причем не так уж и редко. Один из основных методов генной инженерии с растениями — агробактериальная трансформация. В ней участвуют почвенные бактерии Agrobacterium tumefaciens. Так вот, они от природы сами умеют переносить свои гены в ДНК растений и заставлять их производить вещества, которыми питаются. Ученые взяли эту бактерию и «переоборудовали» ее таким образом, чтобы переносить в растения не те гены, которые нужны ей, а те, которые нужны нам. Так получился один из основных методов генной модификации растений.
Один из основных методов генной инженерии с растениями — агробактериальная трансформация. В ней участвуют почвенные бактерии Agrobacterium tumefaciens. Так вот, они от природы сами умеют переносить свои гены в ДНК растений и заставлять их производить вещества, которыми питаются. Ученые взяли эту бактерию и «переоборудовали» ее таким образом, чтобы переносить в растения не те гены, которые нужны ей, а те, которые нужны нам. Так получился один из основных методов генной модификации растений.
Было много примеров того, как вирусы передавали свои гены разным живым организмам, в том числе растениям и животным. Кстати, в геноме человека есть гены вирусного происхождения. Например, такие гены играют важную роль в формировании плаценты и даже в работе нервной системы. Так что с точки зрения биологии, мы с вами тоже не просто ГМО, а еще и трансгенные организмы. Но с юридической точки зрения, поскольку наши гены изменились не в лаборатории, то на нас можно смело вешать лейбл «Био-Эко-Органик». Это по факту не отменяет того, что во время нашей эволюции случался горизонтальный перенос.
Это по факту не отменяет того, что во время нашей эволюции случался горизонтальный перенос.
Большинство генов передаются вертикально — от родителей к детям. Но случаются в эволюции отдельные события, когда гены переносятся горизонтально — от одного организма к другому. Такие примеры чаще встречаются у бактерий, но их можно найти и у растений, и у животных.
— Может быть, поэтому и столько страшилок вокруг ГМО? Ведь если какой-то вирус умеет встроить в человеческий геном свой ген, то почему бы этого не сделать новым ГМО?
— Мы поедаем гены живых организмов постоянно. Мы съели картошку — и вместе с ней полную ее последовательность генов. Но от этого у нас ботва не выросла, ничего на голове не заколосилось. Для нашей пищеварительной системы совершенно все равно, какую последовательность буковок ей переваривать, обращается она с ними одинаково.
Вероятность того, что в нас встроятся гены из трансгенной картошки, не выше вероятности того, что в нас встроятся гены из картошки «нормальной». И эта вероятность с любой практической точки зрения равна нулю.
И эта вероятность с любой практической точки зрения равна нулю.
Те примеры горизонтального переноса, которые мы знаем, работают по-другому, они не так тривиально устроены: не так, чтобы съел — и генно-модифицировался.
Фото farminguk.comДля нашей пищеварительной системы совершенно все равно, какую последовательность буковок ей переваривать, обращается она с ними одинаково«Самое важное, что удалось сделать в агрокультуре, — вызвать устойчивость к вредителям и вирусам»
— Генная инженерия сейчас — один из двигателей прогресса в медицине?
— Сейчас все обсуждают первую вакцину от коронавируса. Она представляет собой генно-модифицированный вирус, созданный генными инженерами. Оболочку взяли от одного вируса, в нее поместили генетический материал от SARS Cov2 — вот вам и пример применения генной инженерии. Понятно, что эту вакцину еще нужно изучать и проверять на безопасность, потому что ее будут, предположительно, вводить большому количеству людей. Но подобных вакцин очень много.
Но подобных вакцин очень много.
С помощью генной инженерии производятся генно-терапевтические препараты, которые могут бороться с врожденными заболеваниями. Например, таким образом — на основе ГМ-вирусов — создали лекарство от одного из типов гемофилии.
Практически весь инсулин производится на основе генетически модифицированных микроорганизмов — если бы не генная инженерия, людям с диабетом было бы жить гораздо тяжелее, чем сейчас.
— А в сельском хозяйстве в какую сторону в основном двигается генная инженерия?
— Наверное, самое важное, что удалось с ее помощью сделать в агрокультуре — вызвать устойчивость к вредителям и вирусам. Например, без использования ГМО на Гавайях сейчас бы там вымерла папайя. Или, например, был под угрозой вымирания один из самых популярных сортов банана — его уничтожала грибковая инфекция. И тогда ученые внесли в геном банана генетическое изменение — теперь есть сорт, который этой болезни не боится. Есть ГМО-сорта, устойчивые к вредителям, и это помогает не поливать поля огромным количеством инсектицидов, а значит, благотворно отражается на состоянии окружающей среды.
Я читал забавный пример из жизни амишей (религиозное движение, которое в числе прочих запретов полностью отказывается от всевозможных современных технологий, — прим. ред.). Они свои растения на полях выращивают вручную. Проблема вредителей для них одна из самых актуальных — они не могут опрыскивать свои посевы, потому что для этого нужны механические средства. Так вот, некоторые амиши используют генно-модифицированный посадочный материал — семена сортов, не боящихся вредителей. И это вроде как не противоречит их религии. Они отказываются от электричества и металлических машин, их религия запрещает то, что мы бы ассоциировали с механикой. А вот ГМО — пожалуйста.
Фото wikipedia.orgНаверное, самое важное, что удалось с ее помощью сделать в агрокультуре — вызвать устойчивость к вредителям и вирусам
— Почему же тогда «Гринпис» так не любит ГМО?
— Для меня это одна из величайших загадок. Потому что есть масса примеров того, как некоторые ГМО могут быть использованы для защиты окружающей среды, есть даже экологические генно-инженерные проекты. Например, была история про свинку, которая могла меньше загрязнять окружающую среду — она содержала ген, позволявший лучше перерабатывать некоторые соединения фосфора — но «Гринпис» был против.
Например, была история про свинку, которая могла меньше загрязнять окружающую среду — она содержала ген, позволявший лучше перерабатывать некоторые соединения фосфора — но «Гринпис» был против.
По идее они должны были очень избирательно относиться к теме ГМО, говорить: «Вот эти генно-модифицированные организмы мы одобряем, а эти — нет», — причем аргументированно. На практике же мы видим довольно принципиальную позицию против ГМО, выраженную всем движением. И это очень печально на самом деле, потому что это связано не с научными вещами, а с тем, как устроено групповое мышление людей.
— Есть слух о том, что коронавирус — это тоже ГМО…
— Слух заключается в том, что он якобы синтезирован в лаборатории. И этот слух не имеет под собой никаких оснований. Это, по-видимому, один из тех случаев, когда вирус перешел от животных к людям. Мы можем досконально изучить геном этого вируса, есть тысячи прочитанных геномов из разных популяций людей, которые болели коронавирусом. И там нет никаких признаков вмешательства. Конечно, конспиролог может сказать: «Они просто так замаскировали это, чтоб было похоже на естественную эволюцию».
И там нет никаких признаков вмешательства. Конечно, конспиролог может сказать: «Они просто так замаскировали это, чтоб было похоже на естественную эволюцию».
Для меня это разговор того же порядка, что Земле на самом деле 6 тысяч лет, просто Бог закопал в нее кости динозавров, чтобы мы думали, что ему миллиарды или сотни миллионов лет. Нет ничего, что мешало бы естественному появлению этого вируса, как и нет никаких признаков того, что кто-то вмешивался в эту эволюцию искусственно.
«Еще не было случаев, когда человек пострадал бы, съев продукт из ГМО»— Среди противников ГМО бытует еще и такой аргумент, что такие растения будут вытеснять натуральные на полях, и все естественное вымрет, а ГМО захватят Землю.
— Сложно себе представить, чтобы любой культивируемый сорт оказался жизнеспособным без ухода. Вся селекция этих организмов была направлена на то, чтобы поставить их выживание в полную зависимость от человека. Они нуждаются в том, чтоб мы их поливали, удобряли и т. д. Это не дикорастущие организмы. Такие растения не смогут выйти за пределы возделываемых полей, они не выживут без нас. Кроме того, те генные модификации, которые мы вносим, в большинстве не были бы полезны в дикой среде. Например, никакого толка в дикой природе нет от улучшения вкусовых качеств картошки или яблока.
д. Это не дикорастущие организмы. Такие растения не смогут выйти за пределы возделываемых полей, они не выживут без нас. Кроме того, те генные модификации, которые мы вносим, в большинстве не были бы полезны в дикой среде. Например, никакого толка в дикой природе нет от улучшения вкусовых качеств картошки или яблока.
Есть более разумная тема для обсуждения — то, что называется проблемой монокультур. Допустим, у вас есть очень хороший сорт, который дает прекрасную урожайность и производительность. Вы заменяете им все остальные сорта этой культуры (повторюсь, я говорю не о дикорастущих видах, а о культурных растениях), и получается, что все покупают одни и те же семена одной и той же культуры от одного и того же производителя. Это приводит к низкому генетическому разнообразию.
Тогда если появляется новый патоген, хорошо приспособленный к конкретно этому сорту, то он сразу поражает множество площадей во многих странах. Проблему монокультур можно решать заранее — и инструментом этого решения тоже может стать генная инженерия. Она позволяет и устранять проблему отсутствия генетического разнообразия (если она появляется), и создавать растения, устойчивые к конкретным патогенам. Например, та же самая монокультура бананов сорта «Кавендиш», которая оказалась бы жертвой болезни, если бы не генная инженерия.
Она позволяет и устранять проблему отсутствия генетического разнообразия (если она появляется), и создавать растения, устойчивые к конкретным патогенам. Например, та же самая монокультура бананов сорта «Кавендиш», которая оказалась бы жертвой болезни, если бы не генная инженерия.
Проблему монокультур можно решать заранее — и инструментом этого решения тоже может стать генная инженерия
— Есть ли свидетельства опасности или вреда ГМО?
— За всю историю человечества еще не было случаев, когда человек пострадал бы, съев продукт из ГМО.
Единственная история, где генная инженерия была в какой-то степени неблагоприятна для людей, была на самой заре создания генных терапий, когда генно-модифицированные вирусы используются для лечения наследственных заболеваний. Сейчас это очень перспективные технологии с большим количеством положительных результатов. А на первых порах бывали и нежелательные побочные эффекты. Поэтому, как только эта технология появилась, были определенные опасения насчет нее и насчет этих исследований.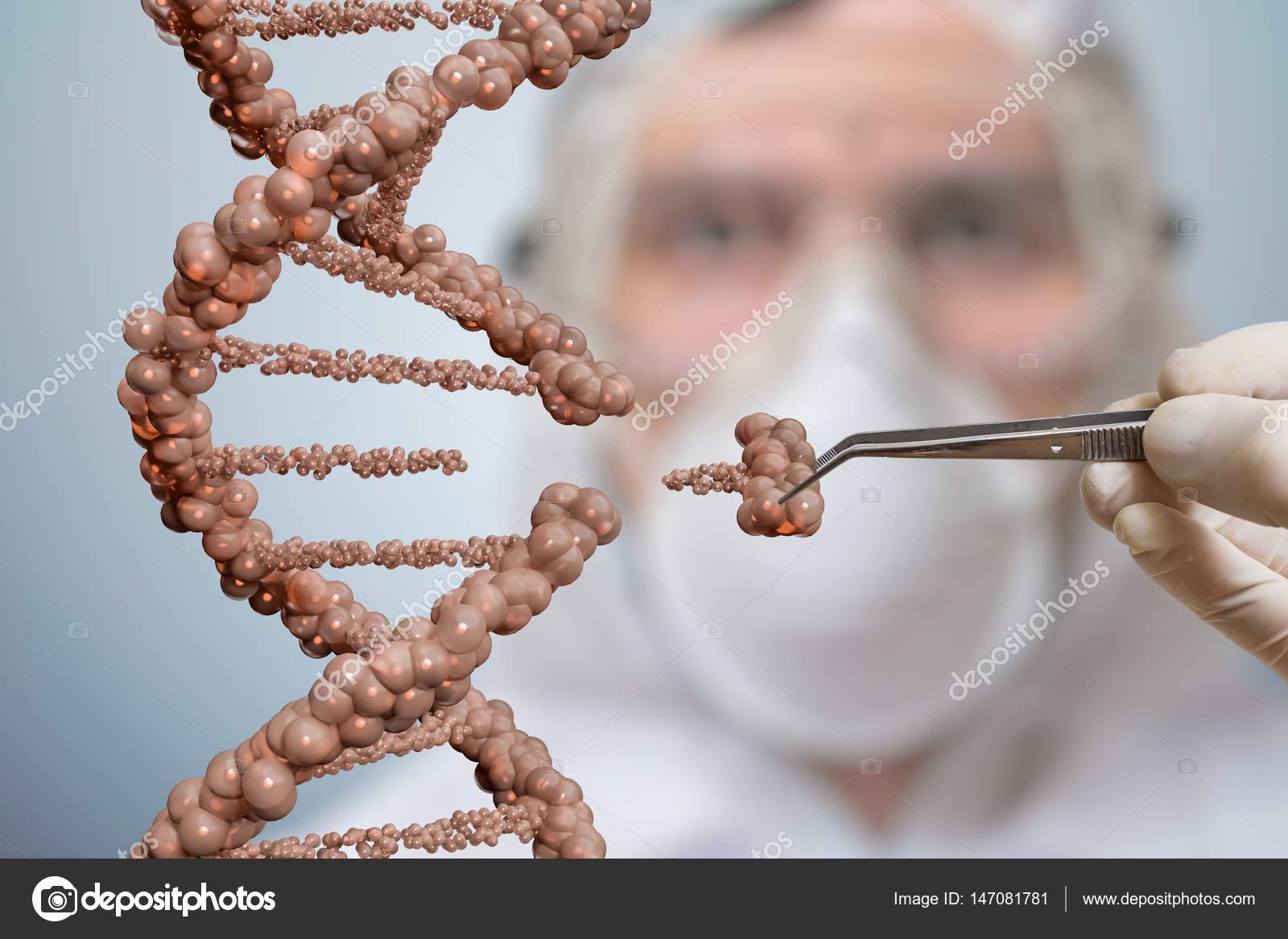 Но ученые уже научились все это делать безопасно. И конечно, есть разница между тем, что вы что-то едите — и между ситуацией, когда вам вирус вводят в кровь. Во втором случае потенциальный риск гораздо больше.
Но ученые уже научились все это делать безопасно. И конечно, есть разница между тем, что вы что-то едите — и между ситуацией, когда вам вирус вводят в кровь. Во втором случае потенциальный риск гораздо больше.
— А как с тем, что была научная статья об увеличении числа онкологических заболеваний у крыс, которые питались ГМО?
— Основная масса идей о том, что ГМО могут вызывать рак, или бесплодие, или другие напасти, берутся из журналистских «уток». Публиковались несколько исследований — единицы — в которых утверждалось о вреде ГМО.
Одну из самых известных таких статей написал француз Жиль-Эрик Сералини. Его работа была подвергнута критике за методологию исследования, и ее в итоге вообще отозвали из научного журнала. Проблема там была в статистическом анализе. Если его провести, оказывается, что никакой разницы между животными, которые употребляли и не употребляли ГМО, нет. Все оказывается в пределах случайной погрешности.
На статью Сералини ссылались все борцы с ГМО, потому что там были еще и фотографии крыс со страшными раковыми опухолями. Но часто умалчивают важную деталь: в своих опытах Сералини использовал специально выведенную линию крыс для онкологических исследований. У таких животных к полутора годам в 45% случаев и безо всякого ГМО развивались раковые опухоли! И, кстати, такие же крысы без ГМО, но с раком, присутствовали в этой работе — но уже без фотографий. Таким образом акцентировали внимание людей: вот, дескать, смотрите, мышка ГМО ела, и вот у нее страшный рак. Но ГМО тут совершенно ни при чем.
Но часто умалчивают важную деталь: в своих опытах Сералини использовал специально выведенную линию крыс для онкологических исследований. У таких животных к полутора годам в 45% случаев и безо всякого ГМО развивались раковые опухоли! И, кстати, такие же крысы без ГМО, но с раком, присутствовали в этой работе — но уже без фотографий. Таким образом акцентировали внимание людей: вот, дескать, смотрите, мышка ГМО ела, и вот у нее страшный рак. Но ГМО тут совершенно ни при чем.
Подобные страшилки и создали образ вредных ГМО.
«Я своими глазами видел плакат с рекламой концерта Стаса Михайлова с надписью «Без ГМО»— Понятно, что сейчас идет истерия. Как она связана с маркетингом?
— Есть конкретные стороны, которые весьма заинтересованы в этих страшилках. Но это не какой-то глобальный заговор, а обычные вещи: есть вот фермер, который производит продукцию без ГМО и хотел бы продавать ее дороже. И когда возникает вопрос, почему у него дороже, он должен всем объяснить: «У них там страшное ГМО, а у меня его нет, поэтому моя сметана стоит в 5 раз дороже».
Я недавно был в США в продуктовом магазине, и там рядом стояли два пакета апельсинового сока. Чтоб вы понимали: генно-модифицированного апельсина в продаже не бывает вообще. Тем не менее на одном из пакетов было написано «Не содержит ГМО». Они были от одного и того же производителя. У них был абсолютно одинаковый состав. Но тот, который «не содержит ГМО», стоил в полтора раза дороже. Это просто вот такой маркетинговый прием: приходит человек, который обеспокоен этими страшилками, и у него есть лишние деньги в кошельке, и он готов платить больше за продукт без ГМО.
Фото yaplakal.comЭто просто вот такой маркетинговый прием: приходит человек, который обеспокоен этими страшилками, и у него есть лишние деньги в кошельке, и он готов платить больше за продукт без ГМО
— Я соль видела без ГМО…
— А есть и вода без ГМО, и презервативы без ГМО, и я своими глазами видел плакат с рекламой концерта Стаса Михайлова, на котором было написано «Без ГМО». Это давно уже маркетинговый бренд. Есть даже бизнес-модели, основанные на таком: «Мы вам продадим БАДы, которые исправляют вред, который нанесли вам ГМО». Так что есть в этом простые заинтересованные лица. А дальше — общая тенденция: страшилки хорошо продаются как новостные инфоповоды.
Это давно уже маркетинговый бренд. Есть даже бизнес-модели, основанные на таком: «Мы вам продадим БАДы, которые исправляют вред, который нанесли вам ГМО». Так что есть в этом простые заинтересованные лица. А дальше — общая тенденция: страшилки хорошо продаются как новостные инфоповоды.
А как можно информационному изданию словить хайпа лучше, кроме как рассказать о какой-то страшной угрозе этому миру? Верит ведь кто-то и в то, что вышки 5G вызывают COVID-19. Точно так же и с ГМО: так устроено групповое мышление. То, что много раз повторено большим количеством людей, воспринимается многими за правду.
— А у нас есть и те, кто на государственном уровне в это верит. У нас же действует закон, запрещающий распространять ГМО?
— Запрет — на выпуск в окружающую среду.
— То есть в лаборатории можно работать?
— Можно работать в лаборатории. А потом, за невозможностью применить на практике ваши прикладные результаты, вы их патентуете, продаете западным компаниям, которые потом это реализуют, а мы — импортируем. По крайней мере я не вижу другого сценария, как это можно сделать.
По крайней мере я не вижу другого сценария, как это можно сделать.
— Получается, сейчас в России генетически модифицированных организмов не выращивают вообще?
— В каких-то промышленных коммерческих количествах — нет, в каких-то частных теплицах научно-исследовательских институтов — да. В России есть специалисты, которые умеют создавать ГМО, причем это очень интересные штуки. Хорошо, что этот запрет не коснулся медицины — хотя выглядит это парадоксально.
Как я уже сказал, некоторые вакцины — это же продукт генной инженерии! То есть с точки зрения наших политиков, вколоть в кровь ГМО — не страшно, а съесть — страшно. Хотя я рад, что хотя бы так. Остаться без важного раздела медицины сейчас было бы страшнее. Но тем не менее этот парадокс забавен.
— Что мы можем купить в магазине в России, что может оказаться генно-модифицированным?
— Картошка, соя, кукуруза. Теоретически (я в этом не уверен) может оказаться папайя (если она с Гавайев — то почти наверняка она ГМО). Кстати, чтобы продемонстрировать маркетинговость этого всего, упомяну еще, что животной продукции ГМО на рынке нет нигде. Единственное исключение — это быстрорастущий лосось, который одобрен к продаже в Канаде. Но если вы зайдете в магазин, то найдете кучу примеров животной продукции — начиная от молока, заканчивая котлетами, на которых будет налеплена наклейка «Не содержит ГМО». Но это чистый маркетинг.
Кстати, чтобы продемонстрировать маркетинговость этого всего, упомяну еще, что животной продукции ГМО на рынке нет нигде. Единственное исключение — это быстрорастущий лосось, который одобрен к продаже в Канаде. Но если вы зайдете в магазин, то найдете кучу примеров животной продукции — начиная от молока, заканчивая котлетами, на которых будет налеплена наклейка «Не содержит ГМО». Но это чистый маркетинг.
Нет в мире молока с ГМО. Нет мяса с ГМО (если только это не колбаса, в которую ГМ-сою добавили).
«Генная инженерия — это не инструмент по созданию сверхлюдей»— Как вы думаете, есть вероятность того, что генетические модификации человека в лаборатории когда-нибудь одобрят?
— Я думаю, это наступит довольно скоро, и в ближайшие десять лет это станет нормальной практикой. Когда-то ведь были дискуссии и сомнения по поводу экстракорпорального оплодотворения и пренатальной диагностики. Это казалось многим чем-то вообще немыслимым, а сейчас это стандартная практика. То же самое в какой-то момент, думаю, станет возможным и с генной инженерией.
То же самое в какой-то момент, думаю, станет возможным и с генной инженерией.
Есть люди, которые родились с заболеванием генетическим, есть — которые без него. Справедливо ли это? Вопрос философский. Но очевидно, хорошо бы, если люди с генетическими проблемами могли бы посредством направленной мутации уравняться со здоровыми людьми
Но тут пока есть техническая проблема: инструменты для генной модификации, с одной стороны, очень хорошо работают, когда мы проверяем, что получилось, а потом из полученных образцов отбираем тот, который нас больше устраивает. Но в случае если мы модифицируем человека, нам надо быть уверенными в том, что не вносим никаких дополнительных мутаций, что мы все сделали хорошо с первого раза. И современные методы генной инженерии к этому очень близки, но не до конца. Еще чуть-чуть!
Как только технологию отладят до совершенства, сделают ее несомненной, тогда, думаю, отпадет и вопрос этики. Ведь почему есть этический вопрос для ученого? Представьте себе, если мы сделаем генно-модифицированного ребенка, и у него будет какое-то заболевание — насколько, во-первых, это будет ужасно для этой семьи и этого ребенка, а во-вторых — насколько это ужасно будет для всего человечества, как сильно это откинет назад доверие к этой технологии. Поэтому ученые очень осторожно выступают за тщательную регуляцию этого процесса.
Поэтому ученые очень осторожно выступают за тщательную регуляцию этого процесса.
С растениями и животными проще: если что-то пошло не так, то мы переделаем. А человека вы не переделаете.
— Вряд ли это будет дешево. Нет ли в этом гипотетической проблемы возникновения впоследствии некоей высшей расы — «идеальных людей», родители которых могут себе позволить модифицировать себе ребенка «под заказ»?
— Во-первых, надо понимать, что генная инженерия — это не инструмент для создания сверхлюдей. Единственное, что мы можем сделать — посмотреть, есть ли мутация, которая присутствует в человеческой популяции, оценить ее (полезная она или вредная) и воспроизвести полезную мутацию в организме, у которого ее нет, или убрать вредную. Есть люди, которые родились с заболеванием генетическим, есть — которые без него. Справедливо ли это? Вопрос философский. Но очевидно, хорошо бы, если люди с генетическими проблемами могли бы посредством направленной мутации уравняться со здоровыми людьми.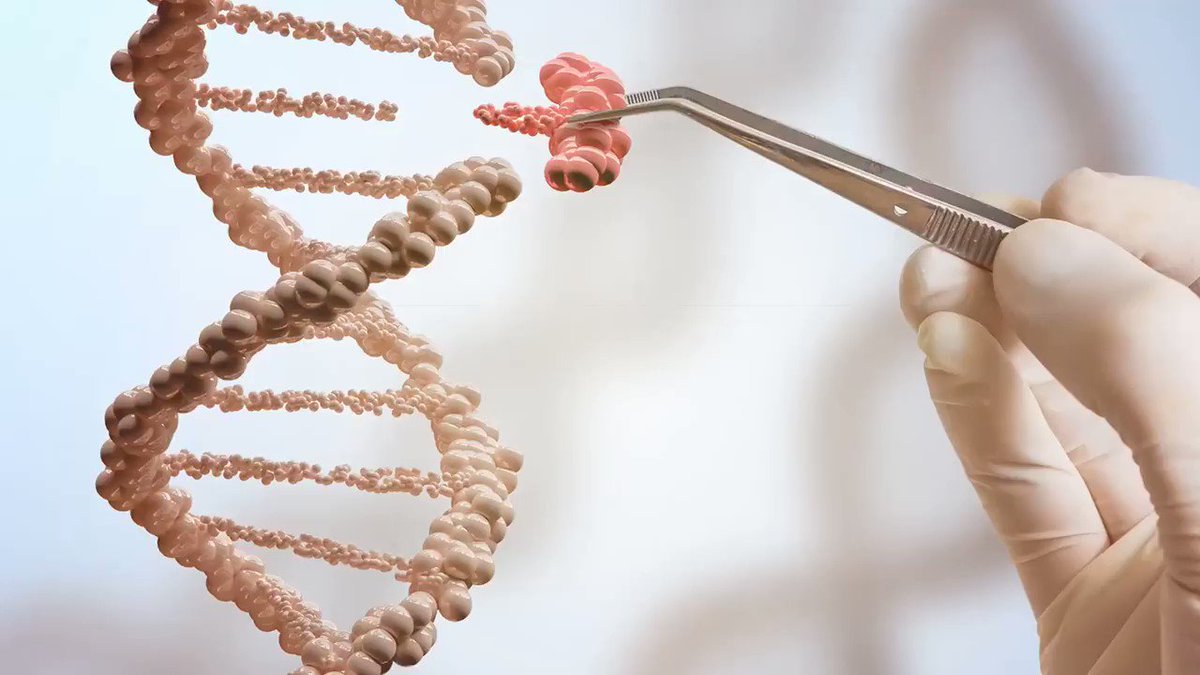
Все исследования, которые идут в этой области сегодня — все это проекты по поиску возможности избежать генетических заболеваний, а вовсе не по созданию «супермена».
— Что нужно сделать, чтобы в России 75% населения верили не во вредность генной инженерии, а в ее пользу?
— Мне кажется, что тема генной инженерии — это одна из тех тем, где большинство людей противники именно из-за незнания простейших биологических вещей. Вроде того, что мутации возникают абсолютно в каждом поколении, и мы все мутанты. Мне кажется, надо это все транслировать, рассказывать, разъяснять максимально широко.
Я бы, конечно, хотел увидеть и изменения в курсе биологии, чтобы школьникам рассказывали о достижениях современной биотехнологии, развеивали актуальные мифы. Это, может быть, утопично с учетом российских реалий. Но то, что мы, научные журналисты и популяризаторы науки, можем сделать — это развеивать заблуждения и хотя бы надеяться на то, что постепенно хорошие идеи вытеснят плохие.
Людмила Губаева
ОбществоМедицинаВсеобщая декларация о геноме человека и правах человека — Декларации — Декларации, конвенции, соглашения и другие правовые материалы
Всеобщая декларация о геноме человека и правах человека
Принята 11 ноября 1997 года Генеральной конференцией Организации Объединенных Наций по вопросам образования, науки и культуры
Генеральная конференция,
напоминая, что в преамбуле Устава ЮНЕСКО провозглашаются «демократические принципы уважения достоинства человеческой личности, равноправия и взаимного уважения людей», а также отказ от любой «доктрины неравенства людей и рас»; что в ней подчеркивается, что «для поддержания человеческого достоинства необходимо широкое распространение культуры и образования среди всех людей на основе справедливости, свободы и мира; поэтому на все народы возлагается в этом отношении священная обязанность, которую следует выполнять в духе взаимного сотрудничества»; что в ней провозглашается, что этот мир «должен базироваться на интеллектуальной и нравственной солидарности человечества», и указывается, что Организация стремится достичь «путем сотрудничества народов всего мира в области образования, науки и культуры международного мира и всеобщего благосостояния человечества, для чего и была учреждена Организация Объединенных Наций, как провозглашает ее Устав»,
торжественно напоминая о своей приверженности всеобщим принципам прав человека, которые провозглашаются, в частности, во Всеобщей декларации прав человека, принятой 10 декабря 1948 г. , и в двух международных пактах Организации Объединенных Наций об экономических, социальных и культурных правах и о гражданских и политических правах, принятых 16 декабря 1966 г., в Конвенции о предупреждении преступления геноцида и наказании за него, принятой 9 декабря 1948 г., в Международной конвенции Организации Объединенных Наций о ликвидации всех форм расовой дискриминации, принятой 21 декабря 1965 г., в Декларации Организации Объединенных Наций о правах умственно отсталых лиц, принятой 20 декабря 1971 г., в Декларации Организации Объединенных Наций о правах инвалидов, принятой 9 декабря 1975 г., в Конвенции Организации Объединенных Наций о ликвидации всех форм дискриминации в отношении женщин, принятой 18 декабря 1979 г., в Декларации основных принципов правосудия для жертв преступлений и злоупотребления властью, принятой 29 ноября 1985 г., в Конвенции Организации Объединенных Наций о правах ребенка, принятой 20 ноября 1989 г., в Правилах Организации Объединенных Наций в отношении обеспечения равенства возможностей для инвалидов, принятых 20 декабря 1993 г.
, и в двух международных пактах Организации Объединенных Наций об экономических, социальных и культурных правах и о гражданских и политических правах, принятых 16 декабря 1966 г., в Конвенции о предупреждении преступления геноцида и наказании за него, принятой 9 декабря 1948 г., в Международной конвенции Организации Объединенных Наций о ликвидации всех форм расовой дискриминации, принятой 21 декабря 1965 г., в Декларации Организации Объединенных Наций о правах умственно отсталых лиц, принятой 20 декабря 1971 г., в Декларации Организации Объединенных Наций о правах инвалидов, принятой 9 декабря 1975 г., в Конвенции Организации Объединенных Наций о ликвидации всех форм дискриминации в отношении женщин, принятой 18 декабря 1979 г., в Декларации основных принципов правосудия для жертв преступлений и злоупотребления властью, принятой 29 ноября 1985 г., в Конвенции Организации Объединенных Наций о правах ребенка, принятой 20 ноября 1989 г., в Правилах Организации Объединенных Наций в отношении обеспечения равенства возможностей для инвалидов, принятых 20 декабря 1993 г. , в Конвенции о запрещении разработки, производства и накопления запасов бактериологического (биологического) и токсинного оружия и об их уничтожении, принятой 16 декабря 1971 г., в Конвенции ЮНЕСКО о борьбе с дискриминацией в области образования, принятой 14 декабря 1960 г., в Декларации принципов международного культурного сотрудничества ЮНЕСКО, принятой 4 ноября 1966 г., в Рекомендации ЮНЕСКО о статусе научно-исследовательских работников, принятой 20 ноября 1974 г., в Декларации ЮНЕСКО о расе и расовых предрассудках, принятой 27 ноября 1978 г., в Конвенции МОТ (№ 111) о дискриминации в области труда и занятий, принятой 25 июня 1958 г., и в Конвенции МОТ (№ 169) о коренных и племенных народах в независимых странах, принятой 27 июня 1989 г.,
, в Конвенции о запрещении разработки, производства и накопления запасов бактериологического (биологического) и токсинного оружия и об их уничтожении, принятой 16 декабря 1971 г., в Конвенции ЮНЕСКО о борьбе с дискриминацией в области образования, принятой 14 декабря 1960 г., в Декларации принципов международного культурного сотрудничества ЮНЕСКО, принятой 4 ноября 1966 г., в Рекомендации ЮНЕСКО о статусе научно-исследовательских работников, принятой 20 ноября 1974 г., в Декларации ЮНЕСКО о расе и расовых предрассудках, принятой 27 ноября 1978 г., в Конвенции МОТ (№ 111) о дискриминации в области труда и занятий, принятой 25 июня 1958 г., и в Конвенции МОТ (№ 169) о коренных и племенных народах в независимых странах, принятой 27 июня 1989 г.,
принимая во внимание, без ущерба для их положений, международные акты, которые могут быть связаны с прикладным использованием генетики в области интеллектуальной собственности, в частности Бернскую конвенцию об охране литературных и художественных произведений, принятую 9 сентября 1886 г. , и Всемирную конвенцию ЮНЕСКО об авторском праве, принятую 6 сентября 1952 г., впоследствии пересмотренные в Париже 24 июля 1971 г., Парижскую конвенцию об охране промышленной собственности, принятую 20 марта 1883 г. и впоследствии пересмотренную в Стокгольме 14 июля 1967 г., Будапештский договор ВОИС о международном признании депонирования микроорганизмов в целях процедуры выдачи патентов, заключенный 28 апреля 1977 г., и Соглашение об аспектах прав интеллектуальной собственности, которые касаются торговли (АДПИК), содержащееся в приложении к Соглашению о создании Всемирной торговой организации, которое вступило в силу 1 января 1995 г.,
, и Всемирную конвенцию ЮНЕСКО об авторском праве, принятую 6 сентября 1952 г., впоследствии пересмотренные в Париже 24 июля 1971 г., Парижскую конвенцию об охране промышленной собственности, принятую 20 марта 1883 г. и впоследствии пересмотренную в Стокгольме 14 июля 1967 г., Будапештский договор ВОИС о международном признании депонирования микроорганизмов в целях процедуры выдачи патентов, заключенный 28 апреля 1977 г., и Соглашение об аспектах прав интеллектуальной собственности, которые касаются торговли (АДПИК), содержащееся в приложении к Соглашению о создании Всемирной торговой организации, которое вступило в силу 1 января 1995 г.,
принимая также во внимание Конвенцию Организации Объединенных Наций о биологическом разнообразии, принятую 5 июня 1992 г., и подчеркивая в этой связи, что признание генетического разнообразия человечества не должно давать повод для какого-либо толкования социального или политического характера, которое могло бы поставить под сомнение «признание достоинства, присущего всем членам человеческой семьи, и равных и неотъемлемых прав их», провозглашаемых в преамбуле Всеобщей декларации прав человека,
напоминая о резолюциях 22 C/13. 1, 23 C/13.1, 24 C/13.1, 25 C/5.2 и 7.3, 27 C/5.15 и 28 C/0.12, 2.1 и 2.2, которые возлагают на ЮНЕСКО обязанность поощрять и развивать анализ этических проблем и принимать соответствующие меры в связи с последствиями научно-технического прогресса в областях биологии и генетики в рамках соблюдения прав человека и основных свобод,
1, 23 C/13.1, 24 C/13.1, 25 C/5.2 и 7.3, 27 C/5.15 и 28 C/0.12, 2.1 и 2.2, которые возлагают на ЮНЕСКО обязанность поощрять и развивать анализ этических проблем и принимать соответствующие меры в связи с последствиями научно-технического прогресса в областях биологии и генетики в рамках соблюдения прав человека и основных свобод,
признавая, что научные исследования по геному человека и практическое применение их результатов открывают безграничные перспективы для улучшения здоровья отдельных людей и всего человечества, подчеркивая вместе с тем, что такие исследования должны основываться на всестороннем уважении достоинства, свобод и прав человека, а также на запрещении любой формы дискриминации по признаку генетических характеристик,
провозглашает следующие принципы и принимает настоящую Декларацию.
А. Человеческое достоинство и геном человека
Статья 1
Геном человека лежит в основе изначальной общности всех представителей человеческого рода, а также признания их неотъемлемого достоинства и разнообразия. Геном человека знаменует собой достояние человечества.
Геном человека знаменует собой достояние человечества.
Статья 2
а) Каждый человек имеет право на уважение его достоинства и его прав, вне зависимости от его генетических характеристик.
b) Такое достоинство непреложно означает, что личность человека не может сводиться к его генетическим характеристикам, и требует уважения его уникальности и неповторимости.
Статья 3
Геном человека в силу его эволюционного характера подвержен мутациям. Он содержит в себе возможности, которые проявляются различным образом в зависимости от природной и социальной среды каждого человека, в частности состояния здоровья, условий жизни, питания и образования.
Статья 4
Геном человека в его естественном состоянии не должен служить источником извлечения доходов.
В. Права соответствующих лиц
Статья 5
a) Исследования, лечение или диагностика, связанные с геномом какого-либо человека, могут проводиться лишь после тщательной предварительной оценки связанных с ними потенциальных опасностей и преимуществ и с учетом всех других предписаний, установленных национальным законодательством.
b) Во всех случаях следует заручаться предварительным, свободным и ясно выраженным согласием заинтересованного лица. Если оно не в состоянии его выразить, то согласие или разрешение должны быть получены в соответствии с законом, исходя из высших интересов этого лица.
c) Должно соблюдаться право каждого человека решать быть или не быть информированным о результатах генетического анализа и его последствиях.
d) В случае исследований их документальные результаты следует представлять на предварительную оценку согласно соответствующим национальным и международным нормам или руководящим принципам.
e) Если какое-либо лицо не в состоянии выразить в соответствии с законом своего согласия, исследования, касающиеся его генома, могут быть проведены лишь при условии, что они непосредственным образом скажутся на улучшении его здоровья и что будут получены разрешения и соблюдены меры защиты, предусматриваемые законом.
Исследования, не позволяющие ожидать какого-либо непосредственного улучшения здоровья, могут проводиться лишь в порядке исключения, с максимальной осторожностью, таким образом, чтобы заинтересованное лицо подвергалось лишь минимальному риску и испытывало минимальную нагрузку, при условии, что эти исследования проводятся в интересах здоровья других лиц, принадлежащих к той же возрастной группе или обладающих такими же генетическими признаками, с соблюдением требований, предусматриваемых законом, а также с обеспечением совместимости этих исследований с защитой прав данного лица.
Статья 6
По признаку генетических характеристик никто не может подвергаться дискриминации, цели или результаты которой представляют собой посягательство на права человека, основные свободы и человеческое достоинство.
Статья 7
Конфиденциальность генетических данных, которые касаются человека, чья личность может быть установлена, и которые хранятся или подвергаются обработке в научных или любых других целях, должна охраняться в соответствии с законом.
Статья 8
Каждый человек в соответствии с международными правом и национальным законодательством имеет право на справедливую компенсацию того или иного ущерба, причиненного в результате непосредственного и детерминирующего воздействия на его геном.
Статья 9
В целях защиты прав человека и основных свобод ограничения, касающиеся принципов согласия и конфиденциальности, могут вводиться лишь в соответствии с законом по крайне серьезным причинам и в рамках международного публичного права и международного права в области прав человека.
С. Исследования, касающиеся генома человека
Статья 10
Никакие исследования, касающиеся генома человека, равно как и никакие прикладные исследования в этой области, особенно в сферах биологии, генетики и медицины, не должны превалировать над уважением прав человека, основных свобод и человеческого достоинства отдельных людей или, в соответствующих случаях, групп людей.
Статья 11
Не допускается практика, противоречащая человеческому достоинству, такая, как практика клонирования в целях воспроизводства человеческой особи. Государствам и компетентным международным организациям предлагается сотрудничать с целью выявления такой практики и принятия на национальном и международном уровнях необходимых мер в соответствии с принципами, изложенными в настоящей Декларации.
Статья 12
a) Следует обеспечивать всеобщий доступ к достижениям науки в области биологии, генетики и медицины, касающимся генома человека, при должном уважении достоинства и прав каждого человека.
b) Свобода проведения научных исследований, которая необходима для развития знаний, является составной частью свободы мысли. Цель прикладного использования результатов научных исследований, касающихся генома человека, особенно в области биологии, генетики и медицины, заключается в уменьшении страданий людей и в улучшении состояния здоровья каждого человека и всего человечества.
D. Условия осуществления научной деятельности
Статья 13
Ответственность, являющаяся неотъемлемой частью деятельности научных работников — в том числе требовательность, осторожность, интеллектуальная честность и непредвзятость — как при проведении научных исследований, так и при представлении и использовании их результатов, должна быть предметом особого внимания, когда речь идет об исследованиях, касающихся генома человека, с учетом их этических и социальных последствий. Лица, принимающие в государственном и частном секторах политические решения в области науки, также несут особую ответственность в этом отношении.
Статья 14
Государствам следует принимать соответствующие меры, способствующие созданию интеллектуальных и материальных условий, благоприятствующих свободе проведения научных исследований, касающихся генома человека, и учитывать при этом этические, правовые, социальные и экономические последствия таких исследований в свете принципов, изложенных в настоящей Декларации./dna-structure-562597795-5ae77532c06471003681d684.jpg)
Статья 15
Государствам следует принимать соответствующие меры, обеспечивающие рамки для беспрепятственного осуществления научных исследований, касающихся генома человека, с должным учетом изложенных в настоящей Декларации принципов, чтобы гарантировать соблюдение прав человека и основных свобод и уважение человеческого достоинства, а также охрану здоровья людей. Такие меры должны быть направлены на то, чтобы результаты этих исследований использовались только в мирных целях.
Статья 16
Государствам следует признать важное значение содействия на различных соответствующих уровнях созданию независимых, многодисциплинарных и плюралистических комитетов по этике для оценки этических, правовых и социальных вопросов, которые возникают в связи с проведением научных исследований, касающихся генома человека, и использованием результатов таких исследований.
Е. Солидарность и международное сотрудничество
Статья 17
Государствам следует практиковать и развивать солидарность с отдельными людьми, семьями и группами населения, которые особенно уязвимы в отношении заболеваний или недостатков генетического характера либо страдают ими. Государствам следует, в частности, содействовать проведению научных исследований, направленных на выявление, предотвращение и лечение генетических заболеваний или заболеваний, вызванных воздействием генетических факторов, в особенности редких заболеваний, а также заболеваний эндемического характера, от которых страдает значительная часть населения мира.
Государствам следует, в частности, содействовать проведению научных исследований, направленных на выявление, предотвращение и лечение генетических заболеваний или заболеваний, вызванных воздействием генетических факторов, в особенности редких заболеваний, а также заболеваний эндемического характера, от которых страдает значительная часть населения мира.
Статья 18
Государствам следует, должным и надлежащим образом учитывая изложенные в настоящей Декларации принципы, прилагать все усилия к дальнейшему распространению в международном масштабе научных знаний о геноме человека, разнообразии человеческого рода и генетических исследованиях, а также укреплять международное научное и культурное сотрудничество в этой области, в особенности между промышленно развитыми и развивающимися странами.
Статья 19
а) В рамках международного сотрудничества с развивающимися странами государствам следует поощрять меры, которые позволяют:
i) осуществлять оценку опасностей и преимуществ, связанных с проведением научных исследований, касающихся генома человека, и предотвращать злоупотребления;
ii) расширять и укреплять потенциал развивающихся стран в области проведения научных исследований по биологии и генетике человека с учетом конкретных проблем этих стран;
iii) развивающимся странам пользоваться достижениями научного и технического прогресса, дабы применение таких достижений в интересах их экономического и социального прогресса осуществлялось ради всеобщего блага;
iv) поощрять свободный обмен научными знаниями и информацией в областях биологии, генетики и медицины.
b) Соответствующим международным организациям следует оказывать поддержку и содействие инициативам, предпринимаемым государствами в вышеозначенных целях.
F. Содействие изложенным в Декларации принципам
Статья 20
Государствам следует принимать соответствующие меры с целью содействия изложенным в настоящей Декларации принципам на основе образования и использования соответствующих средств, в том числе на основе осуществления научных исследований и подготовки в многодисциплинарных областях, а также на основе оказания содействия образованию в области биоэтики на всех уровнях, в особенности предназначенному для лиц, ответственных за разработку политики в области науки.
Статья 21
Государствам следует принимать соответствующие меры, направленные на развитие других форм научных исследований, подготовки кадров и распространения информации, содействующих углублению осознания обществом и всеми его членами своей ответственности перед лицом основополагающих проблем, связанных с необходимостью защитить достоинство человека, которые могут возникать в свете проведения научных исследований в биологии, генетике и медицине, а также прикладного использования их результатов. Им также следует содействовать открытому обсуждению в международном масштабе этой тематики, обеспечивая свободное выражение различных мнений социально-культурного, религиозного или философского характера.
Им также следует содействовать открытому обсуждению в международном масштабе этой тематики, обеспечивая свободное выражение различных мнений социально-культурного, религиозного или философского характера.
G. Осуществление Декларации
Статья 22
Государствам следует активно содействовать изложенным в настоящей Декларации принципам, а также способствовать их осуществлению всеми возможными средствами.
Статья 23
Государствам следует принимать соответствующие меры для содействия посредством образования, подготовки и распространения информации соблюдению вышеизложенных принципов и способствовать их признанию и действенному применению. Государствам следует также способствовать обменам между независимыми комитетами по этике и их объединению в сети по мере их создания для развития всестороннего сотрудничества между ними.
Статья 24
Международному комитету ЮНЕСКО по биоэтике следует способствовать распространению принципов, изложенных в настоящей Декларации, и дальнейшему изучению вопросов, возникающих в связи с их претворением в жизнь и развитием соответствующих технологий. Ему следует организовывать необходимые консультации с заинтересованными сторонами, такими, как уязвимые группы населения. Комитету, в соответствии с уставными процедурами ЮНЕСКО, следует готовить рекомендации для Генеральной конференции и высказывать мнение о ходе претворения в жизнь положений Декларации, особенно в том, что касается практики, которая может оказаться несовместимой с человеческим достоинством, например, случаев воздействия на потомство.
Статья 25
Никакие положения настоящей Декларации не могут быть истолкованы таким образом, чтобы служить какому-либо государству, группе людей или отдельному человеку в качестве предлога для осуществления ими каких-либо действий или любых акций, несовместимых с правами человека и основными свободами, включая принципы, изложенные в настоящей Декларации.
навстречу дивному новому миру? Городской завтрак РСМД в библиотеке Достоевского
Насколько оправданы эксперименты над людьми на текущей стадии развития технологий редактирования генома? Поможет ли генная модификация решить проблемы ВИЧ и других заболеваний? Как регулируется редактирование генома на международном уровне? Существует ли вероятность того, что в некоторых странах будет снят запрет на клонирование человека?
Эти и другие вопросы обсудят эксперты РСМД в ходе городского завтрака Úrbi et órbi 17 апреля в 10:00 в библиотеке им. Ф.М. Достоевского.
В ноябре 2018 г. китайские ученые из Южного университета науки и технологий в Шэньчжэне сообщили, что помогли появиться на свет первым детям с отредактированным геномом — девочкам-близняшкам. По словам доктора Хэ Цзянькуя, руководившего группой исследователей, целью изменения эмбрионов было наделить детей невосприимчивостью к ВИЧ. В то же время редактирование эмбриональных клеток, яйцеклеток, сперматозоидов запрещено в большинстве стран мира из-за рисков, которые оно может нести для потомков «отредактированного» человека. Эксперимент вызвал ожесточенную полемику в научном сообществе, в частности доктора Хэ обвинили в нарушении моральных и этических норм.
Насколько оправданы эксперименты над людьми на текущей стадии развития технологий редактирования генома? Поможет ли генная модификация решить проблемы ВИЧ и других заболеваний? Как регулируется редактирование генома на международном уровне? Существует ли вероятность того, что в некоторых странах будет снят запрет на клонирование человека?
Эти и другие вопросы обсудят эксперты РСМД в ходе городского завтрака Úrbi et órbi 17 апреля в 10:00 в библиотеке им. Ф.М. Достоевского.
Спикеры:
Владимир Губайловский, научный редактор образовательно-просветительского проекта Laba.Media,
Елена Гребенщикова, руководитель Центра научно-информационных исследований по науке, образованию и технологиям ИНИОН РАН,
Елена Введенская, доцент кафедры биоэтики, Российский национальный исследовательский медицинский университет имени Н.И. Пирогова.
Завтрак проводится совместно с образовательно-просветительским проектом Laba.Media.
Информационный партнер городских завтраков Úrbi et órbi – журнал «Международная жизнь».
Трансляция
Модификация человеческих генов — это почти реальность / Хабр
Главный редактор MIT Technology Review Антонио Регаладо
пообщалсяс сотрудниками Гарвардской медицинской школы, которые специализируются на разработке способов генных модификаций. Главный вывод, к которому он пришёл, таков: вмешательство в ДНК человека — это уже скорее вопрос этики, чем научная проблема. Какие вмешательства допустимы и к чему они могут привести? Готово ли общество к тому, что человека можно будет конструировать ещё до его рождения? И как скоро сюжет фильма «Гаттака» станет обыденной реальностью?
Молодой сотрудник Гарварда доктор Лухан Янг (Luhan Yang), одна из ключевых фигур в разработке метода генетической манипуляции
CRISPR-Cas9, недавно основала биотехнологическую компанию, которая занимается изменением геномов крупного рогатого скота. Он говорит, что этот же метод может быть использован для модификации генов человека. Например, сейчас ничто не мешает учёным заменить дефектный ген, ответственный за появление у человека серповидно-клеточной анемии или болезни Альцгеймера.
Несмотря на имеющиеся недостатки, CRISPR уже успешно применяется не только для домашних животных, а и для приматов. Например, гены пары макак были изменены в прошлом году с целью регуляции их метаболизма и производства стволовых клеток. Обезьянки родились здоровыми, но для проверки успешности генной модификации должно пройти три года, прежде чем они достигнут половой зрелости. Сейчас, как говорят генетики Гарварда, в их распоряжении находятся примерно 20 эмбрионов обезьян, так что ожидаемое время таких же манипуляций с ДНК человека они оценивают в 10-20 лет.
Именно при помощи CRISPR-Cas9 совсем недавно группа учёных под руководством профессора института Солка (США) Хуана Бельмонте (Juan Carlos Izpisua Belmonte) провела успешный эксперимент по удалению фрагментов вируса иммунодефицита из ДНК человека. В вирусной ДНК были установлены специальные маркеры в виде молекул РНК, отмечающие фрагменты для удаления. Этот метод протестировали на лимфоцитах и прочих клетках иммунной системы, зараженных ВИЧ. Первая версия РНК-маркеров смогла удалить вирус и его следы в 72% клеток. Уничтожены были как «свежие» ДНК вируса, так и его «спящие» копии.
Недавнее социологическое исследование в США показало, что современное общество в целом готово к подобным манипуляциям. Взрослым задавали вопрос — согласны ли они на то, что с генами их ребёнка будет выполнена генетическая модификация с тем, чтобы он стал «умнее» и был бы менее подвержен серьёзным заболеваниям. Значительное число респондентов высказались положительно:
, что будет дальше с редактированием генов человека
За три месяца, прошедшие с тех пор, как Хэ Цзянькуй объявил о рождении девочек-близнецов с отредактированными геномами, вопросы, стоящие перед научным сообществом, стали еще более запутанными.
Разработав мутации в человеческих эмбрионах, которые затем использовались для производства младенцев, Он капризно вступил в эпоху, когда наука могла переписать генофонд будущих поколений, изменив человеческую зародышевую линию. Он также попирал установленные нормы безопасности и защиты людей на своем пути.
До сих пор нет убедительных доказательств того, что биофизику действительно удалось изменить гены девочек или третьего ребенка, который, как ожидается, родится позже в этом году. Но эксперименты привлекли столько внимания, что инцидент может изменить исследования на долгие годы.
Китайские власти все еще исследуют Хэ, а университеты США задают вопросы некоторым ученым, с которыми он консультировался. Между тем призывы к международному мораторию на связанные эксперименты, которые могут повлиять на фундаментальные исследования, побудили некоторых ученых поддержать аргументы в пользу редактирования генома.
Некоторые обеспокоены тем, как общественное внимание повлияет на будущее области, независимо от того, стремятся ли исследователи изменить зародышевую линию или нет. «Негативный фокус, конечно, нехорош», — говорит Фредрик Ланнер, специалист по стволовым клеткам из больницы Каролинского университета в Стокгольме, который редактировал гены в человеческих эмбрионах, чтобы изучить, как клетки регулируют себя.
Но другие предсказывают, что дело Хэ может продвинуть вперед редактирование человеческих генов. Джонатан Киммельман, специалист по биоэтике, специализирующийся на испытаниях генной терапии на людях из Университета Макгилла в Монреале, Канада, утверждает, что решительные действия после скандала могут ускорить глобальное сотрудничество в области науки и надзора за ней.«Это будет стимулировать, а не препятствовать значительному прогрессу в этой области», — говорит он.
Здесь Nature исследует четыре вопроса, которые все еще не решены в связи с рождением ребенка.
Что будет с Ним и детьми?
Его критиковали, но не только за то, что он занимался редактированием зародышевой линии. Он также не позаботился о проведении надлежащих испытаний на безопасность и не соблюдал стандартные процедуры при отборе участников. Впоследствии он был осужден министерством здравоохранения провинции Гуандун, где он работал, и был уволен из университета.Он не ответил на многочисленные попытки Nature связаться с ним.
На этом этапе дальнейшие наказания, похоже, находятся в руках полиции. Ему может быть предъявлен ряд уголовных обвинений. При наборе участников он и его команда согласились покрыть расходы на лечение бесплодия и связанные с этим расходы до 280 000 юаней (42 000 долларов США). Он также оговорил, что участники должны будут возместить расходы, если они выбыли. Лю Е, юрист Шанхайской юридической фирмы Haishang, говорит, что если такие выплаты будут считаться принудительными мерами, они могут составить преступление.Провинция Гуандун также обнаружила, что он использовал поддельные документы по этической проверке во время набора участников и обменивал образцы крови, чтобы обойти законы, запрещающие людям с ВИЧ использовать вспомогательные репродуктивные технологии.
Он утверждает, что отключил ген под названием CCR5 , который кодирует белок, позволяющий ВИЧ проникать в клетки. Он стремился имитировать мутацию, которая существует примерно у 10% европейцев и помогает защитить их от ВИЧ-инфекции. Но он мог непреднамеренно вызвать мутации в других частях генома, что могло иметь непредсказуемые последствия для здоровья.(Он утверждает, что таких мутаций не обнаружил.) Также считается, что CCR5 помогает людям бороться с последствиями различных других инфекций, таких как вирус Западного Нила. Если ген отключен, девочки могут оказаться уязвимыми. Если они действительно страдают так, как это связано с процедурой Хэ, и будет установлено, что он занимался медициной незаконно, его могут приговорить к тюремному заключению на срок от трех до десяти лет, говорит Чжан Пэн, специалист по уголовному праву из Пекинского Вузи. Университет. Но на выявление этих последствий для здоровья могут потребоваться годы.
Он пообещал следить за девочками, пока им не исполнится 18 лет, но маловероятно, что министерство здравоохранения, приказавшее Ему прекратить заниматься наукой, позволит ему участвовать в оценках. Неизвестно, какие специальные меры принимаются, если таковые имеются, для охраны здоровья девочек или для отслеживания другой беременности.
А как насчет других ученых?
Вскоре после того, как Он рассказал о своем эксперименте, стало ясно, что он действовал не один или тайно.Ответственность других исследователей, которые были в курсе дела, стала предметом горячих споров.
Старшим исследователем, наиболее глубоко знакомым с этой работой, является Майкл Дим, биофизик из Университета Райса в Хьюстоне, штат Техас. Дим когда-то был советником Хэ и членом научного консультативного совета основанной им компании по секвенированию генома из Шэньчжэня. Сообщается, что Дим был также старшим автором статьи, которая до сих пор не опубликована, с описанием экспериментов Хэ, и, как сообщается, присутствовал при наборе участников.Какая у него была роль, не ясно. Адвокаты Дима признают, что Дим иногда комментирует документы Хэ. Но они настаивают на том, что Дим не занимается исследованиями на людях и не делал этого для этого проекта. Они говорят, что он не присутствовал на приеме на работу или собраниях с информированным согласием, не разрешал использовать свое имя в качестве автора в любой работе по редактированию генов человека и не был старшим автором этой статьи. Университет Райса расследует причастность Дима.
Других ученых наказали за то, что они ничего не сделали, чтобы поднять тревогу по поводу своей работы.Хэ Цзянькуй рассказал многим американским ученым о том, чем он занимается, в том числе троим из Стэнфордского университета в Калифорнии и Крейгу Мелло, лауреату Нобелевской премии по молекулярной биологии Медицинской школы Массачусетского университета в Вустере, который был советником компании, основанной пользователя He. Большинство из них говорят, что посоветовали Ему не продолжать.
Мелло говорит, что он устроил на него засаду во время перерыва на заседании консультативного совета, чтобы рассказать ему о своих планах, а затем уведомил его о беременности по электронной почте.«Я сразу же выразил свое беспокойство и осуждение», — говорит Мелло.
Но Натали Кофлер, молекулярный биолог из Йельского университета в Нью-Хейвене, штат Коннектикут, утверждает, что исследователи, которые знали об этом, должны были сделать больше. По ее словам, весь этот эпизод свидетельствует о растущем разрыве между ценностями, провозглашаемыми учеными, и теми, которые они фактически отстаивают. Киммельман разделяет эти опасения и говорит, что, сохраняя молчание, ученые рискуют создать «латентный период», в течение которого опасные практики могут возникать и развиваться в вакууме.«Людям часто требуется фиаско, чтобы понять, что молчание часто может быть формой соучастия», — говорит он.
Стэнфордский биолог по стволовым клеткам Мэтью Портеус говорит, что он не высказался по трем причинам: он думал, что отговорил Он, он хотел уважать его просьбу о конфиденциальности, и он не знал, где и как сообщить то, что он услышал . Другие приводят аналогичные причины.
Альта Чаро, специализирующаяся в области права и биоэтики в Университете Висконсин-Мэдисон, соглашается с тем, что неясно, как кто-либо из этих людей мог эффективно дать сигнал.Если бы исследование проводилось в Соединенных Штатах, ученый мог бы связаться с Управлением по защите научных исследований человека или Управлением честности исследований. Но у Китая другие ценности и непрозрачные правила. «Если это происходит где-то еще, ученый может быть совершенно не знаком с нормами и законами этой зарубежной страны», — говорит Чаро.
Она говорит, что это может измениться, если научное сообщество выполнит планы, намеченные на саммите по редактированию генов, состоявшемся в Гонконге в ноябре — единственном научном форуме, на котором Он представил свою работу.В планах предлагается некий транснациональный консультативный орган и реестр для выявления общих норм и различий во мнениях между странами. Другие организации также рассматривают меры. Например, ранее в этом месяце Всемирная организация здравоохранения объявила о создании международного комитета для разработки руководящих принципов редактирования генов человека. Впервые оно соберется в марте (см. «Редактирование генов человека»).
Редактирование генов человека
Март 2015 г .: Китайские исследователи первыми отредактировали гены эмбриона человека.
Июнь 2016 г .: Хэ Цзянькуй запускает проект по редактированию генов в человеческих эмбрионах с целью живорождения.
Март 2017 г .: Он начинает набирать пары (каждая с ВИЧ-положительным отцом) для экспериментов.
Начало ноября 2018 г .: Сообщается, что рождаются девочки-близнецы, отредактированные генами, и установлена вторая беременность с третьим эмбрионом, отредактированным генами.
25–26 ноября 2018 г .: MIT Technology Review показывает наличие исследовательской программы; Ассошиэйтед Пресс быстро предает гласности историю рождения девочек.
28 ноября 2018 г .: Он предлагает подробности о своей работе на саммите по редактированию генов в Гонконге и подвергается резкой критике.
Ноябрь – декабрь 2018 г .: Национальная комиссия здравоохранения Китая приказывает провести расследование деятельности Хэ.
Январь 2019 г .: Министерство здравоохранения провинции Гуандун вынесло ему осуждение и уволило его из университета.
18 марта 2019 г .: Комитет Всемирной организации здравоохранения соберется для разработки руководящих принципов редактирования генов человека.
Август 2019 г .: Ожидается третий генно-отредактированный ребенок.
Как Его действия могут повлиять на другие исследования?
Четыре года назад группа ученых из Гуанчжоу опубликовала статью 1 , описывающую использование методов редактирования генов в человеческом эмбрионе. Исследователи использовали эмбрионы с мутацией, которая предотвратила их превращение в зародыш. Тем не менее, это было потрясающее исследование, и сразу же возникли вопросы о редактировании зародышевой линии.
В течение следующих двух лет несколько групп — из Китая, США и Великобритании — опубликовали результаты 2 — 4 подобных экспериментов. Исследования перешли от использования нежизнеспособных эмбрионов к использованию эмбрионов, которые предположительно можно было бы имплантировать. Некоторые тестировали новые методы редактирования генов или комбинировали редактирование генов с клонированием. Другие подтвердили способность редактирования генов исправлять мутации, связанные с генетическим заболеванием, и проанализировали гены, важные для раннего развития эмбриона, в том числе некоторые из них, причастные к неудачам при некоторых беременностях.
В ходе экспериментов были выданы предупреждения. Хотя задействованные ученые рекламировали свою работу как тщательное фундаментальное исследование, многие специалисты по этике видели только один возможный результат: клиническое применение, мало чем отличающееся от того, что, по его словам, было сделано. После фиаско с Хэ столкнутся ли те, кто проводит эксперименты с эмбрионами, негативную реакцию?
Некоторые думают, что возмущение Его действиями пройдет раньше, чем это произойдет. «Новостные циклы в наши дни такие короткие», — говорит Киммельман. «Я был бы удивлен, если в результате этого возникнут серьезные сбои в исследованиях.
Но Шухрат Миталипов, биолог-репродуктолог из Орегонского университета здоровья и науки в Портленде, опасается, что разногласия могут повлиять на такие факторы, как финансирование и разрешения регулирующих органов. Миталипов работает над способами восстановления мутировавших генов в человеческих эмбрионах и надеется, что однажды этот подход можно будет использовать для устранения наследственных заболеваний. Правительство США запрещает федеральное финансирование таких экспериментов, но Миталипову и нескольким другим американским исследователям удалось найти другие грантовые деньги для своей работы.Сейчас Миталипов осторожен. «Возможно, еще рано оценивать обратную реакцию», — говорит он. «Конечно, этот случай не помог».
Некоторые ученые призвали к глобальному мораторию на все исследования, связанные с генами человеческих эмбрионов, независимо от того, будут ли эмбрионы впоследствии имплантированы. Есть опасения, что любое такое исследование может привести к другим преждевременным попыткам. «Как мы ясно узнали из Китая, ничто не мешает кому-то стать мошенником», — говорит Федор Урнов, исследователь Института инновационной геномики Калифорнийского университета в Беркли.Он утверждает, что такие попытки могут испортить другие безопасные и этичные способы использования редактирования генов, такие как его усилия по исправлению мутаций во взрослых клетках, которые не повлияли бы на зародышевую линию. «Я категорически за полный мораторий на редактирование эмбрионов», — говорит он.
Импульс вырос из-за своего рода международного моратория, и влиятельные фигуры, такие как Фрэнсис Коллинз, директор Национального института здравоохранения США, высказались в поддержку одного из них. В некоторых странах, в том числе в Канаде, уже есть политика, запрещающая использование редактирования генов человеческого эмбриона, даже если нет намерения имплантировать эмбрион (см. «Правовой ландшафт»).
Будущее редактирования эмбрионов, особенно с целью произвести на свет детей, может зависеть от дебатов по поводу необходимости этого. Многие скептики отмечают, что, хотя редактирование генов может помочь избежать передачи некоторых заболеваний, многих из этих состояний уже можно избежать с помощью техники, известной как предимплантационная генетическая диагностика (ПГД), при которой эмбрионы, созданные в результате оплодотворения in vitro , проверяются на предмет выявления специфические мутации.
Но после скандала с He некоторые видные ученые и биоэтики вступили в битву за редактирование генов.В трех статьях 5 — 7 , опубликованных ранее в этом году, Джордж Дейли, Робин Ловелл-Бэдж, Джули Стеффанн и Чаро высказались в поддержку его как необходимой альтернативы ПГД, когда эмбрионов слишком мало, чтобы найти подходящий. для имплантации, и в редких случаях, когда у обоих родителей есть две копии мутации болезни. В некоторых случаях редактирование генов может быть единственным способом обеспечить успешное лечение бесплодия, говорит специалист по биоэтике Тэцуя Исии из Университета Хоккайдо в Саппоро, Япония.
Где родятся следующие дети CRISPR?
Хотя его планы заручиться поддержкой своего проекта провалились, никто не сомневается, что таких индивидуалистов, как он, будет больше. Техника проста; некоторые из его приложений убедительны; и гласность может быть огромной. Но где и при каких обстоятельствах мог быть зачат еще один генетически отредактированный ребенок, остается только гадать.
Китай был бы очевидным выбором, поскольку произвел большинство генетически отредактированных человеческих эмбрионов для исследований.В стране также неоднозначная позиция в отношении редактирования генов.
Но, судя по удалению ссылок на него с правительственных веб-сайтов и цензуре в социальных сетях, таких как WeChat, его действия, похоже, поставили Китай в неловкое положение. (Это была одна из десяти наиболее подвергнутых цензуре тем в 2018 году.) Его действия могут подтолкнуть Китай к разработке новых нормативных актов и более эффективному институциональному надзору, говорит Ли Тернер, специалист по биоэтике из Университета Миннесоты в Миннеаполисе. В декабре министерство образования призвало университеты выяснить, не занимается ли кто-либо из их исследователей спорной деятельностью по редактированию генов.Ежегодные законодательные собрания Китая начинаются 3 марта, так что уже не за горами принятие более строгих законов.
Но есть много мест с неаккуратной политикой в отношении новых биомедицинских технологий. Исии обследовал страны, в которых есть клиники, предлагающие заместительную митохондриальную терапию (МЗТ) — противоречивую процедуру, которая использовалась для исправления генетических дефектов и повышения успешности беременностей. МРТ запрещена во многих странах из-за сомнений в ее безопасности, но Исии определил клиники, предлагающие эту процедуру, в России, Украине, Испании, Албании и Израиле.В большинстве из них также действуют слабые правила редактирования генов, поэтому клиники могут начать предлагать непроверенные услуги любопытным родителям в любое время. «Кандидатов так много», — говорит он.
Киммельман подозревает, что следующий индивидуалист выйдет из большой страны: чем больше ученых, тем больше шансов на «аномальное» поведение. По его словам, это, вероятно, будет нация, которая не имеет прочной научной основы. «Стимулы для такого трюка, как [Он], вероятно, меньше в стране, где есть более ясные и легкие пути к научному статусу.”
Или, возможно, исследователь или врач из более развитой и строго регулируемой страны поедет куда-нибудь, чтобы произвести на свет ребенка с отредактированным геном. Это произошло с МРТ, когда врач из Нью-Йорка поехал в Мексику, чтобы помочь паре, заинтересованной в использовании этой технологии.
Расследование Хэ и других — и любые наказания, с которыми они могут столкнуться — могут повлиять на выбор исследователей для своих следующих попыток, — говорит Тернер. Если его сотрудники за пределами Китая будут подвергнуты санкциям, это может помочь ограничить исследователей, базирующихся в странах со строгими законами, от работы за пределами этих юрисдикций.«То, что происходит с Майклом Димом — если он на самом деле был значимым участником исследования по редактированию генов зародышевой линии, — также будет сигналом», — говорит Тернер.
Но широкий спектр законов оставляет дверь открытой для дальнейших попыток. «Если в разных юрисдикциях будут применяться самые разные модели управления редактированием генов зародышевой линии, — говорит Тернер, — кажется вероятным, что по крайней мере некоторые ученые будут искать возможности для проведения клинических исследований».
Что такое редактирование генома и CRISPR-Cas9 ?: MedlinePlus Genetics
Редактирование генома (также называемое редактированием генов) — это группа технологий, которые дают ученым возможность изменять ДНК организма.Эти технологии позволяют добавлять, удалять или изменять генетический материал в определенных местах генома. Было разработано несколько подходов к редактированию генома. Последняя известна как CRISPR-Cas9, что является сокращением от кластеризованных регулярно чередующихся коротких палиндромных повторов и CRISPR-ассоциированного белка 9. Система CRISPR-Cas9 вызвала большой интерес в научном сообществе, потому что она быстрее, дешевле и эффективнее. точный и более эффективный, чем другие существующие методы редактирования генома.
CRISPR-Cas9 был адаптирован из естественной системы редактирования генома бактерий. Бактерии захватывают фрагменты ДНК вторгшихся вирусов и используют их для создания сегментов ДНК, известных как массивы CRISPR. Массивы CRISPR позволяют бактериям «запоминать» вирусы (или близкие к ним). Если вирусы атакуют снова, бактерии производят сегменты РНК из массивов CRISPR, чтобы атаковать ДНК вирусов. Затем бактерии используют Cas9 или аналогичный фермент, чтобы разрезать ДНК, что выводит из строя вирус.
Система CRISPR-Cas9 работает аналогично в лаборатории. Исследователи создают небольшой фрагмент РНК с короткой «направляющей» последовательностью, которая прикрепляется (связывается) с определенной целевой последовательностью ДНК в геноме. РНК также связывается с ферментом Cas9. Как и в случае с бактериями, модифицированная РНК используется для распознавания последовательности ДНК, а фермент Cas9 разрезает ДНК в заданном месте. Хотя Cas9 является наиболее часто используемым ферментом, можно также использовать другие ферменты (например, Cpf1). После того, как ДНК разрезана, исследователи используют собственный механизм восстановления ДНК клетки, чтобы добавлять или удалять части генетического материала или вносить изменения в ДНК, заменяя существующий сегмент индивидуализированной последовательностью ДНК.
Редактирование генома представляет большой интерес для профилактики и лечения заболеваний человека. В настоящее время большая часть исследований по редактированию генома проводится для понимания болезней с использованием клеток и животных моделей. Ученые все еще работают над тем, чтобы определить, является ли этот подход безопасным и эффективным для использования на людях. Он изучается в исследованиях по широкому кругу заболеваний, включая одногенные нарушения, такие как муковисцидоз, гемофилия и серповидно-клеточная анемия. Он также является многообещающим для лечения и профилактики более сложных заболеваний, таких как рак, болезни сердца, психические заболевания и инфекция, вызванная вирусом иммунодефицита человека (ВИЧ).
Этические проблемы возникают, когда редактирование генома с использованием таких технологий, как CRISPR-Cas9, используется для изменения генома человека. Большинство изменений, вносимых при редактировании генома, ограничиваются соматическими клетками, то есть клетками, отличными от яйцеклеток и сперматозоидов. Эти изменения затрагивают только определенные ткани и не передаются от поколения к поколению. Однако изменения, внесенные в гены в яйцеклетках или сперматозоидах (клетках зародышевой линии) или в генах эмбриона, могут быть переданы будущим поколениям. Редактирование зародышевых клеток и генома эмбриона поднимает ряд этических проблем, в том числе допустимо ли использовать эту технологию для улучшения нормальных человеческих качеств (таких как рост или интеллект).Из соображений этики и безопасности редактирование зародышевых клеток и генома эмбриона в настоящее время является незаконным во многих странах.
Статьи в научных журналах для дальнейшего чтения
Ормонд К.Э. (1), Мортлок Д.П. (2), Скоулз Д.Т. (3), Бомбард Y (4), Броуди ЛК (5), Фосетт, Вашингтон (6), Гарнизон Северная Америка (7), Херчер Л. (8), Исаси Р. (9), Миддлтон А. (10), Мусунуру К. (11), Шринер Д. (12), Вирани А. (13), Янг К. Э. (3). Редактирование генома зародышевой линии человека. Am J Hum Genet. 2017 3 августа; 101 (2): 167-176. PubMed: 28777929. Полный текст доступен бесплатно в центре PubMed: PMC5544380.
Гупта Р.М., Мусунуру К. Расширение набора инструментов генетического редактирования: ZFN, TALEN и CRISPR-Cas9. J Clin Invest. 2014 Октябрь; 124 (10): 4154-61. DOI: 10.1172 / JCI72992. Epub 2014 1 октября. Обзор. PubMed: 25271723. Полный текст доступен бесплатно в центре PubMed: PMC4191047.
Hsu PD, Lander ES, Zhang F. Разработка и применение CRISPR-Cas9 для геномной инженерии. Клетка. 2014 5 июня; 157 (6): 1262-78. DOI: 10.1016 / j.cell.2014.05.010. Рассмотрение. PubMed: 246. Полный текст можно получить бесплатно в центре PubMed: PMC4343198.
Komor AC, Badran AH, Liu DR. Технологии на основе CRISPR для манипулирования геномами эукариот. Клетка. 2017 20 апреля; 169 (3): 559. DOI: 10.1016 / j.cell.2017.04.005. PubMed: 28431253.
Lander ES. Герои CRISPR. Клетка. 2016 14 января; 164 (1-2): 18-28. DOI: 10.1016 / j.cell.2015.12.041. Рассмотрение. PubMed: 26771483.
Генная терапия и генная инженерия
Введение
Клетки человека или другого организма имеют части, называемые «генами», которые контролируют химические реакции в клетке, которые заставляют ее расти и функционировать и в конечном итоге определяют рост и функции организма.Организм наследует некоторые гены от каждого родителя, и, таким образом, родители передают определенные черты своему потомству.
Генная терапия и генная инженерия — две тесно связанные технологии, которые включают изменение генетического материала организмов. Различие между ними основано на цели. Генная терапия направлена на изменение генов для исправления генетических дефектов и, таким образом, предотвращения или лечения генетических заболеваний. Генная инженерия направлена на изменение генов, чтобы расширить возможности организма сверх нормальных.
Этические противоречия вокруг возможного использования обеих этих технологий на растениях, нечеловеческих животных и людях. В частности, в отношении генной инженерии, например, возникает вопрос, правильно ли было бы возиться с человеческими генами, чтобы сделать людей способными превзойти величайших олимпийских спортсменов, или они будут намного умнее Эйнштейна.
Запутанная терминология
Если под генной инженерией подразумевается в очень широком смысле слова любое преднамеренное генетическое изменение, то она включает генную терапию.Таким образом, можно услышать о «терапевтической генной инженерии» (генная терапия) и «негативной генной инженерии» (генная терапия), в отличие от «улучшающей генной инженерии» и «позитивной генной инженерии» (то, что мы называем просто «генной инженерией»).
Мы используем фразу «генная инженерия» в более узком смысле для обозначения вида изменения, направленного на улучшение, а не на терапию. Мы используем термин «генная терапия» для обозначения усилий по приведению людей в норму, а «генная инженерия» или «усиление генной инженерии» — для усилий по расширению возможностей людей за пределы нормы.
Соматические клетки и репродуктивные клетки
Два основных вида клеток — это соматические клетки и репродуктивные клетки. Большинство клеток нашего тела соматические — клетки, из которых состоят такие органы, как кожа, печень, сердце, легкие и т. Д., И эти клетки отличаются друг от друга. Изменение генетического материала в этих клетках не передается потомству человека. Репродуктивные клетки — это сперматозоиды, яйцеклетки и клетки очень ранних эмбрионов. Изменения в генетическом составе репродуктивных клеток передаются потомству человека.Эти изменения репродуктивных клеток могут привести к иной генетике соматических клеток потомства, чем в противном случае, потому что генетический состав соматических клеток напрямую связан с генетическим составом половых клеток, из которых они произошли.
Методы генетической модификации
При изменении генов необходимо столкнуться с двумя проблемами. Во-первых, какое изменение нужно внести в ген. Во-вторых, как включить это изменение во все остальные ячейки, которые необходимо изменить для достижения желаемого эффекта.
Есть несколько вариантов того, какие изменения внести в ген. ДНК в гене может быть заменена другой ДНК извне (так называемая «гомологичная замена»). Или ген можно заставить мутировать (изменить структуру — «селективная обратная мутация»). Или можно просто добавить ген. Или можно использовать химическое вещество, чтобы просто отключить ген и предотвратить его действие.
Есть также несколько вариантов того, как распространить генетическое изменение на все клетки, которые необходимо изменить.Если измененная клетка является репродуктивной клеткой, тогда несколько таких клеток могут быть изменены, и изменение достигнет других соматических клеток, поскольку эти соматические клетки были созданы по мере развития организма. Но если бы изменение было внесено в соматическую клетку, изменение всех других соответствующих соматических клеток по отдельности, как первая, было бы непрактичным из-за огромного количества таких клеток. Клетки такого крупного органа, как сердце или печень, слишком многочисленны, чтобы изменяться одна за другой. Вместо этого для достижения таких соматических клеток обычным подходом является использование носителя или вектора, который представляет собой молекулу или организм.Например, вирус можно использовать в качестве вектора. Вирус был бы безобидным или изменен так, чтобы не вызывать болезнь. Ему будет вводиться генетический материал, а затем, когда он воспроизводит и «заражает» клетки-мишени, он вводит новый генетический материал. Это должен быть очень специфический вирус, который, например, инфицировал бы клетки сердца, не заражая и не изменяя все остальные клетки тела. Частицы жира и химические вещества также использовались в качестве переносчиков, поскольку они могут проникать через клеточную мембрану и перемещаться в ядро клетки с новым генетическим материалом.
Аргументы в пользу генной терапии и генной инженерии
Генную терапию часто считают безупречной с моральной точки зрения, хотя следует соблюдать осторожность. Основные аргументы в пользу этого метода заключаются в том, что он дает возможность вылечить некоторые заболевания или расстройства у тех, у кого есть проблема, и предотвратить болезни у тех, чьи гены предрасположили их к этим проблемам. Если бы она проводилась на репродуктивных клетках, генная терапия могла бы уберечь детей от таких генов (неблагоприятных генетических заболеваний и нарушений), которые дети получили от своих пациентов.
Генная инженерия для улучшения организмов уже широко используется в сельском хозяйстве, в первую очередь в отношении генетически модифицированных (ГМ) культур (также известных как ГМО — генетически модифицированные организмы). Например, сельскохозяйственные культуры и животные были спроектированы таким образом, чтобы они были устойчивы к гербицидам и пестицидам, что означает, что фермеры могут затем использовать эти химические вещества для борьбы с сорняками и насекомыми на этих культурах, не рискуя нанести вред этим растениям. В будущем генетическое улучшение может быть использовано для создания сельскохозяйственных культур с более высокой питательной ценностью и селективного разведения сельскохозяйственных животных, скаковых лошадей и выставочных животных.
Генно-инженерные бактерии и другие микроорганизмы в настоящее время используются для производства человеческого инсулина, гормона роста человека, белка, используемого для свертывания крови, и других фармацевтических препаратов, и количество таких соединений может возрасти в будущем.
Улучшение людей все еще в будущем, но основной аргумент в пользу этого заключается в том, что это может значительно улучшить жизнь за счет улучшения определенных характеристик людей. Мы ценим интеллект, красоту, силу, выносливость, а также определенные личностные характеристики и поведенческие склонности, и если бы эти черты были обнаружены благодаря генетическому компоненту, мы могли бы улучшить людей, наделив их такими качествами.Сторонники генной инженерии отмечают, что многие люди уже пытаются улучшить себя этими способами — с помощью диеты, физических упражнений, образования, косметики и даже пластической хирургии. Люди стараются делать это для себя, а родители стараются дать это своим детям. Если упражнения для улучшения силы, ловкости и общей физической формы — стоящая цель, и если кого-то хвалят за обучение, направленное на повышение своих умственных способностей, то почему бы не достичь этого с помощью генетики?
Защитники генной инженерии также рассматривают улучшение как элемент базовой репродуктивной свободы.Мы уже не стесняемся выбирать себе пару, частично исходя из возможности обеспечить желанных детей. Мы думаем, что нет ничего плохого в выборе спутника жизни, который, как мы надеемся, может дать умных и привлекательных детей, а не другого партнера, который обеспечит менее желанных детей. Выбор пары для того типа детей, которых можно получить, является вопросом базовой репродуктивной свободы, и у нас есть свобода выбирать лучшие гены для наших детей. Почему, как гласит этот аргумент, у нас должно быть меньше свободы давать нашим детям лучшие гены, которые мы можем, посредством генетического улучшения?
Тех, кто выступает за существенное изменение человека с помощью таких технологий, как генная инженерия, иногда называют «трансгуманистами».”
Аргументы против генной терапии
Три аргумента, которые иногда приводятся против генной терапии, заключаются в том, что она технически слишком опасна, что она дискриминирует или поощряет дискриминацию в отношении людей с ограниченными возможностями и что в некоторых случаях она может становиться все более неуместной.
Возражение об опасности указывает на то, что несколько недавних попыток генной терапии в клинических испытаниях попали в заголовки газет из-за трагической гибели некоторых людей, участвовавших в испытаниях.Не до конца известно, в какой степени это было связано с самой генной терапией, в отличие от ранее существовавших условий или неправильных методов исследования, но в свете таких событий некоторые критики призвали прекратить генную терапию до тех пор, пока не станет известно больше. . Мы просто недостаточно знаем о том, как работает генная терапия и что может пойти не так. Особые опасения вызывает то, что
- векторы могут доставлять ДНК в клетки, отличные от клеток-мишеней, с непредвиденными результатами
- вирусы как переносчики могут быть не такими безобидными, как предполагалось, и могут вызывать болезни
- добавление новых генов в ядро не гарантирует, что они пойдут туда, куда нужно, с потенциально катастрофическими результатами, если они будут вставлены в неправильное место
- , если изменения не интегрированы с другой ДНК, уже находящейся в ядре, изменения могут не распространиться на новые клетки, и человеку, возможно, придется пройти дополнительную терапию позже
- изменение репродуктивных клеток может вызвать события, которые не наблюдались раньше, чем спустя годы, а нежелательные эффекты, возможно, уже были переданы детям пациента
Возражение против дискриминации заключается в следующем.Некоторые люди с физическими, умственными или эмоциональными нарушениями являются таковыми в результате унаследованных ими генетических факторов. Такое нарушение может привести к инвалидности в нашем обществе. Люди с ограниченными возможностями часто подвергаются дискриминации из-за того, что у них меньше возможностей, чем у других людей. Верно, что генная терапия может способствовать устранению одного из источников дискриминации и неравенства в обществе, устраняя генетические нарушения и возникающие в результате нарушения. Но в возражении утверждается, что делается неявное предположение, что людей, страдающих генетическими нарушениями, нужно лечить и делать нормальными.В возражении генная терапия рассматривается как форма дискриминации в отношении людей с ограниченными возможностями и лиц с ограниченными возможностями.
Неуместное возражение состоит в том, что генная терапия репродуктивных клеток в некоторых случаях уже может быть заменена экстракорпоральным оплодотворением и селекцией эмбрионов. Если генетическое заболевание таково, что может быть обнаружено у раннего эмбриона, и не все эмбрионы от родительской пары будут иметь его, тогда родители производят несколько эмбрионов посредством экстракорпорального оплодотворения и имплантируют только те, которые не страдают этим заболеванием.В таком случае генная терапия была бы ненужной и неуместной.
Аргументы против генной инженерии
Специалисты по этике в целом были даже больше озабочены возможными проблемами и последствиями применения улучшающей генной инженерии, чем генной терапией. Во-первых, есть опасения, аналогичные опасениям по поводу генной терапии, о которых недостаточно известно и которые могут иметь непредвиденные опасные последствия. Эти опасения могут быть еще более серьезными, учитывая, что попытки делаются не только в направлении нормальной жизни, но и на незнакомой новой территории, куда люди никогда раньше не заходили.Мы просто не знаем, какие причудливые существа могут появиться в результате неудачных экспериментов.
Ниже приведены некоторые другие важные возражения:
- Генная инженерия противоречит естественному или сверхъестественному порядку. Мысль здесь заключается в том, что Бог, или эволюция, создал набор генов для людей, которые либо являются тем, что мы должны иметь, либо предлагают нам лучшую ценность для выживания. Это противоречит тому, что Бог или природа намеревались возиться с этим генетическим кодом, не для того, чтобы привести его в нормальное состояние (как в генной терапии), а для создания новых видов существ.Этот тип возражения совместим как с «креационизмом», верой в то, что Бог создал людей такими, какие они есть, так и с верой в эволюцию. Согласно последнему мнению, люди, сознательно улучшающие свои гены, считают иначе, чем позволять естественному процессу эволюции «выбирать» гены, которые у нас есть.
- Генная инженерия бесчеловечна, потому что она создаст нечеловеческих, отчужденных существ. Генно-инженерные люди будут отчуждены от самих себя, или будут чувствовать смущение, или перестанут чувствовать себя людьми, или человеческая раса будет чувствовать себя отчужденной от себя.У людей, созданных с помощью генной инженерии, не будет ощущения принадлежности к человеческой расе, но у них не будет достаточно общего с другими подобными существами, чтобы чувствовать себя принадлежащими кому-либо из них. Люди будут отчуждены даже от своих радикально отличных от генетической инженерии детей, которые вполне могут быть отдельным видом.
- Существа, созданные с помощью генной инженерии, будут устаревать. Компьютеры быстро устаревают по мере появления новых моделей. Но это могло случиться с людьми, созданными с помощью генной инженерии.Улучшение горячих генов за один год станет старой новостью несколько лет спустя. Родители будут устаревшими по меркам их детей, а подростки будут безнадежно уступать своим младшим братьям и сестрам.
- Генная инженерия является версией евгеники и вызывает воспоминания об историческом движении евгеники в начале двадцатого века в Америке и нацистской Германии. «Евгеника» — это взгляд на то, что мы должны улучшить генетику человеческого рода; часто пропагандируются такие практики, как селективное размножение, принудительная стерилизация «дефектных» и «нежелательных» (людей с генетическими нарушениями или нежелательными характеристиками или чертами, людей с ограниченными возможностями, людей других рас, людей других этнических групп, гомосексуалистов) и эвтаназии. таких популяций.Вероятно, она достигла крайней формы в нацистской Германии, где имели место массовые истребления, но евгенические настроения существовали и до того, как в США. Эта практика в настоящее время в значительной степени считается морально отвратительной. Критики генной инженерии рассматривают ее как попытку евгеники с помощью технологий.
Генная терапия становится реальностью, когда вы читаете это. До генной инженерии для улучшения все еще далеко. По обоим вопросам наверняка будет много споров.
Генное редактирование людей: дело не только в безопасности
Китайский ученый Хэ Цзянькуй удивил научное сообщество и мир, объявив в ноябре 2018 года, что он генетически модифицировал два эмбриона, а затем позволил им развиться в младенцев.Мало того, он считал, что действовал в соответствии с рекомендациями, изложенными в отчете Национальной академии наук, инженерии и медицины за 2017 год.
Совсем недавно российский ученый Денис Ребриков объявил о своем намерении отредактировать человеческий эмбрион и имплантировать его женщине, чтобы дать ему возможность развиваться. Эти ученые-ренегаты спровоцировали то, что STAT News назвало «переделкой» Национальной академии наук, Национальной академии медицины и Королевского общества Великобритании.
На прошлой неделе эти организации провели первое из серии важных заседаний совместно спонсируемой ими Международной комиссии по клиническому использованию редактирования генома зародышевой линии человека.Кроме того, Всемирная организация здравоохранения сформировала Консультативный комитет экспертов по разработке глобальных стандартов управления и надзора за редактированием генома человека.
Эти группы стремятся на этот раз быть более ясными и создать структуру управления, чтобы такие ученые, как Хе и Ребриков, понимали и уважали руководящие принципы, установленные их коллегами: модификация зародышевой линии человека еще небезопасна. Поскольку остается еще много нерешенных проблем, включая так называемые результаты, не соответствующие цели, частичное редактирование и другие проблемы, базовые лабораторные исследования по редактированию генов могут продолжаться, пока эмбрионам не позволено развиваться.
Однако, несмотря на то, что эти органы перегруппировываются для выработки более четких указаний, я чувствую сдвиг в дебатах. В течение очень долгого времени научный и биоэтический консенсус заключался в том, что мы не должны вносить изменения в зародышевую линию человека — что мы не должны изменять гаметы и эмбрионы таким образом, который был бы постоянным и затрагивал бы все будущие поколения. Напротив, соматические модификации, которые затрагивают только человека, в котором вносятся правки, в основном не вызывали споров.
Но граница между модификацией зародышевой линии и соматической модификацией генома стирается; дух времени ощущается иначе.Растет ощущение неизбежности того, что мы в конечном итоге произведем модификацию зародышевой линии человека и что наша единственная обязанность — ждать, пока это не станет безопасным. Когда наступит этот день, мы, возможно, захотим внести в человеческий вид постоянные наследственные изменения, чтобы искоренить трудноизлечимые болезни. Однако мы должны начать это обсуждение с широко открытыми глазами, рассматривая каждое приложение по отдельности и предвидя широкий круг проблем, выходящих далеко за рамки безопасности. Многие из этих вопросов рассматриваются в Human Flourishing in an Age of Gene Editing, , которое будет опубликовано Oxford University Press 28 августа 2019 года.
Хотя мы еще не знаем генетических предикторов многих состояний, по мере того, как мы узнаем больше, соблазн использовать технологии редактирования генов для «улучшения» самих себя будет необычайным — и особенно проблематичным, если мы получим способность снижать вероятность высокой стигматизируемые черты, такие как гомосексуальность, или исправление очень желательных черт, таких как рост или атлетизм. Многие родители, возможно, законно, утверждают, что они не предвзято относятся к гомосексуализму или какому-либо другому образу жизни, а просто думают, что это усложняет жизнь.Так почему бы не удалить гены, увеличивающие вероятность того, что это произойдет? И разве не все хорошие родители стремятся дать своим детям преимущества?
Многие из вариантов, которые нам предстоит сделать, по праву должны принадлежать будущим родителям. Но даже когда решения являются личными и частными, они должны быть хорошо информированы, поэтому нам нужно гораздо больше способов вовлечь общественность в разговоры о редактировании генома зародышевой линии. Для принятия действительно информированных личных решений необходимо активное обсуждение в сообществе поставленных на карту ценностей.
Нам нужна широкая общественная дискуссия по вопросам, выходящим за рамки безопасности, и по другой причине. То, что люди решают делать самостоятельно, может изменить коллектив, даже если эти изменения не предназначались для населения в целом. Редактирование генома зародышевой линии человека является типичным примером технологии, которая будет иметь как личные, так и коллективные последствия, влияя на нашу общую среду.
Как, например, способность выбирать в своих детях те качества, которые мы хотим, может повлиять на отношения между родителями и детьми и на добродетели, которые мы хотим видеть в наших общинах? Комментаторы, такие как Майкл Сэндел из Гарвардского университета, предупреждали, что контроль над геномами наших детей может привести к ощущению «гиперактивности», в результате чего мы потеряем ощущение детей как подарков, которых нужно взращивать, когда они приходят к нам и предпочитают их видеть. как объекты, которые мы разработали.Будут ли дети, которые были отредактированы, чтобы обладать большим музыкальным талантом или спортивным мастерством, чувствовать себя обязанными осуществить мечты своих родителей даже в большей степени, чем обычно это делают дети?
Более того, мы могли создавать наше потомство на основе популярных, но подозрительных норм, таких как гомофобия или определенные физические особенности. Мы также могли бы непреднамеренно организовать то, что некоторые комментаторы назвали «генетической гонкой вооружений», в которой попытки родителей дать детям преимущество просто заставят всех конкурировать на все более высоких уровнях, независимо от того, какие черты они ищут.
Конечно, до такого контроля еще далеко, но сейчас мы прокладываем путь к человеческому совершенствованию, которое может в конечном итоге уменьшить вариабельность видов или, в течение длительного периода времени, привести к подвидам. Действительно, трансгуманисты защищают именно этот результат — слияние новых биологических и синтетических сил, которое существенно изменит саму природу нашего вида.
Нам нужны форумы и стратегии для обсуждения последствий, выходящих за рамки безопасности: книги для ученых, политиков и заинтересованных представителей общественности, которые будут предвосхищать широкий спектр социальных, экономических и этических последствий улучшения: образовательный опыт для студентов и их учителей; литература и фильмы, которые не делают сенсаций, но помогают нам рассмотреть социальную и этическую сложность наших вновь обретенных способностей; совещательный опрос и другие формы демократического обсуждения; и множественные каналы связи между экспертами и неспециалистами.
И международная комиссия, и комитет ВОЗ обещают рассмотреть широкий круг социальных и этических вопросов, выходящих далеко за рамки безопасности. Я надеюсь, что они будут придерживаться этого намерения. Их встреча на прошлой неделе началась с отличного старта, с призывов к большей научной прозрачности и возобновления обязательств по созданию глобальной основы для определения параметров этого исследования.
Но потребуется стойкое мужество, чтобы устранить все последствия использования этой технологии. В плюралистическом обществе может быть страшно открывать ящик Пандоры для обсуждения глубоко укоренившихся ценностей.При таком большом количестве различных взглядов, которые, казалось бы, невозможно согласовать, будет легче сосредоточиться только на безопасности, а это самый минимум, с которым может согласиться практически каждый. Но мы избегаем более серьезных и серьезных разговоров, опасаясь за наших внуков.
W.H.O. Эксперты ищут ограничения на эксперименты по редактированию человеческих генов
В понедельник комитет экспертов, работающий с Всемирной организацией здравоохранения, призвал страны мира установить более строгие ограничения на мощные методы редактирования человеческих генов.
Их рекомендации, сделанные после двух лет обсуждения, направлены на то, чтобы помешать мошенническим научным экспериментам с человеческим геномом и гарантировать, что правильное использование методов редактирования генов приносит пользу широкой общественности, особенно людям в развивающихся странах, и не только богатые.
«Я очень меня поддерживаю», — сказал доктор Леонард Зон, эксперт по генной терапии из Гарвардского университета, который не был членом комитета, но назвал его «вдумчивой группой». Недавние результаты редактирования генов «впечатляют», сказал он, и рекомендации комитета будут «очень важны для терапии в будущем.”
Руководящие принципы, предложенные W.H.O. Комитет был в значительной степени вызван случаем Хэ Цзянькуя, ученого из Китая, который ошеломил мир в ноябре 2018 года, когда объявил, что изменил ДНК человеческих эмбрионов с помощью CRISPR, техники, которая позволяет точно редактировать гены. Такие изменения означали, что любые изменения, произошедшие в генах, будут реплицироваться в каждой клетке эмбриона, включая сперматозоиды и яйцеклетки. А это означало, что изменения, даже если они были вредными, а не полезными, возникли бы не только у младенцев, рожденных после редактирования генов, но и в каждом поколении, которому передавалась их ДНК.
Целью доктора Хэ было изменение ДНК младенцев в попытке сделать их генетически неспособными заразиться ВИЧ. от родителей. Суд в Китае постановил, что он подделывал этические документы и вводил в заблуждение участников экспериментов, которые не понимали, в чем состоял его эксперимент по редактированию генов. В декабре 2019 года его приговорили к трем годам тюремного заключения.
Тот факт, что такой эксперимент, известный как редактирование зародышевой линии, может иметь место, поднял вопрос о том, как контролировать редактирование генов и как быть уверенным, что оно будет использовано на благо людей.
The W.H.O. стандарты говорят, что использование доктором Хе редактирования зародышевой линии было неприемлемым и что безответственно даже рассматривать возможность его использования сейчас. Но другие виды редактирования генов — это совсем другое дело.
Ученые уже пытаются редактировать гены, чтобы исправить мутацию, вызывающую серповидно-клеточную анемию. Отредактированный ген будет находиться в кроветворных клетках костного мозга людей, страдающих заболеванием, а не в сперматозоидах или яйцеклетках, поэтому изменения не будут передаваться из поколения в поколение.Но даже такое использование CRISPR вызывает другие вопросы.
The W.H.O. комитет описал выдуманный сценарий, когда исследователи из богатой страны хотят провести клиническое испытание редактирования генов серповидных клеток в Африке к югу от Сахары, где это заболевание широко распространено. Если испытание увенчается успехом, лечение по редактированию генов окажется слишком дорогим для всех, кроме очень небольшого числа граждан страны, в которой оно должно быть протестировано.
Другая гипотетическая ситуация связана с испытанием по редактированию генов для исправления генной мутации, вызывающей болезнь Хантингтона, прогрессирующее заболевание головного мозга.У людей, унаследовавших мутировавший ген, с абсолютной уверенностью разовьется болезнь Хантингтона. Если эксперимент по редактированию генов увенчается успехом, он может избавить их от этой ужасной болезни. А поскольку редактирование не касается сперматозоидов и яйцеклеток, изменения не будут переданы по наследству.
Но потребуются годы, возможно, даже десятилетия, чтобы узнать, защищены ли участники исследования, чьи гены были отредактированы, от болезни Хантингтона. Участники не избавились от ужасного страха, что, несмотря на редактирование генов, у них все же может развиться смертельная болезнь мозга.
В таком сценарии W.H.O. Группа спросила, есть ли более быстрые способы оценки эффективности лечения. Было также предложено, чтобы исследователи рассмотрели психологическое бремя для участников, которые надеются, что выздоровели, но не знают наверняка.
Тем не менее, редактирование генов уже здесь и имеет огромные перспективы, заявил комитет. ВОЗ. начал реестр проводимых исследований и говорит, что он уже включает 156 экспериментов с генами, которых нет в сперматозоидах или яйцеклетках.
The W.H.O. Комитет подчеркнул, что каждая страна должна иметь руководящие принципы, чтобы гарантировать, что исследование проводится с соблюдением этических норм и надлежащим надзором, а также с условиями для обеспечения доступа и социальной справедливости. Поскольку ожидается, что стоимость лечения будет очень высокой, по крайней мере, на первых порах, группа заявила, что цель должна состоять в том, чтобы гарантировать, что выгоды от редактирования генов справедливо распространяются на людей во всем мире.
«Это непростая задача», — сказала Франсуаза Бейлис, член комитета, исследователь медицинской этики в Университете Далхаузи в Галифаксе, Новая Шотландия.
Что пошло не так и что могло пойти не так
Образец цитирования: Ван Х, Ян Х (2019) Младенцы, отредактированные генами: что пошло не так и что могло пойти не так. ПЛоС Биол 17 (4): e3000224. https://doi.org/10.1371/journal.pbio.3000224
Опубликовано: 30 апреля 2019 г.
Авторские права: © 2019 Wang, Yang. Это статья в открытом доступе, распространяемая в соответствии с условиями лицензии Creative Commons Attribution License, которая разрешает неограниченное использование, распространение и воспроизведение на любом носителе при условии указания автора и источника.
Финансирование: H.W. поддерживается Национальной программой ключевых исследований и разработок Китая (2018YFA0107703), Программой стратегических приоритетных исследований Китайской академии наук (№ XDA16010503) и Национальным фондом естественных наук Китая (№ 31722036). H.Y. поддерживается Программой НИОКР Китая (2018YFC2000100 и 2017YFC1001302), Программой стратегических приоритетных исследований CAS (XDB32060000), Национальным фондом естественных наук Китая (31871502), Шанхайским муниципальным муниципальным научно-техническим проектом (2018SHZDZX05) и Шанхайским городским комитетом науки и технологический проект (18411953700, 18JC1410100).Финансирующие организации не играли никакой роли в дизайне исследования, сборе и анализе данных, принятии решения о публикации или подготовке рукописи.
Конкурирующие интересы: Авторы заявили, что никаких конкурирующих интересов не существует.
Сокращения: АРТ, Вспомогательные репродуктивные технологии; CCR5, C-C хемокиновый рецептор типа 5; CRISPR-Cas9, кластеризованные регулярно чередующиеся короткие палиндромные повторы и CRISPR-ассоциированный белок 9; DSB, двухниточный разрыв; HDR, гомологически направленный ремонт; hESC, эмбриональные стволовые клетки человека; КО, Вырубить; MII, метафаза II; NHEJ, негомологичное соединение концов; НК, естественная клетка-убийца; PGD, предимплантационная генетическая диагностика; sgRNA, одиночная направляющая РНК; WGS, полногеномное секвенирование; WT, дикий тип
Происхождение: Введен в эксплуатацию; внешняя экспертная оценка
25 ноября 2018 г. Цзянкуй Хэ, доцент Южного научно-технического университета, объявил, что в Китае родились два ребенка с измененными генами хемокинового рецептора C-C типа 5 ( CCR5 ).Он утверждал, что эта генетическая модификация сделает этих детей невосприимчивыми к ВИЧ-инфекции. 28 ноября он представил экспериментальные данные этого проекта на втором Всемирном саммите редактирования генов человека. Хотя веские доказательства этого эксперимента еще предстоит раскрыть, а правдивость таких утверждений не установлена, план эксперимента и данные, представленные на саммите, выявили серьезные проступки как на научном, так и на этическом уровне. Как исследователи, работающие в области редактирования генов в Китае, мы были полностью шокированы этой новостью.Похоже, что Он выполнял эту работу втайне. Насколько нам известно, он не публиковал заслуживающих внимания научных работ в области редактирования генов и не принимал активного участия в сообществе редактирования генов в Китае. Мы были возмущены этим крайне безответственным проступком, который явно нарушал нормативную и медицинскую этику Китая и стран всего мира. Здесь мы сосредотачиваемся на подводных камнях научных аспектов, предполагая, что данные, которые Он представил, были правдой, потому что мы считаем, что ответственное изучение и обсуждение этого события требует хорошего понимания научных фактов.
Во-первых, мы хотели бы критиковать его общую логику. Он утверждал, что отредактировал ген CCR5 , чтобы предотвратить заражение ВИЧ у младенцев, отец которых является носителем ВИЧ (мать не является носителем вируса). Однако редактирование генов у эмбрионов совершенно не нужно для предотвращения передачи ВИЧ плоду. ВИЧ-инфицированный отец может произвести на свет здоровых детей с использованием установленных вспомогательных репродуктивных технологий (ВРТ) с чрезвычайно высоким показателем успеха [1].Что касается будущего иммунитета к ВИЧ-инфекции, для большинства людей достаточно просто избежать потенциального риска заражения ВИЧ. Следовательно, редактирование ранних эмбрионов не приносит пользы младенцам, но создает потенциально серьезные риски по нескольким направлениям, которые мы обсудим далее.
Ген CCR5 кодирует рецептор лейкоцитов, который ВИЧ-1 использует вместе с другим рецептором для заражения клеток человека. Встречающийся в природе аллель CCR5Δ32 присутствует в некоторых европейских популяциях.Хотя как гетерозиготные, так и гомозиготные индивидуумы имеют более медленное прогрессирование или устойчивость к ВИЧ-инфекции [2, 3], даже гомозиготные CCR5Δ32 индивидуумы все еще могут быть инфицированы определенными штаммами ВИЧ [4]. Лица, несущие аллель CCR5Δ32 , в целом здоровы; однако этот аллель существует с очень низкой частотой в неевропейских популяциях, и гомозиготный мутант не был идентифицирован в китайских популяциях [5, 6]. Следовательно, очень сложно предсказать риск внедрения аллеля CCR5Δ32 или других мутантных аллелей CCR5 в генетический фон Китая.Хотя он утверждал, что существует долгосрочный план наблюдения за состоянием здоровья, нет подробностей о том, кто будет финансировать его или возьмет на себя ответственность в случае возникновения каких-либо медицинских проблем.
Далее мы займемся его данными. Сначала он представил данные у мышей с нокаутом Ccr5 (KO), чтобы оценить, «приведет ли потеря CCR5 на стадии эмбриона в результате редактирования гена CRISPR / Cas9 к нежелательным генетическим, физиологическим или поведенческим последствиям?» (все содержание в кавычках цитируется непосредственно из слайдов презентации Хэ).Это абсурд. Невозможно ответить на этот вопрос, просто сравнив гистологическое окрашивание четырех разных тканей без какой-либо количественной оценки и выполнив два простых поведенческих теста на мышах. Качество науки очень низкое и поверхностное. Например, данные теста поведения нового объекта исследования показали, что существует разница между мышами дикого типа (WT) и Ccr5 KO, хотя значение P выше 0,05. Прежде чем утверждать, что Ccr5 KO не вызывал какого-либо поведенческого фенотипа, необходима дополнительная оценка с использованием более крупного размера выборки.Беглый поиск в литературе показал бы, что CCR5 имеет нормальные иммунные функции как рецептор хемокинов, а мыши CCR5 KO имеют фенотип, связанный с естественными клетками-киллерами (NK), что приводит к более высокому риску различных вирусных инфекций [7–9]. .
Затем он сконструировал несколько однонаправляющих РНК (sgRNA) и проверил их эффективность на линиях клеток человека и эмбрионах обезьян. Это очень обычные процедуры, используемые для экспериментов по редактированию генов. После того, как кластерные регулярно чередующиеся короткие палиндромные повторы и компоненты CRISPR-ассоциированного белка 9 (CRISPR-Cas9) доставлены в клетки, в целевом геномном локусе будет образовываться двухцепочечный разрыв ДНК (DSB).Либо процесс репарации негомологичного соединения концов (NHEJ), либо путь гомологично-направленной репарации (HDR) используется для репарации этого DSB ДНК. Ремонт NHEJ часто приводит к небольшим вставкам или делециям (инделениям), тогда как HDR приводит к идеальному восстановлению или точной генетической модификации в целевом сайте. Его презентация показала только характеристику скорости индел-мутаций посредством репарации NHEJ; не было показано экспериментов, предназначенных для введения аллеля CCR5 Δ32 посредством репарации HDR, что позволяет предположить, что у Хэ не было намерения генерировать аллель CCR5 Δ32.Насколько нам известно, CCR5 мутантных аллелей indel, кроме аллеля CCR5 Δ32, не существует в человеческих популяциях с высокой частотой. Предыдущие исследования показали, что экспрессия и стабильность усеченного белка CCR5Δ32 у CCR5 — / — индивидуумов также могут вносить вклад в фенотип устойчивости к ВИЧ [10]. Следовательно, другие нулевые аллели CCR5 нельзя просто приравнять к аллелю Δ32 CCR5 Δ32 при рассмотрении потенциальных преимуществ и рисков.Более того, inframe-мутации потенциально могут генерировать мутации с усилением функции, риски которых еще труднее предсказать.
Он попытался оптимизировать процедуру микроинъекции, используя зиготы обезьян, и выполнил секвенирование, чтобы оценить эффективность редактирования генов и уровень мозаицизма. Поскольку его данные не были опубликованы ни на одной платформе в качестве исследовательской работы, информации, показанной на слайдах PowerPoint, недостаточно для проверки. Судя по его презентации, несмотря на различные попытки, мозаицизм остается проблемой в экспериментах с эмбрионами обезьян.
Затем он перевел свой протокол микроинъекции человеческим эмбрионам. Как проиллюстрировано данными He и предыдущими исследованиями, инъекция эмбрионов на стадии метафазы II (MII) и использование белка Cas9 вместо мРНК Cas9 может уменьшить мозаицизм, но не устранить его [11, 12]. Более того, эта стратегия работает только с опосредованным NHEJ нокаутом гена, а не с опосредованной HDR точной репарацией генов. Хотя о многих стратегиях увеличения HDR сообщалось в клеточных линиях [13], применимы ли они к человеческим эмбрионам, остается открытым вопросом.Работа, проделанная группой Миталипова, предполагает, что материнский аллель может служить шаблоном для репарации гена с целью коррекции патогенной мутации [12], но другие группы утверждали, что Cas9 может вызывать крупномасштабные делеции или перестройки, которые приводят к ложноположительным результатам. с использованием генотипирования на основе ПЦР [14]. Эти научные дебаты показывают наше неполное понимание механизмов и результатов репарации ДНК, связанных с редактированием генов в ранних эмбрионах человека, и предполагают, что он, вероятно, недооценил уровень мозаицизма и риск внесения вредных генетических изменений.
Для оценки мутаций, вызванных нецелевым редактированием, он создал одну линию человеческих эмбриональных стволовых клеток (hESC) из отредактированных человеческих эмбрионов. И здесь качество науки тоже низкое. Только одна линия hESC была получена из одного отредактированного человеческого эмбриона, который затем был использован для полногеномного секвенирования (WGS) для обнаружения потенциальных мутаций, не соответствующих мишени. В процессе образования и распространения hESCs будет происходить множество генетических изменений [15]. Следовательно, чтобы идентифицировать истинные мутации вне мишени, вызванные редактированием генов, необходимо создать несколько линий чЭСК из отредактированных и неотредактированных эмбрионов и охарактеризовать их глубоким секвенированием и обширным биоинформатическим анализом.
Он также утверждал, что он выполнил так называемую WGS на основе одной клетки на образцах доимплантационной генетической диагностики (PGD) из 19 отредактированных человеческих бластоцист, чтобы оценить события редактирования как на мишени, так и вне мишени, прежде чем выбрать те, которые будут переданы реципиентам. Двенадцать из девятнадцати эмбрионов содержали аллели WT, что указывает на то, что ген CCR5 не был полностью отредактирован в этих эмбрионах. Важно отметить, что не существует зрелого и надежного метода для WGS на основе одиночных клеток для устранения нецелевых мутаций [16].Процесс амплификации всего генома, который усиливает единственную копию генома до достаточно большого количества для WGS, вводит множество искусственных мутаций [16]. Кроме того, мозаицизм является серьезной проблемой, которую нельзя решить с помощью PGD, поскольку мы не можем секвенировать все клетки эмбриона [17]. Это означает, что даже если тестируемые клетки правильно отредактированы, все равно существует немалый риск того, что другие клетки эмбриона останутся неотредактированными или несут в себе нежелательные мутации, которые могут иметь непредсказуемые последствия.Таким образом, Его утверждение ненадежно.
В дополнение к потенциальным эффектам, не связанным с мишенью, сообщалось, что DSB, генерируемые CRISPR-Cas9, также могут приводить к эффектам мутагенеза на мишени [18, 19]. Помимо типов вставок, делеций, транслокаций и перестроек, воздействия на мишени включают большие делеции хромосом, усечения хромосом и гомозиготность генома за счет межгомологической репарации. В настоящее время ни один метод не может обнаружить все эти типы мутаций, не соответствующих цели, особенно когда они происходят с очень низкой частотой.
После рождения двух девочек команда Хэ собрала ДНК их пуповинной крови, пуповины и плаценты и выполнила WGS, чтобы подтвердить успех редактирования CCR5 . Результаты WGS предполагают, что в этих образцах существуют только два различных аллеля CCR5 , каждый из которых составляет примерно половину всех считываний секвенирования. Для Lulu один аллель остался WT, а другой аллель имел делецию в рамке считывания (-15 п.н.). Для Наны два мутантных аллеля CCR5 представляли 100% всех считываний секвенирования в целевой области CCR5 , что довольно неожиданно предполагает, что ни одна ткань матери (содержащая аллель WT CCR5 ) не загрязняла ни один из образцов Наны. .Тем не менее, поскольку детали сбора образцов и анализа данных отсутствуют, мы не можем сделать надежный вывод. Мы настоятельно рекомендуем властям провести тщательную проверку всех исходных данных и раскрыть факты научному сообществу и широкой общественности.
В заключение, основываясь на имеющейся в настоящее время информации, мы полагаем, что нет веских научных оснований для выполнения этого типа редактирования генов на зародышевой линии человека, и что поведение Хэ и его команды представляет собой грубое нарушение как китайских правил, так и консенсус, достигнутый международным научным сообществом.Мы решительно осуждаем их действия как крайне безответственные как с научной, так и с этической точки зрения. Мы настоятельно призываем международное сообщество ученых и регулирующих органов как можно скорее начать всестороннее обсуждение для разработки критериев и стандартов редактирования генома в зародышевой линии человека в репродуктивных целях. После достижения четкого консенсуса четкие и строгие законы должны быть приняты, реализованы и обеспечены соблюдением на международном уровне. Однако мы также считаем, что необходимо дальнейшее развитие и совершенствование технологий для внесения точных генетических модификаций в зародышевую линию человека, включая ранние эмбрионы, сперму и ооциты, с использованием экспериментальных установок in vitro.Эти усовершенствованные технологии могут обеспечить решения для генетических заболеваний, но только при достижении консенсуса и создании нормативной базы для лечения конкретных медицинских последствий.
«Профилактика» и управление редактированием человеческих генов | Журнал этики
Абстрактные
Доктрина Холокоста и расовой гигиены, которая помогла его рационализировать, все еще затмевает современные дискуссии об использовании редактирования генов для профилактики болезней.Отчасти это связано с тем, что предупреждение может означать 3 разных вещи, которые часто смешивают. Фенотипическая профилактика включает изменение экспрессии патогенных вариантов ДНК для предотвращения их клинических эффектов у пациентов из группы риска. Генотипическая профилактика включает контроль передачи патогенных вариантов от поколения к поколению, чтобы избежать рождения пораженного потомства. Профилактическое усиление направлено на улучшение обычных человеческих качеств, направленных на противодействие болезням.Эти различия игнорировались в обсуждениях управления редактированием генов человека и разъясняются в этой статье.
Генетическая профилактика и тень ХолокостаНаучный расизм и евгенические заблуждения, которые привели к Холокосту, сегодня широко сторонятся членами сообществ генетиков и геномиков человека. 1 Тем не менее, длинная тень Холокоста все еще очевидна в общественной тревоге по поводу нашей растущей способности контролировать экспрессию и передачу человеческих генов.Сегодня в центре внимания этого беспокойства находится набор новых молекулярных инструментов для редактирования генов, который обещает оживить начинание генной терапии человека. С момента первой демонстрации того, что эти инструменты могут быть использованы для модификации генетических механизмов в клетках человека более точно и эффективно, чем старые формы передачи генов, глобальные организации, отвечающие за их надзор, выпустили поток отчетов и заявлений, предлагающих этические принципы использования этих инструментов. . 2 Большинство этих отчетов концентрируются на непосредственных вопросах этики исследования, возникающих при разработке любых новых биомедицинских инноваций: вопросах о физическом риске, информированном согласии и справедливом распределении выгод и трудностей исследований.Но за этими обсуждениями память о Холокосте выявляет более фундаментальные этические вопросы относительно того, к чему приведет это исследование, и беспокойство о том, что мы можем повторить ошибку создания генетической иерархии из социальных предрассудков и снова попытаться переделать наш вид на фоне фундаментально несправедливой видение здоровья человека.
Эта фоновая проблема проявляется в новой волне руководящих документов по редактированию генов, в которых обсуждение регулирования редактирования генов основывается на предположении о двух границах: (1) ограничение редактирования гена лечением болезни, а не дальнейшее улучшение человека, и (2) ограничение исследований до соматические клетки, а не вмешательства на зародышевой линии. 3 Клиническая неопределенность и риски более ранних технологий генной терапии были достаточными для поддержки широко распространенного консенсуса по обеим этим границам в научном сообществе с тех пор, как они были впервые сформулированы в 1980-х годах. Но повышенная безопасность, эффективность и действенность, обещанные новыми методами редактирования генов, теперь открывают путь к возобновленным обсуждениям обоих традиционных ограничений. Если технические обещания технологии редактирования генов могут быть реализованы, обществу необходимо будет пересмотреть концептуальные и моральные достоинства этих границ непосредственно на фоне вдохновившей их исторической тени Холокоста.Концепция предотвращения играет недооцененную, но важную роль в этих дебатах.
Медицинские приложения, которые были одобрены при проведении черты против генетической модификации в целях улучшения, традиционно понимались как лечения тяжелых заболеваний. Однако многие из недавних отчетов об управлении редактированием генов человека выходят за рамки лечения и включают профилактику болезни в качестве этически приемлемой цели исследования, 4 , что согласуется с усилиями точной геномной медицины в оценке генетического риска и фармакогеномике.Но в редактировании генома концепция профилактика легко включает и объединяет 3 интерпретации целей профилактики, которые я называю фенотипической профилактикой , 5 генотипической профилактикой , 5 и профилактическим усилением . 3 Каждый из них имеет этические последствия, которые следует устранить и прояснить.
Фенотипическая профилактикаПод знаменем точной и персонализированной медицины достижения в исследованиях генома человека делают все более возможным обнаружение патогенных геномных вариантов до того, как их проблемные клинические фенотипы проявятся у конкретных пациентов.Одна из надежд на исследования редактирования генов человека состоит в том, чтобы использовать наши новые возможности для исправления или замены этих вариантов, чтобы предотвратить клинические проблемы со здоровьем, которые они могут вызвать. Фенотипическая профилактика такого рода не является необычной целью для биомедицинских исследований. Он отражает цель, которую разделяют многие медицинские вмешательства — от лекарств до операций и биоповеденческих вмешательств, — которые пытаются вмешаться на достаточно раннем этапе болезни пациента, чтобы предотвратить пагубные последствия, которые пациент в противном случае испытал бы.Единственная разница между профилактическим редактированием генов и фенотипической профилактикой, обеспечиваемой другими традиционными медицинскими средствами, заключается в обещании первого действовать раньше и более полно, вмешиваясь на геномном уровне.
Достижение цели фенотипической профилактики может вызвать широкий круг этических вопросов, о чем свидетельствует обширная литература по этическим проблемам в прогностическом генетическом тестировании и генной терапии соматических клеток. 6 Но как трансляционная цель биомедицинских исследований, тесное согласование фенотипической профилактики с традиционным этическим императивом биомедицины — помогать конкретным пациентам избежать страданий — придает ей широко одобряемый моральный авторитет prima facie .Это признание находит свое отражение в различных мероприятиях, начиная от программ генетического скрининга новорожденных и предсимптоматического генетического тестирования поздних проявлений заболеваний до усилий по использованию генной терапии соматических клеток для предотвращения клинических последствий рака с помощью протоколов «вакцинации против рака». 7
Важной концептуальной предпосылкой фенотипической профилактики, которая помогает обосновать ее медицинский моральный авторитет, является предположение, что ее бенефициаром является идентифицируемый индивидуальный пациент, страдания которого мы обязаны устранить.Для протоколов редактирования генов человека, направленных на модификацию соматических клеток конкретного пациента, чтобы предотвратить пагубные эффекты обнаруженных патогенных вариантов, этот критерий легко соблюдается. Но теперь, когда фундаментальные исследования по редактированию генов показывают, что можно было бы ввести такие же профилактические изменения в клетки зародышевой линии от имени будущих пациентов, что это означает?
Холокост остается самым мрачным предупреждением в истории против идеи о том, что «расовая гигиена» может имитировать усилия общественного здравоохранения по борьбе с инфекционными заболеваниями.
Некоторые утверждают, что вмешательства по редактированию генов у ранних эмбрионов, которые предназначены для предотвращения заболеваний в более позднем возрасте, являются такими же явными примерами фенотипической профилактики, как и скрининг новорожденных, и — при условии, что они могут быть выполнены безопасно — должны пользоваться таким же уровнем этического признания. Это, например, аргумент, который Хэ Цзянькуй использовал для защиты своих усилий по предотвращению ВИЧ-инфекции путем редактирования гена CCR5 в человеческих эмбрионах. 8 Однако успешная защита эмбриональной инженерии как формы фенотипической профилактики требует решения ряда спорных философских вопросов об идентичности, индивидуализации и моральном статусе ранних эмбрионов как субъектов вмешательства.Для тех, кто предпочел бы оставить эти суждения на усмотрение родителей, имеет смысл переосмыслить цель таких вмешательств как предотвращение возникновения предсказуемой проблемы со здоровьем в семье, а не ее проявления у конкретного пациента.
Профилактика генотиповЭто понимание превентивной цели редактирования генов зародышевой линии становится еще яснее, когда оно рассматривается до зачатия, как вмешательство в гаметы будущих родителей. Цель состоит в том, чтобы избежать «вертикальной передачи» патогенных генотипов внутри семьи, а не проявления патологических симптомов у конкретного пациента. 9 Когда ученые указывают на доступность доимплантационного скрининга и отбора эмбрионов, чтобы доказать, что редактирование эмбрионов почти всегда будет ненужным для предотвращения генетических заболеваний, они предполагают, что эта форма профилактики — генотипическая профилактика — является обсуждаемой целью. 10 Но предотвращение передачи определенных генетических вариантов от поколения к поколению отличается от предотвращения проявления болезни у пациента с гораздо более спорным анамнезом.
Фенотипическая профилактика предполагает наличие пациента, проблемы со здоровьем которого можно предотвратить. Таким образом, попытки разделить профилактические вмешательства в генетической медицине на традиционные уровни первичной, вторичной и третичной профилактики, используемые в профилактической медицине и общественном здравоохранении, обычно находят примеры фенотипической профилактики, такие как генетический скрининг новорожденных, на уровне вторичной профилактики, 11 , исходя из предположения, что их цель — прервать существующий процесс заболевания у больного пациента, а не предотвратить наследование его причин.Но медицинские генетические вмешательства, которые классифицируются как первичная профилактика, такие как пренатальный скрининг и скрининг на носительство, не направлены на то, чтобы уберечь конкретных пациентов от приобретения болезнетворных генов, как в контексте инфекционных заболеваний. Вместо этого цель генотипической профилактики обычно формулируется с точки зрения интересов будущих родителей, позволяя им избегать детей с предсказуемыми проблемами со здоровьем. Как отмечают исследователи инвалидности, эта цель подразумевает, что одной из характеристик генотипической профилактики всегда является молчаливое суждение о том, что бремя совладания с новыми случаями генетического заболевания может перевесить любую другую ценность, которую люди с целевыми генотипами могут принести семье или сообществу. 12
Традиция современной клинической генетики состоит в том, чтобы принимать и поддерживать репродуктивные решения будущих родителей, принимающих хорошо информированные, не принуждаемые решения о благополучии своей семьи в рамках недирективного генетического консультирования. Если редактирование генов зародышевой линии гамет и преимплантация отредактированных эмбрионов когда-либо осуществимы, уважение репродуктивной автономии должно в равной степени распространяться и на эти технологии. Тем не менее, вмешательства, направленные на генотипическую профилактику, также часто оцениваются с точки зрения общества и общественного здравоохранения, в зависимости от их способности снижать частоту генетической инвалидности и болезней в популяции.Например, известные популяционные программы генотипической профилактики, такие как средиземноморские программы скрининга носителей бета-талассемии или скрининг Тай-Сакса в общинах ашкенази, считаются историями успеха, потому что они сократили количество членов сообщества с этими состояниями, а не потому, что они увеличили родительскую автономию. 13,14 Должна ли эта логика также применяться к усилиям по редактированию генов зародышевой линии?
Расширение превентивных целей редактирования генов с целью включения интересов населения расширяет обязанности генетической медицины, выходящие за рамки медицинских потребностей конкретных семей, до совокупного населения следующего поколения.Это расширение позволяет легко импортировать цели общественного здравоохранения в редактирование генов и подчинять семейные решения потребностям населения. К сожалению, генотипическая профилактика уже имеет печально известный послужной список в этом направлении в эксцессах евгенических усилий 20-го века по «очищению и защите» идеализированных частей генофонда человека от так называемого заражения иммиграцией, межрасовыми браками и «слабыми». мыслящие. » 15 Холокост остается самым мрачным предупреждением в истории против идеи, что «расовая гигиена» может имитировать усилия общественного здравоохранения по борьбе с инфекционными заболеваниями, направленные на предотвращение вертикальной передачи определенных генотипов во имя укрепления здоровья.В той мере, в какой редактирование зародышевой линии связано с профессиональной приверженностью генотипической профилактике на уровне популяции, оно наследует всю историю, ошибочные предположения и моральные обязательства прошлого, что омрачает перспективы хорошо аргументированной общественной оценки его достоинств.
Профилактическое усилениеС момента начала исследований передачи генов человека в 1980-х годах государственная политика и профессиональное мнение отговаривали исследователей от проведения вмешательств, направленных на улучшение человеческого потенциала, из-за оценочных суждений, которые могут возникнуть в результате таких исследований, и вопросов справедливости, которые они вызывают. 16 Действительно, текущие предложения по управлению исследованиями редактирования генов человека в значительной степени соответствуют ограничениям исследований 1980-х годов на приложения для улучшения. 2 Но текущие исследования генетических вариантов, которые являются доброкачественными, функциональными или даже полезными, предлагают другой способ, которым редактирование генов может приблизиться к профилактике: путем усиления нормальных черт для создания устойчивости к болезням. Должно ли это видение превентивного усиления вызывать беспокойство по поводу улучшения человека или должно быть воспринято как законная цель трансляции для исследований по редактированию генов?
Под лозунгом «геномики благополучия» ученые уже определяют естественные варианты генома, которые, по их мнению, помогают их носителям противостоять болезням, переносить экстремальные условия окружающей среды и быстрее восстанавливаться после травм. 17 Когда редакторы генов используют эти варианты, чтобы попытаться улучшить такие черты у нечеловеческих животных, они делают это во имя сохранения здоровья и проводят аналогии с вакцинами как улучшениями иммунной системы человека, которые помогают нам бороться с инфекцией, вызываемой определенными патогенами. 3 В недавнем отчете об управлении редактированием генов человека говорится, что исследования, оправданные с точки зрения превентивного усиления человека, также могут быть использованы для обоснования трансляционных целей исследований по редактированию генов. 4
Но превентивные меры по усилению могут также вызвать те же опасения по поводу справедливости и человеческой природы, которые преследуют доклинические концепции улучшения человеческого потенциала.Некоторые профилактические укрепляющие вмешательства, такие как те, которые обещают повысить сопротивляемость ожидаемым травмам или повысить способность лучше переносить лишение сна, 18 могут дать счастливые социальные преимущества тем, у кого такие физические улучшения. Профилактическое укрепляющее вмешательство для увеличения мышечной массы у пациентов с мышечной дистрофией, например, может быть использовано «не по назначению» для улучшения здоровья здоровых людей, которые хотят увеличить мышечную массу для социальных целей. 19 В результате возникает интересная проблема для управления редактированием генов, которую еще предстоит решить: если одни и те же вмешательства могут служить законным профилактическим целям у одних пациентов и использоваться другими в целях улучшения, как следует управлять их развитием и использованием?
ОбщиеЧтобы предвидеть этические проблемы, которые могут присутствовать в трех выделенных здесь направлениях предотвращения — фенотипическая профилактика, генотипическая профилактика и превентивное усиление — политика, управляющая редактированием генов человека, должна учитывать их различия и последствия.Каждая форма профилактики направляет нас в разных направлениях: фенотипическая профилактика, к нашему новому опыту превентивной генетической медицины; генотипическая профилактика, к нашей истории усилий по контролю потока генов; и превентивное усиление в трансляционные каналы исследований полезных геномных вариантов. Что должно объединить и обосновать эти усилия, так это обновленная решимость никогда больше не позволять оскорбительным генетическим оценочным суждениям подрывать нашу приверженность нашему общему человеческому моральному равенству перед лицом нашего биологического разнообразия.
Ссылки
- Совет директоров Американского общества генетики человека. Евгеника и неправомерное использование генетической информации для ограничения репродуктивной свободы: заявление ASHG. Ам Дж. Хам Генет . 1999; 64 (2): 335-338.
Brokowski C. Сокращают ли положения этические нормы CRISPR о зародышевой линии? CRISPR J .2018; 1 (2): 115-125.
So D, Kleiderman E, Touré SB, Joly Y. Устойчивость к болезням и определение генетического улучшения. Передний Genet . 2017; 8: 40.
Национальные академии наук, инженерии и медицины. Редактирование генома человека: наука, этика и управление . Национальная академия прессы; 2017.
- Juengst ET. «Профилактика» и цели генетической медицины. Хум Джин Тер . 1995; 6 (12): 1595-1605.
Rehmann-Sutter C, Muller H, ed. Дилеммы раскрытия информации: Этика генетического прогноза после дебатов «Право знать / не знать» . Издательство Ashgate; 2009.
- Грин Н.С., Долан С.М., Мюррей TH. Скрининг новорожденных: сложности универсального генетического тестирования. Am J Public Health .2006; 96 (11): 1955-1959.
Грили HT. CRISPR’d babies: редактирование генома зародышевой линии человека в «деле Хэ Цзянькуй». Дж. Закон Биоски . 2019; 6 (1): 111-183.
Баттин М.П., Фрэнсис Л.П., Джейкобсон Дж. А., Смит С.Б. Вертикальная передача инфекционных заболеваний и генетических нарушений. В: Пациент как жертва и переносчик: этика и инфекционные заболевания . Издательство Оксфордского университета; 2009: глава 11.
Раниш Р.Редактирование генома зародышевой линии в сравнении с преимплантационной генетической диагностикой: есть ли доводы в пользу вмешательств на зародышевой линии? Биоэтика . 2020; 34 (1): 60-69.
- Кэй С., Лаксова Р., Ливингстон Дж. И др. Интеграция генетических услуг в общественное здравоохранение: руководство для государственных и территориальных программ. Сообщество Genet . 2001; 1 (4): 175-196.
Parens E, Asch A, ред. Пренатальное тестирование и права на инвалидность . Издательство Джорджтаунского университета; 2000.
- Цао А, Розателли М.К., Галанелло Р. Популяционный генетический скрининг. Curr Opin Genet Dev . 1991; 1 (1): 48-53.
- Блитцер М.Г., Макдауэлл Г.А. Болезнь Тея-Сакса как модель для выявления врожденных ошибок. Clin Lab Med .1992; 12 (3): 463-480.
Башфорд А., Левин П., ред. Оксфордский справочник по истории евгеники . Издательство Оксфордского университета; 2010.
Юенгст Э., Гранквист Х. Этические проблемы передачи генов человеку: исторический обзор. В: Ashcroft R, Dawson A, Draper H, McMillan J, eds. Принципы этики здравоохранения . Джон Уайли и сыновья; 2007: 789-797.
Коул Р.Wellness genomics: геномика для здоровья и благополучия. БиоСпектр . 15 декабря 2014 г. По состоянию на 21 июля 2020 г. https://www.biospectrumindia.com/features/73/7050/wellness-genomics-genomics-for-health-and-wellness.html
- He Y, Jones CR, Fujiki N и др. Репрессор транскрипции DEC2 регулирует продолжительность сна у млекопитающих. Наука . 2009; 325 (5942): 866-870.
Thomis MA, Aerssens J. Генетические вариации силы мышц человека — возможности терапевтического вмешательства? Curr Opin Pharmacol . 2012; 12 (3): 355-362.
Цитата
AMA J. Этика. 2021; 23 (1): E49-54.
DOI
10.1001 / amajethics.2021.49.Благодарности
Эссе было поддержано грантом HG010661 Национального института здоровья.
Раскрытие информации о конфликте интересов
У автора (-ов) не было конфликта интересов, о котором следует сообщать.
Точки зрения, выраженные в этой статье, принадлежат авторам и не обязательно отражают взгляды и политику AMA.
Информация об авторе
Эрик Т.Юнгст, доктор философии , является директором Центра биоэтики и профессором кафедры социальной медицины и генетики Медицинской школы Университета Северной Каролины в Чапел-Хилл. Он имеет докторскую степень в области философии Джорджтаунского университета, и его исследовательские интересы и публикации сосредоточены на этических, юридических и социальных последствиях новых достижений в области геномики и генетики.


 Это поможет снизить затраты на их разведение и откорм, а также защитить нас от новых эпидемий вроде птичьего или свиного гриппа. Кроме того, для таких животных не понадобятся антибиотики, которыми часто злоупотребляют фермеры.
Это поможет снизить затраты на их разведение и откорм, а также защитить нас от новых эпидемий вроде птичьего или свиного гриппа. Кроме того, для таких животных не понадобятся антибиотики, которыми часто злоупотребляют фермеры.
 Исследования, не позволяющие ожидать какого-либо непосредственного улучшения здоровья, могут проводиться лишь в порядке исключения, с максимальной осторожностью, таким образом, чтобы заинтересованное лицо подвергалось лишь минимальному риску и испытывало минимальную нагрузку, при условии, что эти исследования проводятся в интересах здоровья других лиц, принадлежащих к той же возрастной группе или обладающих такими же генетическими признаками, с соблюдением требований, предусматриваемых законом, а также с обеспечением совместимости этих исследований с защитой прав данного лица.
Исследования, не позволяющие ожидать какого-либо непосредственного улучшения здоровья, могут проводиться лишь в порядке исключения, с максимальной осторожностью, таким образом, чтобы заинтересованное лицо подвергалось лишь минимальному риску и испытывало минимальную нагрузку, при условии, что эти исследования проводятся в интересах здоровья других лиц, принадлежащих к той же возрастной группе или обладающих такими же генетическими признаками, с соблюдением требований, предусматриваемых законом, а также с обеспечением совместимости этих исследований с защитой прав данного лица.
