Прогестерон — Википедия
| Прогестерон | |
|---|---|
 | |
| Хим. формула | C21H30O2 |
| Рег. номер CAS | 57-83-0 |
| PubChem | 5994 |
| Рег. номер EINECS | 200-350-6 |
| SMILES | |
| InChI | 1S/C21h40O2/c1-13(22)17-6-7-18-16-5-4-14-12-15(23)8-10-20(14,2)19(16)9-11-21(17,18)3/h22,16-19H,4-11h3,1-3h4/t16-,17+,18-,19-,20-,21+/m0/s1 |
| ChEBI | 17026 |
| ChemSpider | 5773 |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |
 | |
Прогестерон (C21H30O2) — эндогенный стероид и прогестогенный половой гормон, оказывающий влияние на менструальный цикл, беременность и эмбриональное развитие у человека и других видов. Он принадлежит к группе стероидных гормонов, называющихся прогестогенами, и является главным прогестогеном в организме. Прогестерон также ключевое метаболическое промежуточное звено в производстве других эндогенных стероидов, включая половые гормоны и кортикостероиды, и играет ключевую роль в функционировании мозга как нейростероид.
Прогестерон один из самых важных прогестогенных гормонов в организме. Кроме того, прогестерон является агонистом многих недавно открытых прогестеронных мембранных рецепторов, так же как и лиганда PGRMC1 (прогестеронного рецепторного мембранного компонента-1, прежде известного как σ
К тому же, прогестерон связывается и ведёт себя как частичный агонист глюкокортикоидного рецептора (GR), хотя и c очень небольшой силой (EC50 >100 — значительно меньше, чем кортизола).
Прогестерон через его нейростероидные активные метаболиты, такие как 5α-дигидропрогестерон и аллопрегнанолон, действует опосредованно в качестве положительного аллостерического модулятора ГАМКА-рецептора.
Прогестерон и некоторые его метаболиты, такие как 5β-дигидропрогестерон, являются агонистами прегнан-X-рецептора (PXR), хотя и слабыми (EC50 >10 µM). Прогестерон стимулирует несколько ферментов печени, например, CYP3A4 (цитохром P450 3A4), особенно во время беременности, когда его концентрации больше, чем обычно. Было установлено, что женщины в предменопаузе имеют большую активность CYP3A4, чем у мужчин и у женщин после менопаузы, и было сделано заключение, что это может быть связано с высоким уровнем прогестерона, присутствующим у женщин в предменопаузе.
Гормональное взаимодействие[править | править код]
Прогестерон имеет ряд физиологических эффектов, которые усиливаются в присутствии эстрогенов. Эстрогены через эстрогенные рецепторы (ERs) стимулируют или активируют выработку PR. Одним из примеров этого является ткань молочных желёз, где эстроген позволяет прогестерону посредничать в лабуальвеолярном развитии.
Повышение уровня прогестерона потенциально уменьшает активность альдостерона, удерживающего натрий, что приводит к натрийурезу и уменьшению объёма межклеточной жидкости. С другой стороны, изъятие прогестерона связано с временным увеличением содержания натрия (уменьшение натрийуреза, повышение объёма межклеточной жидкости) из-за компенсирующего повышения выработки альдостерона, который борется с блокадой минералкортикоидного рецептора, ранее повышенной уровнем прогестерона.
Репродуктивная система[править | править код]
Прогестерон с помощью негеномной сигнализации оказывает ключевой эффект на сперму, так как ей нужно пройти через женские половые пути прежде, чем, возможно, произойдёт оплодотворение, хотя рецепторы до сих пор не известны.
Прогестерон иногда называют «гормоном беременности», и он имеет много функций, связанных с развитием эмбриона:
- Прогестерон переводит эндометрий в его секреторную стадию, чтобы подготовить матку к имплантации. В то же время, прогестерон влияет на вагинальный эпителий и цервикальную слизь, делая её толстой и непроницаемой для спермы. Прогестерон является антимитогенным в эпителиальных клетках эндометрия, и к тому же, уменьшает эффекты эстрогена. Если беременность не произошла, уровень прогестерона уменьшится и произойдёт менструация. Нормальные менструальные кровотечения происходят без прогестерона. Если овуляция не происходит и жёлтое тело не образовывается, уровень прогестерона может быть низким, приводя к ановуляторным маточным кровотечениям.
- Во время имплантации и беременности прогестерон уменьшает иммунную реакцию, чтобы позволить организму принять эмбрион.
- Прогестерон снижает сократительную способность гладкой мускулатуры матки.
- Прогестерон ингибирует лактацию во время беременности. Падение уровня прогестерона после родов является одним из сигналов для начала процесса выработки молока.
- Падение уровня прогестерона является одним из возможных этапов, облегчающих начало родов.
У плода плацентарный прогестерон метаболизируется при производстве стероидов, вырабатываемых надпочечниками.
Молочные железы[править | править код]
Лобулоальвеолярное развитие[править | править код]
Прогестерон играет важную роль в развитии молочных желёз у женщин. Вместе с пролактином он опосредует лобулоальвеолярное развитие молочных желёз во время беременности, чтобы обеспечить выработку молока и грудное вскармливание. Эстроген стимулирует выработку PR в грудные ткани, прогестерон зависит от эстрогена, чтобы активировать лобулоальвеолярное развитие.
Развитие протоков[править | править код]
Прогестерон, как было обнаружено, влияет на развитие протоков молочных желёз в гораздо меньшей степени, чем эстроген, который является медиатором развития протоков молочных желёз. Прогестерон опосредует развитие протоков главным образом через индукцию выработки амфирегулина, тот же самый фактор роста, которым эстроген в первую очередь стимулирует выработку медиатора развития протоков.
Результаты исследования на животных предполагают, что, хотя это и не является необходимым для полного развития молочных желёз, прогестерон кажется играет усиливающую и ускоряющую роль в опосредованном эстрогеном развитии молочных протоков.
Риск развития рака груди[править | править код]
Прогестерон также, по-видимому, участвует в патофизиологии рака молочной железы, хотя его роль и то, является ли он ингибитором развития рака молочной железы, не была полностью подтверждена.
В любом случае, хотя большинство синтетических прогестинов, таких как ацетат-медроксипрогестерон, значительно увеличивают риск возникновения рака молочной железы у женщин в период постменопаузы в сочетании с эстрогеном, как компонентом гормонозамещающей терапии, сочетание натурального прогестерона (или нетипичного прогестинового дигидростерона) с эстрогеном не делает то же, как было обнаружено.
Здоровье кожи[править | править код]
Эстрогеновые рецепторы, так же как и прогестероновые рецепторы, были обнаружены в коже, включая кератиноциты и фибробласты. В менопаузе и после неё, понижение уровня женских половых гормонов приводит к атрофии, истончению, и возрастанию числа морщин на коже и также к уменьшению её эластичности и прочности.
Эти кожные изменения составляют ускоренное старение кожи и являются результатом понижения содержания коллагена, нарушений в строении эпидермальных клеток кожи, понижения основного вещества кожных волокон, и редукции капилляров и кровотока. Кожа становится сухой во время менопаузы, что происходит из-за пониженного увлажнения и производства кожных липидов (себума).
Гормонозамещающая терапия, состоящая из систематического лечения только эстрогеном или его сочетанием с прогестероном, оказывала подтвержденные значительные положительные эффекты на кожу у женщин в период постменопаузы. Эти улучшения включают повышение содержания кожного коллагена, плотности и эластичности, а также увлажнения и производства кожных липидов. Было установлено, что местное применение эстрогена также оказывает благоприятное воздействие на кожу. В добавок, исследования выявили, что крем с 2 % содержанием прогестерона значительно повысил эластичность кожи и её прочность, а также заметно снизил число морщин у женщин в периоды пред- и постменопаузы.
Сексуальность[править | править код]
Сексуальное влечение[править | править код]
См. также: Сексуальные стимулы и гормоны
Прогестерон и аллопрегнанолон в его виде нейростероидного активного метаболита, по-видимому, играют важную роль в сексуальном влечении у женщин.
Нервная система[править | править код]
Прогестерон, как прегненолон и дегидроэпиандростерон (DHEA), принадлежит к важной группе эндогенных стероидов, называемых нейростероидами. Он может быть синтезирован в центральной нервной системе и также служить предшественником для другого важного нейростероида, аллопрегнанолона.
Паратиреоидный гормон — Википедия
Материал из Википедии — свободной энциклопедии
Па́ратирео́идный гормо́н (пара́тгормо́н, ПТГ, паратирин
Первые успехи в расшифровке структуры, природы, синтеза и основного действия паратгормона достигнуты после 1972 года[2].
Стимулом для секреции паратгормона в кровь является снижение концентрации катионов кальция в крови. Физиологическое действие паратгормона заключается в угнетении формирования костной ткани посредством влияния на популяцию остеобластов и остеоцитов. Те, в свою очередь, выделяют инсулиноподобный фактор роста 1 и цитокины, стимулирующие метаболизм остеокластов. Активированные остеокласты секретируют щелочную фосфатазу и коллагеназу, что приводит к разрушению костного матрикса.
Паратгормон опосредованно увеличивает канальцевую реабсорбцию катионов кальция, экскрецию фосфатов почками, а также кишечную абсорбцию кальция (путём индукции синтеза кальцитриола). Результатом действия паратгормона является повышение концентрации кальция в плазме крови и снижение содержания кальция в костях (деминерализация костного матрикса), снижение содержания фосфатов в плазме крови.
Биологическое действие паратгормона осуществляется за счёт связывания со специфическими ПТГ-рецепторами на поверхности клеток.
- ↑ Клиническая эндокринология. Руководство / Под ред. Н. Т. Старковой. — 3-е изд., перераб. и доп. — СПб.: Питер, 2002. — С. 182—185. — 576 с. — («Спутник Врача»). — 4000 экз. — ISBN 5-272-00314-4.
- ↑ Николаев О. В., Таркаева В. Н. Гиперпаратиреоз. — М.: Медицина, 1974.
Меланоцитстимулирующие гормоны — Википедия
Материал из Википедии — свободной энциклопедии
Меланоцитстимулирующие гормоны (меланотропины, интермедины, МСГ, меланокортины, melanocyte-stimulating hormones, MSH) — гормоны средней, или промежуточной, доли гипофиза позвоночных животных и человека. По химической природе — полипептиды.
Существует три основные разновидности МСГ:
В таблице показана их структура. Все они образуются путём расщепления общего белка-предшественника — проопиомеланокортина.
| α-МСГ: | Ac-Ser-Tyr-Ser-Met-Glu-His-Phe-Arg-Trp-Gly-Lys-Pro-Val |
| β-МСГ (человек): | Ala-Glu-Lys-Lys-Asp-Glu-Gly-Pro-Tyr-Arg-Met-Glu-His-Phe-Arg-Trp-Gly-Ser-Pro-Pro-Lys-Asp |
| β-МСГ (свинья): | Asp-Glu-Gly-Pro-Tyr-Lys-Met-Glu-His-Phe-Arg-Trp-Gly-Ser-Pro-Pro-Lys-Asp |
| γ-МСГ: | Tyr-Val-Met-Gly-His-Phe-Arg-Trp-Asp-Arg-Phe-Gly |
МСГ стимулируют синтез и секрецию меланинов (меланогенез) клетками-меланоцитами кожи и волос, а также пигментного слоя сетчатки глаза. Наиболее сильное влияние на пигментацию оказывает альфа-меланоцитстимулирующий гормон.
У многих амфибий и рептилий МСГ вызывает потемнение покровов в темноте или на темном субстрате, стимулируя дисперсию меланиновых гранул внутри клеток-меланофоров кожи.
У людей повышение уровня МСГ также вызывает потемнение кожи. Это происходит, например, при беременности, а также при болезни Аддисона, когда наряду с повышением уровня АКТГ повышается и уровень МСГ. Различия в уровне МСГ не являются главной причиной межрасовых различий в цвете кожи. У людей с рыжими волосами и светлой кожей, не способной к загару, присутствует мутация в гене одного из рецепторов МСГ.
Рецепторы МСГ относятся к семейству серпентиновых рецепторов, связанных с G-белками. У млекопитающих существует пять типов меланокортиновых рецепторов.
- Мс1r (MC1, Mc1r или рецептор меланоцитстимулирующего гормона) является одним из главных белков, регулирующих цвет кожи и волос. Он функционирует на поверхности меланоцитов, регулирующие меланогенез у млекопитающих. Под действием одного их продуктов расщепления проопиомеланокортина (как правило, это альфа-меланоцитстимулирующий гормон), MC1R инициирует сложный сигнальный каскад, который приводит к выработке чёрного или коричневого эумеланина. У большинства млекопитающих данный сигнал может быть изменён связыванием другого белка с MC1R. Белок Агути (Agouti signal protein, Asip) ингибирует взаимодействие MC1R. с альфа-меланоцитстимулирующим гормоном, что в результате приводит к выработке красного или жёлтого феомеланина. Пульсирующий характер передачи сигнала с помощью Агути через MC1R. приводит к выработке характерного окраса агути (чередование желтых и чёрных полос на волосе) у большинства млекопитающих. У некоторых видов секреция Агути не пульсирующая, она меняется не во времени, а в зависимости от участка тела. Особенно это хорошо заметно у лошадей, у которых окраска ног, хвоста и гривы чёрная, а тела — красноватая. Исключение составляют человеческие волосы, на цвет которых белок Агути не влияет.
- Mc2r — рецептор адренокортикотропного гормона (рецептор АКТГ, MC2) является специализированным рецептором клеток коры надпочечников и реагирует на AКТГ. Он находится в корковом слое надпочечников и стимулирует выработку кортизола. Рецептор АКТГ использует цАМФ в качестве посредника.
- Mc3r присутствует на клетках разных тканей, кроме коры надпочечников и меланоцитов. У нокаутных мышей повышена масса жира, несмотря на уменьшенное потребление пищи, что свидетельствует об участии этого рецептора в регуляции пищевого гомеостаза.
- Mc4r также связывает α-меланоцитстимулирующий гормон. На мышах было показано, что MC4R участвует в регуляции пищевого поведения, обмена веществ и полового поведения.
В 1998 году было обнаружено, что мутации в гене MC4R связаны с наследственной тучностью у человека. Они проявляются в гетерозиготном состоянии, что свидетельствует об аутосомно-доминантном характере наследования. Другие исследования и наблюдения показали, что эти мутации имеют неполное доминирование и некоторую степень кодоминирования.
- Mc5r. Его ген находится в 18 хромосоме человеческого генома. Когда у трансгенных мышей работа MC5R была нарушена, у них наблюдались нарушения в работе желёз внешней секреции, что привело к уменьшению выделения секрета сальных желёз.
Хорионический гонадотропин — Википедия
Хориони́ческий гонадотропи́н (ХГ, ХГЧ) — гормон, который начинает вырабатываться тканью хориона после имплантации эмбриона — уже на 6—8-й день после оплодотворения яйцеклетки и является одним из важнейших показателей наличия и благополучного развития беременности. Относится к гонадотропным гормонам наряду с лютеинизирующим и фолликулостимулирующим, но отличается от них по аминокислотной последовательности. Начинает продуцироваться с первых часов беременности и возрастает в несколько тысяч раз к 7—11-й неделе, затем постепенно снижается.
На качественном анализе наличия β-субъединицы хорионического гонадотропина в моче основан тест на беременность. Снижение уровня ХГ в крови во время беременности или замедление его роста может говорить о спонтанном выкидыше или внематочной беременности.
У мужчин и небеременных женщин появление хорионического гонадотропина в крови может быть признаком опухоли, выделяющей этот гормон.
Хорионический гонадотропин по химическому строению является гликопротеином, состоящим из двух субъединиц: альфа и бета. α-субъединица ХГ полностью гомологична α-субъединицам лютеинизирующего, фолликулостимулирующего и тиреотропного гормонов. β-субъединица ХГ уникальна именно для этого гормона и отличает его от ЛГ, ФСГ и ТТГ.
Хорионический гонадотропин состоит из 237 аминокислот и имеет молекулярную массу 36,7 килодальтон.
Хорионический гонадотропин обладает биологическими свойствами как ЛГ, так и ФСГ, и связывается с обоими типами рецепторов к гонадотропинам, но лютеинизирующая активность у ХГ значительно преобладает над фолликулостимулирующей. ХГ по лютеинизирующей активности значительно превосходит «обычный» ЛГ, производимый передней долей гипофиза.
Именно благодаря секреции значительных количеств ХГ плацентой плода жёлтое тело, в норме существующее около 2 недель в течение каждого менструального цикла, у беременных не подвергается рассасыванию и остается функционально активным в течение 10-12 недель, до того момент пока плацента не будет в состоянии сама вырабатывать эстроген и прогестерон. Причём жёлтое тело у беременных под влиянием ХГ производит очень большие количества прогестерона, физиологически невозможные в норме в небеременном организме. Также ХГ стимулирует продукцию эстрогенов и слабых андрогенов фолликулярным аппаратом яичников.
В некоторой степени ХГ также обладает, по-видимому, кортикотропными свойствами, повышая стероидогенез в коре надпочечников и способствуя функциональной гиперплазии коры надпочечников у беременной. Повышение секреции глюкокортикоидов под влиянием ХГ может играть роль в механизмах адаптации организма беременной к стрессу, каким является беременность, а также обеспечивает физиологическую иммуносупрессию, необходимую для развития генетически наполовину чужеродного организма внутри матки. В связи с этим стоит отметить, что гипофизарные гонадотропины кортикотропными свойствами не обладают.
Хорионический гонадотропин также играет роль в развитии и поддержании функциональной активности самой плаценты, улучшает её трофику и способствует увеличению количества ворсин хориона.
В небеременном организме в норме ХГ отсутствует, однако он часто производится различными злокачественными опухолями (эктопическая продукция ХГ).
Введение экзогенного ХГ у женщин в середине цикла вызывает, помимо увеличения продукции эстрогенов и прогестерона в яичниках, овуляцию, а затем лютеинизацию лопнувшего фолликула и в дальнейшем поддерживает функцию жёлтого тела.
У мужчин экзогенный ХГ стимулирует сперматогенез и продукцию половых гормонов.
Аптечный тест на беременность основан на определении наличия хорионического гонадотропина в моче. Более точным является количественное определение ХГЧ в крови.
Повышение ХГЧ может быть признаком серьёзных заболеваний у небеременных женщин и у мужчин:
- опухоли яичек
- опухолевые заболевания желудочно-кишечного тракта, свиного цепня.
- новообразования легких, почек, матки
- пузырный занос, рецидив пузырного заноса
- хорионкарцинома
Низкий ХГЧ у беременных женщин может означать неправильную постановку срока беременности или быть признаком серьёзных нарушений:
- внематочная беременность
- неразвивающаяся беременность
- задержка в развитии плода
- угроза самопроизвольного аборта (пониженный ХГЧ более чем на 50 %)
- хроническая плацентарная недостаточность
- истинное перенашивание беременности
- гибель плода (во II—III триместре беременности).
Повышенный ХГЧ у беременных женщин может означать неправильную постановку срока беременности или быть признаком:
- многоплодной беременности (прямо пропорционально количеству развивающихся плодов)
- хромосомных аномалии плода (при пониженном уровне PAPP-A)
- в случае сахарного диабета у матери
- при развитии гестоза
- в случаях применения синтетических гестагенов.
ХГЧ после овуляции повышается не только при наличии беременности. Существуют и другие причины такого явления. Результат трактуют, в зависимости от количества дней, прошедших с момента выхода ооцита из фолликула. Если ХГЧ после овуляции превышает допустимые показатели, при условии удачного оплодотворения, причина может быть следующей:
- неправильное выявление срока положения;
- многоплодная беременность;
- патологии развития ребенка;
- прием лекарственных средств на основе синтетических гестагенов;
- сахарный диабет;
- яркое проявление токсикоза.
Нормы в зависимости от лаборатории могут различаться, но имеют примерно следующий вид:
Мужчины и небеременные женщины 0 — 5
У беременных женщин:
| Срок (от зачатия) | Уровень ХГЧ, мЕд/мл |
| 1—2 недели | 25—155 |
| 2—3 недели | 101—4870 |
| 3—4 недели | 1110—31500 |
| 4—5 недель | 2560—82300 |
| 5—6 недель | 23100—151000 |
| 6—7 недель | 27300—233000 |
| 7—11 недель | 20900—291000 |
| 11—16 недель | 6140—103000 |
| 16—21 неделя | 4720—80100 |
| 21—39 недель | 2700—78100 |
Ложноотрицательные результаты (необнаружение ХГЧ при беременности):
- тест проведен слишком рано;
- внематочная беременность.
Мелатонин — Википедия
| Мелатонин | |
|---|---|
 ( {{{картинка}}}) ( ({{{картинка малая}}}) | |
| Систематическое наименование | N-[2-(5-methoxy-1H-indol-3-yl)ethyl] ethanamide |
| Хим. формула | C13H16N2O2 |
| Молярная масса | 232,278 г/моль |
| Рег. номер CAS | 73-31-4 |
| PubChem | 896 |
| Рег. номер EINECS | 200-797-7 |
| SMILES | |
| InChI | |
| ChEBI | 16796 |
| ChemSpider | 872 |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |
 Медиафайлы на Викискладе Медиафайлы на Викискладе | |
Мелатони́н — основной гормон эпифиза, регулятор циркадного ритма всех живых организмов. К другим важнейшим функциям мелатонина относится его антиоксидантная активность в организме животных. Антиоксидантное действие мелатонина выявлено и у растений.
Препараты мелатонина могут приниматься внутрь для облегчения засыпания или с целью корректировки циркадного ритма при резкой смене часовых поясов.
Гормон мелатонин был открыт в 1958 году А. Б. Лернером. Это основной гормон эпифиза — органа, передающего информацию о световом режиме окружающей среды во внутреннюю среду организма. Изменения концентрации мелатонина имеют заметный суточный ритм — как правило, высокий уровень гормона в течение ночи и низкий уровень в течение дня. Максимальные значения концентрации мелатонина в крови человека наблюдаются между полуночью и 5 часами утра[1] по местному солнечному времени. Вырабатывается основными секреторными клетками эпифиза — пинеалоцитами.
Время биологического полураспада мелатонина — 45 минут. Это означает, что для исследовательских целей образцы крови должны быть собраны через короткие промежутки времени для того, чтобы определить период в продукции мелатонина. Кроме того, нарушение сна пациента в течение ночи с целью сбора образцов может повлиять на уровень мелатонина в крови. Этих проблем можно избежать, если определять уровни метаболитов мелатонина: мелатонин сульфата (6-сульфатоксимелатонина) и 6-гидроксиглюкуронида в моче. 80—90 % мелатонина секретируется в мочу в виде мелатонин сульфата. Концентрация мелатонин сульфата в моче хорошо коррелирует с общим уровнем мелатонина в крови в течение периода сбора образцов.
Синтезированный в эпифизе мелатонин поступает в кровь и спинномозговую жидкость — ликвор, пройдя через которую, накапливается в гипоталамусе. Помимо крови и цереброспинальной жидкости, мелатонин обнаружен в моче, слюне, амниотической жидкости.
Регулирующая роль мелатонина универсальна для всех живых организмов — доказаны присутствие этого гормона и чёткая ритмичность его продукции у всех известных животных, начиная с одноклеточных[1][2].
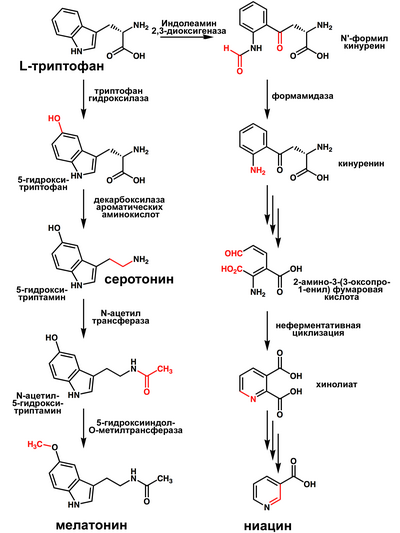
В организме человека мелатонин синтезируется из аминокислоты триптофана, которая участвует в синтезе нейромедиатора (нейропередатчика) серотонина, а он, в свою очередь, под воздействием фермента N-ацетилтрансферазы превращается в мелатонин. Показано, что мелатонин является индольным производным серотонина и синтезируется ночью ферментами N-ацетилтрансферазой и гидроксииндол-О-метилтрансферазой. У взрослого человека за сутки синтезируется около 30 мкг[источник не указан 1611 дней] мелатонина, его концентрация в сыворотке крови ночью в 30 раз больше, чем днём, причём максимум концентрации в среднем по множеству наблюдений приходится приблизительно на 2 часа ночи[1][3] по местному солнечному времени. Мелатонин транспортируется сывороточным альбумином, после освобождения от альбумина связывается со специфическими рецепторами на мембране клеток-мишеней, проникает в ядро и там осуществляет своё действие. Мелатонин быстро гидролизуется в печени и экскретируется с мочой, основным метаболитом является 6-гидроксимелатонин-сульфат (6-СОМТ), содержание которого позволяет косвенно судить о продукции мелатонина эпифизом.
В организме присутствует и мелатонин, образующийся вне эпифиза. Это открытие в 1974 году сделали российские учёные Н. Т. Райхлин и И. М. Кветной — они обнаружили, что мелатонин синтезируется в клетках червеобразного отростка кишечника. Затем выяснилось, что мелатонин образуется и в других отделах желудочно-кишечного тракта, а также во многих других органах[1].
Секреция мелатонина подчинена суточному ритму, определяющему, в свою очередь, ритмичность гонадотропных эффектов и половой функции. Синтез и секреция мелатонина зависят от освещённости — избыток света понижает его образование, а снижение освещённости увеличивает синтез и секрецию гормона. У человека с нормальным распорядком дня (со сном ночью) на ночные часы приходится примерно 70 % суточной продукции мелатонина. В клинических условиях установлено, что депривация сна в ночные часы приводит к нарушению суточного ритма выработки мелатонина — продукция в ночное время снижается и приближается к дневному уровню[4].
Исследования российских учёных под руководством доктора медицинских наук С. И. Рапопорта, проведённые на больных с ишемической болезнью сердца и артериальной гипертензией, показали достоверное снижение выработки мелатонина во время геомагнитных бурь[5][6].
Мелатонин — редкий пример гормона, у которого имеются как мембранные, так и ядерные рецепторы. У млекопитающих имеется два мембранных рецептора мелатонина — MTNR1A (MT1), экспрессирующийся в основном на клетках передней доли гипофиза и супрахиазменных ядер гипоталамуса, но также присутствующий во многих периферических органах, и MTNR1B (MT2), экспрессирующийся в некоторых других участках мозга, в сетчатке и в лёгких. У птиц, амфибий и рыб имеется третий рецептор — MTNR1С (MT3), который у млекопитающих пока не клонирован. Рецепторы мелатонина относятся к семейству рецепторов, связанных с G-белками, и действуют через Gαi-белок, снижая уровень цАМФ.
Средство от бессонницы рамелтеон (ramelteon), выпускаемое в США под торговым названием Rozerem, связывается с обоими типами рецепторов мелатонина. С этими же рецепторами связывается антидепрессант агомелатин, зарегистрированный в России под торговым названием Вальдоксан.
Недавно открытые ядерные рецепторы мелатонина относятся к подсемейству RZR/ROR ретиноидных рецепторов. Видимо, через них опосредуются многие иммуностимулирующие и противоопухолевые эффекты мелатонина.
- Регулирует деятельность эндокринной системы, кровяное давление, периодичность сна
- Уменьшает эмоциональную, интеллектуальную и физическую активность
- Регулирует сезонную ритмику у многих животных
- Замедляет рост и половое развитие у детей
- Уменьшает поступление кальция в кости
- Снижает скорость остановки кровотечения
- Повышает образование антител
- Замедляет процессы старения
- Усиливает эффективность функционирования иммунной системы
- Обладает антиоксидантными свойствами
- Влияет на процессы адаптации при быстрой смене часовых поясов
Кроме того, мелатонин участвует в регуляции
- функций пищеварительного тракта,
- работы клеток головного мозга.
Влияние на секрецию других гормонов и нейромедиаторов[править | править код]
Основное влияние мелатонина на эндокринную систему у многих видов заключается в торможении секреции гонадотропинов. Кроме того, снижается, но в меньшей степени, секреция других тропных гормонов передней доли гипофиза — кортикотропина, тиротропина, соматотропина. Мелатонин снижает чувствительность клеток передней доли к фактору выделения гонадотропинa и может подавлять его секрецию.
Данные экспериментов свидетельствуют о том, что под влиянием мелатонина повышается содержание ГАМК — в ЦНС и серотонина в среднем мозге и гипоталамусе. Известно, что ГАМК является тормозным медиатором в ЦНС, а снижение активности серотонинэргических механизмов может иметь значение в патогенезе депрессивных состояний.
Ночью мелатонин снижает уровень секреции лептина.
Влияние на сезонную ритмику и размножение[править | править код]
Так как продукция мелатонина зависит от длины светового дня, многие животные используют её как «сезонные часы». У людей, как и у животных, продукция мелатонина летом меньше, чем зимой. Таким образом, мелатонин может регулировать функции, зависящие от фотопериода — размножение, миграционное поведение, сезонную линьку. У видов птиц и млекопитающих, которые размножаются при длинном дне, мелатонин подавляет секрецию гонадотропинов и снижает уровень половой активности. У животных, размножающихся при коротком световом дне, мелатонин стимулирует половую активность. Влияние мелатонина на репродуктивную функцию у человека недостаточно изучено. В период полового созревания пиковая (ночная) концентрация мелатонина резко снижается. Зимой число менструальных циклов, не заканчивающихся овуляцией, в среднем выше, чем летом. У женщин с гипофизарной аменореей концентрация мелатонина достоверно выше, чем у здоровых. Эти данные позволяют предполагать, что мелатонин подавляет репродуктивные функции у женщин.[источник не указан 1128 дней]
Одним из основных действий мелатонина является регуляция сна. Мелатонин — основной компонент cистемы организма, задающий темп. Он принимает участие в создании циркадного (циркадианного) ритма: он непосредственно воздействует на клетки и изменяет уровень секреции других гормонов и биологически активных веществ, концентрация которых зависит от времени суток. Влияние светового цикла на ритм секреции мелатонина показано в наблюдении за слепыми. У большинства из них обнаружена ритмичная секреция гормона, но со свободно меняющимся периодом, отличающимся от суточного (25-часовой цикл по сравнению с 24-часовым суточным). То есть у большинства слепых людей ритм секреции мелатонина имеет вид циркадианной мелатониновой волны, «свободно бегущей» в отсутствие смены циклов свет-темнота. Сдвиг ритма секреции мелатонина происходит и при перелёте в другие часовые пояса.
Роль эпифиза и эпифизарного мелатонина в суточной и сезонной ритмике, режиме сна-бодрствования на сегодняшний день представляется несомненной. У диурнальных (дневных) животных (в том числе у человека) секреция мелатонина эпифизом совпадает с привычными часами сна. Проведёнными исследованиями было доказано, что повышение уровня мелатонина не является обязательным сигналом к началу сна. У большинства испытуемых прием физиологических доз мелатонина вызывал лишь мягкий седативный эффект и снижал реактивность на обычные окружающие стимулы. Существует гипотеза, что мелатонин играет роль в открытии так называемых ворот сна, в торможении режимов бодрствования, а не в прямом воздействии на сомногенные структуры головного мозга. По мнению физиологов-сомнологов, открытию «ворот сна» предшествует период повышенной активации человека — «запретный период» («запретная зона») для сна, которая довольно резко сменяется «открытием ворот».
С возрастом активность эпифиза снижается, поэтому количество мелатонина уменьшается, сон становится поверхностным и беспокойным, возможна бессонница. Мелатонин способствует устранению бессонницы, предотвращает нарушение суточного режима организма и биоритма. Бессонница и недосыпание уступают место здоровому и глубокому сну, который снимает усталость и раздражительность. Во время спокойного глубокого сна в организме нормализуется работа всех внутренних органов и систем, расслабляются мышцы, отдыхает нервная система, мозг успевает обработать накопленную за день информацию. В итоге человек чувствует себя бодрым и здоровым.
С нарушением нормального режима выработки мелатонина связаны расстройства циркадных ритмов и такие патологии, как джетлаг; бессонница, обусловленная сменным графиком работы; бессонница выходного дня; синдром задержки фазы сна и другие[7].
Мелатонин нейтрализует разрушительные последствия окислительных процессов, которые являются основной причиной старения и увядания кожи. Важнейшая функция мелатонина — антиоксидантная активность, проявляющаяся в организме повсеместно, так как мелатонин проникает во все органы и ткани. Механизм антиоксидантного действия проявляется в том, что мелатонин обладает выраженной способностью связывать свободные радикалы, в том числе образующиеся при перекисном окислении липидов гидроксильных радикалов, и экзогенные канцерогены, также он активирует глутатионпероксидазу — фактор защиты организма от свободнорадикального повреждения. Основные функции антиоксидантного действия мелатонина направлены на защиту ДНК. В меньшей степени — на защиту белков и липидов.
Мелатонин — самый сильный из известных эндогенных поглотителей свободных радикалов. В последние годы появились данные, что мелатонин может находиться не только в плазме, но и в ядрах клеток и предохранять макромолекулы ядра от окислительного повреждения во всех субклеточных структурах.
На ранних стадиях эмбрионального развития биогенные амины, в том числе мелатонин, играют роль специализированных клеточных сигнальных молекул, которые регулируют процессы клеточного обновления. Установлено, что мелатонин может подавлять клеточную пролиферацию, при этом сила его воздействия не уступает мощному цитотоксическому агенту колхицину. В ряде исследований на лабораторных животных и в системах культур опухолевых тканей было обнаружено, что мелатонин обладает противоопухолевым, онкостатическим действием. Механизмы воздействия мелатонина на опухолевый рост многообразны: он может влиять на синтез и секрецию гипофизарных и половых гормонов, способен модулировать иммунный ответ при наличии опухолевых клеток и оказывать прямой цитотоксический эффект. Имеются предположения, что мелатонин может усиливать экспрессию молекул адгезии и этим препятствовать росту опухоли, так как известно, что в большинстве злокачественных опухолей наличествуют нарушения в адгезии клеток и дефекты функциональных межклеточных связей.
Метаболит мелатонина достоверно положительно коррелирует с надёжным маркером пролиферативной активности опухолевых клеток — ядерным антигеном пролиферирующих клеток (PCNA). Этот показатель отражает степень прогрессии опухоли, то есть метаболиты мелатонина могут служить достоверным диагностическим фактором. Под воздействием мелатонина при некоторых формах рака (молочной железы, яичников, предстательной железы и др.) наблюдалось снижение пролиферативной способности клеток и увеличивалось число клеток, гибнущих в форме апоптоза (онкостатический эффект). Мишенью для реализации противоопухолевых эффектов мелатонина могут служить ядерные рецепторы раковых клеток.
In vitro было показано подавление мелатонином роста клеток меланомы, хотя эффект гормона зависел от интенсивности пролиферации опухоли: рост ингибировался при умеренной, но не при высокой пролиферативной активности клеток. Эффекты мелатонина являлись дозозависимыми, но механизм онкостатического действия на настоящий момент все ещё не вполне понятен. Эпидемиологические данные свидетельствуют, что у женщин, работающих в ночные смены, авиационных служащих (стюардессы, диспетчеры), операторов радио и телеграфа, отмечается повышенный риск развития рака молочной железы, тогда как у женщин первично слепых (то есть имеющих световую депривацию) этот риск в 2 раза меньше.
После экспериментов и прямых клинических наблюдений была сформулирована концепция, что эпифиз и его гормон мелатонин входят в защитную систему организма от неблагоприятных воздействий. Эпифиз и мелатонин играют неспецифическую роль, но эпифизарная поддержка осуществляется на всех уровнях борьбы со стрессом. В случае длительной стрессовой ситуации отмечается двухфазная реакция: первоначальный спад эпифизарной деятельности в резистентную фазу стресса с дальнейшим резким её подъёмом. В экспериментах на крысах было показано, что мелатонин способен менять отрицательное эмоциональное состояние, снижать тревожность, которая провоцируется различными стрессорами. Согласно многочисленным наблюдениям, гормон стабилизирует деятельность различных эндокринных систем, дезорганизованных стрессом, в том числе ликвидируя избыточный стрессовый адреналовый гиперкортицизм.
При переизбытке мелатонина может развиваться депрессия.
Важным последствием длительных стрессов является стрессовый иммунодефицит. Мелатонин способствует нормализации иммунологических показателей.
Мелатонин и другие эпифизарные гормоны могут быть отнесены к числу геропротективных. Установлена связь между степенью возрастной инволюции эпифиза и дряхлением тканей. Известно, что при старении снижается степень иммунологической защиты, а мелатонин, как уже неоднократно указывалось, имеет иммуномодулирующую активность.
Мелатонин стимулирует иммунную систему (иммуностимулятор), так как участвует в регуляции функции тимуса и щитовидной железы, повышая активность Т-клеток и фагоцитов, что является предупреждением для ряда заболеваний и, как показывают лабораторные исследования, замедляет рост семи видов раковых клеток, включая раковые клетки молочной и предстательной желез.
Эксперименты на лабораторных животных показали[1], что при недостатке мелатонина, вызванном удалением рецепторов, животные начинали быстрее стареть: раньше начиналась менопауза, накапливались свободнорадикальные повреждения клеток, снижалась чувствительность к инсулину, развивались ожирение и рак.
Количества гормона, которое вырабатывается в шишковидной железе, не хватает для обеспечения столь многочисленных биологических эффектов мелатонина. Исследованиями было показано, что после удаления пинеальной железы у экспериментальных животных в крови обнаруживаются значимые количества мелатонина. В настоящее время твёрдо установлено, что пинеальная железа не является монопольным органом выработки мелатонина[8]. Экстрапинеальными источниками синтеза мелатонина являются энтерохромаффинные клетки желудочно-кишечного тракта (ЕС-клетки), основные клетки-депо серотонина (содержат до 95 % всего эндогенного серотонина) — предшественника мелатонина. Выявлен синтез этого гормона в большом количестве нейроэндокринных клеток воздухоносных путей, лёгких, в корковом слое почек и вдоль границы между корковым и мозговым слоем надпочечников, под печёночной капсулой, в параганглиях, яичниках, эндометрии, предстательной железе, плаценте, желчном пузыре и внутреннем ухе. Синтез мелатонина обнаружен также и в неэндокринных клетках:
Функционально многие клетки, продуцирующие мелатонин, относятся к так называемой диффузной нейроэндокринной системе — универсальной системе адаптации и поддержания гомеостаза организма.
В пределах этой системы выделяют два звена мелатонинпродуцирующих клеток:
- центральное (включает пинеальную железу и клетки зрительной системы), в котором ритм секреции мелатонина совпадает с ритмом «свет-темнота»;
- периферическое — все остальные клетки, где секреция гормона не зависит от освещённости.
Мелатонин в течение десятилетий считался в первую очередь животным нейрогормоном. Когда мелатонин был обнаружен в экстрактах кофе в 1970-х годах, он считался побочным продуктом процесса экстракции. Однако впоследствии мелатонин был обнаружен во всех исследованных растениях. Он присутствует в разных частях растений, включая листья, стебли, корни, плоды и семена, в различных пропорциях. Особенно высокие концентрации мелатонина были измерены в популярных напитках, таких как кофе, чай, вино и пиво, а также в таких культурах, как кукуруза, рис, пшеница, ячмень и овес. Предполагается, что мелатонин может действовать в качестве регулятора роста. Мелатонин выполняет в растениях функцию защиты от окислительного стресса, то есть проявляет антиоксидантное действие. Мелатонин как антиоксидант оберегает растительные продукты от перекисного окисления, тем самым улучшая их качество и продлевая их срок годности[9].
Выпускается в таблетках, в США считается пищевой добавкой. Мелатонин в таблетках доступен к безрецептурной продаже практически во всех странах мира[10]. В России доступен как лекарственный препарат под названиями Мелаксен, Соннован, Мелапур, Мелатонин, Юкалин, Циркадин, Меларена[11]. Также доступен в магазинах спортивного питания, чаще всего — под названием Melatonin.
В июле 2011 года на полях Уилтшира (Англия) появилась пиктограмма, изображающая структурную формулу мелатонина: http://cropcircles.lucypringle.co.uk/photos/2011/roundway-hill-cropcircle-2011.shtml.
Мелатонин упоминается в песне Melanie Martinez «Milk and Cookies»: [1]
- ↑ 1 2 3 4 5 В. Н. Анисимов, Хронометр жизни, «Природа» № 7, 2007
- ↑ Котова О.В. «Роль мелатонина в лечении депрессии» (неопр.). журнал «Неврология, нейропсихиатрия, психосоматика» (2011).
- ↑ Синий и зеленый свет будят человека по-разному (05.06.2010)
- ↑ Цфасман А. З., Горохов В. Д., Алпаев Д. В. Суточный ритм мелатонина при депривации ночного сна
- ↑ Влияние магнитных бурь на сердце и сосуды — cardio.today — Информационный проект о сердце и сосудах (рус.), cardio.today — Информационный проект о сердце и сосудах (26 ноября 2018). Дата обращения 28 февраля 2019.
- ↑ Семен Рапопорт: «Сбой биоритмов – возможная причина негативного влияния магнитных бурь» (неопр.). www.sechenov.ru. Дата обращения 28 февраля 2019.
- ↑ http://www.sleepnet.ru/dzhet-lag-i-tsirkadnyie-narusheniya/ Собрание популярных и научных статей по циркадным нарушениям
- ↑ Экстрапинеальный синтез мелатонина / Мелатонин — биологический маркер старения и патологии / Геронтология (неопр.). medkarta.com. Дата обращения 21 февраля 2016.
- ↑ Мелатонин у растений (рус.). «Элементы». Дата обращения 25 декабря 2019.
- ↑ Гормон сна мелатонин — лекарство против бессонницы (рус.). FitSeven Russia (16 февраля 2016). Дата обращения 18 февраля 2016.
- ↑ rlsnet.ru Описание вещества Мелатонин (Melatonin): инструкция, применение, противопоказания и формула.
| |
Дегидроэпиандростерон — Википедия
Материал из Википедии — свободной энциклопедии
Текущая версия страницы пока не проверялась опытными участниками и может значительно отличаться от версии, проверенной 23 января 2017; проверки требуют 9 правок. Текущая версия страницы пока не проверялась опытными участниками и может значительно отличаться от версии, проверенной 23 января 2017; проверки требуют 9 правок.| Дегидроэпиандростерон | |
|---|---|
 | |
| Хим. формула | C19H28O2 |
| Рег. номер CAS | 53-43-0 |
| PubChem | 5881 |
| Рег. номер EINECS | 200-175-5 |
| SMILES | |
| InChI | 1S/C19h38O2/c1-18-9-7-13(20)11-12(18)3-4-14-15-5-6-17(21)19(15,2)10-8-16(14)18/h4,13-16,20H,4-11h3,1-2h4/t13-,14-,15-,16-,18-,19-/m0/s1 |
| ChEBI | 28689 |
| ChemSpider | 5670 |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |
 Медиафайлы на Викискладе Медиафайлы на Викискладе | |
Дегидроэпиандростерон (DHEA, ДГЭА) — полифункциональный стероидный гормон. DHEA оказывает действие на андрогеновые рецепторы.
Международное некоммерческое наименование — прастерон.
Синтез DHEA в организме проходит с участием фермента 17-альфа-гидроксилазы. Прегненолон, образованный ранее из холестерина, преобразуется данным ферментом в 17-гидроксипрегненолон, который этим же ферментом преобразуется в дегидроэпиандростерон.
DHEA, в свою очередь подвергаясь действию других ферментов стероидогенного пути, преобразуется в андростендиол и андростендион, а также в дегидроэпиандростерон-сульфат.
ДГЭА — натуральный стероидный гормон производится из холестерина в надпочечниках, в частности, в слое сетчатой коры надпочечников . Он был открыт, а затем синтезирован французским врачом и ученым Этьеном-Эмилем Баулио . Дегидроэпиандростерон химически похож на тестостерон и эстрадиол и может быть легко превращен в него. Производство этого гормона достигает своего пика в раннем взрослом возрасте, а затем начинает снижаться. Его значение в состоянии здоровья и болезни точно не установлено.
Постулируется, что его восполнение может быть полезным при следующих заболеваниях:
Тем не менее, недостаточно научно подтвержденных данных, чтобы рекомендовать использование DHEA в более широком масштабе, за исключением специализированных эндокринных центров .
DHEA может увеличить мышечный анаболизм .
США[править | править код]
Согласно законопроекту, представленному в марте 2009 г., в Американском Сенате (S. 641) попытались классифицировать ДГЭА как контролируемое вещество категории анаболических стероидов. Заказчик — Чарльз Грессли (сенатор-республиканец из штата Айова). Со-заказчики — Ричард Дурбин (сенатор-демократ из штата Иллинойс) и Джон Маккейн (сенатор-республиканец из штата Аризона). Этот законопроект был направлен в Сенатский Законодательный Комитет. В декабре 2007 г. Чарльз Грессли представил законопроект «S. 2470: Закон 2007 года о Сокращении Злоупотребления Дигидроэпиандростероном», в попытке внести поправку в Перечень Контролируемых Веществ, что сделает противозаконным для любого человека сознательную продажу или создание условий продажи продуктов, содержащих дигидроэпиандростерон лицам моложе 18 лет, включая продажу через Интернет — без рецепта. Предусматриваются только гражданские (неуголовные) штрафы. Законопроект зачитывался дважды и был упомянут в Сенатском Законодательном Комитете.
В настоящее время продажа дигидроэпиандростерона разрешена, в то же время он запрещен к употреблению участникам атлетических соревнований.
Канада[править | править код]
Требуется рецепт для покупки ДГЭА.
Андрогены — Википедия
Материал из Википедии — свободной энциклопедии
Текущая версия страницы пока не проверялась опытными участниками и может значительно отличаться от версии, проверенной 29 апреля 2017; проверки требуют 27 правок. Текущая версия страницы пока не проверялась опытными участниками и может значительно отличаться от версии, проверенной 29 апреля 2017; проверки требуют 27 правок. Стероидогенез андрогеновАндроге́ны (др.-греч. ἀνδρός род.п. от ἀνήρ «мужчина» и γένος «происхождение») — общее собирательное название группы стероидных мужских и женских половых гормонов, производимых половыми железами (семенниками у мужчин и яичниками у женщин) и корой надпочечников и обладающих свойством в определённых концентрациях вызывать андрогенез, вирилизацию организма — развитие мужских вторичных и третичных половых признаков у обоих полов.
Андрогены оказывают сильное анаболическое и анти-катаболическое действие, повышают синтез белков и тормозят их распад.
Повышают утилизацию глюкозы клетками за счёт повышения активности гексокиназы и других гликолитических ферментов.
Понижают уровень глюкозы в крови.
Увеличивают мышечную массу и силу.
Способствуют снижению общего количества подкожного жира и уменьшению жировой массы по отношению к мышечной массе, но могут увеличить отложения жира по мужскому типу (на животе) при одновременном уменьшении отложений жира в типично женских местах (ягодицы и бедра, грудь).
Андрогены оказывают атерогенное влияние на липидный обмен, снижая содержание в крови липопротеинов высокой плотности и увеличивая концентрацию липопротеинов низкой плотности (поэтому у мужчин выше риск атеросклеротических изменений сосудов).
Андрогены повышают возбудимость психосексуальных центров ЦНС, либидо (сексуальное влечение) у обоих полов, частоту и силу эрекций полового члена у мужчин, силу эрекции клитора у женщин.
Андрогены вызывают появление или развитие мужских вторичных половых признаков:
- рост волос на лице и теле по мужскому типу,
- превращение пушковых волос на лице и теле в терминальные,
- у мужчин — увеличение размеров полового члена и яичек до генетически заданного максимума, пигментацию мошонки и развитие складчатости кожи мошонки, пигментацию сосков,
- формирование мужского типа лица и скелета,
При определённой генетической предрасположенности (наличии в коже головы фермента 5-альфа-редуктазы) андрогены могут вызывать облысение головы по мужскому типу.
У женщин андрогены в характерных для мужчин концентрациях вызывают:
- увеличение размеров клитора и половых губ и сближение половых губ (что делает их более похожими на мошонку),
- прекращение менструаций и овуляций, бесплодие.
- у беременной на ранних стадиях высокие концентрации андрогенов вызывают выкидыш в связи с остановкой роста размеров матки и создающейся в матке «теснотой» для плода, несмотря на то, что сами по себе андрогены вызывают расслабление мускулатуры матки подобно прогестерону.
- понижают секрецию влагалищной смазки, в силу чего при высоком уровне андрогенов у женщин вагинальный половой акт может стать болезненным
- появление темных волос на лице, руках, ногах, прыщей
- усиление секреции сальных желез, что делает волосы и кожу лица жирными
- поведение становится мужским, появляется раздражительность, агрессия.
Повышенное содержание половых гормонов может вызвать побочные эффекты.
