Роль кальция при мышечном сокращении — Мегаобучалка
Выполнил студент группы СИМ-21
Нагайцев Р.Д.
Роль кальция при мышечном сокращении
Мы́шечное сокраще́ние — реакция мышечных клеток на воздействие нейромедиатора, реже гормона, проявляющаяся в уменьшении длины клетки. Эта жизненно важная функция организма, связанная с оборонительными, дыхательными, пищевыми, половыми, выделительными и другими физиологическими процессами.
Основой всех типов мышечного сокращения служит взаимодействие актина и миозина. В скелетных мышцах за сокращение отвечают миофибриллы (примерно две трети сухого веса мышц). Миофибриллы — структуры толщиной 1 — 2 мкм, состоящие из саркомеров — структур длиной около 2,5 мкм, состоящих из актиновых и миозиновых (тонких и толстых)филаментов и Z-дисков, соединённых с актиновыми филаментами. Сокращение происходит при увеличении концентрации в цитоплазме ионов Ca
Самые первые доказательства физиологической роли Са2+ представлены в работах Рингера (1835 – 1910). Автор обнаружил, что изолированное сердце лягушки прекращает сокращения при отсутствии кальция в омывающем растворе. Так появились раствор Рингера и другие физиологические солевые растворы.
Затем проверяли участие Са2+ в регуляции мышечного сокращения путем введения разных катионов внутрь мышечных волокон. Из всех изученных ионов только кальций вызывал сокращение при концентрациях, соизмеримых с концентрациями Са2+ обычно наблюдаемыми в живой ткани.
Впоследствии было обнаружено, что скелетная мышца не сокращается в ответ на деполяризацию мембраны, если исчерпаны запасы кальция во внутренних депо, а подвергнутые предварительной экстракции препараты волокон скелетной мышцы не сокращаются при добавлении АТФ, если отсутствует Са2+.
Количественная зависимость между концентрацией свободного Са2+ в саркоплазме и силой мышечного сокращения была установлена сравнительно недавно. Для проведения анализа удаляли поверхностную мембрану и оголенные миофибриллы обрабатывали растворами кальция различной концентрации.
Сила возрастает от нуля при концентрации кальция около 10-8 М до максимального значения при концентрации кальция около 5 х 10-6 М.
Данная зависимость между силой и концентрацией Са2+ аналогична зависимости между АТФазной активностью (скоростью гидролиза АТФ) гомогенизированных миофибрилл и концентрацией Са2+. Такое совпадение характеристик наводило на мысль, что Са2+ служит кофактором АТФазной активности миозина. Но оказалось, что это не так.
АТФазная активность чистого раствора миозина довольно низкая, но сильно возрастает при добавлении очищенного актина. Это указывает на то, что АТФазный центр миозина активируется при связывании миозина с актином. В интактной мышце активация АТФазного центра миозина осуществляется при присоединении поперечного мостика к активному филаменту. Эксперименты, проведенные в лаборатории Эбаши, показали, что тропонин и тропомиозин, лежащие вдоль актиновой спирали, препятствуют присоединению миозиновых поперечных мостиков к актину.
Сказанное выше объясняет роль Са2+ в регуляции актин-миозинового взаимодействия в скелетных и сердечной мышцах. В большинстве других мышц роль кальция иная. Есть еще по крайней мере два механизма кальцийзависимой регуляции актинмиозинового взаимодействия. В поперечнополосатых мышцах кальций инициирует сокращение, присоединяясь к легким полипептидным цепям миозина в головках поперечных мостиков. В гладких мышцах и в немышечном актомиозине сокращение контролируется кальцийзависимым фосфорилированием миозиновой головки.
Саркоплазматический ретикулум (СР) – это внутриклеточная мембранная система взаимосвязанных уплощенных пузырьков и канальцев, находится в непосредственной близости миофибрилл.
Как только стало известно, что в СР накапливаются ионы кальция, исследователи начали склоняться к мысли о том, что мышечное сокращение инициируется Са2+, высвобождаемым в саркоплазму из внутренней среды цистерн СР.
Сокращение активируется кальцием, высвобожденным из СР, а поверхностный электрический сигнал, т.е. ПД, поступает в глубокие области мышечного волокна с помощью Т-трубочек. Более того, Т-трубочки образуют тесные контакты с концевыми цистернами саркоплазматического ретикулума. Но как электрический сигнал из Т-трубочек передается в СР, давая команду к высвобождению Са
Согласно этой гипотезе, начальная стадия сопряжения процесса «возбуждение – сокращение» сопровождается распространением возбуждения по поверхности системы Т-трубочек и представляет собой активацию чувствительных к электрическому напряжению ферментов, расположенных на мембране данных трубочек рядом с концевыми цистернами СР. Эти гипотетические ферменты, по-видимому, столь же чувствительны к изменению электрического поля мембраны, как натриевый канал, и реагируют на это изменение конформационным сдвигом. Вызванный деполяризацией мембраны конформационный сдвиг переводит фермент из неактивной формы в активную. И уже этот активный фермент прямо или косвенно определяет образование ИФ
Заключение
Сокращение мышечного волокна заключается в укорочении миофибрилл в пределах каждого саркомера. Толстые (миозиновые) и тонкие (актиновые) нити, в расслабленном состоянии связанные только концевыми отделами, в момент сокращения осуществляют скользящие движения навстречу друг другу. Выделение необходимой для сокращения энергии происходит в результате превращения АТФ в АДФ под влиянием миозина. Ферментная активность миозина проявляется при условии оптимального содержания Са2+, которые накапливаются в саркоплазматической сети.
Роль ионов кальция в регуляции мышечного сокращения. Биологическая химия
Роль ионов кальция в регуляции мышечного сокращения
Ключевая роль в регуляции мышечного сокращения принадлежит ионам кальция (Са2+). Миофибриллы обладают способностью взаимодействовать с АТФ и сокращаться лишь при наличии в среде определенных концентраций ионов кальция. В покоящейся мышце концентрация ионов Са2+ поддерживается ниже пороговой величины при участии Са2+-зависимой АТФазы. В состоянии покоя эта система активного транспорта накапливает кальций в цистернах саркоплазматического ретикулума и трубочках Т-системы.
Мышечное сокращение инициируется приходом потенциала действия на концевую пластинку двигательного нерва. В синапс выделяется ацетилхолин, который связывается с постсинаптическими рецепторами мышечного волокна. Далее потенциал действия распространяется вдоль сарколеммы к поперечным трубочкам Т-системы и происходит передача сигнала на цистерны саркоплазматического ретикулума. Последние начинают освобождать находящийся в них кальций в саркоплазму. Концентрация Са2+ увеличивается с 10–7 до 10–5 ммоль/л. Кальций связывается с Тн-С, что вызывает конформационные сдвиги, передающиеся на тропомиозин и далее — на актин. Открываются закрытые ранее центры в актине для связывания с миозином. Актин взаимодействует с миозином, что инициирует сокращение мышечного волокна.
После прекращения действия двигательного импульса кальций с помощью Са2+-зависимой АТФазы откачивается из цитоплазмы в цистерны саркоплазматического ретикулума. Уход кальция из комплекса с Тн-С приводит к смещению тропомиозина и закрытию активных центров актина. Миозиновая «головка» отсоединяется от актина. Мышца расслабляется.
Кальций является аллостерическим модулятором мышечного сокращения.
Деполяризация Т-трубочек
?
Выброс Са2+ из цистерн
?
саркоплазматического ретикулума
?
Комплекс Тн-С + 4Са2+
?
Тропонин (активный)
?
Тропомиозин (активный)
?
F – актин
?
Актин – Миозин
?
АДФ, Фн
?
сократительный цикл
Рис. 33.2. Роль ионов кальция в мышечном сокращении
Поделитесь на страничкеСледующая глава >
Роль кальция в процессе сокращения
Данные о роли ионов кальция в сократительной активности мышц накапливались довольно медленно. Кальций активен в саркоплазме при такой низкой (10-6 М и менее) концентрации, что до открытия кальцийхелатных реагентов, например ЭДТА и ЭГТА, ее невозможно было поддерживать в экспериментальных растворах. Дело в том, что даже в бидистиллированной воде концентрация ионов кальция превышает 10-6 М. Самые первые доказательства физиологической роли Са2+ представлены в работах Рингера и Бакстона. Авторы обнаружили, что изолированное сердце лягушки прекращает сокращения при отсутствии кальция в омывающем растворе. Так появились раствор Рингера и другие физиологические солевые растворы.
Камада и Киносита, а затем Хейлбрун и Вертинский проверяли участие Са2+ в регуляции мышечного сокращения путем введения разных катионов внутрь мышечных волокон. Из всех изученных ионов только кальций вызывал сокращение при концентрациях, соизмеримых с концентрациями Са2+ обычно наблюдаемыми в живой ткани. Впоследствии было обнаружено, что скелетная мышца не сокращается в ответ на деполяризацию мембраны, если исчерпаны запасы кальция во внутренних депо, а подвергнутые предварительной экстракции препараты волокон скелетной мышцы не сокращаются при добавлении АТФ, если отсутствует Са2+.
Количественная зависимость между концентрацией свободного Са2+ в саркоплазме и силой мышечного сокращения была установлена сравнительно недавно. Для проведения анализа удаляли поверхностную мембрану и оголенные миофибриллы обрабатывали растворами кальция различной концентрации. Сила возрастает от нуля при концентрации кальция около 10-8 М до максимального значения при концентрации кальция около 5х10-6 М. Данная зависимость между силой и концентрацией Са2+ аналогична зависимости между АТФазной активностью (скоростью гидролиза АТФ) гомогенизированных миофибрилл и концентрацией Са2+. Такое совпадение характеристик наводило на мысль, что Са2+ служит кофактором АТФазной активности миозина. Но оказалось, что это не так.
АТФазная активность чистого раствора миозина довольно низкая, но сильно возрастает при добавлении очищенного актина. Это указывает на то, что АТФазный центр миозина активируется при связывании миозина с актином. В интактной мышце активация АТФазного центра миозина осуществляется при присоединении поперечного мостика к активному филаменту. Эксперименты, проведенные в лаборатории Эбаши, показали, что тропонин и тропомиозин, лежащие вдоль актиновой спирали, препятствуют присоединению миозиновых поперечных мостиков к актину. Тропонин – единственный белок в актиновых и миозиновых филаментах поперечнополосатых мышц позвоночных животных, имеющий высокое химическое сродство к Са2+. Каждый тропониновый комплекс связывает четыре иона кальция. Тропониновые комплексы расположены вдоль актинового филамента через каждые 40 нм, прикрепляясь одновременно к актиновому филаменту и молекуле тропомиозина. В состоянии покоя положение тропомиозина конформационно препятствует соединению головок миозина с актиновым филаментом. Связывая Са2+, тропонин претерпевает конформационные изменения, в результате чего молекула тропомиозина смещается и освобождает дорогу миозиновым поперечным мостикам для прикрепления к актиновым центрам. Следовательно, присоединение Са2+ к тропонину устраняет постоянно существующее препятствие для взаимодействия поперечных мостиков с актином. Из результатов экспериментов, сделан вывод, что ингибирование присоединения мостиков снимается при концентрации свободного Са2+ свыше 10-7 М.
Сказанное выше объясняет роль Са2+ в регуляции актин-миозинового взаимодействия в скелетных и сердечной мышце позвоночных животных. В большинстве других мышц роль кальция иная. Есть еще по крайней мере два механизма кальцийзависимой регуляции актин-миозинового взаимодействия. В поперечнополосатых мышцах большинства беспозвоночных животных кальций инициирует сокращение, присоединяясь к легким полипептидным цепям миозина в головках поперечных мостиков. В гладких мышцах позвоночных животных и в немышечном актомиозине сокращение контролируется кальцийзависимым фосфорилированием миозиновой головки.
Вопрос Какая роль кальция в мышечном сокращении?
⇐ ПредыдущаяСтр 3 из 3Ответ: Ионы кальция запускают механизм мышечного сокращения.
Вопрос в тесте: В чем заключается механизм мышечного сокращения?
Ответ: Выделение ацетилхолина (из концевой веточки аксона)àобразование потенциала действия в миоцитеàвыделение ионов кальция в саркоплазмуàобразование актин-миозиновых связей.
Вопрос в тесте: Какие белки относятся к сократительным?
Ответ:
К сократительным белкам относятся:
Актин (тонкие нити)
Миозин (толстые нити)
Тропомиозин (белок стоппер)
4. Тропонин (в соединении с кальцием способствует образованию актин-миозиновых мостиков)
Три механизма регуляции величины мышечного напряжения
Вовлечение в работу наибольшего количества ДЕ (мышечных волокон).
Все мотонейроны лежат в спинном мозге.
Чем крупнее по размеру мотонейрон, тем ниже его возбудимость (его сложнее вовлечь в работу).
Чем больше количество волокон данной мышцы возбуждается(сокращается), тем большее усилие развивает мышца.
Максимальное произвольное усилие (МПС) –сила, которую человек проявляет в произвольном усилии.
Истинная максимальная сила –измеряется только в эксперименте.
Силовой дефицит –это разница между максимальной силой и максимально произвольной силой.
Вопрос в тесте: Какой процент мышечных волокон не вовлекается в работу при максимальных усилиях у тренированного человека (какой силовой дифицит?)
Ответ: У тренированных людей менее 20%
У нетренированных людей 60% (около 60% мышечных волокон не работает)
Вопрос в тесте: Сколько мышечных волокон иннервирует мотонейрон?
Ответ: Один мотонейрон иннервирует несколько мышечных волокон
Центральные нервные факторы –способности ЦНС вовлекать большее количество мотонейронов.
Увеличение частоты импульсации мотонейронов.
При увеличении частоты импульсации мотонейронов, мышечные волокна начинают сокращаться в режиме тетануса и это приводит к увеличению мышечного напряжения.
Вопрос в тесте: наши мышечные волокна сокращаются по закону все или ничего
Режим одиночного сокращения –когда в ответ на один нервный импульс мышечное волокно сокращается и полностью расслабляется.
Режим тетанического сокращения (Тетанус) – наблюдается при увеличении частоты импульсации нейронов.
Полный (гладкий) тетанус — когда последующий импульс приходит в фазу предыдущего сокращения. Воздействие импульса происходит в конце периода укорочения, что приводит к полной суммации сокращенийßвопрос в тесте
Зубчатый тетанус — когда каждый последующий нервный импульс воздействует на начавшую расслабляться мышцу, при этом происходит неполная суммация сокращений.
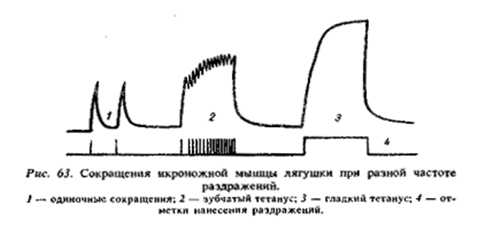
Пример: берем динамометр и держим его с усилием 95% от максимального. При этом мышцы будут работать в режиме тетануса.
3. Синхронизация нервных импульсов –при взрывных усилиях (максимальное усилие в минимальный промежуток времени) – нервные импульсы приходят синхронно к мышечным волокнам, все мышечные волокна синхронно сокращаются, что приводит к увеличению мышечной силы.
Режимы и типы мышечных сокращений
По величине укорочения мышцы различают 3 режима мышечных сокращений:
При статической работе:
1. Изометрический –тип активации мышцы, при котором мышца развивает напряжение, не изменяя своей длины. Изометрический режим в основе статической работы.
При динамической работе:
2. Изотонический –длина мышцы укорачивается, а напряжение (тонус) не меняется. При постоянной внешней нагрузке. В реальных движениях чисто изотонические движения, как правило отсутствуют. (Птичка сидит).
3. Ауксотонический – мышца развивает напряжение и укорачивается. ßвопрос в тесте
При динамической работе выделяют еще 2 типа сокращений:
Концентрический –когда внешняя нагрузка меньше, чем развиваемое мышцей напряжение. При этом мышца укорачивается и развивает движение. Работа преодолевающая (Мышцы преодолевают нагрузку).
Эксцентрический –Когда внешняя нагрузка больше, чем напряжение мышцы. В этих условиях мышца, напрягаясь растягивается, совершая отрицательную уступающую динамическую работу.
Зависимость между силой сокращения мышцы и скоростью ее укорачивания
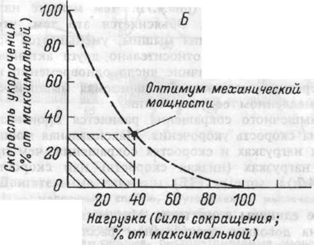
Мощность мышечного сокращения – это произведение мышечной силы на скорость укорачивания.
Оптимум механической мощности — Максимальная мощность наблюдается при средних значениях силы и скорости сокращения мышцы.
Вопрос в тесте: какая зависимость существует между силой и скоростью?
Ответ : Зависимость между силой сокращения мышцы и скоростью ее укорачивания.
Роль кальция в процессе сокращения мышц.
Данные о роли ионов кальция в сократительной активности мышц накапливались довольно медленно. Кальций активен в саркоплазме при такой низкой (10-6 М и менее) концентрации, что до открытия кальцийхелатных реагентов, например ЭДТА и ЭГТА, ее невозможно было поддерживать в экспериментальных растворах. Дело в том, что даже в бидистиллированной воде концентрация ионов кальция превышает 10-6 М. Самые первые доказательства физиологической роли Са2+ представлены в работах Рингера и Бакстона. Авторы обнаружили, что изолированное сердце лягушки прекращает сокращения при отсутствии кальция в омывающем растворе. Так появились раствор Рингера и другие физиологические солевые растворы.
Камада и Киносита, а затем Хейлбрун и Вертинский проверяли участие Са2+ в регуляции мышечного сокращения путем введения разных катионов внутрь мышечных волокон. Из всех изученных ионов только кальций вызывал сокращение при концентрациях, соизмеримых с концентрациями Са2+ обычно наблюдаемыми в живой ткани. Впоследствии было обнаружено, что скелетная мышца не сокращается в ответ на деполяризацию мембраны, если исчерпаны запасы кальция во внутренних депо, а подвергнутые предварительной экстракции препараты волокон скелетной мышцы не сокращаются при добавлении АТФ, если отсутствует Са2+.
Количественная зависимость между концентрацией свободного Са2+ в саркоплазме и силой мышечного сокращения была установлена сравнительно недавно. Для проведения анализа удаляли поверхностную мембрану и оголенные миофибриллы обрабатывали растворами кальция различной концентрации. Сила возрастает от нуля при концентрации кальция около 10-8 М до максимального значения при концентрации кальция около 5х10-6 М. Данная зависимость между силой и концентрацией Са2+ аналогична зависимости между АТФазной активностью (скоростью гидролиза АТФ) гомогенизированных миофибрилл и концентрацией Са2+. Такое совпадение характеристик наводило на мысль, что Са2+ служит кофактором АТФазной активности миозина. Но оказалось, что это не так.АТФазная активность чистого раствора миозина довольно низкая, но сильно возрастает при добавлении очищенного актина. Это указывает на то, что АТФазный центр миозина активируется при связывании миозина с актином. В интактной мышце активация АТФазного центра миозина осуществляется при присоединении поперечного мостика к активному филаменту. Эксперименты, проведенные в лаборатории Эбаши, показали, что тропонин и тропомиозин, лежащие вдоль актиновой спирали, препятствуют присоединению миозиновых поперечных мостиков к актину. Тропонин – единственный белок в актиновых и миозиновых филаментах поперечнополосатых мышц позвоночных животных, имеющий высокое химическое сродство к Са2+. Каждый тропониновый комплекс связывает четыре иона кальция. Тропониновые комплексы расположены вдоль актинового филамента через каждые 40 нм, прикрепляясь одновременно к актиновому филаменту и молекуле тропомиозина. В состоянии покоя положение тропомиозина конформационно препятствует соединению головок миозина с актиновым филаментом. Связывая Са2+, тропонин претерпевает конформационные изменения, в результате чего молекула тропомиозина смещается и освобождает дорогу миозиновым поперечным мостикам для прикрепления к актиновым центрам.
Следовательно, присоединение Са2+ к тропонину устраняет постоянно существующее
препятствие для взаимодействия поперечных мостиков с актином.
Из результатов экспериментов, сделан вывод, что ингибирование присоединения мостиков снимается при концентрации свободного Са2+ свыше 10-7 М. Сказанное выше объясняет роль Са2+ в регуляции актин-миозинового взаимодействия в скелетных и сердечной мышце позвоночных животных. В большинстве других мышц роль кальция иная. Есть еще по крайней мере два механизма кальцийзависимой регуляции актин-миозинового взаимодействия. В поперечнополосатых мышцах большинства беспозвоночных животных кальций инициирует сокращение, присоединяясь к легким полипептидным цепям миозина в головках поперечных мостиков. В гладких мышцах позвоночных животных и в немышечном актомиозине сокращение контролируется кальцийзависимым фосфорилированием миозиновой головки.
Сокращения мышечных тканей
Механизм сокращения мышечных тканей
В молекулярном механизме сокращения мышечных тканей выделяют 2 процесса. Один из них кальций-зависимый, другой — АТФ-зависимый.
В поперечнополосатой и гладкой мышцах кальций-зависимый процесс осуществляется по-разному, а АТФ-зависимый – одинаково.
Кальций-зависимый прОЦесс сокращения в Исчерченной мышце
Сокращение мышечного волокна (или кардиомиоцита) происходит только в том случае, когда на актине открываются участки для связывания миозина, в результате чего миозин соединяется с актином. При этом этапность инициации сокращения происходит в следующей последовательности: сократительный стимул (нервный импульс) проходит по сарколемме и поступает на мембраны Т-трубочек, что стимулирует образование из липидов мембран Т-трубочек инозитол-фосфатов, которые взаимодействуют с рецепторами на мембранах АЭС, что инициирует открытие кальциевых каналов в её мембранах. Выход кальция из АЭС в цитозоль (в покое концентрация кальция в цитозоле 10-7-10-8 ммоль/л, при сокращении — 10-5) и его диффузия к миофибриллам завершается образованием комплексного соединения кальция с тропонином С, в результате чего на актине открываются места для связывания миозина, который соединяется с актином и происходит сокращение.
Кальций-зависимый процесс сокращения в гладкой мышце
Сокращение миоцита происходит вследствие фосфорилирования легкой цепи миозина, только в этом случае головка миозина может связывать и расщеплять АТФ и взаимодействовать с актином. Поступление сократительного стимула (нервный импульс, гормон) инициирует открытие кальциевых каналов в цитомембране миоцита, АЭС и митохондриях. Поступающий через эти каналы кальций соединеняется с кальмодулином. Образующийся комплекс кальций-кальмодулин активирует киназу легких цепей миозина, которая фосфорилирует легкие цепи его головок, в результате чего они приобретают способность связывать и расщеплять АТФ и соединяться с актином.
АТФ-зависимый процесс сокращения
Головка миозина присоединяет молекулу АТФ и расщепляет её до АДФ и фосфата, вследствие чего головка миозина присоединяется к актину. Одновременно с этим от головки миозина отсоединяются АДФ и фосфат. Именно в этот момент головка миозина делает гребковое движение и молекула миозина продвигается вдоль молекулы актина (другими словами – молекула миозина тянет на себя актин) (см. рис. 13). Вслед за этим головка миозина присоединяет новую молекулу АТФ и только после этого отсоединяется от актина и приобретает первоначальное положение.
Таким образом, без АТФ мышца не может ни сократиться, ни расслабиться.
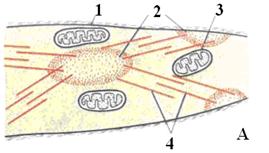
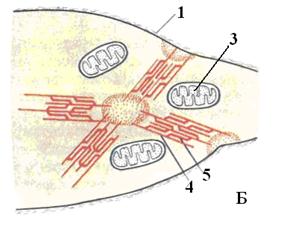
В процессе сокращения мышечных тканей важную роль выполняет гладкая эндоплазматическая сеть (АЭС). В структурных единицах мышечных тканей (особенно в поперечнополосатой) очень хорошо развита АЭС, являющаяся хранилищем ионов кальция. В её мембране имеются кальциевые каналы, по которым кальций выходит из полости АЭС и входит обратно. Выход ионов кальция из плости сети в цитозоль осуществляется пассивно, так как их концентрация в цитозоле намного ниже, чем в полости АЭС, а поступление обратно в полость представляет собой активный транспорт с затратой энергии АТФ.
Сокращение поперечнополосатых мышц
В процессе сокращения поперечнополосатых мышц длина актиновых и миозиновых филаментов не изменяется, а происходит их смещение относительно друг друга: миозиновые нити вдвигаются в пространства между актиновыми, а актиновые — между миозиновыми; в результате этого: ширина I-диска и H-полоски А-диска уменьшается, в то же время ширина диска А не изменяется, а длина саркомера укорачивается (см. рис. 12).
В структурных единицах исчерченных мышечных тканей АЭС оплетает каждую миофибриллу и близко подходит к Т-трубочкам. Сигналом для выхода кальция из канальцев АЭС являются специальные регуляторные вещества – липидные медиаторы – инозитол-3-фосфат и инозитол-4-фосфат, которые синтезируются в мембранах Т-трубочек только в момент прохождения по ним сократительного импульса. Так как канальцы сети близко подходят к Т-трубочкам, инозитол-фосфаты быстро достигают АЭС и взаимодействуют со специфическими рецепторами для инозитол-фосфатов, находящимися на её мембранах. Это приводит к открытию кальциевых каналов в мембранах АЭС и быстрый выход ионов кальция из полости канальцев в цитозоль, что и инициируют сокращение.
Сокращение гладких мышц
В отличие от поперечнополосатых мышц, в которых миофибриллы существуют постоянно, в гладких мышцах они образуются только в момент сокращения, которое происходит вследствие поступления сигнала от нервных клеток. Под воздействием медиатора в плазмолемме миоцитов образуются кавеолы, в которые путём эндоцитоза поступают ионы кальция, вызывающие полимеризацию миозина и его взаимодействие с актиновыми филаментами. Актиновые филаменты одним своим концом с помощью сшивающих белков прикрепляются к специальным областям внутренней поверхности плазмолеммы, а другим — к миозину. Миозиновые филаменты прикрепляются к специальным местам в цитозоле клетки (нексусы).
|
|
Смещение актиновых филаментов относительно миозиновых приводит к укорочению клетки. После прекращения поступления сигнала кальций покидает кавеолы, миозин деполимеризуется, миофибриллы распадаются и клетка расслабляется (рис. 14).
Рис. 14. Схема строения миоцита гладкой мышечной ткани в расслабленном состоянии (А) и при сокращении (Б). 1 – цитолемма: 2 – плотные тельца; 3 – митохондрии; 4 – актиновые филаменты; 5 — миозиновые филаменты.
Роль кальция в процессе сокращения
Данные о роли ионов кальция в сократительной активности мышц накапливались довольно медленно. Кальций активен в саркоплазме при такой низкой (10-6 М и менее) концентрации, что до открытия кальцийхелатных реагентов, например ЭДТА и ЭГТА, ее невозможно было поддерживать в экспериментальных растворах. Дело в том, что даже в бидистиллированной воде концентрация ионов кальция превышает 10-6 М.
Самые первые доказательства физиологической роли Са2+ представлены в работах Рингера и Бакстона. Авторы обнаружили, что изолированное сердце лягушки прекращает сокращения при отсутствии кальция в омывающем растворе. Так появились раствор Рингера и другие физиологические солевые растворы.
Камада и Киносита, а затем Хейлбрун и Вертинский проверяли участие Са2+ в регуляции мышечного сокращения путем введения разных катионов внутрь мышечных волокон. Из всех изученных ионов только кальций вызывал сокращение при концентрациях, соизмеримых с концентрациями Са2+ обычно наблюдаемыми в живой ткани.
Впоследствии было обнаружено, что скелетная мышца не сокращается в ответ на деполяризацию мембраны, если исчерпаны запасы кальция во внутренних депо, а подвергнутые предварительной экстракции препараты волокон скелетной мышцы не сокращаются при добавлении АТФ, если отсутствует Са2+.
Количественная зависимость между концентрацией свободного Са2+ в саркоплазме и силой мышечного сокращения была установлена сравнительно недавно. Для проведения анализа удаляли поверхностную мембрану и оголенные миофибриллы обрабатывали растворами кальция различной концентрации.
Сила возрастает от нуля при концентрации кальция около 10-8 М до максимального значения при концентрации кальция около 5 х 10-6 М.
Данная зависимость между силой и концентрацией Са2+ аналогична зависимости между АТФазной активностью (скоростью гидролиза АТФ) гомогенизированных миофибрилл и концентрацией Са2+. Такое совпадение характеристик наводило на мысль, что Са2+ служит кофактором АТФазной активности миозина. Но оказалось, что это не так.
АТФазная активность чистого раствора миозина довольно низкая, но сильно возрастает при добавлении очищенного актина. Это указывает на то, что АТФазный центр миозина активируется при связывании миозина с актином. В интактной мышце активация АТФазного центра миозина осуществляется при присоединении поперечного мостика к активному филаменту.
Эксперименты, проведенные в лаборатории Эбаши, показали, что тропонин и тропомиозин, лежащие вдоль актиновой спирали, препятствуют присоединению миозиновых поперечных мостиков к актину. Тропонин — единственный белок в актиновых и миозиновых филаментах поперечнополосатых мышц позвоночных животных, имеющий высокое химическое сродство к Са2+.
Каждый тропониновый комплекс связывает четыре иона кальция. Тропониновые комплексы расположены вдоль актинового филамента через каждые 40 нм, прикрепляясь одновременно к актиновому филаменту и молекуле тропомиозина. В состоянии покоя положение тропомиозина конформационно препятствует соединению головок миозина с актиновым филаментом. Связывая Са2+, тропонин претерпевает конформационные изменения, в результате чего молекула тропомиозина смещается и освобождает дорогу миозиновым поперечным мостикам для прикрепления к актиновым центрам. Следовательно, присоединение Са2+ к тропонину устраняет постоянно существующее препятствие для взаимодействия поперечных мостиков с актином.
Из результатов экспериментов, сделан вывод, что ингибирование присоединения мостиков снимается при концентрации свободного Са 2+ свыше 10-7 М.
Сказанное выше объясняет роль Са2+ в регуляции актин-миозинового взаимодействия в скелетных и сердечной мышце позвоночных животных. В большинстве других мышц роль кальция иная. Есть еще, по крайней мере, два механизма кальцийзависимой регуляции актин-миозинового взаимодействия. В поперечнополосатых мышцах большинства беспозвоночных животных кальций инициирует сокращение, присоединяясь к легким полипептидным цепям миозина в головках поперечных мостиков. В гладких мышцах позвоночных животных и в немышечном актомиозине сокращение контролируется кальцийзависимым фосфорилированием миозиновой головки.