Сульфид калия — Википедия
Материал из Википедии — свободной энциклопедии
Текущая версия страницы пока не проверялась опытными участниками и может значительно отличаться от версии, проверенной 2 декабря 2019; проверки требует 1 правка. Текущая версия страницы пока не проверялась опытными участниками и может значительно отличаться от версии, проверенной 2 декабря 2019; проверки требует 1 правка.Калия сульфид — бинарное неорганическое химическое соединение калия с серой. Представляет собой соединение с формулой K2S.
Сульфид калия K2S — бесцветные кубические кристаллы (a = 0,739 нм, Z=4; пространственная группа Fm3m). Хорошо растворимы в воде (с гидролизом). Растворим в спирте и глицерине. Гигроскопичен, образует ди- и пентагидраты.
Прямой синтез из элементов:
- 2K+S→100−200oCK2S{\displaystyle {\mathsf {2K+S{\xrightarrow {100-200^{o}C}}K_{2}S}}}
Восстановление сульфата калия водородом:
- K2SO4+4h3→600oC,Fe2O3K2S+4h3O{\displaystyle {\mathsf {K_{2}SO_{4}+4H_{2}{\xrightarrow {600^{o}C,Fe_{2}O_{3}}}K_{2}S+4H_{2}O}}}
или углеродом (в промышленности — кокс):
- K2SO4+4C→900oC K2S+4CO{\displaystyle {\mathsf {K_{2}SO_{4}+4C{\xrightarrow {900^{o}C}}\ K_{2}S+4CO}}}
Сульфит калия при нагревании диспропорционирует:
- 4K2SO3→600oC K2S+3K2SO4{\displaystyle {\mathsf {4K_{2}SO_{3}{\xrightarrow {600^{o}C}}\ K_{2}S+3K_{2}SO_{4}}}}
На воздухе медленно окисляется:
- 2K2S+2O2+h3O⟶ K2S2O3+2KOH{\displaystyle {\mathsf {2K_{2}S+2O_{2}+H_{2}O\longrightarrow \ K_{2}S_{2}O_{3}+2KOH}}}
в зависимости от условий проведения этой реакции образуются побочные продукты: коллоидная сера, полисульфиды калия.
Сульфид калия при поджигании сгорает:
- 2K2S+2O2→>500oC K2SO4{\displaystyle {\mathsf {2K_{2}S+2O_{2}{\xrightarrow {>500^{o}C}}\ K_{2}SO_{4}}}}
Так как сероводород является слабой кислотой, то сульфид калия разлагается кислотами:
- K2S+2HCl⟶ 2KCl+h3S↑{\displaystyle {\mathsf {K_{2}S+2HCl\longrightarrow \ 2KCl+H_{2}S\uparrow }}}
Концентрированные кислоты могут окислять выделяемый сероводород:
- K2S+3h3SO4⟶ 2KHSO4+SO2↑+S↓+2h3O{\displaystyle {\mathsf {K_{2}S+3H_{2}SO_{4}\longrightarrow \ 2KHSO_{4}+SO_{2}\uparrow +S\downarrow +2H_{2}O}}}
При кипячении раствора сульфида калия с серой или сплавления его с серой образуются полисульфиды:
- K2S+(n−1)S→K2Sn{\displaystyle {\mathsf {K_{2}S+(n-1)S\rightarrow K_{2}S_{n}}}}
для калия выделены полисульфиды вплоть до n = 6.
При пропускании через раствор сульфида калия избытка сероводорода образуются гидросульфид калия:
- K2S+h3S⟶ 2KHS{\displaystyle {\mathsf {K_{2}S+H_{2}S\longrightarrow \ 2KHS}}}
Реагирует, образовывая соединения с сульфидами Ag, Sn и другими.
Калия сульфид компонент светочувствительных эмульсий в фотографии, аналитический реагент для разделения сульфидов металлов, является компонентом входящим в состав для удаления наружного слоя шкур.
В пиротехническом деле[править | править код]
Сульфид калия образуется при сжигании пороха.
- Справочник химика / Редкол.: Никольский Б.П. и др.. — 3-е изд., испр. — Л.: Химия, 1971. — Т. 2. — 1168 с.
Пероксид калия — Википедия
Материал из Википедии — свободной энциклопедии
Текущая версия страницы пока не проверялась опытными участниками и может значительно отличаться от версии, проверенной 12 июня 2017; проверки требуют 2 правки. Текущая версия страницы пока не проверялась опытными участниками и может значительно отличаться от версии, проверенной 12 июня 2017; проверки требуют 2 правки.- 2 K+O2 →−30oC K2O2{\displaystyle {\mathsf {2\ K+O_{2}\ {\xrightarrow {-30^{o}C}}\ K_{2}O_{2}}}}
- 2 KO2 →290oC K2O2+O2{\displaystyle {\mathsf {2\ KO_{2}\ {\xrightarrow {290^{o}C}}\ K_{2}O_{2}+O_{2}}}}
- 2 KOH+(n+2)h3O2 →0oC K2O2⋅nh3O2↓+2 h3O{\displaystyle {\mathsf {2\ KOH+(n+2)H_{2}O_{2}\ {\xrightarrow {0^{o}C}}\ K_{2}O_{2}\cdot nH_{2}O_{2}\downarrow +2\ H_{2}O}}}
- образовавшийся сольват сушат над концентрированной H2SO4.
Пероксид калия представляет собой белый порошок, часто светло-жёлтый из-за примеси KO2. При нагревании желтеет и плавится без разложения при избыточном давлении O2. Имеет ионное строение (K+)2(O21-). Кристаллы пероксида калия принадлежат к ромбической сингонии, пространственная группа P nnn, параметры ячейки a = 0,6736 нм, b = 0,7001 нм, c = 0,6479 нм, Z = 4.
- При нагревании пероксид калия выше температуры плавления разлагается:
- 2K2O2 →500oC 2K2O+O2{\displaystyle {\mathsf {2K_{2}O_{2}\ {\xrightarrow {500^{o}C}}\ 2K_{2}O+O_{2}}}}
- Взаимодействует с водой (по-разному при разных температурах):
- K2O2+2h3O →low τoC 2KOH+h3O2{\displaystyle {\mathsf {K_{2}O_{2}+2H_{2}O\ {\xrightarrow {low\ \tau ^{o}C}}\ 2KOH+H_{2}O_{2}}}}
- 2K2O2+2h3O →τoC 4KOH+O2↑{\displaystyle {\mathsf {2K_{2}O_{2}+2H_{2}O\ {\xrightarrow {\tau ^{o}C}}\ 4KOH+O_{2}\uparrow }}}
- Реакция с кислотой тоже зависит от температуры:
- K2O2+2HCl →low τoC 2KCl+h3O2{\displaystyle {\mathsf {K_{2}O_{2}+2HCl\ {\xrightarrow {low\ \tau ^{o}C}}\ 2KCl+H_{2}O_{2}}}}
- 2K2O2+2h3SO4 →τoC 2K2SO4+2h3O+O2↑{\displaystyle {\mathsf {2K_{2}O_{2}+2H_{2}SO_{4}\ {\xrightarrow {\tau ^{o}C}}\ 2K_{2}SO_{4}+2H_{2}O+O_{2}\uparrow }}}
- Поглощает углекислоту из воздуха:
- 2K2O2+2CO2 → 2K2CO3+O2↑{\displaystyle {\mathsf {2K_{2}O_{2}+2CO_{2}\ {\xrightarrow {\ \ }}\ 2K_{2}CO_{3}+O_{2}\uparrow }}}
- На воздухе медленно взаимодействует с кислородом:
- K2O2+O2 → 2KO2{\displaystyle {\mathsf {K_{2}O_{2}+O_{2}\ {\xrightarrow {\ \ }}\ 2KO_{2}}}}
- Лидин Р.А. и др. Химические свойства неорганических веществ: Учеб. пособие для вузов. — 3-е изд., испр. — М.: Химия, 2000. — 480 с. — ISBN 5-7245-1163-0.
- Рипан Р., Четяну И. Неорганическая химия. Химия металлов. — М.: Мир, 1971. — Т. 1. — 561 с.
- Справочник химика / Редкол.: Никольский Б.П. и др.. — 3-е изд., испр. — Л.: Химия, 1971. — Т. 2. — 1168 с.
- Химическая энциклопедия / Редкол.: Кнунянц И.Л. и др.. — М.: Советская энциклопедия, 1990. — Т. 2. — 671 с. — ISBN 5-82270-035-5.
Амид калия — Википедия
| Амид калия | |
|---|---|
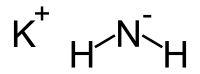 | |
| Общие | |
| Систематическое наименование | Амид калия |
| Хим. формула | KNH2 |
| Физические свойства | |
| Состояние | белые или желтоватые кристаллы |
| Молярная масса | 55,12 г/моль |
| Термические свойства | |
| Температура | |
| • плавления | 338 °C |
| Классификация | |
| Рег. номер CAS | 17242-52-3 |
| PubChem | 87015 |
| Рег. номер EINECS | 241-275-9 |
| SMILES | [Nh3-].[K+] |
| InChI | 1S/K.h3N/h;1h3/q+1;-1FEMRXDWBWXQOGV-UHFFFAOYSA-N |
| ChemSpider | 78490 и 23354231 |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |
Ами́д калия — неорганическое вещество с формулой KNH2, производное аммиака. Белые или желтоватые кристаллы.
Содержание
- 1 Получение
- 2 Химические свойства
- 3 Применение
- 4 Литература
- Реакция газообразного аммиака с металлическим калием:
- 2 K+2 Nh4→65−105oC2 KNh3+ h3{\displaystyle {\mathsf {2\ K+2\ NH_{3}{\xrightarrow {65-105^{o}C}}2\ KNH_{2}+\ H_{2}}}}
- Реакция гидрида калия с аммиаком:
- KH+Nh4→300oC KNh3+h3{\displaystyle {\mathsf {KH+NH_{3}{\xrightarrow {300^{o}C}}\ KNH_{2}+H_{2}}}}
- Реакция оксида калия с жидким аммиаком:
- K2O+Nh4→−50oC KNh3+KOH{\displaystyle {\mathsf {K_{2}O+NH_{3}{\xrightarrow {-50^{o}C}}\ KNH_{2}+KOH}}}
- При нагревании разлагается:
- 6 KNh3→600oC 6 K+4 Nh4+N2{\displaystyle {\mathsf {6\ KNH_{2}{\xrightarrow {600^{o}C}}\ 6\ K+4\ NH_{3}+N_{2}}}}
- Реагирует с водой:
- KNh3+h3O→ KOH+Nh4{\displaystyle {\mathsf {KNH_{2}+H_{2}O{\xrightarrow {\ }}\ KOH+NH_{3}}}}
- С неокисляющими кислотами:
- KNh3+2 HCl→ KCl+Nh5Cl{\displaystyle {\mathsf {KNH_{2}+2\ HCl{\xrightarrow {\ }}\ KCl+NH_{4}Cl}}}
- С окисляющими кислотами:
- 2 KNh3+2 HNO3→ KN3+KNO3+3 h3O{\displaystyle {\mathsf {2\ KNH_{2}+2\ HNO_{3}{\xrightarrow {\ }}\ KN_{3}+KNO_{3}+3\ H_{2}O}}}
- В органическом синтезе.
- Лидин Р.А., Молочко В.А., Андреева Л.Л. Химические свойства неорганических веществ: Учеб. пособие для вузов. — 3-е изд., испр. — М.: Химия, 2000. — 480 с. — ISBN 5-7245-1163-0.
- Справочник химика / Редкол.: Никольский Б.П. и др.. — 3-е изд., испр. — Л.: Химия, 1971. — Т. 2. — 1168 с.
 | Это заготовка статьи о неорганическом веществе. Вы можете помочь проекту, дополнив её. |
Оксид калия, характеристика, свойства и получение, химические реакции
Оксид калия, характеристика, свойства и получение, химические реакции.
Оксид калия – неорганическое вещество, имеет химическую формулу K2O.
Краткая характеристика оксида калия
Физические свойства оксида калия
Получение оксида калия
Химические свойства оксида калия
Химические реакции оксида калия
Применение и использование оксида калия
Краткая характеристика оксида калия:
Оксид калия – неорганическое вещество бесцветного либо бледно-желтого цвета.
Так как валентность калия равна одному, то оксид калия содержит один атом кислорода и два атома калия.
Химическая формула оксида калия K2O.
В воде не растворяется, а вступает в реакцию с ней.
Растворим в органических растворителях.
Обладает высокой гигроскопичностью.
Физические свойства оксида калия:
| Наименование параметра: | Значение: |
| Химическая формула | K2O |
| Синонимы и названия иностранном языке | potassium oxide (англ.) калия окись (рус.) |
| Тип вещества | неорганическое |
| Внешний вид | бесцветные (иногда бледно-желтый) кубические кристаллы |
| Цвет | бесцветный, иногда – бледно-желтый |
| Вкус | —* |
| Запах | — |
| Агрегатное состояние (при 20 °C и атмосферном давлении 1 атм.) | твердое вещество |
| Плотность (состояние вещества – твердое вещество, при 20 °C), кг/м | 2320 |
| Плотность (состояние вещества – твердое вещество, при 20 °C), г/см3 | 2,32 |
| Температура кипения, °C | — |
| Температура плавления, °C | 740 |
| Температура разложения, °C | 300 |
| Гигроскопичность | высокая гигроскопичность |
| Молярная масса, г/моль | 94,196 |
* Примечание:
— нет данных.
Получение оксида калия:
Оксид калия получается в результате следующих химических реакций:
- 1. из пероксида калия:
Вначале получают пероксид калия.
2К + О2 → К2О2.
Затем пероксид калия обогащают калием.
К2О2 + 2К → 2К2О.
Напрямую оксид калия путем окисления самого калия не получается.
Химические свойства оксида калия. Химические реакции оксида калия:
Химически активное вещество.
Химические свойства оксида калия аналогичны свойствам оксидов других щелочных металлов. Поэтому для него характерны следующие химические реакции:
1. реакция оксида калия с галогенами:
К2О + СІ2 → КСІ + КСІО;
К2О + Br2 → КBr + КBrО;
К2О + I2 → КI + КIО.
Оксид калия бурно реагирует с галогенами, образуя соответственно две соли:
– хлорид калия и гипохлорит калия,
– бромид калия и гипобромит калия,
– йодид калия и гипойодит калия.
2. реакция оксида калия с водой:
К2О + Н2О → 2КОН.
Оксид калия бурно реагирует с водой, образуя гидроксид калия.
3. реакция оксида калия с оксидом углерода (углекислым газом):
К2О + СО2 → К2СО3.
Оксид калия на воздухе реагирует с углекислым газом (являющийся кислотным оксидом), образуя соль – карбонат калия.
4. реакция оксида калия с оксидом серы:
К2О + SО2 → К
К2О + SО3 → К2SО4.
Оксид серы также является кислотным оксидом. В результате реакции образуется соответственно соль – в первом случае – сульфит калия, во втором случае – сульфат калия.
5. реакция оксида калия с оксидом кремния:
К2О + SiО2 → К2SiО3.
Оксид кремния также является кислотным оксидом. В результате реакции образуется соль – силикат калия.
Аналогично проходят реакции оксида калия и с другими кислотными оксидами.
6. реакция оксида калия с оксидом цинка:
К2О + ZnО → К2ZnО
Оксид цинка является амфотерным оксидом. Это значит, что как амфотерный оксид оксид цинка проявляет свойства как кислотных, так и основных соединений. В результате реакции образуется соль – цинкат калия.
Аналогично проходят реакции оксида калия и с другими амфотерными оксидами.
7. реакция оксида калия с плавиковой кислотой:
K2O + 2HF → 2KF + H2O.
В результате химической реакции получается соль – фторид калия и вода.
Аналогично проходят реакции оксида калия и с другими кислотами.
8. реакция оксида калия с бромистым водородом (бромоводородом):
K2
В результате химической реакции получается соль – бромид калия и вода.
9. реакция оксида калия с йодоводородом:
K2O + 2HI → 2KI + H2O.
В результате химической реакции получается соль – йодид калия и вода.
10. реакция оксида калия с жидким аммиаком:
K2O + NH3 → КОН + KNH2 (t = -50 oC).
В результате химической реакции получается гидроксид калия и амид калия.
Применение и использование оксида калия:
Оксид калия используется в сельском хозяйстве в качестве компонента минеральных удобрений, в строительстве в составе цемента, а также в химической промышленности для получения других соединений калия.
Примечание: © Фото //www.pexels.com, //pixabay.com




карта сайта
оксид калия реагирует кислота 1 2 3 4 5 вода
уравнение реакций соединения масса взаимодействие оксида калия
реакции с оксидом калия
Коэффициент востребованности 1 935
Феррат калия — Википедия
Материал из Википедии — свободной энциклопедии
Текущая версия страницы пока не проверялась опытными участниками и может значительно отличаться от версии, проверенной 17 июля 2016; проверки требуют 9 правок. Текущая версия страницы пока не проверялась опытными участниками и может значительно отличаться от версии, проверенной 17 июля 2016; проверки требуют 9 правок.- Fe+3KNO3+2KOH →400−420oC K2FeO4+3KNO2+h3O{\displaystyle {\mathsf {Fe+3KNO_{3}+2KOH\ {\xrightarrow {400-420^{o}C}}\ K_{2}FeO_{4}+3KNO_{2}+H_{2}O}}}
- Fe+2KOH+2h3O →e− K2FeO4+3h3↑{\displaystyle {\mathsf {Fe+2KOH+2H_{2}O\ {\xrightarrow {e^{-}}}\ K_{2}FeO_{4}+3H_{2}\uparrow }}}
- Fe2O3+3Cl2+10KOH →45−55oC 2K2FeO4+6KCl+5h3O{\displaystyle {\mathsf {Fe_{2}O_{3}+3Cl_{2}+10KOH\ {\xrightarrow {45-55^{o}C}}\ 2K_{2}FeO_{4}+6KCl+5H_{2}O}}}
- 2Fe(OH)3+4KOH+3KOCl → 2K2FeO4+3KCl+5h3O{\displaystyle {\mathsf {2Fe(OH)_{3}+4KOH+3KOCl\ {\xrightarrow {\ }}2K_{2}FeO_{4}+3KCl+5H_{2}O}}}
Феррат калия образует красно-фиолетовые кристаллы, растворимые в холодной подщелоченной воде.
- Разлагается при нагревании:
- 2K2FeO4 →500−700oC K3FeO4+KFeO2+O2{\displaystyle {\mathsf {2K_{2}FeO_{4}\ {\xrightarrow {500-700^{o}C}}\ K_{3}FeO_{4}+KFeO_{2}+O_{2}}}}
- Реагирует с горячей водой:
- 4K2FeO4+6h3O →100oC 4FeO(OH)↓+8KOH+3O2↑{\displaystyle {\mathsf {4K_{2}FeO_{4}+6H_{2}O\ {\xrightarrow {100^{o}C}}\ 4FeO(OH)\downarrow +8KOH+3O_{2}\uparrow }}}
- 4K2FeO4+10h3SO4 → 2Fe2(SO4)3+4K2SO4+3O2↑+10h3O{\displaystyle {\mathsf {4K_{2}FeO_{4}+10H_{2}SO_{4}\ {\xrightarrow {}}\ 2Fe_{2}(SO_{4})_{3}+4K_{2}SO_{4}+3O_{2}\uparrow +10H_{2}O}}}
- 4K2FeO4+4KOH →400−450oC 4K3FeO4+O2↑+2h3O{\displaystyle {\mathsf {4K_{2}FeO_{4}+4KOH\ {\xrightarrow {400-450^{o}C}}\ 4K_{3}FeO_{4}+O_{2}\uparrow +2H_{2}O}}}
- Как и другие ферраты, является сильным окислителем:
- 4K2FeO4+3Cr(OH)2 →100oC 4FeO(OH)↓+3K2CrO4+2KOH{\displaystyle {\mathsf {4K_{2}FeO_{4}+3Cr(OH)_{2}\ {\xrightarrow {100^{o}C}}\ 4FeO(OH)\downarrow +3K_{2}CrO_{4}+2KOH}}}
- Вступает в обменные реакции:
- K2FeO4+BaCl2+h3O → BaFeO4⋅h3O↓+2KCl{\displaystyle {\mathsf {K_{2}FeO_{4}+BaCl_{2}+H_{2}O\ {\xrightarrow {}}\ BaFeO_{4}\cdot H_{2}O\downarrow +2KCl}}}
- Окисляет гидрат аммиака до азота:
- 2K2FeO4+2Nh4⋅h3O → N2↑+2h3O +2FeO(OH)↓+4KOH{\displaystyle {\mathsf {2K_{2}FeO_{4}+2NH_{3}\cdot H_{2}O\ {\xrightarrow {}}\ N_{2}\uparrow +2H_{2}O\ +2FeO(OH)\downarrow +4KOH}}}
- Химическая энциклопедия / Редкол.: Кнунянц И.Л. и др.. — М.: Советская энциклопедия, 1990. — Т. 2. — 671 с. — ISBN 5-82270-035-5.
- Лидин Р.А. и др. Химические свойства неорганических веществ: Учеб. пособие для вузов. — 3-е изд., испр. — М.: Химия, 2000. — 480 с. — ISBN 5-7245-1163-0.
- Рипан Р., Четяну И. Неорганическая химия. Химия металлов. — М.: Мир, 1972. — Т. 2. — 871 с.
- И.Г. Кокаровцева, И.Н.Беляев и Л.В. Семенякова. Кислородные соединения железа(VI, V, IV). — М.: Успехи химии, 1972. — 16 с.
Надпероксид калия — Википедия
Материал из Википедии — свободной энциклопедии
Надперокси́д ка́лия (диоксид калия, супероксид калия; KO2) — неорганическое соединение жёлтого цвета, которое образуется в результате сгорания расплавленного калия в чистом кислороде. Используется во многих системах жизнеобеспечения. Молекулярный вес 71,10. Температура плавления при нормальном атмосферном давлении 490—530 °C, в вакууме (1—2 мм рт. ст.) 350—415 °C. Гигроскопичен, поглощает из воздуха водяные пары и углекислый газ. Реагирует с водой и этанолом. Плотность 2,158 г/см³.
Простой способ получения состоит в сгорании калия в чистом кислороде:
- K+O2 → KO2{\displaystyle {\mathsf {K+O_{2}\ {\xrightarrow {\ \ }}\ KO_{2}}}}
При этом продукт загрязнён примесью K2O2.
К экзотическим можно отнести способ окисления кислородом раствора калия в жидком аммиаке при ≈ −50 °C:
- K →O2 K2O2 →O2,τoC KO2{\displaystyle {\mathsf {K\ {\xrightarrow {O_{2}}}\ K_{2}O_{2}\ {\xrightarrow {O_{2},\tau ^{o}C}}\ KO_{2}}}}
при этом состав зависит от температуры проведения реакции — чем она выше, тем большая степень окисления.
Оранжево-жёлтые кристаллы тетрагональной сингонии, пространственная группа I 4/mmm, параметры ячейки a = 0,570 нм, b = 0,672 нм, Z = 4, упаковка типа CaC2.
Температура плавления 535 °C под избыточным давлением кислорода.
Раньше надпероксиду калия приписывали формулу K2O4, однако рентгенографические исследования структуры показали, что вещество состоит из ионов K+ и O−
2, что соответствует формуле KO2[1].
Надпероксид калия неустойчив и при нагревании в вакууме отщепляет кислород:
- KO2 → 290oC K2O2 → 530oC K2O{\displaystyle {\mathsf {KO_{2}\ {\xrightarrow {\ 290^{o}C}}\ K_{2}O_{2}\ {\xrightarrow {\ 530^{o}C}}\ K_{2}O}}}
Вода разлагает надпероксид калия с выделением кислорода:
- 2KO2+2h3O → 2KOH+h3O2+O2↑{\displaystyle {\mathsf {2KO_{2}+2H_{2}O\ {\xrightarrow {\ \ }}\ 2KOH+H_{2}O_{2}+O_{2}\uparrow }}}
Разбавленные кислоты разлагают надпероксид калия на пероксид водорода и кислород:
- 2KO2+2HCl → 2KCl+h3O2+O2↑{\displaystyle {\mathsf {2KO_{2}+2HCl\ {\xrightarrow {\ \ }}\ 2KCl+H_{2}O_{2}+O_{2}\uparrow }}}
С концентрированной серной кислотой выделяется озон:
- 2KO2+h3SO4 → K2SO4+h3O+O3↑{\displaystyle {\mathsf {2KO_{2}+H_{2}SO_{4}\ {\xrightarrow {\ \ }}\ K_{2}SO_{4}+H_{2}O+O_{3}\uparrow }}}
Надпероксид калия является сильным окислителем:
- 2KO2+S → K2SO4{\displaystyle {\mathsf {2KO_{2}+S\ {\xrightarrow {\ \ }}\ K_{2}SO_{4}}}}
- 4KO2+3C → 2K2CO3+CO2↑{\displaystyle {\mathsf {4KO_{2}+3C\ {\xrightarrow {\ \ }}\ 2K_{2}CO_{3}+CO_{2}\uparrow }}}
- 2KO2+2h4N → 2KOH+2h3O+N2↑{\displaystyle {\mathsf {2KO_{2}+2H_{3}N\ {\xrightarrow {\ \ }}\ 2KOH+2H_{2}O+N_{2}\uparrow }}}
Наиболее важной, в практическом применении, является реакция с углекислым газом:
- 4KO2+2CO2 → h3O 2K2CO3+3O2↑{\displaystyle {\mathsf {4KO_{2}+2CO_{2}\ {\xrightarrow {\ H_{2}O}}\ 2K_{2}CO_{3}+3O_{2}\uparrow }}}
Эта реакция используется в изолирующих противогазах для очистки выдыхаемого воздуха.
С помощью краун-эфиров надпероксид калия удалось растворить в органических растворителях и использовать для окисления органических веществ.
Промышленность[править | править код]
Надпероксид калия используется в химической промышленности как мощный окислитель, а также для удаления следов углекислого газа CO2 и воды H2O.
Космонавтика и системы жизнеобеспечения[править | править код]
Надпероксид калия применяется в российской космонавтике в качестве источника кислорода и поглотителя углекислого газа. В частности он применяется на российских космических кораблях «Союз» и в специальных костюмах для выхода в открытый космос. Используется также в средствах химзащиты для автономной генерации кислорода и во многих системах жизнеобеспечения (например, в аппаратах для глубоководного погружения, шахтных самоспасателях). Килограмм надпероксида калия может поглотить 0,309 кг CO2 с выделением 0,38 кг кислорода.
Подводные лодки[править | править код]
Также применяется в качестве резервного источника кислорода и поглотителя углекислого газа на подлодках и субмаринах (например, на минисубмарине «Приз»).
Биология[править | править код]
В результате реакции надпероксида калия с водой выделяется кислород. Однако промежуточным продуктом этой реакции в воде является супероксидный радикал — начальный компонент клеточного оксидативного стресса, поэтому надпероксид калия может использоваться в качестве неферментативного источника надпероксида (в отличие от ферментативного образования надпероксида, катализируемого, например ксантиноксидазой) для модельного оксидативного стресса.
- ↑ Реми Г. Курс неорганической химии. — М.: Изд. иностр. лит., 1963. — 921 с.
Дисульфат калия — Википедия
Материал из Википедии — свободной энциклопедии
Текущая версия страницы пока не проверялась опытными участниками и может значительно отличаться от версии, проверенной 14 июля 2016; проверки требуют 4 правки. Текущая версия страницы пока не проверялась опытными участниками и может значительно отличаться от версии, проверенной 14 июля 2016; проверки требуют 4 правки.| Дисульфат калия | |
|---|---|
 ( {{{картинка}}}) | |
| Систематическое наименование | Дисульфат калия |
| Традиционные названия | Пиросульфат калия; сернистокислый калий |
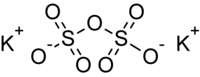
| Хим. формула | K2S2O7 |
| Состояние | бесцветные кристаллы |
| Молярная масса | 254,32 г/моль |
| Плотность | 2,27 г/см³ |
| Температура | |
| • плавления | ≈300 °C |
| Рег. номер CAS | 7790-62-7 |
| PubChem | 62681 |
| Рег. номер EINECS | 232-216-8 |
| SMILES | |
| InChI | |
| ChemSpider | 56432 |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |
Дисульфат калия — неорганическое соединение, соль щелочного металла калия и дисерной кислоты с формулой K2S2O7, бесцветные кристаллы, реагирует с водой.
- K2SO4+SO3 → K2S2O7{\displaystyle {\mathsf {K_{2}SO_{4}+SO_{3}\ {\xrightarrow {}}\ K_{2}S_{2}O_{7}}}}
- 2KHSO4 →320−340oC K2S2O7+h3O{\displaystyle {\mathsf {2KHSO_{4}\ {\xrightarrow {320-340^{o}C}}\ K_{2}S_{2}O_{7}+H_{2}O}}}
- 2K2S2O6(O2) →65−100oC 2K2S2O7+O2{\displaystyle {\mathsf {2K_{2}S_{2}O_{6}(O_{2})\ {\xrightarrow {65-100^{o}C}}\ 2K_{2}S_{2}O_{7}+O_{2}}}}
Дисульфат калия образует бесцветные кристаллы.
- Разлагается при нагревании выше температуры плавления:
- K2S2O7 →440oC K2SO4+SO3{\displaystyle {\mathsf {K_{2}S_{2}O_{7}\ {\xrightarrow {440^{o}C}}\ K_{2}SO_{4}+SO_{3}}}}
- Разлагается водой:
- K2S2O7+h3O → 2KHSO4{\displaystyle {\mathsf {K_{2}S_{2}O_{7}+H_{2}O\ {\xrightarrow {\ }}2KHSO_{4}}}}
- Реагирует с щелочами:
- K2S2O7+2KOH → 2K2SO4+h3O{\displaystyle {\mathsf {K_{2}S_{2}O_{7}+2KOH\ {\xrightarrow {}}\ 2K_{2}SO_{4}+H_{2}O}}}
- K2S2O7+SO3 → K2S3O10{\displaystyle {\mathsf {K_{2}S_{2}O_{7}+SO_{3}\ {\xrightarrow {}}\ K_{2}S_{3}O_{10}}}}
- В аналитической химии.
- Катализатор.
- Справочник химика / Редкол.: Никольский Б.П. и др.. — 3-е изд., испр. — Л.: Химия, 1971. — Т. 2. — 1168 с.
- Лидин Р.А. и др. Химические свойства неорганических веществ: Учеб. пособие для вузов. — 3-е изд., испр. — М.: Химия, 2000. — 480 с. — ISBN 5-7245-1163-0.
- Лидин Р.А. и др. Номенклатура неорганических веществ. — М.: КолосС, 2006. — 95 с. — ISBN 5-9532-0446-9.
