Хлорид калия — Википедия
Материал из Википедии — свободной энциклопедии
Текущая версия страницы пока не проверялась опытными участниками и может значительно отличаться от версии, проверенной 15 ноября 2018; проверки требуют 10 правок. Текущая версия страницы пока не проверялась опытными участниками и может значительно отличаться от версии, проверенной 15 ноября 2018; проверки требуют 10 правок.Хлори́д ка́лия — химическое соединение, неорганическое соединение состава KCl. Является средней калиевой солью соляной кислоты.
Образует белое кристаллическое вещество без запаха. Относится к структурному типу NaCl. В природе встречается в виде минералов сильвина и карналлита, а также входит в состав сильвинита.
В лабораторных условиях[править | править код]
В лабораторных условиях хлорид калия можно получить взаимодействием гидроксида калия с соляной кислотой:
- KOH+HCl→KCl+h3O{\displaystyle {\mathsf {KOH+HCl\rightarrow KCl+H_{2}O}}}
Хлорид калия получают из сильвинита методами галургии и флотации.
Галургический метод основан на различной растворимости KCl и NaCl в воде при повышенных температурах. При нормальной температуре растворимость хлоридов калия и натрия почти одинакова. С повышением температуры растворимость хлорида натрия почти не меняется, а растворимость хлорида калия резко возрастает. На холоде готовится насыщенный раствор обеих солей, затем он нагревается, и сильвинит обрабатывается полученным раствором. В процессе обработки раствор дополнительно насыщается хлоридом калия, а часть хлорида натрия вытесняется из раствора, выпадает в осадок и отделяется фильтрованием. Кристаллы отделятся на центрифугах и сушатся, а маточный раствор идет на обработку новой порции сильвинита.
Флотационный метод заключается в разделении минералов измельченной руды на основе различной их способности удерживаться на границе раздела фаз в жидкой среде.
Для медицинского воздействия на организм человека[править | править код]
Действие на организм человека. Калий — основной внутриклеточный ион, играющий важную роль в регулировании функций организма.
Показания.Нарушение сердечного ритма, интоксикация после введения сердечных гликозидов и диуретиков, недостаток калия в организме.
Фармакологическое действие хлорида калия. Нормализующее кислотно-щелочное состояние, восполняющее дефицит калия. Активирует многие цитоплазматические ферменты, регулирует внутриклеточное осмотическое давление, синтез белка, транспорт аминокислот, проведение нервных импульсов, сокращение скелетных мышц. Ионы калия понижают частоту сердечных сокращений, сократительную активность, проводимость, автоматизм и возбудимость миокарда (в большой дозе хлорид калия вызывает остановку сердца, из-за чего применяется для смертельных инъекций). В малых дозах они расширяют коронарные сосуды, в больших — сужают. Калий способствует повышению содержания ацетилхолина и возбуждению симпатического отдела ЦНС. Оказывает умеренное диуретическое действие. Увеличение уровня калия снижает риск развития токсического действия сердечных гликозидов на сердце. Калия хлорид после приёма внутрь легко и практически в любом количестве пассивно абсорбируется. В подвздошной и толстой кишках калий выделяется в просвет кишок по принципу сопряженного обмена с ионами натрия и выводится с фекалиями (10 %). Распределение калия в организме продолжается около 8 часов с момента приёма: период полувыведения в фазе абсорбции — 1,31 часа; время высвобождения из таблеток (ретард) составляет 6 часов.
В сельском хозяйстве, технике и др.[править | править код]
Хлорид калия является наиболее распространённым калийным удобрением. Согласно ГОСТ 4568-95 содержание активного вещества в пересчёте на K2O в 1-м сорте — не менее 60 %, во 2-м — не менее 58 %, воды — не более 0,5 %.
Применяется для производства гидроксида калия методом электролиза. Иногда применяется в качестве добавки (E508
При строительстве и ремонте скважин, хлорид калия используют в качестве ингибирующего компонента бурового раствора[источник не указан 1670 дней].
На кристаллах хлорида калия возможно формирование голограмм[1].
В ряде штатов США входит в состав инъекции при смертной казни[2].
Будучи наиболее доступной в быту (удобрение) солью калия, чей изотоп 40K (0,0117 %) является бета-активным с периодом полураспада 1,251⋅109 лет, удобен для проверки работы бытовых дозиметров: даже небольшая навеска соли, расположенная непосредственно рядом с окошком счётчика Гейгера даёт радиоактивный фон на уровне около 30 микрорентген/час, т. е. вдвое выше обычного.
Калий — это… Что такое Калий?
| Внешний вид простого вещества | |
|---|---|
| Серебристо-белый мягкий металл | |
| Свойства атома | |
| Имя, символ, номер | Калий / Kalium (K), 19 |
| Атомная масса (молярная масса) | 39,0983[1]а. е. м. (г/моль) |
| Электронная конфигурация | [Ar] 4s1 |
| Радиус атома | 235 пм |
| Химические свойства | |
| Ковалентный радиус | 203 пм |
| Радиус иона | 133 пм |
| Электроотрицательность | 0,82 (шкала Полинга) |
| Электродный потенциал | −2,92 В |
| Степени окисления | 1 |
| Энергия ионизации (первый электрон) | 418,5 (4,34) кДж/моль (эВ) |
| Термодинамические свойства простого вещества | |
| Плотность (при н. у.) | 0,856 г/см³ |
| Температура плавления | 63,51°С; 336,8 K |
| Температура кипения | 1047 K |
| Теплота плавления | |
| Теплота испарения | 76,9 кДж/моль |
| Молярная теплоёмкость | 29,6[2] Дж/(K·моль) |
| Молярный объём | 45,3 см³/моль |
| Кристаллическая решётка простого вещества | |
| Структура решётки | кубическая объёмно-центрированная |
| Параметры решётки | 5,332 Å |
| Температура Дебая | 100 K |
| Прочие характеристики | |
| Теплопроводность | (300 K) 79,0 Вт/(м·К) |
Ка́лий — элемент главной подгруппы первой группы, четвёртого периода периодической системы химических элементов Д. И. Менделеева, с атомным номером 19. Обозначается символом
В природе калий встречается только в соединениях с другими элементами, например, в морской воде, а также во многих минералах. Очень быстро окисляется на воздухе и очень легко вступает в химические реакции, особенно с водой, образуя щёлочь. Во многих отношениях химические свойства калия очень близки к натрию, но с точки зрения биологической функции и использования их клетками живых организмов они всё же отличаются.
История и происхождение названия
Калий (точнее, его соединения) использовался с давних времён. Так, производство поташа (который применялся как моющее средство) существовало уже в XI веке. Золу, образующуюся при сжигании соломы или древесины, обрабатывали водой, а полученный раствор (щёлок) после фильтрования выпаривали. Сухой остаток, помимо карбоната калия, содержал сульфат калия K2SO4, соду и хлорид калия KCl.
В 1807 году английский химик Дэви электролизом расплава едкого кали (KOH) выделил калий и назвал его «потассий» (лат. potassium; это название до сих пор употребительно в английском, французском, испанском, португальском и польском языках). В 1809 году Л. В. Гильберт предложил название «калий» (лат.
Нахождение в природе
В свободном состоянии не встречается. Породообразующий элемент, входит в состав слюд, полевых шпатов и т.д. Также калий входит в состав сильвина KCl, сильвинита KCl·NaCl, карналлита KCl·MgCl2·6H2O, каинита KCl·MgSO4·6H2O, а также присутствует в золе некоторых растений в виде карбоната K2CO3 (поташ). Калий входит в состав всех клеток (см. ниже раздел Биологическая роль). Кларк калия в земной коре составляет 2,4 % (5-й по распространённости металл, 7-й по содержанию в коре элемент). Концентрация в морской воде 380 мг/л
Месторождения
Крупнейшие месторождения калия находятся на территории Канады (производитель PotashCorp), России (ОАО «Уралкалий», г. Березники, ОАО «Сильвинит», г. Соликамск, Пермский край, Верхнекамское месторождение калийных руд[4]), Белоруссии (ПО «Беларуськалий», г. Солигорск, Старобинское месторождение калийных руд[5]).
Получение
Калий, как и другие щелочные металлы, получают электролизом расплавленных хлоридов или щелочей. Так как хлориды имеют более высокую температуру плавления (600—650 °C), то чаще проводят электролиз расплавленных щелочей с добавкой к ним соды или поташа (до 12 %). При электролизе расплавленных хлоридов на катоде выделяется расплавленный калий, а на аноде — хлор:
При электролизе щелочей на катоде также выделяется расплавленный калий, а на аноде — кислород:
Вода из расплава быстро испаряется. Чтобы калий не взаимодействовал с хлором или кислородом, катод изготовляют из меди и над ним помещают медный цилиндр. Образовавшийся калий в расплавленном виде собирается в цилиндре. Анод изготовляют также в виде цилиндра из никеля (при электролизе щелочей) либо из графита (при электролизе хлоридов).
Важное промышленное значение имеют и методы термохимического восстановления:
и восстановление из расплава хлорида калия карбидом кальция, алюминием или кремнием.[6][7]
Физические свойства
Калий под слоем ТГФКалий — серебристое вещество с характерным блеском на свежеобразованной поверхности. Очень лёгок и легкоплавок. Относительно хорошо растворяется в ртути, образуя амальгамы. Будучи внесённым в пламя горелки, калий (а также его соединения) окрашивает пламя в характерный розово-фиолетовый цвет[8].
Калий активно взаимодействует с водой. Выделяющийся водород воспламеняется, а ионы калия придают пламени фиолетовый цвет. Раствор фенолфталеина в воде становится малиновым, демонстрируя щелочную реакцию образующегося KOH.Калий образует кристаллы кубической сингонии, пространственная группа I m3m, параметры ячейки a = 0,5247 нм, Z = 2.
Химические свойства
Элементарный калий, как и другие щелочные металлы, проявляет типичные металлические свойства и очень химически активен, является сильным восстановителем. На воздухе свежий срез быстро тускнеет из-за образования плёнок соединений (оксиды и карбонат). При длительном контакте с атмосферой способен полностью разрушиться. С водой реагирует со взрывом. Хранить его необходимо под слоем бензина, керосина или силикона, дабы исключить контакт воздуха и воды с его поверхностью. С Na, Tl, Sn, Pb, Bi калий образует интерметаллиды.
Взаимодействие с простыми веществами
Калий при комнатной температуре реагирует с кислородом воздуха, галогенами; практически не реагирует с азотом (в отличие от лития и натрия). При умеренном нагревании реагирует с водородом с образованием гидрида (200—350 °C):
,
с халькогенами (100—200 °C, E = S, Se, Te):
.
При сгорании калия на воздухе образуется надпероксид калия KO2 (с примесью K2O2):
В реакции с фосфором в инертной атмосфере образуется фосфид зелёного цвета (200 °C):
Взаимодействие со сложными веществами
Калий при комнатной температуре активно реагирует с водой, кислотами, растворяется в жидком аммиаке (−50 °C) с образованием тёмно-синего раствора.
Калий глубоко восстанавливает разбавленные серную и азотную кислоты:
При сплавлении металлического калия со щелочами он восстанавливает водород гидроксогруппы:
При умеренном нагревании реагирует с газообразным аммиаком с образованием амида (65—105 °C):
Металлический калий реагирует со спиртами с образованием алкоголятов:
Алкоголяты щелочных металлов (в данном случае, этаноат калия) являются очень сильными основаниями и широко используются в органическом синтезе.
Соединения с кислородом
При взаимодействии калия с кислородом воздуха образуется не оксид, а пероксид и супероксид:
Оксид калия может быть получен при нагревании металла до температуры не выше 180 °C в среде, содержащей очень мало кислорода, или при нагревании смеси супероксида калия с металлическим калием:
Оксиды калия обладают ярко выраженными основными свойствами, бурно реагируют с водой, кислотами и кислотными оксидами. Практического значения они не имеют. Пероксиды представляют собой желтовато-белые порошки, которые, хорошо растворяясь в воде, образуют щёлочи и пероксид водорода:
Советский изолирующий противогаз ИП-5Свойство обменивать углекислый газ на кислород используется в изолирующих противогазах и на подводных лодках. В качестве поглотителя используют эквимолярную смесь супероксида калия и пероксида натрия. Если смесь не эквимолярна, то в случае избытка пероксида натрия поглотится больше газа, чем выделится (при поглощении двух объёмов CO2 выделяется один объём O2), и давление в замкнутом пространстве упадёт, а в случае избытка супероксида калия (при поглощении двух объёмов CO2 выделяется три объёма O2) выделяется больше газа, чем поглотится, и давление повысится.
В случае эквимолярной смеси (Na2O2:K2O4 = 1:1) объёмы поглощаемого и выделяемого газов будут равны (при поглощении четырёх объёмов CO2 выделяется четыре объёма O2).
Пероксиды являются сильными окислителями, поэтому их применяют для отбеливания тканей в текстильной промышленности.
Получают пероксиды прокаливанием металлов на воздухе, освобождённом от углекислого газа.
Также известен озонид калия KO3, оранжево-красного цвета. Получить его можно взаимодействием гидроксида калия с озоном при температуре не выше 20 °C:
Озонид калия является очень сильным окислителем, например, окисляет элементарную серу до сульфата и дисульфата уже при 50 °C:
Гидроксид
Гидроксид калия (или едкое кали) представляет собой твёрдые белые непрозрачные, очень гигроскопичные кристаллы, плавящиеся при температуре 360 °C. Гидроксид калия относится к щелочам. Он хорошо растворяется в воде с выделением большого количества тепла. Растворимость едкого кали при 20 °C в 100 г воды составляет 112 г.
Применение
- Жидкий при комнатной температуре сплав калия и натрия используется в качестве теплоносителя в замкнутых системах, например, в атомных силовых установках на быстрых нейтронах. Кроме того, широко применяются его жидкие сплавы с рубидием и цезием. Сплав состава: натрий 12 %, калий 47 %, цезий 41 % — обладает рекордно низкой температурой плавления −78 °C.
- Соединения калия — важнейший биогенный элемент и потому применяются в качестве удобрений.
- Соли калия широко используются в гальванотехнике, так как, несмотря на относительно высокую стоимость, они часто более растворимы, чем соответствующие соли натрия, и потому обеспечивают интенсивную работу электролитов при повышенной плотности тока.
Важные соединения
Кристаллы перманганата калияБиологическая роль
Калий — важнейший биогенный элемент, особенно в растительном мире. При недостатке калия в почве растения развиваются очень плохо, уменьшается урожай, поэтому около 90 % добываемых солей калия используют в качестве удобрений.
Калий в организме человека
 | В этом разделе не хватает ссылок на источники информации. Информация должна быть проверяема, иначе она может быть поставлена под сомнение и удалена. Вы можете отредактировать эту статью, добавив ссылки на авторитетные источники. Эта отметка установлена 12 мая 2011. |
Калий содержится большей частью в клетках, до 40 раз больше чем в межклеточном пространстве. В процессе функционирования клеток избыточный калий покидает цитоплазму, поэтому для сохранения концентрации он должен нагнетаться обратно при помощи натрий-калиевого насоса. Калий и натрий между собой функционально связаны и выполняют следующие функции:
- Создание условий для возникновения мембранного потенциала и мышечных сокращений.
- Поддержание осмотической концентрации крови.
- Поддержание кислотно-щелочного баланса.
- Нормализация водного баланса.
Рекомендуемая суточная доля калия составляет для детей от 600 до 1700 миллиграммов, для взрослых от 1800 до 5000 миллиграммов. Потребность в калии зависит от общего веса тела, физической активности, физиологического состояния, и климата места проживания. Рвота, продолжительные поносы, обильное потение, использование мочегонных повышают потребность организма в калии.
Основными пищевыми источниками являются сушёные абрикосы, дыня, бобы, киви, картофель, батат, авокадо, бананы, брокколи, печень, молоко, ореховое масло, цитрусовые, виноград. Калия достаточно много в рыбе и молочных продуктах.
Практически все сорта рыбы содержат более 200 мг калия в 100 г. Количество калия в разных видах рыбы различается. Овощи, грибы и травы также содержат много калия, однако в консервированных продуктах его уровень может быть гораздо меньше. Много калия содержится в шоколаде.
Всасывание происходит в тонком кишечнике. Усвоение калия облегчает витамин B6, затрудняет — алкоголь.
При недостатке калия развивается гипокалиемия. Возникают нарушения работы сердечной и скелетной мускулатуры. Продолжительный дефицит калия может быть причиной острой невралгии.
При переизбытке калия развивается гиперкалиемия, для которой основным симптомом является язва тонкого кишечника. Настоящая гиперкалиемия может вызвать остановку сердца.
Изотопы
Природный калий состоит из трёх изотопов. Два из них стабильны: 39K (изотопная распространённость 93,258 %) и 41K (6,730 %). Третий изотоп 40K (0,0117 %) является бета-активным с периодом полураспада 1,251·109 лет. В каждом грамме природного калия в секунду распадается в среднем 32 ядра 40K, благодаря чему, например, в организме человека массой 70 кг ежесекундно происходит около 4000 радиоактивных распадов. Поэтому легкодоступные в быту соединения калия (поташ, хлорид калия, калийная селитра и т. д.) можно использовать как пробные радиоактивные источники для проверки бытовых дозиметров. 40K наряду с ураном и торием считается одним из основных источников геотермальной энергии, выделяемой в недрах Земли (полная скорость энерговыделения оценивается в 40—44 ТВт). В минералах, содержащих калий, постепенно накапливается калий-аргоновый метод является одним из основных методов ядерной геохронологии.
См. также
Примечания
- ↑ Atomic Weights and Isotopic Compositions for All Elements. NIST Physical Measurement Laboratory. Архивировано из первоисточника 22 августа 2011. Проверено 16 ноября 2010.
- ↑ Химическая энциклопедия: в 5 т / Редкол.: Кнунянц И. Л. (гл. ред.). — М.: Советская энциклопедия, 1990. — Т. 2. — С. 284. — 671 с. — 100 000 экз.
- ↑ J. P. Riley and Skirrow G. Chemical Oceanography V. 1, 1965
- ↑ КАЛИЙНОЕ МЕСТОРОЖДЕНИЕ
- ↑ Химическое и агрохимическое сырье.
- ↑ А. Ф. Алабышев, К. Д Грачев, С. А. Зарецкий, М. Ф. Лантратов, Натрий и калий (получение, свойства, применение), Л: Гос. н-т. изд-во хим. лит., 1959, С. 321.
- ↑ Хим.энциклопедия, т.2, М.: Сов. энциклопедия, 1990, С.562.
- ↑ Элементы: проба на окрашивание пламени (рус.). Архивировано из первоисточника 22 августа 2011. Проверено 26 января 2010.
Литература
- Пилипенко А. Т. Натрий и калий // Справочник по элементарной химии. — 2-е изд. — Киев: Наукова думка, 1978. — С. 316—319.
- Дроздов А. Яростные металлы // Энциклопедия для детей. Химия. — М.: Аванта +, 2002. — С. 184—187. — ISBN 5-8483-0027-5
- Ахметов Н. С. Общая и неорганическая химия. — М.: Высшая школа, 2001.
- Некрасов Б. В. Основы общей химии. — М.: Химия, 1974.
- Спицын В. И., Мартыненко Л. И. Неорганическая химия. — М.: МГУ, 1991, 1994.
- Лидин Р. А. и др. Элементы IA-группы. Калий // Химические свойства неорганических веществ: Уч. пособие для вузов. — 4-е изд. — М.: КолосС, 2003. — С. 29—40. — ISBN 5-9532-0095-1
Ссылки
 Электрохимический ряд активности металлов Электрохимический ряд активности металлов | |
|---|---|
Eu, Sm, Li, Cs, Rb, K, Ra, Ba, Sr, Ca, Na, Ac, La, Ce, Pr, Nd, Pm, Gd, Tb, Mg, Y, Dy, Am, Ho, Er, Tm, Lu, Sc, Pu, Th, Np, U, Hf, Be, Al, Ti, Zr, Yb, Mn, V, Nb, Pa, Cr, Zn, Ga, Fe, Cd, In, Tl, Co, Ni, Te, Mo, Sn, Pb, H2, W, Sb, Bi, Ge, Re, Cu, Tc, Te, Rh, Po, Hg, Ag, Pd, Os, Ir, Pt, Au |
| ||||||||||||
Сульфат калия — Википедия
| Сульфат калия | |||
|---|---|---|---|
 ( {{{картинка}}}) | |||
| |||
| Систематическое наименование | сульфат калия | ||
| Традиционные названия | сернокислый калий | ||
| Хим. формула | K2SO4 | ||
| Состояние | белое кристаллическое вещество | ||
| Молярная масса | 174.259 г/моль | ||
| Плотность | 2.66 г/см³ | ||
| Температура | |||
| • плавления | 1069 °C | ||
| • кипения | 1689 °C | ||
| • вспышки | негорюч °C | ||
| Мол. теплоёмк. | 131,4 Дж/(моль·К) | ||
| Энтальпия | |||
| • образования | −1437,7 кДж/моль | ||
| Растворимость | |||
| • в воде | (20 °C) 11.1 г/100мл (25 °C) 12 г/100мл (100 °C) 24 г/100 мл | ||
| • в остальных веществах | слабо растворим в глицерине, нерастворим в ацетоне, спирте, CS2 | ||
| Кристаллическая структура | ромбическая | ||
| Рег. номер CAS | 7778-80-5 | ||
| PubChem | 24507 | ||
| Рег. номер EINECS | 231-915-5 | ||
| SMILES | |||
| InChI | |||
| Кодекс Алиментариус | E515(i) | ||
| RTECS | TT5900000 | ||
| ChEBI | 32036 | ||
| ChemSpider | 22915 | ||
| ЛД50 | 6600 мг/кг | ||
| NFPA 704 |  | ||
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |||
 Медиафайлы на Викискладе Медиафайлы на Викискладе | |||
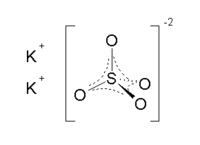
Сульфат калия — неорганическое соединение. Химическая формула K2SO4.
Сульфат калия был известен с начала 14-го века, изучен Глаубером, Бойлом и Тахеусом. В 17 веке он был назван arcanuni или sal duplicatum — эти названия были для кислот и щелочных солей.
В природе находится на месторождениях калийных солей. Присутствует в водах солёных озёр.
Бесцветные кристаллы, ромбическая сингония (a = 0,742 нм, b = 1,001 нм, c = 0,573 нм, Z = 4, пространственная группа Pnam). При температуре выше 584 °C переходит в гексагональную модификацию (a = 0,5947 нм, c = 0,8375 нм, Z = 2, пространственная группа P63/mmc).
Хорошо растворим в воде, не подвергается гидролизу. Нерастворим в концентрированных растворах щелочей или в чистом этаноле.
Вкус горько-солёный[1].
Минеральные формы чистого сульфата калия относительно редки. Минерал арканит (англ. Arcanite) состоит из чистого K2SO4, представляет собой белые или прозрачные кристаллы, встречается в Калифорнии (США).
Есть много минералов, содержащих соли калия:
Промышленные методы получения основаны на обменных реакциях KCl с различными сульфатами и в результате сульфат калия, как правило, сильно загрязнён побочными продуктами:
- 2KCl+2MgSO4⇄K2SO4⋅MgSO4+MgCl2{\displaystyle {\mathsf {2KCl+2MgSO_{4}\rightleftarrows K_{2}SO_{4}\cdot MgSO_{4}+MgCl_{2}}}}
- K2SO4⋅MgSO4+2KCl⇄2K2SO4+MgCl2{\displaystyle {\mathsf {K_{2}SO_{4}\cdot MgSO_{4}+2KCl\rightleftarrows 2K_{2}SO_{4}+MgCl_{2}}}}
- 2KCl+Na2SO4⇄K2SO4+2NaCl{\displaystyle {\mathsf {2KCl+Na_{2}SO_{4}\rightleftarrows K_{2}SO_{4}+2NaCl}}}
- 2KCl+CaSO4⋅2h3O⇄K2SO4+CaCl2+2h3O{\displaystyle {\mathsf {2KCl+CaSO_{4}\cdot 2H_{2}O\rightleftarrows K_{2}SO_{4}+CaCl_{2}+2H_{2}O}}}
- 2KCl+FeSO4⇄K2SO4+FeCl2{\displaystyle {\mathsf {2KCl+FeSO_{4}\rightleftarrows K_{2}SO_{4}+FeCl_{2}}}}
Наиболее чистый продукт получают, обрабатывая твёрдый хлорид калия концентрированной серной кислотой:
- 2KCl+h3SO4→>100oCK2SO4+2HCl↑{\displaystyle {\mathsf {2KCl+H_{2}SO_{4}{\xrightarrow {>100^{o}C}}K_{2}SO_{4}+2HCl\uparrow }}}
Прокаливанием с углём минерала лангбейнита:
- K2SO4⋅2MgSO4+2C→>TK2SO4+2Mg↓+2CO2↑+2SO2↑{\displaystyle {\mathsf {K_{2}SO_{4}\cdot 2MgSO_{4}+2C{\xrightarrow {>T}}K_{2}SO_{4}+2Mg\downarrow +2CO_{2}\uparrow +2SO_{2}\uparrow }}}
В лабораторной практике применяют следующие методы:
- K2O+h3SO4→K2SO4+h3O{\displaystyle {\mathsf {K_{2}O+H_{2}SO_{4}{\xrightarrow {}}K_{2}SO_{4}+H_{2}O}}}
- вытеснением из слабых или неустойчивых кислот:
- K2CO3+h3SO4→K2SO4+CO2↑+h3O{\displaystyle {\mathsf {K_{2}CO_{3}+H_{2}SO_{4}{\xrightarrow {}}K_{2}SO_{4}+CO_{2}\uparrow +H_{2}O}}}
- из щёлочи и разбавленной кислоты:
- 2KOH+h3SO4→K2SO4+2h3O{\displaystyle {\mathsf {2KOH+H_{2}SO_{4}{\xrightarrow {}}K_{2}SO_{4}+2H_{2}O}}}
- 2KHSO4→240oCK2SO4+h3SO4{\displaystyle {\mathsf {2KHSO_{4}{\xrightarrow {240^{o}C}}K_{2}SO_{4}+H_{2}SO_{4}}}}
- KHSO4+KOH→K2SO4+h3O{\displaystyle {\mathsf {KHSO_{4}+KOH{\xrightarrow {}}K_{2}SO_{4}+H_{2}O}}}
- 2KHSO4+KCl→500oCK2SO4+HCl↑{\displaystyle {\mathsf {2KHSO_{4}+KCl{\xrightarrow {500^{o}C}}K_{2}SO_{4}+HCl\uparrow }}}
- K2S+2O2→>500oCK2SO4{\displaystyle {\mathsf {K_{2}S+2O_{2}{\xrightarrow {>500^{o}C}}K_{2}SO_{4}}}}
- 2KO2+S→140oCK2SO4{\displaystyle {\mathsf {2KO_{2}+S{\xrightarrow {140^{o}C}}K_{2}SO_{4}}}}
- 2KO2+SO2→100oCK2SO4+O2{\displaystyle {\mathsf {2KO_{2}+SO_{2}{\xrightarrow {100^{o}C}}K_{2}SO_{4}+O_{2}}}}
Сульфат калия получается при нагреве сульфита калия до температуры в 600 °C:
- 4K2SO3→600oCK2S+3K2SO4{\displaystyle {\mathsf {4K_{2}SO_{3}{\xrightarrow {600^{o}C}}K_{2}S+3K_{2}SO_{4}}}}
Окисление серы бихроматом калия:
- K2Cr2O7+S→800−1000oC Cr2O3+K2SO4{\displaystyle {\mathsf {K_{2}Cr_{2}O_{7}+S{\xrightarrow {800-1000^{o}C}}\ Cr_{2}O_{3}+K_{2}SO_{4}}}}
Взаимодействием сульфата аммония и гидроксид калия:
- (Nh5)2SO4+2KOH→K2SO4+2Nh4↑+2h3O{\displaystyle {\mathsf {(NH_{4})_{2}SO_{4}+2KOH\rightarrow K_{2}SO_{4}+2NH_{3}\uparrow +2H_{2}O}}}
Как соль двухосновной кислоты образует кислые соли:
- K2SO4+h3SO4⇄2KHSO4{\displaystyle {\mathsf {K_{2}SO_{4}+H_{2}SO_{4}\rightleftarrows 2KHSO_{4}}}}
Как все сульфаты взаимодействует с растворимыми соединениями бария:
- K2SO4+BaCl2→2KCl+BaSO4↓{\displaystyle {\mathsf {K_{2}SO_{4}+BaCl_{2}{\xrightarrow {}}2KCl+BaSO_{4}\downarrow }}}
Восстанавливается до сульфида:
- K2SO4+4h3→600oC,Fe2O3K2S+4h3O{\displaystyle {\mathsf {K_{2}SO_{4}+4H_{2}{\xrightarrow {600^{o}C,Fe_{2}O_{3}}}K_{2}S+4H_{2}O}}}
- K2SO4+4C→900oCK2S+4CO{\displaystyle {\mathsf {K_{2}SO_{4}+4C{\xrightarrow {900^{o}C}}K_{2}S+4CO}}}
С оксидом серы образует пиросульфат:
- K2SO4+SO3→K2S2O7{\displaystyle {\mathsf {K_{2}SO_{4}+SO_{3}{\xrightarrow {}}K_{2}S_{2}O_{7}}}}
Основной потребитель сульфата калия — сельское хозяйство. Сульфат калия является ценным бесхлорным удобрением. Эффективность сульфата калия лучше проявляется на бедных калием дерново-подзолистых почвах гранулометрического состава и торфяных почвах. На черноземных почвах он применяется обычно под культуры, которые усваивают много калия и натрия (сахарная свёкла, подсолнечники, плодовые, для корнеплодов, овощей). На каштановых и серозёмных почвах используют в зависимости от вида культуры, технологии выращивания и содержания калия в почве. Сульфат калия намного эффективнее влияет на величину урожая и его качество, если его применять в комплексе с азотными и фосфорными удобрениями. На кислых почвах действие сульфата калия повышается на фоне использования извести.
Калий повышает содержание сахаров и витаминов в выращиваемой продукции, а подкормки в конце августа-сентября способствуют лучшему зимованию плодово-ягодным и декоративным деревьям и кустарникам. Используется на различных почвах, под все культуры, а также для комнатного и балконного цветоводства. Сульфат калия пригоден для всех способов внесения: основного (при перекопке почвы весной или осенью) и для подкормки в течение вегетационного периода.[2]
Применяется в первую очередь под культуры, чувствительные к хлору (картофель, табак, лён, виноград, цитрусовые и др.). Наличие в удобрении сульфат-иона положительно влияет на урожай растений семейства крестоцветных (капуста, брюква, турнепс и др.) и бобовых, потребляющих много серы.
Также сульфат калия используется в производстве стекла, различных квасцов и других соединений калия, как флюс в металлургии.[3] В Европейском союзе допущен в качестве использования как пищевая добавка E515.
Следующие действия сульфатом калия на части тела могут вызвать:
- Глаза: попадание пыли может вызвать механическое раздражение,
- Кожа: попадание на кожу может вызвать раздражение,
- Проглатывание: употребление в пищу больших количеств может вызвать раздражение желудочно-кишечного тракта,
- Вдыхание: при вдыхании может вызвать раздражение дыхательных путей,
- При хроническом употреблении сульфата калия: отравления могут возникать в редких случаях длительного воздействия.
Калий — это… Что такое Калий?
| Внешний вид простого вещества | |
|---|---|
| Серебристо-белый мягкий металл | |
| Свойства атома | |
| Имя, символ, номер | Калий / Kalium (K), 19 |
| Атомная масса (молярная масса) | 39,0983[1]а. е. м. (г/моль) |
| Электронная конфигурация | [Ar] 4s1 |
| Радиус атома | 235 пм |
| Химические свойства | |
| Ковалентный радиус | 203 пм |
| Радиус иона | 133 пм |
| Электроотрицательность | 0,82 (шкала Полинга) |
| Электродный потенциал | −2,92 В |
| Степени окисления | 1 |
| Энергия ионизации (первый электрон) | 418,5 (4,34) кДж/моль (эВ) |
| Термодинамические свойства простого вещества | |
| Плотность (при н. у.) | 0,856 г/см³ |
| Температура плавления | 63,51°С; 336,8 K |
| Температура кипения | 1047 K |
| Теплота плавления | 2,33 кДж/моль |
| Теплота испарения | 76,9 кДж/моль |
| Молярная теплоёмкость | 29,6[2] Дж/(K·моль) |
| Молярный объём | 45,3 см³/моль |
| Кристаллическая решётка простого вещества | |
| Структура решётки | кубическая объёмно-центрированная |
| Параметры решётки | 5,332 Å |
| Температура Дебая | 100 K |
| Прочие характеристики | |
| Теплопроводность | (300 K) 79,0 Вт/(м·К) |
Ка́лий — элемент главной подгруппы первой группы, четвёртого периода периодической системы химических элементов Д. И. Менделеева, с атомным номером 19. Обозначается символом K (лат. Kalium). Простое вещество калий (CAS-номер: 7440-09-7) — мягкий щелочной металл серебристо-белого цвета.
В природе калий встречается только в соединениях с другими элементами, например, в морской воде, а также во многих минералах. Очень быстро окисляется на воздухе и очень легко вступает в химические реакции, особенно с водой, образуя щёлочь. Во многих отношениях химические свойства калия очень близки к натрию, но с точки зрения биологической функции и использования их клетками живых организмов они всё же отличаются.
История и происхождение названия
Калий (точнее, его соединения) использовался с давних времён. Так, производство поташа (который применялся как моющее средство) существовало уже в XI веке. Золу, образующуюся при сжигании соломы или древесины, обрабатывали водой, а полученный раствор (щёлок) после фильтрования выпаривали. Сухой остаток, помимо карбоната калия, содержал сульфат калия K2SO4, соду и хлорид калия KCl.
В 1807 году английский химик Дэви электролизом расплава едкого кали (KOH) выделил калий и назвал его «потассий» (лат. potassium; это название до сих пор употребительно в английском, французском, испанском, португальском и польском языках). В 1809 году Л. В. Гильберт предложил название «калий» (лат. kalium, от араб. аль-кали — поташ). Это название вошло в немецкий язык, оттуда в большинство языков Северной и Восточной Европы (в том числе русский) и «победило» при выборе символа для этого элемента — K.
Нахождение в природе
В свободном состоянии не встречается. Породообразующий элемент, входит в состав слюд, полевых шпатов и т.д. Также калий входит в состав сильвина KCl, сильвинита KCl·NaCl, карналлита KCl·MgCl2·6H2O, каинита KCl·MgSO4·6H2O, а также присутствует в золе некоторых растений в виде карбоната K2CO3 (поташ). Калий входит в состав всех клеток (см. ниже раздел Биологическая роль). Кларк калия в земной коре составляет 2,4 % (5-й по распространённости металл, 7-й по содержанию в коре элемент). Концентрация в морской воде 380 мг/л[3].
Месторождения
Крупнейшие месторождения калия находятся на территории Канады (производитель PotashCorp), России (ОАО «Уралкалий», г. Березники, ОАО «Сильвинит», г. Соликамск, Пермский край, Верхнекамское месторождение калийных руд[4]), Белоруссии (ПО «Беларуськалий», г. Солигорск, Старобинское месторождение калийных руд[5]).
Получение
Калий, как и другие щелочные металлы, получают электролизом расплавленных хлоридов или щелочей. Так как хлориды имеют более высокую температуру плавления (600—650 °C), то чаще проводят электролиз расплавленных щелочей с добавкой к ним соды или поташа (до 12 %). При электролизе расплавленных хлоридов на катоде выделяется расплавленный калий, а на аноде — хлор:
При электролизе щелочей на катоде также выделяется расплавленный калий, а на аноде — кислород:
Вода из расплава быстро испаряется. Чтобы калий не взаимодействовал с хлором или кислородом, катод изготовляют из меди и над ним помещают медный цилиндр. Образовавшийся калий в расплавленном виде собирается в цилиндре. Анод изготовляют также в виде цилиндра из никеля (при электролизе щелочей) либо из графита (при электролизе хлоридов).
Важное промышленное значение имеют и методы термохимического восстановления:
и восстановление из расплава хлорида калия карбидом кальция, алюминием или кремнием.[6][7]
Физические свойства
Калий под слоем ТГФКалий — серебристое вещество с характерным блеском на свежеобразованной поверхности. Очень лёгок и легкоплавок. Относительно хорошо растворяется в ртути, образуя амальгамы. Будучи внесённым в пламя горелки, калий (а также его соединения) окрашивает пламя в характерный розово-фиолетовый цвет[8].
Калий активно взаимодействует с водой. Выделяющийся водород воспламеняется, а ионы калия придают пламени фиолетовый цвет. Раствор фенолфталеина в воде становится малиновым, демонстрируя щелочную реакцию образующегося KOH.Калий образует кристаллы кубической сингонии, пространственная группа I m3m, параметры ячейки a = 0,5247 нм, Z = 2.
Химические свойства
Элементарный калий, как и другие щелочные металлы, проявляет типичные металлические свойства и очень химически активен, является сильным восстановителем. На воздухе свежий срез быстро тускнеет из-за образования плёнок соединений (оксиды и карбонат). При длительном контакте с атмосферой способен полностью разрушиться. С водой реагирует со взрывом. Хранить его необходимо под слоем бензина, керосина или силикона, дабы исключить контакт воздуха и воды с его поверхностью. С Na, Tl, Sn, Pb, Bi калий образует интерметаллиды.
Взаимодействие с простыми веществами
Калий при комнатной температуре реагирует с кислородом воздуха, галогенами; практически не реагирует с азотом (в отличие от лития и натрия). При умеренном нагревании реагирует с водородом с образованием гидрида (200—350 °C):
,
с халькогенами (100—200 °C, E = S, Se, Te):
.
При сгорании калия на воздухе образуется надпероксид калия KO2 (с примесью K2O2):
В реакции с фосфором в инертной атмосфере образуется фосфид зелёного цвета (200 °C):
Взаимодействие со сложными веществами
Калий при комнатной температуре активно реагирует с водой, кислотами, растворяется в жидком аммиаке (−50 °C) с образованием тёмно-синего раствора.
Калий глубоко восстанавливает разбавленные серную и азотную кислоты:
При сплавлении металлического калия со щелочами он восстанавливает водород гидроксогруппы:
При умеренном нагревании реагирует с газообразным аммиаком с образованием амида (65—105 °C):
Металлический калий реагирует со спиртами с образованием алкоголятов:
Алкоголяты щелочных металлов (в данном случае, этаноат калия) являются очень сильными основаниями и широко используются в органическом синтезе.
Соединения с кислородом
При взаимодействии калия с кислородом воздуха образуется не оксид, а пероксид и супероксид:
Оксид калия может быть получен при нагревании металла до температуры не выше 180 °C в среде, содержащей очень мало кислорода, или при нагревании смеси супероксида калия с металлическим калием:
Оксиды калия обладают ярко выраженными основными свойствами, бурно реагируют с водой, кислотами и кислотными оксидами. Практического значения они не имеют. Пероксиды представляют собой желтовато-белые порошки, которые, хорошо растворяясь в воде, образуют щёлочи и пероксид водорода:
Советский изолирующий противогаз ИП-5Свойство обменивать углекислый газ на кислород используется в изолирующих противогазах и на подводных лодках. В качестве поглотителя используют эквимолярную смесь супероксида калия и пероксида натрия. Если смесь не эквимолярна, то в случае избытка пероксида натрия поглотится больше газа, чем выделится (при поглощении двух объёмов CO2 выделяется один объём O2), и давление в замкнутом пространстве упадёт, а в случае избытка супероксида калия (при поглощении двух объёмов CO2 выделяется три объёма O2) выделяется больше газа, чем поглотится, и давление повысится.
В случае эквимолярной смеси (Na2O2:K2O4 = 1:1) объёмы поглощаемого и выделяемого газов будут равны (при поглощении четырёх объёмов CO2 выделяется четыре объёма O2).
Пероксиды являются сильными окислителями, поэтому их применяют для отбеливания тканей в текстильной промышленности.
Получают пероксиды прокаливанием металлов на воздухе, освобождённом от углекислого газа.
Также известен озонид калия KO3, оранжево-красного цвета. Получить его можно взаимодействием гидроксида калия с озоном при температуре не выше 20 °C:
Озонид калия является очень сильным окислителем, например, окисляет элементарную серу до сульфата и дисульфата уже при 50 °C:
Гидроксид
Гидроксид калия (или едкое кали) представляет собой твёрдые белые непрозрачные, очень гигроскопичные кристаллы, плавящиеся при температуре 360 °C. Гидроксид калия относится к щелочам. Он хорошо растворяется в воде с выделением большого количества тепла. Растворимость едкого кали при 20 °C в 100 г воды составляет 112 г.
Применение
- Жидкий при комнатной температуре сплав калия и натрия используется в качестве теплоносителя в замкнутых системах, например, в атомных силовых установках на быстрых нейтронах. Кроме того, широко применяются его жидкие сплавы с рубидием и цезием. Сплав состава: натрий 12 %, калий 47 %, цезий 41 % — обладает рекордно низкой температурой плавления −78 °C.
- Соединения калия — важнейший биогенный элемент и потому применяются в качестве удобрений.
- Соли калия широко используются в гальванотехнике, так как, несмотря на относительно высокую стоимость, они часто более растворимы, чем соответствующие соли натрия, и потому обеспечивают интенсивную работу электролитов при повышенной плотности тока.
Важные соединения
Кристаллы перманганата калияБиологическая роль
Калий — важнейший биогенный элемент, особенно в растительном мире. При недостатке калия в почве растения развиваются очень плохо, уменьшается урожай, поэтому около 90 % добываемых солей калия используют в качестве удобрений.
Калий в организме человека
 | В этом разделе не хватает ссылок на источники информации. Информация должна быть проверяема, иначе она может быть поставлена под сомнение и удалена. Вы можете отредактировать эту статью, добавив ссылки на авторитетные источники. Эта отметка установлена 12 мая 2011. |
Калий содержится большей частью в клетках, до 40 раз больше чем в межклеточном пространстве. В процессе функционирования клеток избыточный калий покидает цитоплазму, поэтому для сохранения концентрации он должен нагнетаться обратно при помощи натрий-калиевого насоса. Калий и натрий между собой функционально связаны и выполняют следующие функции:
- Создание условий для возникновения мембранного потенциала и мышечных сокращений.
- Поддержание осмотической концентрации крови.
- Поддержание кислотно-щелочного баланса.
- Нормализация водного баланса.
Рекомендуемая суточная доля калия составляет для детей от 600 до 1700 миллиграммов, для взрослых от 1800 до 5000 миллиграммов. Потребность в калии зависит от общего веса тела, физической активности, физиологического состояния, и климата места проживания. Рвота, продолжительные поносы, обильное потение, использование мочегонных повышают потребность организма в калии.
Основными пищевыми источниками являются сушёные абрикосы, дыня, бобы, киви, картофель, батат, авокадо, бананы, брокколи, печень, молоко, ореховое масло, цитрусовые, виноград. Калия достаточно много в рыбе и молочных продуктах.
Практически все сорта рыбы содержат более 200 мг калия в 100 г. Количество калия в разных видах рыбы различается. Овощи, грибы и травы также содержат много калия, однако в консервированных продуктах его уровень может быть гораздо меньше. Много калия содержится в шоколаде.
Всасывание происходит в тонком кишечнике. Усвоение калия облегчает витамин B6, затрудняет — алкоголь.
При недостатке калия развивается гипокалиемия. Возникают нарушения работы сердечной и скелетной мускулатуры. Продолжительный дефицит калия может быть причиной острой невралгии.
При переизбытке калия развивается гиперкалиемия, для которой основным симптомом является язва тонкого кишечника. Настоящая гиперкалиемия может вызвать остановку сердца.
Изотопы
Природный калий состоит из трёх изотопов. Два из них стабильны: 39K (изотопная распространённость 93,258 %) и 41K (6,730 %). Третий изотоп 40K (0,0117 %) является бета-активным с периодом полураспада 1,251·109 лет. В каждом грамме природного калия в секунду распадается в среднем 32 ядра 40K, благодаря чему, например, в организме человека массой 70 кг ежесекундно происходит около 4000 радиоактивных распадов. Поэтому легкодоступные в быту соединения калия (поташ, хлорид калия, калийная селитра и т. д.) можно использовать как пробные радиоактивные источники для проверки бытовых дозиметров. 40K наряду с ураном и торием считается одним из основных источников геотермальной энергии, выделяемой в недрах Земли (полная скорость энерговыделения оценивается в 40—44 ТВт). В минералах, содержащих калий, постепенно накапливается калий-аргоновый метод является одним из основных методов ядерной геохронологии.
См. также
Примечания
- ↑ Atomic Weights and Isotopic Compositions for All Elements. NIST Physical Measurement Laboratory. Архивировано из первоисточника 22 августа 2011. Проверено 16 ноября 2010.
- ↑ Химическая энциклопедия: в 5 т / Редкол.: Кнунянц И. Л. (гл. ред.). — М.: Советская энциклопедия, 1990. — Т. 2. — С. 284. — 671 с. — 100 000 экз.
- ↑ J. P. Riley and Skirrow G. Chemical Oceanography V. 1, 1965
- ↑ КАЛИЙНОЕ МЕСТОРОЖДЕНИЕ
- ↑ Химическое и агрохимическое сырье.
- ↑ А. Ф. Алабышев, К. Д Грачев, С. А. Зарецкий, М. Ф. Лантратов, Натрий и калий (получение, свойства, применение), Л: Гос. н-т. изд-во хим. лит., 1959, С. 321.
- ↑ Хим.энциклопедия, т.2, М.: Сов. энциклопедия, 1990, С.562.
- ↑ Элементы: проба на окрашивание пламени (рус.). Архивировано из первоисточника 22 августа 2011. Проверено 26 января 2010.
Литература
- Пилипенко А. Т. Натрий и калий // Справочник по элементарной химии. — 2-е изд. — Киев: Наукова думка, 1978. — С. 316—319.
- Дроздов А. Яростные металлы // Энциклопедия для детей. Химия. — М.: Аванта +, 2002. — С. 184—187. — ISBN 5-8483-0027-5
- Ахметов Н. С. Общая и неорганическая химия. — М.: Высшая школа, 2001.
- Некрасов Б. В. Основы общей химии. — М.: Химия, 1974.
- Спицын В. И., Мартыненко Л. И. Неорганическая химия. — М.: МГУ, 1991, 1994.
- Лидин Р. А. и др. Элементы IA-группы. Калий // Химические свойства неорганических веществ: Уч. пособие для вузов. — 4-е изд. — М.: КолосС, 2003. — С. 29—40. — ISBN 5-9532-0095-1
Ссылки
 Электрохимический ряд активности металлов Электрохимический ряд активности металлов | |
|---|---|
Eu, Sm, Li, Cs, Rb, K, Ra, Ba, Sr, Ca, Na, Ac, La, Ce, Pr, Nd, Pm, Gd, Tb, Mg, Y, Dy, Am, Ho, Er, Tm, Lu, Sc, Pu, Th, Np, U, Hf, Be, Al, Ti, Zr, Yb, Mn, V, Nb, Pa, Cr, Zn, Ga, Fe, Cd, In, Tl, Co, Ni, Te, Mo, Sn, Pb, H2, W, Sb, Bi, Ge, Re, Cu, Tc, Te, Rh, Po, Hg, Ag, Pd, Os, Ir, Pt, Au |
| ||||||||||||
Нитрат калия — Википедия
| Нитрат калия | |||
|---|---|---|---|
| |||
 ( ({{{изображение}}}) | |||
| Систематическое наименование | Нитрат калия | ||
| Сокращения | в народе КС, НК | ||
| Традиционные названия | Ка́лиевая селитра, кали́йная селитра, индийская селитра, Соль Петра (Salt of Peter, petersalt)[1] | ||
| Хим. формула | KNO3 | ||
| Рац. формула | KNO3 | ||
| Состояние | твёрдое | ||
| Молярная масса | 101,1032 г/моль | ||
| Плотность | 2,109 (16 °C) | ||
| Твёрдость | 2 | ||
| Температура | |||
| • плавления | 334 °C | ||
| • кипения | с разложением °C | ||
| • разложения | 400 °C | ||
| Тройная точка | отсутствует | ||
| Мол. теплоёмк. | 95,06 Дж/(моль·К) | ||
| Энтальпия | |||
| • образования | -494,00 кДж/моль | ||
| • плавления | 9,80 кДж/моль | ||
| • сублимации | 181,00 кДж/моль | ||
| Растворимость | |||
| • в воде | 13,3 (0 °C) 36 (25 °C) 247 (100 °C) | ||
| Рег. номер CAS | 7757-79-1 | ||
| PubChem | 24434 | ||
| Рег. номер EINECS | 231-818-8 | ||
| SMILES | |||
| InChI | |||
| Кодекс Алиментариус | E252 | ||
| RTECS | TT3700000 | ||
| ChEBI | 63043 | ||
| Номер ООН | 1486 | ||
| ChemSpider | 22843 | ||
| ЛД50 | 3750 мг/кг | ||
| Токсичность | малотоксичен | ||
| NFPA 704 |  | ||
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |||
 Медиафайлы на Викискладе Медиафайлы на Викискладе | |||
Нитра́т ка́лия, азотноки́слый ка́лий (ка́лиевая сели́тра, кали́йная селитра, инди́йская селитра и др.) — неорганическое соединение, калиевая соль азотной кислоты с формулой KNO3. В кристаллическом состоянии — бесцветное вещество, нелетучее, слегка гигроскопичное, без запаха. Нитрат калия хорошо растворим в воде. Практически не токсичен для живых организмов.
Встречается в природе в виде минерала нитрокалита, в Ост-Индии находится одно из крупнейших месторождений, отсюда второе название — индийская селитра. В очень малых количествах содержится в растениях и животных[2].
Форма кристаллов игольчатая, сами кристаллы очень длинные. Легко поддаётся очистке перекристаллизацией с минимальными потерями.
Основное применение находит в пиротехнике (до XX века особенно широко, как компонент основного в то время взрывчатого вещества — дымного (чёрного) пороха) и как калий-азотное удобрение (очень удобное соединение двух обычно плохо сочетающихся при усваивании растениями элементов).
Нитрат калия в нормальных условиях представляет собой бесцветные кристаллы (в измельчённом состоянии белый порошок) с ионной структурой и ромбической или гексагональной кристаллической решёткой. Слегка гигроскопичен, склонен несильно слеживаться со временем. Не имеет запаха, нелетуч.
Хорошо растворим в воде, в средней степени в глицерине, жидком аммиаке, гидразине, нерастворим в чистом этаноле и эфире (в разбавленных водой растворяется плохо). Таблица растворимости в некоторых растворителях, в граммах KNO3 на 100 г H2O[3]:
| Растворитель / Температура, °С | 0 | 10 | 20 | 25 | 30 | 40 | 60 | 80 | 100 |
|---|---|---|---|---|---|---|---|---|---|
| Вода | 13,9 | 21,2 | 31,6 | 37,9 | 46,0 | 61,3 | 106,2 | 166,6 | 245,0 |
| Жидкий аммиак | 10,52 | 10,4 | |||||||
| Гидразин | 14 |
При медленной кристаллизации вырастают очень длинные игольчатые кристаллы. Нитрат калия хорошо поддаётся очистке перекристаллизацией, причём с небольшими потерями, благодаря сильному повышению растворимости с ростом температуры.
- Разлагается при 400—520 °C с образованием нитрита калия KNO2 и кислорода O2[4] (выделение последнего увеличивает пожароопасность нитрата калия):
- 2KNO3⟶2KNO2+O2↑{\displaystyle {\mathsf {2KNO_{3}\longrightarrow 2KNO_{2}+O_{2}\uparrow }}}
- Является сильным окислителем, реагирует с горючими материалами и восстановителями, при измельчении активно и нередко со взрывом. Смеси нитрата калия с некоторыми органическими материалами склонны к самовоспламенению.
- Восстанавливается водородом в момент выделения (в реакции соляная кислота разбавленная)[4]:
- Zn+2HCl⟶ZnCl2+2H0,{\displaystyle {\mathsf {Zn+2HCl\longrightarrow ZnCl_{2}+2H^{0}}},}
- KNO3+2H0⟶KNO2+h3O.{\displaystyle {\mathsf {KNO_{3}+2H^{0}\longrightarrow KNO_{2}+H_{2}O}}.}
- Расплав нитрата калия может быть использован для получения металлического калия электролизом, однако из-за высоких окислительных способностей нитрата калия в расплавленном состоянии предпочтительнее гидроксид калия.
В Средние Века и Новое Время (когда активно использовали порох) для получения нитрата калия служили селитря́ницы — кучи из смеси навоза (и других перегнивающих компонентов) с известняком, строительным мусором и прочим известняковым материалом с прослойками из соломы или хвороста, накрытые дёрном для удерживания образующихся газов. При гниении навоза образовывался аммиак, который накапливаясь в прослойках из соломы, подвергался нитрификации и превращался вначале в азотистую, а затем в азотную кислоту. Последняя, взаимодействуя с известняком, давала Ca(NO3)2, который выщелачивался водой. Добавка древесной золы (состоящей в основном из поташа) приводила к осаждению CaCO3 и получению раствора нитрата калия; нередко золу добавляли сразу в кучу вместо известняка, тогда калиевая селитра получалась сразу.
- Ca(NO3)2+K2CO3⟶2 KNO3+CaCO3↓{\displaystyle {\mathsf {Ca(NO_{3})_{2}+K_{2}CO_{3}\longrightarrow 2\ KNO_{3}+CaCO_{3}\downarrow }}}
Реакция поташа с кальциевой селитрой (нитратом кальция) является самой древней из используемых человеком для получения нитрата калия и популярна до сих пор. Вместо поташа, впрочем, сейчас в лабораториях чаще всего используют сульфат калия, реакция очень похожа:
- Ca(NO3)2+K2SO4⟶2 KNO3+CaSO4↓.{\displaystyle {\mathsf {Ca(NO_{3})_{2}+K_{2}SO_{4}\longrightarrow 2\ KNO_{3}+CaSO_{4}\downarrow }}.}
Первый способ применялся вплоть до 1854 г., когда немецкий химик К. Нёльнер изобрёл производство нитрата калия, основанное на реакции более доступных и дешевых хлорида калия и нитрата натрия, доступного в виде чилийской селитры:
- KCl+NaNO3⟶KNO3+NaCl{\displaystyle {\mathsf {KCl+NaNO_{3}\longrightarrow KNO_{3}+NaCl}}}
Существует несколько других способов получения нитрата калия. Это взаимодействие нитрата аммония и хлорида калия с образованием нитрата калия и хлорида аммония, последний легко отделяется:
- KCl+Nh5NO3⟶KNO3+Nh5Cl{\displaystyle {\mathsf {KCl+NH_{4}NO_{3}\longrightarrow KNO_{3}+NH_{4}Cl}}}
— наиболее применимая после реакции нитрата кальция с карбонатом или сульфатом калия.
- KOH+HNO3⟶KNO3+h3O{\displaystyle {\mathsf {KOH+HNO_{3}\longrightarrow KNO_{3}+H_{2}O}}} — в основном, демонстрационная реакция соответствующей кислоты и основания
- 21 K+26 HNO3⟶21 KNO3+NO↑+N2O↑+N2↑+13 h3O{\displaystyle {\mathsf {21\ K+26\ HNO_{3}\longrightarrow 21\ KNO_{3}+NO\uparrow +N_{2}O\uparrow +N_{2}\uparrow +13\ H_{2}O}}} — тоже демонстрационная реакция соответствующих кислоты и металла.
- K2O+2 HNO3⟶2 KNO3+h3O{\displaystyle {\mathsf {K_{2}O+2\ HNO_{3}\longrightarrow 2\ KNO_{3}+H_{2}O}}} — демонстрационная реакция соответствующего щелочного оксида с соответствующей кислотой.
Также:
- 2 KOH+N2O5⟶2 KNO3+h3O,{\displaystyle {\mathsf {2\ KOH+N_{2}O_{5}\longrightarrow 2\ KNO_{3}+H_{2}O}},}
- Nh5NO3+KOH⟶Nh4↑+KNO3+h3O,{\displaystyle {\mathsf {NH_{4}NO_{3}+KOH\longrightarrow NH_{3}\uparrow +KNO_{3}+H_{2}O}},}
- K2CO3+2 HNO3⟶2 KNO3+h3O+CO2↑.{\displaystyle {\mathsf {K_{2}CO_{3}+2\ HNO_{3}\longrightarrow 2\ KNO_{3}+H_{2}O+CO_{2}\uparrow }}.}
Природные источники и месторождения[править | править код]
В природе нитрат калия распространён в виде минерала нитрокалита. Крупнейшее его месторождение находится в Индии. Природный нитрат калия образуется в результате разложения азотсодержащих веществ с последующим связыванием медленно выделяющегося аммиака нитробактериями, чему способствует влага и тепло, поэтому наиболее крупные залежи находятся в странах с жарким климатом[5].
В очень малых количествах содержится в растениях и животных[2], является промежуточным продуктом при переработке ими почвенных сульфата и карбоната калия.
Основное применение на сегодняшний день нитрат калия находит в качестве ценного удобрения, так как совмещает в себе два элемента, частично блокирующих усвоение друг друга растениями, когда находятся в составе отдельных соединений.
Применяется при изготовлении дымного пороха и некоторых других горючих смесей (например, карамельного ракетного топлива), которые почти полностью сейчас используются в производстве пиротехнических изделий.
Применяется также в электровакуумной промышленности и оптическом стекловарении для обесцвечивания и осветления технических хрустальных стёкол и придания прочности изделиям из стекла[6].
Расплав иногда используется в химических лабораториях и у любителей химии для получения металлического калия электролизом, наряду с гидроксидом калия.
Используется в качестве сильного окислителя в металлургии, в частности, при переработке никелевых руд.
В пищевой промышленности нитрат калия применяется в качестве консерванта E252[7]. Сам по себе он не имеет существенного антибактериального действия, но его оказывает образующийся в результате восстановления нитрит калия в мясных продуктах, в которых нитрат калия наиболее широко используется в качестве консерванта[8].
Гидроксид калия — Википедия
Гидрокси́д ка́лия (лат. Kalii hydroxidum) — неорганическое соединение с химической формулой KOH. Бесцветные, очень гигроскопичные кристаллы, но гигроскопичность меньше, чем у гидроксида натрия. Водные растворы KOH имеют сильнощелочную реакцию. Получают электролизом растворов KCl, применяют в производстве жидких мыл, для получения различных соединений калия.
Тривиальные названия: едкое кали[1], каустический поташ, а также гидрат окиси калия, гидроокись калия, калиевая щёлочь[3], калиевый щёлок.
Имеет вид бесцветных кристаллов. Может находиться в двух различных модификациях: моноклинной, устойчивой до 247 °C и кубической, аналогичной таковой у хлорида натрия (a = 0,533 нм, z = 4, пространственная группа Fm3m). Температура плавления 405 °C, кипения 1325 °C, плотность 2,044 г/см3. Растворим в воде — 107 г / 100 мл (15 °C)[4][5].
- KOH+HCl⟶KCl+h3O{\displaystyle {\mathsf {KOH+HCl\longrightarrow KCl+H_{2}O}}}
- 2KOH+h3SO4⟶ K2SO4+2h3O{\displaystyle {\mathsf {2KOH+H_{2}SO_{4}\longrightarrow \ K_{2}SO_{4}+2H_{2}O}}}
- 2KOH+CO2⟶ K2CO3+h3O{\displaystyle {\mathsf {2KOH+CO_{2}\longrightarrow \ K_{2}CO_{3}+H_{2}O}}}
- 2KOH+SO3⟶ K2SO4+h3O{\displaystyle {\mathsf {2KOH+SO_{3}\longrightarrow \ K_{2}SO_{4}+H_{2}O}}}
- 2Al+2KOH+6h3O⟶2K[Al(OH)4]+3h3↑{\displaystyle {\mathsf {2Al+2KOH+6H_{2}O\longrightarrow 2K[Al(OH)_{4}]+3H_{2}\uparrow }}}
Гидроксид калия получают электролизом растворов KCl, обычно с применением ртутных катодов, что даёт продукт высокой чистоты, не содержащий примеси хлоридов:
- 2KCl+2h3O⟶2KOH+h3↑+Cl2↑{\displaystyle {\mathsf {2KCl+2H_{2}O\longrightarrow 2KOH+H_{2}\uparrow +Cl_{2}\uparrow }}}
Электролиз расплава протекает по следующему уравнению:
4KOH⟹4K+2h3O+O2.{\displaystyle 4KOH\Longrightarrow 4K+2H_{2}O+O_{2}.}
Именно так впервые были получены чистые натрий и калий учёным Дэви.
Гидроксид калия является практически универсальным химическим соединением. Ниже приведены примеры материалов и процессы, в которых он используется:
- нейтрализация кислот,
- щелочные элементы,
- катализ
- моющие средства,
- буровые растворы,
- красители,
- удобрения,
- производство пищевых продуктов,
- газоочистка,
- металлургическое производство,
- переработка нефти,
- различные органические и неорганические вещества,
- производство бумаги,
- пестициды,
- фармацевтика,
- регулирование pH,
- карбонат калия и другие калийные соединения,
- мыла,
- синтетический каучук[3].
В пищевой промышленности обозначается как пищевая добавка E525. Используется как регулятор кислотности, в качестве осушителя и средства для снятия кожицы с овощей, корнеплодов и фруктов. Он также используется в качестве катализатора в некоторых реакциях.
Также используется для получения метана, поглощения кислотных газов и обнаружения некоторых катионов в растворах.
Популярное средство в производстве косметической продукции, вступая в реакцию с жирными маслами, расщепляется и омыливает при этом масла.
В качестве агента для растворения засоров канализационных труб, в виде сухих гранул или в составе гелей (наряду с гидроксидом натрия). Гидроксид калия дезагрегирует засор и способствует лёгкому продвижению его далее по трубе.
В циркониевом производстве используется для получения обесфторенного гидроксида циркония.
В сфере промышленной мойки продукты на основе гидроксида калия, нагретые до 50-60 °С, применяются для очистки изделий из нержавеющей стали от жира и других масляных веществ, а также остатков механической обработки.
Используется в качестве электролита в щелочных (алкалиновых) батарейках.
Также применяется в ресомации — альтернативном способе «захоронения» тел.
5 % раствор гидроксида калия используется в медицине для лечения бородавок[6].
В фотографии используется как компонент проявителей, тонеров, индикаторов тиосульфатов и для удаления эмульсии с фотографических материалов[7].
В промышленном масштабе гидроксид калия получают электролизом хлористого калия.
Возможны три варианта проведения электролиза:
- электролиз с твердым асбестовым катодом (диафрагменный метод производства),
- электролиз с полимерным катодом (мембранный метод производства),
- электролиз с жидким ртутным катодом (ртутный метод производства).
В ряду электрохимических методов производства самым легким и удобным способом является электролиз с ртутным катодом, но этот метод наносит значительный вред окружающей среде в результате испарения и утечек металлической ртути. Мембранный метод производства самый эффективный, но и самый сложный.
В то время как диафрагменный и ртутный методы были известны соответственно с 1885 и 1892 гг., мембранный метод появился сравнительно недавно — в 1970 гг.
Основной тенденцией в мировом производстве гидроксида калия в последние 10 лет является переход производителей на мембранный метод электролиза. Ртутный электролиз является устаревшей, экономически невыгодной и негативно действующей на окружающую среду технологией. Мембранный электролиз полностью исключает использование ртути. Экологическая безопасность мембранного метода заключается в том, что сточные воды после очистки вновь подаются в технологический цикл, а не сбрасываются в канализацию.
При использовании данного метода решаются следующие задачи:
- исключается стадия сжижения и испарения хлора,
- водород используется для технологического пара, исключаются газовые выбросы хлора и его соединений.
Мировым лидером в области мембранных технологий является японская компания «Асахи Касэй».
В России производство гидроксида калия осуществляется мембранным (ООО «Сода-Хлорат») методом.
Особенностью технологического оформления производства гидроксида калия является тот факт, что на аналогичных установках электролиза можно выпускать как едкое кали, так и каустическую соду. Это позволяет производителям без существенных капиталовложений переходить на производство гидроксида калия взамен каустической соды, производство которой не столь рентабельно, а сбыт в последние годы усложняется. При этом в случае изменений на рынке возможен безболезненный перевод электролизёров на производство ранее выпускавшегося продукта.
Примером перевода части мощностей с производства гидроксида натрия на гидроксид калия может служить ОАО «Завод полимеров КЧХК», начавший промышленный выпуск едкого кали на пяти электролизерах в 2007 году.[3]
Очень сильная щёлочь. В чистом виде действует на кожу и слизистые оболочки прижигающим образом. Особенно опасно попадание даже малейших частиц гидроксида калия в глаза, поэтому все работы с этим веществом должны проводиться в резиновых перчатках и очках. Гидроксид калия разрушает бумагу, кожу и др. материалы органического происхождения.
- Гурлев Д.С. Справочник по фотографии (обработка фотоматериалов). — К.: Тэхника, 1988.
- Степин Б. Д. Калия гидроксид // Химическая энциклопедия: в 5 т. / Кнунянц И. Л.. — М.: Советская энциклопедия, 1990. — Т. 2: Даффа—Меди. — С. 287. — 671 с. — 100 000 экз. — ISBN 5-85270-035-5.
Калийные удобрения — Википедия
Материал из Википедии — свободной энциклопедии
Кали́йные удобре́ния — минеральные вещества, используемые как источник калия для питания растений[1]; помимо увеличения урожайности, они улучшают качественные характеристики выращиваемой продукции: способствуют повышению сопротивляемости растений к заболеваниям, повышению лёжкости плодов при хранении и стойкости при транспортировке, а также улучшению их вкусовых и эстетических качеств.
Калийные удобрения, как правило, применяются в комплексе с азотными и фосфорными удобрениями.
Является концентрированным калийным удобрением. Представляет собой белое кристаллическое вещество и легко растворяется в воде. Содержание питательного вещества в пересчёте на K2O находится в пределах 52-62 %. Основным сырьём для производства хлористого калия являются природные калийные соли (сильвинит и карналлит — соли с содержанием чистого вещества на уровне 12-15 % с примесями солей натрия и магния).
Хлорид калия применяют на любых почвах как основное удобрение. Особенно эффективно при использовании под корнеплоды, картофель, подсолнечник, плодовые и другие культуры.
Комплексное калийно-азотное удобрение: содержание калия — 45 %, азота — 14 %. В объёме 10 см3 содержится 12,5 г (1 г занимает 0,75 см3), то есть в стакане (200 мл) поместится 250 г, в спичечном коробке 25 г. Широко применяется в защищённом грунте: перед высадкой рассады вносят до 36 г/м2, для корневой подкормки 18-20 г/м2.
Комплексное калийно-магниевое удобрение, без содержания хлора. Применяется под хлорофобные культуры положительно отзывающиеся на магний.
Содержание калия 26-32 %, магния 11-18 %. В объёме 10 см3 содержится 10 г (1 г занимает 1 см3), то есть в стакане (200 мл) поместится 200 г, в спичечном коробке 20 г. Не гигроскопична, не слеживается, рассеиваемость хорошая.
Применяют в виде подкормки (10 г/м2) при низком содержании в почве подвижного магния. При основном внесении норма составляет 40 г/м2.
Более 80 % запасов используемой для производства калия руды приходится всего на три страны — Белоруссию, Канаду и Россию.
| Страна | Доля мировых резервов,% | Основное месторождение | Запасы месторождения, млрд.т. | Среднее содержание калия в руде,% | Начало разработки | Площадь месторождения тыс. км2. |
| Канада | 37,5 | Саскачеванское | 50 | 30 | 1958 | ? |
| Россия | 31,4 | Верхнекамское | 13 | 18-34 | 1933 | 6,5 |
| Белоруссия | 9,1 | Старобинское | 7,8 | 22-30 | 1961 | 14 |
| Узбекистан | 1 | Тюбегатанское | 1 | 25-35 | 2007 | 0,56 |
Крупнейшие мировые производители калийных удобрений[править | править код]
Второе рудоуправление «Беларуськалия»| Страна | Производство, млн тонн (2015 год)[2] |
| Канада | 11,2 |
| Белоруссия | 10,6 |
| Россия | 7,4 |
| Германия | 3,4 |
| Китай | 3,1 |
| Израиль | 2,0 |
| Туркменистан | 1,4 |
| Иордания | 1,4 |
| США | 1,1 |
| Чили | 0,8 |
| Узбекистан | 0,62 |
| Великобритания | 0,43 |
| Испания | 0,42 |
| Бразилия | 0,4 |
| Общемировое производство | 37 |

 (
(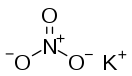
 (
(