щелочной минерал для сердца и защиты клеток
Хотите быть здоровым — думайте о своих клетках
Клетки — кирпичики нашего организма.
Все ткани состоят из клеток, из тканей состоят органы, из органов — системы (их всего 12). Это и есть наш организм.
Здоровые клетки формируют здоровые ткани и органы, а это гарантирует слаженную работу всех систем, а значит — здоровый организм.
КАЛИЕВО-НАТРИЕВЫЙ НАСОС.
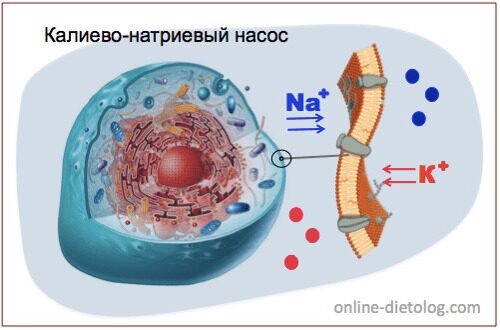
Чтобы в клетках происходили обменные процесы, необходимо постоянное поступление питательных веществ и кислорода, а также своевременное удаление отходов жизнидеятельности.
Калий есть внутри каждой клеточки. Вместе с ионами натрия он обеспечивает движение питательных веществ внутрь клетки, а отходы выводя наружу подобно насосу.
Эти микроэлементы выполняют противоположные функции. Ионы калия ускоряют химические реакции, а ионы натрия — замедляют.
Ионы калия клетки активно накапливают, а ионы натрия выводят наружу. Таким образом создается разность коцентраций — внутри больше калия, снаружи натрия. И это является необходимым условием для проведения нервных импульсов, стабильного сердечного ритма, поддержания водно-солевого баланса и нормального осмотического давлениея крови, а также баланса кислот и щелочей в организме. При этом калия и натрия в организме должно быть примерно одинаковое количество.
Также натрий способен удерживать воду, в то время как калий — наоборот способствует ее выведению из организма, «отталкивает» воду. Таким образом, превышение необходимого количества натрия провоцирует отечность.
НАТРИЯ МНОГО, А КАЛИЯ — КАТАСТРОФИЧЕСКИ НЕ ХВАТАЕТ
Изначально в рационе человека не было чрезмерного количества натрия, пока не началась добыча соли в промышленных масштабах. Сейчас мы солим практически все блюда, натрия в рационе современного человека стало слишком много.
Проблема в том, что в организме есть механизм запасания натрия. А вот с калием беда, калий постоянно выводится с мочой. Говорят его много в бананах. Ну может в тех, что сорвешь с дерева в Эквадоре и много. А нам-то на рынок завозят зеленые, которые дозревают в коробках, нет там никакого калия. Зелени едим мало. Вот калия в организме в организме часто и не хватает, это ведет к нарушению баланса.
Чрезмерное потребления натрия перегружает почки и сердце, а также становится причиной образования отеков. Именно поэтому при заболеваниях почек и сердца, при гипертонической болезни рекомендовано резкое ограничение количества повареной соли в рационе.
К ДЕФИЦИТУ КАЛИЯ ВЕДУТ:
- недостаточное поступление с пищей
- «мертвая» вода вымывает калий
- нарушения в работе ЖКТ (например понос, рвота)
- заболевания почек
- употребление диуретиков, антибиотиков
- гормональные нарушения
- диеты для похудения, голодание
Когда человек пьет мертвую очищенную воду (не говоря уже о прочих напитках), организму нужно сначала своими силами «снабдить» ее минералами. Иначе вода не сможет попасть в клетку. Так постепенно расходуются щелочные минералы — калий, кальций, магний, натрий. Но если натрий в организме большинства людей в избытке, то калия, кальция и магния — наоборот, не хватает.
Хронический недостаток калия провоцирует мышечные судороги и мышечную слабость, нарушение сердечного ритма (аритмия), редкое мочеиспускание, запоры, отечность, часто становится причиной сухости кожи и слабости волос.
КАК ВОССТАНОВИТЬ БАЛАНС
Необходимо уменьшить поступления натрия и увеличить поступление калия. При этом важно понимать — наш организм может усваивать только минералы органического происхождения, то есть из растений. Вот почему бесполезно пить синтетические витаминно-минеральные комплексы, которые в аптеке продаются, или, например, жевать мел в надежде на кальций.
Калий содержится в таких продктах, как молоко и молочные продукты, масо, зелень петрушки, помидоры, картофель, абрикосы, виноград (изюм), чернослив, какао. Проблема в том, что современные продукты содержат калия почти в половину меньше, чем еще 50 лет назад. А получить минералы наш организм может только с едой и водой, сам он их не синтезирует.
Для полноценного функционирования необходимо порядка 3500 мг калия в сутки. И важно обеспечить ежедневное его поступление в организм, так как, мы помним, что калий не запасается впрок.
ПЕНТОКАН — ОРГАНИЧЕСКИЙ КАЛИЙ В ЧИСТОМ ВИДЕ

СОСТАВ:
Гидрокарбонат калия (420 мг), витамин С и рибоза.
Это быстрорастворимые шипучие таблетки, которые насыщают воду органическим биодоступным калием.
Благодаря такой форме достигается уровень усваиваемости калия 97,5%
ПРИМЕНЕНИЕ:
Принимать во время еды. Растворите шипучую таблетку в 60 мл воды (можно больше, но выпить сразу).
Нажимая кнопку «УЗНАТЬ ЦЕНУ», вы переходите на официальный сайт компании-производителя, где указаны розничные цены на продукцию (смотреть правый верхний угол).
Заполните простую заявку и через 2 минуты на Ваш e-mail придет информация о том, как купить продукцию напрямую у компании со скидкой 20%
ЗАЧЕМ В СОСТАВЕ РИБОЗА

Дело в том, что для работы калия необходима энергия, поставляют ее молекулы АТФ (аденозинтрифосфат)
А для выработки АТФ в свою очередь необходима рибоза. В данном случае, когда мы используем рибозу в виде добавки, производство аденозинтрифосфата возрастает в 3-4 раза. А витамин С способствует доставке калия внутрь клетки.
ВИТАМИН «С» — АНТИОКСИДАНТ
Витамин C обладает высокими антиоксидативными свойствами. Это защита от преждевременного старения. Он особенно необходим тем людям, кто живет активной жизнью или напряженно работает, кто испытывает стрессы или живет в неблагоприятных условиях.
Витамин С способствует лучшему уваиванию белков, доставке кислорода в мышцы и ткани, благодаря ему организм легче и быстрее восстанавливается после нагрузок и стрессов.

Калий в жизни растений ⋆ Агрохимия
Накопление калия в хлоропластах и митохондриях способствует стабилизации их структуру и образованию АТФ. Он увеличивает гидрофильность коллоидов протоплазмы, при этом уменьшается транспирация, что способствует растениям лучше переносить кратковременные засухи.
Калий участвует в синтезе и обмене белков. При его недостатке синтез снижается с одновременным распадом старых молекул белков. В растениях накапливаются аминокислоты. Оптимизированное калийное питание приводит к повышению доли белка в растениях пшеницы. Усиливается синтез аспарагина и глютамина. Положительное действие калия на синтез белков связано с его влиянием на накопление и трансформацию углеводов (углеводы в процессе дыхания образуют кетокислоты, из которых синтезируются аминокислоты), а также с усилением ферментативной активности синтеза белка.
Калий катализирует синтез витаминов тиамина и рибофлавина, регулирует функционирование замыкающих клеток устьиц листьев.
Калий поглощается растениями в виде катиона и в этой форме остается в клетках и является основным противоионом отрицательно заряженных анионов клетки. Калий создает разность электрических потенциалов между клеткой и средой.
Участвуя в важнейших биохимических процессах, калий повышает устойчивость к различным заболеваниям в течение вегетации и в послеуборочный период, улучшает лежкость плодов и овощей.
Критический период в потреблении калия растениями приходится на первые 15 дней после появления всходов. Период максимального потребления, чаще всего, совпадает с периодом интенсивного прироста биологической массы. У некоторых культур, например, льна, поступление калия останавливается к фазе полного цветения или к цветению — началу молочной спелости, как у зерновых и зернобобовых. У других культур поступление более растянуто и происходит в течение всего вегетационного периода, как у картофеля, сахарной свеклы, капусты.
В районах, в которых действие калийных удобрений наиболее эффективно, их применение обеспечивает на каждый килограмм внесенного калия удобрений прибавку урожая: 2-3 кг зерна, 20-33 кг картофеля, 35-40 кг сахарной свеклы, 1-1,5 кг льноволокна, 20-33 кг сена сеяных трав и 8-18 кг сена луговых трав.
Гипокалиемия — Википедия
Гипокалиемия (др.-греч. ὑπό — снизу, под + калий + αἷμα — кровь) пониженная концентрация ионов калия в крови.
Гипокалиемия развивается вследствие
- уменьшения поступления калия с пищей,
- его перемещения в клетки,
- усиленного выведения.
Снижение поступления калия редко является единственной причиной гипокалиемии, поскольку за счет реабсорбции в дистальном отделе нефрона экскреция калия с мочой может уменьшаться до 15 ммоль/сут; количество же калия, поступающее в организм с пищей, в большинстве случаев превышает эту величину. Исключение составляют горожане с низким уровнем жизни и лица, придерживающиеся особых диет.
Однако недостаточное поступление калия может усугубить гипокалиемию, обусловленную потерями калия через ЖКТ или почки.
Одна из редких причин, приводящих к гипокалиемии, — поедание глины (геофагия), поскольку она связывает ионы калия и железа. Геофагия была раньше широко распространена среди афроамериканцев на юге США.
Перемещение калия в клетки снижает концентрацию калия в плазме временно, не влияя на его общее содержание в организме. Независимо от причины перемещения калия в клетки изменение его концентрации в норме при этом относительно мало — не более 1 ммоль/л. Однако, как и недостаточное поступление калия с пищей, перемещение калия в клетки может усугублять гипокалиемию, обусловленную потерями калия.
Гипокалиемию вызывают метаболический алкалоз (вследствие перераспределения калия и потерь через почки и ЖКТ), гипергликемия (вследствие осмотического диуреза), введение больших доз инсулина при диабетическом кетоацидозе (в результате стимуляции контртранспорта Na+/H+ и опосредованной этим активации Na+,K±ATФазы), повышение уровня катехоламинов, назначение бета2-адреностимуляторов (вследствие перемещения калия в клетки и повышения секреции инсулина), рост новых клеток (например, при назначении витамина В12 при болезни Аддисона-Бирмера или ГМ-КСФ при нейтропении), переливание размороженных и отмытых эритроцитов (поскольку замороженные эритроциты при хранении теряют до половины калия).
Гипокалиемия также наблюдается при семейном гипокалиемическом периодическом параличе — редком заболевании, которое проявляется приступами мышечной слабости или паралича.
Потоотделение приводит к гипокалиемии как непосредственно, так и вследствие вызванного гиповолемией повышения уровня альдостерона и экскреции калия.
В норме при объёме стула 100—200 мл потери калия с ним составляют 5-10 ммоль/сут.
Гипокалиемия вследствие потерь калия через ЖКТ возникает при ворсинчатом полипе, ВИПоме, поносе (чаще секреторном) и злоупотреблении слабительными. Потери содержимого желудка при рвоте и аспирации через назогастральный зонд сами по себе не являются причинами гипокалиемии (концентрация калия в желудочном соке составляет 5-10 ммоль/л, и для возникновения дефицита в 300—400 ммоль, который обычно наблюдается у подобных больных, потребовались бы потери в объёме 30-80 л). К гипокалиемии в таких случаях приводят гиповолемия и метаболический алкалоз. Гиповолемия стимулирует секрецию альдостерона, а метаболический алкалоз приводит к бикарбонатурии и повышению отрицательного заряда жидкости в собирательных трубочках (отфильтровавшийся бикарбонат не может полностью реабсорбироваться в проксимальных канальцах). Оба эти механизма повышают выведение калия с мочой.
Симптомы гипокалиемии разнообразны и зависят от её тяжести. Они обычно появляются, когда концентрация калия в плазме становится менее 3 ммоль/л. Больные жалуются на утомляемость, слабость в ногах, миалгию. В тяжелых случаях наблюдаются парезы и параличи, нарушения дыхания, динамическая кишечная непроходимость. Все эти симптомы возникают из-за гиперполяризации мышечных клеток. Вследствие нарушения метаболизма мышечной ткани и уменьшения рабочей гиперемии возможен рабдомиолиз. При гипокалиемии вследствие замедления реполяризации желудочков возникают изменения на ЭКГ. При умеренной гипокалиемии наблюдаются уплощение или инверсия зубца Т, повышение амплитуды зубца U, депрессия сегмента ST и удлинение интервала QT (QU), в тяжелых случаях — удлинение интервала PQ, расширение комплекса QRS (редко). Однако четкой связи между изменениями ЭКГ и тяжестью гипокалиемии нет. Возможны желудочковые аритмии, особенно у больных с ишемией миокарда и гипертрофией левого желудочка.
Гипокалиемия способствует гликозидной интоксикации.
В эпидемиологических исследованиях показана связь между недостаточным поступлением калия с пищей и артериальной гипертонией у американских негров. Показано также, что прием препаратов калия снижает артериальное давление (АД) при гипертонической болезни. Причина повышения АД при гипокалиемии неизвестна. Возможно, это связано с усилением реабсорбции натрия и хлора в дистальных отделах нефрона.
Гипокалиемия часто сочетается с нарушениями кислотно-щелочного равновесия (КЩР). Во-первых, многие расстройства приводят одновременно и к гипокалиемии, и к нарушениям КЩР. Во-вторых, при гипокалиемии развивается внутриклеточный ацидоз, усиливается реабсорбция бикарбоната в проксимальных извитых канальцах нефрона, секреция ионов водорода в дистальных канальцах и аммониогенез. Все это приводит к метаболическому алкалозу.
Гипокалиемия может быть причиной нефрогенного несахарного диабета. Вследствие нарушения секреции инсулина и развития инсулинорезистентности при гипокалиемии часто нарушается толерантность к глюкозе.
Причина гипокалиемии в большинстве случаев может быть установлена на основании данных анамнеза. Уточняют, не принимает ли больной слабительные или диуретики. Важно выяснить также, не вызывает ли он искусственную рвоту. При выраженном лейкоцитозе (например, у больных острыми миелоидными лейкозами), если пробы крови хранятся при комнатной температуре, изредка наблюдается псевдогипокалиемия (калий захватывается лейкоцитами). Чтобы избежать этого, следует хранить пробы в холодильнике или же быстро отделять плазму или сыворотку от клеток. Затем исключают уменьшение потребления калия с пищей и причины, приводящие к перемещению калия в клетки. Источник потерь калия помогает установить исследование мочи. Если функция почек не изменена, то в результате снижения секреции и повышения реабсорбции калия его выведение при гипокалиемии снижается до 15 ммоль/сут. Это наблюдается при потерях калия через кожу и ЖКТ, а также спустя некоторое время после приема диуретиков или многократной рвоты.
Почечные потери калия возрастают при увеличении поступления жидкости в дистальные отделы нефрона и повышении концентрации калия в корковых отделах собирательных трубочек. В дифференциальной диагностике причин почечных потерь калия помогают оценка объёма внеклеточной жидкости, КЩР, измерение АД.
Быстрый и простой метод оценки секреции калия — определение чресканальцевого градиента концентрации калия. Этот показатель равен отношению концентрации калия в просвете корковых отделов собирательных трубочек и в перитубулярных капиллярах (то есть в плазме). Его расчет основан на трех условных допущениях:
— в мозговых отделах собирательных трубочек не происходит реабсорбции растворенных веществ;
— в этих отделах калий не секретируется и не реабсорбируется;
— осмоляльность жидкости в концах корковых отделов собирательных трубочек известна.
В большинстве случаев эти допущения более или менее соблюдаются:
— реабсорбция натрия в дистальных отделах собирательных трубочек обычно мало влияет на чресканальцевый градиент концентрации калия;
— секреция или реабсорбция калия в этих отделах происходит только при тяжелой гипокалиемии или гиперкалиемии;
— в условиях действия АДГ осмоляльность жидкости в концах корковых отделов собирательных трубочек равна осмоляльности плазмы, и тогда концентрацию калия в них (К+кст) можно вычислить по формуле:
(К+кст) = (К+)м х Опл/Ом, где
(К+)м — концентрация калия в моче,
Опл — осмоляльность плазмы,
Ом — осмоляльность мочи.
Следовательно,
ЧГКК = (К+кст)/(K+пл) = ((К+)м х Опл/Ом)/(K+пл), где
ЧГКК — чресканальцевый градиент концентрации калия,
(К+)пл — концентрация калия в плазме.
Приведенные расчеты справедливы, если осмоляльность мочи выше осмоляльности плазмы.
Нормальных значений чресканальцевого градиента концентрации калия нет, поскольку они зависят от баланса калия.
Гипокалиемия с чресканальцевым градиентом концентрации калия более 4 указывает на почечные потери калия вследствие усиленной секреции этого иона в дистальных отделах нефрона. Одна из возможных причин этого состояния — гиперальдостеронизм.
Для дифференциальной диагностики разных форм гиперальдостеронизма определяют уровень ренина и альдрстерона в плазме.
Бикарбонатурия, а также присутствие в моче других нереабсорбируемых анионов повышает чресканальцевый градиент концентрации калия и стимулирует выведение этого иона.
Лечение направлено на прекращение потерь калия и устранение его дефицита. При гипокалиемии вследствие перераспределения калия в/в введение препаратов калия не показано, так как может привести к рикошетной гиперкалиемии (исключение — семейный гипокалиемический периодический паралич). Прием препаратов калия внутрь безопасен.
Концентрация калия в плазме недостаточно точно отражает его общее содержание в организме. Так, снижение концентрации калия в плазме до 3 ммоль/л может соответствовать дефициту от 200 до 400 ммоль калия. Если концентрация калия в плазме ниже 3 ммоль/л, то его дефицит часто достигает 600 ммоль. При перемещении калия из клеток (в частности, при диабетическом кетоацидозе) дефицит калия можно недооценить. В связи с этим во время лечения необходимо постоянно следить за концентрацией калия в плазме.
При гипокалиемии с метаболическим алкалозом назначают хлорид калия.
При гипокалиемии с метаболическим ацидозом (при длительном поносе или почечном канальцевом ацидозе) применяют бикарбонат и цитрат калия (последний распадается с образованием бикарбоната).
Внутривенное введение препаратов калия показано при тяжелой гипокалиемии или невозможности приема препаратов внутрь. При введении в периферическую вену концентрация калия в растворе не должна превышать 40 ммоль/л, при введении в центральную вену — 60 ммоль/л. Если нет парезов и угрожающей жизни аритмии, скорость инфузии не должна превышать 20 ммоль/ч. Хлорид калия лучше всего добавлять в 0,9 % NaCl.
Введение калия с растворами глюкозы может привести к ещё большему снижению концентрации калия в плазме вследствие опосредованного инсулином перемещения калия в клетки. Быстрое в/в введение хлорида калия требует тщательного наблюдения за больным (ЭКГ, исследование двигательных функций).
- ↑ Monarch Disease Ontology release 2018-06-29sonu — 2018-06-29 — 2018.
Калий в крови — Забор анализов на дому – 755-9395
Общие сведения
Калий (К) в крови — катион, находящийся в основном внутри клеток. Основные показания к назначению: сердечно-сосудистые заболевания (аритмии, гипертония), нарушения функции почек, контроль при лечении диуретиками, сердечными гликозидами, в оценке кислотно-щелочного равновесия.
Калий необходим для проведения нервного импульса и мышечного сокращения. Основное количество находится в клетках. И только 0,4% калия находится в плазме крови. Внеклеточная жидкость содержит небольшое количество калия. Соотношение в содержании внеклеточной и внутриклеточной концентрации калия является необходимым звеном в электрической активности возбудимых мембран в проводящей системе сердца и нервных волокон. Калий, поступающий с пищей, захватывается клетками и далее выводится почками. Наибольшая часть калия после клубочков реаборбируется в проксимальных канальцах. В дистальных канальцах происходит секреция калия в мочу и одновременно реабсорбция натрия (под контролем альдостерона). При нарушении его выведения возможно значительное превышение содержания в крови, которое может быть опасным для жизни. Изменения содержания калия приводит к нарушению сердечной деятельности (возможна остановка сердца при гиперкалиемии в диастоле и остановка в систоле при гопокалиемии), нарушению водно-электролитного баланса.
Почечные механизмы выделения калия предотвращают задержку калия и развитие гиперкалиемии.
Реабсорбция калия происходит в проксимальных канальца. Секреция калия в дистальном канальце осуществляется путем обмена на натрий. Поэтому при нарушении реабсорбции натрия, например при недостаточности коры надпочечников, секреция калия снижается, и может наступить гиперкалиемия. Таким образом, механизм обмена Na+ — K+ является частью контролируемого альдостероном процесса реабсорбции натрия в дистальном канальце.
Повышение содержания калия в крови (гиперкалиемия) приводит к нарушение сердечной деятельности — фибрилляция желудочков, асистолия.
Повышение калия в крови выше 6 ммоль/л можно отнести к критическим значениям. Повышение выше 7 ммоль/л может быть причиной внезапной коронарной смерти от остановки сердца.
Снижение содержания калия (гипокалиемия) приводит к появлению параличей, слабости мышечной активности, нарушению перистальтики кишечника (непроходимость кишечника) и проводящей системы сердца.
К основным регуляторам концентрации калия можно отнести — альдостерон, инсулин, дофамин, адреналин. Альдостерон непосредственно стимулирует секрецию калия и реабсорбцию натрия в собирательных трубочках в почках. Инсулин, адреналин и дофамин активируют поглощение калия клетками.
Зачем клетка обменивает натрий на калий?. Рассказы о биоэнергетике
Зачем клетка обменивает натрий на калий?
Мысль о двух формах конвертируемой энергии я высказал в 1975 году. Спустя два года эта точка зрения была поддержана Митчелом. А в группе А. Глаголева тем временем начались опыты по проверке одного из предсказаний этой новой концепции.
Я рассуждал следующим образом. Если протонный потенциал — разменная монета, то клетка должна располагать достаточным количеством, таких «денежных знаков».
Зачем клетка обменивает натрий на калий?
Это требование выполнялось, если речь шла об АТФ. Клетка всегда содержит довольно большие количества АТФ, причем приняты меры для стабилизации этого количества в условиях меняющейся конъюнктуры — непрерывно варьирующих скоростей образования и использования АТФ. Есть особое вещество — креатин-фосфат, участвующее только в одной реакции — фосфорилировании АДФ:
АДФ + креатинфосфат ? АТФ + креатин.
Когда АТФ в избытке, а АДФ в дефиците, реакция идет справа налево и накапливается креатинфосфат, которого в этих условиях становится много больше, чем АТФ. Но стоит повыситься уровню АДФ и уменьшиться АТФ, как реакция меняет направление, и креатинфосфат оказывается поставщиком АТФ. Тем самым креатинфосфат выполняет свою функцию стабилизатора, буфера уровня АТФ.
А как обстоят дела с протонным потенциалом?
Несложный расчет позволяет перевести одну энергетическую «валюту» в другую. Этот расчет показывает, что количество энергии, накопленное, к примеру, бактериальной клеткой в виде протонного потенциала, оказывается почти в тысячу раз меньшим, чем количество АТФ, если протонный потенциал находится в электрической форме. Это количество одного порядка с числом генераторов и потребителей потенциала в бактериальной мембране.
Такая ситуация создает особую необходимость в буферной системе, стабилизирующей уровень протонного потенциала. В противном случае даже кратковременное превышение общей скорости потребляющих потенциал процессов над скоростью его генерации приведет к исчезновению потенциала и остановке всех систем, питаемых потенциалом.
Итак, должен быть буфер для протонного потенциала наподобие креатинфосфата для АТФ. Но что за компонент подобрала природа на такую роль?
Обдумывая эту проблему, я попытался найти какую-нибудь связанную с потенциалом биологическую систему, функция которой была бы неизвестна.
Одна из старых загадок биологии: зачем клетка поглощает ионы калия и выбрасывает ионы натрия, создавая дорогостоящую асимметрию в распределении этих близких по своим свойствам ионов между цитоплазмой и окружающей средой? Практически в любой живой клетке ионов калия намного больше, чем ионов натрия, в то время как в среде натрий находится в огромном избытке над калием. Может быть, Na+ — яд для клетки?
Нет, это не так. Хоть некоторые ферментные системы действительно лучше работают в КСl, чем в NaCl, это выглядит вторичным приспособлением к «многокалиевой» и «малонатриевой» внутренней среде клетки. За огромный срок биологической эволюции клетка могла бы приспособиться к естественному соотношению ионов щелочных металлов во внешней среде. Живут же галофильные бактерии в насыщенном растворе NaCl, причем концентрация Na+ в их цитоплазме иногда доходит до моля на литр, что почти в тысячу раз больше концентрации Na+ в обычных клетках. Итак, Na+ не яд.
Заметим, что те же галофильные бактерии поддерживают внутриклеточную концентрацию К+ около 4 молей на литр, тратя на создание натрий-калиевого градиента колоссальные по масштабам клетки количества энергетических ресурсов.
Известно, что возбудимые клетки животных, такие, как нейроны, используют натрий-калиевый градиент для проведения нервного импульса. Но как быть с другими типами клеток, например, с бактериями?
Давайте обратимся к механизму транспорта К+ и Na+ через бактериальную мембрану. Известно, что между цитоплазмой бактерии и внешней средой существует разность электрических потенциалов, поддерживаемая работой белков-генераторов в бактериальной мембране. Откачивая протоны изнутри клетки наружу, белки-генераторы тем самым заряжают внутренность бактерии отрицательно. В этих условиях накопление ионов К+ внутри клетки могло бы происходить просто за счет электрофореза — движения положительно заряженного иона калия в отрицательно заряженную цитоплазму бактерии.
При этом поток калия должен разряжать мембрану, предварительно заряженную протонными генераторами.
В свою очередь, разрядка мембраны должна немедленно активировать работу генераторов.
Это означает, что энергетические ресурсы, затрачиваемые на генерацию разности электрических потенциалов между клеткой и средой, будут использованы для концентрирования ионов К+ внутри клетки. Конечным балансом такого процесса окажется обмен внутриклеточных ионов Н+ на внеклеточные ионы К+ (ионы Н+ откачиваются белками-генераторами наружу, ионы К+ поступают внутрь, двигаясь в электрическом поле, созданном движением ионов Н+).
Стало быть, внутри клетки будет создаваться не только избыток ионов К+, но и дефицит ионов Н+.
Этот дефицит можно использовать для откачки ионов Na+. Сделать это можно следующим образом. Известно, что бактерии располагают особым переносчиком ионов натрия, обменивающим Na+ на Н+ (этот переносчик носит название Nа+/Н+-антипортера). В условиях нехватки Н+ в цитоплазме антипорт может компенсировать протонный дефицит, перенося Н+ из внешней среды внутрь клетки. Произвести такой антипорт переносчик может только одним способом: обменяв внешний на внутренний Na+. Значит, движение ионов Н+ внутрь клетки может быть использовано для откачки из той же клетки ионов Na+.
Вот мы и создали калий-натриевый градиент: внутри клетки накопили К+ и откачали оттуда Na+. Движущей силой этих процессов был создаваемый белками-генераторами протонный потенциал. (Направление потенциала было таково, что внутренность клетки заряжалась отрицательно и там возникала нехватка ионов водорода.)
Допустим теперь, что протонные генераторы по какой-то причине выключились. Что произойдет в этих новых условиях с калий-натриевым градиентом?
Конечно же, он рассеется: ионы К+ вытекут из клетки в окружающую среду, где их мало, ионы Na+ войдут внутрь, где эти ионы в дефиците.
Но вот что интересно. Рассеиваясь, калий-натриевый градиент сам окажется генератором протонного потенциала того же направления, что образовывался при работе белков-генераторов.
Действительно, выход иона К+ как положительно заряженной частицы создает диффузионную разность потенциалов на клеточной мембране со знаком «минус» внутри клетки. Вход Na+ при участии Nа+/Н+ — антипортера будет сопровождаться выходом Н+, то есть созданием дефицита Н+ внутри клетки.
Так что же получается? Когда белки-генераторы работают, создаваемый ими протонный потенциал расходуется на образование калий-натриевого градиента. Зато когда они выключены (или их мощности недостает, чтобы удовлетворить многочисленных потребителей потенциала), калий-натриевый градиент, рассеиваясь, сам начинает генерировать протонный потенциал.
Так ведь это и есть буфер протонного потенциала, тот самый буфер, который так необходим для работы мембранных энергетических систем!
Схематично эту концепцию можно изобразить так:
калий-натриевый градиент
??
внешние энергетические ресурсы ? протонный потенциал ? работа.
Но если такая схема верна, то калий-натриевый градиент должен продлить работоспособность клетки в условиях, когда исчерпаны энергетические ресурсы.
А. Глаголев и И. Броун проверили справедливость этого вывода. Был взят мутант кишечной палочки, лишенный протонной АТФ-синтетазы. Для такого мутанта окисление субстратов кислородом служит единственным энергетическим ресурсом, пригодным, чтобы образовать протонный потенциал. Как было показано в свое время Дж. Адлером и его сотрудниками, мутант подвижен, пока в среде есть кислород.
Глаголев и Броун повторили опыт Адлера и убедились, что исчерпание запаса кислорода в растворе действительно останавливает бактерии, если они находятся в среде с КСl. В этих условиях калий-натриевый градиент отсутствует: калия много и в клетках и в среде, а натрия нет ни там, ни здесь.
А теперь давайте возьмем среду с NaCl. В таких условиях должны быть оба интересующих нас градиента: калиевый (калия много внутри и мало снаружи) и натриевый (натрия много снаружи и мало внутри). Гипотеза предсказывала, что в такой ситуации подвижность сохранится какое-то время и в бескислородных условиях, поскольку возможно превращение энергии:
калий-натриевый градиент ? протонный потенциал ? вращение флагеллы.
И в самом деле, бактерии двигались еще 15—20 минут после того, как измерительное устройство зарегистрировало нулевой уровень СЬ в среде.
Но особенно наглядным, как и следовало ожидать, оказался опыт с солелюбивыми бактериями, которые транспортируют очень большие количества ионов К+ и Na+ , чтобы создать калий-натриевый градиент. Такие бактерии быстро останавливались в темноте в бескислородных условиях, если в среде был КСl, и все еще двигались спустя девять (!) часов, если КСl был заменен на NaCl.
Эта величина — девять часов — интересна прежде всего как иллюстрация объема того резервуара энергии, который представляет собой калий-натриевый градиент у солелюбивых бактерий. Кроме того, она приобретает особый смысл, если вспомнить о том, что солелюбивые бактерии располагают бактериородопсином и, стало быть, способны к превращению энергии света в протонный потенциал. Ясно, что такое превращение возможно лишь в светлый период суток. А как быть ночью? Так вот оказывается, что энергии, запасенной днем в виде калий-натриевого градиента, хватает на всю ночь.
Утверждение, что калий-натриевый градиент играет роль буфера протонного потенциала, позволяет понять не только биологическую функцию этого градиента, но и причину, которая в течение многих лет препятствовала выяснению его значения для жизнедеятельности клетки. Мысль о буферной роли калий-натриевого градиента не могла родиться, прежде чем был открыт протонный потенциал и было доказано, что он служит конвертируемой формой энергии. Все эти годы проблема калия и натрия просто ждала своего часа.
Поделитесь на страничкеСледующая глава >
Калий — это… Что такое Калий?
| Внешний вид простого вещества | |
|---|---|
| Серебристо-белый мягкий металл | |
| Свойства атома | |
| Имя, символ, номер | Калий / Kalium (K), 19 |
| Атомная масса (молярная масса) | 39,0983[1]а. е. м. (г/моль) |
| Электронная конфигурация | [Ar] 4s1 |
| Радиус атома | 235 пм |
| Химические свойства | |
| Ковалентный радиус | 203 пм |
| Радиус иона | 133 пм |
| Электроотрицательность | 0,82 (шкала Полинга) |
| Электродный потенциал | −2,92 В |
| Степени окисления | 1 |
| Энергия ионизации (первый электрон) | 418,5 (4,34) кДж/моль (эВ) |
| Термодинамические свойства простого вещества | |
| Плотность (при н. у.) | 0,856 г/см³ |
| Температура плавления | 63,51°С; 336,8 K |
| Температура кипения | 1047 K |
| Теплота плавления | 2,33 кДж/моль |
| Теплота испарения | 76,9 кДж/моль |
| Молярная теплоёмкость | 29,6[2] Дж/(K·моль) |
| Молярный объём | 45,3 см³/моль |
| Кристаллическая решётка простого вещества | |
| Структура решётки | кубическая объёмно-центрированная |
| Параметры решётки | 5,332 Å |
| Температура Дебая | 100 K |
| Прочие характеристики | |
| Теплопроводность | (300 K) 79,0 Вт/(м·К) |
Ка́лий — элемент главной подгруппы первой группы, четвёртого периода периодической системы химических элементов Д. И. Менделеева, с атомным номером 19. Обозначается символом K (лат. Kalium). Простое вещество калий (CAS-номер: 7440-09-7) — мягкий щелочной металл серебристо-белого цвета.
В природе калий встречается только в соединениях с другими элементами, например, в морской воде, а также во многих минералах. Очень быстро окисляется на воздухе и очень легко вступает в химические реакции, особенно с водой, образуя щёлочь. Во многих отношениях химические свойства калия очень близки к натрию, но с точки зрения биологической функции и использования их клетками живых организмов они всё же отличаются.
История и происхождение названия
Калий (точнее, его соединения) использовался с давних времён. Так, производство поташа (который применялся как моющее средство) существовало уже в XI веке. Золу, образующуюся при сжигании соломы или древесины, обрабатывали водой, а полученный раствор (щёлок) после фильтрования выпаривали. Сухой остаток, помимо карбоната калия, содержал сульфат калия K2SO4, соду и хлорид калия KCl.
В 1807 году английский химик Дэви электролизом расплава едкого кали (KOH) выделил калий и назвал его «потассий» (лат. potassium; это название до сих пор употребительно в английском, французском, испанском, португальском и польском языках). В 1809 году Л. В. Гильберт предложил название «калий» (лат. kalium, от араб. аль-кали — поташ). Это название вошло в немецкий язык, оттуда в большинство языков Северной и Восточной Европы (в том числе русский) и «победило» при выборе символа для этого элемента — K.
Нахождение в природе
В свободном состоянии не встречается. Породообразующий элемент, входит в состав слюд, полевых шпатов и т.д. Также калий входит в состав сильвина KCl, сильвинита KCl·NaCl, карналлита KCl·MgCl2·6H2O, каинита KCl·MgSO4·6H2O, а также присутствует в золе некоторых растений в виде карбоната K2CO3 (поташ). Калий входит в состав всех клеток (см. ниже раздел Биологическая роль). Кларк калия в земной коре составляет 2,4 % (5-й по распространённости металл, 7-й по содержанию в коре элемент). Концентрация в морской воде 380 мг/л[3].
Месторождения
Крупнейшие месторождения калия находятся на территории Канады (производитель PotashCorp), России (ОАО «Уралкалий», г. Березники, ОАО «Сильвинит», г. Соликамск, Пермский край, Верхнекамское месторождение калийных руд[4]), Белоруссии (ПО «Беларуськалий», г. Солигорск, Старобинское месторождение калийных руд[5]).
Получение
Калий, как и другие щелочные металлы, получают электролизом расплавленных хлоридов или щелочей. Так как хлориды имеют более высокую температуру плавления (600—650 °C), то чаще проводят электролиз расплавленных щелочей с добавкой к ним соды или поташа (до 12 %). При электролизе расплавленных хлоридов на катоде выделяется расплавленный калий, а на аноде — хлор:
При электролизе щелочей на катоде также выделяется расплавленный калий, а на аноде — кислород:
Вода из расплава быстро испаряется. Чтобы калий не взаимодействовал с хлором или кислородом, катод изготовляют из меди и над ним помещают медный цилиндр. Образовавшийся калий в расплавленном виде собирается в цилиндре. Анод изготовляют также в виде цилиндра из никеля (при электролизе щелочей) либо из графита (при электролизе хлоридов).
Важное промышленное значение имеют и методы термохимического восстановления:
и восстановление из расплава хлорида калия карбидом кальция, алюминием или кремнием.[6][7]
Физические свойства
Калий под слоем ТГФКалий — серебристое вещество с характерным блеском на свежеобразованной поверхности. Очень лёгок и легкоплавок. Относительно хорошо растворяется в ртути, образуя амальгамы. Будучи внесённым в пламя горелки, калий (а также его соединения) окрашивает пламя в характерный розово-фиолетовый цвет[8].
Калий активно взаимодействует с водой. Выделяющийся водород воспламеняется, а ионы калия придают пламени фиолетовый цвет. Раствор фенолфталеина в воде становится малиновым, демонстрируя щелочную реакцию образующегося KOH.Калий образует кристаллы кубической сингонии, пространственная группа I m3m, параметры ячейки a = 0,5247 нм, Z = 2.
Химические свойства
Элементарный калий, как и другие щелочные металлы, проявляет типичные металлические свойства и очень химически активен, является сильным восстановителем. На воздухе свежий срез быстро тускнеет из-за образования плёнок соединений (оксиды и карбонат). При длительном контакте с атмосферой способен полностью разрушиться. С водой реагирует со взрывом. Хранить его необходимо под слоем бензина, керосина или силикона, дабы исключить контакт воздуха и воды с его поверхностью. С Na, Tl, Sn, Pb, Bi калий образует интерметаллиды.
Взаимодействие с простыми веществами
Калий при комнатной температуре реагирует с кислородом воздуха, галогенами; практически не реагирует с азотом (в отличие от лития и натрия). При умеренном нагревании реагирует с водородом с образованием гидрида (200—350 °C):
,
с халькогенами (100—200 °C, E = S, Se, Te):
.
При сгорании калия на воздухе образуется надпероксид калия KO2 (с примесью K2O2):
В реакции с фосфором в инертной атмосфере образуется фосфид зелёного цвета (200 °C):
Взаимодействие со сложными веществами
Калий при комнатной температуре активно реагирует с водой, кислотами, растворяется в жидком аммиаке (−50 °C) с образованием тёмно-синего раствора.
Калий глубоко восстанавливает разбавленные серную и азотную кислоты:
При сплавлении металлического калия со щелочами он восстанавливает водород гидроксогруппы:
При умеренном нагревании реагирует с газообразным аммиаком с образованием амида (65—105 °C):
Металлический калий реагирует со спиртами с образованием алкоголятов:
Алкоголяты щелочных металлов (в данном случае, этаноат калия) являются очень сильными основаниями и широко используются в органическом синтезе.
Соединения с кислородом
При взаимодействии калия с кислородом воздуха образуется не оксид, а пероксид и супероксид:
Оксид калия может быть получен при нагревании металла до температуры не выше 180 °C в среде, содержащей очень мало кислорода, или при нагревании смеси супероксида калия с металлическим калием:
Оксиды калия обладают ярко выраженными основными свойствами, бурно реагируют с водой, кислотами и кислотными оксидами. Практического значения они не имеют. Пероксиды представляют собой желтовато-белые порошки, которые, хорошо растворяясь в воде, образуют щёлочи и пероксид водорода:
Советский изолирующий противогаз ИП-5Свойство обменивать углекислый газ на кислород используется в изолирующих противогазах и на подводных лодках. В качестве поглотителя используют эквимолярную смесь супероксида калия и пероксида натрия. Если смесь не эквимолярна, то в случае избытка пероксида натрия поглотится больше газа, чем выделится (при поглощении двух объёмов CO2 выделяется один объём O2), и давление в замкнутом пространстве упадёт, а в случае избытка супероксида калия (при поглощении двух объёмов CO2 выделяется три объёма O2) выделяется больше газа, чем поглотится, и давление повысится.
В случае эквимолярной смеси (Na2O2:K2O4 = 1:1) объёмы поглощаемого и выделяемого газов будут равны (при поглощении четырёх объёмов CO2 выделяется четыре объёма O2).
Пероксиды являются сильными окислителями, поэтому их применяют для отбеливания тканей в текстильной промышленности.
Получают пероксиды прокаливанием металлов на воздухе, освобождённом от углекислого газа.
Также известен озонид калия KO3, оранжево-красного цвета. Получить его можно взаимодействием гидроксида калия с озоном при температуре не выше 20 °C:
Озонид калия является очень сильным окислителем, например, окисляет элементарную серу до сульфата и дисульфата уже при 50 °C:
Гидроксид
Гидроксид калия (или едкое кали) представляет собой твёрдые белые непрозрачные, очень гигроскопичные кристаллы, плавящиеся при температуре 360 °C. Гидроксид калия относится к щелочам. Он хорошо растворяется в воде с выделением большого количества тепла. Растворимость едкого кали при 20 °C в 100 г воды составляет 112 г.
Применение
- Жидкий при комнатной температуре сплав калия и натрия используется в качестве теплоносителя в замкнутых системах, например, в атомных силовых установках на быстрых нейтронах. Кроме того, широко применяются его жидкие сплавы с рубидием и цезием. Сплав состава: натрий 12 %, калий 47 %, цезий 41 % — обладает рекордно низкой температурой плавления −78 °C.
- Соединения калия — важнейший биогенный элемент и потому применяются в качестве удобрений.
- Соли калия широко используются в гальванотехнике, так как, несмотря на относительно высокую стоимость, они часто более растворимы, чем соответствующие соли натрия, и потому обеспечивают интенсивную работу электролитов при повышенной плотности тока.
Важные соединения
Кристаллы перманганата калияБиологическая роль
Калий — важнейший биогенный элемент, особенно в растительном мире. При недостатке калия в почве растения развиваются очень плохо, уменьшается урожай, поэтому около 90 % добываемых солей калия используют в качестве удобрений.
Калий в организме человека
 | В этом разделе не хватает ссылок на источники информации. Информация должна быть проверяема, иначе она может быть поставлена под сомнение и удалена. Вы можете отредактировать эту статью, добавив ссылки на авторитетные источники. Эта отметка установлена 12 мая 2011. |
Калий содержится большей частью в клетках, до 40 раз больше чем в межклеточном пространстве. В процессе функционирования клеток избыточный калий покидает цитоплазму, поэтому для сохранения концентрации он должен нагнетаться обратно при помощи натрий-калиевого насоса. Калий и натрий между собой функционально связаны и выполняют следующие функции:
- Создание условий для возникновения мембранного потенциала и мышечных сокращений.
- Поддержание осмотической концентрации крови.
- Поддержание кислотно-щелочного баланса.
- Нормализация водного баланса.
Рекомендуемая суточная доля калия составляет для детей от 600 до 1700 миллиграммов, для взрослых от 1800 до 5000 миллиграммов. Потребность в калии зависит от общего веса тела, физической активности, физиологического состояния, и климата места проживания. Рвота, продолжительные поносы, обильное потение, использование мочегонных повышают потребность организма в калии.
Основными пищевыми источниками являются сушёные абрикосы, дыня, бобы, киви, картофель, батат, авокадо, бананы, брокколи, печень, молоко, ореховое масло, цитрусовые, виноград. Калия достаточно много в рыбе и молочных продуктах.
Практически все сорта рыбы содержат более 200 мг калия в 100 г. Количество калия в разных видах рыбы различается. Овощи, грибы и травы также содержат много калия, однако в консервированных продуктах его уровень может быть гораздо меньше. Много калия содержится в шоколаде.
Всасывание происходит в тонком кишечнике. Усвоение калия облегчает витамин B6, затрудняет — алкоголь.
При недостатке калия развивается гипокалиемия. Возникают нарушения работы сердечной и скелетной мускулатуры. Продолжительный дефицит калия может быть причиной острой невралгии.
При переизбытке калия развивается гиперкалиемия, для которой основным симптомом является язва тонкого кишечника. Настоящая гиперкалиемия может вызвать остановку сердца.
Изотопы
Природный калий состоит из трёх изотопов. Два из них стабильны: 39K (изотопная распространённость 93,258 %) и 41K (6,730 %). Третий изотоп 40K (0,0117 %) является бета-активным с периодом полураспада 1,251·109 лет. В каждом грамме природного калия в секунду распадается в среднем 32 ядра 40K, благодаря чему, например, в организме человека массой 70 кг ежесекундно происходит около 4000 радиоактивных распадов. Поэтому легкодоступные в быту соединения калия (поташ, хлорид калия, калийная селитра и т. д.) можно использовать как пробные радиоактивные источники для проверки бытовых дозиметров. 40K наряду с ураном и торием считается одним из основных источников геотермальной энергии, выделяемой в недрах Земли (полная скорость энерговыделения оценивается в 40—44 ТВт). В минералах, содержащих калий, постепенно накапливается калий-аргоновый метод является одним из основных методов ядерной геохронологии.
См. также
Примечания
- ↑ Atomic Weights and Isotopic Compositions for All Elements. NIST Physical Measurement Laboratory. Архивировано из первоисточника 22 августа 2011. Проверено 16 ноября 2010.
- ↑ Химическая энциклопедия: в 5 т / Редкол.: Кнунянц И. Л. (гл. ред.). — М.: Советская энциклопедия, 1990. — Т. 2. — С. 284. — 671 с. — 100 000 экз.
- ↑ J. P. Riley and Skirrow G. Chemical Oceanography V. 1, 1965
- ↑ КАЛИЙНОЕ МЕСТОРОЖДЕНИЕ
- ↑ Химическое и агрохимическое сырье.
- ↑ А. Ф. Алабышев, К. Д Грачев, С. А. Зарецкий, М. Ф. Лантратов, Натрий и калий (получение, свойства, применение), Л: Гос. н-т. изд-во хим. лит., 1959, С. 321.
- ↑ Хим.энциклопедия, т.2, М.: Сов. энциклопедия, 1990, С.562.
- ↑ Элементы: проба на окрашивание пламени (рус.). Архивировано из первоисточника 22 августа 2011. Проверено 26 января 2010.
Литература
- Пилипенко А. Т. Натрий и калий // Справочник по элементарной химии. — 2-е изд. — Киев: Наукова думка, 1978. — С. 316—319.
- Дроздов А. Яростные металлы // Энциклопедия для детей. Химия. — М.: Аванта +, 2002. — С. 184—187. — ISBN 5-8483-0027-5
- Ахметов Н. С. Общая и неорганическая химия. — М.: Высшая школа, 2001.
- Некрасов Б. В. Основы общей химии. — М.: Химия, 1974.
- Спицын В. И., Мартыненко Л. И. Неорганическая химия. — М.: МГУ, 1991, 1994.
- Лидин Р. А. и др. Элементы IA-группы. Калий // Химические свойства неорганических веществ: Уч. пособие для вузов. — 4-е изд. — М.: КолосС, 2003. — С. 29—40. — ISBN 5-9532-0095-1
Ссылки
 Электрохимический ряд активности металлов Электрохимический ряд активности металлов | |
|---|---|
Eu, Sm, Li, Cs, Rb, K, Ra, Ba, Sr, Ca, Na, Ac, La, Ce, Pr, Nd, Pm, Gd, Tb, Mg, Y, Dy, Am, Ho, Er, Tm, Lu, Sc, Pu, Th, Np, U, Hf, Be, Al, Ti, Zr, Yb, Mn, V, Nb, Pa, Cr, Zn, Ga, Fe, Cd, In, Tl, Co, Ni, Te, Mo, Sn, Pb, H2, W, Sb, Bi, Ge, Re, Cu, Tc, Te, Rh, Po, Hg, Ag, Pd, Os, Ir, Pt, Au |
| ||||||||||||
1) Любовь клетки к калию,
2) любовь калия к свободе.
Как ни странно, но результат этих двух видов любви — пустота!
Именно она, пустота, создаёт в клетке отрицательный электрический заряд — потенциал покоя. Точнее, отрицательный потенциал создают пустые места, оставшиеся от убежавшего из клетки калия.
Итак, результат деятельности мембранных ионных насосов-обменников таков:
Натрий-калиевый ионный насос-обменник создаёт три потенциала (возможности):
1. Электрический потенциал — возможность затягивать внутрь клетки положительно заряженные частицы (ионы).
2. Ионный натриевый потенциал — возможность затягивать внутрь клетки ионы натрия (и именно натрия, а не какие-нибудь другие).
3. Ионный калиевый потенциал — возможновть выталкивать из клетки ионы калия (и именно калия, а не какие-нибудь другие).
1. Дефицит натрия (Na+) в клетке.
2. Избыток калия (K+) в клетке.
Можно сказать так: ионные насосы мембраны создают разность концентраций ионов, или градиент (перепад)концентрации, между внутриклеточной и внеклеточной средой.
Именно из-за получившегося дефицита натрия в клетку теперь «полезет» этот самый натрий снаружи. Так всегда ведут себя вещества: они стремятся выравнять свою концентрацию во всём объёме раствора.
И в то же время в клетке получился избыток ионов калия по сравнению с наружной средой. Потому что насосы мембраны накачали его в клетку. И он стремится уравнять свою концентрацию внутри и снаружи, и поэтому стремится выйти из клетки.
Тут ещё важно понять, что ионы натрия и калия как бы «не замечают» друг друга, они реагируют только «на самих себя». Т.е. натрий реагирует на концентрацию натрия же, но «не обращает внимания» на то, сколько вокруг калия. И наоборот, калий реагирует только на концентрацию калия и «не замечает» натрий. Получается, что для понимания поведения ионов в клетке надо по-отдельности сравнивать концентрации ионов натрия и калия. Т.е. надо отдельно сравнить концентрацию по натрию внутри и снаружи клетки и отдельно — концентрацию калия внутри и снаружи клетки, но не имеет смысла сравнивать натрий с калием, как это часто делается в учебниках.
По закону выравнивания концентраций, который действует в растворах, натрий «хочет» снаружи войти в клетку. Но не может, так как мембрана в обычном состоянии плохо его пропускает. Его заходит немножко и клетка его опять тут же обменивает на наружный калий. Поэтому натрий в нейронах всегда в дефиците.
А вот калий как раз может легко выходить из клетки наружу! В клетке его полно, и она его удержать не может. Так вот он и выходит наружу через особые белковые дырочки в мембране (ионные каналы).
Анализ
От химического — к электрическому
А теперь — самое главное, следите за излагаемой мыслью! Мы должны перейти от движения химических частиц к движению электрических зарядов.
Калий заряжен положительным зарядом, и поэтому он, когда выходит из клетки, выносит из неё не только себя, но и «плюсики» (положительные заряды). На их месте в клетке остаются «минусы» (отрицательные заряды). Это и есть мембранный потенциал покоя!
Мембранный потенциал покоя — это дефицит положительных зарядов внутри клетки, образовавшийся за счёт утечки из клетки положительных ионов калия.
Заключение
Составные части потенциала покоя
Потенциал покоя — отрицательный со стороны клетки и состоит как бы из двух частей.
1. Первая часть — это примерно -10 милливольт, которые получаются от неравносторонней работы мембранного насоса-обменника (ведь он больше выкачивает «плюсиков» с натрием, чем закачивает обратно с калием).
2. Вторая часть — это утекающий всё время из клетки калий, утаскивающий положительные заряды из клетки. Он дает большую часть мембранного потенциала, доводя его до -70 милливольт.
Калий перестанет выходить из клетки (точнее, его вход и выход сравняются) только при уровне электроотрицательности клетки в -90 милливольт. Но этому мешает постоянно подтекающий в клетку натрий, который тащит с собой свои положительные заряды. И в клетке поддерживается равновесное состояние на уровне -70 милливольт.
Так что всё дело в натрий-калиевом мембранном насосе-обменнике и последующем вытекании из клетки «лишнего» калия. За счёт потери положительных зарядов при этом вытекании внутри клетки нарастает электроотрицательность. Она-то и есть «мембранный потенциал покоя». Он измеряется внутри клетки и составляет обычно -70 мВ.
Выводы
Мембранный потенциал покоя образуется за счёт двух процессов:
