Триптофан — Википедия
| Триптофан | |||
|---|---|---|---|
 ( ({{{картинка2}}}) | |||
| Систематическое наименование | 2-амино-3-(1H-индол-3-ил)пропионовая кислота | ||
| Сокращения | Три, Trp, W UGG | ||
| Хим. формула | C11H12N2O2 | ||
| Рац. формула | C11H12N2O2 | ||
| Молярная масса | 204,23 г/моль | ||
| Константа диссоциации кислоты pKa{\displaystyle pK_{a}} | 9,39[1] | ||
| Рег. номер CAS | 73-22-3 | ||
| PubChem | 6305 | ||
| Рег. номер EINECS | 200-795-6 | ||
| SMILES | |||
| InChI | |||
| ChEBI | 16828 и 57912 | ||
| ChemSpider | 6066 | ||
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |||
 Медиафайлы на Викискладе Медиафайлы на Викискладе | |||
Триптофа́н (β-(β-индолил)-α-аминопропионовая кислота, сокр.: Три, Трп, Trp, W) — ароматическая альфа-аминокислота. Существует в двух оптически изомерных формах, L и D, и в виде рацемата (рацемической смеси) (DL).
L-триптофан является протеиногенной аминокислотой и входит в состав белков всех известных живых организмов. Относится к ряду гидрофобных аминокислот, поскольку содержит ароматическое ядро индола. Участвует в гидрофобных и стэкинг-взаимодействиях.
Впервые в 1890 г. триптофан выделил из пищеварительного фермента трипсина и описал его свойства немецкий химик Рихард Ноймайстер и он же дал название аминокислоте. Греческий суффикс «фан» означает «указывающий на»[2].
Триптофан в природе синтезируется через антранилат. В процессе биосинтеза антранилата промежуточными соединениями являются шикимат, хоризмат. Биосинтез антранилата рассмотрен в статье шикиматный путь. Четыре обратимые реакции составляют кратчайший путь преобразования антранилата в триптофан. Гены, ответственные за эти реакции, а также за необратимую реакцию образования антранилата из хоризмата, имеют название
Схематично строение триптофанового оперона Escherichia coli можно выразить записью:
—trpR—…—Промотор—Оператор—Лидер—Аттенуатор—trpE—trpD—trpC—trpB—trpA—Терминатор—Терминатор—
Стадии биосинтетического процесса хоризмат →→ триптофан:
- Из хоризмата синтезируется антранилат. Донором аминогруппы выступает амидный азот глутамина либо аммоний. В результате реакции образуется также пируват. У Escherichia coli реакцию осуществляет компонент I антранилат-синтазы, продукт гена trpE.
- Антранилат фосфорибозилируется фосфорибозилпирофосфатом с образованием фосфорибозилантранилата. В реакции высвобождается неорганический пирофосфат (в присутствии пирофосфатазы реакция протекает практически необратимо). У
- Фосфорибозилантранилат, претерпевая перегруппировку Амадори, изомеризуется в фосфорибулозилантранилат. У Escherichia coli реакция определяется фосфорибозилантранилат-изомеразной активностью индол-глицерол-фосфат-синтазы, являющейся продуктом гена trpC.
- Циклизация фосфорибулозилантранилата, сопровождаемая декарбоксилированием-дегидратацией приводит к индол-глицерол-фосфату. У Escherichia coli реакция определяется индол-глицерол-фосфат-синтазной активностью индол-глицерол-фосфат-синтазы, являющейся продуктом гена
- Заместитель отщепляется в виде глицеральдегид-3-фосфата, происходит замена этого заместителя на другой трёхуглеродный заместитель, происходящий из молекулы L-серина. Реакция протекает через промежуточное образование незамещённого индола. Реакция пиридоксаль-зависима. У Escherichia coli реакцию осуществляет триптофан-синтаза субъединичного состава α2β2 (субъединица α — продукт гена trpA, субъединица β — продукт гена trpB)[3].
В природе триптофан синтезируют микроорганизмы, растения и грибы. Многоклеточные животные не способны синтезировать триптофан
Катаболические превращения L-триптофана в организме человека:
Триптофан→N-формилкинуренин→кинуренин→3-гидроксикинуренин→3-гидроксиантранилат
N-формилкинуренин→N-формилантранилат→антранилат→3-гидроксиантранилат
Кинуренин→антранилат→3-гидроксиантранилат
3-Гидроксиантранилат→2-амино-3-карбоксимуконат-семиальдегид→2-аминомуканат-семиальдегид→2-аминомуконат→2-кетоадипат→глутарил-КоА→кротонил-КоА→(S)-3-гидроксибутаноил-КоА→ацетоацетил-КоА→ацетил-КоА
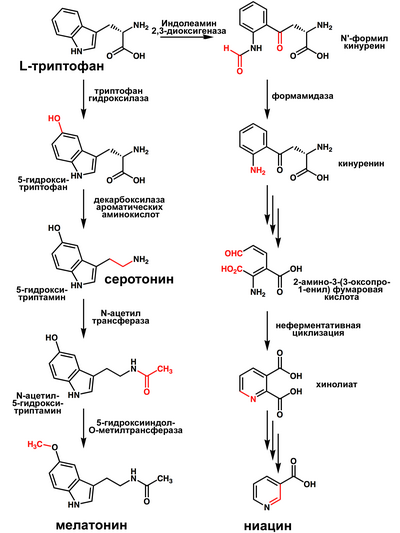
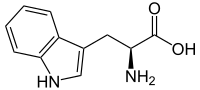
Триптофан является биологическим прекурсором серотонина[4] (из которого затем может синтезироваться мелатонин) и ниацина (см. рисунок).
Часто гиповитаминоз по витамину B3 сопряжён с недостатком триптофана.
Также триптофан является биохимическим предшественником индольных алкалоидов. Например, триптофан→триптамин→N,N-диметилтриптамин→псилоцин→псилоцибин
Метаболит триптофана — 5-гидрокситриптофан (5-HTP) был предложен в качестве средства для лечения эпилепсии[5]
В связи с преобразованием 5-HTP в серотонин в печени есть значительный риск появления пороков сердца из-за влияния серотонина на сердце[8][9].
Способы получения и производство триптофана[править | править код]
Химический синтез[править | править код]
Индол аминометилируют формальдегидом и диметиламином по методу Манниха. Полученный 3-диметиламинометилиндол конденсируют с метиловым эфиром нитроуксусной кислоты, что приводит к метилату 3-индолилнитропропионовой кислоты. Затем восстанавливают нитрогруппу до аминогруппы. После щелочного гидролиза эфира получают D,L-триптофан обычно в форме натриевой соли.
Химико-ферментативный синтез[править | править код]
У микроорганизмов, в том числе и у Escherichia coli, известен пиридоксальзависимый фермент триптофан-индол-лиаза (триптофаназа КФ 4.1.99.1, продукт гена tnaA). Функция этого фермента заключается в поддержании равновесия:
триптофан + вода ⇋ индол + пируват + аммоний.
Благодаря этому триптофан может быть получен ферментативной конденсацией индола, пировиноградной кислоты и аммиака.
Микробиологический синтез[править | править код]
В промышленном производстве L-триптофана обычно используются штаммы дрожжей
Исходным сырьём в микробиологическом производстве триптофана может служить также синтетический индол. Процесс зависит от активности триптофан-синтазы и доступности серина.
Триптофан является компонентом пищевых белков. Наиболее богаты триптофаном такие продукты, как сыр, рыба, мясо, бобовые, творог, грибы[источник не указан 1914 дней], овёс, сушёные финики[источник не указан 1914 дней], арахис, кунжут, кедровый орех, молоко, йогурт.
Триптофан присутствует в большинстве растительных белков, особенно им богаты соевые бобы. Очень малое количество триптофана содержится в кукурузе, поэтому питание только кукурузой приводит к нехватке этой аминокислоты и, как следствие, к пеллагре. Арахис является отличным источником триптофана, однако в арахисе его меньше чем в продуктах животного происхождения.
Мясо и рыба содержат триптофан неравномерно: белки соединительной ткани (коллаген, эластин, желатин) не содержат триптофан[11].
Таблица содержания триптофана в продуктах[править | править код]
Основной источник: [12]| № п/п | продукт | в мг на 100 г |
|---|---|---|
| 1 | красная икра | 960 |
| 2 | чёрная икра | 910 |
| 3 | сыр голландский | 780 |
| 4 | арахис | 285[13] |
| 5 | миндаль | 630 |
| 6 | кешью | 600 |
| 7 | соевые бобы | 600 |
| 8 | сыр плавленый | 500 |
| 9 | кедровые орехи | 420 |
| 10 | халва | 360 |
| 11 | мясо кролика, индейки | 330 |
| 12 | кальмары | 320 |
| 13 | ставрида | 300 |
| 14 | семечки подсолнуха | 300 |
| 15 | фисташки | 300 |
| 16 | курица | 290 |
| 17 | горох, фасоль | 260 |
| 18 | сельдь | 250 |
| 19 | телятина | 250 |
| 20 | говядина | 133 |
| 21 | лосось | 220 |
| 22 | треска | 210 |
| 23 | баранина | 210 |
| 24 | творог жирный | 210 |
| 25 | яйца куриные | 200 |
| 26 | минтай | 200 |
| 27 | шоколад | 200 |
| 28 | свинина | 190 |
| 29 | творог нежирный | 180 |
| 30 | карп | 180 |
| 31 | палтус, судак | 180 |
| 32 | крупа гречневая | 180 |
| 33 | пшено | 180 |
| 34 | окунь морской | 170 |
| 35 | скумбрия | 160 |
| 36 | крупа овсяная | 160 |
| 37 | курага | 150 |
| 38 | грибы | 130 |
| 39 | крупа ячневая | 120 |
| 40 | крупа перловая | 100 |
| 41 | хлеб пшеничный | 100 |
| 42 | картофель жаренный | 84 |
| 43 | финики | 75 |
| 44 | рис отварной | 72 |
| 45 | картофель отварной | 72 |
| 46 | хлеб ржаной | 70 |
| 47 | чернослив | 69 |
| 48 | зелень (укроп, петрушка) | 60 |
| 49 | свекла | 54 |
| 50 | изюм | 54 |
| 51 | капуста | 54 |
| 52 | бананы | 45 |
| 53 | морковь | 42 |
| 54 | лук | 42 |
| 55 | молоко, кефир | 40 |
| 56 | помидоры | 33 |
| 57 | абрикосы | 27 |
| 58 | апельсины | 27 |
| 59 | гранат | 27 |
| 60 | грейпфрут | 27 |
| 61 | лимон | 27 |
| 62 | персики | 27 |
| 63 | вишня | 24 |
| 64 | клубника | 24 |
| 65 | малина | 24 |
| 66 | мандарины | 24 |
| 67 | мёд | 24 |
| 68 | сливы | 24 |
| 69 | огурцы | 21 |
| 70 | кабачки | 21 |
| 71 | арбуз | 21 |
| 72 | виноград | 18 |
| 73 | дыня | 18 |
| 74 | хурма | 15 |
| 75 | клюква | 15 |
| 76 | яблоки | 12 |
| 77 | груши | 12 |
| 78 | ананасы | 12 |
Семейная гипертриптофанемия[править | править код]
Семейная гипертриптофанемия — редкое аутосомно-рецессивное наследственное заболевание, нарушение обмена веществ, которое приводит к накоплению триптофана в крови и выведению его с мочой (триптофанурия).
Болезнь Хартнапа[править | править код]
Причиной заболевания является нарушение активного транспорта триптофана через кишечную стенку, вследствие чего усиливаются процессы его бактериального разложения и образования индольных продуктов, таких как индол, скатол.
Синдром Тада[править | править код]
Наследственное заболевание, связанное с нарушением превращения триптофана в кинуренин. При заболевании наблюдается повреждение ЦНС и нанизм. Заболевание впервые описано К. Тада в 1963 году.
Синдром Прайса[править | править код]
Генетическое заболевание, причиной которого является нарушение превращения кинуренина в 3-гидрокси-L-кинуренин (за реакцию ответственна NADP-зависимая L-кинуренин-3-гидроксилаза КФ 1.14.13.9). Заболевание проявляется повышенной экскрецией кинуренина с мочой, а также склеродермией.
Индиканурия[править | править код]
Индиканурия — повышенное содержание в моче индикана. Причиной может являться непроходимость кишечника, из-за чего в нём начинают усиленно протекать гнилостные процессы.
Триптофан и синдром эозинофилии-миалгии[править | править код]
В конце 1980-х в США и некоторых других странах отмечалась очень большое число случаев синдрома эозинофилии-миалгии (Eosinophilia-myalgia syndrome). Огласке эта проблема подверглась в 1989, после того как личные врачи трёх американок, обсудив между собой ситуацию, подняли тревогу. Впоследствии масштаб той вспышки оценили как приблизительно равный 60 000 случаев, из которых около 1500 случаев привели к инвалидизации и не менее 27 закончились смертельным исходом.
Было установлено, что практически все заболевшие принимали L-триптофан японского производителя Showa Denko. Этот триптофан производился при помощи нового специально разработанного штамма генетически изменённых микроорганизмов. При расследовании были взяты образцы препарата из нескольких партий триптофана. В этих образцах выявили более 60 различных примесей. Эти примеси, среди которых особенно подозрительными оказались EBT (1,1′-ethylidene-bis-L-tryptophan) и MTCA (1-methyl-1,2,3,4-tetrahydro-beta-carboline-3-carboxylic acid), тщательно исследовались, но ни у одной из них не выявили способность вызывать такие серьёзные нарушения здоровья, как синдром эозинофилии-миалгии.
Рассматривалась также возможность того, что синдром эозинофилии-миалгии может вызываться самим L-триптофаном при его избыточном поступлении в организм. Эксперты пытались оценить вероятность того, что метаболиты триптофана могут тормозить деградацию гистамина, а избыточный гистамин может способствовать воспалительным процессам и развитию синдрома эозинофилии-миалгии. Несмотря на все предпринятые усилия, так и не удалось достоверно установить, что именно вызывало эозинофилию-миалгию у людей, принимавших триптофан.
Усиление контроля оборота триптофана, в том числе запрет на ввоз импортного триптофана, привело к резкому снижению случаев синдрома эозинофилии-миалгии. В 1991 году в США большая часть триптофана была не пущена в продажу, другие страны также последовали этому примеру. В феврале 2001 FDA ослабил ограничения, но все же выразил беспокойство:
- «Based on the scientific evidence that is available at the present time, we cannot determine with certainty that the occurrence of EMS in susceptible persons consuming L-tryptophan supplements derives from the content of L-tryptophan, an impurity contained in the L-tryptophan, or a combination of the two in association with other, as yet unknown, external factors.»[14]
Перевод:
- «Опираясь на научные данные, которыми мы в настоящее время располагаем, мы не можем с уверенностью ответить на вопрос, что вызывает эозинофилию-миалгию у восприимчивых людей, употребляющих L-триптофан. Мы не можем сказать, способен ли вызвать эозинофилию-миалгию сам L-триптофан, или же примесь, содержавшаяся в L-триптофане, или комбинации L-триптофана, примесей с другими, пока ещё неизвестными факторами».
Индоламин-2,3-диоксигеназа (изозим триптофан-2,3-диоксигеназы) активируется во время иммунной реакции, чтобы ограничить доступность триптофана для клеток, инфицированных вирусом, или раковых клеток.
Триптофан и продолжительность жизни[править | править код]
Опыты на крысах показали, что диета с пониженным содержанием триптофана увеличивает максимальную продолжительность жизни, но также увеличивает смертность в молодом возрасте[15].
Сонливость, которая наблюдается после употребления мяса индейки (актуально в США, где индейку традиционно употребляют на День благодарения и Рождество), связывают с действием мелатонина, образующегося из триптофана. Существует заблуждение, что индейка содержит очень большое количество триптофана. Индюшатина действительно содержит много триптофана, но его содержание приблизительно такое же, как и во многих других мясных продуктах. Хотя механизмы возникновения сонливости действительно связаны с обменом триптофана, её причиной является общая высокая калорийность и высокое содержание углеводов в пище, которая вызывает сонливость, а не повышенное содержание в ней триптофана.
Триптофан обладает наиболее сильной флуоресценцией среди всех 20 протеиногенных аминокислот. Триптофан поглощает электромагнитное излучение с длиной волны 280 нм (максимум) и сольватохромно излучает в диапазоне 300—350 нм. Молекулярное окружение триптофана оказывает влияние на его флуоресценцию. Этот эффект имеет значение для изучения белков. Взаимодействие индольного ядра с азотистыми основаниями нуклеиновых кислот приводит к уменьшению интенсивности флуоресценции, что позволяет установить роль этой аминокислоты в протеин-нуклеиновых взаимодействиях.
Синтетический 7-азатриптофан из-за структурного сходства с триптофаном может быть ошибочно использован белоксинтезирующей системой вместо триптофана.
Гипотеза о том, что при депрессивных расстройствах уменьшается содержание в мозге серотонина, привела к терапевтическому использованию L-триптофана при депрессии[4]. Он применяется как в качестве монотерапии, так и в сочетании с традиционными антидепрессантами[4].
Имеются данные контролируемых испытаний, согласно которым добавление L-триптофана может усиливать терапевтический эффект антидепрессантов группы ИМАО. Назначение L-триптофана рекомендуется для дополнительного потенцирования серотонинергических эффектов комбинаций «литий + ИМАО» и «литий + кломипрамин»(«серотониновый коктейль»)[16].
Также L-триптофан используется при обсессивно-компульсивном расстройстве. Дополнительное введение L-триптофана в дозе 6—8 г в сутки особенно оправданно при снижении синтеза или истощении запасов серотонина, например вследствие длительного применения серотонинергических антидепрессантов. При этом у части больных терапевтический эффект L-триптофана при длительном лечении склонен истощаться[17].
Кроме того, препараты L-триптофана назначаются при расстройствах сна[18], чувстве страха и напряжения, дисфории, предменструальном синдроме[источник не указан 1615 дней]. Показаниями к применению также являются комплексная терапия больных с алкогольной, опиатной и барбитуратной зависимостью с целью нивелирования проявлений абстинентного синдрома, лечение острой интоксикации этанолом, лечение биполярного аффективного расстройства и депрессии, связанной с менопаузой[источник не указан 1615 дней]. Применение при беременности и в период лактации (грудного вскармливания) не рекомендуется. Биодоступность при пероральном приёме составляет более 90 %.
Побочными действиями L-триптофана являются гипотензия, тошнота, поносы и рвота[18], анорексия. Кроме того, он вызывает сонливость днём, а если принимать его вечером — может улучшать ночной сон[4]. Сочетанное применение серотонинергических антидепрессантов и L-триптофана может вызывать серотониновый синдром[17].
Триптофан также применяется для сбалансирования кормов для животных.
- ↑ Weast R. C. CRC Handbook of Chemistry and Physics (1st student edition) / R. C. Weast — 1 — CRC Press, 1988. — ISBN 978-0-8493-0740-9
- ↑ Леенсон И. А. Язык химии. Этимология химических названий. — М.: АСТ, Corpus, 2016. — 464 с. — ISBN 978-5-17-095739-2.
- ↑ Бокуть С. Б., Герасимович Н. В., Милютин А. А. Молекулярная биология: молекулярные механизмы хранения, воспроизведения и реализации генетической информации / под ред. Мельник Л. С., Касьяновой Л. Д.. — Минск: Вышэйшая школа, 2005. — 463 с. — 3000 экз. — ISBN 985-06-1045-X.
- ↑ 1 2 3 4 Гельдер М., Гэт Д., Мейо Р. Оксфордское руководство по психиатрии: Пер. с англ. — Киев: Сфера, 1999. — Т. 2. — 436 с. — 1000 экз. — ISBN 966-7267-76-8.
- ↑ Kostowski W., Bidzinski A., Hauptmann M., Malinowski J. E., Jerlicz M., Dymecki J. Brain serotonin and epileptic seizures in mice: a pharmacological and biochemical study (англ.) // Pol J Pharmacol Pharm : journal. — 1978. — Vol. 30, no. 1. — P. 41—7. — PMID 148040. (англ.)
- ↑ Turner E. H., Loftis J. M., Blackwell A. D. Serotonin a la carte: supplementation with the serotonin precursor 5-hydroxytryptophan (англ.) // Pharmacol Ther : journal. — 2006. — Vol. 109, no. 3. — P. 325—338. — DOI:10.1016/j.pharmthera.2005.06.004. — PMID 16023217. (англ.)
- ↑ Hardebo J. E., Owman C. Barrier mechanisms for neurotransmitter monoamines and their precursors at the blood-brain interface (англ.) // Ann NeurolAnn Neurol : journal. — 1980. — Vol. 8, no. 1. — P. 1—31. — DOI:10.1002/ana.410080102. — PMID 6105837. (англ.)
- ↑ Gustafsson B. I., Tømmerås K., Nordrum I., Loennechen J. P., Brunsvik A., Solligård E., Fossmark R., Bakke I., Syversen U., Waldum H. Long-term serotonin administration induces heart valve disease in rats (англ.) // Circulation (англ.)русск. : journal. — Lippincott Williams & Wilkins (англ.)русск., 2005. — March (vol. 111, no. 12). — P. 1517—1522. — DOI:10.1161/01.CIR.0000159356.42064.48. — PMID 15781732. (англ.)
- ↑ Xu J., Jian B., Chu R., Lu Z., Li Q., Dunlop J., Rosenzweig-Lipson S., McGonigle P., Levy R. J., Liang B. Serotonin mechanisms in heart valve disease II: the 5-HT2 receptor and its signaling pathway in aortic valve interstitial cells (англ.) // Am. J. Pathol. (англ.)русск. : journal. — 2002. — December (vol. 161, no. 6). — P. 2209—2218. — DOI:10.1016/S0002-9440(10)64497-5. — PMID 12466135. Архивировано 3 апреля 2010 года. (англ.)
- ↑ Солдатенков А. Т., Колядина Н. М., Шендрик И. В. — «Основы органической химии лекарственных веществ»; Москва, «Химия», 2001 г.
- ↑ Белки — основа полноценного питания (неопр.) (недоступная ссылка). Дата обращения 5 июля 2009. Архивировано 19 июня 2009 года.
- ↑ Химический состав пищевых продуктов. / Под ред. М. Ф. Нестерина и И. М. Скурихина.
- ↑ Под ред. М. Ф. Нестерина и И. М. Скурихина. Химический состав пищевых продуктов..
- ↑ Information Paper on L-Tryptophan and 5-hydroxy-L-tryptophan, FDA, February 2001 (англ.)
- ↑ H. Ooka, P. E. Segall, P. S. Timiras. Histology and survival in age-delayed low-tryptophan-fed rats (англ.) // Mechanisms of Ageing and Development : Научный журнал. — 1988. — Vol. 43, no. 1. — P. 79—98. — ISSN 0047-6374. — DOI:10.1016/0047-6374(88)90099-1. — PMID 3374178.
- ↑ Быков Ю. В. Резистентные к терапии депрессии. — Ставрополь, 2009. — 74 с.
- ↑ 1 2 Мосолов С.Н. Современные тенденции в терапии обсессивно-компульсивного расстройства: от научных исследований к клиническим рекомендациям // Биологические методы терапии психических расстройств (доказательная медицина — клинической практике) / Под ред. С.Н. Мосолова. — Москва : Издательство «Социально-политическая мысль», 2012. — С. 669—702. — 1080 с. — 1000 экз. — ISBN 978-5-91579-075-8.
- ↑ 1 2 Тёлле Р. Психиатрия с элементами психотерапии / Пер. с нем. Г. А. Обухова. — Минск: Вышэйшая школа, 1999. — 496 с. — 4000 экз. — ISBN 985-06-0146-9.
| |||
| |||
| |||
| |||
| Данные по лекарственным препаратам приведены в соответствии с реестром зарегистрированных ЛС и ТКФС от 15.10.2008 (* — препарат изъят из оборота) Поиск по базе данных ЛС (неопр.). ФГУ НЦ ЭСМП Росздравнадзора РФ (28 октября 2008). Дата обращения 12 ноября 2008. | |||
Триптофан [LifeBio.wiki]
Молекула L-триптофана
Фармакологическая группа: Аминокислоты
Триптофан (ИЮПАК-МСБХМБ аббревиатура: Trp или W; ИЮПАК аббревиатура: L-Trp или D-Trp; продается для медицинского использования под названием Tryptan) – одна из 22 стандартных аминокислот, незаменимая в рационе человека. В стандартном генетическом коде кодируется кодоном UGG. В структурных или ферментных белках используется только L-стереоизомер триптофана. D-стереоизомер иногда может встречаться в естественно производимых пептидах (например, морском ядовитом пептиде контрифане). Структурно триптофан интересен тем, что он содержит индольную функциональную группу. [[аминокислоты|Аминокислота]] является незаменимой, о чем говорит ее воздействие на рост у крыс.
Изоляция триптофана
В 1901 году Фредерик Хопкинс впервые осуществил выделение триптофана с использованием гидролиза казеина. Из 600 г неочищенного казеина можно выделить 4-8 грамм триптофана.
Биосинтез и промышленное производство
Растения и микроорганизмы обычно синтезируют триптофан из шикимовой или антраниловой кислоты. Последняя конденсируется с фосфорибоцилпирофосфатом (PRPP), генерируя пирофосфат как побочный продукт. После раскрытия кольца фрагмента рибозы и последующего восстановительного декарбоксилирования, производится индол-3-глицеринфосфан, который, в свою очередь, превращается в индол. На последней стадии триптофан-синтаза катализирует образование триптофана из индола и аминокислоты серина. В промышленности триптофан также производится биосинтетическим путем, основанным на ферментации серина и индола с использованием натуральных или генетически модифицированных бактерий, таких как B. amyloliquefaciens, B. subtilis, C. glutamicum или E. coli. Эти штаммы либо производят мутации, предотвращающие обратный захват ароматических аминокислот, либо сверхэкспрессию триптофановых оперонов. Преобразование катализируется ферментом триптофансинтазы.
Функция
Для многих организмов (включая человека), триптофан является незаменимой, то есть жизненно важной, аминокислотой, которая не может быть синтезирована в организме и, следовательно, должна составлять обязательную часть рациона. Аминокислоты, в том числе триптофан, выступают в качестве строительных блоков в биосинтезе белка. Кроме того, триптофан действует как биохимический предшественник для следующих соединений:
Серотонин (нейротрансмиттер), синтезируется через гидроксилазу триптофана. Серотонин, в свою очередь, может быть преобразован в мелатонин (нейрогормон) через N-ацетилтрансферазу и 5-гидроксииндол-O-метилтрансферазу. Никотиновая кислота синтезируется из триптофана, при этом кинуренин и хинолиновая кислота выступают в качестве ключевых промежуточных соединений биосинтеза. Ауксин (фитогормон), при преобразовании ситовидных элементов апоптоза триптофана в ауксины.
Нарушения всасывания фруктозы и непереносимость лактозы являются причиной неправильного поглощения триптофана в кишечнике, снижения уровня триптофана в крови и депрессии. У бактерий, синтезирующих триптофан, высокие клеточные уровни этой аминокислоты активируют белок-репрессор, который связывается с триптофановым опероном. Связывание этого репрессора с опероном предотвращает транскрипцию ДНК, которая кодирует ферменты, участвующие в биосинтезе триптофана. Таким образом, высокие уровни триптофана предотвращают синтез триптофана через цепь отрицательной обратной связи, и при сокращении уровней триптофана в клетках возобновляется транскрипция из триптофанового оперона. Генетическая организация триптофанового оперона позволяет, таким образом, жестко регулировать и быстро реагировать на изменения во внутренних и внешних клеточных уровнях триптофана.
Триптофан в продуктах питания
Триптофан является обычным составляющим большинства белковых пищевых продуктов или пищевых белков. Он содержится в особенно больших количествах в шоколаде, овсе, сушеных финиках, молоке, йогурте, твороге, сыре, красном мясе, яйцах, рыбе, птице, кунжуте, горохе, семенах подсолнечника, семенах тыквы, спирулине, бананах и арахисе. Несмотря на распространенное мнение, что индейка содержит особенно большое количество триптофана, это вещество в равной мере присутствует в организме большинства птиц. Существует также миф, что в растительном белке триптофан присутствует в недостаточном количестве; на самом деле, триптофан имеется в значительных количествах почти во всех формах растительного белка, а в некоторых – даже в очень больших количествах.
Использование в качестве пищевой добавки и лекарственных препаратов
Существуют доказательства того, что уровни триптофана в крови мало зависят от изменения диеты, однако некоторое время назад триптофан был доступен в магазинах здорового питания в качестве пищевой добавки. Клинические исследования показали смешанные результаты в отношении эффективности триптофана в качестве снотворного, особенно у нормальных пациентов. Триптофан показал некоторую эффективность при лечении различных других заболеваний, обычно связанных с низким уровнем серотонина в мозгу. В частности, триптофан в отдельности оказывал некоторое антидепрессивное воздействие, а при применении совместно с другими антидепрессантами действовал как их усилитель. Тем не менее, надежность этих клинических испытаний была поставлена под сомнение из-за отсутствия формального контроля. Кроме того, триптофан сам по себе не может применяться для лечения депрессии или других серотонин-зависимых состояний, однако может быть полезен для понимания химических путей, которые могут дать новый импульс в исследовании фармацевтических препаратов.
Метаболиты
Метаболит триптофана, 5-гидрокситриптофан (5-HTP), был предложен в качестве средства для лечения эпилепсии и депрессии, хотя клинические испытания считаются неубедительными и недостаточными. 5-HTP способен легко проникать через гематоэнцефалический барьер и, кроме того, быстро декарбоксилировать серотонин (5-гидрокситриптамин или 5-НТ). Тем не менее, серотонин имеет относительно короткий период полураспада, поскольку он быстро метаболизируется моноаминоксидазой. В связи с преобразованием 5-HTP в серотонин в печени, воздействие серотонина на сердце может вызывать значительный риск заболеваний сердечного клапана. Первичным продуктом фермента печени триптофан диоксигеназы является кинуренин. Он продается в Европе для лечения депрессии под торговыми марками Cincofarm и Tript-OH. В Соединенных Штатах 5-HTP продается без рецепта, как его продажа осуществляется в рамках Закона о пищевых добавках. Поскольку качество биологически активных добавок теперь регулируется FDA США, производители могут осуществлять продажу продуктов, ингредиенты которых соответствуют маркировке, однако это не гарантирует эффективность таких продуктов.
Триптофан добавки и СЭМ
В 1989 году была зафиксирована крупная вспышка синдрома эозинофилии-миалгии (СЭМ), связанная с применением триптофана, вызвавшая 1500 случаев постоянной инвалидности и, по крайней мере, 37 случаев смерти. Некоторые эпидемиологические исследования показали, что вспышка эпидемии связана с применением L-триптофана, поставляемого японским производителем Showa Denko К. К. Кроме того, предполагалось, что во время производства триптофана было допущено попадание в продукт некоторых примесей, что и вызвало развитие эпидемии. Сам факт того, что для получения L-триптофана компания Showa Denko использовала генетически модифицированные бактерии, породило массу домыслов о том, что генная инженерия ответственна за возникновение подобных неприятностей. Тем не менее, была подвергнута критике методология, используемая в начальных эпидемиологических исследованиях. Альтернативное объяснение вспышки СЭМ 1989 года состоит в том, что большие дозы триптофана могут производить метаболиты, ингибирующие нормальную деградацию гистамина, а избыток гистамина, в свою очередь, может вызывать СЭМ. В 1991 году большая часть триптофана была выведена из продажи в США, и другие страны последовали этому примеру. Однако триптофан по-прежнему продавался для производства детского питания. Во время запрета FDA не знало, или не указывало, что эпидемия СЭМ была вызвана загрязненной партией, и все же, даже когда загрязнение было обнаружено и был запущен процесс очистки, FDA по-прежнему утверждало, что L-триптофан является небезопасным. В феврале 2001 года FDA ослабило ограничения на маркетинг L-триптофана (но не на его импорт), однако все же выразило следующую озабоченность:
"Основываясь на научных данных, доступных в настоящее время, мы не можем с уверенностью определить, что возникновение СЭМ у восприимчивых людей, потребляющих добавки L-триптофана, наблюдается из-за содержания L-триптофана, примесей, содержащихся в L-триптофане, либо из-за пока неизвестных внешних факторов».
С 2002 года L-триптофан продавался в США в своем первоначальном виде. Существует несколько высококачественных источников L-триптофана, которые продаются во многих крупнейших магазинах здорового питания по всей стране. Триптофан продолжает использоваться в клинических и экспериментальных исследованиях. В последние годы в США рецептурные аптеки и некоторые продавцы, работающие по почте и продающие товары в розницу, начали продажи триптофана для широкой публики. Триптофан также остается на рынке как рецептурный препарат (Tryptan), который некоторые психиатры продолжают выписывать, в частности, как средство для увеличения реакции на антидепрессанты.
Мясо индейки и сонливость
Существует мнение, что чрезмерное употребление мяса индейки приводит к сонливости, в связи с высоким уровнем содержащегося в ней триптофана. Тем не менее, количество триптофана в индейке сопоставимо с его содержанием в большинстве других видов мяса. Кроме того, сонливость, возникающая после приема пищи, может быть связана с тем, какую еще пищу, помимо индейки, съел человек и, в частности, какие углеводы. В опытах на животных и человеке было показано, что прием пищи, богатой углеводами, вызывает высвобождение инсулина. Инсулин, в свою очередь, стимулирует поглощение мышцами больших нейтральных аминокислот с разветвленной цепью (branched-chain amino acids, ВСАА), а не триптофан (ароматическую аминокислоту), увеличивая тем самым соотношение триптофана к BCAA в кровотоке. Полученное в результате увеличение такого соотношения триптофана к BCAA в крови снижает конкуренцию у транспортеров больших нейтральных аминокислот (транспортирующих как BCAA, так и ароматические аминокислоты), что приводит к поглощению триптофана через гематоэнцефалический барьер в цереброспинальной жидкости (ЦСЖ). После попадания в ЦСЖ триптофан превращается в серотонин в месте соединения ядер на нормальном ферментативном пути. Полученный в результате серотонин далее метаболизируется шишковидной железой в мелатонин. Таким образом, данные показывают, что «сонливость после приема пищи» может быть результатом приема тяжелой, богатой углеводами, пищи, которая косвенно увеличивает производство мелатонина, который в свою очередь способствует засыпанию.
Доступность:
триптофан.txt · Последние изменения: 2015/09/25 17:53 (внешнее изменение)
Что такое триптофан, в каких продуктах содержится, как принимать
Аминокислоты — важные элементы, составляющие основу любого организма. В этой статье пойдет речь об аминокислоте под названием — триптофан.
Аминокислоты — структурная единица человеческого тела. Из них строятся белки, являющиеся строительной основной тканей и клеток. Заменимые аминокислоты синтезируются самостоятельно, незаменимые можно получить только извне. К одной из таких аминокислот относится триптофан.
Что такое триптофан?
Триптофан содержится в большинстве белков человека. По своим химическим свойствам относится к ароматическим. Один из предшественников серотонина и никотиновой кислоты. Серотонин также важен для нормальной жизнедеятельности человека. Однако если его нельзя получить извне в чистом виде, то триптофан можно принимать в виде безопасных добавок к питанию. При правильном питании он будет попадать в организм, поскольку имеется в любых продуктах.
Полезные свойства
Триптофан — это одна из аминокислот человека. При ее нехватке отмечается нарушение метаболических процессов. На фоне этого развивается как физическое, так и психологическое истощение.
Нарушения психологического фона связаны со следующими свойствами:
- Повышение качества сна за счет ускорения процесса засыпания.
- Релаксирующее действие.
- Снижение головных болей.
- Уменьшение тяги к алкоголю.
- Снижение раздражительности.
- Улучшение внимания.
- Снижение риска депрессий.
Необходимы для правильной работы и другие его качества. Аминокислота снижает у человека чувство голода и нормализует аппетит. В допустимых количествах дает возможность быстрее насытиться, и снижает потребность в углеводах.

Многие специалисты говорят о том, что его можно применять в качестве безопасного снотворного. Применение триптофана для сна значительно повышает его качество и избавляет человека от начальных степеней бессонницы.
Триптофан нужен для обменных процессов. Оказывает стимулирующее действие на гормон роста человека. Влияет на работу сосудов и сердца. Также защищает человека от воздействия алкоголя и никотина.
Присутствие его в ежедневном рационе необходимо, однако не стоит допускать превышения нормы. Это может привести к ряду отрицательных эффектов.
Если же наоборот отмечается недостаток триптофана, могут возникнуть следующие проблемы:
- Нарушение сна.
- Появление избыточного веса на фоне пристрастия к углеводам.
- Частые смены настроения.
- Нарушением внимания.
В детском возрасте может наблюдаться выраженная задержка роста. Что же такое триптофан? Это необходимая для человека аминокислота, при отсутствии которой возникнет ряд отрицательных проявлений.
В каких продуктах содержится триптофан
Эта аминокислота содержится практически во всем, чем питается человек. Отдельно стоит сказать о 6 основных видах продуктов, с которыми она будет поступать в наш организм.
Мясные и рыбные продукты
Одним из самых богатых источников является рыба. Красная и черная икра — неиссякаемый источник этой незаменимой аминокислоты. Любые морепродукты подойдут для повышения его уровня. Речная и озерная рыба содержат намного меньше триптофана.
Из мясных продуктов нужно отметить крольчатину и индейку. В баранине и говядине содержится намного меньше, чем в этих сортах мяса. Таким образом, используя нежирное мясо, можно спокойно повысить уровень содержания триптофана в организме.
Молочные продукты
Среди молочных продуктов, содержащих большое количество аминокислоты, лидирует голландский сыр. После него стоит отметить плавленые сыры, молоко и айран. Если же говорить о твороге, то стоит употреблять только жирный, поскольку, чем выше жирность, тем больше содержится полезной аминокислоты.
Орехи и бобовые
Еще одним незаменимым источником аминокислот являются орехи и бобовые. Триптофан содержится в арахисе и кедровых орехах. В фисташках и миндале также его достаточно. Белая и красная фасоль являются хорошим источником аминокислот. Все остальные бобовые, горох, тоже содержат их, однако в меньшем количестве.
Овощи и фрукты
Фрукты и овощи — источники витаминов, микроэлементов, а также аминокислот. Нужная нам аминокислота не исключение. Практически любой фрукт или овощ содержит определенное количество триптофана. Не сказать, что его в них очень много, однако, если не использовать БАДы, то присутствие овощей и фруктов в рационе обязательно. Картофель, свекла, лук, капуста, бананы, лимоны. Везде содержится триптофан.
Крупы и каши
Достаточное количество содержится в крупах. В частности можно отметить гречку, перловку, овсянку. Вот еще одна причина, почему так полезно на завтрак кушать каши. Из круп больше всего триптофана содержится в пшене. Меньше всего в перловой крупе.
Соки
Свежевыжатые соки — отличный вариант для повышения настроения и улучшения общего состояния организма, ведь в них содержится достаточное количество аминокислот, а также витаминов. Больше всего триптофана содержится в томатном соке. Также рекомендуется употреблять ягодные напитки.

Таблица содержания триптофана в продуктах/мг. на 100 г.
| Продукт | Триптофан | Продукт | Триптофан |
|---|---|---|---|
| Красная икра | 950 | Шоколад | 190 |
| Арахис | 740 | Курага | 140 |
| Кальмары | 320 | Рис | 70 |
| Курица | 290 | Свекла | 55 |
| Лосось | 220 | Лук | 41 |
| Баранина | 200 | Лимон | 26 |
Помимо того, что для повышения содержания аминокислоты нужно потреблять продукты богатые триптофаном, также важно поддерживать правильный баланс микроэлементов. Необходимые для усвоения вещества это железо, магний, витамины группы В. При нехватке данных элементов, может наблюдаться ухудшение всасывания, что отрицательно скажется на общем состоянии организма.
Препараты
После того как специалисты поняли всю ценность, которую в себе несет триптофан, его сразу попытались синтезировать. Сейчас в продаже большое количество биологически активных добавок, которые содержат аминокислоту.
Можно встретить следующие варианты:
- Триптофан Эвалар.
- L-Триптофан.
- Формула спокойствия.

Нужно отметить, что перед приемом любой из таких добавок стоит проконсультироваться со специалистом. Бесконтрольный прием может сильно навредить, несмотря на то, что в них содержится такое полезное вещество. Для взрослых людей рекомендуется принимать по 2 капсулы 2 раза в день. Длительность курса составляет 30 дней. Но нужно помнить, что организм каждого человека индивидуален и дозировка может отличаться.
Важно подбирать качественный препарат. В конце в 80-х годов в США было отмечено частое возникновение побочных эффектов от приемов препаратов с этой аминокислотой. После проведенного расследования выяснилось, что дело в некачественном продукте, где содержались вредные примеси. Сейчас осуществляется серьезный контроль за производством таких добавок, поэтому, если покупать БАДы триптофана у проверенного производителя, риск получить подделку сведен практически к нулю.
Суточная потребность организма
Триптофан является необходимой аминокислотой, за сутки организм должен получать не больше 1 грамма. Для этого достаточно, за один день съесть 400 грамм продуктов, которые содержат эту аминокислоту.
При правильном питании организм всегда будет получать достаточное количество незаменимых аминокислот. В некоторых случаях, врачи рекомендуют применять так называемую, «триптофановую диету».
Триптофан в диетологии
Согласно отзывам диетологов, триптофан будет не лишним для тех, кто собирается сесть на диету. Это связано с его действием на организм. На фоне снижения тяги к пище и углеводам — поддерживает диетотерапию.
Положительно влияет на настроение, помогает снять усталость и вернуть хороший сон. Все эти эффекты объясняются действием на витамин В3. Принцип же триптофановой диеты основан на его действии на гормон серотонин. Добавив в рацион продукты, содержащие достаточно аминокислоты можно в два раза увеличить количество образующегося серотонина.
Очень часто можно встретить содержащее триптофан спортивное питание. Это связано с его особенностями, позволяющими занимающимся спортом, быстрее терять жиры и набирать мышечную массу. Поэтому ничего удивительного в том, что многие тренеры предлагают своим спортсменам принимать комплексы, содержащие аминокислоты.
Триптофан противопоказания и побочные действия
Триптофан нельзя применять в том случае, если отмечается непереносимость. Также нельзя принимать кормящим матерям и беременным. Перед приемом лучше проконсультироваться с врачом. Обязательна консультация специалиста, если есть следующие заболевания:
Опухолевые заболевания с поражением мочевого пузыря.
- Катаракта.
- Синдром мальабсорбции.
- Сахарный диабет.
При нарушении правил приема, в организме может наблюдаться избыток триптофана. В этом случае могут возникнуть следующие проявления:
Выраженная боль в суставах и мышцах.
- Спонтанная лихорадка.
- Появление отеков.
- Одышка.
- Слабость.
Прием большого количества триптофана вместе с антидепрессантами, может вызвать состояние, которое называется серотониновый синдром. Для него характерны бредовые состояния, судороги, резкое повышение температуры тела. При высокой степени тяжести возможно развитие коматозного состояния.
Запрещено использовать аминокислоту при наследственных нарушениях обмена, а именно:
- Синдром Прайса. При заболевании отмечается повышенное выделение продуктов распада. С мочой начинает выделяться кинуренин. Заболевание проявляется склеродермией.
- Болезнь Хартнапа. Нарушение транспорта аминокислот, на фоне чего, при накоплении избытка триптофана образуются патологические вещества.
- Синдром Тада. При этой патологии происходит нарушение обмена аминокислоты, что приводит к нарушению работы ЦНС, а также развитию карликовости.
- Гипертриптофанемия. Избыточное накопление аминокислоты, приводящее к тому, что она попросту не может перейти в продукты распада, выводясь с мочой в исходном виде.
Обменные нарушения такого типа — абсолютные противопоказания к употреблению триптофана.
При длительном употреблении избыточного количества аминокислоты может повыситься риск новообразований. Однако, несмотря на все положительные свойства триптофана, необходимо проконсультироваться с врачом перед началом приема.Не стоит злоупотреблять и превышать дозу. Только при соблюдении правил приема можно добиться заметного эффекта.
Триптофан — это… Что такое Триптофан?
Триптофа́н — (β-индолиламинопропионовая, или α-2-амино-3-(1H-индол-3-ил)пропионовая кислота, сокр.: Три, Трп, Trp, W) — ароматическая альфа-аминокислота. Существует в двух оптически изомерных формах — L и D и в виде рацемата (DL).
L-триптофан является протеиногенной аминокислотой и входит в состав белков всех известных живых организмов. Относится к ряду гидрофобных аминокислот, поскольку содержит ароматическое ядро индола. Участвует в гидрофобных и стэкинг-взаимодействиях.
Биосинтез
Триптофан в природе синтезируется через антранилат. В процессе биосинтеза антранилата промежуточными соединениями являются шикимат, хоризмат. Биосинтез антранилата рассмотрен в статье шикиматный путь. Четыре обратимые реакции составляют кратчайший путь преобразования антранилата в триптофан. Гены, ответственные за эти реакции, а также за необратимую реакцию образования антранилата из хоризмата имеют название trp-гены и у бактерий объединены в триптофановый оперон.
Схематично строение триптофанового оперона Escherichia coli можно выразить записью:
—trpR—…—Промотор—Оператор—Лидер—Аттенуатор—trpE—trpD—trpC—trpB—trpA—Терминатор—Терминатор—
Стадии биосинтетического процесса хоризмат →→ триптофан:
- Из хоризмата синтезируется антранилат. Донором аминогруппы выступает амидный азот глутамина либо аммоний. В результате реакции образуется также пируват. У Escherichia coli реакцию осуществляет компонент I антранилат-синтазы, продукт гена trpE.
- Антранилат фосфорибозилируется фосфорибозилпирофосфатом с образованием фосфорибозилантранилата. В рекции высвобождается неорганический пирофосфат. У Escherichia coli реакцию осуществляет компонент II антранилат-синтазы, продукт гена trpD.
- Фосфорибозилантранилат изомеризуется в фосфорибулозилантранилат. У Escherichia coli реакция определяется фосфорибозилантранилат-изомеразной активностью индол-глицерол-фосфат-синтазы, являющейся продуктом гена trpC.
- Циклизация фосфорибулозилантранилата, сопровождаемая декарбоксилированием-дегидратацией приводит к индол-глицерол-фосфату. У Escherichia coli реакция определяется индол-глицерол-фосфат-синтазной активностью индол-глицерол-фосфат-синтазы, являющейся продуктом гена trpC.
- Заместитель отщепляется в виде глицеральдегид-3-фосфата, роисходит замена этого заместителя на другой трёхуглеродный заместитель, происходящий из молекулы L-серина. Реакция протекает через промежуточное образование незамещённого индола. Реакция пиридоксаль-зависима. У Escherichia coli реакцию осуществляет триптофан-синтаза субъединичного состава α2β2 (субъединица α — продукт гена trpA, субъединица β — продукт гена trpB).[1]
В природе триптофан синтезируют микроорганизмы, растения и грибы. Многоклеточные животные не способны синтезировать триптофан de novo. Для человека, как и для всех Metazoa, триптофан является незаменимой аминокислотой и должен поступать в организм в достаточном количестве с белками пищи.
Катаболизм
Катаболические превращения L-триптофана в организме человека:
Триптофан→N-формилкинуренин→кинуренин→3-гидроксикинуренин→3-гидроксиантранилат
N-формилкинуренин→N-формилантранилат→антранилат→3-гидроксиантранилат
Кинуренин→антранилат→3-гидроксиантранилат
3-Гидроксиантранилат→2-амино-3-карбоксимуконат-семиальдегид→2-аминомуканат-семиальдегид→2-аминомуконат→2-кетоадипат→глутарил-КоА→кротонил-КоА→(S)-3-гидроксибутаноил-КоА→ацетоацетил-КоА→ацетил-КоА
Метаболиты
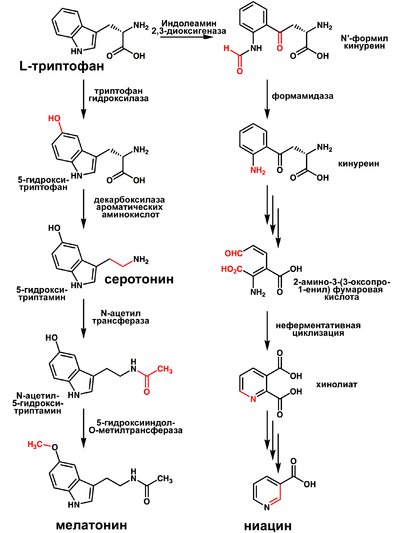
Триптофан является биологическим прекурсором серотонина (из которого затем может синтезироваться мелатонин) и ниацина (см. рисунок).
Часто гиповитаминоз по витамину B3 сопряжён с недостатком триптофана.
Также триптофан является биохимическим предшественником индольных алкалоидов. Например, триптофан→триптамин→N,N-диметилтриптамин→псилоцин→псилоцибин
Метаболит триптофана — 5-гидрокситриптофан (5-HTP) был предложен в качестве средства для лечения эпилепсии[2] и депрессии, но клинические испытания не дали окончательных результатов[3]. 5-HTP легко проникает через гематоэнцефалический барьер и, кроме того, быстро декарбоксилируется в серотонин (5-гидрокситриптамин или 5-HT)[4].
В связи с преобразованием 5-HTP в серотонин в печени, есть значительный риск появления пороков сердца от влияния серотонина на сердце[5][6].
Способы получения и производство триптофана
Химический синтез
Индол аминометилируют формальдегидом и диметиламином по методу Манниха. Полученный 3-диметиламинометил-индол конденсируют с метиловым эфиром нитроуксусной кислоты, что приводит к метилату 3-индолилнитропропионовой кислоты. Затем восстанавливают нитрогруппу до аминогруппы. После щелочного гидролиза эфира получают D/L-триптофан обычно в форме натриевой соли.[7] В триптофане, полученном химическим синтезом, обнаруживаются примеси токсичных соединений. Синтетический триптофан добавляют в комбикорма для животных.
Химико-ферментативный синтез
У микроорганизмов, в том числе и у Escherichia coli, известен пиридоксальзависимый фермент триптофан-индол-лиаза (триптофаназа КФ 4.1.99.1, продукт гена tnaA). Функция этого фермента заключается в поддержании равновесия:
триптофан + вода ⇋ индол + пируват + аммоний.
Благодаря этому триптофан может быть получен ферментативной конденсацией индола, пировиноградной кислоты и аммиака.
Микробиологический синтез
В промышленном производстве L-триптофана обычно используются штаммы дрожжей Candida utilis, дефектные по aro-генам и, как следствие, ауксотрофные по фенилаланину и тирозину. Исходным сырьём обычно служит относительно дешёвая синтетическая антраниловая кислота, что является целесообразным по нескольким причинам. Во-первых, это упрощает и удешевляет процесс, а во-вторых, позволяет обойти механизмы регуляторного контроля (целевой продукт триптофан оказывает ингибирующее действие на антранилатсинтазу). В присутствии минимальных, не вызывающих регуляторных эффектов, количеств фенилаланина и тирозина мутанты Candida utilis переводит вводимую в культуральную среду антраниловую кислоту в L-триптофан.
Исходным сырьём в микробиологическом производстве триптофана может служить также синтетический индол. Процесс зависит от активности триптофан-синтазы и доступности серина.
Пищевые источники триптофана
Триптофан является компонентом пищевых белков. Наиболее богаты триптофаном такие продукты, как грибы, овёс, бананы, сушёные финики, арахис, кунжут, кедровый орех, молоко, йогурт, творог.
Триптофан присутствует в большинстве растительных белков, особенно им богаты соевые бобы. Очень малое количество триптофана содержится в кукурузе, поэтому питание только кукурузой приводит к нехватке этой аминокислоты и, как следствие, к пеллагре. Одним из лучших источников триптофана является арахис, причем как цельные орехи, так и арахисовое масло.
Мясо и рыба содержат триптофан неравномерно: белки соединительной ткани (коллаген, эластин, желатин) не содержат триптофан[8].
Таблица содержания триптофана в продуктах
- Основной источник: [9]
| № п/п | продукт | в мг на 100 г |
|---|---|---|
| 1 | Горох, фасоль | 260 |
| 2 | Мука пшеничная (1-й сорт) | 120 |
| 3 | Крупа гречневая | 180 |
| 4 | Рис | 80 |
| 5 | Пшено | 180 |
| 6 | Крупа овсяная | 160 |
| 7 | Крупа перловая | 100 |
| 8 | Хлеб ржаной | 70 |
| 9 | Хлеб пшеничный | 100 |
| 10 | Макаронные изделия | 130 |
| 11 | Молоко, кефир | 40 |
| 12 | Творог нежирный | 180 |
| 13 | Творог жирный | 210 |
| 14 | Сыр голландский | 790 |
| 15 | Сыр плавленый | 500 |
| 16 | Говядина I категории | 210 |
| 17 | Говядина II категории | 230 |
| 18 | Баранина, свинина мясная | 200 |
| 19 | Мясо кролика | 330 |
| 20 | Колбаса молочная | 160 |
| 21 | Куры I категории | 290 |
| 22 | Яйца куриные | 200 |
| 23 | Карп | 180 |
| 24 | Окунь морской | 170 |
| 25 | Палтус, судак | 180 |
| 26 | Сельдь | 250 |
| 27 | Скумбрия | 160 |
| 28 | Ставрида | 300 |
| 29 | Треска | 210 |
| 30 | Паста «Океан» | 220 |
| 31 | Капуста белокочанная | 10 |
| 32 | Картофель | 30 |
| 33 | Морковь | 10 |
| 34 | Свекла | 10 |
Нарушения обмена
Семейная гипертриптофанемия
Семейная гипертриптофанемия — редкое аутосомно-рецессивное наследственное заболевание, нарушение обмена веществ, которое приводит к накоплению триптофана в крови и выведению его с мочой (триптофанурия).
Болезнь Хартнапа
Причиной заболевания является нарушение активного транспорта триптофана через кишечную стенку, вследствие чего усиливаются процессы его бактериального разложения и образования индольных продуктов, таких как индол, скатол.
Синдром Тада
Наследственное заболевание, связанное с нарушением превращения триптофана в кинуренин. При заболевании наблюдается повреждение ЦНС и нанизм. Заболевание впервые описано К. Тада в 1963 году.
Синдром Прайса
Генетическое заболевание, причиной которого является нарушение превращения кинуренина в 3-гидрокси-L-кинуренин (за реакцию ответственна NADP-зависимая L-кинуренин-3-гидроксилаза КФ 1.14.13.9). Заболевание проявляется повышенной экскрецией кинуренина с мочой, а также склеродермией.
Индиканурия
Индиканурия — повышенное содержание в моче индикана. Причиной может являться непроходимость кишечника, из-за чего в нём начинают усиленно протекать гнилостные процессы.
Триптофан и синдром эозинофилии-миалгии
В конце 1980-х в США и некоторых других странах отмечалась очень большое число случаев синдрома эозинофилии-миалгии. Огласке эта проблема подверглась в 1989, после того, как личные врачи трёх американок, обсудив между собой ситуацию, забили тревогу. В настоящее время масштаб той вспышки оценивают в 60000 случаев, из которых около 1500 случаев закончились инвалидизацией, не менее 27 закончились смертельным исходом. Было установлено, что заболевших связывало то, что практически все они принимали L-триптофан японского производителя Showa Denko. Этот триптофан производился при помощи нового специально разработанного штамма генетически изменённых микроорганизмов. При расследовании были взяты образцы препарата из нескольких партий триптофана. В этих образцах было выявлено более 60 различных примесей. Эти примеси, среди которых особенно подозрительными были EBT (1,1′-ethylidene-bis-L-tryptophan) и MTCA (1-methyl-1,2,3,4-tetrahydro-beta-carboline-3-carboxylic acid), тщательно исследовались, но ни для одной из них не была установлена способность вызывать такие серьёзные нарушения здоровья, как синдром эозинофилии-миалгии. Рассматривалась также возможность того, что синдром эозинофилии-миалгии может вызываться самим L-триптофаном при его избыточном поступлении в организм. Эксперты рассматривали возможность того, что метаболиты триптофана могут тормозить деградацию гистамина, а избыточный гистамин может способствовать воспалительным процессам и развитию синдрома эозинофилии-миалгии. Несмотря на все предпринятые усилия, так и не удалось достоверно установить, что именно вызывало эозинофилию-миалгию у людей, принимавших триптофан. Усиление контроля оборота триптофана, в том числе запрет на ввоз импортного триптофана, привели к резкому снижению случаев синдрома эозинофилии-миалгии. В 1991 году в США большая часть триптофана была не пущена в продажу, другие страны также последовали примеру. В феврале 2001 FDA ослабил ограничения, но все ещё выразил следующее беспокойство:
- «Based on the scientific evidence that is available at the present time, we cannot determine with certainty that the occurrence of EMS in susceptible persons consuming L-tryptophan supplements derives from the content of L-tryptophan, an impurity contained in the L-tryptophan, or a combination of the two in association with other, as yet unknown, external factors.»
Перевод:
- «Опираясь на научные данные, которыми мы в настоящее время располагаем, мы не можем с уверенностью ответить на вопрос, что вызывает эозинофилию-миалгию у восприимчивых людей, употребляющих L-триптофан. Мы не можем сказать, способен ли вызвать эозинофилию-миалгию сам L-триптофан, или же примесь, содержавшаяся в L-триптофане, или комбинации L-триптофана, примесей с другими, пока ещё неизвестными, факторами.»
Триптофан и иммунная система
Индоламин-2,3-диоксигеназа (изозим триптофан-2,3-диоксигеназы) активируется во время иммунной реакции, чтобы ограничить доступность триптофана для инфицированных вирусом или раковых клеток.
Триптофан и продолжительность жизни
Опыты на крысах показали, что диета с пониженным содержанием триптофана увеличивает максимальную продолжительность жизни, но также увеличивает смертность в молодом возрасте.
Триптофан и сонливость
Сонливость, которая наблюдается после употребления мяса индейки (актуально в США, где индейку традиционно употребляют на День благодарения и Рождество), связывают с действием мелатонина, образующегося из триптофана. Существует заблуждение, что индейка содержит очень большое количество триптофана. Индюшатина действительно содержит много триптофана, но его содержание приблизительно такое же, как и во многих других мясных продуктах. Хотя механизмы возникновения сонливости действительно связаны с обменом триптофана, её причиной является общая высокая калорийность и высокое содержание углеводов в пище, которая вызывает сонливость, а не повышенное содержание в ней триптофана.
Флуоресценция
Триптофан обладает наиболее сильной флуоресценцией среди всех 20-ти протеиногенных аминокислот. Триптофан поглощает электромагнитное излучение с длиной волны 280 нм (максимум) и сольватохромно излучает в диапазоне 300—350 нм. Молекулярное окружение триптофана оказывает влияние на его флуоресценцию. Этот эффект имеет значение для изучения белков. Взаимодействие индольного ядра с азотистыми основаниями нуклеиновых кислот приводит к уменьшению интенсивности флуоресценции, что позволяет установить роль этой аминокислоты в протеин-нуклеиновых взаимодействиях.
Аналоги триптофана
Синтетический 7-азатриптофан из-за структурного сходства с триптофаном может быть ошибочно использован белоксинтезирующей системой вместо триптофана.
Применение
Триптофан применяется для сбалансирования кормов для животных. Препараты L-триптофана назначаются при расстройстве сна, чувстве страха и напряжения, дисфории, предменструальном синдроме. Показаниями к применению также являются: комплексная терапия больных с алкогольной, опиатной и барбитуратной зависимостью с целью нивелирования проявлений абстинентного синдрома, лечение острой интоксикации этанолом, лечения маниакальной депрессии и депрессии, связанной с менопаузой. Применение при беременности и в период лактации (грудного вскармливания) не рекомендуется. Биодоступность при пероральном приёме составляет более 90 %.
Примечания
- ↑ Бокуть С. Б. и соавт. — «Молекулярная биология: молекулярные механизмы хранения, воспроизведения и реализации генетической информации»; Минск, «Вышэйшая школа», 2005 г. — ISBN 985-06-1045-X
- ↑ Kostowski W, Bidzinski A, Hauptmann M, Malinowski JE, Jerlicz M, Dymecki J (1978). «Brain serotonin and epileptic seizures in mice: a pharmacological and biochemical study». Pol J Pharmacol Pharm 30 (1): 41–7. PMID 148040. (англ.)
- ↑ Turner EH, Loftis JM, Blackwell AD (2006). «Serotonin a la carte: supplementation with the serotonin precursor 5-hydroxytryptophan». Pharmacol Ther 109 (3): 325–38. DOI:10.1016/j.pharmthera.2005.06.004. PMID 16023217. (англ.)
- ↑ Hardebo JE, Owman C (1980). «Barrier mechanisms for neurotransmitter monoamines and their precursors at the blood-brain interface». Ann NeurolAnn Neurol 8 (1): 1–31. DOI:10.1002/ana.410080102. PMID 6105837. (англ.)
- ↑ Gustafsson BI, Tømmerås K, Nordrum I, Loennechen JP, Brunsvik A, Solligård E, Fossmark R, Bakke I, Syversen U, Waldum H (March 2005). «Long-term serotonin administration induces heart valve disease in rats». Circulation 111 (12): 1517–22. DOI:10.1161/01.CIR.0000159356.42064.48. PMID 15781732. (англ.)
- ↑ Xu J, Jian B, Chu R, Lu Z, Li Q, Dunlop J, Rosenzweig-Lipson S, McGonigle P, Levy RJ, Liang B (December 2002). «Serotonin mechanisms in heart valve disease II: the 5-HT2 receptor and its signaling pathway in aortic valve interstitial cells». Am. J. Pathol. 161 (6): 2209–18. DOI:10.1016/S0002-9440(10)64497-5. PMID 12466135. (англ.)
- ↑ Солдатенков А. Т., Колядина Н. М., Шендрик И. В. — «Основы органической химии лекарственных веществ»; Москва, «Химия», 2001 г.
- ↑ Белки — основа полноценного питания
- ↑ Химический состав пищевых продуктов. / Под ред. М. Ф. Нестерина и И. М. Скурихина.
Триптофан — это… Что такое Триптофан?
Триптофа́н — (β-индолиламинопропионовая, или α-2-амино-3-(1H-индол-3-ил)пропионовая кислота, сокр.: Три, Трп, Trp, W) — ароматическая альфа-аминокислота. Существует в двух оптически изомерных формах — L и D и в виде рацемата (DL).
L-триптофан является протеиногенной аминокислотой и входит в состав белков всех известных живых организмов. Относится к ряду гидрофобных аминокислот, поскольку содержит ароматическое ядро индола. Участвует в гидрофобных и стэкинг-взаимодействиях.
Биосинтез
Триптофан в природе синтезируется через антранилат. В процессе биосинтеза антранилата промежуточными соединениями являются шикимат, хоризмат. Биосинтез антранилата рассмотрен в статье шикиматный путь. Четыре обратимые реакции составляют кратчайший путь преобразования антранилата в триптофан. Гены, ответственные за эти реакции, а также за необратимую реакцию образования антранилата из хоризмата имеют название trp-гены и у бактерий объединены в триптофановый оперон.
Схематично строение триптофанового оперона Escherichia coli можно выразить записью:
—trpR—…—Промотор—Оператор—Лидер—Аттенуатор—trpE—trpD—trpC—trpB—trpA—Терминатор—Терминатор—
Стадии биосинтетического процесса хоризмат →→ триптофан:
- Из хоризмата синтезируется антранилат. Донором аминогруппы выступает амидный азот глутамина либо аммоний. В результате реакции образуется также пируват. У Escherichia coli реакцию осуществляет компонент I антранилат-синтазы, продукт гена trpE.
- Антранилат фосфорибозилируется фосфорибозилпирофосфатом с образованием фосфорибозилантранилата. В рекции высвобождается неорганический пирофосфат. У Escherichia coli реакцию осуществляет компонент II антранилат-синтазы, продукт гена trpD.
- Фосфорибозилантранилат изомеризуется в фосфорибулозилантранилат. У Escherichia coli реакция определяется фосфорибозилантранилат-изомеразной активностью индол-глицерол-фосфат-синтазы, являющейся продуктом гена trpC.
- Циклизация фосфорибулозилантранилата, сопровождаемая декарбоксилированием-дегидратацией приводит к индол-глицерол-фосфату. У Escherichia coli реакция определяется индол-глицерол-фосфат-синтазной активностью индол-глицерол-фосфат-синтазы, являющейся продуктом гена trpC.
- Заместитель отщепляется в виде глицеральдегид-3-фосфата, роисходит замена этого заместителя на другой трёхуглеродный заместитель, происходящий из молекулы L-серина. Реакция протекает через промежуточное образование незамещённого индола. Реакция пиридоксаль-зависима. У Escherichia coli реакцию осуществляет триптофан-синтаза субъединичного состава α2β2 (субъединица α — продукт гена trpA, субъединица β — продукт гена trpB).[1]
В природе триптофан синтезируют микроорганизмы, растения и грибы. Многоклеточные животные не способны синтезировать триптофан de novo. Для человека, как и для всех Metazoa, триптофан является незаменимой аминокислотой и должен поступать в организм в достаточном количестве с белками пищи.
Катаболизм
Катаболические превращения L-триптофана в организме человека:
Триптофан→N-формилкинуренин→кинуренин→3-гидроксикинуренин→3-гидроксиантранилат
N-формилкинуренин→N-формилантранилат→антранилат→3-гидроксиантранилат
Кинуренин→антранилат→3-гидроксиантранилат
3-Гидроксиантранилат→2-амино-3-карбоксимуконат-семиальдегид→2-аминомуканат-семиальдегид→2-аминомуконат→2-кетоадипат→глутарил-КоА→кротонил-КоА→(S)-3-гидроксибутаноил-КоА→ацетоацетил-КоА→ацетил-КоА
Метаболиты
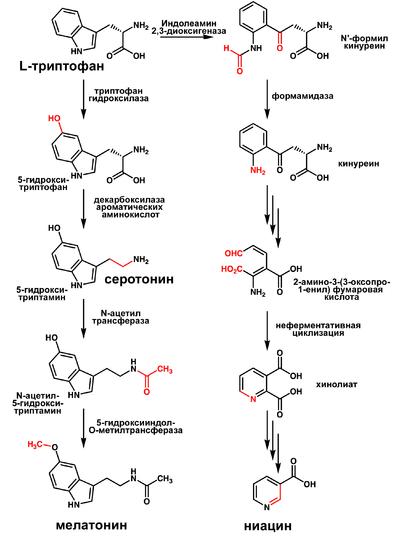
Триптофан является биологическим прекурсором серотонина (из которого затем может синтезироваться мелатонин) и ниацина (см. рисунок).
Часто гиповитаминоз по витамину B3 сопряжён с недостатком триптофана.
Также триптофан является биохимическим предшественником индольных алкалоидов. Например, триптофан→триптамин→N,N-диметилтриптамин→псилоцин→псилоцибин
Метаболит триптофана — 5-гидрокситриптофан (5-HTP) был предложен в качестве средства для лечения эпилепсии[2] и депрессии, но клинические испытания не дали окончательных результатов[3]. 5-HTP легко проникает через гематоэнцефалический барьер и, кроме того, быстро декарбоксилируется в серотонин (5-гидрокситриптамин или 5-HT)[4].
В связи с преобразованием 5-HTP в серотонин в печени, есть значительный риск появления пороков сердца от влияния серотонина на сердце[5][6].
Способы получения и производство триптофана
Химический синтез
Индол аминометилируют формальдегидом и диметиламином по методу Манниха. Полученный 3-диметиламинометил-индол конденсируют с метиловым эфиром нитроуксусной кислоты, что приводит к метилату 3-индолилнитропропионовой кислоты. Затем восстанавливают нитрогруппу до аминогруппы. После щелочного гидролиза эфира получают D/L-триптофан обычно в форме натриевой соли.[7] В триптофане, полученном химическим синтезом, обнаруживаются примеси токсичных соединений. Синтетический триптофан добавляют в комбикорма для животных.
Химико-ферментативный синтез
У микроорганизмов, в том числе и у Escherichia coli, известен пиридоксальзависимый фермент триптофан-индол-лиаза (триптофаназа КФ 4.1.99.1, продукт гена tnaA). Функция этого фермента заключается в поддержании равновесия:
триптофан + вода ⇋ индол + пируват + аммоний.
Благодаря этому триптофан может быть получен ферментативной конденсацией индола, пировиноградной кислоты и аммиака.
Микробиологический синтез
В промышленном производстве L-триптофана обычно используются штаммы дрожжей Candida utilis, дефектные по aro-генам и, как следствие, ауксотрофные по фенилаланину и тирозину. Исходным сырьём обычно служит относительно дешёвая синтетическая антраниловая кислота, что является целесообразным по нескольким причинам. Во-первых, это упрощает и удешевляет процесс, а во-вторых, позволяет обойти механизмы регуляторного контроля (целевой продукт триптофан оказывает ингибирующее действие на антранилатсинтазу). В присутствии минимальных, не вызывающих регуляторных эффектов, количеств фенилаланина и тирозина мутанты Candida utilis переводит вводимую в культуральную среду антраниловую кислоту в L-триптофан.
Исходным сырьём в микробиологическом производстве триптофана может служить также синтетический индол. Процесс зависит от активности триптофан-синтазы и доступности серина.
Пищевые источники триптофана
Триптофан является компонентом пищевых белков. Наиболее богаты триптофаном такие продукты, как грибы, овёс, бананы, сушёные финики, арахис, кунжут, кедровый орех, молоко, йогурт, творог.
Триптофан присутствует в большинстве растительных белков, особенно им богаты соевые бобы. Очень малое количество триптофана содержится в кукурузе, поэтому питание только кукурузой приводит к нехватке этой аминокислоты и, как следствие, к пеллагре. Одним из лучших источников триптофана является арахис, причем как цельные орехи, так и арахисовое масло.
Мясо и рыба содержат триптофан неравномерно: белки соединительной ткани (коллаген, эластин, желатин) не содержат триптофан[8].
Таблица содержания триптофана в продуктах
- Основной источник: [9]
| № п/п | продукт | в мг на 100 г |
|---|---|---|
| 1 | Горох, фасоль | 260 |
| 2 | Мука пшеничная (1-й сорт) | 120 |
| 3 | Крупа гречневая | 180 |
| 4 | Рис | 80 |
| 5 | Пшено | 180 |
| 6 | Крупа овсяная | 160 |
| 7 | Крупа перловая | 100 |
| 8 | Хлеб ржаной | 70 |
| 9 | Хлеб пшеничный | 100 |
| 10 | Макаронные изделия | 130 |
| 11 | Молоко, кефир | 40 |
| 12 | Творог нежирный | 180 |
| 13 | Творог жирный | 210 |
| 14 | Сыр голландский | 790 |
| 15 | Сыр плавленый | 500 |
| 16 | Говядина I категории | 210 |
| 17 | Говядина II категории | 230 |
| 18 | Баранина, свинина мясная | 200 |
| 19 | Мясо кролика | 330 |
| 20 | Колбаса молочная | 160 |
| 21 | Куры I категории | 290 |
| 22 | Яйца куриные | 200 |
| 23 | Карп | 180 |
| 24 | Окунь морской | 170 |
| 25 | Палтус, судак | 180 |
| 26 | Сельдь | 250 |
| 27 | Скумбрия | 160 |
| 28 | Ставрида | 300 |
| 29 | Треска | 210 |
| 30 | Паста «Океан» | 220 |
| 31 | Капуста белокочанная | 10 |
| 32 | Картофель | 30 |
| 33 | Морковь | 10 |
| 34 | Свекла | 10 |
Нарушения обмена
Семейная гипертриптофанемия
Семейная гипертриптофанемия — редкое аутосомно-рецессивное наследственное заболевание, нарушение обмена веществ, которое приводит к накоплению триптофана в крови и выведению его с мочой (триптофанурия).
Болезнь Хартнапа
Причиной заболевания является нарушение активного транспорта триптофана через кишечную стенку, вследствие чего усиливаются процессы его бактериального разложения и образования индольных продуктов, таких как индол, скатол.
Синдром Тада
Наследственное заболевание, связанное с нарушением превращения триптофана в кинуренин. При заболевании наблюдается повреждение ЦНС и нанизм. Заболевание впервые описано К. Тада в 1963 году.
Синдром Прайса
Генетическое заболевание, причиной которого является нарушение превращения кинуренина в 3-гидрокси-L-кинуренин (за реакцию ответственна NADP-зависимая L-кинуренин-3-гидроксилаза КФ 1.14.13.9). Заболевание проявляется повышенной экскрецией кинуренина с мочой, а также склеродермией.
Индиканурия
Индиканурия — повышенное содержание в моче индикана. Причиной может являться непроходимость кишечника, из-за чего в нём начинают усиленно протекать гнилостные процессы.
Триптофан и синдром эозинофилии-миалгии
В конце 1980-х в США и некоторых других странах отмечалась очень большое число случаев синдрома эозинофилии-миалгии. Огласке эта проблема подверглась в 1989, после того, как личные врачи трёх американок, обсудив между собой ситуацию, забили тревогу. В настоящее время масштаб той вспышки оценивают в 60000 случаев, из которых около 1500 случаев закончились инвалидизацией, не менее 27 закончились смертельным исходом. Было установлено, что заболевших связывало то, что практически все они принимали L-триптофан японского производителя Showa Denko. Этот триптофан производился при помощи нового специально разработанного штамма генетически изменённых микроорганизмов. При расследовании были взяты образцы препарата из нескольких партий триптофана. В этих образцах было выявлено более 60 различных примесей. Эти примеси, среди которых особенно подозрительными были EBT (1,1′-ethylidene-bis-L-tryptophan) и MTCA (1-methyl-1,2,3,4-tetrahydro-beta-carboline-3-carboxylic acid), тщательно исследовались, но ни для одной из них не была установлена способность вызывать такие серьёзные нарушения здоровья, как синдром эозинофилии-миалгии. Рассматривалась также возможность того, что синдром эозинофилии-миалгии может вызываться самим L-триптофаном при его избыточном поступлении в организм. Эксперты рассматривали возможность того, что метаболиты триптофана могут тормозить деградацию гистамина, а избыточный гистамин может способствовать воспалительным процессам и развитию синдрома эозинофилии-миалгии. Несмотря на все предпринятые усилия, так и не удалось достоверно установить, что именно вызывало эозинофилию-миалгию у людей, принимавших триптофан. Усиление контроля оборота триптофана, в том числе запрет на ввоз импортного триптофана, привели к резкому снижению случаев синдрома эозинофилии-миалгии. В 1991 году в США большая часть триптофана была не пущена в продажу, другие страны также последовали примеру. В феврале 2001 FDA ослабил ограничения, но все ещё выразил следующее беспокойство:
- «Based on the scientific evidence that is available at the present time, we cannot determine with certainty that the occurrence of EMS in susceptible persons consuming L-tryptophan supplements derives from the content of L-tryptophan, an impurity contained in the L-tryptophan, or a combination of the two in association with other, as yet unknown, external factors.»
Перевод:
- «Опираясь на научные данные, которыми мы в настоящее время располагаем, мы не можем с уверенностью ответить на вопрос, что вызывает эозинофилию-миалгию у восприимчивых людей, употребляющих L-триптофан. Мы не можем сказать, способен ли вызвать эозинофилию-миалгию сам L-триптофан, или же примесь, содержавшаяся в L-триптофане, или комбинации L-триптофана, примесей с другими, пока ещё неизвестными, факторами.»
Триптофан и иммунная система
Индоламин-2,3-диоксигеназа (изозим триптофан-2,3-диоксигеназы) активируется во время иммунной реакции, чтобы ограничить доступность триптофана для инфицированных вирусом или раковых клеток.
Триптофан и продолжительность жизни
Опыты на крысах показали, что диета с пониженным содержанием триптофана увеличивает максимальную продолжительность жизни, но также увеличивает смертность в молодом возрасте.
Триптофан и сонливость
Сонливость, которая наблюдается после употребления мяса индейки (актуально в США, где индейку традиционно употребляют на День благодарения и Рождество), связывают с действием мелатонина, образующегося из триптофана. Существует заблуждение, что индейка содержит очень большое количество триптофана. Индюшатина действительно содержит много триптофана, но его содержание приблизительно такое же, как и во многих других мясных продуктах. Хотя механизмы возникновения сонливости действительно связаны с обменом триптофана, её причиной является общая высокая калорийность и высокое содержание углеводов в пище, которая вызывает сонливость, а не повышенное содержание в ней триптофана.
Флуоресценция
Триптофан обладает наиболее сильной флуоресценцией среди всех 20-ти протеиногенных аминокислот. Триптофан поглощает электромагнитное излучение с длиной волны 280 нм (максимум) и сольватохромно излучает в диапазоне 300—350 нм. Молекулярное окружение триптофана оказывает влияние на его флуоресценцию. Этот эффект имеет значение для изучения белков. Взаимодействие индольного ядра с азотистыми основаниями нуклеиновых кислот приводит к уменьшению интенсивности флуоресценции, что позволяет установить роль этой аминокислоты в протеин-нуклеиновых взаимодействиях.
Аналоги триптофана
Синтетический 7-азатриптофан из-за структурного сходства с триптофаном может быть ошибочно использован белоксинтезирующей системой вместо триптофана.
Применение
Триптофан применяется для сбалансирования кормов для животных. Препараты L-триптофана назначаются при расстройстве сна, чувстве страха и напряжения, дисфории, предменструальном синдроме. Показаниями к применению также являются: комплексная терапия больных с алкогольной, опиатной и барбитуратной зависимостью с целью нивелирования проявлений абстинентного синдрома, лечение острой интоксикации этанолом, лечения маниакальной депрессии и депрессии, связанной с менопаузой. Применение при беременности и в период лактации (грудного вскармливания) не рекомендуется. Биодоступность при пероральном приёме составляет более 90 %.
Примечания
- ↑ Бокуть С. Б. и соавт. — «Молекулярная биология: молекулярные механизмы хранения, воспроизведения и реализации генетической информации»; Минск, «Вышэйшая школа», 2005 г. — ISBN 985-06-1045-X
- ↑ Kostowski W, Bidzinski A, Hauptmann M, Malinowski JE, Jerlicz M, Dymecki J (1978). «Brain serotonin and epileptic seizures in mice: a pharmacological and biochemical study». Pol J Pharmacol Pharm 30 (1): 41–7. PMID 148040. (англ.)
- ↑ Turner EH, Loftis JM, Blackwell AD (2006). «Serotonin a la carte: supplementation with the serotonin precursor 5-hydroxytryptophan». Pharmacol Ther 109 (3): 325–38. DOI:10.1016/j.pharmthera.2005.06.004. PMID 16023217. (англ.)
- ↑ Hardebo JE, Owman C (1980). «Barrier mechanisms for neurotransmitter monoamines and their precursors at the blood-brain interface». Ann NeurolAnn Neurol 8 (1): 1–31. DOI:10.1002/ana.410080102. PMID 6105837. (англ.)
- ↑ Gustafsson BI, Tømmerås K, Nordrum I, Loennechen JP, Brunsvik A, Solligård E, Fossmark R, Bakke I, Syversen U, Waldum H (March 2005). «Long-term serotonin administration induces heart valve disease in rats». Circulation 111 (12): 1517–22. DOI:10.1161/01.CIR.0000159356.42064.48. PMID 15781732. (англ.)
- ↑ Xu J, Jian B, Chu R, Lu Z, Li Q, Dunlop J, Rosenzweig-Lipson S, McGonigle P, Levy RJ, Liang B (December 2002). «Serotonin mechanisms in heart valve disease II: the 5-HT2 receptor and its signaling pathway in aortic valve interstitial cells». Am. J. Pathol. 161 (6): 2209–18. DOI:10.1016/S0002-9440(10)64497-5. PMID 12466135. (англ.)
- ↑ Солдатенков А. Т., Колядина Н. М., Шендрик И. В. — «Основы органической химии лекарственных веществ»; Москва, «Химия», 2001 г.
- ↑ Белки — основа полноценного питания
- ↑ Химический состав пищевых продуктов. / Под ред. М. Ф. Нестерина и И. М. Скурихина.
ТРИПТОФАН: инструкция, отзывы, аналоги, цена в аптеках
Фармакологические свойства
Триптофан — препарат для лечения заболеваний нервной системы.
Триптофан — одна из 8 незаменимых аминокислот. Помимо участия в белковом синтезе, триптофан является источником образования в головном мозге серотонина, мелатонина, кинуренина, хинолиновой кислоты, играющих важную роль в регуляции поведения, настроения, когнитивных функций и сна. Кроме того, прием триптофана повышает в мозгу содержание дофамина, норадреналина, бета-эндорфина и через обмен серотонина модулирует эндокринные функции.
Фармакокинетика
Триптофан хорошо адсорбируется из желудочно-кишечного тракта. В крови триптофан находится преимущественно (85-95%) в связанной форме. Свободный триптофан плазмы конкурирует с нейтральными аминокислотами за транспортер, переносящий аминокислоты в мозг. Поэтому дополнительный прием триптофана к диете даже в относительно низких дозах нелинейно увеличивает его свободную фракцию в плазме, что сдвигает соотношение между триптофаном и конкурентными нейтральными аминокислотами в пользу триптофана и создает условия для его повышенного транспорта в мозг, приводящего к увеличению уровня серотонина, мелатонина и других нейроактивных метаболитов.
Показания к применению
Показаниями к применению препарата Триптофан являются: коррекция расстройств сна, связанных с нарушением засыпания; алкогольная и наркотическая зависимость (в составе комплексной терапии с целью нивелирования проявлений абстинентного синдрома).
Способ применения
Триптофан принимать при хронической бессоннице — по 1-3 г перед сном, запивая водой.
Алкогольная и наркотическая зависимость (в составе комплексной терапии с целью нивелирования проявлений абстинентного синдрома) – 3-4 раза в течение дня в суточной дозе от 1 до 4 г вместе с приемами пищи богатой углеводами, которая повышает эффективность триптофана.
Может применяться в сочетании с другими лекарственными средствами (антидепрессантами, литием), режим приема определяет лечащий врач. Суточные дозы свыше 8 г не рекомендуются в связи с повышением риска побочных явлений.Побочные действия
Согласно данным клинических исследований большинство людей переносят Триптофан без побочных эффектов. Препарат не оказывает седативного последействия на следующие сутки после вечернего приема с целью улучшения сна. Побочные эффекты в дозах до 6 г/день встречаются редко: сухость рта, сонливость, снижение аппетита. В комбинации с антидепрессантами (особенно ингибиторами МАО) могут индуцировать симптомы серотонинового синдрома (тремор, миоклонусы, гиперактивность), которые исчезают вскоре после отмены триптофана.
Противопоказания
Гиперчувствительность к Триптофану и другим компонентам препарата.
Беременность
Триптофан не рекомендуется применять во время беременности и в период грудного вскармливания, так как достаточного опыта применения препарата в эти периоды нет.
Взаимодействие с другими лекарственными средствами
Триптофан может усиливать седативное действие нейролептиков, антидепрессантов, анксиолитиков, алкоголя. При сочетании с ингибиторами МАО, трициклическими и гетероциклическими антидепрессантами, а также селективными ингибиторами обратного захвата серотонина возрастает риск развития серотонинового синдрома (тремор, гипертонус, миоклонусы, гиперактивность, галлюцинации и др.). Эти симптомы исчезают без последствий после отмены триптофана.
Передозировка
Симптомами передозировки Триптофана являются головная боль, головокружение, рвота, диарея, метеоризм; редко — признаки серотонинового синдрома (при комбинации с антидепрессантами).
При появлении симптомов передозировки дозу препарата следует откорректировать или препарат отменить.
Лечение передозировки симптоматическое, включая при необходимости применение средств поддержания жизненно важных функций.
Синдрома эозинофилии/миалгии при массовом применении триптофана на протяжении последних более чем 20 лет не описано.
Условия хранения
В защищенном от влаги и света месте при температуре не выше 25°С. Хранить в недоступном для детей месте.
Форма выпуска
Триптофан— капсулы 200 мг.
Упаковка по 10 капсул в контурную ячейковую упаковку.
По две, три или пять контурных ячейковых упаковок вместе с инструкцией по применению вкладывают в пачку из картона коробочного.
Состав
1 капсула Триптофан содержит действующее вещество: L-триптофан — 200 мг.
Вспомогательные вещества: метилцеллюлоза, кальция стеарат.
Состав капсулы: желатин, глицерин, вода очищенная, титана диоксид, натрия лаурилсульфат.
Дополнительно
Триптофан должен применяться с предосторожностями под наблюдением врача при раке мочевого пузыря, сахарном диабете, ахлоргидрии/малабсорбции, катаракте.
Влияние на способность к управлению автотранспортом и другими потенциально опасными механизмами. Лица, у которых триптофан вызывает сонливость, на фоне приема триптофана должны воздерживаться от управления транспортными средствами и работы с опасными механизмами.
Основные параметры
польза и вред триптофана: признаки дефицита и передозировки
Продолжение. Начало здесь: http://zaryad-zhizni.ru/dlya-chego-nuzhen-triptofan/
и здесь: http://zaryad-zhizni.ru/chem-polezen-triptophan/
Триптофан – гетероциклическая незаменимая аминокислота. Она поступает в организм человека только с пищей и выполняет множество важных функций.
- Участвует в образовании серотонина – гормоноподобного вещества, которое регулирует тонус гладкой мускулатуры, в т.ч. кишечника и сосудов, а также регулирует настроение
- Участвует в образовании мелатонина – гормона сна
- Участвует в образовании никотиновой кислоты (витамина РР) – предшественника НАД и НАДФ, энергодающих молекул.
- Повышает сопротивляемость к стрессам
- Является антидепрессантом
- Используется в лечении мигреней
- Способствует релаксации и хорошему сну
- Повышает иммунитет
- Улучшает пищеварение
- Снижает тягу к сладкому, контролирует аппетит
- Стимулирует подъем уровня гормона роста в крови
- Улучшает состояние кожи, способствует росту волос.
Нехватка триптофана даже на непродолжительное время приводит к снижению белков плазмы крови и тканей. При нехватке триптофана у молодых возникает уменьшение массы тела, помутнение роговицы, катаракта, замедление роста зубов и волос, выпадение волос, облысение, анемия. Даже 10-дневный дефицит триптофана у новорожденного ведет к анорексии и гипопротеинемии (снижению белков плазмы крови).
У взрослых кроме анемии и облысения, происходит атрофия семенников, рассасывание плода.
Нехватка триптофана
Признаками нехватки триптофана являются следующие состояния:
- Раздражительность, агрессивность
- Плохой сон
- Быстрая утомляемость
- Частые головные боли
- Проблемы с сердечно-сосудистой системой, в т.ч. спазмы коронарных артерий
- Предменструальный синдром
- Гипогалактия у кормящих женщин
- Дерматиты
- Проблемы с пищеварением, в т.ч. диарея (понос)
Потребность в триптофане возрастает при следующих состояниях:
- Депрессии
- Сезонных функциональных расстройствах
- Расстройствах приема пищи (булимия, анорексия)
- Мигрени и головных болях разных типов
- Неврозе навязчивых состояний, шизофрении
- Хронических заболеваниях сердца и сосудов
- Расстройствах сна
- Повышенной чувствительности к боли
- Курении, употреблении алкоголя
- Синдроме хронической усталости
- Остром и хроническом стрессе любого происхождения (эмоциональный, социальный, физический).
- Травмах, ожогах, операциях, кровопотерях
- Инфекционных болезнях
- Беременности, грудном вскармливании
- У грудных детей
- Интенсивных занятиях спортом
- Интенсивных мозговых нагрузках
Триптофан нужен всегда. Триптофан нужен всем.
Обычное питание не дает необходимого количества триптофана, ибо во многих продуктах эта аминокислота не содержится, а те продукты, в которых она содержится в большом количестве – относятся к деликатесам и редко бывают на столе. Неудивительно, что люди страдают от депрессии, хронической усталости, падает качество жизни, а всего-то надо изменить свой рацион питания.
В настоящее время фармакологическая промышленность выпускает препараты триптофана, но к ним следует подходить с осторожностью, ибо избыток триптофана вместо пользы способен принести вред.
Избыток триптофана
При нарушениях иммунной системы дополнительный прием триптофана может спровоцировать развитие онкологических заболеваний, а также усугубить болезнь при ее наличии, ибо раковые клетки находятся в процессе бесконтрольного размножения, что требует избытка белка и аминокислот.
Избыток триптофана приводит к накоплению продукта его обмена 3 – оксиантраниловой кислоты, которая может вызывать опухоль мочевых путей.
Избыток триптофана блокирует включение в белки аминокислот с разветвленной цепью – лейцина и изолейцина. Это необходимо учитывать спортсменам – культуристам и тем, чья цель – увеличение мышечной массы.
Триптофан усиливает седативное действие большинства успокаивающих препаратов и антидепрессантов. Это может быть опасно при нарушениях со стороны сердечно-сосудистой системы.
Противопоказано применять триптофан в виде лекарственного средства при беременности и в период лактации (грудного вскармливания).
Триптофан и сахарный диабет
Еще в 80-е годы сотрудниками Латвийского НИИ экспериментальной и клинической медицины было выявлено, что метаболиты триптофана могут быть причиной сахарного диабета. (Рудзит В.К. 1973, 1981). Диабетогенное действие триптофана наблюдалось на крысах при скармливании дозы 2,5 г на 1 г. массы тела, что в 700 раз выше нормы суточного потребления. Предполагают, что свободный триптофан в сверхвысоких дозах выступает конкурентом гормонов ЖКТ, содержащих триптофан в активном центре, которые стимулируют выделение инсулина. Свободный триптофан соединяется с рецепторами мембран клеток, секретирующих инсулин, и блокирует их, в результате чего клетки не реагируют на сигналы гормонов.
Механизм диабетогенного действия производных триптофана различен: серотонин тормозит освобождение инсулина из поджелудочной железы, кинуреновая и ксантуреновая кислоты задерживают синтез и способствуют инактивации инсулина путем связывания и выведения с мочой цинка. Хинальдиновая и 8-оксихинальдиновая кислоты препятствуют образования проинсулина рибосомами клеток Ландергальса поджелудочной железы.
Кинуреновая, ксантуреновая, хинальдиновая и 8-оксихинальдиновая кислоты накапливаются в организме при многих заболеваниях и неправильном питании, особенно при излишнем потреблении жира и жирных кислот, а также злоупотреблении лекарственными средствами. Основной причиной накопления в организме этих кислот является недостаточность пиридоксаль-5-фосфата, т.е. активной формы витамина В6.
Введение дополнительного приема витамина В6 способствует коррекции кинуренинового пути метаболизма триптофана и предупреждения риска возникновения сахарного диабета при преддиабетических состояниях и скрытой формы болезни.
Есть данные, что у лабораторных животных диета с пониженным содержанием триптофана увеличивает максимальную продолжительность жизни, но при этом повышает риск смертности в молодом возрасте.
Следует помнить, что поступление триптофана с пищей – это естественный, физиологический путь поддержания здоровья и долголетия, и лишь при заболеваниях имеет смысл обсудить с врачом необходимость приема лекарственных средств на основе триптофана.
Опасность передозировки
Передозировка триптофана возможна при употреблении аминокислоты в виде лекарственных препаратов.
Максимально допустимой безопасной дозой триптофана, не вызывающей побочные эффекты, считают 4,5 г. Однако это усредненный показатель, дозировку препарата следует подбирать индивидуально.
Передозировка может вызвать изжогу, боли в желудке, отрыжку, метеоризм, рвоту, диарею, потерю аппетита, сухость во рту. Среди других возможных побочных действий: головная боль, сонливость, мышечная слабость.
При употреблении триптофана в высоких дозах в сочетании с антидепрессантами возможно развитие «серотонинового» синдрома, сопровождающегося высокой температурой тела, судорогами, бредом, иногда – состоянием комы.
Исследования, проводившиеся в 1989 г. выявили, что применение БАДов с триптофаном вызвало более чем у тысячи человек развитие синдрома «эозинофилии-миалгии», для которого характерно сильные мышечные и суставные боли, высокая температура, слабость, появление отеков рук и ног, нарушение дыхания вплоть до комы. Более трех десятков летальных исходов были связаны с этим синдромом. По мнению экспертов, к столь печальным последствиям привели посторонние вещества, обнаруженные в препарате, однако врачебное сообщество по-прежнему полагает, что прием высоких доз этой аминокислоты крайне небезопасен.
Наличие избыточного количества триптофана определяют в лабораторных исследованиях крови на содержание 3-оксиантраниловой кислоты – один из промежуточных метаболитов триптофана.
О триптофановой диете читайте здесь: http://zaryad-zhizni.ru/triptofan-v-produktah-pitaniya/

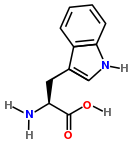
 (
(