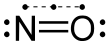Монооксид азота и его функциональная роль в организме — Студопедия
Одним из наиболее ярких открытий последних лет, имеющее фундаментальное значение, позволившее по-новому подойти к пониманию молекулярного механизма ряда физиологических процессов в клетке, является установление важной роли монооксида азота (NO) в регуляции различных физиологических и биохимических процессов. Началом «NO-истории» можно считать отмеченный в 1980 г. факт, согласно которому действие некоторых вазодилататоров не реализуется в отсутствие или в условиях повреждения эндотелия сосудов (так называемые «эндотелий-зависимые вазодилататоры»). Был выделен фактор, осуществляющий отмеченный эффект эндотелия ─ эндотелиальный фактор релаксации сосудов (EDRF), природа которого оставалась неясной до 1987 г, когда было установлено, EDRF представляет собой окись азота (NO). Как вскоре оказалось, NO (EDRF) синтезируется не только в эндотелиальных, но во многих других тканях, органах, в том числе и в нервной системе. В соответствии с приведенной выше классификацией NO является агентом паракринной или аутакоидной регуляции на периферии и медиатором в мозге.
Идентификация монооксида азота увенчалась присуждением Нобелевской премии 1998 г. по физиологии или медицине Фэрчготту, Игнарро и Мураду.
Монооксид азота по своей химической природе относится к двухатомным нейтральным молекулам. Малые размеры и отсутствие заряда обеспечивают этой молекуле высокую проницаемость через мембраны клеток и субклеточных структур. Наличие одного электрона с неспаренным спином придает молекуле NO достаточно высокую реакционную способность. Взаимодействуя с другими свободными радикалами, NO способна образовывать ковалентные связи. Благодаря этой способности NO может как активировать цепные свободнорадикальные реакции, так и ингибировать их. Кроме того, NO может взаимодействовать с белками и низкомолекулярными соединениями, содержащими в активном центре ионы переменных металлов, а также вступает в окислительно-восстановительные превращения, образуя многочисленные азотсодержащие соединения.
NO синтезируется из L-аргинина при участии фермента NO-синтазы (NOS) путем присоединения молекулярного кислорода к концевому атому азота в гуанидиновой группе L-аргинина. Эта простейшая сигнальная молекула продуцируется одним из наиболее сложных ферментов, для проявления активности которого требуется 5 кофакторов: NADPH, FAD, FMN, тетрагидробиоптерин и Са2+/кальмодулин. Кроме того, NOS содержит гем. Выделены три изоформы NO-синтаз: эндотелиальная (eNOS), нейронная (nNOS) и индуцибельная (iNOS, содержится в марофагах). Активность различных изоформ NO-синтаз колеблется в широком пределе: нейрональная NO-синтаза имеет максимальное значение около 300, макрофагальная – до 1000, эндотелиальная — около 15 нмоль/мг/мин. Нейронная NO-синтаза имеет молекулярный вес около 160000, тогда как макрофагальная и эндотелиальная около 130000. Все изоформы NOS обнаруживают высокую степень гомологии с цитохром Р-450 редуктазой. Эта гомология отражает родственную природу систем окислительного биосинтеза NO и микросомального окисления. Удивительно, но этим сходство не ограничивается. Недавно цитохром Р-450 редуктаза была обнаружена в мозге, где она является донором электронов для гем-оксигеназы. В результате гем-оксигеназной реакции кроме продуктов распада гема образуется угарный газ СО, который, как оказалось, тоже играет сигнальную роль в нервной системе.
eNOS обнаружена в эндотелии всех сосудов (включая церебральные), в сердце (эндокарде и миокарде) и в тромбоцитах. Хотя эндотелиальную NO-синтазу относят к конститутивным изоформам, уровень ее генной экспресии может изменяться под влиянием некоторых факторов и при патологических состояниях.
Вторая конститутивная форма NO-синтазы ─ нейронная, экспрессирована в нейронах. Клетки, содержащие nNOS, характеризуются сильноразветвленной системой отростков и составляют около 2% общего количества нейронов. Наиболее высока активность nNOS в обонятельной луковице и мозжечке, несколько ниже ее уровень в среднем мозге, стриатуме, коре, гиппокампе и продолговатом мозге. NO играет важную роль в регуляции мозгового кровообращения.
Большое число NO-ергических нейронов находится в вегетативной нервной системе, где они управляют важнейшими вегетативными функциями. Нервные клетки содержащие NO-синтазу найдены по всей длине пищеварительного тракта в т.н. энтеральной нервной системе, где они расслабляют гладкие мышцы пищевода, желудка, кишечника и практически всех сфинктеров (кардиального, пилорического, анального и др.). Монооксид азота выделяется в окончаниях парасимпатических нервов, иннервирующих половые органы, за счет чего происходит переполнение кровью пещеристых тел и эрекция. Нейронная NOS найдена в скелетной мускулатуре, где NO наряду с другими факторами (рН, аденозин, К
В отличие от эндотелиальной и нейронной NO-синтаз, которые экспрессированы постоянно (конститутивно), индуцибельная изоформа NO-синтазы не представлена в клетках в обычных состояниях. Она играет ведущую патофизиологическую роль в реализации цитотоксических функций активированных макрофагов. Основная функция NO, вырабатываемого макрофагами, ─ цитотоксическое действие на клетки-мишени (опухолевые, а также бактерии, вирусы и др.). Макрофагальная NOS найдена и мозге, где ее экспрессируют особые клетки глии – т.н. микроглия.
Монооксид азота активирует растворимую форму (т.е. не связанную с мембраной) фермента гуанилатциклазы. Это основная мишень действия NO в нервных клетках. Гуанилатциклаза катализирует синтез цГМФ из ГТФ. цГМФ опосредует (через изменение уровня кальция, активности цГМФ-зависимых протеинкиназ, фосфодиэстераз и др.) регуляторные эффекты NO. Кроме этого, монооксид азота является реакционноспособной молекулой и может сам по себе, без участия каких либо ферментов модифицировать различные белки (например, нитрозилировать по SH группам цистеина), в том числе, белки ионных каналов. Нитрозилированные белки натриевых каналов инактивируются и теряют способность участвовать в проведении нервных импульсов. Недавно установлено, что нитрозилированию подвергается аденилатциклаза в нервных клетках, что приводит к потере способности этого фермента активироваться сигнальными молекулами. Нитрозилирование аденилатциклазы и ионных каналов обратимо в восстанавливающих условиях, что свидетельствует о подлинной регуляторной роли этого механизма в управлении активностью ферментов и ионных каналов.
В нейронах гиппокампа NO синтезируется в постсинаптических нейронах в ответ на активацию NMDA-рецепторов глутаматом. Вход кальция в клетку при этом активирует nNOS, которая синтезирует NO из L-аргинина. Образующийся в ответ на этот импульс NO в свою очередь диффундирует из постсинаптического нейрона в пресинаптическое окончание (ретроградно), где оказывает облегчающее влияние на выделение нейромедиатора глутамата. Этот механизм лежит в основе одной из наиболее важных физиологических функций NO в головном мозгу: NO участвует в процессах долговременной синаптической потенциации — феномена, связанного с образованием памяти.
Будучи липофильной молекулой, NO свободно переходит через поверхностные мембраны эндотелиальных и гладкомышечных клеток сосудов, стимулируя образование в них цГМФ, который, при посредстве протеинкиназы G и цАМФ-специфичной цГМФ-зависимой фосфодиэстеразы (ФДЭ II) уменьшает концентрацию ионизированного кальция в цитоплазме. Первый фермент активирует кальциевую помпу в саркоплазматическом ретикулуме, второй снижает уровень цАМФ, что угнетает проводимость кальциевых каналов плазмалеммы. Кроме этого, цГМФ-зависимая протеинкиназа G активирует фосфатазу легких цепей миозина, дефосфорилирующую головки миозина (см. лекцию 10). Дефосфорилированный миозин теряет способность образовывать поперечные мостики с актином. В результате тонус гладкомышечных клеток падает, сосуды расслабляются, сопротивление кровотоку в них понижается. Недавно обнаружен и цГМФ-независимый механизм расслабления гладких мышц, обусловленный прямым влиянием NO (нитрозилированием) на сократительные белки гладкомышечных клеток, что активирует фосфатазы, ответственных за дефосфорилирование легких цепей миозина
Небольшие количества NO, продуцируемые неповрежденным эндотелием под влиянием конститутивной NOS поддерживают артериальные сосуды в состоянии дилатации. Ингибиторы синтеза NO вызывают сужение сосудов и существенное повышение системного артериального давления. Недавно были проведены испытания действия ингибиторов NO-синтазы на здоровых нормотензивных добровольцах. Оказалось, что ингибиторы вызывают весьма значительный подъем артериального давления у людей (приблизительно на 25 мм ртутного столба). Наоборот, назначение больным первичной гипертензией предшественника образования NO в организме — L-аргинина в виде пищевой добавки по 500 мг в сутки в течение 1 месяца повышало на 50-100% образование NO у этих больных, что сопровождалось снижением артериального давления до нормальных величин.
Малые физиологические концентрации NO (<10-6 М) оказывают цито- и нейропротекторное действие. Связано это с тем, что монооксид азота является относительно долгоживущим слабым радикалом, который эффективно перехватывает гораздо более опасные радикалы, такие как супероксидный (O2.-), гидроксильный (.OH), тиильный (напр. .GS) липопероксильный (.LOO) и др. Однако, относительно большие концентрации NO в тканях (>10-6 М), выделяющиеся при интенсивном возбуждении нейронов либо при активации макрофагальной
Превращение NO. из физиологического регулятора в токсический агент происходит в результате взаимодействия NO. c супероксид анионом и образования ONOO—, который, протонируется и распадаясь в процессе диффузии от места его образования на ОН— и NO2, буквально сокрушает на своем пути самые различные биомолекулы и биомембраны.
ONOOН ==> ОН. + NO2 (5),
Азот, подготовка к ЕГЭ по химии
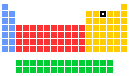
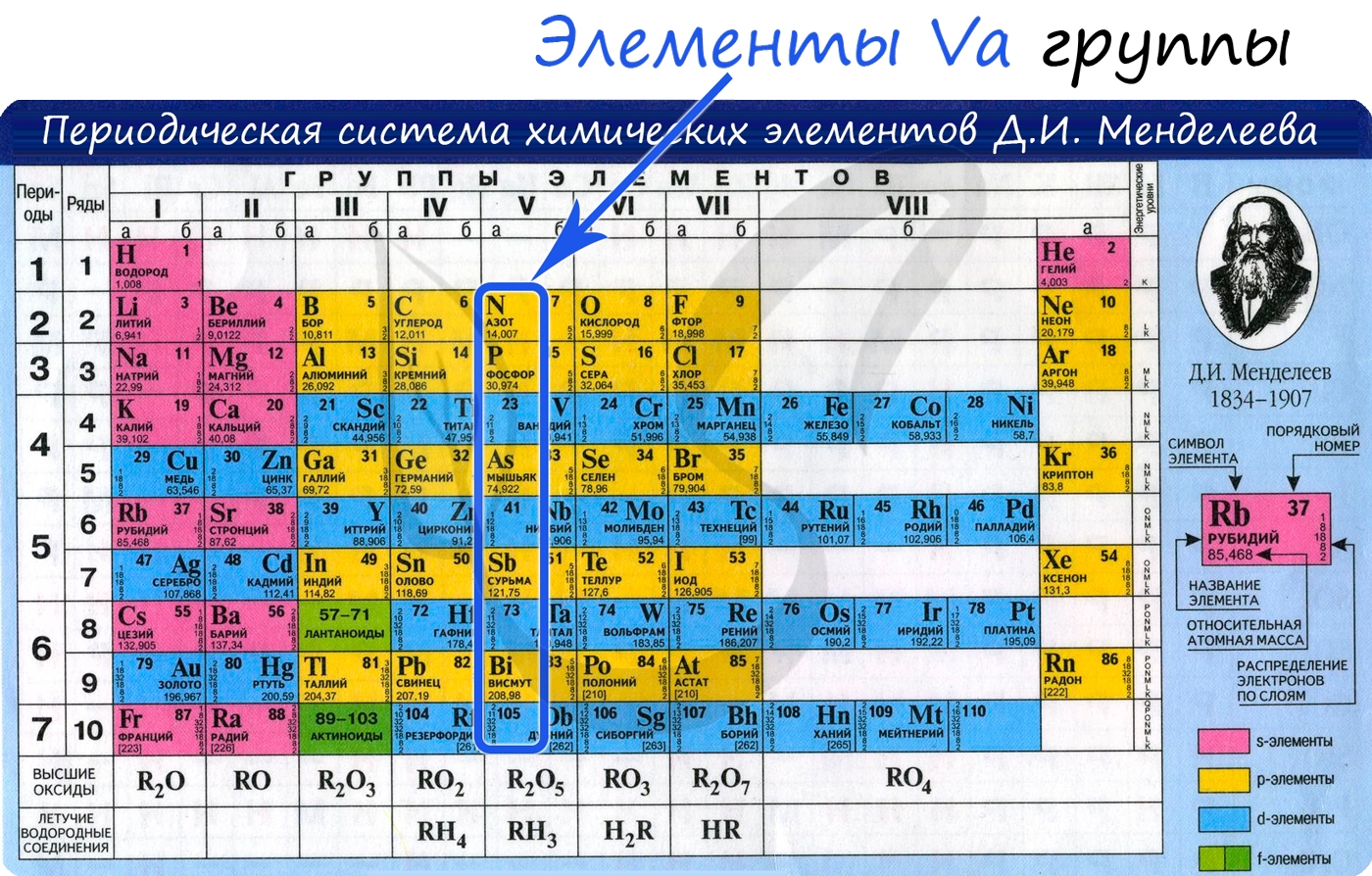
Азот — неметаллический элемент Va группы периодической таблицы Д.И. Менделеева. Составляет 78% воздуха. Входит в состав белков, являющихся важной частью живых организмов.
Температура кипения азота составляет -195,8 °C. Однако быстрого замораживания объектов, которое часто демонстрируют в кинофильмах, не происходит. Даже для заморозки растения нужно продолжительное время, это связано с низкой теплоемкостью азота.
Общая характеристика элементов Va группы
От N к Bi (сверху вниз в периодической таблице) происходит увеличение: атомного радиуса, металлических, основных, восстановительных свойств. Уменьшается электроотрицательность, энергия ионизация, сродство к электрону.
Азот, фосфор и мышьяк являются неметаллами, сурьма — полуметалл, висмут — металл.
Электронные конфигурации у данных элементов схожи, так как они находятся в одной группе (главной подгруппе!), общая формула ns2np3:
- N — 2s22p3
- P — 3s23p3
- As — 4s24p3
- Sb — 5s25p3
- Bi — 6s26p3
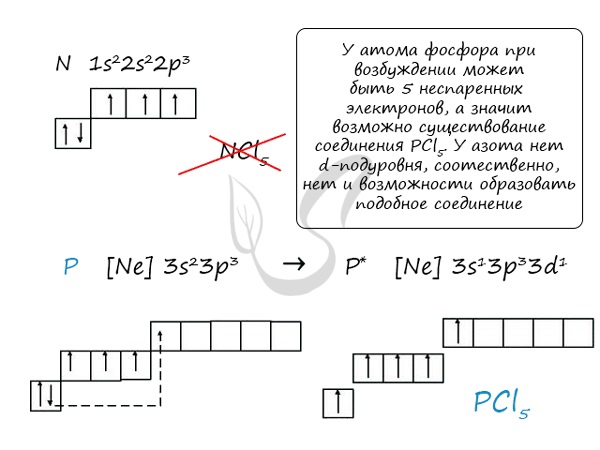
Основное и возбужденное состояние азота
При возбуждении атома азота электроны на s-подуровне распариваются и переходят на p-подуровень. Поскольку азот находится во втором периоде, то 3ий уровень у него отсутствует, что проявляется в особенностях электронной конфигурации возбужденного состояния.
Сравнивая возможности перемещения электронов у азота и фосфора, разница становится очевидна.
Природные соединения
В природе азот встречается в виде следующих соединений:
- Воздух — во вдыхаемом нами воздухе содержится 78% азота
- Азот входит в состав нуклеиновых кислот, белков
- KNO3 — индийская селитра, калиевая селитра
- NaNO3 — чилийская селитра, натриевая селитра
- NH4NO3 — аммиачная селитра (искусственный продукт, в природе не встречается)
Селитры являются распространенными азотными удобрениями, которые обеспечивают быстрый рост и развитие растений, повышают урожайность. Однако, следует строго соблюдать правила их применения, чтобы не превысить допустимые концентрации.

Получение
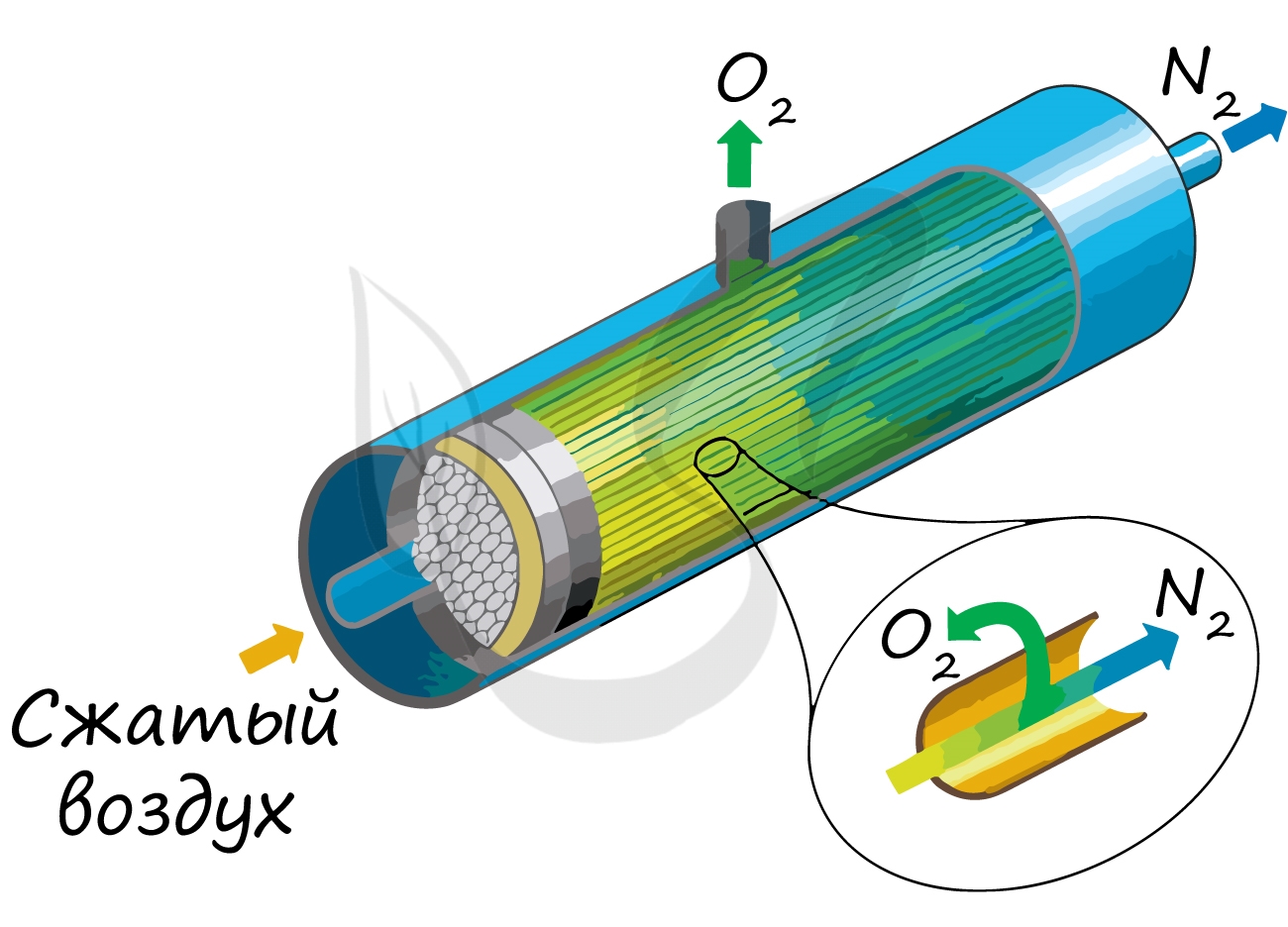
В промышленности азот получают путем сжижения воздуха. В дальнейшем путем испарения их сжиженного воздуха получают азот.
Применяют и метод мембранного разделения, при котором через специальный фильтр из сжатого воздуха удаляют кислород.
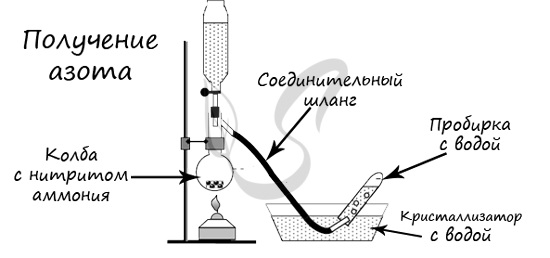
В лаборатории методы не столь экзотичны. Чаще всего получают азот разложением нитрита аммония
NH4NO2 → (t) N2 + H2O
Также азот можно получить путем восстановления азотной кислоты активными металлами.
HNO3(разб.) + Zn → Zn(NO3)2 + N2 + H2O
Химические свойства
Азот восхищает — он принимает все возможные для себя степени окисления от -3 до +5.
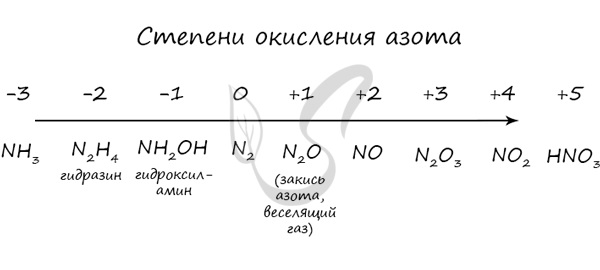
Молекула азота отличается большой прочностью из-за наличия тройной связи. Вследствие этого многие реакции эндотермичны: даже горение азота в кислороде сопровождается поглощением тепла, а не выделением, как обычно бывает при горении.

- Реакция с металлами
- Реакция с неметаллами
Без нагревания азот взаимодействует только с литием. При нагревании реагирует и с другими металлами.
N2 + Li → Li3N (нитрид лития)
N2 + Mg → (t) Mg3N2
N2 + Al → (t) AlN
Важное практическое значение имеет синтез аммиака, который применяется в дальнейшим при изготовлении удобрений, красителей, лекарств.
N2 + H2 ⇄ (t, p) NH3
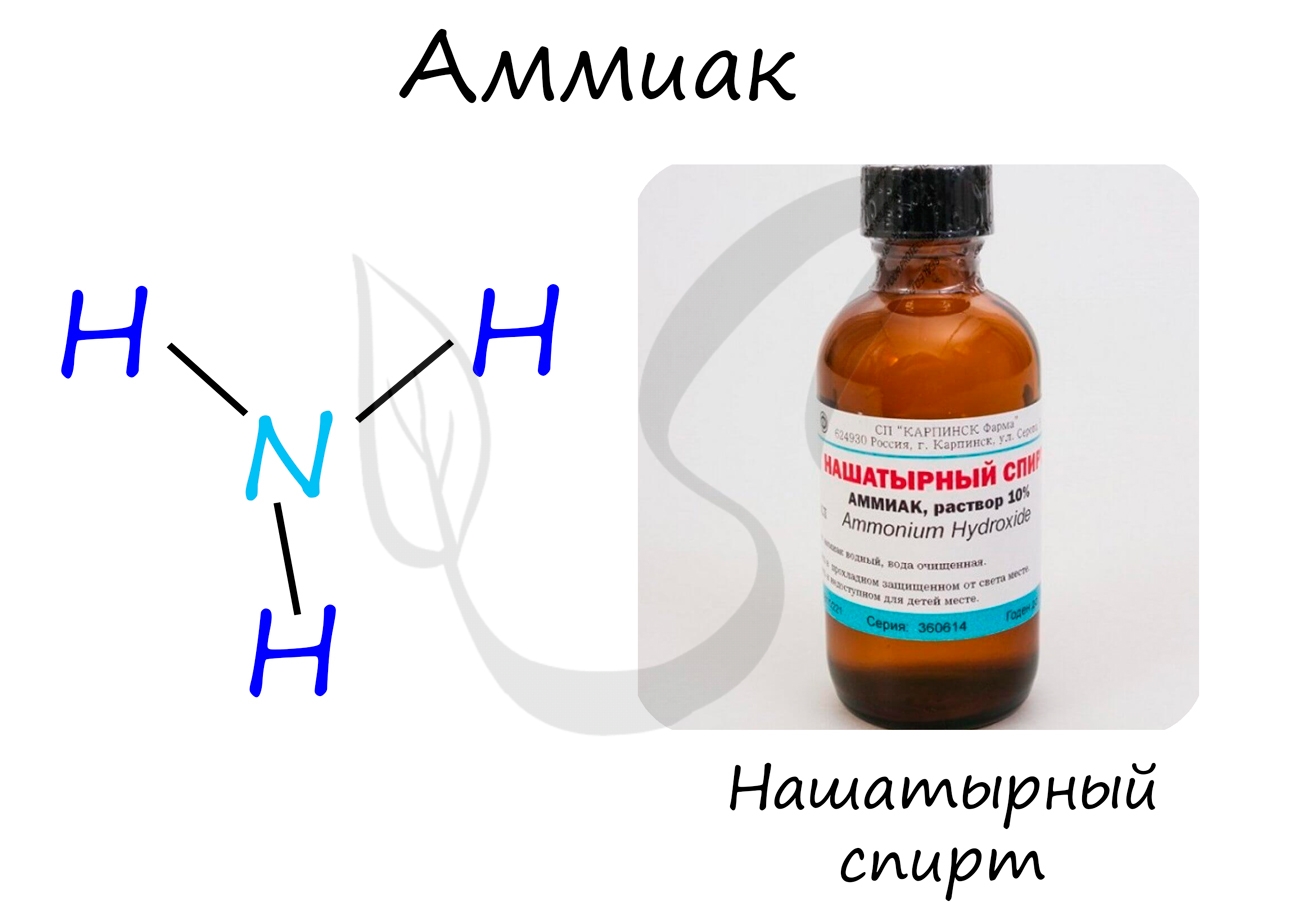
Аммиак
Бесцветный газ с резким едким запахом, раздражающим слизистые оболочки. Раствор концентрацией 10% аммиака применяется в медицинских целях, называется нашатырным спиртом.
Получение
В промышленности аммиак получают прямым взаимодействием азота и водорода.
N2 + H2 ⇄ (t, p) NH3
В лабораторных условиях сильными щелочами действуют на соли аммония.
NH4Cl + NaOH → NH3 + NaCl + H2O
Химические свойства
Аммиак проявляет основные свойства, окрашивает лакмусовую бумажку в синий цвет.
- Реакция с водой
- Основные свойства
- Восстановительные свойства
Образует нестойкое соединение — гидроксид аммония, слабое основание. Оно сразу же распадается на воду и аммиак.
NH3 + H2O ⇄ NH4OH
Как основание аммиак способен реагировать с кислотами с образованием солей.
NH3 + HCl → NH4Cl (хлорид аммония)
NH3 + HNO3 → NH4NO3 (нитрат аммония)

Поскольку азот в аммиаке находится в минимальной степени окисления -3 и способен только ее повышать, то аммиак проявляет выраженные восстановительные свойства. Его используют для восстановления металлов из их оксидов.
NH3 + FeO → N2↑ + Fe + H2O
NH3 + CuO → N2↑ + Cu + H2O
Горение аммиака без катализатора приводит к образованию азота в молекулярном виде. Окисление в присутствии катализатора сопровождается выделением NO.
NH3 + O2 → (t) N2 + H2O
NH3 + O2 → (t, кат) NO + H2O

Соли аммония
Получение
NH3 + H2SO4 → NH4HSO4 (гидросульфат аммония, избыток кислоты)
3NH3 + H3PO4 → (NH4)3PO4
Химические свойства
Помните, что по правилам общей химии, если по итогам реакции выпадает осадок, выделяется газ или образуется вода — реакция идет.
- Реакции с кислотами
- Реакции с щелочами
- Реакции с солями
- Реакция гидролиза
- Реакции разложения
NH4Cl + H2SO4 → (NH4)2SO4 + HCl↑
В реакциях с щелочами образуется гидроксид аммония — NH4OH. Нестойкое основание, которое легко распадается на воду и аммиак.
NH4Cl + KOH → KCl + NH3 + H2O
(NH4)2SO4 + BaCl2 = BaSO4↓ + NH4Cl
В воде ион аммония подвергается гидролизу с образованием нестойкого гидроксида аммония.
NH4+ + H2O ⇄ NH4OH + H+
NH4OH ⇄ NH3 + H2O
NH4Cl → (t) NH3↑ + HCl↑
(NH4)2CO3 → (t) NH3↑ + H2O + CO2↑
NH4NO2 → (t) N2↑ + H2O
NH4NO3 → (t) N2O↑ + H2O
(NH4)3PO4 → (t) NH3↑ + H3PO4

Оксид азота I — N2O
Закись азота, веселящий газ — N2O — обладает опьяняющим эффектом. Несолеобразующий оксид. При н.у. является бесцветным газом с приятным сладковатым запахом и привкусом. В медицине применяется в больших концентрациях для ингаляционного наркоза.

Получают N2O разложением нитрата аммония при нагревании:
NH4NO3 → N2O + H2O
Оксид азота I разлагается на азот и кислород:
N2O → (t) N2 + O2
Оксид азота II — NO
Окись азота — NO. Несолеобразующий оксид. При н.у. бесцветный газ, на воздухе быстро окисляется до оксида азота IV.
Получение
В промышленных масштабах оксид азота II получают при каталитическом окислении аммиака.
NH3 + O2 → (t, кат) NO + H2O
В лабораторных условиях — в ходе реакции малоактивных металлов с разбавленной азотной кислотой.
Cu + HNO3(разб.) → Cu(NO3)2 + NO + H2O
Химические свойства
На воздухе быстро окисляется с образованием бурого газа — оксида азота IV — NO2.
NO + O2 → NO2

Оксид азота III — N2O3
При н.у. жидкость синего цвета, в газообразной форме бесцветен. Высокотоксичный, приводит к тяжелым ожогам кожи.

Получение
Получают N2O3 в две стадии: сначала реакцией оксида мышьяка III с азотной кислотой, затем охлаждением полученной смеси газов до температуры — 36 °C.
As2O3 + HNO3 → H3AsO 3 + NO↑ + NO2↑
При охлаждении газов образуется оксид азота III.
NO + NO2 → N2O3
Химические свойства
Является кислотным оксидом. соответствует азотистой кислота — HNO2, соли которой называются нитриты (NO2—). Реагирует с водой, основаниями.
H2O + N2O3 → HNO2
NaOH + N2O3 → NaNO2 + H2O
Оксид азота IV — NO2
Бурый газ, имеет острый запах. Ядовит.

Получение
В лабораторных условиях данный оксид получают в ходе реакции меди с концентрированной азотной кислотой. Также NO2 выделяется при разложении нитратов.
Cu + HNO3(конц) → Cu(NO3)2 + NO2 + H2O
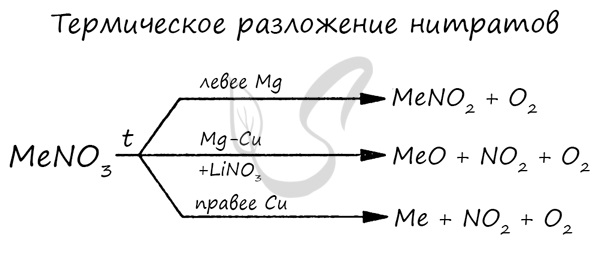
Cu(NO3)2 → (t) CuO + NO2 + O2
Pb(NO3)2 → (t) PbO + NO2 + O2
Химические свойства
Проявляет высокую химическую активность, кислотный оксид.
- Окислительные свойства
- Реакции с водой и щелочами
Как окислитель NO2 ведет себя в реакциях с фосфором, углеродом и серой, которые сгорают в нем.
NO2 + C → CO2 + N2
NO2 + P → P2O5 + N2
Окисляет SO2 в SO3 — на этой реакции основана одна из стадий получения серной кислоты.
SO2 + NO2 → SO3 + NO
Оксид азота IV соответствует сразу двум кислотам — азотистой HNO2 и азотной HNO3. Реакции с водой и щелочами протекают по одной схеме.
NO2 + H2O → HNO3 + HNO2
NO2 + LiOH → LiNO3 + LiNO2 + H2O
Если растворение в воде оксида проводить в избытке кислорода, образуется азотная кислота.
NO2 + H2O + O2 → HNO3

© Беллевич Юрий Сергеевич 2018-2020
Данная статья написана Беллевичем Юрием Сергеевичем и является его интеллектуальной собственностью. Копирование, распространение (в том числе путем копирования на другие сайты и ресурсы в Интернете) или любое иное использование информации и объектов без предварительного согласия правообладателя преследуется по закону. Для получения материалов статьи и разрешения их использования, обратитесь, пожалуйста, к Беллевичу Юрию.
монооксид азота — с русского на немецкий
См. также в других словарях:
Монооксид углерода — Общие Систематическое наименование Монооксид углерода Химическая формула … Википедия
АЗОТА ОКСИДЫ — АЗОТА ОКСИДЫ: гемиоксид N2O и монооксид NO (бесцветные газы) сесквиоксид N2O3 (синяя жидкость), диоксид NO2 (бурый газ, при обычных условиях смесь NO2 и его димера N2O4), оксид N2O5 (бесцветные кристаллы). N2O и NO несолеобразующие оксиды, N2O3 с … Большой Энциклопедический словарь
АЗОТА ОКСИДЫ — АЗОТА ОКСИДЫ: гемиоксид N2O и монооксид NO (бесцветные газы), сесквиоксид N2O3 (синяя жидкость), диоксид NO2 (бурый газ, при обычных условиях смесь NO2 и его димера N2O4), оксид N2O5 (бесцветные кристаллы). N2O и NO несолеобразующие оксиды, N2O3… … Энциклопедический словарь
азота оксиды{:} — гемиоксид N2О и монооксид NO (бесцветные газы), сесквиоксид N2О3 (синяя жидкость), диоксид NO2 (бурый газ, при обычных условиях смесь NO2 и его димера N2О4), оксид N2О5 (бесцветные кристаллы). N2О и NO несолеобразующие оксиды, N2O3 с водой даёт… … Энциклопедический словарь
АЗОТА ОКСИДЫ — гемиоксид N2O и монооксид NO (бесцв. газы), сесквиоксид N203 (синяя жидкость), диоксид NO2 (бурый газ, при обычных условиях смесь NO2 и его димера N2О4), оксид N2О5 (бесцв. кристаллы). N2О и NO несолеобразующие оксиды, N2О3 с водой даёт азотистую … Естествознание. Энциклопедический словарь
Открытие азота — Азот / Nitrogenium (N) Атомный номер 7 Внешний вид простого вещества Газ без цвета вкуса и запаха, химически весьма инертен Свойства атома Атомная масса (молярная масса) 14,00674 а. е. м. (г/моль) Р … Википедия
Оксиды азота — Оксиды азота неорганические бинарные соединения азота с кислородом. Содержание 1 Список оксидов 2 N2O 3 NO 4 N2O3(III) … Википедия
Моноксид азота — Оксид азота(II) Общие Систематическое наименование Оксид азота(II) Химическая формула … Википедия
Окись азота — Оксид азота(II) Общие Систематическое наименование Оксид азота(II) Химическая формула … Википедия
Оксид азота (II) — Оксид азота(II) Общие Систематическое наименование Оксид азота(II) Химическая формула … Википедия
ОКИСЬ АЗОТА — ОКИСЬ АЗОТА, см. монооксид АЗОТА … Научно-технический энциклопедический словарь
Самые простые способы спастись от инфаркта
Когда мы хотим укрепить свое здоровье, то в первую очередь на ум приходят витамины и микроэлементы, которых людям, живущим в больших городах, и впрямь не хватает. С другой стороны, все чаще врачи говорят о том, что наш организм и сам, без посторонней помощи способен вырабатывать различные вещества, необходимые ему для поддержания работоспособности. Не исключение и оксид азота, особая роль которого была открыта учеными около 20 лет назад. Так, по словам Ихора Хука, австрийского профессора, дважды доктора наук и врача Венской частной клиники, чем больше этого элемента в нашем организме, тем крепче иммунитет и меньше… вероятность сердечного приступа.
Нобелевская премия за открытие молекулы оксида азота была вручена в 1998 году. Американский фармаколог Луи Игнарро с коллегами не просто установили, что эта молекула продуцируется в человеческом теле. Была обнаружена тесная связь множества болезней, среди которых гипертония, ишемия миокарда, тромбозы, онкология, с нарушениями физиологических процессов, которые регулирует окись азота.
Многолетний проект профессора Игнарро по изучению роли оксида азота был описан в его книге «NO more heart diseases» («Нет больше сердечных заболеваний»), которая переведена на русский язык. В ней ученый, в частности, отводит очень важную роль терапии оксидом азота в предотвращении и лечении сердечно-сосудистых заболеваний. Ведь, к сожалению, с возрастом «самопроизводство» оксида азота в человеческом организме снижается. Постепенно артерии перестают вырабатывать достаточно кислорода и обрастают холестериновыми бляшками. Чтобы избежать сосудистой катастрофы, инсульта или инфаркта, предлагается поддерживать здоровье сосудов, стимулируя выработку в организме оксида азота и, конечно же, ведя здоровый образ жизни.
Читайте по теме
 Гид по бытовым травмам: как лечить правильно
Гид по бытовым травмам: как лечить правильно
Помощь при порезах и ссадинах
Как стимулировать выработку оксида азота?
Сегодня по-прежнему многие даже не подозревают о важности оксида азота для организма. Как рассказал Ихор Кук, «даже мои студенты учатся по устаревшим учебникам. Когда я спросил их, какой элемент в нашем организме играет самую важную роль, 99 процентов из них ответили, что это кислород. Это в корне неверно! Уже 20 лет нам известно, что таким элементом является оксид азота. За это открытие мой друг в 1997 году получил Нобелевскую премию».
По словам профессора Хука, даже если доступ к кислороду перекрыт, сердце продолжает биться, а вот без оксида азота сердечная мышца тут же прекращает качать кровь.
Но оксид азота полезен не только для здоровья сердца. Самое большое количество этих молекул содержится в мозге защищая его от деменции и дегенеративных нарушений, говорят медики. Оксид азота также влияет на долговременную память, мышление, укрепляет иммунную систему, позволяя ей бороться с вирусами, бактериями и даже раком.
К слову, женщины после пятидесяти лет гораздо чаще сталкиваются с сердечно-сосудистыми проблемами, чем мужчины. Все дело в том, что до менопаузы уровень эстрогенов у женщин очень высок — благодаря этому и количество оксида азота в организме также достаточно большое. Однако после наступления менопаузы и резкого падения уровня женских гормонов снижается и уровень оксида азота. Именно поэтому дамы обязаны следить за его количеством в крови, начиная с раннего возраста.
По словам доктора Хука, активизировать выработку этого вещества проще всего с помощью здоровой диеты. Прежде всего, необходимо налегать на тыкву и орехи. В них содержится много аргинина — аминокислоты, необходимой для синтеза этой молекулы в организме. Суточная норма аргинина — 100−150 граммов в день. Если вы не любите тыкву и не хотите есть много орехов из-за страха поправиться, принимайте аргинин в виде добавок. А самый простой и абсолютно доступный всем источник оксида азота — свежевыжатый свекольный сок, напоминает врач и телеведущий Дмитрий Шубин.
Чтобы стимулировать продуцирование оксида азота, необходимо поддерживать в организме и нормальный уровень (500 мг в день) кальция. Для этого, в свою очередь, нужны витамины D3 и К2. Суточная норма витамина D3, большое количество которого содержится в молочных продуктах и рыбе, составляет около 600 МЕ. По словам профессора Хука, передозировка исключена, потому что организм нуждается в огромных количествах элемента. Как правило, у людей, наоборот, наблюдается недостаток этого витамина из-за нехватки солнечного света. Витамин К2 (необходимое суточное количество которого составляет 100−200 мкг) контролирует выработку кальция и предотвращает его отложение в почках в виде камней.
Доктор Хук напоминает, что кальций очень важен для здоровья. «Если весь кальций испарится из вашего организма, вы умрете. 99% человеческого организма состоит из шести элементов: 65% кислорода, 18% углерода, 10% водорода, 3% азота, 1,5% кальция и 1,2% фосфора», — подчеркивает врач. Остальные одиннадцать элементов составляют менее 1%: 0,2% калия, 0,2% серы, 0,2% хлора, 0,1% натрия, менее 0,05% кобальта, 0,05% меди, 0,05% цинка и йода».
Изучение оксида азота и его свойств продолжается, с ним связывают и поиски в области создания новых лекарственных средств от множества самых разных болезней.
Читайте по теме
 Кому на самом деле помогает гомеопатия
Кому на самом деле помогает гомеопатия
Врач откровенно рассказала о секретах больших и малых разведений
Шесть советов для здоровья сердечно-сосудистой системы от Нобелевского лауреата Луи Игнарро:
- Больше стойте и меньше сидите. Сидение замедляет циркуляцию липазы — энзима крови, который отвечает за всасывание жира. Обязательно делайте 15 — 30-минутные перерывы на стояние или хождение и находите другие возможности двигаться: ходите, разговаривая по телефону и делайте перерывы на прогулку по офису и на улице.
- Добавьте в свой рацион продукты, которые укрепляют здоровье сердечно-сосудистой системы, например, свекольный сок или голубику. Свекольный сок содержит высокие уровни нитрата, который наш организм превращает в окись азота — важную сигнальную молекулу, способствующую расслаблению кровеносных сосудов и здоровому кровотоку. Этот процесс поддерживает здоровый уровень кровяного давления. Голубика содержит подкласс флавоноидов, которые известны как антоцианы, поддерживающие здоровую функцию эндотелия (плоских клеток, выстилающих внутреннюю поверхность кровеносных и лимфатических сосудов) и, как результат, выработку окиси азота.
- Ходьба, бег трусцой или обычный бег — отличные способы заставить вашу кровь циркулировать интенсивнее. Кровь, протекающая по кровеносным сосудам, побуждает эндотелиальные клетки вырабатывать окись азота.
- Занимайтесь йогой. Йога хороша не только для душевного покоя, она также помогает поддерживать здоровое кровяное давление. Считается, что этому способствуют релаксация и уменьшение стресса, что положительно сказывается на сердечном ритме. Йога также поддерживает общую физическую подготовку, силу и гибкость.
- Отдыхайте. Во время сна сердечный ритм замедляется, кровяное давление падает, а сердечно-сосудистая система восстанавливается и обновляется. Этот процесс является важной частью поддержки здоровой циркуляции. Очень важен качественный сон — 7 — 8 часов в ночное время. Не ломайте свой биологический ритм долгим ночным сидением в интернете. Воздержитесь от позднего ужина, вовремя ложитесь спать и рано вставайте, тогда организм будет иметь возможность максимально восстановиться.
- Особую роль в поддержании здоровой циркуляции играют жирные кислоты Омега 3, которые помогают поддерживать нормальные уровни холестерина и триглицеридов, способствуя тем самым здоровью сердечно-сосудистой системы. Две и больше порций жирной рыбы (лосось, скумбрия или тунец) в неделю помогают обеспечить необходимое количество этих нутриентов.
Новости здоровья: Ученые назвали болезнь, из-за которой повышается риск развития онкологии
Информация о лекарствах окиси азота, профессиональный
Общее название: Оксид азотаВА КЛАССИФИКАЦИЯ
Основной: CV402
Обычно используемые торговые марки: INOmax.
Другое широко используемое название:
Монооксид азота {01} Моноксид азота {01} Примечание: Список лекарственных форм и торговых марок по доступности в стране см. В разделе (ах) «Лекарственные формы ». ,
† В Канаде не продается.
Категория:
Антигипертензивные (легочные) —
Показания
Принято
Легочная гипертензия (лечение) — оксид азота вместе с респираторной поддержкой или другими подходящими средствами показан для лечения в срок и недоношенные новорожденные (> 34 недель) с гипоксической дыхательной недостаточностью из-за легочной гипертензии. {02}
Фармакология / фармакокинетика
Физико-химические характеристики:
Химическая группа —
Оксид азота — это газ с химической формулой NO. {02}
Молекулярная масса —
30,01 {01}
Механизм действия / Эффект:
Оксид азота — это эндогенное соединение, которое расслабляет гладкие мышцы сосудов, связываясь внутриклеточно с гемовыми составляющими растворимого гуанилата. циклаза; это активирует гуанилатсинтазу, что приводит к усилению синтеза циклического гуанозин-3 ‘, 5’-монофосфата (цГМФ) и последующей вазодилатации гладких мышц. Он увеличивает парциальное давление артериального кислорода (PaO 2 ) за счет расширения лучше вентилируемых областей легкого и перераспределения кровотока из областей с низким соотношением вентиляция / перфузия (V / Q) в области с нормальным соотношением. {02}
Другие действия / эффекты:
Оксид азота снижает сопротивление сосудов легких у новорожденных со стойкой легочной гипертензией новорожденных (PPHN), улучшает оксигенацию и снижает шунтирование крови справа налево. протока через открытый артериальный проток и овальное отверстие. {02}
Абсорбция:
Оксид азота всасывается системно после вдыхания. {02}
Распределение:
После ингаляции оксид азота распределяется в ложе легочных капилляров и быстро инактивируется путем объединения с гемоглобином.Системные эффекты клинически незначимы. {02}
Биотрансформация:
Большая часть оксида азота соединяется с оксигемоглобином в среде, насыщенной кислородом на 60–100%, с образованием метгемоглобина и нитрата. В среде с низким содержанием кислорода оксид азота соединяется с дезоксигемоглобином с образованием нитрозилгемоглобина, который в присутствии кислорода образует оксиды азота и метгемоглобин. В легких оксид азота соединяется с кислородом и водой с образованием диоксида азота и нитрита, который взаимодействует с оксигемоглобином с образованием метгемоглобина и нитрата.Конечными продуктами оксида азота, которые попадают в системный кровоток, являются метгемоглобин и нитрат. {02}
Период полувыведения:
Выведение — 2–6 секунд {06}
Начало действия:
Легочная гипертензия, ингаляция: от 1 до 3 минут {07} ,
Выведение:
Через почки> 70% дозы оксида азота выводится в виде нитратов. Клиренс нитратов приближается к скорости клубочковой фильтрации. {02}
Меры предосторожности, которые следует учитывать
Канцерогенность
Долгосрочные исследования на животных для оценки канцерогенного потенциала оксида азота не проводились. {02}
Мутагенность
Было показано, что оксид азота генотоксичен для Salmonella (тест Эймса), лимфоцитов человека и после воздействия in vivo на крыс. {02}
Беременность / размножение
Фертильность —
Исследования на животных и людях не проводились. {02}
Беременность —
Исследования на животных и людях не проводились. {02}
FDA Категория беременности C {02}
Кормление грудью
Неизвестно, попадает ли оксид азота в грудное молоко. Исследования среди взрослого населения не проводились. {02}
Педиатрия
Исследования, проведенные на сегодняшний день, не продемонстрировали специфических педиатрических проблем, которые ограничивали бы полезность оксида азота у детей.
Гериатрия
Информация о взаимосвязи возраста и воздействия оксида азота у гериатрических пациентов отсутствует.
Лекарственные взаимодействия и / или связанные с ними проблемы
Следующие лекарственные взаимодействия и / или связанные с ними проблемы были выбраны на основе их потенциальной клинической значимости (возможный механизм указан в скобках, где это уместно) — не обязательно включительно ( » = основные клиническое значение):
Примечание: Комбинации, содержащие любые из следующих лекарств, в зависимости от присутствующего количества, также могут взаимодействовать с этим лекарством.
Нитроглицерин или
Нитропруссид (одновременное использование соединений-доноров оксида азота может увеличить риск развития метгемоглобинемии {02} )
Медицинские соображения / Противопоказания
Медицинские соображения / противопоказания были выбраны на основе их потенциальное клиническое значение (причины, указанные в скобках, где это уместно) — не обязательно включительно ( » = основное клиническое значение).
За исключением особых обстоятельств, этот препарат не следует использовать при наличии следующих медицинских проблем:
» Новорожденные, которые зависят от шунтирования крови справа налево (оксид азота может ухудшить состояние этих пациентов)
Риск-выгода следует учитывать при наличии следующих медицинских проблем
Наблюдение за пациентом
Следующее может быть особенно важным при наблюдении за пациентом (для некоторых пациентов могут потребоваться другие тесты, в зависимости от состояния; » = основное клиническое значение):
» Метгемоглобин, сыворотка (следует периодически контролировать во время терапии {02} )
» Диоксид азота (концентрации оксида азота и диоксида азота следует постоянно контролировать с помощью правильно откалиброванного анализатора с аварийной сигнализацией) 90 014
{02}
» Парциальное давление артериального кислорода (PaO 2 ) (следует контролировать в течение 4 часов после начала терапии и периодически в течение всего лечения, чтобы оценить, улучшилась ли оксигенация и можно ли снизить дозировку { 02} )
Побочные / побочные эффекты
Следующие побочные / побочные эффекты были выбраны на основе их потенциальной клинической значимости (возможные признаки и симптомы указаны в скобках, где это необходимо) — не обязательно включая:
Те, которые указывают потребность в медицинской помощи
Заболеваемость чаще
Ателектаз (кашель; затрудненное дыхание)
целлюлит (опухшая область, которая ощущается теплой и болезненной)
гематурия (кровь в моче; боль в пояснице; боль или жжение при мочеиспускании)
гипергликемия (сонливость) ; запах изо рта, напоминающий фруктовый; учащенное мочеиспускание; необычная жажда)
гипотония (помутнение зрения; спутанность сознания, головокружение, обморок или головокружение при внезапном вставании из положения лежа или сидя; необычная потливость; усталость или слабость)
инфекция и
сепсис (озноб; лихорадка; учащенное сердцебиение)
стридор (резкий, пронзительный звук при дыхании)
абстиненция (боль в груди при дыхании)
{02}
Заболеваемость редко
900 04 Желудочно-кишечное кровотечение (черный или дегтеобразный стул; кровь в стуле)
внутричерепное кровоизлияние, перивентрикулярная лейкомаляция или церебральный инфаркт (головная боль; онемение; ощущение, что вы или окружающие кружитесь; афазия или дизартрия (нарушение речи, влияющее на произношение, чтение и письмо)
легочное кровотечение (кашель с кровью или кровянистой слизью)
судороги (судороги)
{02}
Передозировка
Для получения дополнительной информации о лечении передозировки или непреднамеренного контакта с пищей, токсикологический центр (см. Перечень токсикологического центра).
Клинические эффекты передозировки
Следующие эффекты были выбраны на основе их потенциальной клинической значимости (возможные признаки и симптомы указаны в скобках, где это необходимо) — не обязательно включая:
Острые
Острые повреждения легких (кашель; одышка) — из-за воздействия повышенного уровня диоксида азота
метгемоглобинемия (голубоватые губы, ногти, ладони; темная моча; затрудненное дыхание; головокружение или головокружение; усталость; лихорадка; головная боль) ; бледная кожа; учащенное сердцебиение; одышка; боль в горле; необычное кровотечение или синяк; необычная усталость или слабость)
{02}
Лечение передозировки
Дозу оксида азота следует уменьшить или прекратить при приеме диоксида азота уровни> 3 частей на миллион или уровни метгемоглобина> 7%. {02}
Специальное лечение:
Ввести внутривенное введение аскорбиновой кислоты, внутривенное введение метиленового синего или переливание крови, если метгемоглобинемия не проходит после уменьшения или прекращения терапии оксидом азота. {02}
См. Монографию по метиленовому синему (системный) для получения конкретных рекомендаций по дозированию.
Мониторинг:
Может включать мониторинг уровней метгемоглобина в сыворотке и оксида азота в Y-образном переходнике, расположенном рядом с пациентом. {02}
Общая информация по дозированию
Для форм ингаляционных доз:
Следует использовать дополнительные методы лечения, такие как сурфактант, высокочастотная колебательная или механическая вентиляция, сосудорасширяющие средства, внутривенные жидкости и бикарбонатная терапия. с оксидом азота для максимального насыщения крови кислородом (PaO 2 ). {02}
Система доставки оксида азота должна обеспечивать постоянные заданные концентрации оксида азота на протяжении всего дыхательного цикла. {02}
Терапию оксидом азота не следует прекращать резко, так как это может привести к повышению давления в легочной артерии и / или ухудшению PaO 2 . Лечение следует прекратить и осторожно отлучить от груди. {02}
Резервный аккумуляторный источник питания и резервная система подачи оксида азота должны быть доступны в случае сбоя питания. {02}
Лекарственные формы для ингаляций
ОКСИД АЗОТА
Обычная доза для детей
Легочная гипертензия
Доношенные и недоношенные новорожденные (> 34 недель на миллион): ингаляции ppm) в течение 14 дней или до устранения десатурации кислородом. {02}
В клинических испытаниях доза была снижена до 5 частей на миллион в соответствии с переносимостью у пациентов, у которых оксигенация улучшилась после 4 часов лечения. {02}
Обычные педиатрические пределы назначения
20 ppm.
Дозы до 80 ppm использовались, но обычно неэффективны у тех пациентов, у которых не улучшилось состояние при дозе 20 ppm. Риск метгемоглобинемии и повышенного уровня диоксида азота значительно увеличивался при дозах> 20 ppm. {02}
Прочность (я) обычно доступна
US —
100 ppm в азоте (Rx) [ INOmax (размер D, переносные алюминиевые баллоны)]
800 ppm в азоте (Rx ) [ INOmax (размер D, переносные алюминиевые баллоны)]
100 ppm в азоте (Rx) [ INOmax (размер 88, алюминиевые баллоны)]
800 ppm в азоте (Rx) [ INOmax (Размер 88, алюминиевые цилиндры)]
Канада—
Нет в продаже.
Упаковка и хранение:
Хранить при 25 ° C (77 ° F) с допуском отклонения от 15 до 30 ° C (59 и 86 ° F). {02}
Осторожно:
Предел воздействия Управления по охране труда (OSHA) для оксида азота составляет 25 частей на миллион, а для диоксида азота — 5 частей на миллион. {02}
Разработано: 08.03.2000
Ссылки
- Parfitt, K (ed): Martindale, The Complete Drug Reference, 32-е изд.Pharmaceutical Press, Лондон, Великобритания, 1999: с.923.
- Информация о продукте: INOmax ™, оксид азота, INO Therapeutics, Clinton, NJ, rev. 12/99, рассмотрено 2/2000.
- Не используется.
- Не используется.
- Не используется.
- Higenbottam T: Вдыхаемый оксид азота: волшебная пуля? QJ Med 1993; 86: 555-558.
- Робертс Дж. Д., Ланг П., Бигателло Л. М. и др.: Вдыхаемый оксид азота при врожденном пороке сердца.Тираж 1993 г .; 87: 447-453.
Дополнительная информация
Всегда консультируйтесь с вашим лечащим врачом, чтобы информация, отображаемая на этой странице, соответствовала вашим личным обстоятельствам.
Заявление об отказе от ответственности
,WebElements Периодическая таблица »Азот» окись азота
-

С N O Si -P S -

- Актиний ☢
- Алюминий
- Алюминий
- Америций ☢
- Сурьма
- Аргон
- Мышьяк
- Астатин ☢
- Барий
- Берклиум ☢
- Бериллий
- висмут
- Бориум ☢
- Бор
- Бром
- Кадмий
- Цезий
- Кальций
- Калифорний ☢
- Углерод
- Церий
- Цезий
- Хлор
- Хром
- Кобальт
- Copernicium ☢
- Медь
- Кюрий ☢
- Дармштадтиум ☢
- Дубний ☢
- Диспрозий
- Эйнштейний ☢
- Эрбий
- Европий
- Фермий ☢
- Флеровий ☢
- Фтор
- Франций
- Гадолиний
- Галлий
- Германий
- Золото
- Гафний
- Калий ☢
- Гелий
- Гольмий
- Водород
- Индий
- Йод
- Иридий
- Утюг
- Криптон
- Лантан
- Лоуренсий ☢
- Свинец
- Литий
- Ливерморий ☢
- Лютеций
- Магний
- Марганец
- Мейтнерий ☢
- Менделевий ☢
- Меркурий
- Молибден
- Московиум ☢
- Неодим
- Неон
- Нептуний
- Никель
- Нихоний ☢
- Ниобий
- Азот
- Нобелий
- Оганессон ☢
- Осмий
- Кислород
- Палладий
- фосфор
- Платина
- Плутоний ☢
- Полоний
- Калий
- Празеодим
- Прометий ☢
- Протактиний ☢
- Радий ☢
- Радон ☢
- Рений
- Родий
- Рентгений ☢
- Рубидий
- Рутений
- Резерфорд ☢
- Самарий
- Скандий
- Сиборгий ☢
- Селен
- Кремний
- Серебро
- Натрий
- Стронций
- Сера
- Сера
- Тантал
- Технеций
- Теллур
- Теннессин 5
- Тербий
- Таллий
- Торий ☢
- Тулий
- Олово
- Титан
- Вольфрам
- Уран ☢
- Ванадий
- Ксенон
- Иттербий
- Иттрий
- Цинк
- Цирконий
- Соединения N
- Еще соединения…
- Трифторид азота: NF 3
- Тетрафторид диазота: N 2 F 4
- цис -дифтордиазин: N 2 F 2
- транс -дифтордиазин: N 2 F 2
- Трихлорид азота: NCl 3
- Трииодид азота: NI 3
- Закись азота: N 2 O
- Двуокись азота: NO 2
- Окись азота: NO
- Трехокись азота: N 2 O 3
- Тетраоксид диазота: N 2 O 4
- Пятиокись азота: N 2 O 5
Моноксида азота — Википедия бахаса Индонезия, энсиклопедия бебас
 | |||
| |||
| Нама | |||
|---|---|---|---|
| Нама ИЮПАК Оксид азота | |||
| Nama IUPAC (sistematis) Азот-оксид (•) [1] (добавка) | |||
| Nama lain Оксид азота | |||
| Пенанда | |||
| 3DMet | B00122 | ||
| ЧЕБИ | |||
| ЧЕМБЛ | |||
| ChemSpider | |||
| DrugBank | |||
| Nomor EC | 233-271-0 | ||
| Referensi Gmelin | 451 | ||
| КЕГГ | |||
| Nomor RTECS | QX0525000 | ||
| UNII | |||
| Nomor UN | 1660 | ||
| |||
| Сифат | |||
| НЕТ | |||
| Масса молярный | 30,01 г · моль −1 | ||
| Penampilan | Бесцветный газ | ||
| Densitas | 1.3402 г дм −3 | ||
| Titik lebur | -164 ° С (-263 ° F, 109 К) | ||
| Титик Дидих | -152 ° С (-242 ° F, 121 К) | ||
| 0,0098 г / 100 мл (0 ° C) 0,0056 г / 100 мл (20 ° C) | |||
| Индекс смещения ( n D ) | 1.0002697 | ||
| Struktur | |||
| linear (точечная группа C ∞ v ) | |||
| Термокимия | |||
| Молярный стандарт Entropi ( S | 210.76 Дж K −1 моль −1 | ||
| Entalpi pembentukan standar (Δ f H | 90.29 кДж моль −1 | ||
| Farmakologi | |||
| Rute administrasi | Вдыхание | ||
| Фармакокинетика: | |||
| хорошо | |||
| через ложе легочных капилляров | |||
| 2–6 секунд | |||
| Бахая | |||
 O O  T T | |||
| Frasa-R | R8, R23, R34, шаблон: R44 | ||
| Frasa-S | S1, S17, S23, S36 / 37/39, S45 | ||
| Сенявский теркаит | |||
 N верификаси (apa ini N верификаси (apa ini  Y Y  N ?) N ?) | |||
| Sangkalan dan referensi | |||
Моноксида азота (оксид азота , эндотелиальный релаксирующий фактор, оксид азота, NO ) aktivitas neural.Molekul NO sering juga diproduksi oleh polutan dari asap rokok, kendaraan dan lain-lain, sehingga sering dianggap bersifat toksik dan sangat reaktif, namun penggunaan gas NO konsentrasi rendah Untuk perawatan meyjakan dilapuan dilapaa paru papa. [2] Selain itu, NO dapat diproduksi oleh нейрон selama 80 tahun di dalam otak manusia tanpa menimbulkan efek keracunan, kadar NO yang cukup diperlukan tubuh untuk memelihara hati dari kerusakan iskemik produkti 900 [sekamik] akibat 3 kerusakan iskemik akibat 900] искемия отак акан мерусак нейрон ян сама.
Sitotoksisitas yang dipicu NO, ditimbulkan oleh peroksinitrita (ONOO-), yang terbentuk dari reaksi antara NO dengan senyawa radikal bebas berupa анион супероксида. Peroksinitrita berinteraksi dengan lipid, ДНК и белок melalui mekanisme langsung berupa reaksi oksidatif dan mekanisme tidak langsung dengan kofaktor berupa radikal bebas. Аданья сеньава пероксинитрита мерупакан индикаси бербагай кондиси патегеник сеперти инсульт, инфаркси миокардиал, гагальный янтунг кронис, диабет, канкер, множественный склероз, артрит, келайнан нейродегенеративный , хронический шок кровообращения олех карена сеньава супероксида денган цепат акан диредам олех бербагай дженис энзим дисмутаза супероксида ян тердапат пада митокондрия, ситоплазма дан периплазма, седангкан NO денган цепат акан тердифуси келуар селма далам далам перьяна меиплобинSehingga reaksi antara NO дан супероксида ян мембентук пероксинитрита, сангат джаранг терджади.
Peroksinitrita akan menyebabkan apoptosis pada sel yang terpapar, seperti timosit, sel HL-60, sel PC-12, fibroblas, sel SN-4741 янь мерупакан нейрон , допаминергик , селед нейробластома, праймер SH-SY5Y, нейробластома, олендрозит, нейробластома SH-SY5Y, нейробластома. селэндотелиальный, селбета пада островок Лангерганса, нейтрофил, кондрозит, кардиомиозит дан сел тубулярный пада салуран почечный.
- ^ «Оксид азота (CHEBI: 16480)». (Inggris) «Оксид азота и пероксинитрит для здоровья и болезней». Секция травм тканей, вызванных окислительным стрессом, Лаборатория физиологических исследований, Национальные институты здравоохранения, Национальный институт злоупотребления алкоголем и алкоголизмом, Институт Линуса Полинга, Департамент биохимии и биофизики, сельского хозяйства и наук о жизни, Университет штата Орегон, Департамент интенсивной терапии , Университетская больница; ПАЛ ПАХЕР, ДЖОЗЕФ С. БЕКМАН и ЛУКАС ЛИАУДЕТ . Diakses tanggal 31 июля 2011 г. (Inggris) «Оксид азота подавляет экспрессию гена синтазы оксида азота, индуцируемую гепатоцитами». Отделение хирургии, Университет Питтсбурга; Тейлор Б.С., Ким Ю.М., Ван К., Шапиро Р.А., Биллиар Т.Р., Геллер Д.А. . Diakses tanggal 18 октября 2010 г.
BIPM — оксид азота
 В BIPM поддерживается установка для сравнения первичных стандартов газообразного оксида азота. Установка NO позволяет анализировать первичные эталонные смеси NO / N 2 в диапазоне (от 30 до 70) мкмоль / моль с погрешностью измерения около 0,05% — примерно такой же, как неопределенность гравиметрического приготовления таких смесей. Кроме того, примеси в стандартах количественно определяют с помощью инфракрасной спектрометрии с преобразованием Фурье (FTIR) в BIPM.
В BIPM поддерживается установка для сравнения первичных стандартов газообразного оксида азота. Установка NO позволяет анализировать первичные эталонные смеси NO / N 2 в диапазоне (от 30 до 70) мкмоль / моль с погрешностью измерения около 0,05% — примерно такой же, как неопределенность гравиметрического приготовления таких смесей. Кроме того, примеси в стандартах количественно определяют с помощью инфракрасной спектрометрии с преобразованием Фурье (FTIR) в BIPM.
Система полностью автоматизирована с помощью программного обеспечения, разработанного в BIPM. В 2005-2006 гг. Он использовался в качестве центрального аналитического центра для международного сравнения стандартов газообразного оксида азота CCQM-P73 с участием 12 НМИ и координировался BIPM [1] . Результаты продемонстрировали снижение неопределенностей, которое может быть достигнуто путем сравнения с измерениями, выполненными на центральном предприятии. С тех пор ведется ключевое сравнение CCQM-K137 со стандартами NO при 30 мкмоль-моль –1 и 70 мкмоль-моль –1 .При этой последней концентрации приготовление NO в азотных стандартах рассматривается как пример основной способности NMI, активных в анализе газов.
Установка также использовалась для маркировки вторичных стандартов газа для установки титрования газовой фазы озоном (GPT), тем самым обеспечивая прослеживаемость системы GPT к первичным стандартам NO / N 2 . По сравнению с более традиционным методом измерения озона по поглощению ультрафиолетового излучения это позволило рассчитать независимое значение поперечного сечения поглощения озона, которое в настоящее время рассматривается целевой группой рабочей группы CCQM по анализу газов.
- Wielgosz RI, Esler M., Viallon J., Moussay P., Oh SH, Kim BM, Tshilongo J., Mokgoro IS, Maruyama M., Mace T., Sutour C., Stovcik V., Musil S., Castorena А.П., Мурильо Ф.Р., Кустиков Ю.А., Панкратов В.В., Громова Е.В., Торн В., Дж., Гюнтер Ф.Р., Смеулдерс Д., Баптиста Г., Диас Ф., Вессель Р.М., Ньивенкамп Г. и ван дер Вин AMH, Заключительный отчет на CCQM-P73: Международное сравнение оксида азота в стандартах газообразного азота (30-70) мкмоль / моль, 2008 г., Metrologia 45 Tech.Дополн. 08002