Хлорид натрия — Википедия
| Хлорид натрия | |
|---|---|
 ( ({{{картинка3D}}}) | |
 ( ({{{изображение}}}) | |
| Систематическое наименование | Хлорид натрия |
| Традиционные названия | Соль, поваренная соль, столовая соль, пищевая соль, каменная соль, галит[1] |
| Хим. формула | NaCl |
| Молярная масса | 58,44277 г/моль |
| Плотность | 2,165 г/см³ |
| Температура | |
| • плавления | 800,8 °C |
| • кипения | 1465 °C |
| Мол. теплоёмк. | 50,8 Дж/(моль·К) |
| Энтальпия | |
| • образования | −234,8 кДж/моль |
| Удельная теплота испарения | 170,85 кДж/моль |
| Удельная теплота плавления | 28,68 кДж/моль |
| Растворимость | |
| • в воде | 35,6 г/100 мл (0 °C) 35,9 г/100 мл (+25 °C) 39,1 г/100 мл (+100 °C) |
| • в метаноле | 1,49 г/100 мл |
| • в аммиаке | 21,5 г/100 мл |
| Показатель преломления | 1,544202 (589 нм) |
| Координационная геометрия | Октаэдральная (Na +) Октаэдральная (Cl -) |
| Кристаллическая структура | гранецентрированная кубическая, cF8 |
| Рег. номер CAS | 7647-14-5 |
| PubChem | 5234 |
| Рег. номер EINECS | 231-598-3 |
| SMILES | |
| InChI | |
| RTECS | VZ4725000 |
| ChEBI | 26710 |
| ChemSpider | 5044 |
| ЛД50 | 3000–8000 мг/кг |
| NFPA 704 |  |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |
 Медиафайлы на Викискладе Медиафайлы на Викискладе | |
 Кристалл хлорида натрия
Кристалл хлорида натрияХлори́д на́трия или хлористый натрий
В природе хлорид натрия встречается в виде минерала галита, который образует залежи каменной соли среди осадочных горных пород, прослойки и линзы на берегах солёных озёр и лиманов, соляные корки в солончаках и на стенках кратеров вулканов и в сольфатарах. Огромное количество хлорида натрия растворено в морской воде. Мировой океан содержит 4 × 10
Наиболее вероятно, что первое знакомство человека с солью произошло в лагунах тёплых морей или на соляных озёрах, где на мелководье солёная вода интенсивно испарялась под действием высокой температуры и ветра, а в осадке накапливалась соль. По образному выражению Пифагора, «соль была рождена благородными родителями: солнцем и морем»
Галит[править | править код]
В природе хлорид натрия чаще всего встречается в виде минерала галита. Он имеет гранецентрированную кубическую решётку и содержит 39,34 % Na, 60,66 % Cl. Другими химическими элементами, входящими в состав примесей, являются: Br, N, H, Mn, Cu, Ga, As, I, Ag, Ba, Tl, Pb, K, Ca, S, O. Плотность 2,1—2,2 г/см³, а твёрдость по шкале Мооса — 2. Бесцветный прозрачный минерал со стеклянным блеском. Распространённый минерал соленосных толщ. Образуется при осаждении в замкнутых водоёмах, а также как продукт сгона на стенках кратеров вулканов. Составляет пласты в осадочных породах лагунных и морских фаций, штокоподобные тела в соляных куполах и тому подобных.[4]
Каменная соль[править | править код]
Каменной солью называют осадочную горную породу из группы эвапоритов, состоящую более чем на 90 % из галита. Галит также часто называют каменной солью. Эта осадочная горная порода может быть бесцветной или снежно-белой, но чаще она окрашена примесями глин, талька (серый цвет), оксидами и гидроксидами железа (жёлтый, оранжевый, розовый, красный), битумами (бурая). Каменная соль содержит хлориды и сульфаты натрия, калия, магния и кальция, бромиды, иодиды, бораты, гипс, примеси карбонатно-глинистого материала, доломита, анкериту, магнезита, битумов и так далее[4].
По условиям формирования месторождений каменную соль подразделяют на следующие виды[4]:
- рассолы современных соляных бассейнов
- соляные подземные воды
- залежи минеральных солей современных соляных бассейнов
- ископаемые залежи (важнейшие для промышленности).
Морская соль[править | править код]
Морская соль является смесью солей (хлориды, карбонаты, сульфаты и т. д.), образующейся при полном испарении морской воды. Среднее содержание солей в морской воде составляет:
| Соединение | Масс. доля, % |
|---|---|
| NaCl | 77,8 |
| MgCl2 | 10,9 |
| MgSO4 | 4,7 |
| KCl | 2,5 |
| K2SO4 | 2,5 |
| CaCO3 | 0,3 |
| Ca(HCO3)2 | 0,3 |
| другие соли | 0,2 |
 Очищенная кристаллическая морская соль
Очищенная кристаллическая морская сольПри испарении морской воды при температуре от +20 до +35 °C в осадке сначала кристаллизуются наименее растворимые соли — карбонаты кальция и магния и сульфат кальция. Затем выпадают более растворимые сульфаты натрия и магния, хлориды натрия, калия и магния, и после них — сульфаты калия и магния. Последовательность кристаллизации солей и состав осадка может несколько варьироваться в зависимости от температуры, скорости испарения и других условий. В промышленности морскую соль получают из морской воды, в основном методом обычного выпаривания. Она отличается от каменной соли значительно большим содержанием других химических солей, минералов и различных микроэлементов, в первую очередь йода, калия, магния и марганца. Соответственно, она отличается от хлорида натрия и по вкусу — горько-солёный привкус ей придают соли магния. Она используется в медицине: при лечении кожных заболеваний, таких как псориаз. Как лечебное вещество в аптечной и обычной торговой сети, распространённым продуктом является соль из Мёртвого моря. В очищенном виде этот вид соли также предлагается в продуктовой торговой сети — как натуральная и богатая йодом пищевая
Залежи[править | править код]
Залежи каменной соли найдены во всех геологических системах. Важнейшие из них сосредоточены в кембрийских, девонских, пермских и третичных отложениях. Каменная соль составляет мощные пластовые залежи и ядра сводчатых структур (соляных куполов и штоков), образует прослойки, линзы, гнезда и вкрапления в других породах[4]. Среди озёрных месторождений России крупнейшие — Эльтонское, Баскунчак в Прикаспии, Кучукское озеро, Кулундинское озеро, Эбейты и другие озёра в Западной Сибири.
Производство[править | править код]
В древности технология добычи соли заключалась в том, что соляную рапу (раствор) вытаскивали лошадиным приводом из шахт, которые назывались «колодцами» или «окнами», и были достаточно глубокими — 60—90 м. Извлечённый солевой раствор выливали в особый резервуар —
На Руси поморы вываривали соль на побережье Белого моря и называли её морянка. В 1137 году новгородский князь Святослав определил налог на соляные варницы[6]:
 | …на мори от чрена и от салгы по пузу…[7] |  |
Беломорской солью, называемой «морянкой», торговали по всей Российской империи до начала XX века, пока её не вытеснила более дешёвая поволжская соль.
Современная добыча хлорида натрия механизирована и автоматизирована. Соль массово добывается выпариванием морской воды (тогда её называют морской солью) или рассола с других ресурсов, таких как соляные источники и соляные озера, а также разработкой соляных шахт и добычей каменной соли.
Для добычи хлорида натрия из морской воды необходимы условия жаркого климата с низкой влажностью воздуха, наличие значительных низменных территорий, лежащих ниже уровня моря, или затопляемых приливом, слабая водопроницаемость почвы испарительных бассейнов, малое количество осадков в течение сезона активного испарения, отсутствие влияния пресных речных вод и наличие развитой транспортной инфраструктуры.
Мировое производство соли в 2009 году оценивается в 260 миллионов тонн. Крупнейшими мировыми производителями являются Китай (60,0 млн тонн), США (46,0 млн тонн), Германия (16,5 млн тонн), Индия (15,8 млн тонн) и Канада (14 млн тонн)[8].
-

Добыча соли в южной части Мертвого моря, Израиль
-

Кристаллы каменной соли
-

Плантация морской соли в Дакаре
-

Соляные кучи на солончаке Уюни, Боливия
В пищевой промышленности и кулинарии[править | править код]
Соль повареннаяВ пищевой промышленности и кулинарии используют хлорид натрия, чистота которого должна быть не менее 97 %. Его применяют как вкусовую добавку и для консервирования пищевых продуктов. Такой хлорид натрия имеет товарное название поваренная соль, порой также употребляются названия пищевая, столовая, а также уточнение названия в зависимости от её происхождения — каменная, морская, и по составу добавок — йодированная, фторированная и т. д. Такая соль является кристаллическим сыпучим продуктом с солёным вкусом без привкуса, без запаха (за исключением йодированной соли), в котором не допускаются посторонние примеси, не связанные с методом добывания соли. Кроме хлорида натрия, поваренная соль содержит небольшое количество солей кальция, магния, калия, которые придают ей гигроскопичности и жёсткости. Чем меньше этих примесей в соли, тем выше её качество.
Выделяют сорта: экстра, высший, первый и второй. Массовая доля хлористого натрия в сортах, %:
- экстра — не менее 99,5;
- высший — 98,2;
- первый — 97,5;
- второй — 97,0.
Массовая доля влаги в выварочной соли сорта «экстра» 0,1 %, в высшем сорте — 0,7 %. Допускают добавки йодида калия (йодистого калия), йодата калия, фторидов калия и натрия. Массовая доля йода должна составлять (40,0 ± 15,0) × 10−4 %, фтора (25,0 ± 5,0) × 10−3 %. Цвет экстра и высшего сортов — белый, однако для первого и второго допускается серый, желтоватый, розовый и голубоватый оттенки в зависимости от происхождения соли. Пищевую поваренную соль производят молотой и сеяной. По размеру зёрен молотую соль подразделяют на номера: 0, 1, 2, 3. Чем больше номер, тем больше зерна соли.
В кулинарии хлорид натрия потребляют как важнейшую приправу. Соль имеет характерный вкус, без которого пища кажется человеку пресной. Такая особенность соли обусловлена физиологией человека. Однако зачастую люди потребляют соли больше, чем нужно для физиологических процессов.
Хлорид натрия имеет слабые антисептические свойства — 10-15%-ное содержание соли предотвращает размножение гнилостных бактерий. Этот факт обусловливает её широкое применение как консерванта.
В медицине[править | править код]
Изотонический раствор хлорида натрия в воде (0,9 %) применяется как дезинтоксикационное средство, для коррекции состояния систем организма в случае обезвоживания, как растворитель других лекарственных препаратов. Гипертонические растворы (10 % раствор) используют как вспомогательный осмотический диуретик при отёке головного мозга, для поднятия давления при кровотечениях, в состояниях, характеризующихся дефицитом ионов натрия и хлора, при отравлении нитратом серебра, для обработки гнойных ран (местно). В офтальмологии как местное средство раствор хлорида натрия обладает противоотёчным действием[9].
В коммунальном хозяйстве. Техническая соль[править | править код]
Зимой хлорид натрия, смешанный с другими солями, песком или глиной — так называемая техническая соль — применяется как антифриз против гололёда. Ею посыпают тротуары, хотя это отрицательно влияет на кожаную обувь и техническое состояние автотранспорта ввиду коррозийных процессов.
Регенерация Nа-катионитовых фильтров[править | править код]
Nа-катионитовые фильтры широко применяются в установках умягчения воды всех мощностей при водоподготовке. Катионитным материалом на современных водоподготовительных установках служат в основном глауконит, полимерные ионообменные смолы и сульфированные угли. Наиболее распространены сульфокатионитные ионообменные смолы.
Регенерацию Nа-катионитовых фильтров осуществляют 6—10%-м раствором поваренной соли, в результате катионит переводится в Na-форму, регенерируется. Реакции идут по уравнениям:
- CaR2+2NaCl→2NaR+CaCl2{\displaystyle {\mathsf {CaR_{2}+2NaCl\rightarrow 2NaR+CaCl_{2}}}}
- MgR2+2NaCl→2NaR+MgCl2{\displaystyle {\mathsf {MgR_{2}+2NaCl\rightarrow 2NaR+MgCl_{2}}}}
Химическая промышленность[править | править код]
Соль, наряду с каменным углём, известняками и серой, образует «большую четвёрку» продуктов минерального сырья, которые являются важнейшими для химической промышленности[10]. Из неё получают соду, хлор, соляную кислоту, гидроксид натрия, сульфат натрия и металлический натрий. Кроме этого соль используется также для промышленного получения легкорастворимого в воде хлората натрия, который является средством для уничтожения сорняков[11]. Суммарное уравнение реакции электролиза горячего раствора хлорида натрия[12]:
- NaCl+3h3O→NaClO3+3h3{\displaystyle {\mathsf {NaCl+3H_{2}O\rightarrow NaClO_{3}+3H_{2}}}}
Получение хлора и гидроксида натрия[править | править код]
В промышленности путём электролиза раствора хлорида натрия получают хлор. Процессы, происходящие на электродах[13][14]:
- на катоде как побочный продукт выделяется водород вследствие восстановления ионов H+, образованных в результате электролитической диссоциации воды:
- h3O⇄H++OH−{\displaystyle {\mathsf {H_{2}O\rightleftarrows H^{+}+OH^{-}}}}
- 2H++2e−→h3{\displaystyle {\mathsf {2H^{+}+2e^{-}\rightarrow H_{2}}}}
- поскольку (вследствие практически полной электролитической диссоциации NaCl), хлор в растворе находится в виде хлорид-ионов, они окисляются на аноде до свободного хлора в виде газа:
- NaCl→Na++Cl−{\displaystyle {\mathsf {NaCl\rightarrow Na^{+}+Cl^{-}}}}
- 2Cl−→Cl2+2e−{\displaystyle {\mathsf {2Cl^{-}\rightarrow Cl_{2}+2e^{-}}}}
- суммарная реакция:
- 2NaCl+2h3O→2NaOH+Cl2↑+ h3↑{\displaystyle {\mathsf {2NaCl+2H_{2}O\rightarrow 2NaOH+Cl_{2}\!\uparrow +\ H_{2}\!\uparrow }}}
Как видно из уравнения суммарной реакции, ещё одним продуктом является гидроксид натрия. Расход электроэнергии на 1 т хлора составляет примерно 2700 кВт × час. Полученный хлор при повышенном давлении сжижается в жёлтую жидкость уже при обычной температуре[15].
Если между анодом и катодом нет диафрагмы, то растворённый в воде хлор начинает реагировать с гидроксидом натрия, образуя хлорид и гипохлорит натрия NaClO[14]:
- 2NaOH+Cl2→NaCl+NaOCl+h3O{\displaystyle {\mathsf {2NaOH+Cl_{2}\rightarrow NaCl+NaOCl+H_{2}O}}}
Поэтому для получения гидроксида натрия применяют диафрагму и соответствующий метод получения NaOH называют диафрагменным. В качестве диафрагмы применяют асбестовый картон. В процессе электролиза раствор хлорида натрия постоянно подаётся в анодное пространство, а из катодного пространства непрерывно вытекает раствор хлорида и гидроксида натрия. Во время выпаривания последнего хлорид кристаллизуется, поскольку его растворимость в 50 % растворе NaOH крайне мала (0,9 %). Полученный раствор NaOH выпаривают в железных чанах, затем сухой остаток переплавляют.
Для получения чистого гидроксида натрия (без добавок хлорида натрия) применяют ртутный метод, где используют графитовый анод и ртутный катод. Вследствие того, что перенапряжение выделения водорода на ртути очень большое, на ней вновь появляются ионы натрия и образуется амальгама натрия[14][16]:
- Na++e−→Na(Hg){\displaystyle {\mathsf {Na^{+}+e^{-}\rightarrow Na_{(Hg)}}}}
Амальгаму позже разлагают горячей водой с образованием гидроксида натрия и водорода, а ртуть перекачивают насосом обратно в электролизер:
- 2Na(Hg)+2h3O→2NaOH+h3↑{\displaystyle {\mathsf {2Na_{(Hg)}+2H_{2}O\rightarrow 2NaOH+H_{2}\!\uparrow }}}
Суммарная реакция процесса такая же, как и в случае диафрагменного метода.
Получение металлического натрия[править | править код]
Металлический натрий получают электролизом расплава хлорида натрия. Происходят следующие процессы:
- на катоде выделяется натрий:
- Na++e−→Na{\displaystyle {\mathsf {Na^{+}+e^{-}\rightarrow Na}}}
- на аноде выделяется хлор (как побочный продукт):
- 2Cl−→Cl2+2e−{\displaystyle {\mathsf {2Cl^{-}\rightarrow Cl_{2}+2e^{-}}}}
- суммарная реакция:
- 2Na++2Cl−→2Na+Cl2{\displaystyle {\mathsf {2Na^{+}+2Cl^{-}\rightarrow 2Na+Cl_{2}}}}
Ванна электролизера состоит из стального кожуха с футеровкой, графитового анода и кольцевого железного катода. Между катодом и анодом располагается сетчатая диафрагма. Для снижения температуры плавления NaCl (+800 °C), электролитом является не чистый хлорид натрия, а его смесь с хлоридом кальция CaCl 2 (40:60) с температурой плавления +580 °C. Металлический натрий, который собирается в верхней части катодного пространства, содержит до 5 % примесь кальция, но последний со временем почти полностью отделяется, поскольку его растворимость в жидком натрии при температуре его плавления (+371 K = 98 °C) составляет всего 0,01 %. С расходованием NaCl его постоянно добавляют в ванну. Затраты электроэнергии составляют примерно 15 кВт × ч на 1 кг натрия[17].
Получение соляной кислоты и сульфата натрия[править | править код]
Среди многих промышленных методов получения соляной кислоты, то есть водного раствора хлороводорода (HCl), применяется реакция обмена между твёрдым хлоридом натрия и концентрированной серной кислотой:
- NaCl+h3SO4 →t<110oC NaHSO4+HCl↑{\displaystyle {\mathsf {NaCl+H_{2}SO_{4}\ {\xrightarrow {t<110^{o}C}}\ NaHSO_{4}+HCl\uparrow }}}
- NaCl+NaHSO4 →450−800oC Na2SO4+HCl↑{\displaystyle {\mathsf {NaCl+NaHSO_{4}\ {\xrightarrow {450-800^{o}C}}\ Na_{2}SO_{4}+HCl\uparrow }}}
Первая реакция происходит в значительной степени уже при обычных условиях, а при слабом нагреве идёт почти до конца. Вторая происходит лишь при высоких температурах. Процесс осуществляется в специальных механизированных печах большой мощности. Хлороводород, который выделяется, обеспыливают, охлаждают и поглощают водой с образованием соляной кислоты. Как побочный продукт образуется сульфат натрия Na2SO4[18][19].
Этот метод применяется также для получения хлороводорода в лабораторных условиях.
Физические и физико-химические свойства[править | править код]
Температура плавления +800,8 °С, кипения +1465 °С.
Умеренно растворяется в воде, растворимость мало зависит от температуры: коэффициент растворимости NaCl (в граммах на 100 г воды) равен 35,9 при +21 °C и 38,1 при +80 °C. Растворимость хлорида натрия существенно снижается в присутствии хлороводорода, гидроксида натрия, солей — хлоридов металлов. Растворяется в жидком аммиаке, вступает в реакции обмена. В чистом виде хлорид натрия не гигроскопичен. Однако соль часто бывает загрязнена примесями (преимущественно ионами Ca2+, Mg2+ и SO2−
4), и такая соль на воздухе сыреет[20]. Кристаллогидрат NaCl · 2H2O можно выделить при температуре ниже +0,15 °C[21].
Смесь измельчённого льда с мелким порошком хлорида натрия является эффективным охладителем. Так, смесь состава 30 г NaCl на 100 г льда охлаждается до температуры −20 °C. Это происходит потому, что водный раствор соли замерзает при температуре ниже 0 °C. Лёд, имеющий температуру около 0 °C, плавится в таком растворе, поглощая тепло окружающей среды.
| Термодинамические характеристики | |
|---|---|
| ΔfH0g | −181,42 кДж/моль |
| ΔfH0l | −385,92 кДж/моль |
| ΔfH0s | −411,12 кДж/моль |
| ΔfH0aq | −407 кДж/моль |
| S0g, 1 bar | 229,79 Дж/(моль·K) |
| S0l, 1 bar | 95,06 Дж/(моль·K) |
| S0s | 72,11 Дж/(моль·K) |
Диэлектрическая проницаемость NaCl — 6,3
Плотность и концентрация водных растворов NaCl
| Концентрация, % | Концентрация, г/л | Плотность, г/мл |
|---|---|---|
| 1 | 10,05 | 1,005 |
| 2 | 20,25 | 1,012 |
| 4 | 41,07 | 1,027 |
| 6 | 62,47 | 1,041 |
| 8 | 84,47 | 1,056 |
| 10 | 107,1 | 1,071 |
| 12 | 130,2 | 1,086 |
| 14 | 154,1 | 1,101 |
| 16 | 178,5 | 1,116 |
| 18 | 203,7 | 1,132 |
| 20 | 229,5 | 1,148 |
| 22 | 256 | 1,164 |
| 24 | 283,2 | 1,18 |
| 26 | 311,2 | 1,197 |
Лабораторное получение и химические свойства[править | править код]
При действии концентрированной серной кислоты на твёрдый хлорид натрия выделяется хлороводород:
- 2NaCl+h3SO4→t>110oCNa2SO4+2HCl↑{\displaystyle {\mathsf {2NaCl+H_{2}SO_{4}{\xrightarrow {t>110^{o}C}}Na_{2}SO_{4}+2HCl\uparrow }}}
С раствором нитрата серебра образует белый осадок хлорида серебра (качественная реакция на хлорид-ион):
- NaCl+AgNO3→NaNO3+AgCl↓{\displaystyle {\mathsf {NaCl+AgNO_{3}\rightarrow NaNO_{3}+AgCl\downarrow }}}
При смешивании с сульфатом меди в растворе получается тетрахлоркупрат натрия, при этом синий раствор зеленеет из-за преобладания гидратированного иона [CuCl4(h3O)2]2−{\displaystyle {\ce {[CuCl4(h3O)2]^2-}}}[22] :
- CuSO4+4NaCl⇄Na2[CuCl4]+Na2SO4{\displaystyle {\mathsf {CuSO_{4}+4NaCl\rightleftarrows Na_{2}[CuCl_{4}]+Na_{2}SO_{4}}}}
Учитывая огромные природные запасы хлорида натрия, необходимости в его промышленном или лабораторном синтезе нет. Однако, его можно получить различными химическими методами как основной или побочный продукт.
- получение из простых веществ натрия и хлора является экзотермической реакцией[23]:
- 2Na+Cl2→2NaCl+410 kJ/mol{\displaystyle {\mathsf {2Na+Cl_{2}\rightarrow 2NaCl+410\ kJ/mol}}}
- нейтрализация щелочи гидроксида натрия соляной кислотой[24]:
- NaOH+HCl→NaCl+h3O{\displaystyle {\mathsf {NaOH+HCl\rightarrow NaCl+H_{2}O}}}
Поскольку хлорид натрия в водном растворе почти полностью диссоциирован на ионы:
- NaCl→Na++Cl−{\displaystyle {\mathsf {NaCl\rightarrow Na^{+}+Cl^{-}}}}
Его химические свойства в водном растворе определяются соответствующими химическими свойствами катионов натрия и хлорид-анионов.
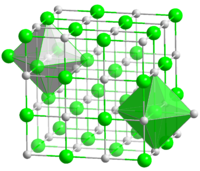
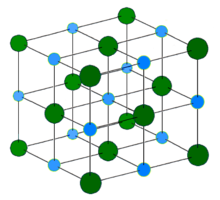 Кристаллическая решётка хлорида натрия.
Кристаллическая решётка хлорида натрия. Голубой цвет = Na+
Зелёный цвет = Cl−
Хлорид натрия образует бесцветные кристаллы кубической сингонии, пространственная группа Fm3m, параметры ячейки a = 0,563874 нм, d = 2,17 г/см3. Каждый из ионов Cl− окружён шестью ионами Na+ в октаэдрической конфигурации, и наоборот. Если мысленно отбросить, например, ионы Na+, то останется плотно упакованная кубическая структура ионов Cl−, называемая гранецентрированной кубической решёткой. Ионы Na+ тоже образуют плотно упакованную кубическую решётку. Таким образом, кристалл состоит из двух подрешёток, сдвинутых друг относительно друга на полупериод. Такая же решётка характерна для многих других минералов.
В кристаллической решётке между атомами преобладает ионная химическая связь, что является следствием действия электростатического взаимодействия противоположных по заряду ионов.
ru.wikipedia.org
Динатриевая соль этилендиаминтетрауксусной кислоты — Википедия
Материал из Википедии — свободной энциклопедии
| Динатриевая соль этилендиаминтетрауксусной кислоты | |
|---|---|
 ( {{{картинка}}}) | |
 ( ({{{изображение}}}) | |
| Сокращения | EDTA-Na2, ЭДТА-Na2 |
| Хим. формула | C10H14N2Na2O8 |
| Молярная масса | безводный продукт — 336,21, дигидрат — 372,24 г/моль |
| Константа диссоциации кислоты pKa{\displaystyle pK_{a}} | 1,99(1), 2,67(2), 6,16(3), 10,26(4) |
| Растворимость | |
| • в воде, при t = 20 °C | 100 г/л |
| • в воде, при t = 80 °C | 230 г/л |
| Рег. номер CAS | 139-33-3 (безводный продукт), 6381-92-6 (дигидрат) |
| PubChem | 8759 |
| Рег. номер EINECS | 205-358-3 (безводный продукт) |
| SMILES | |
| InChI | |
| Кодекс Алиментариус | E386 |
| ChEBI | 64734 |
| ChemSpider | 8429 |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |
Дина́триевая соль этилендиаминтетрау́ксусной кислоты́ (другие названия: комплексо́н-III, трило́н Б, хелато́н III) — органическое соединение, натриевая соль этилендиаминтетрауксусной кислоты, представляет собой белый кристаллический порошок или кристаллы белого цвета. Хорошо растворяется в воде и щелочах, очень слабо растворяется в спирте; рН 1%-ного водного раствора 4,5; рН препарата с массовой долей 5% 4-5,5.
Образует очень устойчивые комплексные соединения с большинством катионов.
Вступает в реакцию с сильными окислителями.
При хранении вещества не допускать его контакта с алюминием, цинком, никелем, медью и медными сплавами.
Трилон Б — его торговое название и представляет собой кристаллический порошок белого цвета. Это название введено фирмой BASF и использовалась как торговая марка этого, но очень быстро вошло в все языки и используется другими фирмами для обозначения продукта.
Используются также тринатриевая и тетранатриевая соль этилендиаминтетрауксусной кислоты, но для связывания одного и того же количества ионов их надо брать в большем количестве. Трилон Б придаёт растворимость нерастворимым солям многих металлов. Его действие основано на извлечении ионов металла из молекул нерастворимых солей металлов и замещения в них ионами натрия, почти все соли которого растворимы в воде, причём независимо от валентности металла 1 молекула трилона реагирует с 1 молекулой соли металла. Это ценное свойство нашло большое применение в аналитической химии.
Пример растворения нерастворимого осадка карбоната кальция:
ЭДТА-Na2(растворим)+CaCO3(нерастворим)⟶ЭДТА-Ca(растворим)+Na2CO3(растворим).{\displaystyle {\mathsf {{\text{ЭДТА-Na}}_{2}}}_{\text{(растворим)}}{\mathsf {+CaCO_{3}}}_{\text{(нерастворим)}}{\mathsf {\longrightarrow {\text{ЭДТА-Ca}}}}_{\text{(растворим)}}{\mathsf {+Na_{2}CO_{3}}}_{\text{(растворим)}}.}
Аналогичное взаимодействие происходит с солями меди, железа в степени окисления II и III, магния и марганца. Причём трилон Б не является окислителем и не взаимодействует с металлами, находящимися в нулевой степени окисления.
Основная применение: делает нерастворимые соли металлов растворимыми.
- в аналитической химии для качественного и количественного определения многих катионов и анионов, напр.: Ca, Mg, Cu, Со, Ni, Zn, Fe, Mo, Al, редкоземельных элементов, Tc, U, SO42−, PO43−, CN− и др. (см. Комплексонометрия), при потенциометрических, полярографических и амперометрических определениях, благодаря возможности вещества образовывать с ионами металлов комплексные соединения, окрашенные в различный цвет, цвет раствора будет зависеть от иона металла, с которым образован комплекс;
- в производстве медицинских препаратов и при отравлениях тяжелыми металлами;
- в производстве препаратов для бытовой химии и в синтетических моющих средств;
- в сельском хозяйстве и гидропонном растениеводстве, для повышения стабильности железа в питательных растворах, а также для улучшения усвоения питательных элементов при внекорневой подкормке растений;
- при консервировании и др.;
- в реставрацонных работах для удаления коррозии с изделий из бронзы и других цветных металлов, особо хорошо себя проявляет в очистке изделий из серебра[1];
- в промышленности для промывки теплоэнергетического оборудования, труб, трубопроводов котлов от накипи и ржавчины, уменьшающих полезное сечение, водоподготовки в котельных и теплосетях, с этой же целью трилон Б применяют для очистки автомобильных систем охлаждения, защиты стиральных машин от накипи как отдельный препарат или в комплексе со стиральным порошком;
- в виде стабилизатора в процессах полимеризации;
- в целлюлозно-бумажной промышленности;
- при производстве каучука;
- аммиачный раствор трилона Б (5 % аммиака, 3 % трилона Б) позволяет быстро и эффективно восстанавливать свинцовые аккумуляторы за счёт десульфатации свинцовых пластин[источник не указан 43 дня];
- в фотографии трилон Б применяют в качестве водоумягчителя в различных растворах[2], при приготовлении таких растворов на дистиллированной воде, трилон Б можно не применять, но в рецептах отбеливающих растворов в цветной фотографии трилон Б служит для получения непосредственно в растворе железной соли трилона Б, которая обладает свойством окислять металлическое серебро[3]; в таких растворах исключать трилон Б нельзя; тем не менее, подобная рецептура получения железной соли трилона Б использовалась только в устаревших процессах Agfa/Orwo и для цветных материалов СССР, выпуск которых полностью прекращён в конце 1990-х годов; в современных процессах C-41, E-6 и RA-4 железная соль трилона Б по-прежнему применяется для этой цели, однако подобный способ её получения непригоден по причине загрязнения раствора, поэтому необходимо использовать чистый реактив[4].
Может вызвать раздражение кожи, слизистых оболочек глаз и дыхательных путей и вызвать симптомы бронхита.
Средства индивидуальной защиты[править | править код]
Противопылевой респиратор, средства защиты лица, глаз.
Меры первой помощи[править | править код]
Вынести пострадавшего на свежий воздух, снять загрязнённую одежду. Глаза и кожные покровы тщательно и обильно промыть водой. Оттягивать веки от глазных яблок для более полного промывания. При проглатывании прополоскать рот, дать воды для питья.
ru.wikipedia.org
Сегнетова соль — Википедия
Материал из Википедии — свободной энциклопедии
Текущая версия страницы пока не проверялась опытными участниками и может значительно отличаться от версии, проверенной 16 марта 2015; проверки требуют 9 правок. Текущая версия страницы пока не проверялась опытными участниками и может значительно отличаться от версии, проверенной 16 марта 2015; проверки требуют 9 правок.| Сегнетова соль | |
|---|---|
 ( {{{картинка}}}) | |
| Систематическое наименование | Калия-натрия тартрата тетрагидрат |
| Традиционные названия | Сегнетова соль |
| Хим. формула | C4H4KNaO6 |
| Рац. формула | KNaC4H4O6·4H2O |
| Молярная масса | 282,1 г/моль |
| Плотность | ≈1,790 (при 20 °C) |
| Температура | |
| • плавления | 70—80 °C |
| • разложения | 130—140 °C |
| Растворимость | |
| • в воде | 63[1] |
| Рег. номер CAS | 304-59-6 |
| PubChem | 9855836 |
| Рег. номер EINECS | 206-156-8 |
| SMILES | |
| InChI | |
| Кодекс Алиментариус | E337 |
| ChEBI | 63019 |
| ChemSpider | 8031536 |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |
 Медиафайлы на Викискладе Медиафайлы на Викискладе | |
Сегне́това соль — тетрагидрат двойной натриево-калиевой соли винной кислоты KNaC4h5O6⋅4h3O{\displaystyle {\ce {KNaC4h5O6*4h3O}}} (тартрат натрия-калия). Названа по имени французского аптекаря Пьера Сеньета (фр. Pierre Seignette), 1660—1719 (в других источниках указывается имя аптекаря Эли Сенье[2] (1632—1698), а также годы получения соли — 1672[3] и 1675).
Физические свойства и применение в технике[править | править код]
Окраска кристаллов сегнетовой соли — от бесцветной до голубоватой. Разлагаться вещество начинает уже при 55,6 °C[4] (вероятно, имеется в виду частичная или полная потеря кристаллизационной воды). Построение кристалла соответствует ромбической системе (обычно вещество кристаллизуется в ромбовидные кристаллы с 12 гранями, 2 из которых — пинакоиды; углы между двумя боковыми гранями равны 163° un 40°[5]).
У сегнетовой соли впервые (1920; по другим данным, в 1894[6] г.) были обнаружены своеобразные электрические свойства — самопроизвольная поляризация в определённом интервале температур, причём эта поляризация поддаётся изменению под воздействием достаточно сильного внешнего электрического поля. Позже вещества с такими свойствами стали называть по имени сегнетовой соли сегнетоэлектриками.
Кроме того, тетрагидрат тартрата калия-натрия является одним из первых веществ, у которых были обнаружены пьезоэлектрические свойства (Пьер и Жак Кюри, 1880). Позднее эти свойства нашли применение в технике: сначала в межвоенный период в США (патент фирмы BRUSH № 2483647[7]), а затем и в других странах (в СССР в 1941—1942[8] гг.) сегнетову соль стали применять в звукоснимателях электрофонов, микрофонах, телефонных трубках и других подобных устройствах (например, в слуховых аппаратах). Особенно широко это вещество нашло применение во время повышенного спроса на электротехнику в послевоенные годы. По сравнению с другими преобразователями выходное напряжение сегнетовой соли весьма велико (даже в три тысячи раз больше[8][9]). Однако изготовленные из неё преобразователи не могут храниться во влажном месте, поскольку соль из-за своей гигроскопичности постепенно расплывается.
Так как тартрат натрия-калия — соль винной кислоты, ему соответствуют несколько оптических изомеров. В природе встречается только L-(+)-винная кислота[источник не указан 2288 дней].
Тетрагидрат растворим в воде хорошо (54 г/100 г h3O{\displaystyle {\ce {h3O}}}) при 15 °C, при 30 °C 1390 г/л[2]), к тому же соль гигроскопична. Однако соль как таковая, очевидно, малорастворима, поскольку в реакции получения выпадает в осадок.
Тартрат натрия-калия является компонентом Фелинговой жидкости, в составе которой он используется для обнаружения сахаров. Также сегнетову соль используют в серебрении зеркал по методу Генрихсона[10]. Кроме того, эта соль используется в органическом синтезе как деэмульгатор в водных растворах, обычно в реакциях с применением гидрида алюминия. Наконец, в растворе для определения белков биуретовым методом также содержится тартрат калия-натрия.
В лаборатории эту соль получают осаждением в мелкокристаллическом виде из горячего раствора кислого тартрата калия добавлением стехиометрического количества Na2CO3.
 Сравнительно большой кристалл, выращенный на станции «Скайлэб»
Сравнительно большой кристалл, выращенный на станции «Скайлэб»Кристаллы большего размера выращены в космосе в условиях слабого тяготения и конвекции, например, на американской орбитальной станции «Скайлэб». Выращивают кристаллы нужного размера и в промышленности[11].
Тартрат калия-натрия используется в пищевой промышленности в качестве добавки E337 (антиоксиданта). Он обладает солёным, холодящим вкусом. Используется эта соль и в пекарских порошках[12]. Вещество нашло применение и в медицине — в качестве слабительного (якобы аптекарь Сеньет употреблял эту соль для помощи при желудочных расстройствах[5]). В этих целях сегнетову соль часто применяют в составе порошка Сейдлица[13], ранее она использовалась в составе «венского питья».
ru.wikipedia.org
Калиево-натриевая соль: что за зверь?
Натрий и калий являются конкурирующими элементами: если одного больше, концентрация второго уменьшается. Оба минерала необходимы и должны поставляться в организм — например, в виде калиево-натриевой соли. Что это за продукт и почему стоит обратить на него внимание?
Натрий отвечает за нормальную проводимость нервных импульсов, а также за правильную работу сердца. Он нужен и для поддержания кислотно-щелочного баланса. С другой стороны, избыток натрия провоцирует повышение артериального давления.
Калий участвует в углеводном обмене и синтезе белков, помогает поддерживать необходимый водный баланс и кислотно-щелочное равновесие. Также калий снижает кровяное давление. Смесь двух солей — калиевой и натриевой — может стать способом сохранить баланс между этими значимыми минералами.
Калиево-натриевая соль на отечественном рынке
Этот «гибридный» продукт представляет собой смесь соли поваренной и калийной. Натриевая ограничивает развитие микрофлоры в сырах и мясе, а также способствует правильному брожению теста. Кроме того, такая соль растворяет белки на поверхности мясных блюд, помогая им становиться более сочными. Он необходим и при производстве созревающих сыров — отвечает за набухание белков.
Около 20 лет назад на европейском рынке у поваренной соли появилась «родственница», рассматриваемая как ее более здоровая альтернатива. Она доступна на отечественном рынке, но не в супермаркетах и обычных магазинах, а только в торговых точках, продающих органическую еду, в некоторых интернет-магазинах.
Натриево-калийную соль также называют солью с пониженным содержанием натрия, потому что этот элемент в процессе производства частично заменен соперником-калием. У последнего тоже соленый вкус, но чуть менее интенсивный, поэтому разница между традиционной поваренной солью и более здоровым ее заменителем невелика. А вот ценовая разница между калийно-натриевой солью и ее «коллегой», находящейся в большинстве солонок, велика. Но ее полностью компенсирует улучшение состояния здоровья, наблюдающееся при замене натриевой соли ее более дорогой альтернативой. Ведь в ней меньше натрия, избыток которого является проблемой для многих потребителей. В этом продукте примерно на 30 % меньше натрия, содержание калия составляет около 15 %.
Как уже отмечалось, высокий уровень натрия в организме приводит к гипертонии, которая, в свою очередь, способна спровоцировать заболевания почек и сердечно-сосудистой системы. Кроме того, из-за такого положения вещей существенно увеличивается выведение кальция с мочой, что приводит к развитию остеопороза. Соль добавляется во многие продукты, и замена поваренной соли натриево-калиевой разновидностью помогает в целом существенно снизить уровень натрия в ежедневном рационе.
Натриевую соль обогащают только йодом. Бывает йодированным и калиево-натриевый продукт, но он дополнительно содержит и карбонат магния. Поэтому такая соль помогает уменьшить риск формирования дефицита калия и магния. Этот продукт очень хорошо включать в диету, предполагающую низкое содержание натрия.
Здоровее, но не здоровая
Калийно-натриевая соль здоровее, чем обычная, но далеко не она считается самой здоровой. Пальма первенства в этом семействе принадлежит розовой гималайской разновидности. Она включает более 80 минералов, в том числе кальций, железо, йод и магний. Такая специя не только помогает покрыть потребность в микро- и макроэлементах, на и способствует очищению организма от тяжелых металлов. Может быть использована в качестве добавки к салатам, мясу, крупам и картофелю, а также задействуется в ваннах.
Очень полезна соль Мертвого моря – калийно-магниевая, называемая также карналитовой. Ей приписывают сильные регенеративные и питающие свойства. Карналитовая соль используется в основном для приготовления солевых ванн, которые минерализуют и восстанавливают кожу, а также хорошо очищают поры и стимулируют клеточный метаболизм. А вот на кухне она не используется, потому что имеет горький вкус.
Натрий является важным компонентом рациона. Но среднестатистический потребитель в силу особенностей современных технологических процессов употребляет ее чересчур много, что может вызвать проблемы со здоровьем. Более здоровые заменители соли стоят дороже, но при этом повышают ценность еды, обогащая ее полезными минералами. Разумное ограничение натрия, в том числе за счет использования калиево-натриевый соли, особенно полезно людям, подверженным риску или уже страдающим от гипертонии. Да и остальным она, несомненно, сослужит добрую службу.
volshebnaya-eda.ru
Нитрат натрия — Википедия
Материал из Википедии — свободной энциклопедии
Текущая версия страницы пока не проверялась опытными участниками и может значительно отличаться от версии, проверенной 10 июня 2017; проверки требуют 10 правок. Текущая версия страницы пока не проверялась опытными участниками и может значительно отличаться от версии, проверенной 10 июня 2017; проверки требуют 10 правок.| Нитрат натрия | |
|---|---|
({{{изображение}}}) | |
| Систематическое наименование | Нитрат натрия |
| Традиционные названия | Натриевая селитра, натронная селитра, чилийская селитра, нитронатрит |
| Хим. формула | NaNO3 |
| Состояние | твёрдое |
| Молярная масса | 84,993 г/моль |
| Плотность | 2,257 г/см³ |
| Твёрдость | 2 |
| Поверхностное натяжение | 119 (320°C) 117 (350°C) 114 (400°C) Н/м |
| Динамическая вязкость | 2,86 (317°C) 2,01 (387°C) 1,52 (457°C) мПа•с |
| Температура | |
| • плавления | 308 °C |
| • кипения | с разложением °C |
| • разложения | 380 °C |
| Мол. теплоёмк. | 67 Дж/(моль·К) |
| Энтальпия | |
| • образования | -257 кДж/моль |
| • плавления | 16 кДж/моль |
| Растворимость | |
| • в жидком аммиаке | 127 г/100 мл |
| • в воде | 91,6 (25 °С) 114,1 (50°C) 176,0 (100°C) |
| • в гидразине | 100 (20°C) |
| Рег. номер CAS | 7631-99-4 |
| PubChem | 24268 |
| Рег. номер EINECS | 231-554-3 |
| SMILES | |
| InChI | |
| Кодекс Алиментариус | E251 |
| RTECS | WC5600000 |
| ChEBI | 63005 |
| Номер ООН | 1498 |
| ChemSpider | 22688 |
| ЛД50 | 3500 мг/кг (мыши, перорально) |
| Пиктограммы ECB |   |
| NFPA 704 |  |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |
 Медиафайлы на Викискладе Медиафайлы на Викискладе | |
Нитра́т на́трия (азотноки́слый на́трий, натриевая селитра, чилийская селитра, натронная селитра) — натриевая соль азотной кислоты с формулой NaNO3. Бесцветные прозрачные кристаллы с ромбоэдрической или тригональной кристаллической решеткой без запаха. Вкус — резкий солёный. Применяется очень широко и является незаменимым в промышленности соединением.
Физические свойства[править | править код]
Молекулярная масса — 85. Это бесцветные длинные кристаллы, плотностью 2,257 г/см3. tпл 308 °C, при t выше 380 °С разлагается.
Растворимость (г в 100 г) в:
- воде — 72,7 (0°С), 87,6 (20°С), 91,6 (25 °С), 114,1 (50 °C), 124,7 (60°С), 176,0 (100°С)
- жидком аммиаке — 127 (25 °С)
- гидразине — 100 (25 °С)
- этаноле — 0,036 (25 °С)
- метаноле — 0,41 (25 °С)
- пиридине — 0,35 (25 °С).
Натриевая селитра обладает высокой гигроскопичностью, что затрудняет использование этого вещества в пиротехнике.
Химические свойства[править | править код]
При нагревании более 380°С разлагается с выделением кислорода и нитрита натрия:
- 2NaNO3⟶ 2NaNO2+O2↑{\displaystyle {\mathsf {\ 2NaNO_{3}\longrightarrow \ 2NaNO_{2}+O_{2}\uparrow }}}
Может вступать в реакции обмена с солями щелочных металлов. Благодаря меньшей, по сравнению с нитратом натрия, растворимости образующихся нитратов, равновесие указанных реакций смещено вправо:
- NaNO3+KCl⟶ KNO3+NaCl{\displaystyle {\mathsf {\ NaNO_{3}+KCl\longrightarrow \ KNO_{3}+NaCl}}}
- NaNO3+RbI⟶ RbNO3+NaI{\displaystyle {\mathsf {\ NaNO_{3}+RbI\longrightarrow \ RbNO_{3}+NaI}}}
Проявляет сильные окислительные свойства в твердом агрегатном состоянии и в расплавах.[источник не указан 2565 дней].
В процессе разложения выделяет кислород, вследствие чего может взаимодействовать с неметаллами:
- 2NaNO3+S⟶ 2NaNO2+SO2↑{\displaystyle {\mathsf {\ 2NaNO_{3}+S\longrightarrow \ 2NaNO_{2}+SO_{2}\uparrow }}}
- 2NaNO3+C⟶ 2NaNO2+CO2↑{\displaystyle {\mathsf {\ 2NaNO_{3}+C\longrightarrow \ 2NaNO_{2}+CO_{2}\uparrow }}}
Реакция с серой проходит с большим выделением света и тепла, таким, что стеклянный сосуд, в котором проводится опыт, может лопнуть или расплавиться.
Его окислительные свойства близки к свойствам нитрата калия, поэтому он может использоваться аналогично в некоторых направлениях, например в пиротехнике.
В лаборатории нитрат натрия можно получить следующими способами:
- 21Na+26 HNO3⟶ 21NaNO3+NO↑+N2O↑+N2↑+13h3O{\displaystyle {\mathsf {\ 21Na+26\ HNO_{3}\longrightarrow \ 21NaNO_{3}+NO\uparrow +N_{2}O\uparrow +N_{2}\uparrow +13H_{2}O}}}
- Na2O+2HNO3⟶ 2NaNO3+h3O{\displaystyle {\mathsf {\ Na_{2}O+2HNO_{3}\longrightarrow \ 2NaNO_{3}+H_{2}O}}}
- NaOH+HNO3⟶ NaNO3+h3O{\displaystyle {\mathsf {\ NaOH+HNO_{3}\longrightarrow \ NaNO_{3}+H_{2}O}}}
- NaHCO3+HNO3⟶ NaNO3+CO2↑+h3O{\displaystyle {\mathsf {\ NaHCO_{3}+HNO_{3}\longrightarrow \ NaNO_{3}+CO_{2}\uparrow +H_{2}O}}}
Также вместо азотной кислоты можно использовать нитрат аммония:
- NaOH+Nh5NO3⟶ NaNO3+Nh4↑+h3O{\displaystyle {\mathsf {\ NaOH+NH_{4}NO_{3}\longrightarrow \ NaNO_{3}+NH_{3}\uparrow +H_{2}O}}}
- NaHCO3+Nh5NO3⟶ NaNO3+Nh4↑+CO2↑+h3O{\displaystyle {\mathsf {\ NaHCO_{3}+NH_{4}NO_{3}\longrightarrow \ NaNO_{3}+NH_{3}\uparrow +CO_{2}\uparrow +H_{2}O}}}
- Взаимодействием нитрата серебра с пищевой солью (качественная реакция на ион Cl—):
- AgNO3+NaCl⟶ NaNO3+AgCl↓{\displaystyle {\mathsf {\ AgNO_{3}+NaCl\longrightarrow \ NaNO_{3}+AgCl\downarrow }}}
Применяется как удобрение; в пищевой[1], стекольной, металлообрабатывающей промышленности; для получения взрывчатых веществ, ракетного топлива и пиротехнических смесей для придания огню жёлтого цвета. Получается из природных залежей выщелачиванием горячей водой и кристаллизацией; абсорбцией раствором соды окислов азота; обменным разложением кальциевой или аммиачной селитры с сульфатом, хлоридом или карбонатом натрия.
ru.wikipedia.org
Сульфат натрия — Википедия
Материал из Википедии — свободной энциклопедии
Текущая версия страницы пока не проверялась опытными участниками и может значительно отличаться от версии, проверенной 9 апреля 2018; проверки требуют 7 правок. Текущая версия страницы пока не проверялась опытными участниками и может значительно отличаться от версии, проверенной 9 апреля 2018; проверки требуют 7 правок.| Сульфат натрия | |
|---|---|
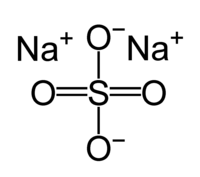 ( {{{картинка}}}) | |
 ( ({{{изображение}}}) | |
| Систематическое наименование | сульфат натрия, натрий сернокислый |
| Хим. формула | Na2SO4 |
| Рац. формула | Na2SO4 |
| Состояние | белые гигроскопичные кристаллы |
| Молярная масса | 142,04 г/моль |
| Плотность | 2,68 г/см³ |
| Температура | |
| • плавления | 883 °C |
| Энтальпия | |
| • образования | −1387,9 кДж/моль |
| Растворимость | |
| • в воде | 19,2 (20 °C), 42,3 (100 °C) |
| Рег. номер CAS | 7757-82-6 |
| PubChem | 24436 |
| Рег. номер EINECS | 231-820-9 |
| SMILES | |
| InChI | |
| Кодекс Алиментариус | E514(i) |
| RTECS | WE1650000 |
| ChEBI | 32149 |
| ChemSpider | 22844 |
| NFPA 704 |  |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |
 Медиафайлы на Викискладе Медиафайлы на Викискладе | |
Сульфат натрия, сернокислый натрий, Na2SO4 — натриевая соль серной кислоты.
Бесцветные кристаллы. Безводный Na2SO4 устойчив выше температуры 32,384 °C, ниже этой температуры в присутствии воды образуется кристаллогидрат Na2SO4·10H2O.
В природе безводный сульфат натрия встречается в виде минерала тенардита. Кристаллогидрат Na2SO4·10H2O образует минерал мирабилит (глауберову соль). Встречаются также двойные соли сульфата натрия с другими сульфатами, например астраханит Na2SO4·MgSO4·4H2O, глауберит Na2SO4·CaSO4. Значительные количества сульфата натрия содержатся в рапе и донных отложениях солёных озёр хлорид-сульфатного типа и заливе Кара-Богаз-Гол. В них при понижении температуры идёт реакция:
- 2NaCl + MgSO4 ⇆ MgCl2 + Na2SO4
В России крупнейшим производителем природного сульфата натрия является компания ОАО «Кучуксульфат» — 600 тыс. тонн в год.
Промышленный способ получения сульфата натрия — взаимодействие NaCl с H2SO4 в специальных «сульфатных» печах при 500—550 °C; одновременно получается хлороводород.
- 2NaCl+h3SO4⟶Na2SO4+2HCl{\displaystyle {\mathsf {2NaCl+H_{2}SO_{4}\longrightarrow Na_{2}SO_{4}+2HCl}}}
В настоящее время такой способ практически не используется, так как имеются достаточно большие запасы природного сырья.
Также сульфат натрия получается как отход (не имеющий запаха) в производстве хромпика.
В мире большое количество сульфата натрия использовались ранее при производстве синтетических моющих средств, однако во многих странах в последние годы произошёл переход на концентрированные (компактные) стиральные порошки, в которых сульфат либо не используется, либо используется в небольших количествах. В России производители стиральных порошков закупают более 300 тыс. тонн сульфата натрия.
Второе по количеству применение сульфата натрия — стекольное производство. Также это вещество используют в больших объёмах при получении целлюлозы сульфатным методом, а также в текстильной, кожевенной промышленности и в цветной металлургии.
В небольших количествах сульфат натрия находит применение в химических лабораториях — в качестве обезвоживающего средства. Несмотря на то, что он обезвоживает органические растворители медленнее, чем сульфат магния, многие предпочитают именно это средство по двум причинам: дешево и легко отфильтровывать.
В ещё меньших количествах ранее использовался в медицине и ветеринарии в качестве солевого слабительного средства и как компонент в средствах для промывания носа.
Зарегистрирован в качестве пищевой добавки E514.
Регулятор кислотности, используется как буферная добавка поддерживающая pH на определенном уровне [1].
Физиологическое действие и указания по технике безопасности[править | править код]
Сульфат натрия Na2SO4 пожаро- и взрывобезопасен. По степени воздействия на организм человека натрий сернокислый относится к IV классу опасности (малоопасные вещества) согласно ГОСТ 12.1.007-76. По токсикологии NFPA 704 сульфату натрия присвоена низшая токсичность.
- Реми Г. Курс неорганической химии. Т.2. — М., 1966
ru.wikipedia.org
Гидрокарбонат натрия — Википедия
| Гидрокарбонат натрия | |
|---|---|
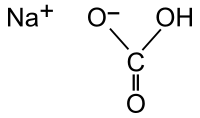 ( {{{картинка}}}) | |
 ( ({{{изображение}}}) | |
| Систематическое наименование | гидрокарбонат натрия |
| Традиционные названия | пищевая (питьевая) сода, сода двууглекислая, двууглекислый натрий, бикарбонат натрия, кислый углекислый натрий |
| Хим. формула | CHNaO3 |
| Рац. формула | NaHCO3 |
| Состояние | твёрдое |
| Молярная масса | 84,0066 г/моль |
| Плотность | 2,159 г/см³ |
| Температура | |
| • разложения | 60—200 °C |
| Растворимость | |
| • в воде | 9,59 г/100 мл |
| Рег. номер CAS | 144-55-8 |
| PubChem | 516892 |
| Рег. номер EINECS | 205-633-8 |
| SMILES | |
| InChI | |
| Кодекс Алиментариус | E500(ii) |
| RTECS | VZ0950000 |
| ChEBI | 32139 |
| ChemSpider | 8609 |
| ЛД50 | 4220 мг/кг |
| NFPA 704 |  |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |
 Медиафайлы на Викискладе Медиафайлы на Викискладе | |
Гидрокарбона́т на́трия (лат. Natrii hydrocarbonas), другие названия: бикарбона́т на́трия, ча́йная со́да, питьева́я или пищева́я сода, двууглеки́слый натрий — неорганическое соединение, натриевая кислая соль угольной кислоты с химической формулой NaHCO3.
В обычном виде — мелкокристаллический порошок белого цвета.
Используется в промышленности, пищевой промышленности, в кулинарии, в медицине как нейтрализатор химических ожогов кожи и слизистых оболочек концентрированными кислотами и для снижения кислотности желудочного сока. Также применяется в буферных растворах.
Гидрокарбонат натрия — кислая натриевая соль угольной кислоты. Проявляет все свойства соли сильного основания и слабой кислоты. В водных растворах имеет слабощелочную реакцию. В широком диапазоне концентраций в водном растворе pH раствора изменяется незначительно, на этом основано применение раствора вещества в качестве буферного раствора.
Реакция с кислотами[править | править код]
Гидрокарбонат натрия реагирует с кислотами с образованием соответствующей кислоте соли, например, хлорида натрия, сульфата натрия и угольной кислоты, которая в процессе реакции распадается на углекислый газ и воду, при этом углекислый газ выделяется из раствора в виде пузырьков:
- NaHCO3+HCl→NaCl+h3CO3,{\displaystyle {\mathsf {NaHCO_{3}+HCl\rightarrow NaCl+H_{2}CO_{3}}},}
- h3CO3→h3O+CO2↑,{\displaystyle {\mathsf {H_{2}CO_{3}\rightarrow H_{2}O+CO_{2}\uparrow }},}
- 2NaHCO3+h3SO4→Na2SO4+2h3O+2CO2↑.{\displaystyle {\mathsf {2NaHCO_{3}+H_{2}SO_{4}\rightarrow Na_{2}SO_{4}+2H_{2}O+2CO_{2}\uparrow }}.}
В быту обычно применяется реакция «гашения соды» уксусной кислотой, с образованием ацетата натрия или гашение лимонной кислотой с образование цитрата натрия, реакция с уксусной кислотой:
- NaHCO3+Ch4COOH→Ch4COONa+h3O+CO2↑.{\displaystyle {\mathsf {NaHCO_{3}+CH_{3}COOH\rightarrow CH_{3}COONa+H_{2}O+CO_{2}\uparrow }}.}
При температуре выше 60 °C гидрокарбонат натрия начинает распадаться на карбонат натрия, углекислый газ и воду (процесс разложения наиболее эффективен при 200 °C, при более высоких температурах карбонат натрия начинает распадаться на оксид натрия и углекислый газ):
- 2NaHCO3→60−200∘CNa2CO3+h3O+CO2↑.{\displaystyle {\mathsf {2NaHCO_{3}{\xrightarrow {60-200^{\circ }C}}Na_{2}CO_{3}+H_{2}O+CO_{2}\uparrow }}.}
При этом процессе выделения воды в виде водяного пара и углекислого газa масса исходного продукта уменьшается примерно на 37 %[источник не указан 435 дней].
В промышленности гидрокарбонат натрия получают аммиачно-хлоридным способом[1]. В концентрированный раствор хлорида натрия, насыщенный аммиаком, под давлением пропускают углекислый газ. В процессе синтеза происходят две реакции:
- Nh4+CO2+h3O→Nh5HCO3{\displaystyle {\mathsf {NH_{3}+CO_{2}+H_{2}O\rightarrow NH_{4}HCO_{3}}}}
- Nh5HCO3+NaCl→NaHCO3↓+Nh5Cl.{\displaystyle {\mathsf {NH_{4}HCO_{3}+NaCl\rightarrow NaHCO_{3}\downarrow +NH_{4}Cl}}.}
В холодной воде гидрокарбонат натрия мало растворим, и его отделяют от охлаждённого раствора фильтрованием, а из полученного после фильтрования раствора хлорида аммония снова получают аммиак, возвращаемый в производство вновь:
- 2Nh5Cl+Ca(OH)2→2Nh4↑+CaCl2+2h3O.{\displaystyle {\mathsf {2NH_{4}Cl+Ca(OH)_{2}\rightarrow 2NH_{3}\uparrow +CaCl_{2}+2H_{2}O}}.}
Двууглекислый натрий (бикарбонат) применяется в химической, пищевой, лёгкой, медицинской, фармацевтической промышленности, цветной металлургии, в быту. Зарегистрирован в качестве пищевой добавки E500 (ii), входит в состав пищевой добавки E500.
В химической промышленности[править | править код]
Применяется для производства красителей, пенопластов и других органических продуктов, фторорганических соединений, продуктов бытовой химии, наполнителей в огнетушителях, Реагент для отделения диоксида углерода, сероводорода из газовых смесей, например, отходящих газов топливосжигающих установок. В этом процессе углекислый газ поглощается раствором гидрокарбоната натрия при повышенном давлении и пониженной температуре, далее поглощённый углекислый газ выделяется из раствора при подогреве и снижении давления;
В лёгкой промышленности — в производстве резины для подошв обуви и в производстве искусственных кож, кожевенном производстве при дублении и нейтрализации кожи после кислого дубления, текстильной промышленности при отделке шёлковых и хлопчатобумажных тканей;
В пищевой промышленности — в хлебопечении, производстве кондитерских изделий, приготовлении газированных напитков.
В кулинарии[править | править код]

Основное применение пищевой соды в пищевой промышленности и в быту — кулинария, где применяется, преимущественно, в качестве основного или дополнительного разрыхлителя в составе кислого и пресного теста. При добавлении питьевой соды в кислое тесто происходит реакция с молочной кислотой, продуцированной при заквашивании дрожжевыми микроорганизмами, при этой реакции выделяется углекислый газ, вспучивающий тесто.
При добавлении в пресное тесто углекислый газ выделяется при выпечке из-за термического разложения.
При применении соды в чистом виде важно соблюсти правильную дозировку, так как она оставляет в продукте карбонат натрия, дающий определённый привкус. Порядок замешивания для теста: соду — в муку, кислые компоненты (уксус, кефир и пр.) — в жидкость.
В медицине[править | править код]
Традиционно раствор питьевой соды используется для дезинфекции зубов и дёсен при зубных болях[2] и полости рта и горла, при сильном кашле, ангине, фарингите[3], а также как общепринятое средство от изжоги и болей в желудке.
Применяется при заболеваниях, сопровождающиеся выраженным ацидозом (при диабете, инфекциях и др), для борьбы с ацидозом при хирургических вмешательствах (назначается 3-5 г. внутрь)[4].
Применяется в качестве антиаритмического средства[4].
Как антацидное средство (как и все другие щелочи) применяется при язвенной болезни желудка, и двенадцатиперстной кишки, при повышенной кислотности желудочного сока[4].
Имеются так же данные о применении препарата (в виде капельных и внутривенных вливаний) при гипертонической болезни, симптоматической почечной гипертонии[5], и хронической почечной недостаточности[6]. Эффект связан с увеличением выделения ионов натрия и хлора и возрастанием осмотического диуреза[4].
В виде свечей применяется против укачивания при морской и воздушной болезнях[4]
Применяется в качестве отхаркивающего средства, т.к. повышая щелочные резервы крови, сдвигает в щелочную сторону реакцию бронхиальной слизи, делая мокроту менее вязкой[4].
При ринитах, конъюнктивитах, стоматитах, ларингитах и т.п. применяют для полосканий, промываний, ингаляций 0,5 — 2% р-ры гидрокарбоната натрия[4].
Применяется внутривенно с целью быстрого устранения метаболического ацидоза во время реанимационных мероприятий, заболеваниях почек[4].
Нужно иметь ввиду, что в результате применения может возникнуть т.н. кислотный рикошет (при реакции содой с соляной кислотой происходит выделение CO2, который оказывает раздражающее действие на стенку желудка, усиливая выделение гастрина[4]).
В альтернативной медицине питьевая сода иногда заявляется как «лекарство» от рака, однако, никакой экспериментально подтверждённой эффективности применения такого «лечения» не существует[7].
Противопоказания к применению в медицинских целях[править | править код]
Индивидуальная гиперчувствительность; состояния, сопровождающиеся развитием алкалоза; гипокальциемия, при приеме внутрь усиливает алкалоз и повышает риск развития тетанических судорог, гипохлоремия — снижение концентрации в крови ионов Cl—, в том числе вызванная рвотой, или снижением всасывания в желудочно-кишечном тракте, может привести к тяжёлому алкалозу.
Является источником натрия, тем самым увеличивая объём циркулирующей крови, усугубляя отёки и повышая артериальное давление. Применение при сниженной скорости клубочковой фильтрации может привести к метаболическому алкалозу.
Пожаротушение[править | править код]
Гидрокарбонат натрия вместе с карбонатом аммония используется в качестве наполнителя в огнетушителях с сухим наполнением и в стационарных системах сухого пожаротушения. Это применение обусловлено тем, что от воздействия высокой температуры в очаге горения вещество выделяет углекислый газ, атмосфера которого затрудняет доступ кислорода воздуха в очаг горения.
В быту[править | править код]
Применяется как безопасное для здоровья средство для чистки поверхностей столовой и кухонной посуды, поверхностей кухонных столов, иных поверхностей, соприкасающихся с пищей, путем протирки их с помощью влажной тряпки с сухим порошком питьевой соды.
В транспорте[править | править код]
Применяется для нейтрализации следов электролита — серной кислоты на поверхности пластмассовых корпусов свинцовых аккумуляторов насыщенным водным раствором питьевой соды.
В Российской Федерации двууглекислый натрий выпускается в соответствии с требованиями[8] и техническими условиями[9], выпускается на предприятиях АО «Башкирская содовая компания» в г. Стерлитамак, Республика Башкортостан, а также на Крымском содовом заводе в г. Красноперекопск, Крымский полуостров[10].
Гидрокарбонат натрия хранят в закрытых упаковках, в сухом месте вдали от источников огня. Гарантийный срок хранения натрия двууглекислого — 12 месяцев со дня изготовления. Срок годности не ограничен.
Вещество нетоксично, пожаро- и взрывобезопасно.
Имеет солоноватый, мыльный вкус. При попадании пыли вещества на слизистые оболочки глаз и носа вызывает лёгкое раздражение. При частой работе в атмосфере, загрязнённой пылью двууглекислого натрия, может возникнуть раздражение верхних дыхательных путей. Предельно допустимая концентрация пыли бикарбоната натрия в воздухе производственных помещений 5 мг/м3[11].
- ↑ Глинка Н. Л. Общая химия. — М.: «Химия», 1977, переработанное. — С. 441. — 720 с.
- ↑ Полоскание при зубной боли — рекомендации » Аденто.ру
- ↑ Полоскание рта содой как средство от воспалений
- ↑ 1 2 3 4 5 6 7 8 9 Машковский М.Д. Лекарственные средства (пособие по фармокотерапии для врачей). — Медицина, 1998. — С. 112. — 688 с.
- ↑ Шульцев Г.П., Захарченко В.Н., Барицкий В.Н. и др. К применению гидрокарбоната натрия при гипертонической болезни и почечных гипертониях.. — Киев: Клиническая медицина №10, 1974. — С. 134-138.
- ↑ Рябов С.И. Современные методы лечения хронической почечной недостаточности.. — Киев: Клиническая медицина №10, 1974. — С. 134-138.
- ↑ Sodium Bicarbonate (копия Archive.org) // American Cancer Society, 11/28/2008 (англ.): «Available peer-reviewed medical journals do not support claims that sodium bicarbonate works as a cancer treatment.»
- ↑ ГОСТ 2156-76 «Натрий двууглекислый. Технические условия» и ГОСТ 32802-2014
- ↑ «Добавки пищевые. Натрия карбонаты Е500. Общие технические условия» на предприятии «Сода»
- ↑ Данный объект расположен на территории Крымского полуострова, бо́льшая часть которого является объектом территориальных разногласий между Россией, контролирующей спорную территорию, и Украиной, в пределах признанных международным сообществом границ которой спорная территория находится. Согласно федеративному устройству России, на спорной территории Крыма располагаются субъекты Российской Федерации — Республика Крым и город федерального значения Севастополь. Согласно административному делению Украины, на спорной территории Крыма располагаются регионы Украины — Автономная Республика Крым и город со специальным статусом Севастополь.
- ↑ ГОСТ 2156-76 «Натрий двууглекислый. Технические условия» Архивная копия от 13 января 2010 на Wayback Machine
- ГОСТ 2156-76. Натрий двууглекислый. Технические условия (с Изменениями № 1, 2, 3, 4).
- ГОСТ 32802-2014. Добавки пищевые. Натрия карбонаты E500. Общие технические условия.
ru.wikipedia.org




