Хлорат натрия — Википедия
Материал из Википедии — свободной энциклопедии
Текущая версия страницы пока не проверялась опытными участниками и может значительно отличаться от версии, проверенной 19 апреля 2018; проверки требуют 3 правки. Текущая версия страницы пока не проверялась опытными участниками и может значительно отличаться от версии, проверенной 19 апреля 2018; проверки требуют 3 правки.| Хлорат натрия | |
|---|---|
 ( {{{картинка}}}) | |
 ( ({{{изображение}}}) | |
| Систематическое наименование | Хлорат натрия |
| Традиционные названия | Хлорноватокислый натрий |
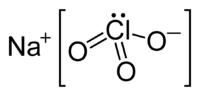
| Хим. формула | NaClO3 |
| Состояние | бесцветные кристаллы |
| Молярная масса | 106,44 г/моль |
| Плотность | 2,490; 2,493 г/см³ |
| Температура | |
| • плавления | 255; 261; 263 °C |
| • кипения | разл. 390 °C |
| Мол. теплоёмк. | 100,1 Дж/(моль·К) |
| Энтальпия | |
| • образования | -358 кДж/моль |
| Растворимость | |
| • в воде | 100,525; 204100 г/100 мл |
| • в этилендиамине | 52,8 г/100 мл |
| • в диметилформамиде | 23,4 г/100 мл |
| • в моноэтаноламине | 19,7 г/100 мл |
| • в ацетоне | 0,094 г/100 мл |
| Рег. номер CAS | 7775-09-9 |
| PubChem | 516902 |
| Рег. номер EINECS | 231-887-4 |
| SMILES | |
| InChI | |
| RTECS | FO0525000 |
| ChEBI | 65242 |
| NFPA 704 |  |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |
 Медиафайлы на Викискладе Медиафайлы на Викискладе | |
Хлорат натрия — неорганическое соединение, соль металла натрия и хлорноватой кислоты с формулой NaClO3, бесцветные кристаллы, хорошо растворимые в воде.
- Na2CO3+2 HClO3 → 2 NaClO3+h3O+CO2↑{\displaystyle {\mathsf {Na_{2}CO_{3}+2\ HClO_{3}\ {\xrightarrow {\ }}\ 2\ NaClO_{3}+H_{2}O+CO_{2}\uparrow }}}
- 6 NaOH+3 Cl2 → NaClO3+5 NaCl+3 h3O{\displaystyle {\mathsf {6\ NaOH+3\ Cl_{2}\ {\xrightarrow {\ }}\ NaClO_{3}+5\ NaCl+3\ H_{2}O}}}
- 6 NaCl+3 h3O →e− NaClO3+5 NaCl+3 h3↑{\displaystyle {\mathsf {6\ NaCl+3\ H_{2}O\ {\xrightarrow {e^{-}}}\ NaClO_{3}+5\ NaCl+3\ H_{2}\uparrow }}}
Хлорат натрия — бесцветные кристаллы кубической сингонии, пространственная группа P 213, параметры ячейки a = 0,6568 нм, Z = 4.
При 230-255°С переходит в другую фазу, при 255-260°С переходит в моноклинную фазу.
- 10 NaClO3 →390−520oC 6 NaClO4+4 NaCl+3 O2↑{\displaystyle {\mathsf {10\ NaClO_{3}\ {\xrightarrow {390-520^{o}C}}\ 6\ NaClO_{4}+4\ NaCl+3\ O_{2}\uparrow }}}
- Хлорат натрия — сильный окислитель, в твёрдом состоянии в смеси с углеродом, серой и другими восстановителями детонирует при нагревании или ударе.
- Хлорат натрия нашел применение в пиротехнике.
- Дефолиант.
- В целлюлозно-бумажной промышленности используется для производства диоксида хлора, отбеливателя целлюлозы.
- Химическая энциклопедия / Редкол.: Кнунянц И.Л. и др.. — М.: Советская энциклопедия, 1992. — Т. 3. — 639 с. — ISBN 5-82270-039-8.
- Справочник химика / Редкол.: Никольский Б.П. и др.. — 2-е изд., испр. — М.-Л.: Химия, 1966. — Т. 1. — 1072 с.
- Справочник химика / Редкол.: Никольский Б.П. и др.. — 3-е изд., испр. — Л.: Химия, 1971. — Т. 2. — 1168 с.
- Рипан Р., Четяну И. Неорганическая химия. Химия металлов. — М.: Мир, 1971. — Т. 1. — 561 с.
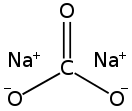
Карбонат натрия — Википедия
| Карбонат натрия | |||
|---|---|---|---|
| |||
({{{изображение}}}) | |||
| Систематическое наименование | Карбонат натрия | ||
| Традиционные названия | кальцинированная сода, углекислый натрий | ||
| Хим. формула | Na2CO3 | ||
| Молярная масса | 105,99 г/моль | ||
| Плотность | 2,53 г/см³ | ||
| Температура | |||
| • плавления | 854 °C | ||
| • разложения | 1000 °C | ||
| Константа диссоциации кислоты pKa{\displaystyle pK_{a}} | 10,33 | ||
| Растворимость | |||
| • в воде при 20 °C | 21,8 г/100 мл | ||
| Рег. номер CAS | 497-19-8 | ||
| PubChem | 10340 | ||
| Рег. номер EINECS | 207-838-8 | ||
| SMILES | |||
| InChI | |||
| Кодекс Алиментариус | E500(i) | ||
| RTECS | VZ4050000 | ||
| ChEBI | 29377 | ||
| ChemSpider | 9916 | ||
| ЛД50 | 4 г/кг (крысы, орально) | ||
| Пиктограммы СГС |  | ||
| NFPA 704 |  | ||
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |||
 Медиафайлы на Викискладе Медиафайлы на Викискладе | |||
Карбона́т на́трия (кальцинированная сода) — неорганическое соединение, натриевая соль угольной кислоты с химической формулой Na2CO3. Бесцветные кристаллы или белый порошок, хорошо растворимый в воде. В промышленности в основном получают из хлорида натрия по методу Солвэ. Применяют при изготовлении стекла, для производства моющих средств, используют в процессе получения алюминия из бокситов и при очистке нефти.
Имеет вид бесцветных кристаллов или белого порошка. Существует в нескольких разных модификациях: α-модификация с моноклинной кристаллической решеткой образуется при температуре до 350 °C, затем, при нагреве выше этой температуры и до 479 °C осуществляется переход в β-модификацию, также имеющую моноклинную кристаллическую решетку. При увеличении температуры выше 479 °C соединение переходит γ-модификацию с гексагональной решеткой. Плавится при 854 °C, при нагреве выше 1000 °C разлагается с образованием оксида натрия и диоксида углерода[1][2].
Кристаллогидраты карбоната натрия существуют в разных формах: бесцветный моноклинный Na2CO3·10H2O, при 32,017 °C переходит в бесцветный ромбический Na2CO3·7H2O, последний при нагревании до 35,27 °C бесцветный переходит в ромбический Na
| Параметр | Безводный карбонат натрия | Декагидрат Na2CO3·10H2O |
|---|---|---|
| Молекулярная масса | 105,99 а. е. м. | 286,14 а. е. м. |
| Температура плавления | 854 °C | 32 °C |
| Растворимость | Не растворим в ацетоне, и сероуглероде, малорастворим в этаноле, хорошо растворим в глицерине и воде | |
| Плотность ρ | 2,53 г/см³ (при 20 °C) | 1,446 г/см³ (при 17 °C) |
| −1131 кДж/моль (т) (при 297 К) | −4083,5 кДж/моль ((т) (при 297 К) | |
| Стандартная энергия Гиббса образования G | −1047,5 кДж/моль (т) (при 297 К) | −3242,3 кДж/моль ((т) (при 297 К) |
| Стандартная энтропия образования S | 136,4 Дж/моль·K (т) (при 297 К) | |
| Стандартная мольная теплоёмкость Cp | 109,2 Дж/моль·K (жг) (при 297 К) |
| Температура, °C | 0 | 10 | 20 | 25 | 30 | 40 | 50 | 60 | 80 | 100 | 140 | |
| Растворимость, г Na2CO3 на 100 г H2O | 7 | 12,2 | 21,8 | 29,4 | 39,7 | 48,8 | 47,3 | 46,4 | 45,1 | 44,7 | 42,7 | 39,3 |
В водном растворе карбонат натрия гидролизуется, что обеспечивает щелочную реакцию среды. Уравнение гидролиза (в ионной форме):
- CO32−+h3O⇄HCO3−+OH−{\displaystyle {\mathsf {CO_{3}^{2-}+H_{2}O\rightleftarrows HCO_{3}^{-}+OH^{-}}}}
Первая константа диссоциации угольной кислоты равна 4,5⋅10−7. Все кислоты, более сильные, чем угольная, вытесняют её в реакции с карбонатом натрия. Так как угольная кислота крайне нестойкая, она тут же разлагается на воду и углекислый газ:
- Na2CO3+h3SO4→Na2SO4+h3O+CO2↑{\displaystyle {\mathsf {Na_{2}CO_{3}+H_{2}SO_{4}\rightarrow Na_{2}SO_{4}+H_{2}O+CO_{2}\uparrow }}}
В природе сода встречается в золе некоторых морских водорослей, а также в виде минералов:
Современные содовые озёра известны в Забайкалье и в Западной Сибири; большой известностью пользуется озеро Натрон в Танзании и озеро Сирлс в Калифорнии[3][неавторитетный источник?]. Трона, имеющая промышленное значение, открыта в 1938 в составе эоценовой толщи Грин-Ривер (Вайоминг, США). Вместе с троной в этой осадочной толще обнаружено много ранее считавшихся редкими минералов, в том числе давсонит, который рассматривается как сырьё для получения соды и глинозёма. В США природная сода удовлетворяет более 40 % потребности страны в этом полезном ископаемом.
До начала XIX века карбонат натрия получали преимущественно из золы некоторых морских водорослей, прибрежных и солончаковых растений путём перекристаллизации относительно малорастворимого NaHCO3 из щёлока.
Способ Леблана[править | править код]
В 1791 году французский химик Никола Леблан получил патент на «Способ превращения глауберовой соли в соду». По этому способу при температуре около 1000 °C запекается смесь сульфата натрия («глауберовой соли»), мела или известняка (карбоната кальция) и древесного угля. Уголь восстанавливает сульфат натрия до сульфида:
- Na2SO4+2C→Na2S+2CO2{\displaystyle {\mathsf {Na_{2}SO_{4}+2C\rightarrow Na_{2}S+2CO_{2}}}}
Сульфид натрия реагирует с карбонатом кальция:
- Na2S+CaCO3→Na2CO3+CaS{\displaystyle {\mathsf {Na_{2}S+CaCO_{3}\rightarrow Na_{2}CO_{3}+CaS}}}
Полученный расплав обрабатывают водой, при этом карбонат натрия переходит в раствор, сульфид кальция отфильтровывают, затем раствор карбоната натрия упаривают. Сырую соду очищают перекристаллизацией. Процесс Леблана даёт соду в виде кристаллогидрата (см. выше), поэтому полученную соду обезвоживают кальцинированием.
Сульфат натрия получали обработкой каменной соли (хлорида натрия) серной кислотой:
- 2NaCl+h3SO4→Na2SO4+2HCl{\displaystyle {\mathsf {2NaCl+H_{2}SO_{4}\rightarrow Na_{2}SO_{4}+2HCl}}}
Выделявшийся в ходе реакции хлороводород улавливали водой с получением соляной кислоты.
Первый содовый завод такого типа в России был основан промышленником М. Прангом и появился в Барнауле в 1864 году.
После появления более экономичного (не остаётся в больших количествах побочный сульфид кальция) и технологичного способа Сольве, заводы, работающие по способу Леблана, стали закрываться. К 1900 году 90 % предприятий производили соду по методу Сольве, а последние фабрики, работающие по методу Леблана, закрылись в начале 1920-х.
Промышленный аммиачный способ (способ Сольве)[править | править код]
 Карбонат натрия
Карбонат натрияВ 1861 году бельгийский инженер-химик Эрнест Сольве запатентовал метод производства соды, который используется и по сей день.
В насыщенный раствор хлорида натрия пропускают эквимолярные количества газообразных аммиака и диоксида углерода, то есть как бы вводят гидрокарбонат аммония NH4HCO3:
- Nh4+CO2+h3O+NaCl→NaHCO3+Nh5Cl{\displaystyle {\mathsf {NH_{3}+CO_{2}+H_{2}O+NaCl\rightarrow NaHCO_{3}+NH_{4}Cl}}}
Выпавший остаток малорастворимого (9,6 г на 100 г воды при 20 °C) гидрокарбоната натрия отфильтровывают и кальцинируют (обезвоживают) нагреванием до 140—160 °C, при этом он переходит в карбонат натрия:
- 2NaHCO3→otNa2CO3+h3O+CO2↑{\displaystyle {\mathsf {2NaHCO_{3}{\xrightarrow[{}]{^{o}t}}Na_{2}CO_{3}+H_{2}O+CO_{2}\uparrow }}}
Образовавшийся CO2 возвращают в производственный цикл. Хлорид аммония NH4Cl обрабатывают гидроксидом кальция Ca(OH)2:
- 2Nh5Cl+Ca(OH)2→CaCl2+2Nh4+2h3O{\displaystyle {\mathsf {2NH_{4}Cl+Ca(OH)_{2}\rightarrow CaCl_{2}+2NH_{3}+2H_{2}O}}}
Полученный NH3 также возвращают в производственный цикл.
Таким образом, единственным отходом производства является хлорид кальция.
Первый содовый завод такого типа в мире был открыт в 1863 в Бельгии; первый завод такого типа в России был основан в районе уральского города Березники фирмой «Любимов, Сольве и Ко» в 1883 году. Его производительность составляла 20 тысяч тонн соды в год. В 2010 году ФАС России отказала фирме Solvay в покупке этого завода, разрешив покупку группе Башкирская химия (ей также принадлежит завод Сода).[источник не указан 2870 дней]
До сих пор этот способ остаётся основным способом получения соды во всех странах.
Способ Хоу[править | править код]
Разработан китайским химиком Хоу (Hou Debang) в 1930-х годах. Отличается от процесса Сольве тем, что не использует гидроксид кальция.
По способу Хоу в раствор хлорида натрия при температуре 40 градусов подается диоксид углерода и аммиак. Менее растворимый гидрокарбонат натрия в ходе реакции выпадает в осадок (как и в методе Сольве). Затем раствор охлаждают до 10 градусов. При этом выпадает в осадок хлорид аммония, а раствор используют повторно для производства следующих порций соды.
Сравнение способов[править | править код]
По методу Хоу в качестве побочного продукта образуется NH4Cl вместо CaCl2 по методу Сольве.
Способ Сольве был разработан до появления процесса Габера, в то время аммиак был в дефиците, поэтому регенерировать его из NH4Cl было необходимо. Метод Хоу появился позже, необходимость регенерации аммиака уже не стояла так остро, соответственно, аммиак можно было не извлекать, а использовать его как азотное удобрение в виде соединения NH4Cl.
Тем не менее NH4Cl содержит хлор, избыток которого вреден для многих растений, поэтому использование NH4Cl в качестве удобрения ограничено. В свою очередь рис хорошо переносит избыток хлора, и в Китае, где применяется NH4Cl для рисоводства, метод Хоу, дающий NH4Cl в качестве побочного продукта, более широко представлен по сравнению с другими регионами.
В настоящее время в ряде стран практически весь искусственно производящийся карбонат натрия вырабатывается по методу Сольве (включая метод Хоу как модификацию), а именно в Европе 94 % искусственно производимой соды, во всем мире — 84 % (2000 год)[4].
Карбонат натрия используют в стекольном производстве; мыловарении и производстве стиральных и чистящих порошков; эмалей, для получения ультрамарина. Также он применяется для смягчения воды паровых котлов и вообще уменьшения жёсткости воды, для обезжиривания металлов и десульфатизации доменного чугуна. Карбонат натрия — исходный продукт для получения NaOH, Na2B4O7, Na2HPO4. Может использоваться в сигаретных фильтрах[5].
В пищевой промышленности карбонаты натрия зарегистрированы в качестве пищевой добавки E500, — регулятора кислотности, разрыхлителя, препятствующего комкованию и слёживанию. Карбонат натрия (кальцинированная сода, Na2CO3) имеет код 500i, гидрокарбонат натрия (пищевая сода, NaHCO3) — 500ii, их смесь — 500iii.
Одна из новейших технологий повышения нефтеотдачи пластов — АСП заводнение, в котором применяется сода в сочетании с ПАВ для снижения межфазного натяжения между водой и нефтью.
В фотографии используется в составе проявителей как ускоряющее средство[6].
Самостоятельно добавляется в моторное масло для предотвращения полимеризации. Концентрация 2 г на 1 л масла.[источник не указан 77 дней]
Предельно допустимая концентрация аэрозоли кальцинированной соды в воздухе производственных помещений — 2 мг/м3[1]. Кальцинированная сода относится к веществам 3-го класса опасности. Аэрозоль кальцинированной соды при попадании на влажную кожу и слизистые оболочки глаз и носа может вызвать раздражение, а при длительном воздействии ее — дерматит.
Сода — общее название технических натриевых солей угольной кислоты.
- Na2CO3 (карбонат натрия) — кальцинированная сода, бельевая сода
- Na2CO3·10H2O (декагидрат карбоната натрия, содержит 62,5 % кристаллизационной воды) — стиральная сода; иногда выпускается в виде Na2CO3·H2O или Na2CO3·7H2O
- NaHCO3 (гидрокарбонат натрия) — пищевая сода, натрий двууглекислый, бикарбонат натрия
«Сода» в европейских языках происходит, вероятно, от арабского «suwwad» — общего названия различных видов солянок, растений, из золы которых её добывали в средние века; существуют и другие версии[7]. Кальцинированная сода (карбонат натрия) называется так потому, что для получения её из бикарбоната последний «кальцинируют» (лат. calcinatio, от calx, по сходству с процессом обжига извести), то есть прокаливают.
Гидросульфат натрия — Википедия
Материал из Википедии — свободной энциклопедии
Текущая версия страницы пока не проверялась опытными участниками и может значительно отличаться от версии, проверенной 22 июля 2018; проверки требуют 4 правки. Текущая версия страницы пока не проверялась опытными участниками и может значительно отличаться от версии, проверенной 22 июля 2018; проверки требуют 4 правки.| Гидросульфат натрия | |
|---|---|
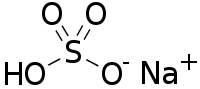 | |
| Систематическое наименование | Гидросульфат натрия |
| Традиционные названия | Кислый сернокислый натрий, бисульфат натрия |
| Хим. формула | NaHSO4 |
| Состояние | бесцветные кристаллы |
| Молярная масса | 120 г/моль |
| Плотность | 2,472 г/см³ |
| Температура | |
| • плавления | 186 °C |
| Растворимость | |
| • в воде | 28,60; 50100 г/100 мл |
| Рег. номер CAS | 7681-38-1 |
| PubChem | 516919 |
| Рег. номер EINECS | 231-665-7 |
| SMILES | |
| InChI | |
| Кодекс Алиментариус | E514(ii) |
| RTECS | VZ1860000 |
| ChemSpider | 56397 |
| NFPA 704 |  |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |
 Медиафайлы на Викискладе Медиафайлы на Викискладе | |
Гидросульфа́т на́трия — кислая соль натрия и серной кислоты с формулой NaHSO4, бесцветные кристаллы. Образует кристаллогидрат NaHSO4·H2O.
- NaOH+h3SO4 → NaHSO4+h3O{\displaystyle {\mathsf {NaOH+H_{2}SO_{4}\ {\xrightarrow {\ }}\ NaHSO_{4}+H_{2}O}}}
- Na2SO4+h3SO4 → 2NaHSO4{\displaystyle {\mathsf {Na_{2}SO_{4}+H_{2}SO_{4}\ {\xrightarrow {\ }}\ 2NaHSO_{4}}}}
- Гидросульфат натрия образует бесцветные кристаллы триклинной сингонии, пространственная группа P 1, параметры ячейки a = 0,7005 нм, b = 0,7125 нм, c = 0,6720 нм, α = 95,93°, β = 92,31°, γ = 75,52°, Z = 4. При нагревании претерпевает два полиморфных перехода при 140 и 170 °C.
- Кристаллогидрат гидросульфата натрия — бесцветные гигроскопические кристаллы моноклинной сингонии, пространственная группа A a, параметры ячейки a = 0,8213 нм,
- 2NaHSO4 →250oC Na2S2O7+h3O{\displaystyle {\mathsf {2NaHSO_{4}\ {\xrightarrow {250^{o}C}}\ Na_{2}S_{2}O_{7}+H_{2}O}}}
- При подщелачивании гидросульфат натрия переходит в сульфат:
- NaHSO4+NaOH → Na2SO4+h3O{\displaystyle {\mathsf {NaHSO_{4}+NaOH\ {\xrightarrow {\ }}\ Na_{2}SO_{4}+H_{2}O}}}
- При спекании гидросульфат натрия взаимодействует с солями:
- NaHSO4+NaCl →450−800oC Na2SO4+HCl↑{\displaystyle {\mathsf {NaHSO_{4}+NaCl\ {\xrightarrow {450-800^{o}C}}\ Na_{2}SO_{4}+HCl\uparrow }}}
- и оксидами:
- 2NaHSO4+CuO →450oC CuSO4+Na2SO4+h3O↑{\displaystyle {\mathsf {2NaHSO_{4}+CuO\ {\xrightarrow {450^{o}C}}\ CuSO_{4}+Na_{2}SO_{4}+H_{2}O\uparrow }}}
- Как флюс в цветной металлургии.
- Как реагент для перевода труднорастворимых окислов в растворимые сульфаты.
- Зарегистрирован в качестве пищевой добавки E514.
- в виде порошка или гранул в качестве реагента, понижающего уровень рН в бассейнах
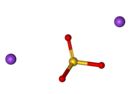
Сульфит натрия — Википедия
| Сульфит натрия | |||
|---|---|---|---|
| |||
 ( ({{{изображение}}}) | |||
| Хим. формула | Na2SO3 | ||
| Молярная масса | 126,037 г/моль | ||
| Плотность | 2,633 г/см³ | ||
| Температура | |||
| • плавления | 500 °C[1] | ||
| • разложения | 600 °C[1] | ||
| Растворимость | |||
| • в воде | 14,29 г/100 мл (0 °С) 26,10 г/100 мл (20 °С) 36,99 г/100 мл (40 °С) 29,20 г/100 мл (80 °С) | ||
| Рег. номер CAS | 7757-83-7 | ||
| PubChem | 24437 | ||
| Рег. номер EINECS | 231-821-4 | ||
| SMILES | |||
| InChI | |||
| Кодекс Алиментариус | E221 | ||
| RTECS | WE2150000 | ||
| ChEBI | 86477 | ||
| ChemSpider | 22845 | ||
| Токсичность | умеренная | ||
| NFPA 704 |  | ||
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |||
 Медиафайлы на Викискладе Медиафайлы на Викискладе | |||
Сульфи́т на́трия (сернистокислый натрий) — неорганическое соединение, соль натрия и сернистой кислоты с формулой Na2SO3. Применяют в фотографии, при изготовлении тканей и вискозного волокна, при обработке руд цветных металлов и для обезвреживания сточных вод.
В фотографии впервые было использовано в 1882 году Х. Б. Беркли для пирогаллоловых проявителей с целью уменьшить пятна, возникающие на фотоматериале в процессе обработки. С 1882 года многие составы включали в себя сульфитные ионы, как правило с целями защиты проявителя от окисления, но в целом роль этих ионов была малопонятна и только спустя годы исследований удалось выявить значительный ряд функций этого соединения в составе проявляющих растворов[2].
Соединение имеет вид бесцветных кристаллов гексагональной сингонии с параметрами: a=0,5459 нм, с=0,6160 нм, z=2, пространственная группа C3. Плотность 2,633 г/см3. Растворим в воде, при этом с ростом температуры растворимость сначала растет (в 100 г воды): 14,29 г (при 0 °C), 26,10 г (при 20 °C), 36,99 г (при 40 °C), дальше падает: 29,20 г (при 80 °C). Предел температуры, после которой начинается уменьшение растворимости и начало кристаллизации — 33,4 °C[3].
Образует гептагидрат Na2SO3·7H2O при кристаллизации из водных растворов ниже 33,4 °C. Гептагидрат сульфита натрия имеет плотность 1,539 г/см3[3].
Сульфит натрия устойчив на воздухе при комнатной температуре, но при нагревании разлагается с образованием сульфата натрия и сульфида натрия, при этом при температуре выше 800 °C разложение идет до образования оксида натрия и диоксида серы[3].
Гептагидрат сульфита натрия во влажном воздухе легко окисляется до сульфата натрия, для замедления окисления используют ингибиторы — гидрохинон, пирогаллол, 1,4-фенилендиамин. В сухом воздухе гептагидрат не окисляется, но частично теряет кристаллизационную воду, полностью обезвоживаясь при температуре 150—160 °C[3].
Водные растворы сульфита натрия имеют щелочную реакцию, при их подкислении происходит выделение диоксида серы[4].
Сульфит натрия является сильным восстановителем. В водных растворах находится в частично гидролизованном состоянии, легко окисляется кислородом воздуха, перманганатом калия, бихроматом калия, бромом, иодом и другими окислителями до сульфата натрия. Растворы сульфита натрия поглощают диоксид серы, образуя гидросульфит натрия, а при кипячении присоединяют серу с образованием тиосульфата натрия. В кислых растворах хлорида титана (III), двуххлористого олова и хлорида железа (II) восстанавливается до дитионита натрия или до сульфида натрия[3].
Фотографические свойства[править | править код]
Многочисленные исследования свойств сульфита натрия в составе проявляющих растворов показали, что действие этого соединения не ограничивается узкой областью снижения количества пятен на эмульсии, образующихся в процессе обработки в некоторых окрашивающих проявителях, для чего это соединение было предложено изначально. Практически сразу сульфит натрия стал использоваться в своей роли основного универсального сохраняющего вещества, что было вызвано его многоаспектным действием на фотографические составы при всех этапах проявления и хранения растворов[5].
Антиоксидант[править | править код]
| Зависимость скорости окисления водного раствора смеси сульфита и метола при pH 6,6[6]. Ось X — доля сульфита в смеси; Ось Y — скорость поглощения O2, см3/мин. |
Основная роль сульфита натрия в составе фотографических проявляющих растворов заключается в защите органических проявляющих веществ от окисления кислородом воздуха. При высоком значении pH раствора проявляющее вещество в отсутствии сульфита быстро окисляется, становясь фотографически неактивным. Например, гидрохинон сначала превращается в хинон, вследствие чего раствор приобретает жёлтую окраску, а затем в фотографически неактивный оксихинон, окрашивающий раствор в тёмно-коричневый цвет. Небольшое количество сульфита натрия резко замедляет этот процесс за счет того, что вместо гидрохинона с кислородом в первую очередь будет реагировать сам сульфит с образованием сульфата натрия. Присутствие же органического проявляющего вещества, в свою очередь, является ингибитором процесса окисления сульфита кислородом[7].
Точный механизм ингибирования окисления органических проявляющих веществ неизвестен, но предполагается, что он обусловлен связыванием сульфитом натрия окрашенных окисленных форм проявляющих веществ, которые в несвязанном состоянии катализируют дальнейшее окисление своей неокисленной формы[7].
Окисление гидрохинона кислородом воздуха в растворах, содержащих сульфит натрия, будет происходить уже не с образованием хинона и оксихинона, а с образованием бесцветного добезилата натрия, который также является проявляющим веществом[7]:
 + O2 + 2 Na2SO3→h3O{\displaystyle {\ce {->[H_{2}O]}}}
+ O2 + 2 Na2SO3→h3O{\displaystyle {\ce {->[H_{2}O]}}}  + Na2SO4 + NaOH
+ Na2SO4 + NaOH
Разрыв цепи полимеризации[править | править код]
При проявлении гидрохиноном и его производными в растворе образуются семихиноны — высокоактивные и нестабильные соединения. Они имеют тенденцию к полимеризации в гуминовые кислоты, цепи которых в типичных условиях для фотографического проявления образуются из порядка 10 молекул окисленных остатков гидрохинона и имеют тёмную окраску. Так как на стадии образования семихинона сульфит реагирует с ним, то полимеризации, как правило, не происходит, а следовательно, не будет и каталитического воздействия данных полимерных соединений на неокисленную форму проявляющего вещества. Тем не менее, для пирогаллола сульфит не способен взаимодействовать с нерастворимыми окрашенными продуктами окисления, аналогично и для слабоокрашенных продуктов окисления фенидона и L-аскорбиновой кислоты[5].
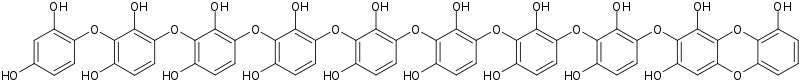 Гуминовая кислота, образующаяся из 10 молекул гидроксигидрохинона в безсульфитных проявителях по Х. Тилю и Х. Кеттнеру[5]
Гуминовая кислота, образующаяся из 10 молекул гидроксигидрохинона в безсульфитных проявителях по Х. Тилю и Х. Кеттнеру[5]Обесцвечивающий агент[править | править код]
Сульфит натрия в описанном выше процессе связывания окрашенных форм образует бесцветные соединения, вместо сильноокрашенных, тем самым снижая нежелательные пятна и окраску результирующего изображения[5].
Поддержание активности проявления[править | править код]
Окисленные остатки проявляющего вещества в растворе, хотя и непосредственно не реагируют с галогенидом серебра в эмульсии, но изменяют pH среды и другие её показатели, что может вести либо к нарастанию скорости проявления, либо к её спаду. Лишь немногие проявляющие вещества не дают подобного эффекта. Рост активности наблюдается в проработавших растворах проявляющих веществ, имеющих активные гидроксогруппы, например у глицина-фото. Если же проявляющее вещество имеет только аминогруппы, то скорость проявления будет падать. Превращение окисленных форм в сульфонаты при реакции с сульфитом стабилизирует и поддерживает активность, тем самым позволяя избегнуть нежелательного пере- или недопроявления
Сульфит натрия получают:
- взаимодействием растворов Na2CO3 с SO2:
- Na2CO3+SO2→Na2SO3+CO2{\displaystyle {\mathsf {Na_{2}CO_{3}+SO_{2}\rightarrow Na_{2}SO_{3}+CO_{2}}}}
- NaHSO3+NaOH→Na2SO3+h3O{\displaystyle {\mathsf {NaHSO_{3}+NaOH\rightarrow Na_{2}SO_{3}+H_{2}O}}}
- 2NaOH+SO2→Na2SO3+h3O{\displaystyle {\mathsf {2NaOH+SO_{2}\rightarrow Na_{2}SO_{3}+H_{2}O}}}
Безводную соль:
- 2NaHSO3+Ca(OH)2⟶CaSO3↓+Na2SO3+2h3O{\displaystyle {\ce {2NaHSO3 + Ca(OH)2 -> CaSO3v + Na2SO3 + 2h3O}}}
Применяют для удаления следов хлора после отбеливания тканей, для удаления серы из вискозного волокна после формования, как флотореагент для руд цветных металлов, в производстве пестицидов, для обезвреживания сточных вод, содержащих хром[3].
В фотографии используют как основное сохраняющее вещество в проявителях, входит в состав фиксажей и других растворов
Временно допустимая концентрация в воздухе 0,1 мг/м3[3].
- ↑ 1 2 SODIUM SULFITE
- ↑ Haist, 1979, с. 220.
- ↑ 1 2 3 4 5 6 7 8 Белоусова, 1992.
- ↑ Стасиневич, 1964.
- ↑ 1 2 3 4 5 Haist, 1979, с. 220—229.
- ↑ Редько, 2006, с. 857.
- ↑ 1 2 3 Редько, 2006, с. 856.
- ↑ Гурлев, 1988, с. 296.
- Белоусова А. П. Натрия сульфит : статья // Химическая энциклопедия / Гл. ред. Кнунянц И. Л. — М. : Большая Российская энциклопедия, 1992. — Т. 3: Меди — Полимерные. — С. 186. — 639 с. — ISBN 5-85270-039-8.
- Гурлев Д. С. Справочник по фотографии (обработка фотоматериалов). — К.: Тэхника, 1988. — ISBN 5-335-00125-4.
- Редько А. В. Химия фотографических процессов. — СПб. : НПО «Профессионал», 2006. — С. 837—954. — 1464 с. — (Новый справочник химика и технолога / ред. Москвин А. В. ; вып. Общие сведения. Строение вещества. Физические свойства важнейших веществ. Ароматические соединения. Химия фотографических процессов. Номенклатура органических соединений. Техника лабораторных работ. Основы технологии.). — ISBN 978-5-91259-013-9.
- Стасиневич Д. С. Натрия сульфит : статья // Краткая химическая энциклопедия / Редкол.: Кнунянц И. Л. (отв. ред.) и др.. — М. : Советская энциклопедия, 1964. — Т. 3: Мальтаза—Пиролиз. — С. 384.
- Haist G. M. Modern Photographic Processing. — New York, Chichester, Brisbane, Toronto: John Whiley and sons, 1979. — Т. 1. — (Photographic science and technology and graphic arts). — ISBN 0-471-02228-4.
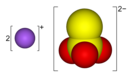
Тиосульфат натрия — Википедия
Материал из Википедии — свободной энциклопедии
| Тиосульфат натрия | |||
|---|---|---|---|
 ( ({{{картинка малая}}}) | |||
 ( ({{{изображение}}}) | |||
| Систематическое наименование | тиосульфат натрия | ||
| Традиционные названия | гипосульфит | ||
| Хим. формула | Na2S2O3, Na2S2O3·5H2O (кристаллогидрат) | ||
| Молярная масса | 158,11 г/моль | ||
| Плотность | 2,345 г/см³ | ||
| Температура | |||
| • плавления | 48,5 °С (пентагидрат) | ||
| • разложения | 300 °C[1] | ||
| Растворимость | |||
| • в воде | 70,120; 22980 г/100 мл | ||
| Рег. номер CAS | 7772-98-7 | ||
| PubChem | 24477 | ||
| Рег. номер EINECS | 231-867-5 | ||
| SMILES | |||
| InChI | |||
| Кодекс Алиментариус | E539 | ||
| RTECS | XN6476000 | ||
| ChEBI | 132112 | ||
| ChemSpider | 22885 | ||
| NFPA 704 |  | ||
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |||
 Медиафайлы на Викискладе Медиафайлы на Викискладе | |||
Тиосульфа́т на́трия (антихлор, гипосульфит, сульфидотриоксосульфат натрия, натрий серноватистокислый) — неорганическое соединение, соль натрия и тиосерной кислоты c химической формулой Na2S2O3 или Na2SO3S, образует кристаллогидрат состава Na2S2O3·5H2O. Применяется в медицине, фотографии и других отраслях промышленности.
- окислением полисульфидов Na;
- кипячение избытка серы с Na2SO3:
- Na2SO3+S→Na2S2O3{\displaystyle {\mathsf {Na_{2}SO_{3}+S\rightarrow Na_{2}S_{2}O_{3}}}}
- взаимодействием H2S и SO2 с NaOH (побочный продукт в производстве NaHSO3, сернистых красителей, при очистке промышленных газов от S):
- 4SO2+2h3S+6NaOH→3Na2S2O3+5h3O{\displaystyle {\mathsf {4SO_{2}+2H_{2}S+6NaOH\rightarrow 3Na_{2}S_{2}O_{3}+5H_{2}O}}}
- кипячение избытка серы с гидроксидом натрия:
- 4S+6NaOH→2Na2S+Na2S2O3+3h3O{\displaystyle {\mathsf {4S+6NaOH\rightarrow 2Na_{2}S+Na_{2}S_{2}O_{3}+3H_{2}O}}}
затем по приведённой выше реакции сульфит натрия присоединяет серу, образуя тиосульфат натрия.
Одновременно в ходе этой реакции образуются полисульфиды натрия (они придают раствору жёлтый цвет). Для их разрушения в раствор пропускают SO2.
- чистый безводный тиосульфат натрия можно получить реакцией серы с нитритом натрия в формамиде. Эта реакция количественно протекает (при 80 °C за 30 минут) по уравнению:
- 2NaNO2+2S→Na2S2O3+N2O{\displaystyle {\mathsf {2NaNO_{2}+2S\rightarrow Na_{2}S_{2}O_{3}+N_{2}O}}}
- 2Na2S+2O2+h3O→Na2S2O3+2NaOH{\displaystyle {\mathsf {2Na_{2}S+2O_{2}+H_{2}O\rightarrow Na_{2}S_{2}O_{3}+2NaOH}}}
Имеет вид бесцветных кристаллов. Образует три модификации: моноклинную α (a = 0,8513, b = 0,8158, c = 0,6425, β = 97,08°, z = 4, пространственная группа P21/c), а также β и γ. α-модификация переходит в β при температуре 330 °C, β переходит в γ при 380 °C. Плотность α-модификации 2,345 г/моль[2].
Растворим в воде (50,1 г/100 мл (0 °C), 70,2 г/100 мл (20 °C), 231,8 г/100 мл (80 °C))[2].
Молярная масса 248,17 г/моль (пентагидрат). При 48,5 °C кристаллогидрат растворяется в своей кристаллизационной воде, образуя перенасыщенный раствор; обезвоживается около 100оС.
При нагревании до 220 °C распадается по схеме:
- 4Na2S2O3→3Na2SO4+Na2S+4S{\displaystyle {\mathsf {4Na_{2}S_{2}O_{3}\rightarrow 3Na_{2}SO_{4}+Na_{2}S+4S}}}
Тиосульфат натрия — сильный восстановитель:
С сильными окислителями, например, свободным хлором, окисляется до сульфатов или серной кислоты:
- Na2S2O3+4Cl2+5h3O→2h3SO4+2NaCl+6HCl{\displaystyle {\mathsf {Na_{2}S_{2}O_{3}+4Cl_{2}+5H_{2}O\rightarrow 2H_{2}SO_{4}+2NaCl+6HCl}}}
Более слабыми или медленно действующими окислителями, например, иодом, переводится в соли тетратионовой кислоты:
- 2Na2S2O3+I2→Na2S4O6+2NaI{\displaystyle {\mathsf {2Na_{2}S_{2}O_{3}+I_{2}\rightarrow Na_{2}S_{4}O_{6}+2NaI}}}
Приведённая реакция очень важна, так как служит основой иодометрии. Следует отметить, что в щелочной среде окисление тиосульфата натрия иодом может идти до сульфата.
Выделить тиосерную кислоту (тиосульфат водорода) реакцией тиосульфата натрия с сильной кислотой невозможно, так как она неустойчива и тут же разлагается на воду, серу и диоксид серы:
- Na2S2O3+h3SO4→Na2SO4+h3O+S+SO2{\displaystyle {\mathsf {Na_{2}S_{2}O_{3}+H_{2}SO_{4}\rightarrow Na_{2}SO_{4}+H_{2}O+S+SO_{2}}}}
Расплавленный кристаллогидрат Na2S2O3·5H2O очень склонен к переохлаждению.
Сульфид натрия — Википедия
Материал из Википедии — свободной энциклопедии
Текущая версия страницы пока не проверялась опытными участниками и может значительно отличаться от версии, проверенной 3 августа 2018; проверки требуют 5 правок. Текущая версия страницы пока не проверялась опытными участниками и может значительно отличаться от версии, проверенной 3 августа 2018; проверки требуют 5 правок.Сульфид натрия, устар. сернистый натрий, — сложное неорганическое вещество с химической формулой Na2S.
Сульфид натрия — бескислородная соль. В обычном состоянии — порошок белого цвета, очень гигроскопичный. Плавится без разложения, термически устойчивый. Технический сульфид натрия желтоватый или коричневатый (красноватый) содержит в себе до 60 % сульфида натрия. Хорошо растворим в воде, гидролизуется по аниону, создает в растворе сильнощелочную среду. При стоянии на воздухе раствор мутнеет (коллоидная сера) и желтеет (окраска полисульфида). Типичный восстановитель. Присоединяет серу. Вступает в реакции ионного обмена.
В промышленности — прокаливание минерала мирабилит Na2SO4 · 10H2O.
- Na2SO4+4h3⟶Na2S+4h3O{\displaystyle {\mathsf {Na_{2}SO_{4}+4H_{2}\longrightarrow Na_{2}S+4H_{2}O}}}
- Na2SO4+4C⟶Na2S+4CO{\displaystyle {\mathsf {Na_{2}SO_{4}+4C\longrightarrow Na_{2}S+4CO}}}
- Na2SO4+4CO⟶Na2S+4CO2{\displaystyle {\mathsf {Na_{2}SO_{4}+4CO\longrightarrow Na_{2}S+4CO_{2}}}}
Взаимодействует с разбавленной соляной кислотой:
Na2S+2HCl⟶2NaCl+h3S{\displaystyle {\mathsf {Na_{2}S+2HCl\longrightarrow 2NaCl+H_{2}S}}}
Взаимодействует с концентрированной серной кислотой:
Na2S+3h3SO4⟶SO2+S+2h3O+2NaHSO4{\displaystyle {\mathsf {Na_{2}S+3H_{2}SO_{4}\longrightarrow SO_{2}+S+2H_{2}O+2NaHSO_{4}}}}
Реагирует с водным раствором перманганата калия:
3Na2S+2KMnO4+4h3O⟶2MnO2+6NaOH+2KOH+3S{\displaystyle {\mathsf {3Na_{2}S+2KMnO_{4}+4H_{2}O\longrightarrow 2MnO_{2}+6NaOH+2KOH+3S}}}
В реакции с йодом оседает чистая сера:
Na2S+I2=2NaI+S{\displaystyle {\mathsf {Na_{2}S+I_{2}=2NaI+S}}}
Сульфид натрия применяется в производстве сернистых красителей и целлюлозы, для удаления волосяного покрова шкур при дублении кож, как реагент в аналитической химии, а так же на хим.водоочистке.
Сульфид натрия ядовит.
- Лидин Р. А. «Справочник школьника. Химия» М.: Астерель, 2003.
Натрий — это… Что такое Натрий?
| Внешний вид простого вещества | |
|---|---|
 Серебристо-белый мягкий металл Серебристо-белый мягкий металл | |
| Свойства атома | |
| Имя, символ, номер | Натрий/Natrium (Na), 11 |
| Атомная масса (молярная масса) | 22,989768 а. е. м. (г/моль) |
| Электронная конфигурация | [Ne] 3s1 |
| Радиус атома | 190 пм |
| Химические свойства | |
| Ковалентный радиус | 154 пм |
| Радиус иона | 97 (+1e) пм |
| Электроотрицательность | 0,93 (шкала Полинга) |
| Электродный потенциал | -2,71 в |
| Степени окисления | 1 |
| Энергия ионизации (первый электрон) | 495,6(5,14) кДж/моль (эВ) |
| Термодинамические свойства простого вещества | |
| Плотность (при н. у.) | 0,971 г/см³ |
| Температура плавления | 370,96 K (97,81°C) |
| Температура кипения | 1156,1 K (882,95°C) |
| Теплота плавления | 2,64 кДж/моль |
| Теплота испарения | 97,9 кДж/моль |
| Молярная теплоёмкость | 28,23[1] Дж/(K·моль) |
| Молярный объём | 23,7 см³/моль |
| Кристаллическая решётка простого вещества | |
| Структура решётки | кубическая объемноцентрированая |
| Параметры решётки | 4,2820 Å |
| Температура Дебая | 150 K(-123.15°C) |
| Прочие характеристики | |
| Теплопроводность | (300 K) 142,0 Вт/(м·К) |
На́трий — элемент главной подгруппы первой группы, третьего периода периодической системы химических элементов Д. И. Менделеева, с атомным номером 11. Обозначается символом Na (лат. Natrium). Простое вещество натрий (CAS-номер: 7440-23-5) — мягкий щелочной металл серебристо-белого цвета.
История и происхождение названия
Натрий (а точнее, его соединения) использовался с давних времён. Например, сода (натрон), встречается в природе в водах натронных озёр в Египте. Природную соду древние египтяне использовали для бальзамирования, отбеливания холста, при варке пищи, изготовлении красок и глазурей. Плиний Старший пишет, что в дельте Нила соду (в ней была достаточная доля примесей) выделяли из речной воды. Она поступала в продажу в виде крупных кусков, из-за примеси угля окрашенных в серый или даже чёрный цвет.
Название «натрий» происходит от латинского слова natrium (ср. др.-греч. νίτρον), которое было заимствовано из среднеегипетского языка (nṯr), где оно означало среди прочего: «сода», «едкий натр»[2].
Аббревиатура «Na» и слово natrium были впервые использованы академиком, основателем шведского общества врачей Йенсом Якобсом Берцелиусом (Jöns Jakob Berzelius, 1779—1848) для обозначения природных минеральных солей, в состав которых входила сода[3]. Ранее элемент именовался содием (лат. sodium). Название sodium, возможно, восходит к арабскому слову suda, означающему «головная боль», так как сода применялась в то время в качестве лекарства от головной боли[4].
Натрий впервые был получен английским химиком Хемфри Дэви в 1807 году электролизом расплава гидроксида натрия.
Нахождение в природе
Кларк натрия в земной коре 25 кг/т. Содержание в морской воде в виде соединений — 10,5 г/л[5]. Металлический натрий встречается как примесь, окрашивающая каменную соль в синий цвет. Данную окраску соль приобретает под действием радиации.
Получение
Промышленное получение натрия по способу Девилля, распространённое в 19 веке. AC — железная трубка со смесью соды, угля и мела; B — холодильник Донни и Мареска; R — приёмник с нефтью.Первым промышленным способом получения натрия стала карботермическая реакция восстановления карбоната натрия углем при нагревании тесной смеси этих веществ в железной ёмкости до 1000 °C (способ Девилля) [6]:
Аналогично, могут быть использованы карбид кальция, алюминий, кремний, ферросилиций, силикоалюминий. [7][8]
С появлением электроэнергетики стал более практичен другой способ получения натрия — электролиз расплава едкого натра или хлорида натрия. В настоящее время электролиз — основной способ получения натрия.
Натрий также можно получить циркониетермическим методом, а также термическим разложением азида натрия.
Физические свойства
Металлический натрий, сохраняемый в масле Качественное определение натрия с помощью пламени — ярко-жёлтый цвет эмиссионного спектра «D-линии натрия», дублет 588,9950 и 589,5924 нм.
Качественное определение натрия с помощью пламени — ярко-жёлтый цвет эмиссионного спектра «D-линии натрия», дублет 588,9950 и 589,5924 нм.Натрий — серебристо-белый металл[9], в тонких слоях с фиолетовым оттенком, пластичен, даже мягок (легко режется ножом), свежий срез натрия блестит. Величины электропроводности и теплопроводности натрия достаточно высоки, плотность равна 0,96842 г/см³ (при 19,7 °C), температура плавления 97,86 °C, температура кипения 883,15 °C.
Под давлением становится прозрачным и красным, как рубин[9].
При комнатной температуре натрий образует кристаллы в кубической сингонии, пространственная группа I m3m, параметры ячейки a = 0,42820 нм, Z = 2. При температуре -268°С (5 К) натрий переходит в гексагональную фазу, пространственная группа P 63/mmc, параметры ячейки a = 0,3767 нм, c = 0,6154 нм, Z = 2.
Химические свойства
Щелочной металл, на воздухе легко окисляется. Для защиты от кислорода воздуха металлический натрий хранят под слоем керосина.
При горении на воздухе или в кислороде образуется пероксид натрия:
С водой натрий реагирует очень бурно, реакция идёт с выделением водорода, который может самовоспламениться или взорваться, куски металла всплывают на поверхность и могут расплавиться:
Как и все щелочные металлы, натрий является сильным восстановителем и энергично взаимодействуют со многими неметаллами (за исключением азота, иода, углерода, благородных газов):
Натрий более активный чем литий. С азотом реагирует крайне плохо в тлеющем разряде, образуя очень неустойчивое вещество — нитрид натрия (в противоположность нитриду лития):
С разбавленными кислотами взаимодействует как обычный металл:
С концентрированными окисляющими кислотами выделяются продукты восстановления:
Растворяется в жидком аммиаке, образуя синий раствор:
С газообразным аммиаком взаимодействует при нагревании
С ртутью образует амальгаму натрия, которая используется как более мягкий восстановитель вместо чистого металла. При сплавлении с калием даёт жидкий сплав.
Алкилгалогениды с избытком металла могут давать натрийорганические соединения — высокоактивные соединения, которые обычно самовоспламеняются на воздухе и взрываются с водой.
Применение
Металлический натрий широко используется в препаративной химии и промышленности как сильный восстановитель, в том числе в металлургии. Используется для осушения органических растворителей, например, эфира. Натрий используется в производстве весьма энергоёмких натриево-серных аккумуляторов. Его также применяют в выпускных клапанах грузовиков как теплоотвод. Изредка металлический натрий применяется в качестве материала для электрических проводов, предназначенных для очень больших токов.
В сплаве с калием, а также с рубидием и цезием используется в качестве высокоэффективного теплоносителя. В частности, сплав состава натрий 12 %, калий 47 %, цезий 41 % имеет рекордно низкую температуру плавления −78 °C и был предложен в качестве рабочего тела ионных ракетных двигателей и теплоносителя для атомных энергоустановок.
Натрий также используется в газоразрядных лампах высокого и низкого давления (НЛВД и НЛНД). Лампы НЛВД типа ДНаТ (Дуговая Натриевая Трубчатая) очень широко применяются в уличном освещении. Они дают ярко-жёлтый свет. Срок службы ламп ДНаТ составляет 12-24 тысяч часов. Поэтому газоразрядные лампы типа ДНаТ незаменимы для городского, архитектурного и промышленного освещения. Также существуют лампы ДНаС, ДНаМТ (Дуговая Натриевая Матовая), ДНаЗ (Дуговая Натриевая Зеркальная) и ДНаТБР (Дуговая Натриевая Трубчатая Без Ртути).
Металлический натрий применяется в качественном анализе органического вещества. Сплав натрия и исследуемого вещества нейтрализуют этанолом, добавляют несколько миллилитров дистиллированной воды и делят на 3 части, проба Ж. Лассеня (1843), направлена на определение азота, серы и галогенов (проба Бейльштейна)
Хлорид натрия (поваренная соль) — древнейшее применяемое вкусовое и консервирующее средство.
Азид натрия (NaN3) применяется в качестве азотирующего средства в металлургии и при получении азида свинца.
Цианид натрия (NaCN) применяется при гидрометаллургическом способе выщелачивания золота из горных пород, а также при нитроцементации стали и в гальванотехнике (серебрение, золочение).
Хлорат натрия (NaClO3) применяется для уничтожения нежелательной растительности на железнодорожном полотне.
Изотопы натрия
В настоящее время (2012 г.) известно 20 изотопов с массовыми числами от 18 до 37 и 2 ядерных изомера натрия. Единственный стабильный изотоп 23Na. У большинства изотопов период полураспада меньше одной минуты. Существуют также 2 радиоактивных изотопа с большим периодом полураспада. Это претерпевающий позитронный распад 22Na с периодом полураспада 2,6027 года, его используют в качестве источника позитронов и в научных исследованиях. 24Na, с периодом полураспада электронного типа 15 часов, используется в медицине для диагностики и для лечения некоторых форм лейкемии.
Биологическая роль
В высших организмах натрий находится большей частью в межклеточной жидкости клеток (примерно в 15 раз больше чем в цитоплазме клетки). Разность концентраций поддерживает встроенный в мембраны клетки натрий-калиевый насос, откачивающий ионы натрия из цитоплазмы в межклеточную жидкость.
Совместно с калием натрий выполняет следующие функции:
- Создание условий для возникновения мембранного потенциала и мышечных сокращений.
- Поддержание осмотической концентрации крови.
- Поддержание кислотно-щелочного баланса.
- Нормализация водного баланса.
- Обеспечение мембранного транспорта.
- Активация многих энзимов.
Рекомендуемая доза натрия составляет для детей от 600 до 1700 миллиграммов, для взрослых от 1200 до 2300 миллиграммов в день. В виде поваренной соли это составляет от 3 до 6 граммов в день.
Натрий содержится практически во всех продуктах, хотя большую его часть организм получает из поваренной соли. Усвоение в основном происходит в желудке и тонкой кишке. Витамин Д улучшает усвоение натрия, однако, чрезмерно солёная пища и пища богатая белками препятствуют нормальному всасыванию. Количество поступившего с едой натрия показывает содержание натрия в моче. Для богатой натрием пищи характерна ускоренная экскреция.
Дефицит натрия у питающегося сбалансированной пищей человека не встречается, однако, некоторые проблемы могут возникнуть при вегетарианских диетах и голодании. Временный дефицит может быть вызван использованием мочегонных препаратов, поносом, обильным потением или избыточным употреблением воды. Симптомами нехватки натрия являются потеря веса, рвота, образование газов в желудочно-кишечном тракте, и нарушение усвоения аминокислот и моносахаридов. Продолжительный дефицит вызывает мышечные судороги и невралгию.
Переизбыток натрия вызывает отек ног и лица, а также повышенное выделение калия с мочой. Максимальное количество соли, которое может быть переработано почками составляет примерно 20-30 граммов, большее количество уже опасно для жизни.
Меры предосторожности
В лабораториях небольшие количества натрия (примерно до 1 кг) хранят в закрытых стеклянных банках под слоем керосина, так, чтобы керосин покрывал весь металл. Банка с натрием должна храниться в металлическом несгораемом шкафу (сейфе). Натрий берут пинцетом или щипцами, отрезают скальпелем (натрий пластичен и легко режется ножом) на сухой поверхности (не на столе, а в стеклянной чашке) необходимое количество и остаток тут же возвращают в банку под слой керосина, а отрезанный кусок либо помещают в сухой керосин, либо тут же вводят в реакцию. Прежде чем приступить к работе с натрием, необходимо пройти инструктаж по технике безопасности, лица, впервые приступающие к работе с натрием, должны производить эту работу под наблюдением сотрудников, имеющих опыт такой работы. Обычно в лабораторных условиях для реакций используют количества натрия, не превышающие нескольких десятков грамм. Для демонстративных опытов, например, в школе на уроках химии стоит брать не более одного грамма натрия. После работы с металлическим натрием всю посуду и остатки натрия заливают неразбавленным спиртом и полученный раствор нейтрализуют слабым раствором кислоты. Следует обратить особое внимание, чтобы все остатки и обрезки натрия были полностью нейтрализованы до их выбрасывания, так как натрий в мусорном ведре может вызвать пожар, а в канализационном сливе может вызвать разрушение трубы. Хранить натрий дома и производить с ним какие-либо опыты не рекомендуется.
Воспламенение и даже взрыв металлического натрия при соприкосновении с водой и многими органическими соединениями может нанести серьёзные травмы и ожоги. Попытка взять кусочек металлического натрия голыми руками может привести к его воспламенению (иногда взрыву) из-за влажности кожи и образованию тяжелейших ожогов натрием и образующейся щелочью. Горение натрия создает аэрозоль оксида, пероксида и гидроксида натрия, обладающего разъедающим действием. Некоторые реакции натрия протекают очень бурно (например, с серой, бромом).
Примечания
- ↑ Редкол.:Кнунянц И. Л. (гл. ред.) Химическая энциклопедия: в 5 т. — Москва: Советская энциклопедия, 1992. — Т. 3. — С. 178. — 639 с. — 50 000 экз. — ISBN 5—85270—039—8
- ↑ Петровский Н. С., ЕГИПЕТСКИЙ ЯЗЫК. Введение в иероглифику, лексику и очерк грамматики среднеегипетского языка. Л., 1958. (стр. 83)
- ↑ Thomas Thomson, Annals of Philosophy
- ↑ Newton, David E.. Chemical Elements. ISBN 0-7876-2847-6.
- ↑ J.P. Riley and Skirrow G. Chemical Oceanography V. 1, 1965
- ↑ Д.Менделеев, Основы химии, 7 изд., СПб, 1903, С.386.
- ↑ А. Ф. Алабышев, К. Д Грачев, С. А. Зарецкий, М. Ф. Лантратов, Натрий и калий (получение, свойства, применение), Л: Гос. н-т. изд-во хим. лит., 1959, С.255.
- ↑ А. Г. Морачевский, И. А. Шестеркин, В. Б. Буссе-Мачукас и др., Натрий. Свойства, производство, применение (Под. ред. А. Г. Морачевского), СПб: Химия, 1992, С.186. ISBN 5-7245-0760-9
- ↑ 1 2 Газета. Ру: Элементы под давлением
Ссылки
 Электрохимический ряд активности металлов Электрохимический ряд активности металлов | |
|---|---|
Eu, Sm, Li, Cs, Rb, K, Ra, Ba, Sr, Ca, Na, Ac, La, Ce, Pr, Nd, Pm, Gd, Tb, Mg, Y, Dy, Am, Ho, Er, Tm, Lu, Sc, Pu, Th, Np, U, Hf, Be, Al, Ti, Zr, Yb, Mn, V, Nb, Pa, Cr, Zn, Ga, Fe, Cd, In, Tl, Co, Ni, Te, Mo, Sn, Pb, H2, W, Sb, Bi, Ge, Re, Cu, Tc, Te, Rh, Po, Hg, Ag, Pd, Os, Ir, Pt, Au |
| ||||||||||||

 (
(
 (
(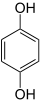 + O2 + 2 Na2SO3→h3O{\displaystyle {\ce {->[H_{2}O]}}}
+ O2 + 2 Na2SO3→h3O{\displaystyle {\ce {->[H_{2}O]}}} 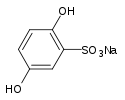 + Na2SO4 + NaOH
+ Na2SO4 + NaOH
 (
(