Оксид азота — применение, свойства, вред
Оксидом азота называется инертный газ, который не обладает ароматическими качествами и цветом. Есть несколько соединений:
- Оксид (I) несолеобразующий. При условии высокой концентрации может спровоцировать возбуждение нервной системы. По-другому его называют веселящим газом. Свое применение оксид азота нашел как наркоз слабого действия в медицине;
- Монооксид азота – это газ, не обладающий цветом. Свойством оксида азота (II) является слабая степень растворимости в воде;
- Оксид (III) – это жидкость, обладающая темно-синим цветом. В нормальных условиях проявляет неустойчивость. При условии взаимодействия с водой способен образовывать азотистую кислоту;
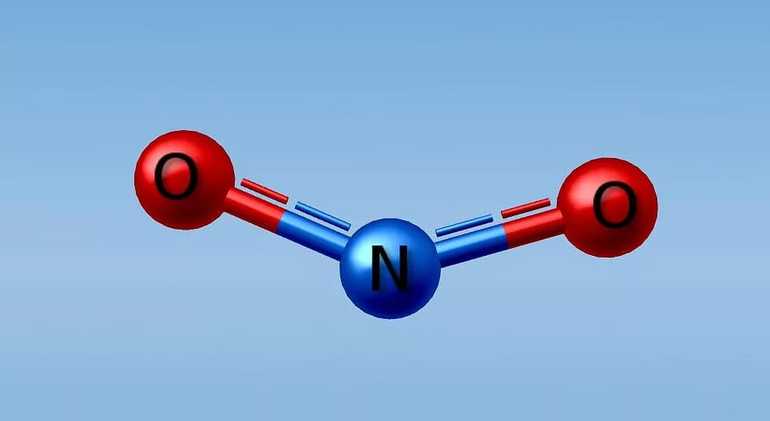
- Оксид (IV) обладает газообразной формой, его окрас – бурый. В таком состоянии вещество тяжелее воздуха, поэтому способно легко сжиматься. Одним из свойств оксида азота является способность взаимодействовать с водой и щелочными растворами;
- Оксид (V) является веществом в кристаллической форме без цвета. Проявляет свойства сильного окислителя.
Оксид азота как пищевая добавка обладает свойствами антифламинга и глазирователя. Данное соединение также известно под наименованиями азотистый ангидрид, несолеобразующий оксид, диоксид азота, азотный ангидрид, триоксид диазота, монооксид азота, пентаоксид диазота, тетраоксид диазота, нитрозилазид, тринитрамид.
Применение оксида азота
Соединение в качестве добавки к продуктам питания практически не используется. Свое применение оксид азота нашел при упаковке продуктов, используется с целью приготовления аэрозольных масел, для взбивания сливок.
Благодаря своим особым свойствам соединение используется как газ-спрей в медицинских флаконах. Благодаря способности проявлять наркозный эффект оксид применяется в хирургической практике.
Оксид азота в организме

Как было установлено за последние годы, молекула оксида азота имеет широкий спектр биологического влияния. Данное действие можно поделить на защитное, регуляторное и вредное.
Оксид принимает участие в регуляции систем межклеточной и внутриклеточной сигнализации. Кроме того, соединение ответственно за эндотелиальное расслабление гладкой мускулатуры, принимает участие в процессах репродуктивной, иммунной, нервной системах. Показывает цитостатические и цитотоксические свойства.
Оксид клетками иммунной системы используется для уничтожения клеток злокачественных опухолей и бактерий. В случае нарушения метаболизма и биосинтеза оксида азота развивается бронхиальная астма, ишемическая болезнь сердца, первичная легочная гипертензия, инфаркт миокарда, невротическая депрессия, сахарный диабет, нейродегенеративные заболевания, импотенция, эссенциальная артериальная гипертензия.
Оксид азота в спорте
Наверное, многие слышали о продуктах, которые способны активизировать выработку оксида азота. Данные продукты в сфере пищевых добавок стали весьма популярными. Считается, что за счет усиления выработки оксида увеличивается приток крови к мышцам скелета, что положительно сказывается на организме атлета.
Согласно данным ученых Техасского университета, стадия, которая ограничивает скорость ткани аминокислот, отвечает за транспорт через межклеточную жидкость и кровь. Это означает, что усиление притока крови к мышцам скелета совместно с увеличением концентрации аминокислот обеспечивает более интенсивное поглощение мышечными клетками аминокислот.
Вред оксида азота
Несмотря ни на что, оксиды азота вредны и опасны для человеческого здоровья. Вследствие этого пищевая добавка относится к третьему классу опасности. Например, NO считается сильным ядом, который оказывает влияние на центральную нервную систему, может привести к поражению крови за счет связывания гемоглобина. NO2 также проявляет высокую токсичность, может спровоцировать раздражение дыхательных органов.
Оксиды азота — Википедия
Материал из Википедии — свободной энциклопедии
Текущая версия страницы пока не проверялась опытными участниками и может значительно отличаться от версии, проверенной 27 ноября 2019; проверки требуют 3 правки. Текущая версия страницы пока не проверялась опытными участниками и может значительно отличаться от версии, проверенной 27 ноября 2019; проверки требуют 3 правки. Эта статья описывает оксиды азота как химические соединения; об образовании и способах сокращения выбросов оксидов азота при горении см. NOx (оксиды азота).Окси́ды азо́та — неорганические бинарные соединения азота с кислородом.
Известны 10 соединений азота с кислородом. Кроме пяти классических оксидов азота — закиси азота N2O, окиси азота NO, оксида азота(III) N2O3, диоксида азота NO2 и оксида азота(V) N2O5 — известны также димер диоксида азота N2O4 и 4 малостабильных соединения: нитрозилазид NON3, нитрилазид NO2N3, тринитрамид N(NO2)3 и нитратный радикал NO3.
Несолеобразующий оксид. При нагревании разлагается на азот и кислород. При высоких концентрациях N2O возбуждает нервную систему («веселящий газ»). В медицине N2O применяют как слабое средство для наркоза, в высоких концентрациях
- снижает температуру всасываемого в двигатель воздуха, обеспечивая плотный поступающий заряд смеси;
- увеличивает содержание кислорода в поступающем заряде;
- повышает скорость (интенсивность) сгорания в цилиндрах двигателя.
Оксид азота NO (монооксид азота) — бесцветный газ, незначительно растворим в воде. Не взаимодействует с водой, растворами кислот и щелочей. Оксид азота(II) — очень реакционное соединение, может вступать в реакции присоединения с рядом солей (нитрозосоли), с галогенами (напр., нитрозилхлорид NOCl), органическими соединениями. При обычной температуре NO соединяется с кислородом с образованием NO
Оксид N2O3 (триоксид диазота, азотистый ангидрид) — темно-синяя жидкость, неустойчивая при обычных условиях, взаимодействует с водой, образуя азотистую кислоту HNO
Оксид азота NO2 (диоксид азота) — бурый ядовитый газ тяжелее воздуха, легко сжижается. При комнатной температуре NO2 находится в смеси с его бесцветным димером N2O4, приблизительно 1:1. Взаимодействует с водой:
- 2NO2+h3O→HNO3+HNO2{\displaystyle {\mathsf {2NO_{2}+H_{2}O\rightarrow HNO_{3}+HNO_{2}}}}
и растворами щелочей:
- 2NO2+2NaOH→NaNO3+NaNO2+h3O{\displaystyle {\mathsf {2NO_{2}+2NaOH\rightarrow NaNO_{3}+NaNO_{2}+H_{2}O}}}
Сильный окислитель. Многие вещества (уголь, сера, фосфор, органические соединения) могут гореть в NO
Оксид азота N2O5 (пентаоксид диазота, азотный ангидрид) — бесцветное кристаллическое вещество, легко разлагается на NO2 и О2. Сильный окислитель. В воде легко растворяется с образованием азотной кислоты HNO3.
- N2O5+h3O→2HNO3{\displaystyle {\mathsf {N_{2}O_{5}+H_{2}O\rightarrow 2HNO_{3}}}}
- Химическая энциклопедия / Редкол.: И. Л. Кнунянц и др.. —
- Леонтьев А. В., Фомичева О. А., Проскурнина М. В., Зефиров Н. С. Современная химия оксида азота(I) (рус.) // Успехи химии. — Российская академия наук, 2001. — Т. 70, № 2. — С. 107—122.
- Weller, Richard, Could the sun be good for your heart? Архивы TedxGlasgow. Filmed March 2012, posted January 2013
- Roszer, T (2012) The Biology of Subcellular Nitric Oxide. ISBN 978-94-007-2818-9
- Stryer, Lubert. Biochemistry, 4th Edition. — W.H. Freeman and Company, 1995. — P. 732. — ISBN 0-7167-2009-4.
- Plant-based Diets | Plant-based Foods | Beetroot Juice | Nitric Oxide VegetablesАрхивы . Berkeley Test.
- Ghosh, S. M.; Kapil, V.; Fuentes-Calvo, I.; Bubb, K. J.; Pearl, V.; Milsom, A. B.; Khambata, R.; Maleki-Toyserkani, S.; Yousuf, M.; Benjamin, N.; Webb, A. J.; Caulfield, M. J.; Hobbs, A. J.; Ahluwalia, A. Enhanced Vasodilator Activity of Nitrite in Hypertension: Critical Role for Erythrocytic Xanthine Oxidoreductase and Translational Potential (англ.) // Hypertension : journal. — 2013. — Vol. 61, no. 5. — P. 1091—1102. —
описание, применение в медицине, показания и особенности :: SYL.ru
Оксид азота широко используется в разных сферах жизнедеятельности человека. Огромное влияние он имеет в технической и медицинской области. Многие используют его в пищевых целях. Чтобы разобраться в том, для чего он необходим обществу, следует изучить его подробно, уделяя особое внимание его наиболее важной роли в анестезиологии.
История возникновения
Медицинская закись азота активно применяется в анестезии. Ее использование благотворно влияет на быстрое восстановление после операций, снижая при этом различные риски.
Пищевая закись азота может быть использована в бытовых условиях. Техническую приобретают исключительно для производственных целей.
Диоксид азота впервые синтезировал Джозеф Пристли в далеком 1772 году. Сделал он это благодаря воздействию кислоты азота на медь. Изначально закись применяли в качестве анальгетика в стоматологии. Однако уже через 40 лет ее начали применять в огромном перечне процедур, касающихся хирургии. Ее стали использовать не только для анестезии, но и для обезболивания.
Действие оксида азота
Точного определения действия диоксида азота неизвестно науке. Можно с уверенностью сказать лишь о том, что он активно распространяется на все болевые точки головного, а также спинного мозга. Определено, что этот эффект оказывает влияние на клеточную структуру гамма-аминомасляных кислот. Они усиливают торможение нервных клеток, которые отвечают за сонное состояние человека, а также сам процесс сна. Во многом это связано с выработкой эндогенных нейронов, среди которых есть пептиды и серотонин, известные своим опиоидным воздействием.
Медицинская закись азота
Она абсолютно безопасна для человека и не вызывает каких-либо побочных действий при использовании. Существуют противопоказания к ее применению в анестезиологии, но они совершенно индивидуальны и относятся к особенностям организма. Она имеет собственный тип сертификации и запрещена для свободной продажи в отличие от пищевой закиси азота. Используют ее в медицинских целях только при совмещении с кислородом.
Эту закись азота продают исключительно лечебным заведениям, которые имеют действующую лицензию. Поэтому без наличия соответствующих документов есть шанс попасть в руки мошенников. Только они смогут продать поддельное вещество, не обращая внимание на наличие лицензии. Купить закись азота в Москве можно, лишь тщательно проверяя все необходимые документы и сертификаты, чтобы не нарваться на подделку.
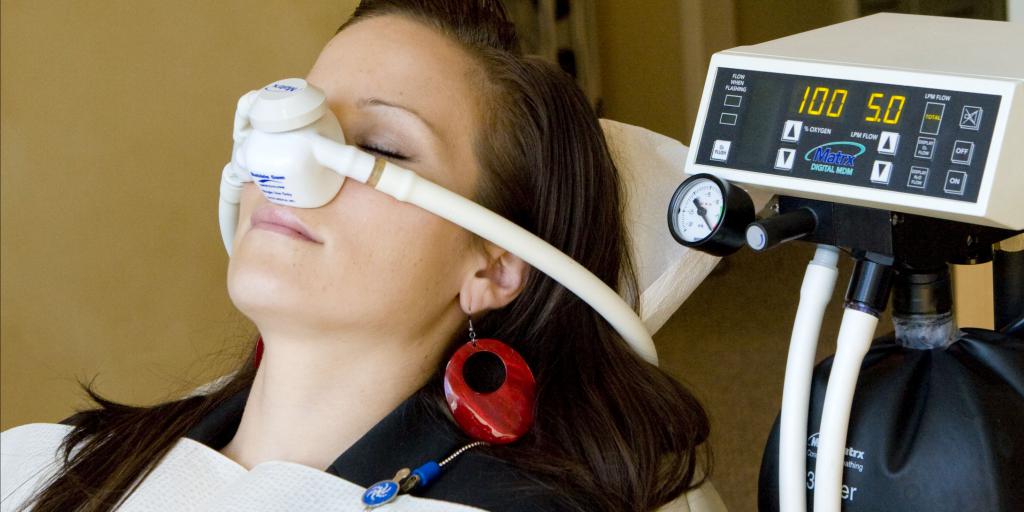
Анестезия оксидом азота
На данный момент именно эта анестезия является самым доступным и широко распространенным средством для проведения ингаляций во время осуществления наркоза. Применение закиси азота не погрузит пациента в глубокий наркоз, но позволит легко и безболезненно сделать небольшие операции. В медицине этот метод ингаляции считается комбинированным. Совместно с миорелаксантом, местным анальгетиком и остальными анестезиологическими средствами, данное вещество используют в качестве вводной анестезии для проведения различных хирургических процедур.
Применение закиси азота в отдельном виде, без использования других анестетиков возможно в тех ситуациях, когда полное отключение человека не желательно. К таким ситуациям относятся:
- Родовая деятельность.
- Аборты.
- Гинекологические краткосрочные операции.
- Мелкие хирургические вмешательства.
- Лечение зубов у детей.

Преимущества ингаляции оксидом азота
Среди плюсов данной процедуры можно отметить следующие свойства:
- Вещество не содержит токсинов и не отравляет ими организм. Внутренние органы не поддаются его воздействию.
- Человек быстро погружается в сон и легко просыпается.
- Газ очень быстро выводится из дыхательных органов. Это не сопровождается неприятными ощущениями или плохим самочувствием.
- Нет никакого влияния на легкие или бронхи.
- Абсолютно безопасное вещество.
Недостатки данного вида ингаляций
Даже у такого щадящего метода ингаляции есть свои минусы. К ним можно отнести следующее:
- Невозможно ввести пациента в состояние глубокого наркоза. Этот метод не позволяет сделать серьезную операцию.
- Если будет введена большая доза, снизится уровень насыщения крови кислородом. Это может вызвать гипоксию.
- Сократительная активность миокарда незначительно, но понизится.
- Если во время операции пациент почувствует сильную боль – он может резко дернуться, осложнив этим работу врача.
- Большие дозы могут способствовать угнетению мозговой деятельности.
Подготовка к проведению наркоза
Когда пациента подготавливают к ингаляции закисью азота, ему дают седативные средства. В последнее время наркоз все чаще сочетают с такими лекарствами, как фторотан и циклопропан. Благодаря этому можно достичь необходимой глубины наркоза, чтобы провести серьезную хирургическую операцию. Однако эти препараты могут быть использованы не для каждого организма. Они имеют целый ряд противопоказаний, которые в обязательном порядке должны учитываться врачом.
Перед ингаляционным наркозом необходимо придерживаться голодной диеты, а также принимать выданные доктором таблетки. В основном пациенту прописывают успокоительные препараты, которые снимают стресс перед операцией и снижают уровень напряжения.
Как проводят масочную анестезию
Процедура не отличается сложностью или длительностью. Все манипуляции проводятся довольно легко и просто. Когда пациент уже готов к операции, ему дают вдохнуть чистый кислород сквозь лицевую маску. Таким образом можно избежать гипоксии и насытить кровь необходимым количеством кислорода. При этом врач обязан внимательно следить, чтобы маска хорошо прилегала к лицу пациента, не пропуская лишний воздух. После этой процедуры начинается введение наркоза методом ингаляции.
Его процентное соотношение всегда находится на уровне 70/30 либо 80/20 (оксид азота/кислород). Пациент засыпает незамедлительно, в течение нескольких минут. Затем врач увеличивает дозу кислородного вещества, наблюдая при этом за количеством углекислого газа в крови.
При поступлении малых доз медицинская закись азота вызывает ощущение веселья и чрезмерной радости. Именно поэтому многие называют это вещество веселящим газом. В таких дозах его используют для приведения пациента в норму после перенесенного стресса или перед предстоящим хирургическим вмешательством. В таких случаях он обладает успокаивающим действием. Также подобную концентрацию применяют при небольших вывихах и ушибах, при смене повязок на открытых ранах. Закись азота постоянно используют в стоматологии. Особенно во время удаления сложных зубов или для лечения маленьких детей.
Ингаляции азотом при лечении детей
Чаще всего лечение зубов у ребенка не обходится без использования анестезии. Одним из самых лучших методов успокоить малыша и настроить на позитивный лад считается ингаляция с закисью азота. Детям ее вводят в очень малых дозах, и ребенок даже не засыпает. Конечно, если у малыша сильная истерика, будет лучше, если он заснет на полчаса. Тогда используют закись азота для наркоза. Обычно этого времени хватает, чтобы стоматолог закончил манипуляции с больным зубом. Многих родителей смущает подобная процедура. Они не знают, как организм ребенка ее перенесет, возникнут ли побочные действия и не станет ли ему хуже после ингаляции. Поэтому необходимо разобраться во всех нюансах процедуры, узнать о ее преимуществах и недостатках.
Плюсы ингаляции для детей
- Концентрация вещества очень мала. На ребенка она действует как легкое и расслабляющее успокоительное. Эту процедуру можно назвать седацией закисью азота.
- Малыш остается в сознании, но его стресс, вызванный нахождением в кресле стоматолога, тут же проходит. Не нужно будет заставлять ребенка замирать и сидеть, не двигаясь, на протяжении всего лечения. К тому же, многих детей просто невозможно уговорить на подобную процедуру. Ингаляция быстро успокоит и расслабит.
- Качественная очистка медицинской закиси азота предотвращает любую возможную аллергическую реакцию. На органы дыхания вещество не влияет.
- Быстро выводится из организма. Уже через 5 минут после завершения ингаляции закись азота испаряется тем же методом, которым поступала.
- Лучшее средство для лечения гиперактивных детей. Даже самого неугомонного ребенка можно усадить в кресло, если применить данный метод анестезии.
Закись азота в стоматологии является одним из самых безопасных лекарств. Он быстро действует, не имеет противопоказаний для здорового ребенка, мгновенно выводится из организма и не влияет на работу внутренних органов.
Недостатки применения у детей
Среди минусов данной процедуры можно отметить следующие побочные действия:
- У некоторых детей может появиться головная боль или головокружение.
- Запах газа может не понравиться малышу и даже вызвать рвотный рефлекс.
- Закись азота нельзя использовать во время насморка, а также любых других заболеваниях органов дыхания.
- Процедура седации стоит довольно дорого.
- Бывают случаи, что ребенок, наоборот, становится слишком активным и возбужденным во время ингаляции. Такое явление считается исключением, но, тем не менее, возможно.
- Закись азота не исключает необходимость использования дополнительного анестетика.
Необходимость ингаляций в детской стоматологии
Чаще всего лечение закисью азота проводят не по желанию родителей. Данный метод выбирается врачом во время знакомства с ребенком. Использовать закись азота для ингаляции приходится в следующих ситуациях:
- Если у ребенка много запущенных зубов.
- При паническом страхе, перерастающим в истерику. Он будет бояться врача и всячески мешать этим лечению. Седация успокоит ребенка и поможет ему избавиться от страха к стоматологам.
- При дошкольном возрасте. Малыш просто не в состоянии будет высидеть час и более в кресле стоматолога.
Если врач настаивает на применении, необходимо принять его сторону. Однако следует убедиться, что у ребенка нет противопоказаний к данному виду анестезии.
Противопоказания к процедуре
Ребенку нельзя делать седацию закисью азота, если у него присутствуют следующие заболевания:
- Простуда, аллергический ринит, синусит и любые другие инфекционные болезни, которые мешают нормальной работе носового дыхания.
- Если в последние три месяца малыш перенес черепно-мозговую травму.
- При хроническом течении отита.
- Если возможны судороги или приступы эпилепсии.
- В случае, если ребенок слишком сильно боится.
К противопоказаниям относится и возраст до 3 лет. Маленький ребенок будет не в состоянии нормально выразить свои ощущения и эмоции. А при седации просто необходимо узнавать о его самочувствии, чтобы предупредить возможное ухудшение состояния. Во всех вышеперечисленных ситуациях ингаляции закисью азота детям не делаются.
Отзывы об использовании веселящего газа в стоматологии
Большинство стоматологов, а также родители подвижных детей положительно отзываются об ингаляциях. Судя по отзывам врачей, лечение под закисью азота помогает улучшить ход восстановления поврежденных зубов. Мягкая седация устраняет боязнь стоматологического кресла и доктора в белом халате. Практически все единогласны в том, что данная процедура делает поход к врачу приятным и спокойным. Родители отмечают, что ребенок становится легко управляемым и практически не шевелится во время лечения зубов.
Некоторые мамы относятся к процедуре с недоверием. Они считают, что закись азота плохо влияет на состоянии здоровья малыша. Доводы и убеждения врачей при этом на них абсолютно не действуют. Многим родителям нравится то, что можно слегка увеличить дозу веселящего газа, чтобы малыш заснул на время проведения стоматологического лечения. Во время его сна можно вылечить все проблемные зубы. Без подобного вида ингаляций, сделать это с маленьким ребенком было бы невозможно.
Закись азота является идеальным анестетиком. Она быстро вводится в организм, не оказывает пагубного воздействия на внутренние органы, легко переносится и не дает аллергической реакции. Тем не менее, этот вид ингаляций имеет один серьезный недостаток. С помощью них невозможно погрузить пациента в состояние глубокого наркоза. Серьезные хирургические манипуляции после ингаляций закисью азота не провести. Если бы это было возможно, все другие виды наркоза уже давно бы остались в прошлом.
Применение оксида азота 1
Характеристики и физические свойства оксида азота
В связи с тем, что в своих соединениях азот проявляет различные валентности, для этого элемента характерно несколько оксидов: оксид диазота, моно-, три-, ди- и пентаоксиды азота. Рассмотрим каждый из них более подробно.
Плохо растворяется в воде. При сильном охлаждении из раствора кристаллизуется кларат N2O×5,75H2O.
В твердом состоянии он полностью димеризован (N2O2), в жидком состоянии – частично (≈ 25% N2O2), в газе – в очень малой степени. Чрезвычайно термически устойчив. Плохо растворяется в воде.
При комнатной температуре на 90% разлагается на NOи NO2 и окрашивается в бурый цвет (NO2), не имеет температуры кипения (NO испаряется первым). В твердом состоянии – это белое или голубоватое вещество с ионным строением – нитрит нитрозила (NO + )(NO2 — ). В газе имеет молекулярное строение ON-NO2.
При температуре выше 135 o С – это мономер, при комнатной температуре – красно-бурая смесь NO2 и его димера (тетраоксида диазота) N2O4. В жидком состоянии димер бесцветен, в твердом состоянии белый. Хорошо растворяется в холодной воде (насыщенный раствор – ярко-зеленый), полностью реагируя с ней.
При нагревании возгоняется и плавится, при комнатной температуре разлагается за 10 часов. В твердом состоянии имеет ионное строение (NO2 + )(NO3 — ) – нитрат нитроила.
Таблица 1. Физические свойства оксидов азота.
Молярная масса, г/моль
Температура плавления, o С
Температура кипения, o С
Получение оксида азота
В лабораторных условиях оксид диазота получают путем осторожного нагревания сухого нитрата аммония (1) или нагреванием смеси сульфаминовой и азотной (73%-ная) кислот (2):
Монооксид азота получают взаимодействием простых веществ азота и кислорода при высоких температурах (≈1300 o С):
Кроме этого оксид азота (II) является одним из продуктов реакции растворения меди в разбавленной азотной кислоте:
При охлаждении смеси газов, состоящей из оксидов азота (II) и (IV) до -36 o С образуется триоксид азота:
Данное соединение можно получить при действии 50%-ной азотной кислоты на оксид мышьяка (III) (3) или крахмал (4):
Термическое разложение нитрата свинца (II) приводит к образованию диоксидазота:
Это же соединение образуется при растворении меди в концентрированной азотной кислоте:
Пентаоксид азота получают путем пропускания сухого хлора над сухим нитратом серебра (5), а также по реакции взаимодействия между оксидом азота (IV) и озоном (6):
Химические свойства оксида азота
Оксид диазота малореакционноспособный, не реагирует с разбавленными кислотами, щелочами, гидратом аммиака, кислородом. При нагревании реагирует с колнцентрированной серной кислотой, водородом, металлами, аммиаком. Поддерживает горение углерода и фосфора. В ОВР может проявлять свойства как слабого окислителя, так и слабого восстановителя.
Монооксид азота не реагирует с водой, разбавленными кислотами, щелочами, гидратом аммиака. Мгновенно присоединяет кислород. При нагревании реагирует с галогенами и другими неметаллами, сильными окислителями и восстановителями. Вступает в реакции комплексообразования.
Триоксид азота проявляет кислотные свойства, реагирует с водой, щелочами, гидратом аммиака. Энергично реагирует с кислородом и озоном, окисляет металлы.
Диоксид азота реагирует с водой и щелочами. В ОВР проявляет свойства сильного окислителя. Вызывает коррозию металлов.
Пентаоксид азота проявляет кислотные свойства, реагирует с водой, щелочами, гидратом аммиака. Является очень сильным окислителем.
Применение оксида азота
Оксид диазота используют в пищевой промышленности (пропеллент при изготовлении взбитых сливок), медицине (для ингаляционного наркоза), а также в качестве основного компонента ракетного топлива.
Триоксид и диоксид азота применяются в неорганическом синтезе для получения азотной и серной кислот. Оксид азота (IV) также нашел применение в качестве одного из компонентов ракетного топлива и смесевых взрывчатых веществ.
Примеры решения задач
| Задание | Оксид азота содержит 63,2% кислорода. Какова формула оксида. |
| Решение | Массовая доля элемента Х в молекуле состава НХ рассчитывается по следующей формуле: |
ω (Х) = n × Ar (X) / M (HX) × 100%.
Вычислим массовую долю азота в оксиде:
ω (N) = 100% — ω(O) = 100% — 63,2% = 36,8%.
Обозначим количество моль элементов, входящих в состав соединения за «х» (азот) и «у» (кислород). Тогда, мольное отношение будет выглядеть следующим образом (значения относительных атомных масс, взятых из Периодической таблицы Д.И. Менделеева, округлим до целых чисел):
x:y= 36,8/14 : 63,2/16;
x:y= 2,6 : 3,95 = 1 : 2.
Значит формула соединения азота и кислорода будет иметь вид NO2. Это оксид азота (IV).
| Задание | Какие газы тяжелее, а какие легче воздуха и во сколько раз: диоксид углерода, диоксид азота, монооксид углерода, хлор, аммиак? |
| Решение | Отношение массы данного газа к массе другого газа, взятого в том же объеме, при той же температуре и том же давлении, называется относительной плотностью первого газа по второму. Данная величина показывает, во сколько раз первый газ тяжелее или легче второго газа. |
Относительную молекулярную массу воздуха принимают равной 29 (с учетом содержания в воздухе азота, кислорода и других газов). Следует отметить, что понятие «относительная молекулярная масса воздуха» употребляется условно, так как воздух – это смесь газов.
Dair(CO) = 28 / 29 = 0,97.
| Понравился сайт? Расскажи друзьям! |
| Оксид азота | |
|---|---|
 | |
 | |
 | |
| Общие | |
| Систематическое наименование | Оксонитрид азота(I) |
| Хим. формула | N2O |
| Физические свойства | |
| Состояние | бесцветный газ |
| Молярная масса | 44,0128 г/моль |
| Плотность | 1,98 г/л (при н. у.) |
| Энергия ионизации | 12,89 ± 0,01 эВ [1] |
| Термические свойства | |
| Т. плав. | -90,86 °C |
| Т. кип. | -88,48 °C |
| Давление пара | 51,3 ± 0,1 атм [1] |
| Классификация | |
| Рег. номер CAS | 10024-97-2 |
| PubChem | 948 |
| Рег. номер EINECS | 233-032-0 |
| SMILES | |
| Кодекс Алиментариус | E942 |
| RTECS | QX1350000 |
| ChEBI | 17045 и 44250 |
| ChemSpider | 923 |
| Безопасность | |
| NFPA 704 |
|
| Приводятся данные для стандартных условий (25 °C, 100 кПа), если не указано иного. | |
Окси́д азо́та(I) (оксид диазота, закись азота, веселящий газ) — соединение с химической формулой N2O. Иногда называется «веселящим газом» из-за производимого им опьяняющего эффекта. При нормальной температуре это бесцветный негорючий газ с приятным сладковатым запахом и привкусом.
Содержание
История [ править | править код ]
Впервые был получен в 1772 году Джозефом Пристли, который назвал его «дефлогистированным нитрозным воздухом» [2] . В 1799 г. его исследовал Г. Дэви.
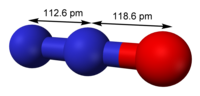
Строение молекулы [ править | править код ]
Строение молекулы оксида азота(I) описывается следующими резонансными формами:
Наибольший вклад вносит N-оксидная форма оксида азота(I). Порядок связи N-N оценивается как 2,73, порядок связи N-O — как 1,61. Резонансная структура с возможностью противоположного расположения зарядов в молекуле N2O обусловливает низкий дипольный момент молекулы, равный 0,161 Д.
Физические свойства [ править | править код ]
Бесцветный газ, тяжелее воздуха (относительная плотность 1,527), с характерным сладковатым запахом. Растворим в воде ( 0,6 объёма N2O в 1 объёме воды при 25 °C , или 0,15 г/100 мл воды при 15 °C ), растворим также в этиловом спирте, эфире, серной кислоте. При 0 °C и давлении 30 атм , а также при комнатной температуре и давлении 40 атм сгущается в бесцветную жидкость. Из 1 кг жидкой закиси азота образуется 500 л газа. Молекула закиси азота имеет дипольный момент 0,161 Д, коэффициент преломления в жидком виде равен 1,330 (для жёлтого света с длиной волны 589 нм ). Давление паров жидкого N2O при 20 °C равно 5150 кПа .
Химические свойства [ править | править код ]
Относится к несолеобразующим оксидам, с водой, с растворами щелочей и кислот не взаимодействует. Не воспламеняется, но поддерживает горение: тлеющая лучина, опущенная в него, загорается, как в чистом кислороде. Смеси с эфиром, циклопропаном, хлорэтаном в определённых концентрациях взрывоопасны. Оксид азота(I) является озоноразрушающим веществом, а также парниковым газом. В нормальных условиях N2O химически инертен, при нагревании проявляет свойства окислителя:
N 2 O + H 2 → N 2 + H 2 O <displaystyle <mathsf O+H_<2>
ightarrow N_<2>+H_<2>O>>> 2 N 2 O + C → 2 N 2 + C O 2 <displaystyle <mathsf <2N_<2>O+C
ightarrow 2N_<2>+CO_<2>>>> 2>
При взаимодействии с сильными окислителями N2O может проявлять свойства восстановителя:
5 N 2 O + 8 K M n O 4 + 7 H 2 S O 4 → 5 M n ( N O 3 ) 2 + 3 M n S O 4 + 4 K 2 S O 4 + 7 H 2 O <displaystyle <mathsf <5N_<2>O+8KMnO_<4>+7H_<2>SO_<4>
ightarrow 5Mn(NO_<3>)_<2>+3MnSO_<4>+4K_<2>SO_<4>+7H_<2>O>>>
При нагревании N2O разлагается:
2 N 2 O → 2 N 2 + O 2 <displaystyle <mathsf <2N_<2>O
ightarrow 2N_<2>+O_<2>>>>
Оксид азота(I) реагирует с амидами металлов с образованием соответствующих неорганических азидов:
2 N a N H 2 + N 2 O → N a N 3 + N a O H + N H 3 <displaystyle <mathsf <2NaNH_<2>+N_<2>O
ightarrow NaN_<3>+NaOH+NH_<3>>>>
При взаимодействии аммиака над катализатором образуется азид аммония:
2 N H 3 + N 2 O → N i − A l 2 O 3 N H 4 N 3 + H 2 O <displaystyle <mathsf <2NH_<3>+N_<2>O<xrightarrow[<>]O_<3>>>NH_<4>N_<3>+H_<2>O>>> 2>
Получение [ править | править код ]
Оксид азота(I) получают осторожным (опасность взрывного разложения!) нагреванием сухого нитрата аммония:
N H 4 N O 3 → N 2 O + 2 H 2 O . <displaystyle <mathsf NO_<3>
ightarrow N_<2>O+2H_<2>O.>>> 4>
Более удобным способом является нагревание сульфаминовой кислоты с 73%-й азотной кислотой:
N H 2 S O 2 O H + H N O 3 ( 73 % ) → N 2 O + H 2 S O 4 + H 2 O . <displaystyle <mathsf SO_<2>OH+HNO_<3>(73\%)
ightarrow N_<2>O+H_<2>SO_<4>+H_<2>O.>>> 2>
В химической промышленности закись азота является побочным продуктом и для её разрушения используют каталитические конвертеры, так как выделение в виде товарного продукта, как правило, экономически нецелесообразно.
Биологическое значение [ править | править код ]
Закись азота образуется как при ферментативном, так и при неферментативном восстановлении из окиси азота (II) [3] . В опытах in vitro было обнаружено, что закись азота образуется при реакции между окисью азота (II) и тиолом или тиол-содержащими соединениями [4] . Сообщается, что образование N2O из окиси азота было обнаружено в цитозоле гепатоцитов, что заставляет предполагать возможное образование этого газа в клетках млекопитающих в физиологических условиях [5] . В организме бактерий закись азота образуется в ходе процесса, называемого денитрификацией, и катализируемого нитрооксид-редуктазой. Ранее этот процесс предполагался специфичным для некоторых видов бактерий и отсутствующим у млекопитающих, но новые данные заставляют предполагать, что это не так. Было показано, что физиологически релевантные концентрации закиси азота ингибируют как ионные токи, так и опосредуемые эксайтотоксичностью нейродегенеративные процессы, происходящие при чрезмерном возбуждении NMDA-рецепторов [6] . Также закись азота ингибирует биосинтез метионина, угнетая активность метионин-синтетазы и скорость превращения гомоцистеина в метионин и повышая концентрацию гомоцистеина в культурах лимфоцитов [7] и в биоптатах человеческой печени [8] . Хотя закись азота не является лигандом для гема, и не реагирует с тиоловыми группами, она обнаруживается во внутренних структурах гемосодержащих белков, таких, как гемоглобин, миоглобин, цитохромоксидаза [9] . Способность закиси азота нековалентно, обратимо изменять структуру и функции гемосодержащих белков была показана исследованием сдвига инфракрасных спектров тиоловых групп цистеинов гемоглобина [10] и тем, что закись азота способна частично и обратимо ингибировать функцию цитохромоксидазы C [11] . Точные механизмы этого нековалентного взаимодействия закиси азота с гемосодержащими белками и биологическое значение этого явления заслуживают дальнейших исследований. В настоящее время представляется возможным, что эндогенная закись азота участвует в регуляции активности NMDA [6] и опиоидной системы [12] [13] . Обладает нейротоксическими свойствами.
Применение [ править | править код ]
Существует два вида закиси азота — пищевая, или медицинская для медицинского применения (высокой степени очистки) и техническая — технический оксид диазота, в котором есть примеси, количество которых указывается в соответствующих техусловиях (ТУ) на данный газ. «Медицинская» закись азота используется в основном как средство для ингаляционного наркоза, находит применение и в пищевой промышленности (например, для изготовления взбитых сливок) в качестве пропеллента. Как пищевой продукт, имеет индекс E942. Также иногда используется для улучшения технических характеристик двигателей внутреннего сгорания. В промышленности применяется как пропеллент и упаковочный газ. Может использоваться в ракетных двигателях в качестве окислителя, а также как единственное топливо в монокомпонентных ракетных двигателях.
Средство для ингаляционного наркоза [ править | править код ]
Малые концентрации закиси азота вызывают лёгкое опьянение (отсюда название — «веселящий газ»). При вдыхании чистого газа быстро развиваются состояние опьянения и сонливость. Закись азота обладает слабой наркотической активностью, в связи с чем в медицине её применяют в больших концентрациях. В смеси с кислородом при правильном дозировании (до 80 % закиси азота) вызывает хирургический наркоз. Часто применяют комбинированный наркоз, при котором закись азота сочетают с другими средствами для наркоза, анальгетиками, миорелаксантами и т. п. Например, применяется комбинированный наркоз закисью азота и гексеналом с фентаниловой анальгезией и миорелаксацию дитилином.
Закись азота, предназначенная для медицинских нужд (высокой степени очистки от примесей), не вызывает раздражения дыхательных путей. Будучи, в процессе вдыхания, растворенной в плазме крови, практически не изменяется и не метаболизируется, с гемоглобином не связывается. После прекращения вдыхания выделяется (в течение 10—15 мин) через дыхательные пути в неизменном виде. Период полувыведения — 5 минут.
Закись азота используется для ингаляционного наркоза в хирургии, она удобна для кратковременного наркоза (и рауш-наркоза) в хирургической стоматологии, а также для обезболивания родов (поскольку слабо влияет на родовую деятельность и нетоксична для плода).
Смесь закиси азота с кислородом получают и непосредственно применяют при помощи специальных аппаратов для наркоза. Обычно начинают со смеси, содержащей 70—80 % закиси азота и 30—20 % кислорода, затем количество кислорода увеличивают до 40—50 % [ источник не указан 2213 дней ] . Если не удается получить необходимую глубину наркоза, при концентрации закиси азота 70—75 %, добавляют более мощные наркотические средства: фторотан, диэтиловый эфир, барбитураты.
Для более полного расслабления мускулатуры применяют миорелаксанты, при этом не только усиливается расслабление мышц, но также улучшается течение наркоза.
После прекращения подачи закиси азота следует во избежание гипоксии продолжать давать кислород в течение 4—5 мин.
Применять закись азота, как и любое средство для наркоза, необходимо с осторожностью, особенно при выраженных явлениях гипоксии и нарушении диффузии газов в лёгких.
Для обезболивания родов пользуются методом прерывистой аутоанальгезии с применением, при помощи специальных наркозных аппаратов, смеси закиси азота (75 %) и кислорода. Роженица начинает вдыхать смесь при появлении предвестников схватки и заканчивает вдыхание на высоте схватки или по её окончании.
Для уменьшения эмоционального возбуждения, предупреждения тошноты и рвоты и потенцирования действия закиси азота возможна премедикация внутримышечным введением 0,5%-го раствора диазепама (седуксена, сибазона) в количестве 1—2 мл (5—10 мг).
Форма выпуска: в металлических баллонах вместимостью 10 л под давлением 50 атм в сжиженном состоянии. Баллоны окрашены в серый цвет и имеют надпись «Для медицинского применения».
При использовании закиси азота для анестезии и пограничных уровнях витамина в B12 развивается полинейропатия вызванная дефицитом B12. Эффект описан в работах [14] [15] и др. Необходима терапия фолатами и B12.
В двигателях внутреннего сгорания [ править | править код ]

Закись азота иногда используется для улучшения технических характеристик двигателей внутреннего сгорания. В случае автомобильных применений вещество, содержащее закись азота, и горючее впрыскиваются во впускной (всасывающий) коллектор двигателя, что приводит к следующим результатам:
- снижает температуру всасываемого в двигатель воздуха, обеспечивая плотный поступающий заряд смеси.
- увеличивает содержание кислорода в поступающем заряде (воздух содержит лишь
23,15 масс. % кислорода).
В реактивных двигателях [ править | править код ]
Иногда используется в качестве окислителя в однокомпонентном топливе с этаном, этиленом или ацетиленом в качестве топлива.
В пищевой промышленности [ править | править код ]
В пищевой промышленности соединение зарегистрировано в качестве пищевой добавки E942, как пропеллент и упаковочный газ (предотвращают порчу продукта). Закись азота используется в основном для распыления пищевых продуктов.
Хранение [ править | править код ]
Хранение: при комнатной температуре в закрытом помещении, вдали от огня.
формула, свойства, применение :: SYL.ru
Оксидами называют бинарные соединения химических элементов с кислородным атомом, у которого окислительная степень равна 2-. Азот, обладающий меньшим электроотрицательным значением, образует различные комбинации с кислородом. Эти соединения относятся к разным классам веществ. Оксид азота кислород содержит в количестве, которое устанавливает валентность элемента N. Она колеблется от 1 до 5.
Какие бывают оксиды
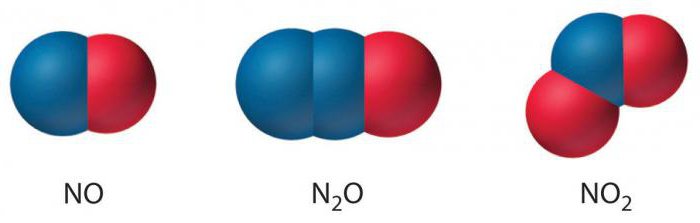
Существует около десятка азотистых соединений, содержащих O-элемент. Из них пять наиболее часто встречаемых: оксид одновалентного, оксид двухвалентного, оксид трехвалентного, оксид четырехвалентного и оксид пятивалентного азота.
Остальные соединения считаются менее распространенными. К ним относят оксид азота четырехвалентного в форме димера, нестабильные молекулы нитрилазида, нитрозилазида, тринитрамида и нитратный радикал.
Формулы оксидов азота
Ниже приведены обозначения наиболее значимых соединений элемента N.
Это прежде всего оксид азота, формула которого состоит из двух химических знаков — N и O. За ними ставятся индексы, в зависимости от степени окисления атомов.
- Азота одновалентного оксид имеет формулу N2O. В нем атом N заряжен +1.
- Азота двухвалентного оксид имеет формулу NO. В нем атом N заряжен +2.
- Азота трехвалентного оксид имеет формулу N2O3. В нем атом N заряжен +3.
- Четырехвалентный оксид азота, формула которого NO2, имеет заряд атома N +4.
- Пятивалентное кислородное соединение обозначается как N2O5. В нем атом N заряжен +5.
Описание одновалентного оксида азота
Он еще именуется диазотом, закисью и газом веселящим. Последнее название произошло от действия, связанного с опьянением.
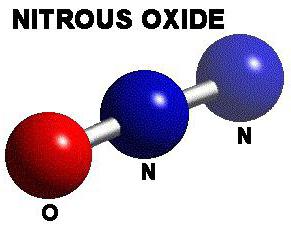
Оксид азота с валентностью I в условиях нормальной температуры существует в форме негорючего газа, без цвета, который проявляет приятный сладковатый привкус и запах. Воздух легче данного соединения. Оксид растворяется в водной среде, этаноле, эфирах и кислоте серной.
Вода, щелочные и кислотные растворы не способны с ним вступать в реакцию, он не образует соли. Не подвергается воспламенению, зато способен поддержать процесс горения.
Аммиак оксид азота переводит в азид (N3Nh5).
При соединении с молекулами эфиров, хлорэтана и циклопропана образуется взрывоопасная смесь.
Обычные условия способствуют его инертности. Под действием нагревания вещество восстанавливается.
Описание оксида двухвалентного азота
Его еще называют моноокисью, окисью или нитрозил-радикалом. В условиях нормальной температуры является бесцветным негорючим газом, слаборастворимым в водной среде. Воздухом окисляется, получается NO2. Жидкая и твёрдая его форма становятся голубого цвета.

Оксид азота может быть восстановителем в реакциях взаимодействия с галогенами. Продуктом их присоединения является нитрозилгалогенид, который имеет формулу NOBr.
Диоксид серы и другие сильные восстановители окисляют NO с получением молекул N2.
Описание оксида трехвалентного азота
Они именуется ангидридом азотистым. В нормальном состоянии может быть жидкостью, с синей окраской, а стандартные параметры среды переводят оксид в форму газа, не имеющего цвета. Обладает устойчивостью только при низких температурах.
Молекулы N2O3 диссоциируют во время нагревания с выделением одно- и двухвалентного оксида.
В качестве ангидрида присоединяет воду с получением кислоты азотистой, а со щелочами формирует соли в виде нитритов.
Описание оксида четырехвалентного азота
По-другому его называют диоксидом. Существует в форме буро-красного газа, у которого имеется острый запах, а также может быть желтоватой жидкостью.
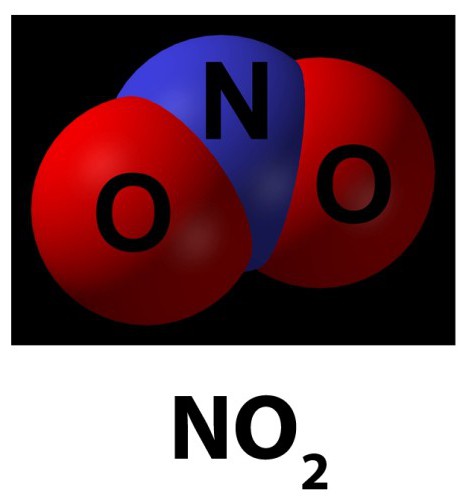
Относится к кислотным оксидам, у которых развита хорошо химическая активность.
Его молекулы окисляют неметаллы с образованием кислородсодержащих соединений и свободного азота.
Диоксид взаимодействует с оксидом четырехвалентной и шестивалентной серы. Получается кислота серная. Метод ее синтеза называют нитрозным.
В водной среде можно растворить оксид азота. Азотная кислота является результатом данной реакции. Такой процесс называют диспропорционированием. Промежуточным компонентом считается кислота азотистая, которая быстро распадается.
Если растворить азота четырехвалентного оксид в щелочи, то происходит образование растворов нитратов и нитритов. Можно использовать его жидкую форму для взаимодействия с металлом, тогда получится безводная соль.
Описание оксида пятивалентного азота
Его также называют диазотным пентаоксидом, нитратом нитрония, нитриловым нитратом или азотным ангидридом.
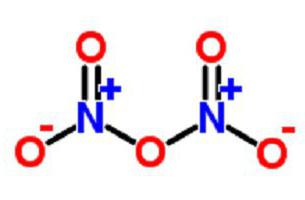
Существует в форме бесцветных кристаллов, которые обладают летучестью и неустойчивостью. Их стабильность наблюдается при низкой температуре. Такую структуру образуют нитрат- и нитрит-ионы.
В газообразном виде вещество имеет форму ангидрида NO2−O−NO2.
Оксид азота пятивалентный обладает свойствами кислотными. Он легко разлагается с выделением кислорода.
Вещество реагирует с водой, в результате получается азотная кислота.
Щелочи растворяют ангидрид с выделением солей нитратов.
Как получают оксиды азота
Закись N2O образуется при острожном нагревании аммония нитрата в сухом виде, однако такой способ может сопровождаться взрывом.
Предпочтительным методом получения оксида одновалентного является воздействие кислотой азотной в концентрированном виде на кислоту сульфаминовую. Главным условием считается нагревание.
Нитрозил, или NO, – это особый оксид азота, получение которого осуществляется при взаимодействии молекул N2 иO2. Важным условием такого процесса является сильное нагревание свыше 1000 °C.
Природный способ получения связан с грозовыми разрядами в атмосферном воздухе. Такой оксид быстро соединяется с кислородными молекулами и формируется диоксид.
Лабораторный метод синтеза NO связан с реакцией металлов и неконцентрированной кислоты азотной. Примером такой реакции может быть взаимодействие меди с HNO3.
Другой способ образования моноокиси азота — реакция хлорида железа двухвалентного с натрия нитритом и кислотой соляной. Результатом процесса являются железа трехвалентного и натрия хлориды, вода и сама окись.
В промышленных масштабах его добывают за счет окисления аммиачных молекул во время нагревания и под высоким давлением. Ускорителем процесса является платина или хрома трехвалентного оксид.

Диоксид, или NO2, получается при взаимодействии мышьяка трехвалентного оксида с 50 % кислотой азотной, которую наносят по каплям на поверхность твердого реагента. Образуется смесь из оксидов двухвалентного и четырехвалентного азота.
Если ее охладить до температуры -30 °С, то синтезируется ангидрид азотистый, или N2O3.
В порошкообразном виде он получается в случае пропускания тока электрического сквозь газообразную его форму.
Если на крахмальный порошок подействовать кислотой азотной с концентрацией 50 %, то выделяется оксид двухвалентного и четырехвалентного азота, газ углекислый и вода. В дальнейшем из полученных первых двух соединений формируется молекула N2O3.
В результате теплового расщепления свинцового нитросоединения выделяется диоксид азота, свободный кислород и оксид свинца.
Ангидрид, или N2O5, образуется благодаря отщеплению молекулы воды от кислоты азотной действием фосфора оксида пятивалентного.
Другой способ его синтеза является пропускание сухого хлора сквозь безводный серебряный нитрат.
Если на диоксид азотный подействовать молекулами озона, то формируется N2O5.
Оксид азота ℹ️ формула, химические и физические свойства, получение и применение, с какими веществами реагирует, влияние на организм человека
Виды и свойства
Азот — вещество, которое образует несколько групп оксидов. Все они обладают разной молярной массой и физическими характеристиками. В группу солеобразующих входят:
- Триоксид диазота (III). Химическая формула N2O3, кратность связи равна 3. Вещество имеет вид жидкости тёмно-синего цвета, плотность которой меньше плотности воды. Кристаллизуется при температуре -100 градусов. Этот кислотный оксид реагирует со щелочами, образуя соли. С водой образует азотистую кислоту: N2O3+h3O = 2HNO2.
- Двуокись азота (IV) — NO2. Атомы в молекуле расположены под углом к друг другу. Вещество является ядовитым газом бурого цвета, имеет характерный запах. Легко растворимо в воде. Оксид образует 2 кислоты — азотную и азотистую. Азотная кислота образуется в присутствии воздуха и воды. Со щелочами образует 2 соли — нитрат и нитрит. При температуре меньше 22 градусов молекулы димеризуются и образуется N2O4. Образуется жидкость, которая при дальнейшем охлаждении превращается в кристаллы.
- Пентаоксид (V) — N2O5. Другое название — азотный ангидрид. Представляет собой кристаллы, имеющие белую окраску. При нормальной температуре и давлении легко разлагается. При низких температурах сохраняет высокую степень устойчивости. Обладает свойствами окислителя и восстановителя.
Связи атомов происходят по механизму «донор-акцептор». Атом азота отдаёт электрон и приобретает заряд со знаком «плюс». Кислород присоединяет электрон, приобретая отрицательный заряд.
Несолеобразующие соединения
Второй класс соединений — несолеобразующие. В неё входят оксид одновалентного и двухвалентного азота. Вещество с формулой N2O имеет линейное строение молекулы. Представляет собой газ, не имеющий цвета. В нормальных условиях вещество инертно. Обладает сладковатым вкусом и слабым запахом. Легко растворяется в воде, однако не вступает с ней в химические реакции. С водородом реагирует со взрывом. Не вступает в химические реакции с кислотами и основаниями.
При небольшом нагревании быстро разлагается, проявляет свойства окислителя. Окисляет металлы, водород, сернистый газ и прочее. Растворяясь в воде, образует азотную кислоту. В результате таких реакций образуется свободная форма азота.
Вступая в контакт с окислителями, N2O выступает в роли восстановителя. К примеру, раствор перманганата в серной кислоте окисляет закись азота до образования монооксида. В водном растворе окисляет диоксид серы до серной кислоты.
Монооксид (II) — NO. При низких температурах молекулы димеризуются и образуют новое вещество. Окись азота представляет собой газ без цвета и запаха, малорастворимый в воде. В присутствии кислорода загорается, образуется диоксид — вещество коричневого цвета. Под действием хлора или озона легко окисляется. Жидкая и твёрдая форма имеет голубую окраску. Вступает во взаимодействие с основаниями и основными оксидами.
Вступает в химические связи с окислителями, водородом, активными металлами. Входит в состав выхлопных газов автомобилей в качестве побочного продукта.
Получение в природе и промышленности
В природе азот встречается преимущественно в чистом виде. Во время грозы азот и кислород вступают во взаимодействие при высокой температуре. Образуется монооксид: N2+O2 = 2NO.
В промышленных условиях получают следующие соединения:

- При разложении нитрата аммония образуется оксид азота, формула которого выглядит как N2O. Уравнение химической реакции записывается следующим образом: Nh5NO3 → N2O+2h3O.
- На производстве получение оксида азота (I) происходит путём окисления аммиака. Химический процесс нуждается в присутствии катализатора, в роли которого выступает платина.
- В лабораторных условиях монооксид получают путём взаимодействия меди и разбавленной азотной кислоты. Другой способ получения — окисление хлорида железа или йодоводорода в результате взаимодействия с азотной кислотой.
- Двуокись получается в результате взаимодействия монооксида с атомами кислорода.
- Лабораторным путём NO2 (IV) получается при взаимодействии концентрированной азотной кислоты с медью. Второй вариант — разложение нитрата меди или свинца.
- Азотистый ангидрид можно получить из оксидов при низкой температуре.
Живые организмы также вырабатывают соединения азота. Растения способны вырабатывать монооксид азота несколькими способами:
- С помощью фермента синтазы и аминокислоты аргинина. Хотя некоторые учёные считают, что в растительных клетках нет прямых аналогов этого фермента.
- С помощью фермента нитрат-редуктазы, который находится в клеточных оболочках. Вещество способно восстанавливать нитраты и нитриты, которые растение получает из почвы.
- Посредством транспортировки электронов в митохондриях.
- Путём окисления аммиака или восстановления нитратов и нитритов без участия катализаторов.
Практическое применение
Химические свойства оксида азота нашли практическое применение. Их используют в медицинской практике, военной, пищевой и химической промышленности. Наиболее часто соединения используются в следующих целях:
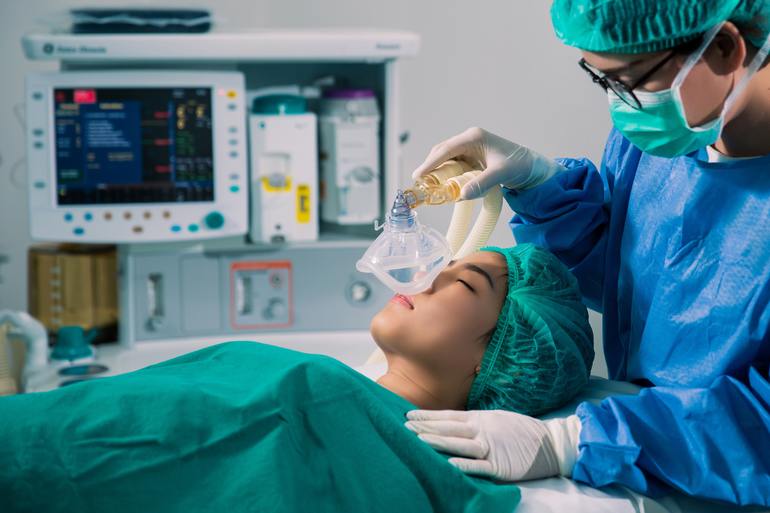
- Влияние оксида азота на организм человека используется в медицинской практике. В хирургии применяется для дачи ингаляционного наркоза в смеси с кислородом (2 части кислорода на 8 частей закиси азота).
- Поскольку NO2 обладает свойствами сильного окислителя, он используется в производстве ракетного топлива. Когда вещество взаимодействует с гидразином, образуется колоссальное количество энергии. Кроме того, оно используется для изготовления взрывчатых смесей.
- Соединение NO2 применяется в химии для производства серной и азотной кислоты.
- С помощью NO улучшают технические качества двигателей внутреннего сгорания у автомобилей.
- В пищевой промышленности вещество применяется в качестве добавки для улучшения вкуса готовых продуктов. На упаковках ему соответствует символ Е942.
- Монооксид и оксид трёхвалентного азота используется в химической промышленности в качестве сырья для производства азотной кислоты и её солей.
Влияние на живые организмы
В смеси с кислородом закись азота в малых концентрациях воздействует на нервную систему человека. Эффект напоминает опьянение лёгкой степени и сопровождается эйфорией. За это веществу дали название — «веселящий газ». В чистом виде вещество вызывает состояние опьянения и выраженную сонливость. При передозировке вначале вызывает приступ судорожного смеха, затем потерю сознания.
Монооксид азота — высокотоксичное соединение. Поступая в организм в больших концентрациях, способен изменить структуру гемоглобина, что взывает кислородное голодание. Оксид азота (IV) — крайне ядовитое вещество, представляющее опасность для здоровья и жизни.
Монооксид азота — вторичный посредник, который участвует в механизмах внутриклеточной и межклеточной передачи импульсов. Это вещество вырабатывают практически все живые организмы, от одноклеточных до млекопитающих.
Изначально окись азота была известна как эндотелиальный сосудорасширяющий фактор. Она образовалась в организме из аминокислоты аргинина. В химическом процессе участвуют молекулы кислорода, НАДФ и синтаза оксида азота. Другой способ образования вещества — восстановление неорганических солей азотной кислоты.
Эндотелиальные клетки сосудов передают сигнал гладкомышечным элементам, в результате сосуды расширяются и усиливается местный кровоток. Молекула оксида азота обладает способностью легко проникать через мембраны клеток. Благодаря этому она служит для обмена сигналами. Это благотворно влияет на состояние сердечно-сосудистой системы. Снижается риск ишемии миокарда и развития гипертонической болезни.
Уровень эндогенной окиси азота могут повышать растительные продукты — руккола, шпинат, свёкла, петрушка и прочие. Получение вещества из растительных продуктов требует присутствия сапрофитных микроорганизмов. В норме они живут в ротовой полости человека.
Системы закиси азота — Википедия
Материал из Википедии — свободной энциклопедии
Текущая версия страницы пока не проверялась опытными участниками и может значительно отличаться от версии, проверенной 16 марта 2015; проверки требуют 24 правки. Текущая версия страницы пока не проверялась опытными участниками и может значительно отличаться от версии, проверенной 16 марта 2015; проверки требуют 24 правки.
Система закиси азота (NOS — от англ. Nitrous Oxide System) — система, использующаяся для изменения технических характеристик двигателей внутреннего сгорания. Вещество, содержащее закись азота, и горючее впрыскиваются во впускной коллектор двигателя.
Двигатель функционирует, сжигая топливо, которое в момент вспышки в камере сгорания нагревает воздух, находящийся в цилиндре, который, расширяясь, создает избыточное давление, толкая поршни. Для увеличения мощности двигателя необходимо увеличить количество топлива. Для высвобождения большего количества энергии необходимо сжигать больше топлива. При этом любое топливо требует для горения кислород. Увеличение количества кислорода позволяет сжигать большее количество топлива, и, как следствие, высвобождать больше энергии.
Системы закиси азота являются одним из наиболее эффективных способов увеличить поток кислорода (когда закись азота подается в двигатель, теплота сгорания разрушает химическую связь N2O, снабжая двигатель большим количеством атомарного кислорода), а, соответственно, и топлива в двигатель. Подающаяся в состав смеси в виде сжиженного газа, закись азота приводит к её немедленному охлаждению, так как температура испаряющегося сжиженного газа всегда значительно ниже температуры окружающей среды. Атомы азота, выделяемые при распаде N2O, не дают смеси детонировать.
Краткий обзор систем («сухая», «мокрая», прямая) впрыска закиси азота[править | править код]
Существуют три типа систем закиси азота: так называемые «сухая», «мокрая» и система прямого впрыска закиси азота.
- «Сухая» система закиси азота. Топливо, требуемое для получения дополнительной мощности с помощью закиси азота, подается через топливные инжекторы (топливо производит мощность, закись азота просто позволяет сжечь большее количество топлива), что позволяет впускному коллектору оставаться «сухим» от топлива. Достигается двумя способами:
- Первый — увеличение давления на инжекторах путём приложения давления закиси азота от соленоида, когда активна система. Это служит причиной увеличения потока топлива.
- Второй — увеличение времени работы топливного инжектора. Достигается путём изменения информации, которую получает компьютер, заставляя его подавать требуемое количество топлива.
Такая система самая дешёвая, большим минусом считается ее «неуправляемость», то есть либо включили и работает, либо выключили и не работает. В связи с этим рассчитать оптимальное соотношение топлива и закиси азота бывает очень сложно, что приводит к детонации в двигателе, также прибавочная мощность в таком способе довольно ограничена.
- «Мокрая» система закиси азота. Эти системы, включая системы с карбюраторными пластинами, добавляют закись азота и топливо одновременно, в одном и том же месте (обычно на расстоянии 3-4″ от дроссельной заслонки для двигателей с впрыском или прямо под карбюратором для систем с пластинами). Этот тип системы делает впускной коллектор «мокрым» от топлива. Этот тип систем лучше всего использовать с коллекторами, разработанными для мокрого потока, и на турбированных/наддувных двигателях.
Эта система считается надёжнее сухой, но главной проблемой является в том, что в ближнем цилиндре от форсунки закиси азота, смесь обогащается, а в дальнем проблемном цилиндре, наоборот обедняется по топливу, что приводит к стрессу и капитальной поломке двигателя.
- Система прямого впрыска закиси азота Как следует из названия, система поставляет закись азота и топливо непосредственно в каждое впускное отверстие двигателя. Системы этого типа, как правило, добавляют закись азота и топливо вместе через форсунки. Форсунки смешивают и отмеряют закись азота и топливо, доставленные в каждый цилиндр. Это самый мощный и один из самых точных типов систем, что достигается как размещением форсунок в каждом впускном отверстии, так и возможностью использовать большие клапаны соленоидов. Системы прямого впрыска имеют распределительный блок и соленоиды, которые передают закись азота и топливо к форсункам. В связи с тем, что каждый цилиндр имеет собственные форсунки и жиклёры (как закиси азота, так и топлива), существует возможность контролировать соотношение закись азота/топливо для каждого цилиндра индивидуально. Системы прямого впрыска являются еще и самыми сложными в установке. В связи с этим, а также с их высокой мощностью, эти системы применяются в основном на гоночных автомобилях.

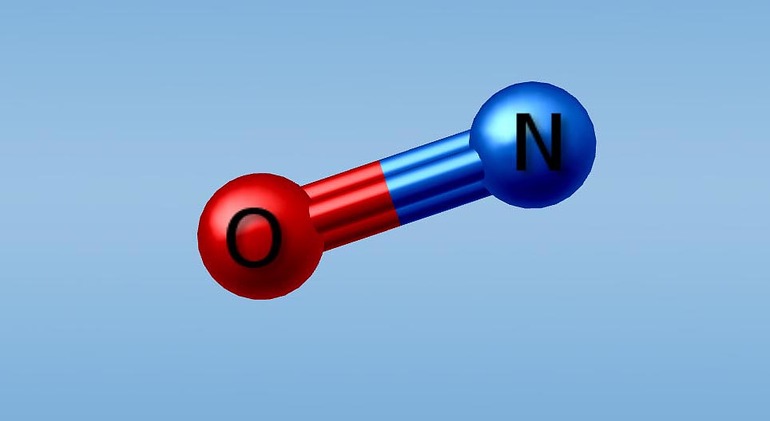
 Оксид азота – химическое соединение группы окисей азота, в котором азот присутствует во II степени окисления. Он имеет один непарный радикальный электрон, следовательно, является нестабильным, имеет высокую реакционную способность и обладает свойствами свободного радикала.
Оксид азота – химическое соединение группы окисей азота, в котором азот присутствует во II степени окисления. Он имеет один непарный радикальный электрон, следовательно, является нестабильным, имеет высокую реакционную способность и обладает свойствами свободного радикала. Оксид азота широко применяется в традиционной медицине при различных заболеваниях и оказывает положительное влияние на:
Оксид азота широко применяется в традиционной медицине при различных заболеваниях и оказывает положительное влияние на: