Донаторы оксида азота (нитраты), L-аргинин, или ингибиторы синтазы оксида азота при остром инсульте
Вопрос Являются ли донаторы оксида азота, L-аргинин или ингибиторы синтазы оксида азота безопасными и эффективными лекарствами для использования у людей вскоре после того, как они перенесли инсульт?
Актуальность: Оксид азота является ключевой молекулой, участвующей в контроле кровяного давления, кровотока и мозговой активности, как до, так и во время мозгового приступа (инсульта, возникающего вследствие закупорки или разрыва артерии в головном мозге). Лекарства, которые продуцируют оксид азота или контролируют его продукцию, могут быть полезны при остром инсульте. В этом обзоре были рассмотрены испытания, в которых применение этих лекарств изучали у людей, перенесших инсульт в течение последних нескольких дней.
Характеристика исследований: Этот обзор актуален по состоянию на сентябрь 2016 года. Мы включили пять исследований, в которых приняли участие 4197 человек; во всех испытаниях исследовали глицерила тринитрат, лекарство, применяемое как накожный пластырь, который высвобождает оксид азота.
Основные результаты: В целом, глицерила тринитрат не улучшил показатели смертности или зависимости по сравнению с теми, кто не получал глицерила тринитрат после острого инсульта. Глицерила тринитрат не привел к улучшению других исходов, включая смерть и качество жизни. Глицерила тринитрат снижает кровяное давление, повышает частоту сердечных сокращений и частоту головной боли у людей с острым инсультом.
Качество доказательств Основные результаты основаны на доказательствах высокого качества.
Выводы В настоящее время нет достаточных доказательств, чтобы рекомендовать применение лекарств, влияющих на выработку оксида азота при остром инсульте.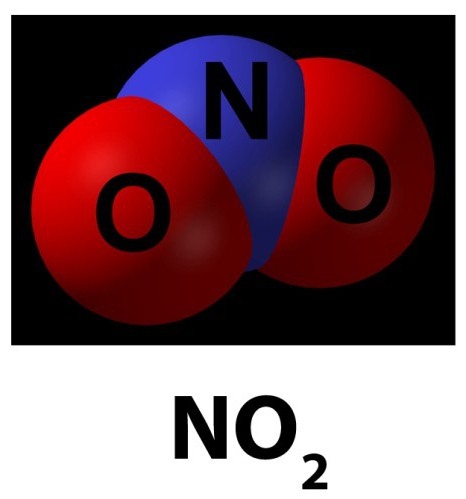 В целом, глицерила тринитрат недорогой, снижает кровяное давление, повышает частоту сердечных сокращений и головной боли, но не приводит к изменению клинических исходов у людей, перенесших инсульт.
В целом, глицерила тринитрат недорогой, снижает кровяное давление, повышает частоту сердечных сокращений и головной боли, но не приводит к изменению клинических исходов у людей, перенесших инсульт.
Оксид азота как средство лечения СOVID-19: новое направление исследований
Ингалируемый оксид азота (NO) обладает селективным вазодилатирующим действием в отношении легочных сосудов, не оказывая системного воздействия на гемодинамику. Снижая сосудистое сопротивление в вентиллируемых участках легких, NO улучшает вентилляционно-перфузионное отношение и может увеличивать системную оксигенацию. NO десятилетиями используется в лечении пациентов с легочной гипертензией, острым респираторным дистресс-синдромом (ОРДС), правожелудочковой недостаточностью после кардиохирургических вмешательств или пересадки легких. NO используется как «спасительное» мероприятие при экстремальной гипоксии, для уменьшения потребности в ЭКМО, а также оптимизации ИВЛ при ОРДС. На новостном ресурсе Medscape опубликовано интервью Lorenzo Berra, медицинского директора по респираторной поддержке в Massachusetts General Hospital, также занимающегося исследованиями в области анестезиологии в Harvard Medical School, посвященное возможной роли NO в лечении COVID-19.
Помимо вазодилатирующего действия, NO обладает еще рядом свойств, ценных в лечении пациентов с COVID-19: он является бронходилататором, обладает противовоспалительным действием, а также уменьшает аггрегацию тромбоцитов, что снижает вероятность тромбообразования. Наконец, группа доктора Berra рассматривает гипотезу о вирулицидном действии NO. Они опираются на некоторые исследования, которые проводились в отношении SARS. Так, было показано, что применение ингаляции NO у пациентов с ОРДС существенно ускоряет улучшение рентгенологической картины, что не может быть связано только с улучшением оксигенации (https://www.medscape.com/viewarticle/478772). В другом исследовании было показано, что in vitro NO оказывает ингибирующее действие на вирус SARS-СoV (https://pubmed.
Вазодилатирующего эффекта с улучшением оксигенации можно достичь при использовании небольшой дозы NO — стартуя с 20-40 ppm. Однако предполагается, что вирулицидный эффект может быть достигнут при использовании высоких доз NO (в клинических исследованиях сейчас тестируются дозы до 250 ppm). Ограничением для использования NO является низкая фракция выброса ЛЖ, особенно в случае развития острой левожелудочковой недостаточности с отеком легких. Доктор Berra указывает, что применение NO требует контроля уровня диоксида азота, метгемоглобина, а также почечной функции.
По материалам:
Can Nitric Oxide Prevent COVID-19 Infection or Progression? — Medscape — May 26, 2020
https://www.medscape.com/
Текст: Шахматова О.О.
Исследование уровня оксида азота
О чем расскажет оксид азота?
Простое и информативное исследование, которое помогает врачам-пульмонологам.
Оксид азота (химическая формула – NO) давно известен как загрязнитель воздуха, который содержится в сигаретном дыме и выхлопных газах. И лишь относительно недавно ученые обнаружили, что это вещество присутствует в организме человека и животных. Оксид азота выполняет важные биологические функции: помогает передавать нервные сигналы, участвует в подавлении воспаления, расширяет просвет сосудов, бронхов, а является свободным радикалом и может повреждать клетки.
NO – неотъемлемый участник большинства процессов, происходящих в легких. Он присутствует в выдыхаемом воздухе, и по его концентрации можно судить о состоянии дыхательной системы. Например, определение оксида азота в выдыхаемом воздухе очень помогает в диагностике бронхиальной астмы.
В каких случаях проводят это исследование?
Основные показания для измерения уровня оксида азота в выдыхаемом воздухе:
- Диагностика атопической и эозинофильной бронхиальной астмы в случаях, когда после проведения других исследований диагноз все еще остается сомнительным.
- Иногда этот тест применяют для диагностики других заболеваний, таких как хронические обструктивные болезни легких (ХОБЛ), хронический и эозинофильный бронхит, пневмония, идиопатический фиброзирующий альвеолит и др.
- Подбор оптимального лечения. Определение уровня оксида азота в выдыхаемом воздухе помогает проверить, насколько хорошо помогают ингаляции стероидов.

- Проверка эффективности лечения. На фоне терапии пациент может чувствовать себя хорошо. Но если во время исследования в воздухе, который он выдыхает, повышено содержание оксида азота, это говорит о том, что коррекция достигнута не полностью. Врач повысит дозы препаратов, и это поможет улучшить состояние больного в долгосрочной перспективе.
Тест на уровень NO в выдыхаемом воздухе зачастую помогает разобраться в причинах хронического кашля, если исследования показывают, что функция внешнего дыхания в норме. Вы можете пройти такую процедуру в клинике «Сова». У нас ее выполняют опытные врачи-пульмонологи.
Как подготовиться к процедуре?
Итак, врач сказал, что вам нужно провести исследование содержания оксида азота в выдыхаемом воздухе и назначил дату визита в клинику. Для того чтобы тест показал точные результаты, к нему нужно немного подготовиться и соблюдать некоторые рекомендации:
- Лучше проходить исследование на пустой желудок, или, по крайней мере, ничего не есть в течение 1–3 часов.

- За сутки до визита в клинику нужно избегать физических нагрузок, курения, употребления алкоголя.
- Нужно прекратить принимать бронхорасширяющие препараты короткого действия за 6 часов до процедуры, а длительного действия – за 12 часов. Еще лучше, если получится отказаться от всех препаратов за 12 часов.
Как происходит измерение уровня оксида азота в выдыхаемом воздухе?
Ничего страшного в процедуре нет, это совсем не больно и не причинит вам никаких неприятных ощущений. Исследование продолжается около пяти минут.
Измерение уровня оксида азота проводят с помощью специального небольшого прибора – портативного газоанализатора. К нему подсоединяют трубку, а на нее надевают одноразовый чистый мундштук, который пациент должен взять в рот. Нужно сделать вдох и выдохнуть воздух в мундштук. При этом нос должен быть зажат (врач даст вам специальный зажим). Через несколько секунд газоанализатор покажет результат. Всё, исследование закончено. Но, возможно, его придется повторить, чтобы врач мог убедиться в достоверности результата.
Но, возможно, его придется повторить, чтобы врач мог убедиться в достоверности результата.
Преимущества этого метода диагностики налицо:
- Он весьма информативен, зачастую помогает быстро подтвердить или исключить диагноз, проверить состояние дыхательной системы.
- Для этого не нужно большое, сложное, дорогое оборудование.
- Процедура проходит очень быстро, и врач тут же получает результат. Если нужно, исследование можно быстро повторить.
- Для пациента это совершенно безопасно и безболезненно. Никакого дискомфорта. Не нужно госпитализироваться в стационар – достаточно приехать на несколько минут в клинику. У некоторых людей во время глубокого вдоха и выдоха может закружиться голова, но это не опасно. Врач попросит немного отдохнуть, успокоиться, и повторит тест.
Как врач интерпретирует результаты, и что они означают?
Концентрация оксида азота в выдыхаемом воздухе измеряется в миллиардных долях, что обозначается сокращенно как ppb:
|
Значение в ppb |
Результат исследования |
|
менее 25 (у детей – менее 20) |
В дыхательных путях с высокой степенью вероятности нет воспалительного процесса. |
|
26–50 (у детей – 21–35) |
«Серая зона». Результаты исследования оценивают в совокупности с симптомами, которые беспокоят пациента. |
|
более 50 (у детей – более 35) |
В дыхательных путях есть воспаление. Нужно назначить терапию, которая улучшит состояние пациента. |
Интерпретируя результаты, врач должен учитывать симптомы и жалобы пациента, данные других исследований, в том числе предыдущих определений уровня NO, поинтересоваться, является ли пациент курильщиком (если да – какой стаж), не болен ли они сейчас простудой. Важно оценивать уровень оксида азота в выдыхаемом воздухе в динамике: как он изменяется с течением времени, после использования ингалятора.
По результатам исследования врач может:
- Диагностировать бронхиальную астму
- Назначить стероиды.
- Увеличить дозировку стероидов.
- Порекомендовать пациенту повторить тест 3–4 раза в год, чтобы проверить, как протекает заболевание, не стоит ли изменить план лечения.
Пройдите исследование уровня оксида азота в выдыхаемом воздухе в клинике «Сова». У нас его проводят опытные врачи-пульмонологи прямо во время приема в кабинете. Доктор сразу же даст рекомендации, составит оптимальную программу лечения, если показатель окажется повышенным.
ОКСИД АЗОТА: СВОЙСТВА, БИОЛОГИЧЕСКАЯ РОЛЬ, МЕХАНИЗМЫ ДЕЙСТВИЯ
В настоящее время большое внимание уделяется изучению роли оксида азота (NO), как универсального трансмиттера, в развитии различных патологических состояний. NO вызывает расслабление гладких мышц сосудов, участвует в защите от патогенов, является нейромедиатором, регулирует программируемую гибель и пролиферацию клеток, играет важную роль в секреторной и репродуктивной системе. В
связи с этим целью настоящего обзора является попытка обобщить данные
литературы для того, чтобы приблизиться к более глубокому пониманию возможностей
использования NO в биологии и медицине.
В
связи с этим целью настоящего обзора является попытка обобщить данные
литературы для того, чтобы приблизиться к более глубокому пониманию возможностей
использования NO в биологии и медицине.Физические свойства
В свободном состоянии монооксид азота (NO) – это бесцветный газ без запаха, обладающий высокой реакционной способностью. Его молекулярная масса составляет 30,01 г/моль, растворимость в воде – 74 см3/дм3, показатель преломления – 1,0002697, температура плавления – 163,6 °С, температура кипения – 151,7 °С [5].
Основным природным источником NO являются
электрические разряды молний в грозу. При сгорании топлива примерно 90% оксидов
азота превращается в NO, а оставшиеся 10% – в диоксид азота [20]. В ходе химических реакций значительная
часть монооксида азота превращается в N2O. Это бесцветный
газ со сладковатым вкусом, большие количества которого приводят к притуплению
болевой чувствительности и потере сознания, благодаря чему в смеси с кислородом
(80% N2О+20% О2) он иногда применяется для наркоза.
Обнаружено, что оксид азота вырабатывается различными клетками организма – эндотелиоцитами, эпителиоцитами, мезангиоцитами, миоцитами, лимфоцитами, нейтрофилами, тромбоцитами, макрофагами, моноцитами, фибробластами, нейронами, гепатоцитами, тучными клетками – и контролирует в них многие функции и биохимические процессы [21; 22]. Одно из наиболее удивительных открытий последнего десятилетия – установление роли NO как внутриклеточного мессенджера.
Открытие
Профессор доктор биологических наук А.Ф. Ванин в 1965 году обнаружил в биологических объектах с помощью электронного парамагнитного резонанса радикалы неизвестной природы, показав их гипотензивное действие. В 1985 г. он получил данные, что открытые радикалы имеют отношение к окиси азота [16].
В 1980 году фармаколог из Университета штата Нью-Йорк Р. Фарчготт
в эксперименте показал, что ацетилхолин расширяет кровеносные сосуды в тех
случаях, когда стенка сосудов не повреждена. Р. Фарчготт пришел к выводу, что
неповрежденные эндотелиальные клетки продуцируют сигнал, расслабляющий гладкую
мускулатуру сосудов. Этот сигнал молекулы был назван EDRF (эндотелиум-получательно-распределяющий фактор).
Р. Фарчготт пришел к выводу, что
неповрежденные эндотелиальные клетки продуцируют сигнал, расслабляющий гладкую
мускулатуру сосудов. Этот сигнал молекулы был назван EDRF (эндотелиум-получательно-распределяющий фактор).
Независимо от Р. Фарчготта в поисках неизвестной сигнальной молекулы принимал участие доктор Л. Игнарро из Калифорнийского университета в Лос-Анджелесе. В 1986 году Л. Игнарро заключил, что EDRF идентичен окиси азота.
В 1977 году врач-фармаколог Ф. Мюрад из Медицинской школы Техасского университета в Хьюстоне установил, что нитроглицерин и другие родственные сосудорасширяющие вещества освобождают окись азота, которая расширяет гладкую мускулатуру клеток.
В июле 1986 года Р. Фарчготт и Л. Игнарро получили аналогичные данные. Это вызвало лавину исследований в различных лабораториях во всем мире. 10 декабря 1998 г. в Стокгольме (Швеция) трем ученым из США: Р. Ферчготту, Л. Игнарро и Ф. Мюраду, была присуждена Нобелевская премия по физиологии и
медицине за открытие роли оксида азота как сигнальной молекулы в сердечно-сосудистой
системе [12].
Синтез монооксида азота в организме
Образование монооксида азота происходит в результате окисления атомом кислорода L-аргинина в присутствии специфического фермента NO-синтазы [1].
2L-аргинин + 3НАДФН + 4O2 + 3H+ → 2L-цитруллин + 2NO + 3НАДФ+ + 4h3O
В зависимости от
структуры и локализации различают следующие изоформы NO-синтаз
(NOS): эндотелиальные (eNOS), нейрональные (nNOS) и макрофагальные (mNOS). Активность nNOS имеет максимальное значение около 300 нмоль/мг/мин, mNOS – до 1000 нмоль/мг/мин, eNOS – около 15 нмоль/мг/мин. Молекула nNOS (161 kDa) состоит
из 1434 аминокислотных остатков, mNOS (131 kDa) – 1153, eNOS (133 kDa) –1203. nNOS и mNOS содержатся, главным образом, в
цитоплазме клетки, eNOS связана с клеточными мембранами [9; 22; 23]. В
активный центр NOS входит железопорфириновый комплекс,
содержащий цистеин или метионин. В синтез монооксида азота посредством
NO-синтаз включаются шесть кофакторов:
никотинамидадениндинуклеотидфосфат (НАДФ-Н), флавинадениндинуклеотид (ФАД),
флавинмононуклеотид (ФМН), тетрагидробиоптерин, гем и кальмодулин.
Изоформы NOS отличаются по механизму действия и биологическому значению для организма. Поэтому их подразделяют на конститутивную (cNOS) и индуцибельную (iNOS). Нейрональная NOS является только конститутивной, mNOS –индуцибельной формой, eNOS в 80% является конститутивной и в 20% – индуцибельной ферментативной формой (табл. 1).
Активность cNOS зависит от концентрации Са2+ и
кальмодулина. Механизм действия eNOS и nNOS имеет сходный
характер. Под влиянием вазодилятаторных агентов (ацетилхолина, аденозина, 5-оксиптриптамина,
глутамата, брадикинина, гистамина и других) в цитозоле эндотелиальных
клеток возрастает уровень Са2+, который соединяется с
кальмодулином. Комплекс Ca-кальмодулин выступает как кофактор, активирующий
NOS. Под влиянием ингредиентной NOS образуются малые количества NO, который осуществляет
местную регуляцию. Он диффундирует к прилегающим гладким мышцам, вызывая
последовательную активацию гуанилатциклазы, протеинкиназы G, протеинфосфатазы. В
результате дефосфорилируется одна из субъединиц К+ мембранного
канала, приводя к усилению калиевой проводимости через плазматическую мембрану миоцитов.
Вследствие конформационных изменений, вызванных гиперполяризацией мембраны,
снижается проницаемость кальциевых каналов и падает уровень свободного Са2+
в клетках. Это вызывает расслабление миофибрилл и является причиной снижения тонуса
кровеносных сосудов [13; 22; 24; 26; 32].
В
результате дефосфорилируется одна из субъединиц К+ мембранного
канала, приводя к усилению калиевой проводимости через плазматическую мембрану миоцитов.
Вследствие конформационных изменений, вызванных гиперполяризацией мембраны,
снижается проницаемость кальциевых каналов и падает уровень свободного Са2+
в клетках. Это вызывает расслабление миофибрилл и является причиной снижения тонуса
кровеносных сосудов [13; 22; 24; 26; 32].
Таблица 1
Сравнительная характеристика NOS [1]
|
Характеристики |
nNOS |
iNOS |
eNOS |
|
Клеточная экспрессия |
Нейроны, эпителиоциты, эндотелиоциты, миоциты скелетных мышц и сосудов, нейтрофилы, тромбоциты, f3-клетки поджелудочной железы |
Макрофаги, нейтрофилы, эпителиоциты, кардиомиоциты, глиальные клетки, миоциты сосудов, эндотелиоциты, нейроны |
Эндотелиоциты, кардиомиоциты, тромбоциты, нейроны |
|
Гены |
NOS1
(12q24. |
NOS2 (17q11.2-q12) |
NOS2 (7q35-7q36) |
|
Основные регуляторные механизмы |
Ca2+зависимый Ca-дистрофин |
Ca2+-независимый |
Ca2+зависимый (Ca-кальмодулиновый), Ca2+-зависимый (фосфорилирование) |
|
Субклеточная локализация |
Цитоплазма, эндоплазматический ретикулум, сарколемма |
Фагосомы, пероксисомы, мембрана, ядро клетки, митохондрии |
Аппарат Гольджи, мембрана клетки в области маленьких инвагинаций, которые содержат трансмембранный кавеолин, ядро клетки, митохондрии |
Активация сNOS наблюдается
при гипоксических
состояниях организма, при вазоконстрикции
сосудов, под влиянием фактора
активации тромбоцитов (ФАТ) через ФАТ-рецепторы
на клетках эндотелия [2; 6; 12]. Монооксид
азота, продуцируемый под влиянием nNOS и eNOS, при некоторых формах патологии,
наряду с регуляторным, оказывает и протективное действие [10; 11; 21].
Монооксид
азота, продуцируемый под влиянием nNOS и eNOS, при некоторых формах патологии,
наряду с регуляторным, оказывает и протективное действие [10; 11; 21].
iNOS появляется в клетках (макрофагах, нейтрофилах, кератиноцитах, фибробластах, хондроцитах, остеокластах) только после индукции их бактериальными эндотоксинами и некоторыми медиаторами воспаления (гамма-интерфероном, ИЛ-1, ИЛ-2, фактором некроза опухоли), активными формами кислорода, а также гормонами, которые воздействуют на синтез циклического аденозинмонофосфата (адреналин, глюкагон). iNOS участвует в реакциях неспецифического иммунитета [12; 15; 18; 20-23; 26].
Физиологическая роль и механизмы действия NO
Все многообразие физиологических эффектов NO можно разделить на 3 типа:
• регуляторное влияние;
• защитное действие;
• повреждающее действие [17; 19].
Центральная и периферическая нервная система. Наиболее хорошо изучена роль NO в нервной системе, где окись азота активирует процесс выброса
нейромедиаторов из нервных окончаний во время синаптической передачи. Более
того, молекула NO сама может играть роль нейромедиатора
[4; 12; 20; 21; 22; 26].
Наиболее хорошо изучена роль NO в нервной системе, где окись азота активирует процесс выброса
нейромедиаторов из нервных окончаний во время синаптической передачи. Более
того, молекула NO сама может играть роль нейромедиатора
[4; 12; 20; 21; 22; 26].
nNOS регулирует рост и дифференцировку клеток ЦНС и, предположительно, их восстановление после локальных ишемических повреждений головного мозга [11; 12; 17]. В ишемизированном участке мозга глутаматергические нейроны вместо физиологической порции нейротрансмиттера выделяют поток глутамата, который обрушивается на NO-синтезирующие нейроны, – происходит так называемый глутаматный каскад. В результате повышается поступление Ca2+ в клетку и, как следствие, возрастает синтез и выделение из нейрона NO [23]. Ингибиторы синтеза оксида азота (нитроаргинин, гемоглобин) защищают нейроны, снижая их гибель на 73% [4; 7; 26].
NO участвует в
процессах долговременной синаптической потенциации, связанной с образованием памяти. Таким образом, в мыслительной деятельности окись азота является и
непосредственным участником, и косвенным регулятором [11; 15; 23].
Таким образом, в мыслительной деятельности окись азота является и
непосредственным участником, и косвенным регулятором [11; 15; 23].
Сердечно-сосудистая система. NO поддерживает вазодилатацию, регулирует кровоток и контролирует базальное артериальное давление [7; 12; 16]. Окисленные липопротеины низкой плотности (ЛПНП) подавляют синтез оксида азота в тромбоцитах, стимулируют их агрегацию, образование тромбоксана А2 и серотонина, способствуя дисфункции эндотелия и нарушению структуры сосудов, ведущих к развитию атеросклероза [11; 12].
В случае инфаркта миокарда оксид азота стимулирует ангиогенез [12]. NO способствует синтезу эндотелиального фактора роста, тормозит пролиферацию и миграцию гладкомышечных клеток [11], гипертрофию сосудов [1], подавляет синтез внеклеточного матрикса, поддерживая всем этим нормальную структуру сосудистой стенки.
Пищеварительный и
урогенитальный тракты, дыхательная система. Оксид азота участвует в обеспечении
моторной функции желудочно-кишечного тракта, при этом некоторые заболевания (болезнь Гиршспрунга,
ахалазия кардии,
хроническая
псевдообструкция кишечника) обусловлены снижением числа
внутрикишечных нейронов, вырабатывающих NO [12]. NO регулирует поступление
желчи в кишечник и является одним из важных факторов
защиты слизистой желудка путем воздействия на её кровоснабжение.
Оксид азота участвует в обеспечении
моторной функции желудочно-кишечного тракта, при этом некоторые заболевания (болезнь Гиршспрунга,
ахалазия кардии,
хроническая
псевдообструкция кишечника) обусловлены снижением числа
внутрикишечных нейронов, вырабатывающих NO [12]. NO регулирует поступление
желчи в кишечник и является одним из важных факторов
защиты слизистой желудка путем воздействия на её кровоснабжение.
NO, вырабатываемый в
гепатоцитах, защищает эти клетки от действия ряда токсичных веществ, включая этанол
и парацетамол.
Эндогенный оксид азота подавляет синтез белка в печени, ингибирует ряд ферментов
энергетического обмена, в том числе митохондриальную аконитазу, НАДН-дегидро-геназу
и сукцинатдегидрогеназу
(комплексы I и II дыхательной цепи). При поражении гепатотоксичными
окислителями NO может действовать как антиоксидант,
сохраняя клеточные запасы восстановленного глутатиона. Оксид азота замедляет распад глюкозы, ингибируя глицеральдегидфосфатдегидрогеназу. Таким образом, защитное действие NO может быть обусловлено замедлением обменных
процессов и сохранением запасов энергии в печени.
Таким образом, защитное действие NO может быть обусловлено замедлением обменных
процессов и сохранением запасов энергии в печени.
В различных отделах почки представлены все три изоформы NOS. Оксид азота активно участвует в её физиологических процессах: регулирует почечную гемодинамику, гломерулярную фильтрацию, ингибирует транспорт Na+ и увеличивает его экскрецию.
NO играет важную роль в регуляции функций легких и в патофизиологии заболеваний системы дыхания. Активные радикалы азота увеличивают продукцию муцина и эпителиальной слизи, ускоряют движения ресничек реснитчатого эпителия, индуцируют активность апикальных анионных и базолатеральных калиевых каналов эпителиоцитов, способствуя механической элиминации инфекционных агентов.
При цилиарной дискинезии, муковисцидозе, дефиците α1-антитрипсина, легочной артериальной гипертензии наблюдается снижение содержания NO в выдыхаемом воздухе [1].
Иммунонейроэндокринная система. Установлена важная роль оксида азота в регуляции иммунонейроэндокринной системы [8; 9; 15]. Запуск стресс-реакции происходит за счет активации гипоталамо-гипофизарно-надпочечниковой и симпатоадреналовой систем [27]. Торможение активности nNOS способствует увеличению концентрации вазопрессина и окситоцина [29]. NO ингибирует активацию гипоталамо-гипофизарно-надпочечниковой системы, вызываемую вазопрессином, обладая стресслимитирующим действием [9; 13; 15; 29].
Аксоны NO-ергических нейронов надпочечников контактируют с хромаффинными клетками, продуцирующими катехоламины. Выделение оксида азота происходит одновременно с норадреналином. В небольших концентрациях NO угнетает высвобождение катехоламинов из надпочечников и симпатических нервных окончаний, приводя к ограничению стресс-реакции [28].
Оксид азота выполняет функцию медиатора воспаления. Каждая фаза асептического воспаления ассоциирована с определенными изоформами NOS. На ранней фазе воспалительной реакции под действием медиаторов (гистамина, брадикинина, простагландинов и лейкотриенов) [30] происходит стимуляция продукции оксида азота с помощью nNOS. Параллельно усиливается активность еNOS. В клетках сосудистого эндотелия NO активирует растворимую гуанилатциклазу, что приводит к усиленному образованию цГМФ, который вызывает релаксацию гладкомышечных клеток сосудов, увеличивая сосудистую проницаемость [17]. сNOS и iNOS имеют отношение к продукции оксида азота в ранней фазе воспаления.
В развитие поздней фазы воспаления вносит вклад только оксид азота, продуцируемый с помощью iNOS, локализованной в лейкоцитах. На этой стадии воспалительного процесса NO стимулирует синтез и высвобождение провоспалительных цитокинов – ИЛ-1, ИЛ-2, ИЛ-3, ИЛ-6, лейкотриенов, хемокинов, которые, в свою очередь, стимулируют миграцию лейкоцитов в очаг воспаления. NOS контролирует биосинтез ИЛ-4, ИЛ-10, ИЛ-11 и ИЛ-13, которые относятся к противовоспалительным цитокинам [17; 30].
Действие высоких и низких концентраций оксида азота
Действие оксида азота опосредовано его концентрацией (рисунок). Малые физиологические концентрации NO (<10-6 М), которые сопровождают функционирование конститутивных эндотелиальных и нейронных изоформ NOS, оказывают цито- и нейропротекторное действие. Его нетоксические уровни обладают выраженной антиапоптотической активностью, вероятно, за счет непосредственного нитрозилирования внутриклеточных цистеиновых протеаз (каспаз-3, -8) и других проапоптотических белков [3; 25]. Показано, что в больших концентрациях он индуцирует апоптоз клеток определенного типа – макрофагов, тимоцитов, клеток островков поджелудочной железы, некоторых нейронов и опухолевых клеток. Повреждение ДНК активными радикалами азота приводит к накоплению p53, которое считают индикатором NO-опосредованного апоптоза [1].
Действие высоких и низких концентраций оксида азота [1]
Высокие концентрации оксида азота, которые возникают при работе iNOS, вызывают цитотоксическое, антибактериальное, противовирусное, противогрибковое действие, а также активируют воспалительный процесс [7; 12]. Показано, что NO, вступая в реакцию с железо- и тиолсодержащими участками ферментов митохондриального дыхания, репликации ДНК инфекционных агентов, проявляет прямое бактерицидное действие. Он ингибирует многие вирусные протеиназы и факторы транскрипции, необходимые для вирусной репликации, а также усиливает противовирусный эффект интерферона-γ. NO уменьшает или препятствует размножению вируса HIV [31].
Опосредованное влияние на инфекционные агенты связано с ингибированием каталазы, которое приводит к накоплению перекиси водорода и гидроксильного радикала, образованию пероксинитрита, более токсичного, чем оксид азота, для большинства бактериальных, вирусных и грибковых инфекционных агентов. Показано, что NO и пероксинитрит оказывают выраженное бактерицидное действие на Streptococcus группы B, Staphylococcus aureus, Mycoplasma pneumonia, Chlamydia, Leishmania, Mycobacterium tuberculosis.
Пролонгированная во времени высокая концентрация может привести к нарушению баланса активности внутриклеточных сигнальных путей. Активные радикалы азота активируют или ингибируют белки ионных каналов, ядерные факторы транскрипции, киназы, каспазы, металлопротеиназы, метилтрансферазы, фосфодиэстеразы.
Заключение
Таким образом, разнообразие эффектов оксида азота обусловлено образованием физиологически активных метаболитов NO и его взаимодействием с различными молекулярными мишенями, а также носит дозозависимый характер. Анализ литературы показал, что многие аспекты NO еще до конца не изучены и зачастую противоречивы. Тем не менее выяснение механизма действия оксида азота заслуживает пристального внимания и дальнейшего исследования, поскольку способствует решению многих фундаментальных проблем биологии и имеет большое практическое значение для медицины.
Рецензенты:
Буйлова Т.В., д.м.н., профессор, директор Института реабилитации и здоровья человека ННГУ им. Н.И. Лобачевского г. Нижний Новгород;
Перетягин С.П., д.м.н., профессор, президент Ассоциации российских озонотерапевтов, г. Нижний Новгород.
Биологическая роль оксида азота при сахарном диабете | Бондаренко
1. Балаболкин М.И. Патогенез сахарного диабета типа 1. // В кн.: Диабетология. — М. «Медицина» — 2000. — С. 1 99 — 217.
2. Ванин А.Ф., Манухина Е.Б., Лапшин А.В., Меерсон Ф.З. Усиление синтеза оксида азота в стенке аорты при экспериментальном инфаркте миокарда. // Бюллетень экспериментальной биологии и медицины. — 1993. — N. 8. — С. 142 — 144.
3. Ванин А.Ф. NO в биологии: история, состояние и перспективы исследований. // Биохимия. — 1998. — Т.63, вып. 7. — С. 966 — 975.
4. Ванин А.Ф. Динитрозильные комплексы железа и S-нитрозотиолы — две возможные формы стабилизации и транспорта оксида азота в биосистемах. // Биохимия. — 1998. — Т.63, вып. 7. — С. 924 — 938.
5. Волин М.С., Дэвидсон К.А., Камински П.М., Фейнгерш Р.П., Мохаз- заб-Х К.М. Мехенизмы передачи сигнала оксидант-оксид азота в сосудистой ткани. // Биохимия. — 1998. — Т. 63, вып. 7. — С. 958 — 965.
6. Голиков П.П., Голиков А.П. Роль оксида азота в патологии. // Международный Медицинский Журнал ТОП медицина. — 1999. — N. 5. — С. 24 — 27.
7. Голубев А.Г. Окись азота (NO) в ЦНС. // Бюллетень экспериментальной биологии и медицины. — 1 994. — Т. 1 17. — N. 2. — С. 201.
8. Дедов И.И., Шестакова М.В. «Медиаторы» прогрессирования диабетической нефропатии. //В кн.: Диабетическая нефропатия. — М. «Универсум Паблишинг» — 2000. — С. 66 — 79.
9. Маеда X., Акаике Т. Оксид азота и кислородные радикалы при инфекции, воспалении и раке. // Биохимия. — 1 998. — Т. 63, вып. 7. — С. 1007- 1019.
10. Малышев И.Ю. Введение в биохимию оксида азота. Роль оксида азота в регуляции основных систем организма. // Российский журнал гастроэнтерологии, гепатологии, колопроктологии. — 1997. — N. 1. — С. 49 — 55.
11. Малышев И.Ю., Манухина Е.Б. Стресс, адаптация и оксид азота. // Ж. Патологической физиологии и экспериментальной терапии. — 1 998. — Т. 63, вып. 7.N. — С. 992 — 1006.
12. Невзорова В.А., Зуга М.В., Гельцер Б.И. Роль окиси азота в регуляции легочных функций. // Терапевтический архив. — 1997. N. 3. — С. 68 — 73.
13. Недоспаев А.А. Биогенный NO в конкурентных отношениях. // Биохимия. — 1 998. Т. 63, вып. 7. — С. 881 — 904
14. Поленов С.А. Окись азота в регуляции функций желудочно-кишечного тракта. // Российский журнал астроэнтерологии, гепатологии, колопроктологии. — 1 998. — N1. — С. 53 — 61
15. Фищенко А.Д., Верткин АЛ., Мартынов А.И. Применение нитратов в лечении ишемической болезни сердца. // Кардиология. — 1996. — Т. 36. -Ы6.-С.88- 97.
16. Цапин А.И., Степаничев М.Ю., Либе М.Л., Гулеева Н.В. Определение NO-синтазы в мозгу. // Бюллетень экспериментальной биологии и медицины. — 1 994. — Том. 1 17. — N. 1. — С. 39 — 41.
17. Цыганин А.А., Медвинская Н.А., Козяр В.В. Влияние окиси азота на окислительное фосфорилирование митохондрий сердца, печени, мозга, почек и АТФ-азную активность актиномиозина миокарда. // Анестезиология и реаниматология. — 1 991. — N. 2. — С. 7 — 8.
18. Чирков Ю.Ю., Белушкина H.H., Тыщук И.А., Северина И.С. // Вестн. АМН СССР. — 1991.-N. 10.-С. 51 -54.
19. Шебеко В.И., Родионов Ю.Л. Ингибирование NocHHTa3bi вызывает устойчивую прессорную реакцию в условиях 10-минутной внутривенной инфузии ангиотензина двум наркотизированным крысам. // Бюллетень экспериментальной биологии и медицины. — 1 993. N.11. -С. 479-480.
20. Шестакова М.В., Северина И.С., Дедов И.И. и соавт. Эндотелиальный фактор релаксации в развитии диабетической нефропатии. // Вестн. Акад. Мед. Наук — 1 995. — N 5. — С. 30 — 34.
21. Шестакова М.В., Кутырина И.М., Рагозин А.К. Роль сосудистого эндотелия в регуляции почесной гемодинамики. // Тер. Архив. — 1 994. — N2.-С. 83 — 86.
22. Albert J., Wallen H., Li N., Frostell С., Hjemdahl P. Effects of nitric oxide ingalation on platelet function during systemic inhibition of endogenous NO production by L-NMMA. // Second International Congress, Stockholm, August 29-30. — 1997. — P. 53.
23. Aruoma O.l. Free radicals and antioxidant strategies in sports. // J. of Nutritional Biochem. — 1 994. — Vol. 5. — N. 8.- P. 370 — 381.
24. Bank N., Aynedjian H. Role of EDRF (nitric oxide) in diabetic renal hyperfiltration. // Kidney Int. — 1 993. — Vol. 43. — P. 1306 — 1312.
25. Beckman J.S., Chen J., Ischiropoulos H., Grow J.P. Oxidative chemistry of peroxynitrite. // Methods Enzymol. — 1 994. Vol. 233. — P. 229 — 240.
26. Bluethmann H., Rothe J., Schultze N.# Trachuk М., Koebel P. Establishment of the role of IL-6 and TNF receptor 1 using gene knockout mice. // J. of Leucocyte Biology. — 1 994. — Vol. 63. — P. 175 — 195.
27. Brown J.F., Tepperman B.L., Whittle B.J.L., Moncada S. Differential distribution of nitric oxide synthase between cell fractions isolated from the red gastric mucosa. // Biochem. Biophys. Res. Commun. — 1 992. — Vol. 184. — N. 4. — P. 680 — 685.
28. Buttery L.D.K., Springall D.R., Evans T.J., Parums D.V., Standfield N., Polac J.M. Inducible nitric oxide synthase (iNOS) is present in atherosclerotic vessels and relates to the severity of the lesion. // Endothelium. (Suppl.) — 1995. — Vol. 3. — P. 37.
29. Cason B.A., Shubayev I., Hickey R.F. Blockade of adenosine triphosphate-sensitive potassium channels eliminates isoflurane-induced coronary vasodilatation. // Anesthesiology. — 1 994. — Vol. 81. N. 5,- P. 1245 — 1255.
30. Corbett J.A., Wang J.L., Hughes J.H. et al. Nitric oxide and cyclic GMF formation induced by interleucin-1 in islets of Langerhancse. Evidence for on effector role of nitric oxide in islet dysfunction. // Biochem. J. — 1992. Vol. 287. — P. 229 — 235.
31. Corraliza I.М., Campo M.L., Soler G.; Modolell M. Determination of arginase activity in macrophages: a micrometod. // J. of immunol. Methods. — 1994. — Vol. 1 74. — P. 1 — 2.
32. Drexler H., Hablawetz E., Lu W., Riede U., Christes A. Effects of nitric oxide formation on regional blood flow in experimental myocardial infarction. // Circulation. — 1 992. — Vol. 86. — N. 1. — P. 255 — 262.
33. Ducala R., Trasey K.J., Cerami A. Advanced Glycosylation products quench nitric oxide and mediate defective endothelium-dependent vasodilatation in experimental diabetes. //S. Clin. Invest. — 1991,- Vol. 87.-N. 2.-P. 432 -438.
34. Dudec R.R., Conforfo A., Bing R.J. Lysophosphatidylcholine-induced vascular relaxation of cGMF are mediated by endothelium-derived factor. // Proceeding of the Society for Exper. Biol. And Medicine. — 1993. — Vol. 203. — N. 4. — P. 474 — 479.
35. Ehring Т., Baumgart D., Krajcar М., Hummelgen М., Kompa S., Heusch G. Attenuation of myocardial stunning by the ACE inhibitor ramiprilat through a signal cascade of bradykinin and prostaglandins but not nitric oxide. // Circulation. — 1994. — Vol. 90. — N/ 3/ — P. 1368 — 1 385.
36. Endelman D.T., Watanabe М., Maulik N., Cordis G.A., ndelman R.M., Rousou J.A. et al. L-arginine reduced endothelial inflammation and myocardial stunning during ischemia/reperfusion. // Ann. Thorac. Surg. — 1995.-Vol. 60.-N. 5.-P. 1275 — 1281.
37. Garthwaite J., Charles S.L., Chess-Williams R. Endothelium-derived relaxing factor release on activation of NMDA receptors suggest role as intercellular messenger in the brain. // Nature. — 1 988. — Vol. 336. — P. 385 — 388.
38. Hamon М., Vallet B., Bauters C., Wernert N., McFadden E.P., Lablanche J.M., Dupuis B., Bertrand M.E. Long-term oral administration of L-argi- nine reduces intimal thickening and enchances neoendothelium-dependent acetylcholine-induced relaxation after arterial injury. // Circulation. — 1994. — Vol. 90. — N. 3. — P. 1357 — 1362.
39. Hecker H., Alam Т., Moonga B.S. et al. A role for endothelium-derived NO in bone resorption. // J. Physiol. — 1 991. — Vol. 438. — P. 307.
40. Hibbs J.B., Varvin Z., Taintor R.R. L-arginin is required for expression of the activated macrophage effector mechanism causing selectiv metabolic inhibition in target cells. // J. Immunology. — 1987. Vol. 138. — P. 550 — 565.
41. Hibbs J.B., Taintor R.R., Vavrin Z., Rachlin E.M. Nitric oxide: a cytotoxic activated macrophage effector molecule. // Biochem. Biophys. Res. Commun. — 1988. — Vol. 157. — P. 87 — 94.
42. Iyengar R., Stuehr D.J., Marietta M.A. Macrophage synthesis of nitrite, nitrate, and N-nitrosamines: precursors and role of the respiratory burst. // Proc. Natl. Acad. Sci. — 1987. — Vol. 84. — P. 6368 — 6373.
43. Keller R., Bassetti S., Keist R., Mulnsch A., Klauser S. Induction of NOS is a necessary precondition for expression of tumor necrosis factor- independent tumoricidal activity by activated macrophages. // Biochem. Biophys. Res. Commun. — 1992. — Vol. 1 84. N. 3. — P. 1346 — 1371.
44. Ketteler М., Wayne A. Border, Nancy A. Noble. Cytokines and L-argi- nine in renal injury and repair. // Am. J. Physiol. — 1994. — Vol. 267. — P. FI 97 — F207.
45. Kunz D., Muhl H., Walker G., Pfeilschiffer J. // Endothelium (suppl.). — 1993. -Vol. l.-S. 23.-P. 90.
46. Leiher A.M., Schray-UIz.B., Busse R. // Endothelium (suppl.). — 1993. — Vol. 1. — S. — 4. — P. 15.
47. Pein М., Ehlert U., Marcks R. et al. Nitric-oxide-synthase activity in vitro is different in IDDM at high and low risk for thr development of diabetic nephropathy. // Diabetologia. — 1994. — Vol. 37. (suppl. 1). — P. A4.
48. Palmer R.M.G., Ferrige A.G., Moncada S. Nitric oxide release accounts for the biologycal activity of endothelium-derived relaxing factor. // Nature. — 1 987. — Vol. 327. — P. 524 — 526.
49. Plane F., Garland C.J. Smooth muscle hyperpolarization and relaxation to acetylcholine in the rabbit basilar artery. // J. of the Autonomic Nervous System. — 1994. — Vol. 49. — P. SI 5 — SI 8.
50. Pfeilschifter J. Does nitric oxide, an inflamatory mediator of glomerular mesangial cells, have a role in diabetic nephropathy? // Kidney Int. — 1995. — Vol. 48 (suppl. 51). — P. S50 — S61.
51. Rembish S.J., Yang Y.L., Trush M.A. Inhibition of mitochondrial superoxide generation in rat alveolar macrophages by 12-Otetradecanoylphorbol-l 3- acetate: potential role of protein kinase C. // Research Communic. In Molecular Pathol. And Pharmacol. — 1994. — Vol. 85. — N. 2. — P. 115129.
52. Riedel М., Mugge a. Direct effects of estrogens on the vascular tone: characterisation and clinical importance. // Zeitschrift fur kardiologia. — 1994. — Vol. 83. — N. 10. — P. 768 — 774.
53. Robinson L.G., Thomas M. // Endothelium (suppl.). — 1993. Vol. l.-S. 1. — P. 3.
54. Rossi P., Menchini Fabris F., Fiorini I. et al. //Biomed Pharmacother.- 1998. -Vol. 53,- N. 7 — 8.-P.308 — 310.
55. Rubanyi G.M., Kauser K. // Endothelium (suppl.). — 1993. — Vol. l.-S. — 1. — P. 4.
56. Schirar A., Chang C., Rousseau J.P. // J. Neuroendocrinol. — 1997. — Vol. 9. — N. 2. — P. 141 — 150.
57. Shabsigh R. // World J. Urol. — 1997. — Vol. 15. — N. 1. — P. 21 — 26.
58. Sessa W.C., Pritchard K., Seyedi N. et al. // Endothelium (suppl.). — 1993.-Vol. l.-S.l.-P.l.
59. Snyder S.H. // Proc. Natl. Acad. Sci. USA. — 1989. — Vol. 86. — P. 9030-9033.
60. Stevens M.J., Feldman E.L., Greene D.A. // The aetiology of diabetic neuropathy: the combined roles of metabolic and vascular defects. // Diabetic medicine. — 1995. — Vol. 1 2. — P. 566 — 579.
61. Takamura Т., Kato I., Kimura N. et al. Transgenic mice overexpressing type 2 nitric-oxide synthase in pancreatic (3 cells develop insulin- dependent diabetes without insulitis // J. Biol. Chem. — 1998. — Vol. 273. — P. 2493 — 2496.
62. Vernet D., Cai L., Garbin et al. // Endocrinology. — 1995. — Vol. 136. — P. 5709-5717.
63. Weiner C., Baylis S., Lizasoan J. et al. // Endothelium (suppl.). — 1993. -Vol. l.-S. — l.-P. 3.
64. Wildhirt S.М., Dudec R.R., Suzuki H., Pinto V., Narayan K.S., Bing R.J. Immunohistochemistry in the identification of nitric oxide synthase isoenzymes in myocardial infarction. // Cardiovasc. Res. — 1995. — Vol. 29.- N. 4. — P. 526 — 531.
Содержание эндотелиальной синтазы оксида азота в плазме после физических нагрузок различного характера | Дьякова
1. Метельская В.А., Гуманова Н.Г. Оксид азота: роль в регуляции биологических функций, методы определения в крови человека // Актуальные проблемы сердечно-сосудистой патологии. 2005; 7: 19–24.
2. Шенкман Б.С., Ломоносова Ю.Н., Немировская Т.Л. Нейрональная NO-синтаза – молекулярный гарант стабильности мышечного волокна: NO-зависимые сигнальные пути в активной и разгруженной мышце // Успехи физиологических наук. 2014; 45 (2): 37–48.
3. Kapilevich L.V., Kovalev I.V., Baskakov M.B., Medvedev M.A. Intracellular signal systems in the epithelium- and endothelium-dependent relaxation of smooth muscles // Uspekhi fiziologicheskikh nauk. 2001; 32 (2): 88–98.
4. Kobzik L., Reid M.B., Bredt D.S., Stamler J.S. Nitric oxide in skeletal muscle // Nature. 1994; 372(6506): 546–548.
5. Cocks M., Shaw C.S., Shepherd S.O., Fisher J.P., Ranasinghe A.M., Barker T.A., Tipton K.D., Wagenmakers A.J. Sprint interval and endurance training are equally effective in increasing muscle microvascular density and eNOS content in sedentary males // J. Physiol. 2013; 591(3): 641–656.
6. Frandsen U., Höffner L., Betak A., Saltin B., Bangsbo J., Hellsten Y. Endurance training does not alter the level of neuronal nitric oxide synthase in human skeletal muscle // J. Appl. Physiol. 2000; 89 (3): 1033–1038.
7. Капилевич Л.В., Кабачкова А.В., Çахарова А.Н., Лалаева Г.С., Кироненко Т.А., Дьякова Е.Ю., Орлов С.Н. Секреторная функция скелетных мышц: механизмы продукции и физиологические эффекты миокинов // Успехи физиологических наук. 2016; 47(2): 7–26.
8. Pedersen B.K., a Febbraio M. Muscles, exercise and obesity: skeletal muscle as a secretory organ // Nat. Rev. Endocrinol. 2012; 8 (8): 457–465.
9. Broholm C., Laye M.J., Brandt C., Vadalasetty R., Pilegaard H., Pedersen B.K., Scheele C. LIF is a contraction-induced myokine stimulating human myocyte proliferation // J. Appl. Physiol. 2011; 111 (1): 251–259.
10. Scheler M., Irmler M., Lehr S., Hartwig S., Staiger H., Al-Hasani H., Beckers J., de Angelis M.H., Häring H.U., Weigert C. Cytokine response of primary human myotubes in an in vitro exercise model // Am. J. Physiol. Cell. Physiol. 2013; 305: C877–C886.
11. Wang M.X., Murrell D.F., Szabo C., Warren R.F., Sarris M., a Murrell G. Nitric oxide in skeletal muscle: inhibition of nitric oxide synthase inhibits walking speed in rats // Nitric Oxide. 2001; 5 (3): 219–232.
12. Gibala M.J., a MacLean D., Graham T.E., Saltin B. Tricarboxylic acid cycle intermediate pool size and estimated cycle flux in human muscle during exercise // Am. J. Physiol. 1998; 275 (2 Pt 1): E235–E242.
13. Lima-Cabello E., Cuevas M.J., Garatachea N., Baldini M., Almar M., González-Gallego J. Eccentric exercise induces nitric oxide synthase expression through nuclear factor-kappaB modulation in rat skeletal muscle // J. Appl. Physiol. 2010; 108(3): 575–583.
14. Powers S.K., Duarte J., Kavazis A.N., Talbert E.E. Reactive oxygen species are signalling molecules for skeletal muscle adaptation // Exp. Physiol. 2010; 95 (1): 1–9.
15. Devereux G.R., Coleman D., Wiles J.D., Swaine I. Lactate accumulation following isometric exercise training and its relationship with reduced resting blood pressure // J. Sports Sci. 2012; 30 (11): 1141–1148.
ЭФФЕКТИВНОСТЬ И БЕЗОПАСНОСТЬ ПРИМЕНЕНИЯ ИНГАЛЯЦИОННОГО ОКСИДА АЗОТА У ПАЦИЕНТОВ С ЛЕГОЧНОЙ ГИПЕРТЕНЗИЕЙ И ХРОНИЧЕСКОЙ СЕРДЕЧНОЙ НЕДОСТАТОЧНОСТЬЮ III–IV ФУНКЦИОНАЛЬНОГО КЛАССА, ПЕРЕНЕСШИХ ИНФАРКТ МИОКАРДА ЛЕВОГО ЖЕЛУДОЧКА: РЕЗУЛЬТАТЫ СРАВНИТЕЛЬНОГО НЕРАНДО | Павленко
1. Ивашкин В.Т., Драпкина О.М. Клиническое значение оксида азота и белков теплового шока. 2-е издание. М.: гэотар-Медиа, 2011.
2. Ивашкин В.Т., Драпкина О.М. Оксид азота в регуляции функциональной активности физиологических систем. Российский журнал гастроэнтерологии, гепатологии, колонопроктологии
3. ;4(3):16–21.
4. Шумаков В.И., Козлов И.А., Попцов В.Н. Ингаляционная окись азота в сердечной и сосудистой хирургии. М., 2000.
5. Kim G. Pulmonary hypertension in infants with bronchopulmonary dysplasia. Korean J Pediatr 2010;53(6):688–93.
6. Ardehali A., Hughes K., Sadeghi A., et al. Inhaled nitric oxide for pulmonary hypertension after heart transplantation. Transplantation 2001;72:638–41.
7. Busch T., Bercker S., Laudi S., et al. Inhaled nitric oxide for rescue treatment of refractory hypoxemia in ARDS patients. Anasthesiol Intensivmed Notfallmed Schmerzther 2008;43(11–12):778–83.
8. Kinsella J., Cutter G., Walsh W., et al. Early inhaled nitric oxide therapy in premature newborns with respiratory failure. N Engl J Med 2006;355:354–64.
9. Creagh-Brown B.C., Griffiths M.J., Evans T.W. Bench-to-bedside review: Inhaled nitric oxide therapy in adults. Crit Care 2009;13(3):221.
10. Paradise W., Vesper B., Goel A., et al. Nitric oxide: perspectives and emerging studies of a well known cytotoxin. Int J Mol Sci 2010;11(7):2715–45.
11. Inglessis I., Shin J., Lepore J., et al. Hemodynamic effects of inhaled nitric oxide in right ventricular myocardial infarction and cardiogenic shock. J Am Coll Cardiol 2004;44:793–8.
12. Hemnes A., Champion H. Right heart function and haemodynamics in pulmonary hypertension. Int J Clin Pract Suppl 2008;(160):11–9.
13. O’Callaghan D., McNeil K. Pulmonary hypertension and left heart disease: emerging concepts and treatment strategies. Int J Clin Pract Suppl 2008;(160):29–31.
14. Galie N., Hoeper M., Humbert M., et al.; ESC Committee for Practice Guidelines (CPG). Guidelines for the diagnosis and treatment of pulmonary hypertension: The Task Force for the Diagnosis and Treatment of Pulmonary Hypertension of the European Society of Cardiology (ESC) and the
15. European Respiratory Society (ERS), endorsed by the International Society of Heart and Lung Transplantation (ISHLT). Eur Heart J 2009;30(20):2493–537.
16. Guyton A.C., Hall J.E. Textbook of medical physiology. 10th ed. Saunders Elsevier, 2000.
17. Chemla D., Castelain V., Hervé P., et al. Haemodynamic evaluation of pulmonary hypertension. Eur Respir J 2002;20:1314–31.
18. ATS Committee on Proficiency Standards for Clinical Pulmonary Function Laboratories. ATS statement: guidelines for the six-minute walk test. Am J Respir Crit Care Med 2002;166:111–7.
19. Galie N., Seeger W., Naeije R., et al. Comparative analysis of clinical trials and evidence-based treatment algorithm in pulmonary arterial hypertension. J Am Coll Cardiol 2004;43(12 Suppl S):81–8.
20. Gomberg-Maitland M., Gaine S. The evolving epidemiology of pulmonary arterial hypertension. Int J Clin Pract Suppl 2009;(161):1–3.
Оксид азота — обзор
Определение
Оксид азота (NO) — это газообразная молекула с аутокринным и паракринным действием на многие типы клеток. NO синтезируется из аминокислоты l-аргинин NO-синтазой (NOS) и участвует во множестве клеточных функций, включая расслабление мышц, передачу сигналов нейронов и иммунную функцию. Синтез NO зависит от наличия кофакторов, таких как тетрагидробиоптерин (Bh5), гем, флавинадениндинуклеотид (FAD) и восстановленный никотинамид-адениндинуклеотидфосфат (NADPH).Фермент, ограничивающий скорость, NOS, существует в трех различных изоформах: нейрональная NOS (nNOS), эндотелиальная NOS (eNOS) и индуцибельная NOS (iNOS). nNOS и eNOS являются Ca 2+ / кальмодулин-зависимыми, конститутивно активными ферментами, тогда как активность iNOS не зависит от Ca 2+ . Ген nNOS человека расположен на хромосоме 12, iNOS — на хромосоме 17, а eNOS — на хромосоме 7. nNOS локализован в дискретных популяциях центральных нейронов и в периферических вегетативных нервах; eNOS в изобилии присутствует в эндотелиальных клетках, включая церебральные кровеносные сосуды, в то время как iNOS может индуцироваться в макрофагах, астроцитах и микроглии после повреждения или воспаления.В головном мозге мечение nNOS сосуществует с окрашиванием NADPH-диафоразой, а очищенный nNOS проявляет активность NADPH-диафоразы.
NO может легко диффундировать через плазматические мембраны до 200 мкМ in vivo в нормальной ткани мозга. В физиологических условиях NO может влиять на функцию нейронов, по крайней мере, двумя независимыми механизмами: (1) NO активирует растворимую гуанилилциклазу и увеличивает внутриклеточные уровни циклического гуанинмонофосфата (цГМФ), который, в свою очередь, модулирует высвобождение нейротрансмиттера, эффективность рецептора, передачу сигналов и синаптическую пластичность. и (2) NO S -нитрозилирует множество белков, включая субъединицы рецептора NMDA, каталитические субъединицы каспаз, α-тубулин и АТФазу натриевой помпы, тем самым влияя на внутриклеточную передачу сигналов.Кроме того, модулируя высвобождение нейромедиаторов, NO косвенно влияет на нейротрансмиссию. NO увеличивает высвобождение дофамина и серотонина в медиальной преоптической области крысы, а также норадреналина и глутамата в гиппокампе, подавляя при этом высвобождение ГАМК в гиппокампе. При физиологических концентрациях NO оказывает нейропротекторное действие, хотя более высокие уровни могут быть нейротоксичными.
nNOS-содержащие нейроны в изобилии присутствуют в двигательных областях мозга, включая лобную кору, базальные ганглии, покрышку моста, дофаминергические центры среднего мозга и мозжечок.NO участвует в физиологической активности этих центров, включая изменение высвобождения нейромедиаторов, модуляцию эффективности рецепторной функции и передачи сигналов, а также синаптическую пластичность. NO также регулирует длительную депрессию в нейронах полосатого тела, что имеет решающее значение для обучения и моторного контроля базальных ганглиев.
nNOS-содержащие нейроны распределены по всей коре головного мозга и в подкорковом белом веществе. В сенсомоторной коре крыс они представляют собой аспиновые интернейроны, которые коэкспрессируют ГАМК и распределены в основном во II и III слоях.Активность NADPH-диафоразы или nNOS наблюдается в ~ 2% нейронов полосатого тела и локализована в субпопуляции ГАМКергических интернейронов, содержащих соматостатин и нейропептид Y, у всех млекопитающих. Нейроны полосатого тела, содержащие НАДФН-диафоразу, у крыс получают глутаматергические проекции из коры головного мозга, ГАМКергические волокна из внешнего сегмента бледного шара, дофаминергические проекции из компактной части черной субстанции и иннервируют проекционные нейроны полосатого тела. Вспышка дофаминергических нейронов черного цвета активирует нейроны nNOS полосатого тела через дофаминовые рецепторы D 5 , что приводит к синтезу NO, который увеличивает уровни цГМФ в проекционных нейронах полосатого тела, способствуя долговременной депрессии кортикостриатных синапсов.nNOS физически прикреплен к белку постсинаптической плотности 95 (PSD95), который является частью рецепторного комплекса NMDA. Следовательно, активность NMDA в полосатом теле вызывает nNOS-опосредованный синтез NO и последующее повышение уровней цГМФ. В холинергических нейронах это приводит к вызванному NMDA высвобождению ацетилхолина в полосатом теле.
Фармакологическая блокада nNOS подавляет спонтанную двигательную и исследовательскую активность у крыс. Совместное введение ингибиторов nNOS снижает гиперлокомоцию, вызываемую антагонистами NMDA или агонистами дофамина.Однако после целенаправленной делеции nNOS у мышей не наблюдалось никаких отклонений в произвольной двигательной активности или функции базальных ганглиев. Интересно, что эти мыши демонстрировали нарушение равновесия и координации только в темноте, тогда как их острота зрения казалась нормальной. Кроме того, самцы мышей nNOS — / — являются гиперагрессивными и демонстрируют повышенное сексуальное поведение. Стоит отметить, что у этих мышей активность НАДФН-диафоразы лишь частично снижена в коре головного мозга и полосатом теле, тогда как мозжечок и миндалевидное тело продемонстрировали полную потерю активности.
Повышенные концентрации NO влияют на функцию митохондрий, способствуют передаче сигналов апоптоза и способствуют окислению, нитрованию и чрезмерному S -нитрозилированию белков, что приводит к нарушению их функции и клиренса и тем самым вызывает нейротоксичность. nNOS физически связан с рецепторами NMDA, и чрезмерная активность NMDA приводит к увеличению продукции NO, увеличивая эксайтотоксичность. Повышенные концентрации NO ингибируют цитохром С-оксидазу (ЦОГ), что приводит к нарушению целостности митохондриальной мембраны и истощению клеточной энергии, что способствует диффузии ионов супероксида из митохондрий.Помимо этого, ионы супероксида также образуются как побочный продукт метаболизма дофамина. Ионы супероксида активно связываются с NO с образованием пероксинитрита, который разлагается на гидроксильные и реактивные кислородные радикалы. Эти свободные радикалы вместе с пероксинитритом вызывают серьезное повреждение белков, липидов и ДНК, заставляя клетки подвергаться апоптозу. NO и сами эти радикалы, а также процесс повреждения ДНК активируют поли-АДФ-рибозо-полимеразу (PARP), вызывая дальнейшее истощение энергии, тем самым подталкивая клетки к апоптозу.PARP также способствует транслокации фактора, индуцирующего апоптоз (AIF) из митохондрий в ядро, чтобы вызвать дальнейшее повреждение ДНК ( Рисунок 1 ).
Рисунок 1. Связывание глутамата с рецепторами NMDA приводит к притоку Ca 2+ , что приводит к локальному увеличению концентрации Ca 2+ и последующему образованию комплекса кальций-кальмодулин, который активирует nNOS в постсинаптической плотности. Активированный nNOS производит NO, который быстро разряжает и блокирует ЦОГ, что приводит к снижению АТФ и нарушению проницаемости митохондрий, обеспечивая диффузию супероксид-ионов (O 2 –) из митохондрий.Ионы супероксида связываются с NO и образуют пероксинитрит (ONOO — ). Пероксинитрит свободно диффундирует и вызывает нитрование и окисление белков и липидов, а также повреждение ДНК. Повреждение ДНК активирует PARP. Активированный PARP истощает выработку энергии за счет снижения уровней NAD + , а также способствует транслокации AIF из митохондрий в ядро, вызывая дальнейшее повреждение ДНК, ведущее к апоптозу.
Чрезмерные уровни NO также приводят к нитрованию молекул, вызывая нарушение клеточных функций.Высокие уровни нитротирозина наблюдались в мозге пациентов с болезнью Паркинсона, болезнью Хантингтона, боковым амиотрофическим склерозом и болезнью Альцгеймера. Помимо нитрования, NO-опосредованное S -нитрозилирование реактивных цистеиновых остатков белков нарушает их функцию и клиренс. NO-опосредованное S -нитрозилирование глицеральдегид-3-фосфатдегидрогеназы (GAPDH) способствует образованию и ядерной транслокации мутантного комплекса Хантингтин-GAPDH-Siah 1 в нейродегенеративном процессе нейронов полосатого тела при болезни Хантингтона.Аналогичным образом NO S -нитрозилат паркин. Паркин — это убиквитинлигаза, участвующая в деградации белка через убиквитин-протеосомную систему, и мутации паркина являются наиболее частой причиной семейного раннего паркинсонизма.
В заключение, NO продуцируется в головном мозге нейронами, астроцитами, микроглией и эндотелиальными клетками и участвует в ряде физиологических функций, таких как обучение и пластичность, а также в нескольких дегенеративных процессах. NO опосредует свои эффекты, увеличивая концентрацию цГМФ и вызывая окисление, нитрование и S -нитрозилирование клеточных белков.В высоких концентрациях NO влияет на проницаемость митохондрий, снижает выработку клеточной энергии, изменяет структуру, транспорт, функцию и деградацию белка, вызывает повреждение ДНК и индуцирует апоптотический сигнальный каскад. Передача сигналов NO становится потенциальной терапевтической мишенью при неврологических расстройствах, таких как болезнь Паркинсона и Хантингтона.
Добавки оксида азота — Исследования преимуществ, побочных эффектов и взаимодействий
Обзор | Как оценивается уровень оксида азота? | Что влияет на уровень оксида азота?Обзор
Человеческое тело превращает нитрат в оксид азота (NO), который является сигнальной молекулой, связанной с несколькими физиологическими функциями, включая регуляцию артериального давления, здоровье сердечно-сосудистой системы, производство митохондрий, транспорт кальция, окислительный стресс и восстановление скелетных мышц. [1] Он играет важную роль вазодилататора, что означает расслабление кровеносных сосудов и улучшение кровотока.
Прием нитратов в чистом виде (например, нитрат натрия / калия) или с пищей (например, свекольный сок / порошок) может временно снизить потребность организма в кислороде во время упражнений. Снижение потребности в кислороде может привести к улучшению физических упражнений и мышечной деятельности. [2] [3]
Как оценивается уровень оксида азота?
Прямой
Самый точный метод определения уровня NO — это измерение содержания нитратов и нитритов в плазме крови.Период полураспада NO составляет , невероятно короткий , существующий менее 0,1 секунды, прежде чем он распадется на нитрат и нитрит. [4] [5] Эти два метаболита измеряются как заменители (т. Е. Суррогатные маркеры) продукции NO.
Исследователи не могут использовать этот метод из-за неудобств или соображений стоимости. Вместо этого они могут использовать косвенные подходы.
Косвенный
Исследователи нередко проверяют влияние добавки, богатой нитратами, на вторичные конечные точки, на которые влияет уровень NO.Ниже приведен список часто используемых конечных точек.
Что влияет на уровень оксида азота?
Дополнения
УровеньNO может быть увеличен прямым приемом нитратов. Очевидно, правда? Но есть нюанс: нитраты не существуют в виде отдельных пищевых добавок из-за правил, регулирующих высокие количества нитрата натрия. Вместо этого добавление нитратов обычно достигается с помощью продуктов или напитков, богатых нитратами. Большинство исследований предоставляют нитраты в виде свекольного сока или порошка.
Такие добавки, как цитруллин и аргинин, также могут повышать уровень NO, но их общий эффект от умеренного до незначительного. [6] Изофлавоны растений, такие как изофлавоны сои, также могут влиять на выработку NO.
В таблице ниже представлен анализ исследований на людях и показано, как добавки могут влиять на уровни NO и выработку.
Еда
Нитраты содержатся в различных продуктах питания, особенно в свекле и листовых зеленых овощах. Капсулы экстракта свеклы не содержат достаточного количества нитратов, чтобы повлиять на кровоток, но свекольный порошок и сок — допустимые варианты.
Руккола / руккола, зелень капусты, укроп и зелень репы также имеют высокое содержание нитратов. [7] [8]
Гормоны
Эстроген регулирует кровоток, индуцируя выработку NO, [9] — мощного вазодилататора, вырабатываемого эндотелиальными клетками, которые представляют собой особый тип клеток, выстилающий все кровеносные сосуды. После образования в эндотелии NO диффундирует в подлежащие гладкомышечные клетки, которые регулируют тонус сосудов, заставляя их расслабляться и впоследствии увеличивая кровоток в организме.Этот процесс называется расширением сосудов.
Вы должны войти в систему, прежде чем сможете следить за этой страницей.
Теперь вы подписаны на Оксид азота. Вы будете уведомлены, когда будет произведено какое-либо существенное обновление.
Вы хотите отписаться от этой страницы?
Назальный оксид азота в организме человека
В последнее десятилетие наблюдался взрыв интереса биологов к газу оксида азота (NO). Этот высокореактивный свободный радикал, который сначала считался только вредным загрязнителем воздуха, вырабатывается в клетках млекопитающих специфическими ферментами и, как полагают, играет жизненно важную роль во многих биологических событиях, включая регуляцию кровотока, функцию тромбоцитов, иммунитет и нейротрансмиссию.1 Прямое измерение NO в биологических тканях затруднительно, поскольку этот газ быстро реагирует, например, с гемоглобином или другими белками, содержащими Fe 2+ . Поэтому часто необходимо полагаться на косвенные измерения, чтобы обнаружить синтез NO in vivo. В отличие от ситуации в большинстве биологических тканей, где NO быстро разрушается, в газовой фазе NO достаточно стабилен при низких концентрациях3. NO, образующийся в поверхностных структурах полых органов, будет диффундировать в просвет и, таким образом, обнаруживаться в газе, собранном из таких органов.
Присутствие NO в выдыхаемом воздухе у людей было впервые продемонстрировано Gustafsson et al. в 1991 г. 4 Поздние исследования ясно показали, что у здоровых людей контрольной группы в состоянии покоя почти весь NO, обнаруживаемый в выдыхаемом воздухе, поступает из верхних дыхательных путей, причем лишь незначительное количество NO, обнаруживаемое в выдыхаемом воздухе. вклад нижних дыхательных путей и легких. 5-7
Происхождение назального NO
Точное происхождение NO, обнаруженного в носовом воздухе, и относительный вклад из различных источников в носовых дыхательных путях неизвестны.Однако есть некоторые признаки того, что околоносовые пазухи, а не слизистая оболочка носовой полости являются основным источником носового NO у взрослых здоровых людей.8 Во-первых, высвобождение NO в носовые пазухи заметно снижается за счет интрасинусной инстилляции NO-синтазы. ингибитор (l-NAME), тогда как назальные концентрации NO лишь незначительно снижаются после интраназального введения этого ингибитора.9 Во-вторых, иммуногистохимические исследования и исследования гибридизации in situ показали плотное окрашивание синтазы оксида азота (NOS) и ее мРНК в эпителии синуса, тогда как окрашивание слабое. был обнаружен в носовом эпителии.9 В-третьих, временное снижение назального NO (измеренного из одной ноздри) наблюдалось в исследовании, когда воздух непрерывно удалялся из одной верхнечелюстной пазухи во время отбора пробы из носа, а противоположное (кратковременное повышение) происходило, когда воздух вводился в ту же пазуху 10. В-четвертых, уровни оксида азота в носу заметно снижаются у пациентов, у которых обычно имеются слизистые околоносовые пазухи и непроходимость носовых пазух (синдром Картагенера 6, муковисцидоз, 11 острый синусит12). Наконец, носовые уровни NO высоки у людей и других приматов13, но очень низкие у бабуинов 14, единственного млекопитающего, у которого отсутствуют придаточные пазухи носа.
Как иммуногистохимические исследования, так и исследования гибридизации in situ показывают, что NOS, обнаруженный в эпителии здоровых носовых пазух9, идентичен или очень близок к индуцибельному NOS (iNOS), который был клонирован из активированных гепатоцитов человека.15 Более того, активность NOS в слизистой оболочке носовых пазух преимущественно кальций-независимый, характеристика, связанная с iNOS.16 Однако регуляция экспрессии и активности синусовой NOS, по-видимому, отличается от таковой, описанной ранее для iNOS. Таким образом, синусовая БДУ постоянно выражена и кажется устойчивой к стероидам 9. , 16 свойств, обычно связанных с низкой скоростью образования NO эндотелиальной и нейрональной NOS.Иммуноокрашивание на NOS в слизистой оболочке носа показало только слабое окрашивание на iNOS.9 Более того, Ramis и др. обнаружили только кальцийзависимую активность NOS в слизистой оболочке носа у здоровых субъектов.17 Назальный эпителий человека от пациентов с заболеванием носовых полипов экспрессирует повышенную мРНК iNOS. по сравнению с нормальным эпителием.18
Измерение назального NO
Практически во всех литературных исследованиях по измерению назального NO использовался метод хемилюминесценции. В этом методе используется избыток озона (O 3 ), который реагирует с NO с образованием диоксида азота (NO 2 ) с электроном в возбужденной стадии (NO 2 *).NO 2 * возвращается в основное состояние при испускании электромагнитного излучения в диапазоне длин волн 600–3000 нм. Эту хемилюминесценцию обнаруживает фотоумножитель, который пропорционально преобразует интенсивность люминесценции в электрический сигнал. Метод хемилюминесценции очень чувствителен, и NO может быть обнаружен на уровнях вплоть до частей на триллион. , 19 Это быстрое и простое в использовании устройство, которое позволяет в режиме реального времени измерять количество выдыхаемого NO. Другие методы, которые использовались для установления присутствия NO в выдыхаемом воздухе человека, включают масс-спектроскопию и газовую хроматографию-масс-спектроскопию.4 , 20
Для сбора носового воздуха использовалось несколько методов, наиболее часто используемый метод — это отбор пробы назального воздуха непосредственно из одной ноздри.21 , 22 С помощью собственного потока хемилюминесцентного анализатора или внешнего насоса воздух всасывается из одной ноздри. Контралатеральная ноздря остается открытой, и испытуемый либо задерживает дыхание, либо дышит через рот. Таким образом, воздух направляется от одной стороны носа к другой через носоглотку. Чтобы избежать загрязнения NO из нижних дыхательных путей, испытуемого можно попросить выдохнуть устно, преодолевая сопротивление, чтобы закрыть мягкое небо.23 , 24
Другой предлагаемый метод измерения назального NO — выдох через нос после полного вдоха до жизненной емкости. Выдох должен производиться с постоянной скоростью. После этой процедуры субъект затем выдыхает через рот с полной жизненной емкостью с той же скоростью, и значение NO от орального выдоха вычитается из значения, измеренного во время носового выдоха (неопубликованное наблюдение).
Оптимальная методика измерения назального NO еще не определена.Надежный и стандартизованный метод позволит лучше сравнивать результаты между разными лабораториями. Попытки стандартизировать назальные измерения NO продолжаются, и в ближайшем будущем будут даны рекомендации по подходящим методам отбора проб.
Факторы, влияющие на уровни NO в носу
МЕТОДИКА ИЗМЕРЕНИЙ
Поскольку NO постоянно выделяется в носовые дыхательные пути, его концентрация будет зависеть от скорости потока, с которой аспирируется проба.21 Таким образом, назальные концентрации NO выше при более низких скоростях потока. Поэтому может быть предпочтительнее выражать назальный NO как выход за единицу времени (например, нл / мин), который, как было показано, относительно не зависит от скорости потока.25
ФИЗИОЛОГИЧЕСКИЕ ФАКТОРЫ
В раннем исследовании назальный NO измерялся у здоровых людей в разном возрасте от 0 до 70 лет.9 Интересно, что назальный NO присутствовал уже при рождении. В более позднем исследовании Schedin и др. обнаружили значительные уровни NO в носу у новорожденных, в том числе рожденных путем кесарева сечения.26 В исследовании Lundberg и др. использовалась одинаковая скорость потока во всех возрастных группах, и было установлено, что назальный NO у новорожденных и младенцев был намного ниже, чем у взрослых. Однако, если концентрация NO в носу на основе этих данных рассчитывается по отношению к массе тела, обнаруживается, что концентрация у детей в возрасте около 10 лет примерно вдвое выше, чем у новорожденных и взрослых. Нет никаких доказательств половых различий в назальном NO, но различия в уровнях NO еще не изучались в зависимости от менструального цикла.Выход NO в носовые дыхательные пути резко снижается при физических нагрузках. 27-30 В исследовании Lundberg et al 27 прямые измерения в одной гайморовой пазухе показали снижение концентрации NO в пазухах на 83% после пяти минут упражнений. Снижение уровня NO в носу нельзя объяснить только разбавлением носового воздуха из-за изменения объема носовой полости или увеличения вентиляции. Вместо этого эти изменения назального NO были приписаны уменьшению кровотока в слизистой оболочке носовых дыхательных путей с сопутствующим уменьшением подачи субстрата к высокой скорости образования NOS в придаточных пазухах носа.27
ЗАБОЛЕВАНИЯ
Влияние различных заболеваний на уровни NO в носу суммировано в таблице 1. У детей с синдромом Картагенера — триадой, состоящей из синусита, бронхоэктатической болезни и обратного сидения — уровни NO в носу чрезвычайно низки по сравнению со здоровыми людьми соответствующего возраста. 6 Уровень NO в носу также очень низкий у пациентов с муковисцидозом (рис. 1) .11 , 31 , 32 Baraldi и др. измерили назальный NO в группе детей с острым синуситом и обнаружили низкие уровни назального NO.12 У этих пациентов уровни NO в носу увеличивались, когда состояние пациентов улучшалось после лечения антибиотиками. Хронический синусит связан со снижением уровня NO в носу более чем на 50 %.33 В целом, вышеупомянутые исследования показывают, что уровни NO в носу ниже у пациентов с заболеваниями носовых пазух. Не было установлено, являются ли низкие уровни NO в носу у пациентов с заболеваниями носовых пазух исключительно результатом измененного прохождения газа NO из носовых пазух в полость носа или же у этих пациентов снижается фактическое производство NO в носовых пазухах.
Таблица 1Назальный оксид азота (NO): последствия заболевания.
Рисунок 1Устойчивые уровни NO в воздухе, взятом непосредственно из одной ноздри у здоровых детей, детей с муковисцидозом и детей с синдромом Картагенера. Данные Lundberg.6 , 11
Изменяются ли уровни NO в носу у пациентов с ринитами различной этиологии, полностью не установлено. Некоторые группы сообщили о более высоких уровнях назального NO у пациентов с аллергическим ринитом. 34–38 В одном исследовании назальный NO снизился после лечения назальными местными стероидами.35 Kirsten и др. сообщили о повышенных уровнях NO в носу после интраназальной провокации свиной пылью, содержащей эндотоксин.39 Напротив, мы не обнаружили изменений в уровнях NO в носу в группе детей с круглогодичным ринитом.11 Причины расхождений между исследования не ясны. Можно предположить, что iNOS активируется в носу во время ринита, как это имеет место в нижних дыхательных путях при астме.41 Это объясняет более высокие уровни NO, о которых сообщалось в некоторых исследованиях.С другой стороны, набухание слизистой оболочки носа во время ринита может также привести к частичной закупорке устья пазухи, что приведет к уменьшению прохождения NO из пазухи в полость носа, где он измеряется.
Eccles et al измерили уровни NO в носу у пациентов с простудой, но не обнаружили каких-либо различий по сравнению со здоровыми людьми.42 В другом исследовании экспериментального гриппа у людей уровни NO в носу у людей немного снизились в течение симптоматического периода.43 год
Общий дефицит NO участвует в патогенезе преэклампсии, заболевания беременных, характеризующегося отеком, гипертонией и протеинурией. Однако в недавнем исследовании мы обнаружили схожие носовые уровни NO у пациенток и здоровых беременных из контрольной группы.
ЛЕКАРСТВЕННЫЕ СРЕДСТВА
Действие различных препаратов на назальный NO суммировано в таблице 2. Ранние сообщения об эффекте местных глюкокортикоидов не показали влияния этих препаратов на уровни NO в носу. На самом деле, даже системные стероиды в высоких дозах, по-видимому, не влияли на уровни NO в носу.Герлах и др. предположили, что бактерии в носоглотке вызывают выделение NO из носа.7 Однако мы не обнаружили влияния системного лечения антибиотиками на уровни NO в носу.6 Более того, как уже упоминалось, у новорожденных, рожденных с помощью кесарева сечения, был высокий уровень NO в носу. Таким образом, высвобождение NO из носа не зависит от бактерий, обычно присутствующих в носоглотке.
Таблица 2Назальный оксид азота (NO): эффекты наркотиков, сигаретного дыма и физических упражнений
Было показано, что местные назальные деконгестанты, такие как оксиметазолин, снижают уровень оксиметазолина в носу.37 , 42 , 45 Причина этого не ясна, но было высказано предположение, что уменьшение кровотока в носу / пазухах, вызванное этими лекарствами, приводит к уменьшению поступления субстрата к высокопродуктивным iNOS в пазухах.45 Действительно, снабжение субстратом, по-видимому, ограничено. важен для высвобождения NO из носа / носовых пазух, поскольку внутривенное введение l-аргинина привело к увеличению уровня NO в носу.
Риндер и др. изучали влияние гистамина и капсаицина на уровни NO в носу, но не обнаружили никаких эффектов этих препаратов.45
Ингибитор NO-синтазы N G -нитро-1-аргинин метиловый эфир (l-NAME) оказывает лишь незначительное влияние на назальные уровни NO при местном введении в нос.9 , 45 Напротив, Альберт и др. обнаружили значительное снижение назальных уровней NO после внутривенного введения N G -монометил-1-аргинина (1-NMMA), другого ингибитора NOS46. Это хорошо согласуется с теорией, согласно которой придаточные пазухи носа являются основным источником NO в носовых дыхательных путях. Таким образом, ингибиторы NOS, вероятно, плохо проникают в носовые пазухи при местном введении в нос, тогда как при внутривенном введении эти препараты достигают слизистой оболочки носовых пазух.
У курильщиков сигарет уровень NO в носу был ниже7 , 47 но увеличиваются через неделю после отказа от курения47.
Животные модели
Schedin и др. измерили назальный NO у большого числа видов и обнаружили высокие уровни только у приматов и слонов.13 Левандовски и др. недавно измерили назальный NO у павианов и обнаружили только низкие уровни. 14 Интересно, что павианы — единственное известное млекопитающее, у которого отсутствуют придаточные пазухи носа. Из-за больших различий в продукции NO через нос у разных видов животных следует проявлять осторожность при сравнении данных, полученных на животных моделях, с результатами исследований на людях.
Роль назального NO
Хотя точная роль назального NO далеко не ясна, разумно полагать, что этот плюрипотентный газ участвует во множестве физиологических, а также патофизиологических событий в дыхательных путях.
HOST DEFENSE
Среди различных биологических свойств NO — его влияние на рост различных патогенов, включая бактерии, грибы и вирусы. , 48 Считается, что NO, продуцируемый лейкоцитами, играет важную роль в уничтожении этими клетками определенных микроорганизмов.Кроме того, некоторые бактерии чувствительны к аутентичному газу NO в концентрациях до 100 частей на миллиард (ppb) .49 Тот факт, что локальные концентрации NO в носовых дыхательных путях могут быть в несколько сотен раз выше, поддерживает идею о том, что NO участвует в локальных процессах. защита хозяина в верхних дыхательных путях. Местные концентрации в придаточных пазухах носа могут достигать 30 000 частей на миллиард [9]. Мы предположили, что этот NO может помочь сохранить стерильность носовых пазух в нормальных условиях. Можно предположить, что очень низкие уровни NO в носу у пациентов с синдромом Картагенера или муковисцидозом8 способствуют повышенной восприимчивости к инфекциям дыхательных путей у этих пациентов.Если это верно, то стимуляция выработки эндогенного NO может повысить устойчивость к инфекциям дыхательных путей у пациентов с низкими уровнями NO в носу, как предполагалось ранее.6 Неясно, действует ли сам NO непосредственно на микроорганизмы или же он сочетается с другими компонентами, чтобы дают другие химически активные промежуточные соединения азота, которые являются токсичными50.
Помимо действия непосредственно на микроорганизмы, NO может также способствовать местной защите хозяина, стимулируя перистальтику ресничек.51 Исследование Runer et al показало, что нанесение донора NO на слизистую носа человека действительно вызывает увеличение частоты биений ресничек.52 Более того, та же группа показала, что низкие уровни назального NO коррелируют с нарушением мукоцилиарной функции верхних дыхательных путей человека53.
ВОСПАЛЕНИЕ
Синтез NO явно усиливается локально в местах воспаления54. Это описано не только при астме5, но также, например, при воспалительном заболевании кишечника55 , 56 и цистит.57 Однако роль NO в воспалении далеко не определена. Некоторые исследования указывают на вредную роль NO во время воспаления, тогда как другие указывают на обратное.Возможные провоспалительные действия NO включают активацию ферментов, таких как циклооксигеназа или металлопротеиназы. Кроме того, пероксинитрит, образующийся в результате реакции NO с супероксидом, может оказывать токсическое действие на ткани.36 , 58 Возможные вредные эффекты NO объясняются большим количеством этого газа, выделяемого iNOS во время воспаления. Однако недавнее открытие постоянно экспрессируемого iNOS в носовых дыхательных путях усложняет эту картину, поскольку ясно демонстрирует, что единственная экспрессия iNOS и последующая повышенная продукция NO не связаны с повреждением тканей.Напротив, iNOS в верхних дыхательных путях может выполнять важные защитные функции, как обсуждалось выше. Кроме того, на животной модели воспаления толстой кишки McCafferty и др. показали, что у мышей, лишенных гена iNOS, развивается гораздо более серьезное воспаление, чем у мышей дикого типа.59
НАСАЛЬНЫЙ NO КАК ВОЗДУШНЫЙ МЕССЕНДЕР
Влияние вдыхаемого экзогенного NO в настоящее время изучается в крупномасштабных клинических испытаниях у пациентов с легочной гипертензией и / или респираторным дистресс-синдромом у взрослых, и его клиническое применение у новорожденных детей со стойкой легочной гипертензией было изучено. сообщил.60 Некоторые исследователи обнаружили явное влияние на оксигенацию артерий и давление в легочной артерии, используя такие низкие концентрации вдыхаемого NO, как 10–100 частей на миллиард 61. , 62 Интересно, что во время нормального дыхания эндогенный NO вдыхается в концентрациях (приблизительно 100 частей на миллиард), которые, как известно, оказывают сосудорасширяющее действие в малом круге кровообращения. , 7 Мы показали, что носовое дыхание снижает сопротивление легочных сосудов и улучшает артериальную оксигенацию по сравнению с оральным дыханием у субъектов без заболеваний легких (рис. 2).8 , 63 , 64 Добавление 100 частей на миллиард NO во время орального дыхания имитировало эффект носового дыхания, в то время как увлажненный воздух во время орального дыхания не имел никакого эффекта.63 Интубированные пациенты лишены естественного вдыхания эндогенного NO из верхних дыхательных путей. Добавление назального воздуха интубированным пациентам, получающим лечение с помощью аппарата ИВЛ, также улучшает оксигенацию артерий и снижает сопротивление легочных сосудов.65 Более того, Pinsky и др. показали, что сжатый воздух в больнице может содержать уровни NO, аналогичные описанным выше (6–500 частей на миллиард). которые, следовательно, могут влиять на оксигенацию артерий и давление в легочной артерии у пациентов с механической вентиляцией легких.66 , 67 В недавнем исследовании расширение ноздрей с помощью назальной ленты улучшило оксигенацию артериальной крови у пациентов со спонтанным дыханием, вероятно, за счет усиления вентиляции через носовые дыхательные пути, тем самым увеличивая доставку NO из носовых дыхательных путей в легкие. чрескожное давление кислорода у здорового субъекта во время периодов орального дыхания (пустые столбцы), носового дыхания (заполненные столбцы) или орального дыхания воздуха, содержащего экзогенный NO в концентрации 100 частей на миллиард (заштрихованные столбцы).Перепечатано из Lundberg et al63 с разрешения.
Эти результаты показывают, что NO, полученный из верхних дыхательных путей, способен улучшать поглощение кислорода и снижать сопротивление легочных сосудов (рис. 3). Возникает соблазн предположить, что производство NO в придаточных пазухах носа имеет цель модулировать функцию легких у людей. Поскольку NO вырабатывается выше разветвления крупных дыхательных путей, этот вазодилатирующий газ воздействует только на легочные сосуды, находящиеся в контакте с вентилируемыми альвеолами, тем самым улучшая соответствие вентиляции и перфузии.Этот новый физиологический принцип NO как переносимого по воздуху медиатора может выходить за рамки вазодилатации. Дальнейшие исследования покажут, обладает ли ингаляция эндогенного NO антимикробным действием, стимулирует подвижность ресничек и подавляет агрегацию тромбоцитов. Если это правда, то хорошо известные осложнения, связанные с длительной интубацией и вентиляцией, такие как цилиарная дисфункция и бактериальные инфекции, могут частично объясняться отсутствием NO из-за нарушения естественного промывания низкими дозами нижних дыхательных путей путем самостоятельного вдыхания. эндогенного NO из верхних дыхательных путей.69
Рисунок 3Оксид азота (NO) у человека выделяется в носовых дыхательных путях. Во время вдоха через нос это NO будет следовать за воздушным потоком в нижние дыхательные пути и легкие. Было показано, что NO, полученный через нос, увеличивает давление кислорода в артериальной крови и снижает сопротивление легочных сосудов, тем самым действуя как переносчик по воздуху.
Клиническая ценность назальных измерений NO
Измерения назальных уровней NO привлекательны, поскольку они полностью неинвазивны и могут быть легко выполнены даже у маленьких детей.Обнаружение низких уровней NO в носу у пациентов с хроническими заболеваниями носовых пазух, такими как синдром Картагенера и муковисцидоз, представляет интерес. 8 Возникает соблазн предположить, что измерения NO в носу могут использоваться для облегчения ранней диагностики этих двух респираторных заболеваний.
Возможная полезность назальных измерений NO для диагностики и мониторинга лечения аллергического ринита, несомненно, требует дальнейшей оценки. Если назальный NO является надежным маркером местного воспаления, этот простой тест можно использовать для наблюдения за пациентами с ринитами различной этиологии.
Как упоминалось выше, интубированные пациенты лишены возможности вдыхать NO, продуцируемый в носовых дыхательных путях. Принимая во внимание возможные положительные эффекты назального NO на легочную функцию, возможно, что замена назального NO принесет пользу пациентам, находящимся на искусственной вентиляции легких с помощью эндотрахеальной трубки.
Есть основания полагать, что препараты, влияющие на синтез эндогенного NO, в будущем будут использоваться в клинической практике. Эти препараты могут способствовать или уменьшать выработку NO, например, вмешиваясь в различные NOS.Измерение назального NO может быть интересным неинвазивным способом мониторинга эффектов таких лекарств и оптимизации дозировки. Неселективный ингибитор NOS 1-NMMA в настоящее время исследуется для использования у пациентов с сепсисом. Интересно, что этот ингибитор при внутривенном введении приводит к дозозависимому снижению уровней NO в носу.46 И наоборот, системное введение l-аргинина увеличивает уровни NO в носу.
Краткое содержание и направления на будущее
Большие количества NO постоянно выделяются в носовые дыхательные пути человека, и околоносовые пазухи, по-видимому, являются основным источником этого NO.Назальный NO может иметь важные как местные, так и дистальные эффекты, например, в защите хозяина и регуляции легочной функции.
Измерение назального уровня NO может быть полезным для дальнейшего изучения физиологической и патофизиологической роли этого газа в дыхательных путях. Более того, этот простой тест может быть клинически полезным для диагностики и мониторинга лечения некоторых респираторных заболеваний. Для полной оценки возможностей назальных измерений NO в клинических условиях важно, чтобы мы разработали стандартизированный и надежный метод.Нам также необходимо больше узнать о различных факторах, влияющих на уровень NO в носу.
Оксид азота: определение и обзор
Что такое оксид азота?
Оксид азота — это прозрачный бесцветный газ, выполняющий ряд важных функций в организме. Оксид азота считается таким важным химическим веществом в организме, что журнал Science назвал его «молекулой года» в 1992 году, а в 1998 году три ученых получили Нобелевскую премию по медицине за исследование его роли в организме.
Что оксид азота делает для организма?
Люди с диабетом имеют пониженную способность вырабатывать оксид азота, что может быть одной из причин повышенного риска сердечных заболеваний. Нарушения производства оксида азота в организме вызывают высокое кровяное давление, атеросклероз (сужение артерий) и инсульт.
Обычно клетки, выстилающие внутреннюю стенку кровеносных сосудов, выделяют оксид азота, который перемещается к мышечным клеткам вокруг кровеносных сосудов и заставляет их расширяться, облегчая кровоток.Нарушение производства оксида азота может способствовать сужению кровеносных сосудов, высокому кровяному давлению и атеросклерозу. Ученые теперь знают, что нитроглицерин и аналогичные препараты расширяют кровеносные сосуды и помогают облегчить стенокардию — временную боль в груди, возникающую из-за недостатка кислорода в сердце, — потому что эти препараты стимулируют высвобождение оксида азота. Оксид азота также не дает тромбоцитам слипаться и прилипать к внутренним стенкам артерий, защищая организм от тромбов и атеросклероза
Оксид азота также способствует возникновению эрекции полового члена.Во время сексуальной стимуляции нервы полового члена выделяют оксид азота, в результате чего кавернозные тела — стержни губчатой ткани внутри полового члена — наполняются кровью и становятся эрегированными. Открытие роли оксида азота в эрекции привело к разработке популярных препаратов от импотенции силденафила (торговая марка Виагра), варденафила (Левитра, Стаксин), тадалафила (Адцирка, Сиалис) и аванафила (Стендра). Прием этих препаратов может быть потенциально опасным для людей, которые также принимают нитратные препараты, такие как нитроглицерин, поскольку они могут слишком сильно повысить уровень оксида азота.Всегда сообщайте своему врачу, если вы принимаете нитратные препараты.
Хотите узнать больше о диабете и сексуальном здоровье? Прочтите «Когда виагра не работает: лечение эректильной дисфункции», «Когда диабет влияет на вашу сексуальную жизнь» и «Секс и диабет».
Первоначально опубликовано 2 мая 2006 г.
Сигнализация оксида азота и мочекаменная болезнь — Урологический исследовательский центр О’Брайена
Сигнализация оксида азота и мочекаменная болезнь
Целью этого пилотного проекта по передаче сигналов оксида азота и мочекаменной болезни является выявление новых механизмов, которые способствуют возникновению и развитию отложений кальция в эктопических тканях.
Наша центральная гипотеза состоит в том, что потеря передачи сигналов оксида азота (NO) является основным фактором ускоренного образования камней в почках, и что реактивация передачи сигналов NO устранит образование камней в почках у мышей in vivo. Этот пилотный проект использует текущую работу, финансируемую Национальными институтами здравоохранения, в лаборатории специалиста по сердечно-сосудистым заболеваниям Mayo Clinic Джордана Д. Миллера, доктора философии, включая клинические испытания активаторов sGC на людях с кальцифицированной болезнью аортального клапана.
Две конкретные цели пилотного проекта:
- Чтобы определить, будет ли реактивация передачи сигнала NO с помощью HMR1766 устранять образование почечных камней у мышей с гиперхолестеринемией, получавших L-NAME в питьевой воде
- Чтобы определить, отменяет ли усиление передачи сигнала NO почечное отложение кальция при нефрокальцинозе, индуцированном глиоксилатом, у мышей
Повторная дифференцировка клеток до остеобластоподобного фенотипа считается центральным фактором прогрессирования кальцинированных поражений в сердечно-сосудистых тканях.Подавляющее большинство факторов риска развития сердечно-сосудистой кальцификации (таких как старение, гиперхолестеринемия, гипертония и курение) связаны с усилением окислительного стресса, который повсеместно связан со снижением передачи сигналов оксида азота. Однако мало что известно о роли передачи сигналов оксида азота в патогенезе эктопического отложения кальция в других тканях.
Лаборатория доктора Миллера недавно провела исследование, в котором мышам с гиперхолестеринемией давали L-NAME с питьевой водой в течение шести месяцев.Первоначальное внимание было сосредоточено на сердечно-сосудистой ткани, где мы обнаружили, что постоянное лечение мышей L-NAME приводит к значительному увеличению сердечно-сосудистой кальцификации и дисфункции аортального клапана.
После подтверждения нашей первичной гипотезы о том, что снижение биодоступности NO ускорит сердечно-сосудистую кальцификацию, мы затем попытались определить, приведет ли уменьшение передачи сигналов NO к индукции эктопической кальцификации в других тканях, где образование кальцинированных узелков является обычным явлением.Важно отметить, что мы обнаружили, что снижение передачи сигнала NO приводит к резкому увеличению отложения кальция в почках мышей.
Таким образом, мы полагаем, что мы определили новую модель нефрокальциноза на животных, на которой можно протестировать терапевтические вмешательства, направленные на замедление инициации и прогрессирования образования почечных камней.
Мы также обнаружили, что реактивация рГЦ с использованием производных антраниловой кислоты (таких как HMR1766) замедляет прогрессирование сердечно-сосудистой кальцификации и дисфункции аортального клапана у мышей с гиперхолестеринемией.Мало что известно о терапевтической эффективности увеличения биодоступности оксида азота в контексте образования почечных камней.
.
оксид азота (ингаляционный газ) | Michigan Medicine
Какую самую важную информацию я должен знать об оксиде азота?
Чтобы наилучшим образом участвовать в уходе за вашим ребенком во время лечения этим лекарством, внимательно следуйте всем инструкциям, предоставленным опекунами вашего ребенка.
Что такое оксид азота?
Оксид азота — это вдыхаемый газ. Он работает, расслабляя гладкие мышцы, расширяя (расширяя) кровеносные сосуды, особенно в легких.
Оксид азота используется вместе с дыхательным аппаратом (вентилятором) для лечения дыхательной недостаточности у недоношенных детей.
Ваш ребенок будет получать это лекарство в отделении интенсивной терапии новорожденных (NICU) или аналогичном больничном учреждении.
Оксид азота также может использоваться для целей, не указанных в данном руководстве.
Что мне следует обсудить с поставщиком медицинских услуг, прежде чем мой ребенок получит оксид азота?
Чтобы наилучшим образом участвовать в уходе за вашим ребенком, пока он или она находится в отделении интенсивной терапии, внимательно следуйте всем инструкциям, предоставленным опекунами вашего ребенка.
Как вводится оксид азота?
Оксид азота вдыхается в легкие ребенка через рот или нос.
Ваш ребенок может также использовать дыхательную трубку, подключенную к аппарату искусственной вентиляции легких (устройство, которое вводит и выводит воздух из легких, чтобы помочь вашему ребенку дышать легче и получить достаточно кислорода).
Оксид азота обычно назначается на срок до 14 дней. Возможно, вам нужно будет отучать от этого лекарства медленно, используя все меньше и меньше, прежде чем лечение будет полностью прекращено.
Во время лечения оксидом азота необходимо внимательно следить за дыханием, кровяным давлением, уровнем кислорода и другими жизненно важными показателями вашего ребенка. Это поможет вашему врачу определить, как долго продолжать лечение оксидом азота. Вашему ребенку также могут потребоваться анализы крови.
Что произойдет, если пропустить дозу?
Поскольку оксид азота вводится по мере необходимости медицинским работником, маловероятно, что ваш ребенок пропустит дозу.
Что произойдет при передозировке?
Поскольку оксид азота вводится в контролируемых медицинских учреждениях медицинским работником, передозировка маловероятна. Однако не ожидается, что передозировка оксида азота вызовет опасные для жизни симптомы.
Чего следует избегать после того, как мой ребенок получит оксид азота?
Следуйте инструкциям врача о любых ограничениях в кормлении, приеме лекарств или физической активности после лечения вашего ребенка оксидом азота.
Каковы возможные побочные эффекты оксида азота?
Оксид азота вызывает мало побочных эффектов, но у вашего ребенка может быть шумное дыхание, кровь в моче или, возможно, коллапс легкого. Также существует вероятность того, что у ребенка будет затрудненное дыхание после прекращения лечения оксидом азота.
Некоторые из этих проблем могут потребовать дальнейшего лечения специалистами здравоохранения. Во время лечения оксидом азота ваш ребенок будет оставаться под постоянным наблюдением.
Это не полный список побочных эффектов; могут возникать и другие. Спросите у своего доктора о побочных эффектах. Вы можете сообщить о побочных эффектах в FDA по телефону 1-800-FDA-1088.
Какие другие лекарства повлияют на оксид азота?
Лица, ухаживающие за вашим ребенком, будут контролировать и контролировать все лекарства, которые вы принимаете вашему ребенку во время лечения в отделении интенсивной терапии. Не ожидается лекарственного взаимодействия между оксидом азота и другими лекарствами.
Не давайте ребенку какие-либо лекарства, которые не были прописаны врачом.Сюда входят витамины, минералы или растительные продукты.
Где я могу получить дополнительную информацию?
Ваш врач или фармацевт может предоставить дополнительную информацию об оксиде азота.
Помните, храните это и все другие лекарства в недоступном для детей месте, никогда не передавайте свои лекарства другим и используйте это лекарство только по назначению.
Были приложены все усилия, чтобы информация, предоставленная Cerner Multum, Inc.(‘Multum’) является точным, актуальным и полным, но на этот счет не дается никаких гарантий. Содержащаяся здесь информация о препарате может меняться с течением времени. Информация Multum была собрана для использования практикующими врачами и потребителями в Соединенных Штатах, и поэтому Multum не гарантирует, что использование за пределами США является целесообразным, если специально не указано иное. Информация о лекарственных препаратах Multum не содержит рекомендаций по лекарствам, диагностике пациентов и лечению. Информация о лекарственных препаратах Multum — это информационный ресурс, предназначенный для оказания помощи лицензированным практикующим врачам в уходе за своими пациентами и / или обслуживании потребителей, рассматривающих эту услугу как дополнение к опыту, навыкам, знаниям и суждениям практикующих врачей, а не их замену.Отсутствие предупреждения для данного лекарственного средства или комбинации лекарств никоим образом не должно толковаться как указание на то, что лекарство или комбинация лекарств безопасны, эффективны или подходят для любого данного пациента. Multum не несет никакой ответственности за какие-либо аспекты здравоохранения, управляемые с помощью информации, предоставляемой Multum. Информация, содержащаяся в данном документе, не предназначена для охвата всех возможных способов использования, указаний, мер предосторожности, предупреждений, лекарственных взаимодействий, аллергических реакций или побочных эффектов. Если у вас есть вопросы о лекарствах, которые вы принимаете, проконсультируйтесь с врачом, медсестрой или фармацевтом.
Авторские права 1996-2021 Cerner Multum, Inc. Версия: 2.02. Дата редакции: 01.12.2015.
Вдыхание газа оксида азота при тяжелом остром респираторном синдроме при COVID-19. — Full Text View
Инфекция, связанная с новым коронавирусом (2019-nCoV) (COVID-19), заразна и унесла тысячи жизней. Возникший в Ухане (Китай), 2019-nCoV распространяется во многие страны, включая Италию, Корею и Японию. Хотя на сегодняшний день нет целевого лечения вируса 2019-nCoV, вдыхаемый газ оксида азота (NO) продемонстрировал противовирусную активность против коронавируса во время вспышки атипичной пневмонии в 2003 году.Исследователи разработали это исследование, чтобы оценить, улучшает ли вдыхаемый NO выживаемость у пациентов с тяжелой формой COVID-2019.
Клинический спектр симптоматических пациентов варьируется от легкого синдрома верхних дыхательных путей до тяжелой диффузной вирусной пневмонии в контексте тяжелой полиорганной дисфункции, ведущей к смерти. В Китае общий уровень летальности среди пациентов с доказанной инфекцией составляет 2,2%. Около 25% госпитализированных пациентов с COVID-19 требовали госпитализации в отделение интенсивной терапии.Из них 61% пациентов соответствовали клиническим критериям острого респираторного дистресс-синдрома (ОРДС). В другом ретроспективном исследовании, проведенном в Ухане (Китай) с участием 52 пациентов в критическом состоянии с COVID-19, частота пациентов с пневмонией, отвечающих критериям ОРДС, составила 67%. Смертность в ОИТ достигла 63% при различных профилях комбинированной органной недостаточности у умерших пациентов (81% с ОРДС, 37,5% с ОПП, 28% с сердечным повреждением и 28% с печеночной недостаточностью).
В 2004 году во время вспышки коронавируса тяжелого острого респираторного синдрома (SARS-CoV) было продемонстрировано, что лечение NO, обращенное на легочную гипертензию, улучшило тяжелую гипоксию и сократило продолжительность поддерживающей вентиляции легких по сравнению с подобранными контрольными пациентами с SARS-CoV.В последующем исследовании in vitro доноры NO (например, S-нитрозо-N-ацетилпеницилламин) значительно увеличили выживаемость эукариотических клеток, инфицированных SARS-CoV, что свидетельствует о прямом противовирусном эффекте NO. Коронавирус, ответственный за SARS-CoV, имеет большую часть генома COVID-19, что указывает на потенциальную эффективность терапии ингаляционным NO у этих пациентов.
Здесь исследователи предлагают рандомизированное клиническое исследование, направленное на предотвращение прогрессирования заболевания у пациентов с тяжелым острым респираторным синдромом.
Контрольная группа: будет предоставлен стандартный медицинский уход. Группа лечения: в дополнение к стандартной терапии пациенты будут получать ингаляции NO. Вдохновленный NO / N2 будет доставлен в количестве 80 частей на миллион (ppm) в первые 48 часов после регистрации. После этого уровень NO будет снижен до 40 ppm до исчезновения тяжелой гипоксии. Отлучение от NO начнется, когда пациенты улучшат уровень оксигенации до PaO2 / FiO2> 300 мм рт.ст. или SpO2> 93% в течение более 24 часов подряд.Врач будет следовать своим собственным протоколам отлучения от груди. В отсутствие институциональных протоколов, NO будет снижаться каждые 4 часа поэтапно, начиная с 40 ppm до 20, 10, 5, 3, 2 и 1 ppm. Если во время отлучения от груди возникает гипоксемия (SpO2 <93%) или острая гипотензия (систолическое артериальное давление <90 мм рт.ст.), уровень NO следует увеличить до более высокой концентрации.
Безопасность: длительное лечение вдыхаемым NO может привести к повышению уровня метгемоглобина.


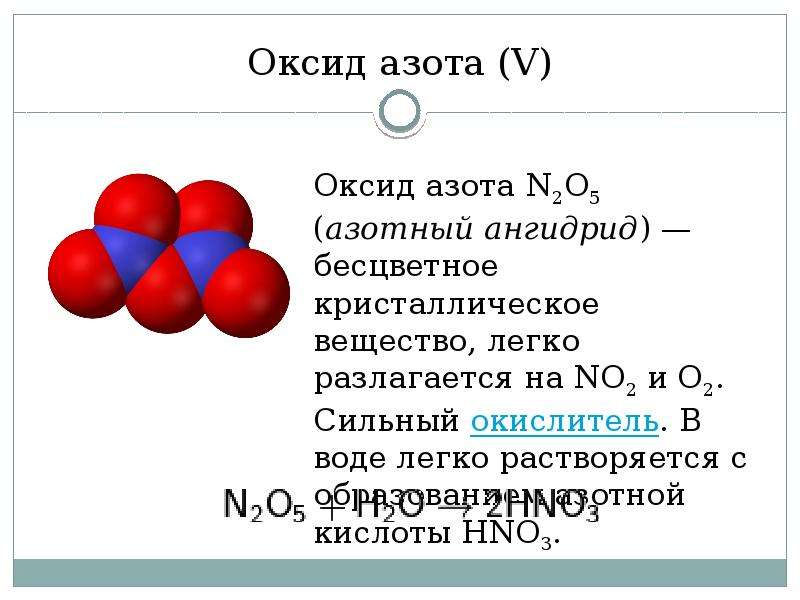

 2-12q24.3)
2-12q24.3)