Оксид азота — препараты, польза, как принимать
Лишь несколько десятилетий назад люди стали обращать внимание на оксид азота. А сегодня оксид азота, препараты которого можно найти в магазинах здорового питания, становится лечебных ингредиентом от многих состояний. Молекулу оксида азота стали изучать в 1992 году, ранее она была довольно недооцененным аспектом здоровья человека. Несколько лет спустя, в 1998 году, трое ученых были удостоены Нобелевской премии за открытие, что оксид азота является ключевой молекулой в сердечно-сосудистой системе, которая помогает поддерживать здоровье кровеносных сосудов и регулирует кровяное давление.
Теперь мы знаем, что оксид азота может укрепить здоровье еще больше.
Сегодня препараты, повышающие уровень оксида азота, очень популярны. Интересная вещь — вы не можете принимать препараты оксида азота – их не существует. Но вы можете принимать добавки, которые содержат ингредиенты, которые ваше тело использует для производства оксида азота.
Добавки — не единственный вариант. Вы также можете повысить уровень оксида азота естественным путем, употребляя продукты, богатые нитратами. Овощи, такие как свекла и листовая зелень, особенно богаты нитратами. Физические упражнения — еще один естественный способ повысить уровень оксида азота в организме.
Что такое оксид азота
Формула оксида азота — это NO, что означает, что этот бесцветный газ состоит из одной молекулы азота и одной молекулы кислорода. Оксид азота вырабатывается почти каждой клеткой человеческого организма. Две аминокислоты , L-аргинин и L-цитруллин, повышают выработку оксида азота в организме. Более конкретно, почки превращают L-цитруллин в L-аргинин, который является предшественником оксида азота.
Оксид азота считается посредником межклеточной коммуникации и играет важную роль в самых разнообразных процессах в организме, включая воспаление, вазодилатацию и нейротрансмиссию. Он считается одной из самых важных молекул, когда речь идет о здоровье наших кровеносных сосудов. Оксид азота играет очень важную роль в расширении сосудов.
Что такое вазодилатация
Это открытие или расширение кровеносных сосудов, которое возникает в результате расслабления мышечных стенок сосудов.
Оксид азота — препараты, полезные свойстваЧем полезны препараты оксида азота
Рассмотрим подробнее, какими полезными свойствами обладает оксид азота и препараты, повышающие оксид азота в организме.
1. Понижает кровяное давление
Что делает оксид азота (NO) в организме? Он делает много вещей, в том числе действует как вазодилататор. Это означает, что он может способствовать более легкому движению крови по сосудам, так что сердце не должно работать в усиленном режиме. Это помогает снизить кровяное давление. Исследования, проведенные на сегодняшний день, демонстрируют, как потребление диетических нитратов и, как следствие, увеличение производства NO резко снижают артериальное давление у здоровых людей.
Помимо положительного влияния на артериальное давление, NO также может улучшить функцию эндотелия. Это важно, так как известно, что эндотелиальная дисфункция способствует развитию артеросклероза, который может привести к инфаркту или инсульту. Исследование, опубликованное в 2014 году в
2. Уменьшает вероятность тромбоза
В дополнение к снижению артериального давления, еще одна впечатляющая функция оксида азота — это способность улучшать здоровье сердца, делая тромбоциты менее липкими. Почему это хорошо? Когда тромбоциты менее липкие, они реже слипаются и образуют сгусток крови. Тромбы или сгустки крови могут быть смертельно опасными, потому что они могут вызвать инсульты и сердечные приступы. Исследования показывают, что NO может помочь уменьшить скорость образования сгустка, а также его прочность.
Эксперименты на животных также показали, что NO может уменьшить воспаление кровеносных сосудов и предотвратить свертывание.
3. Помогает эректильной дисфункции и повышает либидо мужчин и женщин
Оксид азота является «основным медиатором эрекции полового члена». Он активирует расслабление гладких мышц полового члена. Это увеличивает кровоток, который необходим для начала и поддержания эрекции. По мере старения мужчин наблюдается тенденция к снижению синтазы оксида азота или NOS, которые являются ферментами, вызывающими выработку оксида азота из L-аргинина. С этим уменьшением NOS и, следовательно, NO, наблюдается тенденция к снижению эректильной реакции. Это может быть причиной, почему мужчина борется с эректильной дисфункцией (ЭД).
Положительные эффекты на артериальное давление препаратов оксида азота являются еще одной причиной, по которой NO помогает при ЭД, поскольку высокое артериальное давление и ЭД связаны между собой. Открытие влияния оксида азота на эрекцию привело к разработке некоторых из самых известных лекарств от импотенции существующих сегодня. Оксид азота также играет важную роль в возбуждении женщин.
4. Поддерживает здоровье мозга
Оксид азота также известен как ключевой элемент в здоровье мозга. Было доказано, что он является важным коммуникатором мозга с различными системами органов. Но особенно важен оксид азота для центральной нервной системы, где он выступает в качестве посредника в клеточной коммуникации в мозге.
Исследования, проведенные в Университете Лестера, показывают, как NO может изменить «вычислительную способность» мозга, что указывает на способность NO помогать в лечении нейродегенеративных заболеваний, таких как болезнь Альцгеймера. Ученые говорят, что снижение уровня окисда азота может объяснить ослабленную способность пациентов с болезнью Альцгеймера (и другими нейродегенеративными заболеваниями) узнавать новую информацию.
5. Укрепляет иммунную систему
Многие клетки иммунной системы производят и реагируют на оксид азота. Он играет ключевую роль в работе иммунной системы и помогает бороться с болезнями.
В научном обзоре, опубликованном в Indian Journal of Biochemistry and Biophysics,
6. Может улучшить спортивные результаты
Многие атлеты и бодибилдеры принимают перед тренировкой препараты оксида азота, потому что считают, что это помогает им работать производительнее и дольше. Есть ли правда в этом? Исследования дали смешанные результаты.
В одном научном обзоре 42 исследований делается вывод, что добавки NO могут «улучшать толерантность» к аэробным и анаэробным упражнениям у неподготовленных или умеренно обученных здоровых людей. Но, по-видимому, такой пользы для профессиональных спортсменов не наблюдается. В обзоре также указывается, что большая часть исследований была проведена с молодым мужским населением, поэтому необходимы дополнительные исследования для женщин и пожилых людей.
Способы естественного увеличения оксида азота
Возможные симптомы дефицита оксида азота включают гипотензию, бессонницу, беспокойство, потерю либидо и эректильную дисфункцию. К счастью, есть много естественных способов повысить уровень оксида азота в организме.
Вы задаетесь вопросом, как увеличить уровень оксид азота в организме естественным путем с помощью диеты? На самом деле не существует такой вещи, как «продукты из оксида азота», но есть продукты, которые повышают содержание NO в организме. Эти продукты содержат нитраты, которые затем превращаются в нитриты. Нитриты затем превращаются в оксид азота в организме. Примерно 80% пищевых нитратов поступают из употребления овощей. Если вы посмотрите на любую пищевую карту оксида азота, вы обязательно найдете свеклу.
Продукты, богатые нитратами
- красная свекла
- листовая зелень, включая рукколу (было доказано, что среди листовой зелени, это лучший усилитель оксида азота), мангольд, шпинат и салат
- эндивий
- лук-порей
- редис
- сельдерей
- брокколи
- укроп
- китайская капуста
- репа
- огурцы
- морковь
- цветная капуста
- травы, такие как петрушка и укроп
- гранатовый сок
- апельсины
- бананы
Поскольку клетки используют аргинин для создания оксида азота, вы также можете рассмотреть возможность увеличения потребления аргинина с помощью продуктов с высоким содержанием белка, богатых аргинином, включая говядину, рыбу, яйца, молочные продукты, такие как кефир, сыр, семечки (тыквенные и семена подсолнечника), водоросли и спирулина.
Исследование 2016 года, опубликованное в журнале Nutrients, показывает, что более высокое потребление аргинина в пище связано с повышением уровня нитритов и нитратов в крови, которые являются мерой продукции оксида азота в организме. Помимо аргинина, отличным усилителем NO является аминокислота цитруллин. Лучший пищевой источник цитруллина — арбуз.
Оксида азота – препараты и дозировка
Как мы уже отметили, не существует препаратов «Оксид азота», есть добавки, которые могут повысить содержание оксида азота в организме. К ним относятся:
Пищевые добавки из свеклы
Когда вы едите свеклу, уровень оксида азота в организме естественным образом увеличивается. Было доказано, что свекла является настолько впечатляющим усилителем оксида азота, что ее даже стали выпускать в виде добавки как концентрированный сок, порошок или капсулы. Исследование, опубликованное в 2018 году, обнаружило, что употребление свекольного сока увеличило уровень выдыхаемого оксида азота у здоровых людей. В то время как исследования все еще находятся на ранних стадиях, ученые делают вывод о том, что пищевые добавки с нитратами представляют собой многообещающий новый подход к усилению аспектов физиологического ответа на физические упражнения, такие как мышечная эффективность и оксигенация, которые могут повысить работоспособность.
Рекомендуемый препарат
Eclectic Institute, Organic, свекольный сок в порошке, 3,2 унции (90 г)
L-аргинин
Для повышения уровня оксида азота при ЭД некоторые люди предпочитают принимать добавку L-аргинина. По данным клиники Майо, некоторые специфические состояния, при которых добавки L-аргинина могут быть полезны, включают стенокардию, высокое кровяное давление и эректильную дисфункцию. Что L-аргинин делает для либидо? Некоторые исследования показывают, что пероральный прием L-аргинина может улучшить сексуальную функцию у мужчин с эректильной дисфункцией.
Рекомендуемый препарат
Doctor’s Best, L-аргинин с длительным высвобождением и немедленным высвобождением, 500 мг, 120 таблеток с двойным слоем
L-цитруллин
При рассмотрении препаратов для увеличения оксида азота при эректильной дисфункции, L-цитруллин является еще одним вариантом. Исследования показывают, что у пациентов с эректильной дисфункцией более вероятно снижение уровня предшественников NO, а именно L-цитруллина и L-аргинина. Похоже, что низкие уровни L-цитруллина и L-аргинина могут увеличивать риск эректильной дисфункции за счет снижения концентрации оксида азота в организме. L-цитруллин также может помочь при гипотонии. Одно исследование, опубликованное в Journal of Applied Physiology, показало, что L-цитруллин был более эффективен, чем L-аргинин, в снижении артериального давления и повышении производительности упражнений.
Рекомендуемые препараты
Doctor’s Best, L-цитруллин Порошок, 7 унций (200 г)
Jarrow Formulas, Arginine-Citrulline Sustain, 120 таблеток
Для разработки индивидуальной программы улучшения здоровья при помощи средств натуропатии и нутрициологии и прохождения ее под контролем опытного наставника, приглашаем вам на health-coaching.
Побочные эффекты оксида азота
В окружающей среде оксид азота создаются естественным путем в результате таких явлений, как лесные пожары, молнии и выбросы в почву. Искусственные источники включают двигатели внутреннего сгорания, электростанции, удобрения и сельскохозяйственное сжигание.
Может ли слишком много окиси азота быть вредным?
Да, NO является токсичным газом в высоких концентрациях.
Вдыхание оксида азота может быть опасным. Иногда он используется для новорожденных, у которых есть дыхательная недостаточность из-за легочной гипертонии. Побочные эффекты при вдыхании оксида азота могут включать помутнение зрения, спутанность сознания, головокружение и потоотделение. Более серьезные побочные эффекты могут включать учащенное сердцебиение и голубоватые губы, ногти или ладони.
Побочные эффекты добавок оксида азота различаются в зависимости от того, какой препарат оксида азота вы выберете:
- Побочные эффекты и взаимодействия с добавкой свеклы включают иногда выделение мочи или испражнений розового или красного цвета. Иногда розовая моча после употребления свекольного сока также может косвенно свидетельствовать о синдроме «дырявого» кишечника.
- Побочные эффекты и взаимодействия с добавками L-аргинина включают боль в животе, вздутие живота, диарею, подагру, аномалии крови, аллергии, воспаление дыхательных путей, ухудшение астмы и низкое кровяное давление.
- Побочные эффекты и взаимодействия L-цитруллина включают потенциально опасное падение артериального давления, наряду с другими лекарственными взаимодействиями.
Меры предосторожности
Согласно статье, опубликованной в 2016 году в журнале Nitric Oxide, в настоящее время нет общедоступного и надежного теста, доступного для определения уровня NO в организме. В настоящее время на рынке есть тест-полоски из оксида азота слюны, но «они вряд ли точно оценят биодоступность оксида азота», говорится в документе. Поэтому единственным методом примерной оценки уровня оксида азота в организме является анализ симптоматики и вашего самочувствия.
Проконсультируйтесь с вашим лечащим врачом, прежде чем принимать препараты для оксида азота, особенно если вы в настоящее время беременны, кормите грудью, лечитесь от какого-либо заболевания или принимаете другие лекарства и / или добавки.
Заключительные мысли
- Итак, окись или оксид азота — полезен или вреден для здоровья? Подобно другим ключевым соединениям, содержащимся в организме человека, в оптимальных количествах он может способствовать укреплению здоровья различными способами.
- Оксид азота наиболее легко и безопасно можно увеличить с помощью пищевых источников.
- Продукты с высоким содержанием оксида азота — это продукты с высоким содержанием нитратов, которые повышают выработку NO. Эти продукты включают свеклу, листовую зелень, такую как руккола, эндивий, лук-порей, петрушка, брокколи и фенхель.
- Препараты оксида азота на самом деле не содержат оксида азота, но они содержат ингредиенты, которые являются известными усилителями оксида азота.
- Одной из лучших добавок NO может быть свекольный сок, порошок или капсулы, поскольку свекла известна своим высоким содержанием нитратов.
- Две аминокислоты, L-аргинин и L-цитруллин, также повышают выработку оксида азота в организме. Они также доступны в форме добавок для увеличения NO.
- Регулярные занятия спортом также помогают увеличить выработку NO в организме.
- Использование оксида азота включает снижение высокого кровяного давления, укрепление мозга и иммунитета, повышение производительности тренировки и улучшение ЭД / сексуального возбуждения.
Вам также будет интересно:
Мы будем благодарны, если вы поделитесь этой статьей в социальных сетях!
blisswoman.ru
Оксиды азота. Азотная кислота | АЛХИМИК
Оксиды азота
Известны несколько оксидов азота.
Несолеобразующие оксиды: N2O, NO
Солеобразующие оксиды: N2O3, NO2, N2O4, N2O5
Все оксиды азота, кроме N2O, ядовитые вещества.
Оксид азота (I) N2O – это бесцветный газ со слабым запахом и сладковатым вкусом, хорошо растворимый в воде, но не взаимодействует с ней. При достаточно высокой температуре разлагается по уравнению:
2N2O = 2N2 + O2
В смеси с кислородом N2O используется в медицине для наркоза («веселящий» газ).
Наиболее важными являются оксиды азота (II) и (IV).
Оксид азота (II) NO – бесцветный газ, не имеет запаха. В воде малорастворим, относится, как и N2O, к несолеобразующим оксидам. Оксид азота (II) NO образуется из азота и кислорода при сильных электрических разрядах (например, во время грозы в воздухе) или при высокой температуре:
N2 + O2 = 2NO
В лаборатории оксид азота (II) получают, например, при взаимодействии меди и разбавленной азотной кислоты:
3Cu + 8HNO3 = 3Cu(NO3)2 + 2NO↑ + 4H2O
Оксид азота (II) в промышленности получают каталитическим окислением аммиака и используют для получения азотной кислоты:
4NH3 + 5O2 = 4NO + 6H2O
Оксид азота (II) на воздухе легко окисляется до оксида азота (IV):
2NO + O2 = 2NO2
 Оксид азота (IV)
Оксид азота (IV)Оксид азота (IV) NO2 – ядовитый газ бурого цвета, имеет характерный запах. Хорошо растворяется в воде. Оксид азота (IV) является смешанным оксидом, которому соответствуют две кислоты: азотистая HNO2 и азотная HNO3. Поэтому взаимодействие с водой происходит по уравнению:
2NO2 + H2O = HNO2 + HNO3
При взаимодействии NO2 с водой в присутствии кислорода (на воздухе) образуется только азотная кислота:
4NO2 + O2 + 2H2O ⇄ 4HNO3
При растворении NO2 в щелочи, например NaOH, образуются две соли (нитрат и нитрит) и вода:
2NO2 + 2NaOH = NaNO2 + NaNO3 + H2O
В избытке кислорода образуется только нитрат натрия:
4NO2 + 4NaOH + O2 = 4NaNO3 + 2H2O
Ниже 22 0С молекулы оксида азота (IV) NO2 легко соединяются попарно и образуют бесцветную жидкость состава N2O4, которая при охлаждении до – 10,2 0С превращается в бесцветные кристаллы.
В лаборатории NO2 можно получить при взаимодействии, например, меди с концентрированной азотной кислотой:
Cu + 4HNO3 = Cu(NO3)2 + 2NO2↑ + 2H2O
В промышленности NO2 получают путем окисления NO кислородом и далее используют для получения азотной кислоты.
Оксид азота (III) N2O3 – это темно-синяя жидкость, является кислотным оксидом. При взаимодействии с водой образуется азотистая кислота:
 Оксид азота (III)
Оксид азота (III)N2O3 + H2O = 2HNO2
Оксид азота (V) N2O5 – бесцветные кристаллы, хорошо растворимые в воде с образованием азотной кислоты:
N2O5 + H2O = 2HNO3
Азотная кислота
Физические свойства
Азотная кислота HNO3 – бесцветная жидкость, имеет резкий запах, легко испаряется, кипит при температуре 83 0С. При попадании на кожу азотная кислота может вызвать сильные ожоги (на коже образуется характерное желтое пятно, его сразу же следует промыть большим количеством воды, а затем нейтрализовать содой). С водой азотная кислота смешивается в любых соотношениях.
Обычно применяемая в лаборатории концентрированная азотная кислота содержит 63% HNO3. При хранении довольно легко, особенно на свету разлагается по уравнению:
4HNO3 ⇄ 2H2O + 4NO2↑ + O2↑
Выделяющийся газ NO2 окрашивает азотную кислоту в бурый цвет.
Химические свойства
 Азотная кислота
Азотная кислотаКислотно – основные свойства
Азотная кислота – одна из наиболее сильных кислот. В водных растворах она полностью диссоциирована на ионы:
HNO3 ⇄ H+ + NO3—
Как и все кислоты, она реагирует:
а) с оксидами металлов:
MgO + 2HNO3 = Mg(NO3)2 + H2O
б) с основаниями:
Mg(OH)2 + HNO3 = Mg(NO3)2 + H2O
в) с солями более слабых кислот:
K2CO3 + HNO3 = KNO3 + CO2↑ + H2O
Окислительно – восстановительные свойства
Азотная кислота является одним из сильнейших окислителей. Ее окислительно-восстановительные свойства обусловлены присутствием в молекуле HNO3 атома азота в высшей степени окисления N+5 в составе кислотного остатка NO3—. Окислительные свойства кислотного остатка NO3— значительно сильнее, чем ионов водорода Н+, поэтому азотная кислота взаимодействует практически со всеми металлами, кроме золота и платины, находящимися в конце ряда напряжений. Так как окислителем в HNO3 являются ионы NO3—, а не ионы Н+, то при взаимодействии HNO3 с металлами практически никогда не выделяется водород. Нитрат-ионы NO3— при взаимодействии HNO3 с металлами восстанавливаются тем полнее, чем более разбавлена кислота и чем более активен металл. На следующей схеме показано, какие продукты могут образоваться при восстановлении HNO3:

 Общая схема взаимодействия азотной кислоты с металлами
Общая схема взаимодействия азотной кислоты с металламиКонцентрированная HNO3 при взаимодействии с наиболее активными металлами (до Al в ряду напряжений) восстанавливается до N2O. Например:
10HNO3 + 4Ca = 4Ca(NO3)2 + N2O↑ + 5H2O
Концентрированная HNO3 при взаимодействии с менее активными металлами (Ni, Cu, Ag, Hg) восстанавливается до NO2. Например:
4HNO3 + Ni = Ni(NO3)2 + 2NO2↑ + 2H2O
Аналогично концентрированная азотная кислота реагирует с некоторыми неметаллами. Неметалл при этом окисляется до оксокислоты. Например:
5HNO3 + P = HPO3 + 5NO2↑ + 2H2O
Следует отметить, что концентрированная HNO3 пассивирует такие металлы, как Fe, Al, Cr. Сущность пассивирования заключается в образовании на поверхности металла тонкой, но очень плотной оксидной плёнки, предохраняющей металл от дальнейшего взаимодействия с кислотой; например:
3Al + 12HNO3 = Al(NO3)3 + Al2O3 + 9NO2↑ + 6H2O
Разбавленная HNO3 реагирует с наиболее активными металлами (до Al) с образованием аммиака или нитрата аммония NH4NO3:
10HNO3 + 4Mg = 4Mg(NO3)2 + NH4NO3 + 3H2O
При взаимодействии разбавленной азотной кислоты с менее активными металлами образуется оксид азота (II) NO:
8HNO3 + 3Cu = 3Cu(NO3)2 + 2NO↑ + 4H2O
Таким же образом разбавленная HNO3 взаимодействует с некоторыми неметаллами:
2HNO3 + S = H2SO4 + 2NO↑
 Взаимодействие азотной кислоты с медью
Взаимодействие азотной кислоты с медьюПолучение
В лаборатории азотную кислоту получают при взаимодействии безводных нитратов с концентрированной серной кислотой:
Ba(NO3)2 + H2SO4 = BaSO4↓ + 2HNO3
В промышленности получение азотной кислоты идет в три стадии:
- Окисление аммиака до оксида азота (II):
4NH3 + 5O2 = 4NO + 6H2O
- Окисление оксида азота (II) в оксид азота (IV):
2NO + O2 = 2NO2
- Растворение оксида азота (IV) в воде и избытком кислорода:
4NO2 + 2H2O + O2 = 4HNO3
Применение
Азотную кислоту применяют для получения азотных удобрений, лекарственных и взрывчатых веществ.
Соли азотной кислоты
Соли азотной кислоты называются нитратами. Нитраты калия, натрия, аммония и кальция называются селитрами. Селитры применяют как минеральные азотные удобрения, так как азот является одним из основных элементов питания растений.
Все соли азотной кислоты хорошо растворимы в воде.
Соли азотной кислоты, как и она сама, являются сильными окислителями.
При нагревании все нитраты разлагаются с выделением кислорода, характер других продуктов разложения зависит от положения металла в ряду напряжений:

Примеры:
2NaNO3 = 2NaNO2 + O2↑
2Zn(NO3)2 = 2ZnO + 4NO2↑ + O2↑
2AgNO3 = 2Ag + 2NO2↑ + O2↑
*на изображении записи кристаллы нитрата меди (II)
Похожее
al-himik.ru
Оксид азота — свойства, получение, применение
 Оксид азота – химическое соединение группы окисей азота, в котором азот присутствует во II степени окисления. Он имеет один непарный радикальный электрон, следовательно, является нестабильным, имеет высокую реакционную способность и обладает свойствами свободного радикала.
Оксид азота – химическое соединение группы окисей азота, в котором азот присутствует во II степени окисления. Он имеет один непарный радикальный электрон, следовательно, является нестабильным, имеет высокую реакционную способность и обладает свойствами свободного радикала.
Оксид азота или окись азота, а также известный как монооксид азота представляет собой молекулу с химической формулой NO. Это свободные радикалы, которые является важным промежуточным продуктом химических реакций.
В организмах млекопитающих и человека оксид азота является важной составляющей клеточных сигнальных молекул, участвующих во многих физиологических и патологических процессах. Это мощный вазодилататор с коротким, в несколько секунд, периодом полураспада в крови.
В конце 80-х годов было доказано, что особые ферментные системы организмов способны синтезировать газ оксида азота. Это происходит в результате окисления гуанидиновой группы аминокислоты L-аргинина с одновременным синтезом цитруллина.
Получение оксида азота
В лабораторных условиях получение оксида азота возможно путем проведения реакции разбавленной азотной кислоты с медью или восстановлением азотистой кислоты в виде нитрита натрия или нитрита калия.
Основным природным источником оксида азота являются электрические разряды молний в грозу. Оксид азота является побочным продуктом, возникающим при сгорании веществ в автомобильных двигателях и топлива на электростанциях.
Также получение оксида азота возможно из свободных элементов, для этого необходимо при температуре 1200-1300°C провести соединение азота с кислородом.
Применение оксида азота
Оксид азота используется в медицине для расширения кровеносных сосудов при ишемической болезни сердца путем уменьшения нагрузки на сердце.
Оксид азота используется при неотложной помощи для содействия капиллярному расширению легких для лечения первичной легочной гипертензии у новорожденных, связанной с врожденными дефектами. Терапия оксидом азота значительно повышает качество жизни и, в некоторых случаях, спасает жизнь детей с риском развития заболевания сосудов легких.
Оксид азота также вводится в виде спасительной терапии у больных с острой правожелудочковой недостаточностью, которая является вторичной по отношению к легочной эмболии.
В пищевой промышленности оксид азота известен под названием пищевая добавка Е942 и используется в качестве пропеллента и упаковочного газа.
Свойства оксида азота
Оксид азота – это бесцветный газ с температурой плавления -163,6°С и температурой кипения -151,7°С. Молекулярная формула оксида азота – NO, молярная масса – 30.01 грамм/моль, плотность – 1,3402 г дм, растворимость в воде – 74 см3/дм3, показатель преломления – 1.0002697.
Польза оксида азота
 Оксид азота широко применяется в традиционной медицине при различных заболеваниях и оказывает положительное влияние на:
Оксид азота широко применяется в традиционной медицине при различных заболеваниях и оказывает положительное влияние на:
- Систему кровообращения – регуляторные свойства оксида азота оказывают влияние на циркуляцию крови по всему телу, увеличивают диаметр кровеносных сосудов и предотвращают образование тромбов. Он помогает эндотелиальным клеткам контролировать кровеносные сосуды. Оксид азота также повышает уровень кислорода внутри тела, понижает уровень артериального давления и помогает в оптимальном режиме функционировать сердцу;
- Иммунную систему – иммунные клетки в организме человека синтезируют оксид азота, чтобы уничтожать бактерии и вирусы, способные вызывать инфекции. Известно также свойство оксида азота предотвращать появление доброкачественных и злокачественных опухолей в клетках организма;
- Уровень выносливости — оксид азота повышает уровень выносливости мышечных клеток, что позволяет выдерживать более тяжелые нагрузки и с легкостью вести более активную деятельность;
- Повышение реакции нервных клеток – оксид азота действует как внутриклеточный посредник между различными клетками в организме, в том числе, нервными клетками. При достаточном содержании оксида азота в организме связь между нервными клетками становится быстрее, что приводит к быстроте реакции на внешние раздражители, увеличению фокуса и бдительности;
- Повышение сексуальной энергии – применение оксида азота стимулирует, бодрит и усиливает сексуальные механизмы реагирования в организме. Сенсорные и психические стимуляции, вызываемые нервными клетками под действием оксида азота, приводят к расслаблению мышц и притоку крови к пенису, благодаря чему происходит эрекция. Таким же образом процесс протекает и в женском организме, под действием оксида азота приток крови увеличивается в тканях влагалища;
- Облегчение боли – оксид азота обеспечивает долгосрочное облегчение от боли, связанной с артритом и воспалением суставов. Он способен активировать противовоспалительные механизмы в клетках организма, и способствует уменьшению воспаления;
- Увеличение мышечной массы – добавки содержащие оксид азота расширяют кровеносные каналы, улучшают кровообращение и увеличивают мышечную массу. При увеличении потока крови увеличивается количество питательных веществ в мышцах, что приводит к увеличению их размера;
- Внутриклеточные связи – оксид азота улучшает процесс связи между различными клетками в организме, в том числе, между нервными клетками и клетками мозга. Применение добавок содержащих оксид азота приводит к улучшению памяти, повышению уровня концентрации и способности к обучению.
Вред оксида азота
Применение оксида азота у большинства людей не вызывает побочных эффектов, однако, в случаях передозировки он приводит к диарее, слабости, тошноте, головной боли, учащению пульса и сердцебиения, задержкам воды, усталости, раздражениям на коже и сухости во рту.
Также побочными эффектами применения оксида азота являются проблемы с дыханием, сильная аллергия или сыпь, крапивница, зуд, одышка, опасные для жизни осложнения астмы, внезапный озноб, потливость, тремор, рвота и обмороки. В некоторых случаях применение оксида азота приводит к вспышкам герпеса, расширению сосудов и кровотечениям.
www.neboleem.net
Окись азота и судьба человека
Бесцветный газ — окись азота — всегда считался вредным для организма человека. Инженеры разрабатывают более совершенные двигатели внутреннего сгорания, в меньшей степени загрязняющие атмосферу окисью азота, конструируют системы регенерации окиси азота в другие вещества. Но в конце ушедшего века ученые неожиданно обнаружили, что окись азота присутствует в любом живом организме в довольно больших концентрациях. И не просто присутствует, а управляет важнейшими физиологическими процессами.Профессор Анатолий Федорович Ванин, впервые обнаруживший радикалы окиси азота в живых клетках, беседует с нобелевским лауреатом Робертом Форшготтом, впервые описавшим явление, обусловленное действием окиси азота. Москва, 1989 год.
Электронная формула окиси азота (NO).
Наука и жизнь // Иллюстрации
Схема физиологических воздействий окиси азота на тонус сосудов.
‹
›
Окись азота (химическое название — оксид азота) — новая «путеводная звезда» в медицине, указывающая направление поиска лекарственных средств против множества болезней. Именно так считают сейчас большинство исследователей.
Лавинообразный рост числа публикаций по исследованию роли окиси азота в биологических объектах дал основание Американской ассоциации развития науки и авторитетному научному журналу «Science» («Наука») назвать в 1992 году окись азота молекулой года.
Чем же продиктован такой все возрастающий научный интерес к окиси азота?
Оказалось, что окись азота управляет как внутриклеточными, так и межклеточными процессами в живой клетке. Многие болезни — гипертония, ишемия миокарда, тромбозы, рак — вызваны нарушением физиологических процессов, которые регулирует окись азота. Именно по этой причине окись азота представляет огромный интерес для биологов и медиков самых разных специальностей.
Нейрофизиологи и нейрохимики интересуются окисью азота в связи с тем, что она управляет важнейшими процессами, происходящими в нервной системе. Высшая нервная деятельность человека во многом обусловлена прохождением импульса с одной нервной клетки (нейрона) на другую — так называемой синаптической передачей. Если попытаться описать этот процесс в двух словах, то можно сказать, что при прохождении нервного импульса из окончания одного нейрона «выбрасывается» молекула сигнального вещества — нейромедиатора (например, ацетилхолина, глутамата), которую «захватывает» специальный белок (рецептор) на мембране нервного окончания другого нейрона. Затем сложная цепь биохимических и электрохимических реакций обеспечивает прохождение нервного импульса по этому нейрону. Когда сигнал достигает нервного окончания, снова происходит выброс из него молекулы нейромедиатора и так далее. Оказалось, что окись азота активирует процесс выброса нейромедиаторов из нервных окончаний во время синаптической передачи. Более того, молекула окиси азота сама может играть роль нейромедиатора, то есть непосредственно передавать сигнал с одной нервной клетки на другую. Неудивительно, что окись азота присутствует во всех отделах головного мозга человека: гипоталамусе, среднем мозге, коре, гиппокампе, продолговатом мозге и др.
Таким образом, в мыслительной деятельности окись азота является и непосредственным участником, и косвенным регулятором. Что касается телесного существования, то и здесь ее роль не меньшая.
Кардиологи и специалисты, изучающие систему кровообращения, интересуются окисью азота, поскольку она регулирует расслабление гладких мышц сосудов и синтез так называемых «белков теплового шока», которые «защищают» сосуды при ишемической болезни сердца.
Гематологов окись азота интересует в связи с тем, что она тормозит агрегацию (слипание) тромбоцитов, влияет на перенос кислорода эритроцитами, а также на реакции с участием химически активных молекул (свободных радикалов) в крови.
Иммунологов окись азота интересует потому, что активация клеток, участвующих в иммунном ответе, — макрофагов и нейтрофилов — сопровождается высвобождением этими клетками окиси азота.
Онкологи проявляют повышенный интерес к окиси азота из-за ее предполагаемого участия в процессе развития злокачественных образований.
Физиологи, занимающиеся проблемами регуляции водно-солевого обмена в организме, и нефрологи интересуются окисью азота по той причине, что она регулирует почечный кровоток и солевой обмен в почечных канальцах.
Даже интимная жизнь без окиси азота невозможна — ее высвобождение способствует эрекции.
Но и это еще не все. В последние годы лавинообразно нарастает поток информации о влиянии окиси азота на функционирование генома.
Судьба человека определяется его поведением и характером, на которые, в свою очередь, влияет состояние его души и тела. Значит, судьба человека в некотором смысле связана с окисью азота.
Что же представляет собой молекула окиси азота?
Известно, что, когда в электронном семействе какой-либо молекулы имеется электрон без своей пары, то есть для него нет партнера, все семейство испытывает беспокойство и проявляет повышенную агрессивность по отношению к другим соединениям, стремясь найти и отобрать чужой недостающий электрон. Соединения, имеющие неспаренный электрон, называются радикалами. Радикалы обычно неустойчивы и появляются на промежуточных стадиях химических реакций.
Окись азота из-за наличия в ее электронной структуре неспаренного электрона относится к разряду радикалов и, следовательно, как и все радикалы, стремится «найти» недостающий электрон для создания новой электронной пары. Когда это удается сделать, образуется молекула NO_ — нитроксил-анион. Чаще же приобрести недостающий электрон, отнимая его у другой молекулы, без «войны» не удается. В результате происходят самые разнообразные реакционные процессы, в ходе которых окись азота может претерпевать различные превращения.
Не стоит путать окись азота с закисью азота (ее химическая формула — N2O), тоже бесцветным газом со сладковатым вкусом, кратковременное вдыхание которого вызывает признаки истерии, а большие количества действуют на нервную систему возбуждающе, вызывая состояние, сходное с опьянением. В связи с этим закись азота называют «веселящим газом». Длительное вдыхание «веселящего газа» приводит к притуплению болевой чувствительности и потере сознания, благодаря чему в смеси с кислородом (80% N2о+20% О2) он иногда применяется для наркоза.
Окись азота же сама по себе таких эффектов не вызывает. Но закись азота, поступающая в определенные отделы мозга, химически разрушается там с образованием окиси азота, действие которой на нервные клетки и определяет эффекты, вызываемые вдыханием закиси. Алкоголь действует на клетки головного мозга так же опосредованно и через окись азота.
За разработку проблемы окиси азота в биологии и медицине ряд ученых удостоен Нобелевской премии по физиологии и медицине 1998 года. Точная формулировка звучит так: «Нобелевская премия по физиологии и медицине присуждена за открытие роли оксида азота как сигнальной молекулы в сердечно-сосудистой системе». Нобелевскими лауреатами стали американские ученые Роберт Форшготт, Ферид Мьюрэд и Луис Игнарро.
А началось все с открытия, результаты которого были опубликованы Робертом Форшготтом в 1955 году. Ученый, проводя физиологические эксперименты с кровеносными сосудами, обнаружил расслабляющее действие света на аорту кролика. Это загадочное поведение аорты в ответ на действие света стало в дальнейшем для него и других исследователей объектом пристального внимания. Можно считать, что оно явилось своеобразной точкой отсчета нового раздела биологической науки.
Следующий шаг был сделан в нашей стране человеком, который совершил открытие, ставшее вехой в понимании роли окиси азота в биологии и медицине. Это — профессор, доктор биологических наук Анатолий Федорович Ванин, заведующий лабораторией Института химической физики Российской академии наук.
В 1965 году журнал «Биофизика» опубликовал его небольшую, но, как позже оказалось, чрезвычайно важную статью под названием «Свободные радикалы нового типа в дрожжевых клетках». В ней говорилось, что в биологических объектах обнаружены радикалы неизвестной природы, которые никто в мире еще не наблюдал. Наша страна тогда была «впереди планеты всей» по части создания аппаратуры для обнаружения радикалов, основанной на явлении электронного парамагнитного резонанса (ЭПР). Приборы и средства обнаружения радикалов, работающие на его основе, называются радиоспектрометрами. Именно этими приборами и была оснащена лаборатория, где работал Анатолий Федорович, который сегодня считается одним из признанных авторитетов в области ЭПР-спектроскопии.
Явление ЭПР в 1944 году открыл профессор Казанского университета Е. К. Завойский. Суть этого явления связана со способностью радикалов, находящихся в магнитном поле, избирательно поглощать энергию радиоволн.
Неизвестная радикальная субстанция сначала была обнаружена в культурах дрожжей, а затем и в клетках животного происхождения. Стало понятным, что открыто новое вещество, которое присутствует во всех живых клетках.
Работы Форшготта и Ванина застолбили новое научное направление. Сейчас ученым понятно, что открытые Анатолием Федоровичем неизвестные радикалы не что иное, как молекулы окиси азота. Но в то время предстояло еще выполнить немало сложнейших исследований, чтобы узнать, какие именно радикалы подают необычный ЭПР-сигнал. Одно было ясно уже тогда: науке эти радикалы неизвестны. Годы напряженного труда позволили Ванину сделать второе открытие. Он доказал, что сигналы подает окись азота, причем не одна, а в комплексе с ионами железа и белками, содержащими сульфгидрильные группы. Теперь их называют «динитрозильные комплексы».
Какова роль комплекса окиси азота и белка в живой клетке? На этом вопросе и сконцентрировалось внимание Ванина и других исследователей, подключившихся к изучению проблемы.
Между тем Р. Форшготт продолжал изучать природу открытого им явления. В 1961 году он опубликовал обзорную статью, в которой еще раз осветил вопрос о расслабляющем действии видимого света на кровеносные сосуды. Результатом исследований, продолжавшихся четверть века, явилось открытие Форшготтом в 1980 году неизвестного физиологически активного вещества — эндотелиального фактора расслабления сосудов (EDRF).
Форшготт обнаружил, что ацетилхолин, являющийся одним из медиаторов нервной системы, обычно вызывал сжатие кровеносных сосудов, но в некоторых опытах он их почему-то расслаблял. Анализируя эти эксперименты, Форшготт обратил внимание, что расслабляющее действие ацетилхолина на сосуды наблюдалось только в тех случаях, когда они были плохо очищены от эндотелиальных клеток, выстилающих внутреннюю поверхность сосудов. Форшготт догадался, что именно присутствие эндотелия меняло физиологический эффект ацетилхолина на противоположный. После проведения серии остроумных опытов сомнений не оставалось: сделано открытие. Так и был обнаружен эндотелиальный фактор расслабления сосудов (EDRF). Это научное достижение приобрело широкий общественный резонанс и взбудоражило весь ученый мир. Большинство ученых сразу поняли, насколько оно важно для физиологии, патофизиологии и практической медицины.
В 1991 году Форшготт публикует целую серию статей, в которых он обосновывает утверждение, что EDRF — это не что иное, как молекула окиси азота. То есть, под действием ацетилхолина происходит выброс окиси азота из эндотелия кровеносных сосудов, которая затем поступает в слой мышечных клеток. И именно молекула окиси азота оказывает расслабляющее действие на стенки сосудов. А что же происходит под действием света? Почему он тоже вызывает сосудистую релаксацию? Видимо, под действием светового излучения высвобождается та же самая окись азота, которая (как показал Ванин) существует в виде динитрозильного комплекса с белками.
Как ученый-физиолог, Форшготт в своих научных исследованиях шел от явлений (физиологии) к их механизмам. Это путь от сложного к простому. Для Ванина, как биофизика и биохимика, путь от простого к сложному, от факта к его роли и значению был более естественным. Ванин и начал с того, что открыл существование радикальной субстанции в живых объектах и стал изучать, что это за молекула и какие функции она выполняет.
Форшготт первым в мире описал явление, обусловленное действием окиси азота, — релаксацию кровеносных сосудов. Ванин открыл наличие неизвестной субстанции в живой материи. В своих дальнейших исследованиях они шли навстречу друг другу, быстро сближаясь. Ими как бы были поставлены две вехи, между которыми пролегла невидимая связующая нить.
Результаты исследований не заставили себя ждать. Уже вскоре обозначена еще одна важная веха. Ее поставил американский ученый Ферид Мьюрэд, после того как в середине 70-х годов он сделал важное открытие, касающееся гуанилатциклазы. Гуанилатциклаза — один из ключевых ферментов, управляющих жизнью клетки. Мьюрэд показал, что гуанилатциклаза активируется при действии нитро- и нитрозосоединений. Мьюрэд высказывает идею, что действующим активным началом этих соединений являются не они сами, а окись азота, выделяемая из них, и экспериментально ее подтверждает.
В это же время Ванин изучает биологическое действие динитрозильных комплексов железа и показывает, что они обладают мощным гипотензивным действием — расслабляют кровеносные сосуды.
Ванин также предложил метод обнаружения окиси азота в органах и тканях, получивший широкое распространение. Следующий шаг его в научном поиске не менее важен. Он первым приходит к убеждению и обосновывает, что EDRF имеет прямое отношение к окиси азота. Когда авторы открытий буквально наступают друг другу на пятки, дышат в затылок в гонке за приоритетом, обычно учитывается, чьи результаты раньше увидели свет. Ванин, получив данные, что EDRF имеет отношение к окиси азота, в 1985 году решил их опубликовать в журнале «Бюллетень экспериментальной биологии и медицины», но напечатана статья была только через три года после подачи. Тут начал расти вал публикаций на эту тему в зарубежных изданиях. Такие же данные в 1986 году получили Форшготт и Игнарро, а в 1987 году — Сальвадор Монкада. Последний убедительно показал, что в состав EDRF входит окись азота, и немедленно опубликовал свои данные в международном научном журнале «Nature» («Природа») . Все эти публикации вышли в свет раньше, чем оригинальная статья Анатолия Федоровича.
Форшготт и Ванин, пройдя каждый свою половину пути, встретились в 1989 году во Всесоюзном кардиологическом научном центре в Москве. О чем они говорили тогда, понятно: конечно же, о научных планах, своих невероятных догадках и сомнениях. Их общение продолжилось в Лондоне на 1-й конференции по биологической роли оксида азота и в последующей переписке.
Авторитет Ванина как основоположника нового научного направления общепризнан. Но вот парадокс: главная научная награда — Нобелевская премия обошла его стороной. Незаслуженно — это не то слово. Видимо, выбор Нобелевского комитета не всегда основывается на научной значимости работ. Величие Анатолия Федоровича в том, что он не стал оспаривать решение комитета. А мы знаем, что такие гении, как Ньютон и Лейбниц, оспаривали друг у друга научные приоритеты. И это при том, что о Ньютоне говорили как о единственном смертном, вставшем вровень с богами. Да и Лейбниц за заслуги перед человечеством также вполне может быть приравнен к ним. Так что даже боги не всегда могут поделить между собой пальму первенства.
Но и исследователи, которым присудили Нобелевскую премию (напомним, что это Форшготт, Мьюрэд и Игнарро), — воистину великие ученые и, вне всякого сомнения, заслужили столь высокое признание. Тем не менее можно констатировать, что одно из главных действующих лиц в истории про окись азота просто вычеркнули из списков.
Возможно, с историей открытия действия окиси азота кто-то будет и не во всем согласен — неудивительно: логика исследований и роль каждого из ведущих ученых, разрабатывавших эту тему, может видеться всем по-разному. Но вряд ли кто усомнится и будет оспаривать, что все началось с основополагающих открытий Форшготта и Ванина. Именно они были пионерами в установлении всеобъемлющей роли окиси азота в живой природе.
Где же те весы, на которых можно было бы объективно взвесить признание заслуг ученого, чтобы справедливо воздать ему за них?
www.nkj.ru
Оксид азота: общие сведения, влияние на человека и окружающую среду
Оксид азота – химическое соединение группы окисей азота, в котором азот присутствует во II степени окисления. Он имеет один непарный радикальный электрон, следовательно, является нестабильным, имеет высокую реакционную способность и обладает свойствами свободного радикала.
Оксид азота или окись азота, а также известный как монооксид азота представляет собой молекулу с химической формулой NO. Это свободные радикалы, которые является важным промежуточным продуктом химических реакций.
В организмах млекопитающих и человека оксид азота является важной составляющей клеточных сигнальных молекул, участвующих во многих физиологических и патологических процессах. Это мощный вазодилататор с коротким, в несколько секунд, периодом полураспада в крови.
В конце 80-х годов было доказано, что особые ферментные системы организмов способны синтезировать газ оксида азота. Это происходит в результате окисления гуанидиновой группы аминокислоты L-аргинина с одновременным синтезом цитруллина.
Получение оксида азота
В лабораторных условиях получение оксида азота возможно путем проведения реакции разбавленной азотной кислоты с медью или восстановлением азотистой кислоты в виде нитрита натрия или нитрита калия.
Основным природным источником оксида азота являются электрические разряды молний в грозу. Оксид азота является побочным продуктом, возникающим при сгорании веществ в автомобильных двигателях и топлива на электростанциях.
Также получение оксида азота возможно из свободных элементов, для этого необходимо при температуре 1200-1300°C провести соединение азота с кислородом.
Применение оксида азота
Оксид азота используется в медицине для расширения кровеносных сосудов при ишемической болезни сердца путем уменьшения нагрузки на сердце.
Оксид азота используется при неотложной помощи для содействия капиллярному расширению легких для лечения первичной легочной гипертензии у новорожденных, связанной с врожденными дефектами. Терапия оксидом азота значительно повышает качество жизни и, в некоторых случаях, спасает жизнь детей с риском развития заболевания сосудов легких.
Оксид азота также вводится в виде спасительной терапии у больных с острой правожелудочковой недостаточностью, которая является вторичной по отношению к легочной эмболии.
В пищевой промышленности оксид азота известен под названием пищевая добавка Е942 и используется в качестве пропеллента и упаковочного газа.
Свойства оксида азота
Оксид азота – это бесцветный газ с температурой плавления -163,6°С и температурой кипения -151,7°С. Молекулярная формула оксида азота – NO, молярная масса – 30.01 грамм/моль, плотность – 1,3402 г дм, растворимость в воде – 74 см3/дм3, показатель преломления – 1.0002697.
Польза оксида азота
Оксид азота широко применяется в традиционной медицине при различных заболеваниях и оказывает положительное влияние на:
- Систему кровообращения – регуляторные свойства оксида азота оказывают влияние на циркуляцию крови по всему телу, увеличивают диаметр кровеносных сосудов и предотвращают образование тромбов. Он помогает эндотелиальным клеткам контролировать кровеносные сосуды. Оксид азота также повышает уровень кислорода внутри тела, понижает уровень артериального давления и помогает в оптимальном режиме функционировать сердцу;
- Иммунную систему – иммунные клетки в организме человека синтезируют оксид азота, чтобы уничтожать бактерии и вирусы, способные вызывать инфекции. Известно также свойство оксида азота предотвращать появление доброкачественных и злокачественных опухолей в клетках организма;
- Уровень выносливости — оксид азота повышает уровень выносливости мышечных клеток, что позволяет выдерживать более тяжелые нагрузки и с легкостью вести более активную деятельность;
- Повышение реакции нервных клеток – оксид азота действует как внутриклеточный посредник между различными клетками в организме, в том числе, нервными клетками. При достаточном содержании оксида азота в организме связь между нервными клетками становится быстрее, что приводит к быстроте реакции на внешние раздражители, увеличению фокуса и бдительности;
- Повышение сексуальной энергии – применение оксида азота стимулирует, бодрит и усиливает сексуальные механизмы реагирования в организме. Сенсорные и психические стимуляции, вызываемые нервными клетками под действием оксида азота, приводят к расслаблению мышц и притоку крови к пенису, благодаря чему происходит эрекция. Таким же образом процесс протекает и в женском организме, под действием оксида азота приток крови увеличивается в тканях влагалища;
- Облегчение боли – оксид азота обеспечивает долгосрочное облегчение от боли, связанной с артритом и воспалением суставов. Он способен активировать противовоспалительные механизмы в клетках организма, и способствует уменьшению воспаления;
- Увеличение мышечной массы – добавки содержащие оксид азота расширяют кровеносные каналы, улучшают кровообращение и увеличивают мышечную массу. При увеличении потока крови увеличивается количество питательных веществ в мышцах, что приводит к увеличению их размера;
- Внутриклеточные связи – оксид азота улучшает процесс связи между различными клетками в организме, в том числе, между нервными клетками и клетками мозга. Применение добавок содержащих оксид азота приводит к улучшению памяти, повышению уровня концентрации и способности к обучению.
В дополнение ко всему оксид азота является богатым источником необходимых питательных веществ, таких как b-ситостерин, урсоловая кислота, гликозиды, растительные стерины, а также цинк, кальций, калий, железо и витамины А и С для организма.
Вред оксида азота
Применение оксида азота у большинства людей не вызывает побочных эффектов, однако, в случаях передозировки он приводит к диарее, слабости, тошноте, головной боли, учащению пульса и сердцебиения, задержкам воды, усталости, раздражениям на коже и сухости во рту.
Также побочными эффектами применения оксида азота являются проблемы с дыханием, сильная аллергия или сыпь, крапивница, зуд, одышка, опасные для жизни осложнения астмы, внезапный озноб, потливость, тремор, рвота и обмороки. В некоторых случаях применение оксида азота приводит к вспышкам герпеса, расширению сосудов и кровотечениям.
Влияние оксида азота на организм человека
Для человеческого организма оксиды азота еще более вредны, чем угарный газ. Общий характер воздействия меняется в зависимости от содержания различных оксидов азота: NO2, N2O3, N2O4. Наибольшую опасность представляет NO2. Воздействие оксидов азота на человека приводит к нарушения функций легких и бронхов.
Воздействию оксидов азота в большей степени дети и взрослые, страдающие сердечно — сосудистыми заболеваниями. В воздухе оксиды азота в зависимости от концентрации вызывают: раздражения слизистых оболочек носа и глаз С = 0,001 об. % , начало кислородного голодания С = 0,001 об. % , отек легких С = 0,008 об. %.
При контакте диоксида азота с влажной поверхностью (слизистые оболочки глаз, носа, бронхов) образуются азотная и азотистая кислоты, раздражающие слизистые оболочки и поражающие альвеолярную ткань легких. При высоких концентрациях оксидов азота (0,004 — 0,008 %) возникают астматические проявления и отек легких. Вдыхая воздух, содержащий оксиды азота в высоких концентрациях, человек не имеет неприятных ощущений и не предполагает отрицательных последствий.
При длительном воздействии оксидов азота в концентрациях, превышающих норму, люди заболевают хроническим бронхитом, воспалением слизистой желудочно-кишечного тракта, страдают сердечной слабостью, а также нервными расстройствами. NO2 тяжелее воздуха, поэтому собирается в углублениях, канавах и представляет большую опасность при техническом обслуживании транспортных средств.
Оксиды азота ответственны за возникновение смога и кислотных дождей. Смог вызывает затруднение дыхания, кашель у детей и способствует развитию болезней органов дыхания. Особенно страдают от смога астматики и дети.
Ощущение запаха и незначительного раздражения во рту отмечается при концентрации NO2 порядка 0,0002 мг/л. Вредное воздействие оказывают оксиды азота и на нервную систему человека. Содержание в атмосферном воздухе оксидов азота свыше 0,28 мг/м3 приводит к повреждению некоторых видов растений вызывает затруднение дыхания, кашель у детей и способствует развитию болезней органов дыхания.
Вторичная реакция на воздействие оксидов азота проявляется в образовании в человеческом организме нитритов и всасывании их в кровь. Это вызывает превращение гемоглобина в метагемоглобин, что приводит к нарушению сердечной деятельности.
Оксиды азота оказывают отрицательное воздействие и на растительность, образуя на листовых пластинах растворы азотной и азотистой кислот. Этим же свойством обусловлено влияние оксидов азота на строительные материалы и металлические конструкции. Кроме того, они участвуют в фотохимической реакции образования смога. В уходящих газах дизелей концентрации СО и NOx могут достигать 0,5 % (по объему).
Влияние оксида азота на окружающую среду
Оксид азота является естественным компонентом атмосферы. Однако интенсивное использование искусственных азотных удобрений и сжигание ископаемого топлива в двигателях внутреннего сгорания составляет большую часть антропогенных выбросов оксида азота. На него приходится около 6% глобального потепления. Если общее ежегодное выделение оксидов азота в мире оценивалось в 1967 г. в 53 млн. т, то уже в 1995 г. оно составило 130 млн. т.
Парниковая активность закиси азота в 298 раз выше, чем у углекислого газа. Все оксиды азота физиологически активны, относятся к третьему классу опасности. Оксид азота N2O обладает наркозным эффектом. Оксид азота NO — сильный яд, оказывающий влияние на центральную нервную систему, а также вызывающий поражение крови за счёт связывания гемоглобина. Относительно высокой токсичностью (при концентрации выше 0,05 мг/л) обладает и оксид азота NO2. Он раздражает дыхательные пути и угнетает аэробное окисление в легочной ткани, что приводит к развитию токсического отёка легких. Для болеющих астмой и аналогичных больных повышается риск отрицательных легочных эффектов при содержании диоксида азота значительно меньшем, чем тот, на который не наблюдается реакция у здоровых людей. Оксиды азота могут отрицательно влиять на здоровье сами по себе и в комбинации с другими загрязняющими веществами.
Оксиды азота занимают второе место после диоксида серы по вкладу в увеличение кислотности осадков. В дополнение к косвенному воздействию (кислотный дождь), длительное воздействие диоксида азота в концентрации 470-1880 мкг/м3 может подавлять рост некоторых растений (например, томатов). Значимость атмосферных эффектов оксидов азота связана с ухудшением видимости. Диоксид азота играет важную роль в образовании фотохимического смога.
Читайте также:
Оцените статью:
[Всего голосов: 1 Средний: 5/5]ekobalans.ru
Оксид азота (I, II, III, IV, V): свойства, получение, применение
Введение
Если внимательно взглянуть на азот в периодической системе химических элементов Д. И. Менделеева, то можно заметить, что он имеет переменную валентность. Это значит, что азот образует сразу несколько бинарных соединений с кислородом. Некоторые из них были открыты недавно, а некоторые — изучены вдоль и поперек. Существуют малостабильные и устойчивые оксиды азота. Химические свойства каждого из этих веществ совершенно разные, поэтому при их изучении нужно рассматривать как минимум пять оксидов азота. Вот о них и пойдет речь в сегодняшней статье.
Оксид азота (I)
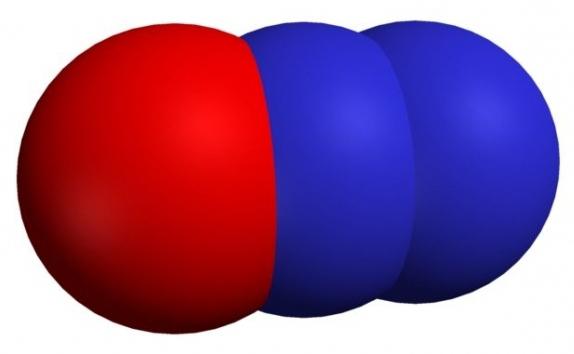 Формула — N2O. Иногда его могут называть оксонитридом азота, оксидом диазота, закисью азота или веселящим газом.
Формула — N2O. Иногда его могут называть оксонитридом азота, оксидом диазота, закисью азота или веселящим газом.Свойства
В обычных условиях представлен бесцветным газом, имеющим сладковатый запах. Его могут растворять вода, этанол, эфир и серная кислота. Если газобразный оксид одновалентного азота нагреть до комнатной температуры под давлением 40 атмосфер, то он сгущается до бесцветной жидкости. Это несолеобразующий оксид, разлагающийся во время нагревания и показывающий себя в реакциях как восстановитель.
Получение
Этот оксид образуется, когда нагревают сухой нитрат аммония. Другой способ его получения — термическое разложение смеси «сульфаминовая + азотная кислота».
Применение
Используется в качестве средства для ингаляционного наркоза, пищевая промышленность знает этот оксид как добавку E942. С его помощью также улучшают технические характеристики двигателей внутреннего сгорания.
Оксид азота (II)
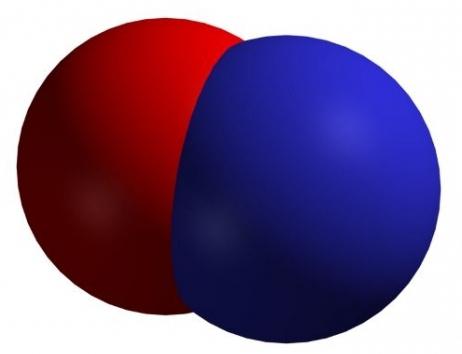 Формула — NO. Встречается под названиями монооксида азота, окиси азота и нитрозил-радикала
Формула — NO. Встречается под названиями монооксида азота, окиси азота и нитрозил-радикалаСвойства
При нормальных условиях имеет вид бесцветного газа, который плохо растворяется в воде. Его трудно сжижить, однако в твердом и жидком состояниях это вещество имеет голубой цвет. Данный оксид может окисляться кислородом воздуха
Получение
Его довольно просто получить, для этого нужно нагреть до 1200-1300оС смесь азота и кислорода. В лабораторных условиях он образуется сразу при нескольким опытах:
- Реакция меди и 30%-ного раствора азотной кислоты.
- Взаимодействие хлорида железа, нитрита натрия и соляной кислоты.
- Реакция азотистой и иодоводородной кислот.
Применение
Это одно из веществ, из которых получают азотную кислоту.
Оксид азота (III)
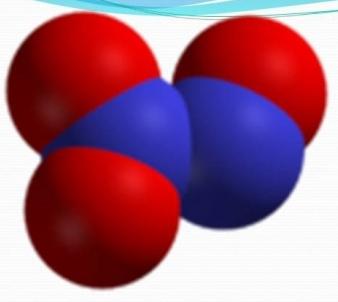 Формула — N2O3. Также его могут называть азотистым ангидридом и сесквиоксидом азота.
Формула — N2O3. Также его могут называть азотистым ангидридом и сесквиоксидом азота.Свойства
В нормальных условиях является жидкостью, которая имеет синий цвет, а в стандартных — бесцветным газом. Чистый оксид существует только в твердом агрегатном состоянии.
Получение
Образуется при взаимодействии 50%-ной азотной кислоты и твердого оксида трехвалентного мышьяка (его также можно заменить крахмалом).
Применение
С помощью этого вещества в лабораториях получают азотистую кислоту и ее соли.
Оксид азота (IV)
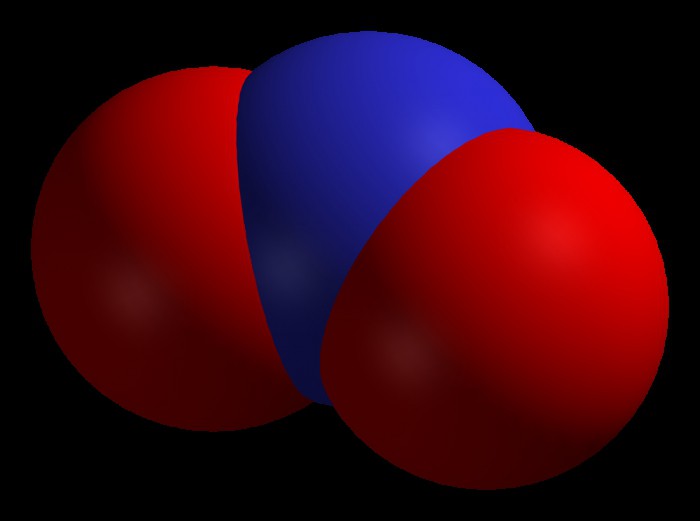 Формула — NO2. Также его могут называть диоксидом азота или бурым газом.
Формула — NO2. Также его могут называть диоксидом азота или бурым газом.Свойства
Последнее название соответствует одному из его свойств. Ведь этот оксид имеет вид или красно-бурого газа или желтоватой жидкости. Ему присуща высокая химическая активность.
Получение
Данный оксид получают при взаимодействии азотной кислоты и меди, а также во время термического разложения нитрата свинца.
Применение
С помощью него производят серную и азотную кислоты, окисляют жидкое ракетное топливо и смесевые взрывчатые вещества.
Оксид азота (V)
 Формула — N2O5. Может встречаться под названиями пентаоксида диазота, нитрата нитроила или азотного ангидрида.
Формула — N2O5. Может встречаться под названиями пентаоксида диазота, нитрата нитроила или азотного ангидрида.Свойства
Имеет вид бецветных и очень летучих кристаллов. Они могут плавиться при температуре 32,3оС.
Получение
Этот оксид образуется при нескольких реакциях:
- Дегидрация азотной кислоты оксидом пятивалентного фосфора.
- Пропускание сухого хлора над нитратом серебра.
- Взаимодействие озона с оксидом четырехвалентного азота.
Применение
Из-за своей крайней неустойчивости в чистом виде нигде не используется.
Заключение
В химии существует девять оксидов азота, приведенные выше являются только классическими соединениями этого элемента. Остальные четыре — это, как уже было сказано, нестабильные вещества. Однако их все объединяет одно свойство — высокая токсичность. Выбросы оксидов азота в атмосферу приводят к ухудшению состояния здоровья живущих поблизости от промышленных химических предприятий людей. Симптомы отравления каким-либо из этих веществ — токсический отек легких, нарушение работы центральной нервной системы и поражение крови, причина которого — связывание гемоглобина. Поэтому с оксидами азота необходимо осторожно обращаться и в большинстве случаев использовать средства защиты.
fb.ru
Оксид азота (IV) (диоксид азота), свойства, получение, химические реакции
Оксид азота (IV) (диоксид азота), свойства, получение, химические реакции.
Оксид азота (IV) (диоксид азота) – неорганическое вещество, имеет химическую формулу NO2.
Краткая характеристика оксида азота (IV)
Физические свойства оксида азота (IV)
Получение оксида азота (IV)
Химические свойства оксида азота (IV)
Химические реакции оксида азота (IV)
Применение и использование оксида азота (IV)
Краткая характеристика оксида азота (IV):
Оксид азота (IV) – неорганическое вещество, ядовитый газ, красно-бурого цвета, с характерным острым запахом или желтоватая жидкость.
Оксид азота (IV) содержит один атом азота и два атома кислорода.
Химическая формула оксида азота (IV) NO2.
В обычном состоянии NO2 существует в равновесии со своим димером N2O4. Склонность к его образованию объясняется наличием в молекуле NO2 неспаренного электрона.
При температуре 140 °C оксид азота (IV) состоит только из молекул NO2, но очень тёмного, почти чёрного цвета.
В точке кипения NO2 – +21,1 °C представляет собой желтоватую жидкость, содержащую около 0,1 % NO2.
При температуре ниже +21°С – это бесцветная жидкость (или желтоватая из-за примеси мономера).
При температуре ниже −12 °C белые кристаллы состоят только из молекул N2O4.
Кислотный оксид.
Оксид азота (IV) высокотоксичен. Даже в небольших концентрациях он раздражает дыхательные пути, в больших концентрациях вызывает отёк лёгких.
Физические свойства оксида азота (IV):
| Наименование параметра: | Значение: |
| Химическая формула | NO2 |
| Синонимы и названия иностранном языке | nitrogen dioxide (англ.) nitrogen(IV) oxide (англ.) азота двуокись (рус.) азота диоксид (рус.) диазота тетраоксид (рус.) |
| Тип вещества | неорганическое |
| Внешний вид | красно-бурый газ или желтоватая жидкость |
| Цвет | красно-бурый, желтоватый |
| Вкус | —* |
| Запах | характерный острый запах |
| Агрегатное состояние (при 20 °C и атмосферном давлении 1 атм.) | жидкость |
| Плотность (состояние вещества – жидкость, при 0 °C), кг/м3 | 1491 |
| Плотность (состояние вещества – жидкость, при 0 °C), г/см3 | 1,491 |
| Плотность (состояние вещества – газ), кг/м3 | 2,0527 |
| Плотность (состояние вещества – газ), г/л | 2,0527 |
| Температура кипения, °C | 21,1 |
| Температура плавления, °C | -11,2 |
| Молярная масса, г/моль | 46,0055 |
Примечание:
* — нет данных.
Получение оксида азота (IV):
Оксид азота (IV) в лаборатории получают в результате следующих химических реакций:
- 1. путем воздействия концентрированной азотной кислоты на медь:
Cu + 4HNO3 → Cu(NO3)2 + 2NO2 + 2H2O.
- 2. путем термического разложения нитрата свинца:
2Pb(NO3)2 → 2PbO + 4NO2 + O2 (t = 200-470 °C).
Химические свойства оксида азота (IV). Химические реакции оксида азота (IV):
Оксид азота (IV) относится к кислотным оксидам.
Химические свойства оксида азота (IV) аналогичны свойствам кислотным оксидов других неметаллов. Однако отличается высокой химической активностью. Реагирует с неметаллами. Сильный окислитель. Поэтому для него характерны следующие химические реакции:
1. реакция оксида азота (IV) и углерода:
2NO2 + 2С → 2СO2 + N2.
В результате реакции образуются углекислый газ и азот. Углерод сгорает в оксиде азота (IV).
2. реакция оксида азота (IV) и фосфора:
10NO2 + 8P → 4P2O5 + 5N2.
В результате реакции образуются оксид фосфора (V) и азот. Фосфор сгорает в оксиде азота (IV).
3. реакция оксида азота (IV) и серы:
2S + 2NO2 → 2SO2 + N2.
В результате реакции образуются оксид серы (IV) и азот. Сера сгорает в оксиде азота (IV).
4. реакция оксида азота (IV) и фтора:
2NO2 + 2F2 → 2NO2F.
В результате реакции образуeтся фторид-диоксид азота (V).
5. реакция оксида азота (IV) и калия:
NO2 + K → KNO2.
В результате реакции образуется соль – нитрит калия.
6. реакция оксида азота (IV) и меди:
2NO2 + 4Cu → 4CuO + N2 (t = 500-600 °C).
В результате реакции образуются оксид меди и азот.
7. реакция оксида азота (IV) и висмута:
6NO2 + Bi → Bi(NO3)3 + 3NO (t = 70-110 °C).
В результате реакции образуются оксид висмута и оксида азота (II).
8. реакция оксида азота (IV) и цинка:
4NO2 + Zn → 2NO + Zn(NO3)2 (t = 500-600 °C).
В результате реакции образуются оксид азота (II) и нитрат цинка. При этом для проведения реакции используется жидкий оксид азота (IV) и цинк в виде порошка.
9. реакция оксида азота (IV) и натрия:
2NO2 + Na → NO + NaNO3.
В результате реакции образуются соль – нитрат натрия и оксид азота (II). При этом для проведения реакции используется жидкий оксид азота (IV).
10. реакция оксида азота (IV) и водорода:
2NO2 + 7H2 → 4H2O + 2NH3 (kat = Pt, Ni).
В результате реакции образуются аммиак и вода.
11. реакция оксида азота (IV) и озона:
2NO2 + O3 → N2O5 + O2 (t = -78 оС).
В результате реакции образуются оксид азота (V) и кислород.
12. реакция оксида азота (IV) с бромистым водородом (бромоводородом):
NO2 + 2HBr → NO + Br + H2O (tо).
В результате химической реакции получается оксид азота (II), бром и вода.
13. реакция оксида азота (IV) с йодоводородом:
2HI + NO2 → I2 + NO + H2O.
В результате химической реакции получается оксид азота (II), йод и вода.
14. реакция оксида азота (IV) и воды:
2NO2 + H2O → HNO3 + HNO2,
3NO2 + H2O → 2HNO3 + NO (tо).
В результате химической реакции в первом случае получается азотная кислота и азотистая кислота, во втором случае – поскольку азотистая кислота неустойчива, при растворении NO2 в тёплой воде образуются азотная кислота и оксид азота (II).
15. реакция оксида азота (IV), кислорода и воды:
4NO2 + 2H2O + O2 → 4HNO3.
В результате химической реакции получается азотная кислота.
16. реакция оксида азота (IV) и оксида калия:
K2O + 2NO2 → KNO2 + KNO3 (t = 150-200 оС).
В результате химической реакции получается нитрат калия и нитрит калия.
17. реакция оксида азота (IV) и гидроксида калия:
2NO2 + 2KOH → KNO3 + KNO2 + H2O.
В результате химической реакции получается нитрат калия, нитрит калия и вода.
18. реакция оксида азота (IV) и гидроксида натрия:
2NO2 + 2NaOH → NaNO3 + NaNO2 + H2O.
В результате химической реакции получается нитрат натрия, нитрит натрия и вода. Гидроксид натрия – разбавленный раствор.
19. реакция оксида азота (IV) и хлорида калия:
2NO2 + KCl → NOCl + KNO3.
В результате химической реакции получается хлорид нитрозила и нитрат калия. При этом для проведения реакции используется жидкий оксид азота (IV).
20. реакция оксида азота (IV) и бромида калия:
2NO2 + KBr → NOBr + KNO3.
В результате химической реакции получается бромид нитрозила и нитрат калия. При этом для проведения реакции используется жидкий оксид азота (IV).
21. реакция оксида азота (IV) и фосфористой кислоты:
H3PO3 + NO2 → H3PO4 + NO (t = 30-50 оС).
В результате химической реакции получается ортофосфорная кислота и оксид азота (II).
22. реакция термического разложения оксида азота (IV):
2NO2 → 2NO + O2 (t = 500 оС).
В результате химической реакции получается кислород и оксид азота (II).
Применение и использование оксида азота (IV):
Оксид азота (IV) используется при производстве серной и азотной кислот, а также в качестве окислителя в жидком ракетном топливе.
Примечание: © Фото //www.pexels.com, //pixabay.com




карта сайта
оксид азота (IV) реагирует кислота 1 2 3 4 5 вода
уравнение реакций соединения масса взаимодействие оксида азота (IV)
реакции с оксидом азота (IV)
Коэффициент востребованности 1 246
xn--80aaafltebbc3auk2aepkhr3ewjpa.xn--p1ai
