Характеристика химического элемента КАЛИЯ | Kratkoe.com


Характеристика химического элемента КАЛИЯ
Калий — обозначается символом K — химический элемент I группы периодической системы Менделеева;
- атомный номер 19,
- атомная масса 39,098;
Калий — серебристо-белый, очень легкий, мягкий и легкоплавкий металл.
Элемент состоит из двух стабильных изотопов — 39K (93,08%), 41K (6,91%) и одного слабо радиоактивного 40K (0,01%) с периодом полураспада 1,32·109 лет.
Элемент калий находится в четвертом периоде периодической системы, значит, все электроны располагаются на четырех энергетических уровнях. Таким образом, строение атома калия записывается так: +19К: 2ё; 8ё; 8ё; 1ё.
Исходя из строения атома, можно предсказать степень окислени С1 калия в его соединениях. Так как в химических реакциях атом калия отдает один внешний электрон, проявляя восстановительные свойства, следовательно, он приобретает степень окисления +1.


Восстановительные свойства у калия выражены сильнее, чем у натрия, но слабее, чем у рубидия, что связано с ростом радиусов от Nа к Rb.
Калий — простое вещество, для него характерна металлическая кристаллическая решетка и металлическая химическая связь, а отсюда — и все типичные для металлов свойства.
Металлические свойства у калия выражены сильнее, чем у натрия, но слабее, чем у рубидия, т.к. атом калия легче отдает электрон, чем атом натрия, но труднее, чем атом рубидия.
Металлические свойства у калия выражены сильнее, чем у кальция, т.к. один электрон атома калия легче оторвать, чем два электрона атома кальция.
Оксид калия К2O является основным оксидом и проявляет все типичные свойства основных оксидов. Взаимодействие с кислотами и кислотными оксидами.
К2O + 2НСl = 2КСl +H2O;
К2O +SO3 = К2SO4
В качестве гидроксида калию соответствует основание (щелочь) КОН, которое проявляет все характерные свойства оснований: взаимодействие с кислотами и кислотными оксидами.
КОН+НNОз = КNO3+Н2O;
2КОН+H2O5 = 2KNO3+Н2O.
Летучего водородного соединения калий не образует, а образует гидрид калия КН
В природе калий встречается только в соединениях с другими элементами, например, в морской воде, а также во многих минералах. Он очень быстро окисляется на воздухе и очень легко вступает в химические реакции, особенно с водой, образуя щёлочь. Во многих отношениях химические свойства калия очень близки к натрию, но с точки зрения биологической функции и использования их клетками живых организмов они все же отличаются.
kratkoe.com
Калий
|
Калий |
|
|---|---|
| Атомный номер |
19 |
| Внешний вид простого вещества |
Серебристо-белый мягкий металл |
| Свойства атома | |
|
Атомная масса (молярная масса) |
39,0983 а. е. м. (г/моль) |
| Радиус атома |
235 пм |
|
Энергия ионизации (первый электрон) |
|
| Электронная конфигурация |
[Ar] 4s1 |
| Химические свойства | |
| Ковалентный радиус |
203 пм |
| Радиус иона |
133 пм |
|
Электроотрицательность (по Полингу) |
0,82 |
| Электродный потенциал |
−2,92 В |
| Степени окисления |
1 |
| Термодинамические свойства простого вещества | |
| Плотность |
0,856 г/см³ |
| Молярная теплоёмкость |
29,6 Дж/(K·моль) |
| Теплопроводность | 79,0 Вт/(м·K) |
| Температура плавления |
336,8 K |
| Теплота плавления |
102,5 кДж/моль |
| Температура кипения |
1047 K |
| Теплота испарения |
2,33 кДж/моль |
| Молярный объём |
|
| Кристаллическая решётка простого вещества | |
| Структура решётки |
кубическая объёмноцентрированная |
| Параметры решётки |
5,332 Å |
| Отношение c/a | — |
| Температура Дебая |
100 K |
| K | 19 |
| 39,0983 | |
| 4s1 | |
| Калий | |
Калий — элемент главной подгруппы первой группы, четвёртого периода периодической системы химических элементов Д. И. Менделеева, с атомным номером 19. Обозначается символом K (лат. Kalium). Простое вещество калий (CAS-номер: 7440-09-7) — мягкий щелочной металл серебристо-белого цвета. В природе калий встречается только в соединениях с другими элементами, например, в морской воде, а также во многих минералах. Он очень быстро окисляется на воздухе и очень легко вступает в химические реакции, особенно с водой, образуя щёлочь. Во многих отношениях химические свойства калия очень близки к натрию, но с точки зрения биологической функции и использования их клетками живых организмов они все же отличаются. История и происхождение названия калий
Калий (точнее, его соединения) использовался с давних времён. Так, производство поташа (который применялся как моющее средство) существовало уже в XI веке. Золу, образующуюся при сжигании соломы или древесины, обрабатывали водой, а полученный раствор (щёлок) после фильтрования выпаривали. Сухой остаток, помимо карбоната калия, содержал сульфат калия K
В 1807 году английский химик Дэви электролизом твёрдого едкого кали (KOH) выделил калий и назвал его «потассий» (лат. potassium; это название до сих пор употребительно в английском, французском, испанском, португальском и польском языках). В 1809 году Л. В. Гильберт предложил название «калий» (лат. kalium, от араб. аль-кали — поташ). Это название вошло в немецкий язык, оттуда в большинство языков Северной и Восточной Европы (в том числе русский) и «победило» при выборе символа для этого элемента — K.
Присутствие в природе калия
В свободном состоянии не встречается. Калий входит в состав сильвинита KCl·NaCl, карналлита KCl·MgCl2·6H2O, каинита KCl·MgSO4·6H2O, а также присутствует в золе некоторых растений в виде карбоната K2CO3 (поташ). Калий входит в состав всех клеток (см. ниже раздел Биологическая роль).
Калий — получение калия
Калий, как и другие щелочные металлы, получают электролизом расплавленных хлоридов или щелочей. Так как хлориды имеют более высокую температуру плавления (600—650 °C), то чаще проводят электролиз расправленных щелочей с добавкой к ним соды или поташа (до 12 %). При электролизе расплавленных хлоридов на катоде выделяется расплавленный калий, а на аноде — хлор:
2Cl− − 2e− → Cl2
При электролизе щелочей на катоде также выделяется расплавленный калий, а на аноде — кислород:
4OH− − 4e− → 2H2O + O2
Вода из расплава быстро испаряется. Чтобы калий не взаимодействовал с хлором или кислородом, катод изготовляют из меди и над ним помещают медный цилиндр. Образовавшийся калий в расплавленном виде собирается в цилиндре. Анод изготовляют также в виде цилиндра из никеля (при электролизе щелочей) либо из графита (при электролизе хлоридов).
Физические свойства калия
Калий — серебристое вещество с характерным блеском на свежеобразованной поверхности. Очень лёгок и легкоплавок. Относительно хорошо растворяется в ртути, образуя амальгамы. Будучи внесённым в пламя горелки калий (а также его соединения) окрашивает пламя в характерный розово-фиолетовый цвет.
Химические свойства калия
Калий, как и другие щелочные металлы, проявляет типичные металлические свойства и очень химически активен, легко отдаёт электроны.
Является сильным восстановителем. Он настолько активно соединяется с кислородом, что образуется не оксид, а супероксид калия KO
Калий хранят под слоем керосина.
Оксиды калия и пероксиды калия
При взаимодействии калия с кислородом воздуха образуется не оксид, а пероксид и супероксид:
Оксид калия может быть получен при нагревании металла до температуры не выше 180 °C в среде, содержащей очень мало кислорода, или при нагревании смеси супероксида калия с металлическим калием:
Оксиды калия обладают ярко выраженными основными свойствами, бурно реагируют с водой, кислотами и кислотными оксидами. Практического значения они не имеют. Пероксиды представляют собой желтовато-белые порошки, которые, хорошо растворяясь в воде, образуют щёлочи и пероксид водорода:
Свойство обменивать углекислый газ на кислород используется в изолирующих противогазах и на подводных лодках. В качестве поглотителя используют эквимолярную смесь супероксида калия и пероксида натрия. Если смесь не эквимолярна, то в случае избытка пероксида натрия поглотится больше газа, чем выделится (при поглощении двух объёмов CO
В случае эквимолярной смеси (Na2O2:K2O4 = 1:1) объёмы поглощаемого и выделяемого газов будут равны (при поглощении четырёх объёмов CO2 выделяется четыре объёма O2).
Пероксиды являются сильными окислителями, поэтому их применяют для отбеливания тканей в текстильной промышленности.
Получают пероксиды прокаливанием металлов на воздухе, освобождённом от углекислого газа.
Гидроксиды калия
Гидроксид калия (или едкое кали) представляет собой твёрдые белые непрозрачные, очень гигроскопичные кристаллы, плавящиеся при температуре 360 °C. Гидроксид калия относится к щелочам. Он хорошо растворяется в воде с выделением большого количества тепла. Растворимость едкого калия при 20 °C в 100 г воды составляет 112 г.
Применение калия
- Жидкий при комнатной температуре сплав калия и натрия используется в качестве теплоносителя в замкнутых системах, например, в атомных силовых установках на быстрых нейтронах. Кроме того, широко применяются его жидкие сплавы с рубидием и цезием. Сплав состава натрий 12 %, калий 47 %, цезий 41 % обладает рекордно низкой температурой плавления −78 °C.
- Соединения калия — важнейший биогенный элемент и потому применяются в качестве удобрений.
- Соли калия широко используются в гальванотехнике, так как, несмотря на относительно высокую стоимость, они часто более растворимы, чем соответствующие соли натрия, и потому обеспечивают интенсивную работу электролитов при повышенной плотности тока.
Важные соединения
Фиолетовый цвет пламени ионов калия в пламени горелки
- Бромид калия — применяется в медицине и как успокаивающее средство для нервной системы.
- Гидроксид калия (едкое кали) — применяется в щелочных аккумуляторах и при сушке газов.
- Карбонат калия (поташ) — используется как удобрение, при варке стекла.
- Хлорид калия (сильвин, «калийная соль») — используется как удобрение.
- Нитрат калия (калийная селитра) — удобрение, компонент чёрного пороха.
- Перхлорат и хлорат калия (бертолетова соль) используются в производстве спичек, ракетных порохов, осветительных зарядов, взрывчатых веществ, в гальванотехнике.
- Дихромат калия (хромпик) — сильный окислитель, используется для приготовления «хромовой смеси» для мытья химической посуды и при обработке кожи (дубление). Также используется для очистки ацетилена на ацетиленовых заводах от аммиака, сероводорода и фосфина.
- Перманганат калия — сильный окислитель, используется как антисептическое средство в медицине и для лабораторного получения кислорода.
- Тартрат натрия-калия (сегнетова соль) в качестве пьезоэлектрика.
- Дигидрофосфат и дидейтерофосфат калия в виде монокристаллов в лазерной технике.
- Пероксид калия и супероксид калия используются для регенерации воздуха на подводных лодках и в изолирующих противогазах (поглощает углекислый газ с выделением кислорода).
- Фтороборат калия — важный флюс для пайки сталей и цветных металлов.
- Цианид калия применяется в гальванотехнике (серебрение, золочение), при добыче золота и при нитроцементации стали.
- Калий совместно с перекисью калия применяется при термохимическом разложении воды на водород и кислород (калиевый цикл «Газ де Франс», Франция).
Биологическая роль
Калий — важнейший биогенный элемент, особенно в растительном мире. При недостатке калия в почве растения развиваются очень плохо, уменьшается урожай, поэтому около 90 % добываемых солей калия используют в качестве удобрений.
Калий в организме человека
Калий содержится большей частью в клетках, до 40 раз больше чем в межклеточном пространстве. В процессе функционирования клеток избыточный калий покидает цитоплазму, поэтому для сохранения концентрации он должен нагнетаться обратно при помощи натрий-калиевого насоса.
Калий и натрий между собой функционально связаны и выполняют следующие функции:
- Создание условий для возникновения мембранного потенциала и мышечных сокращений.
- Поддержание осмотической концентрации крови.
- Поддержание кислотно-щелочного баланса.
- Нормализация водного баланса.
- Обеспечение мембранного транспорта.
- Активация различных ферментов.
- Нормализация ритма сердца.
Рекомендуемая суточная доля калия составляет для детей от 600 до 1700 миллиграмм, для взрослых от 1800 до 5000 миллиграмм. Потребность в калии зависит от общего веса тела, физической активности, физиологического состояния, и климата места проживания. Рвота, продолжительные поносы, обильное потение, использование мочегонных повышают потребность организма в калии.
Основными пищевыми источниками являются сушёные абрикосы, дыня, бобы, киви, картофель, авокадо, бананы, брокколи, печень, молоко, ореховое масло, цитрусовые, виноград. Калия достаточно много в рыбе и молочных продуктах.
Всасывание происходит в тонком кишечнике. Усвоение калия облегчает витамин В6, затрудняет — алкоголь.
При недостатке калия развивается гипокалиемия. Возникают нарушения работы сердечной и скелетной мускулатуры. Продолжительный дефицит калия может быть причиной острой невралгии.
При переизбытке калия развивается гиперкалиемия, для которой основным симптомом является язва тонкого кишечника. Настоящая гиперкалиемия может вызвать остановку сердца.
Изотопы
Природный калий состоит из трёх изотопов. Два из них стабильны: 39K (изотопная распространённость 93,258 %) и 41K (6,730 %). Третий изотоп 40K (0,0117 %) является бета-активным с периодом полураспада 1,251×109 лет. В каждом грамме природного калия в секунду распадается в среднем 32 ядра 40K, благодаря чему, например, в организме человека весом 70 кг ежесекундно происходит около 4000 радиоактивных распадов. 40K считается одним из основных источников геотермальной энергии, выделяемой в недрах Земли (мощность оценивается в 44 ТВт). В минералах, содержащих калий, постепенно накапливается 40Ar, один из продуктов распада калия-40, что позволяет измерять возраст горных пород; калий-аргоновый метод является одним из основных методов ядерной геохронологии.
Дополнительная информация
Соединения калия
Щелочные металлы
Натрий, по химическим свойствам очень схожий с калием
himsnab-spb.ru
Калий — Википедия
| Внешний вид простого вещества | |
|---|---|
| Серебристо-белый мягкий металл | |
| Свойства атома | |
| Название, символ, номер | Калий / Kalium (K), 19 |
| Атомная масса (молярная масса) | 39,0983(1)[1] а. е. м. (г/моль) |
| Электронная конфигурация | [Ar] 4s1 |
| Радиус атома | 235 пм |
| Химические свойства | |
| Ковалентный радиус | 203 пм |
| Радиус иона | 133 пм |
| Электроотрицательность | 0,82 (шкала Полинга) |
| Электродный потенциал | −2,92 В |
| Степени окисления | 0; +1 |
| Энергия ионизации (первый электрон) | 418,5 (4,34) кДж/моль (эВ) |
| Термодинамические свойства простого вещества | |
| Плотность (при н. у.) | 0,856 г/см³ |
| Температура плавления | 336,8К; 63,65 °C |
| Температура кипения | 1047К; 773,85 °C |
| Уд. теплота плавления | 2,33 кДж/моль |
| Уд. теплота испарения | 76,9 кДж/моль |
| Молярная теплоёмкость | 29,6[2] Дж/(K·моль) |
| Молярный объём | 45,3 см³/моль |
| Кристаллическая решётка простого вещества | |
| Структура решётки | кубическая объёмно-центрированная |
| Параметры решётки | 5,332 Å |
| Температура Дебая | 100 K |
| Прочие характеристики | |
| Теплопроводность | (300 K) 79,0 Вт/(м·К) |
| Номер CAS | 7440-09-7 |
| Эмиссионный спектр | |
Ка́лий — элемент первой группы (по старой классификации — главной подгруппы первой группы), четвёртого периода периодической системы химических элементов Д. И. Менделеева, с атомным номером 19. Обозначается символом K (лат. Kalium). Простое вещество калий — мягкий щелочной металл серебристо-белого цвета.
В природе калий встречается только в соединениях с другими элементами, например, в морской воде, а также во многих минералах. Очень быстро окисляется на воздухе и очень легко вступает в химические реакции, особенно с водой, образуя щёлочь.
Во многих свойствах калий очень близок натрию, но с точки зрения биологической функции и использования клетками живых организмов они антагонистичны.
История и происхождение названия
Соединения калия используются с древнейших времён. Так, производство поташа (который применялся как моющее средство) существовало уже в XI веке. Золу, образующуюся при сжигании соломы или древесины, обрабатывали водой, а полученный раствор (щёлок) после фильтрования выпаривали. Сухой остаток, помимо карбоната калия, содержал сульфат калия K2SO4, соду и хлорид калия KCl.
19 ноября 1807 года в Бейкеровской лекции английский химик Дэви сообщил о выделении калия электролизом расплава едкого кали (KOH)[3](в рукописи лекции Дэви указал, что он открыл калий 6 октября 1807 года[4]) и назвал его «потасий» (лат. potasium[3]:32; это название (правда, в некоторых языках с двумя буквами s) до сих пор употребительно в английском, французском, испанском, португальском и польском языках). В 1809 году Л. В. Гильберт предложил название «калий» (лат. kalium, от араб. аль-кали — поташ). Это название вошло в немецкий язык, оттуда в большинство языков Северной и Восточной Европы (в том числе русский) и «победило» при выборе символа для этого элемента — K.
Нахождение в природе
В свободном состоянии не встречается. Породообразующий элемент, входит в состав слюд, полевых шпатов и т. д. Также калий входит в состав сильвина KCl, сильвинита KCl·NaCl, карналлита KCl·MgCl2·6H2O, каинита KCl·MgSO4·6H2O, а также присутствует в золе некоторых растений в виде карбоната K2CO3 (поташ). Калий входит в состав всех клеток (см. ниже раздел Биологическая роль). Кларк калия в земной коре составляет 2,4 % (5-й по распространённости металл, 7-й по содержанию в коре элемент). Концентрация в морской воде — 380 мг/л[5].
Месторождения
Крупнейшие месторождения калия находятся на территории Канады (производитель PotashCorp), России (ПАО «Уралкалий», г. Березники, г. Соликамск, Пермский край, Верхнекамское месторождение калийных руд[6]), Белоруссии (ПО «Беларуськалий», г. Солигорск, Старобинское месторождение калийных руд[7]).
Получение
Калий, как и другие щелочные металлы, получают электролизом расплавленных хлоридов или щелочей. Так как хлориды имеют более высокую температуру плавления (600—650 °C), то чаще проводят электролиз расплавленных щелочей с добавкой к ним соды или поташа (до 12 %). При электролизе расплавленных хлоридов на катоде выделяется расплавленный калий, а на аноде — хлор:
- K++e−→K{\displaystyle {\mathsf {K^{+}+e^{-}\rightarrow K}}}
- 2Cl−→Cl2{\displaystyle {\mathsf {2Cl^{-}\rightarrow Cl_{2}}}}
При электролизе щелочей на катоде также выделяется расплавленный калий, а на аноде — кислород:
- 4OH−→2h3O+O2{\displaystyle {\mathsf {4OH^{-}\rightarrow 2H_{2}O+O_{2}}}}
Вода из расплава быстро испаряется. Чтобы калий не взаимодействовал с хлором или кислородом, катод изготовляют из меди и над ним помещают медный цилиндр. Образовавшийся калий в расплавленном виде собирается в цилиндре. Анод изготовляют также в виде цилиндра из никеля (при электролизе щелочей) либо из графита (при электролизе хлоридов).
Важное промышленное значение имеют и методы термохимического восстановления:
- Na+KOH→N2380−450oCNaOH+K{\displaystyle {\mathsf {Na+KOH{\xrightarrow[{N_{2}}]{380-450^{o}C}}NaOH+K}}}
и восстановление из расплава хлорида калия карбидом кальция, алюминием или кремнием.[8][9]
Физические свойства
Калий под слоем ТГФКалий — серебристый металл с характерным блеском на свежеобразованной поверхности. Очень лёгок и легкоплавок. Относительно хорошо растворяется в ртути, образуя амальгамы. Будучи внесённым в пламя горелки, калий (а также его соединения) окрашивает пламя в характерный розово-фиолетовый цвет[10].
Калий активно взаимодействует с водой. Выделяющийся водород воспламеняется, а ионы калия придают пламени фиолетовый цвет. Раствор фенолфталеина в воде становится малиновым, демонстрируя щелочную реакцию образующегося KOH.Калий образует кристаллы кубической сингонии, пространственная группа I m3m, параметры ячейки a = 0,5247 нм, Z = 2.
Химические свойства
Элементарный калий, как и другие щелочные металлы, проявляет типичные металлические свойства и очень химически активен, является сильным восстановителем. На воздухе свежий срез быстро тускнеет из-за образования плёнок соединений (оксиды и карбонат). При длительном контакте с атмосферой способен полностью разрушиться. С водой реагирует со взрывом. Хранить его необходимо под слоем бензина, керосина или силикона, дабы исключить контакт воздуха и воды с его поверхностью. С Na, Tl, Sn, Pb, Bi калий образует интерметаллиды.
Взаимодействие с простыми веществами
Калий при комнатной температуре реагирует с кислородом воздуха, галогенами; практически не реагирует с азотом (в отличие от лития и натрия). При умеренном нагревании реагирует с водородом с образованием гидрида (200—350 °C):
- 2K+h3⟶2KH{\displaystyle {\mathsf {2K+H_{2}\longrightarrow 2KH}}}
с халькогенами (100—200 °C, E = S, Se, Te):
- 2K+E⟶K2E{\displaystyle {\mathsf {2K+E\longrightarrow K_{2}E}}}
При сгорании калия на воздухе образуется надпероксид калия KO2 (с примесью K2O2):
- K+O2⟶KO2{\displaystyle {\mathsf {K+O_{2}\longrightarrow KO_{2}}}}
В реакции с фосфором в инертной атмосфере образуется фосфид зелёного цвета (200 °C):
- 3K+P⟶K3P{\displaystyle {\mathsf {3K+P\longrightarrow K_{3}P}}}
Взаимодействие со сложными веществами
Калий при комнатной температуре (20*С) активно реагирует с водой, кислотами, растворяется в жидком аммиаке (−50 °C) с образованием тёмно-синего раствора.
- 2K+2h3O⟶2KOH+h3↑{\displaystyle {\mathsf {2K+2H_{2}O\longrightarrow 2KOH+H_{2}\uparrow }}}
- 2K+2HCl⟶2KCl+h3↑{\displaystyle {\mathsf {2K+2HCl\longrightarrow 2KCl+H_{2}\uparrow }}}
- K+6Nh4⟶[K(Nh4)]6{\displaystyle {\mathsf {K+6NH_{3}\longrightarrow [K(NH_{3})]_{6}}}}
Калий глубоко восстанавливает разбавленные серную и азотную кислоты:
- 8K+6h3SO4⟶4K2SO4+SO2↑+S↓+6h3O{\displaystyle {\mathsf {8K+6H_{2}SO_{4}\longrightarrow 4K_{2}SO_{4}+SO_{2}\uparrow +S\downarrow +6H_{2}O}}}
- 21K+26HNO3⟶21KNO3+NO↑+N2O↑+N2↑+13h3O{\displaystyle {\mathsf {21K+26HNO_{3}\longrightarrow 21KNO_{3}+NO\uparrow +N_{2}O\uparrow +N_{2}\uparrow +13H_{2}O}}}
При сплавлении металлического калия со щелочами он восстанавливает водород гидроксогруппы:
- 2K+2KOH⟶2K2O+h3↑(450∘C){\displaystyle {\mathsf {2K+2KOH\longrightarrow 2K_{2}O+H_{2}\uparrow (450^{\circ }C)}}}
При умеренном нагревании реагирует с газообразным аммиаком с образованием амида (65—105 °C):
- 2K+2Nh4⟶2KNh3+h3{\displaystyle {\mathsf {2K+2NH_{3}\longrightarrow 2KNH_{2}+H_{2}}}}
Металлический калий реагирует со спиртами с образованием алкоголятов:
- 2K+2C2H5OH⟶2C2H5OK+h3↑{\displaystyle {\mathsf {2K+2C_{2}H_{5}OH\longrightarrow 2C_{2}H_{5}OK+H_{2}\uparrow }}}
Алкоголяты щелочных металлов (в данном случае − этанолат калия) являются очень сильными основаниями и широко используются в органическом синтезе.
Соединения с кислородом
При взаимодействии калия с кислородом воздуха образуется не оксид, а пероксид и супероксид:
- K+O2⟶KO2{\displaystyle {\mathsf {K+O_{2}\longrightarrow KO_{2}}}}
Оксид калия может быть получен при нагревании металла до температуры не выше 180 °C в среде, содержащей очень мало кислорода, или при нагревании смеси супероксида калия с металлическим калием:
- KO2+3K⟶2K2O{\displaystyle {\mathsf {KO_{2}+3K\longrightarrow 2K_{2}O}}}
Оксиды калия обладают ярко выраженными основными свойствами, бурно реагируют с водой, кислотами и кислотными оксидами. Практического значения они не имеют. Пероксиды представляют собой желтовато-белые порошки, которые, хорошо растворяясь в воде, образуют щёлочи и пероксид водорода:
- K2O2+2h3O⟶2KOH+h3O2{\displaystyle {\mathsf {K_{2}O_{2}+2H_{2}O\longrightarrow 2KOH+H_{2}O_{2}}}}
- 4KO2+2h3O⟶4KOH+3O2↑{\displaystyle {\mathsf {4KO_{2}+2H_{2}O\longrightarrow 4KOH+3O_{2}\uparrow }}}
- 4KO2+2CO2⟶2K2CO3+3O2↑{\displaystyle {\mathsf {4KO_{2}+2CO_{2}\longrightarrow 2K_{2}CO_{3}+3O_{2}\uparrow }}}
Свойство обменивать углекислый газ на кислород используется в изолирующих противогазах и на подводных лодках. В качестве поглотителя используют эквимолярную смесь супероксида калия и пероксида натрия. Если смесь не эквимолярна, то в случае избытка пероксида натрия поглотится больше газа, чем выделится (при поглощении двух объёмов CO2 выделяется один объём O2), и давление в замкнутом пространстве упадёт, а в случае избытка супероксида калия (при поглощении двух объёмов CO2 выделяется три объёма O2) выделяется больше газа, чем поглотится, и давление повысится.
В случае эквимолярной смеси (Na2O2:K2O4 = 1:1) объёмы поглощаемого и выделяемого газов будут равны (при поглощении четырёх объёмов CO2 выделяется четыре объёма O2).
Пероксиды являются сильными окислителями, поэтому их применяют для отбеливания тканей в текстильной промышленности.
Получают пероксиды прокаливанием металлов на воздухе, освобождённом от углекислого газа.
Также известен озонид калия KO3, оранжево-красного цвета. Получить его можно взаимодействием гидроксида калия с озоном при температуре не выше 20 °C:
- 4KOH+4O3⟶4KO3+O2+2h3O{\displaystyle {\mathsf {4KOH+4O_{3}\longrightarrow 4KO_{3}+O_{2}+2H_{2}O}}}
Озонид калия является очень сильным окислителем, например, окисляет элементарную серу до сульфата и дисульфата уже при 50 °C:
- 6KO3+5S⟶K2SO4+2K2S2O7{\displaystyle {\mathsf {6KO_{3}+5S\longrightarrow K_{2}SO_{4}+2K_{2}S_{2}O_{7}}}}
Гидроксид
Гидроксид калия (или едкое кали) представляет собой твёрдые белые непрозрачные, очень гигроскопичные кристаллы, плавящиеся при температуре 360 °C. Гидроксид калия относится к щелочам. Он хорошо растворяется в воде с выделением большого количества тепла. Растворимость едкого кали при 20 °C в 100 г воды составляет 112 г.
Применение
- Жидкий при комнатной температуре сплав калия и натрия используется в качестве теплоносителя в замкнутых системах, например, в атомных силовых установках на быстрых нейтронах. Кроме того, широко применяются его жидкие сплавы с рубидием и цезием. Сплав состава: натрий 12 %, калий 47 %, цезий 41 % — обладает рекордно низкой температурой плавления −78 °C.
- Соединения калия — важнейший биогенный элемент и потому применяются в качестве удобрений. Калий является одним из трех базовых элементов, которые необходимы для роста растений наряду с азотом и фосфором. В отличие от азота и фосфора, калий является основным клеточным катионом. При его недостатке у растения прежде всего нарушается структура мембран хлоропластов — клеточных органелл, в которых проходит фотосинтез. Внешне это проявляется в пожелтении и последующем отмирании листьев. При внесении калийных удобрений у растений увеличивается вегетативная масса, урожайность и устойчивость к вредителям.
- Соли калия широко используются в гальванотехнике, так как, несмотря на относительно высокую стоимость, они часто более растворимы, чем соответствующие соли натрия, и потому обеспечивают интенсивную работу электролитов при повышенной плотности тока.
Важные соединения
- Бромид калия применяется в медицине и как успокаивающее средство для нервной системы.
- Гидроксид калия (едкое кали) применяется в щелочных аккумуляторах и при сушке газов.
- Карбонат калия (поташ) используется как удобрение, при варке стекла, как кормовая добавка для птицы.
- Хлорид калия (сильвин, «калийная соль») используется как удобрение.
- Нитрат калия (калийная селитра) — удобрение, компонент чёрного пороха.
- Перхлорат и хлорат калия (бертолетова соль) используются в производстве спичек, ракетных порохов, осветительных зарядов, взрывчатых веществ, в гальванотехнике.
- Дихромат калия (хромпик) — сильный окислитель, используется для приготовления «хромовой смеси» для мытья химической посуды и при обработке кожи (дубление). Также используется для очистки ацетилена на ацетиленовых заводах от аммиака, сероводорода и фосфина.
Биологическая роль
Калий — важнейший биогенный элемент, особенно в растительном мире. При недостатке калия в почве растения развиваются очень плохо, уменьшается урожай, поэтому около 90 % добываемых солей калия используют в качестве удобрений.
Калий в организме человека
Калий содержится большей частью в клетках, до 40 раз больше, чем в межклеточном пространстве. В процессе функционирования клеток избыточный калий покидает цитоплазму, поэтому для сохранения концентрации он должен нагнетаться обратно при помощи натрий-калиевого насоса. Калий и натрий между собой функционально связаны и выполняют следующие функции:
Рекомендуемая суточная доля калия составляет для детей от 600 до 1700 миллиграммов, для взрослых — от 1800 до 5000 миллиграммов. Потребность в калии зависит от массы тела, физической активности, физиологического состояния, и климата места проживания. Рвота, продолжительные поносы, обильное потение, использование мочегонных повышают потребность организма в калии.
Основными пищевыми источниками являются бобы (в первую очередь белая фасоль), шпинат и капуста кормовая, финики, картофель, батат, сушёные абрикосы, дыня, киви, авокадо, помело, бананы, брокколи, печень, молоко, ореховое масло, цитрусовые, виноград. Калия достаточно много в рыбе и молочных продуктах.
Практически все сорта рыбы содержат более 200 мг калия в 100 г. Количество калия в разных видах рыбы различается. Овощи, грибы и травы также содержат много калия, однако в консервированных продуктах его уровень может быть гораздо меньше. Много калия содержится в шоколаде.
Всасывание происходит в тонком кишечнике. Усвоение калия облегчает витамин B6, затрудняет — алкоголь.
При недостатке калия развивается гипокалиемия. Возникают нарушения работы сердечной и скелетной мускулатуры. Продолжительный дефицит калия может быть причиной острой невралгии.
При избытке калия развивается гиперкалиемия, для которой основным симптомом является язва тонкого кишечника. Настоящая гиперкалиемия может вызвать остановку сердца.
Изотопы
Природный калий состоит из трёх изотопов. Два из них стабильны: 39K (изотопная распространённость 93,258 %) и 41K (6,730 %). Третий изотоп 40K (0,0117 %) является бета-активным с периодом полураспада 1,251·109 лет. В каждом грамме природного калия в секунду распадается в среднем 31,0±0,3 ядра 40K, благодаря чему, например, в организме человека массой 70 кг ежесекундно происходит около 4000 радиоактивных распадов. Поэтому легкодоступные в быту соединения калия (поташ, хлорид калия, калийная селитра и т. д.) можно использовать как пробные радиоактивные источники для проверки бытовых дозиметров. 40K наряду с ураном и торием считается одним из основных источников геотермальной энергии, выделяемой в недрах Земли (полная скорость энерговыделения оценивается в 40—44 ТВт). В минералах, содержащих калий, постепенно накапливается 40Ar, один из продуктов распада калия-40, что позволяет измерять возраст горных пород; калий-аргоновый метод является одним из основных методов ядерной геохронологии.
Один из искусственных изотопов — 37K, — с временем полураспада 1,23651 с, применяется в экспериментах по изучению Стандартной модели слабого взаимодействия[11].
См. также
Примечания
- ↑ Michael E. Wieser, Norman Holden, Tyler B. Coplen, John K. Böhlke, Michael Berglund, Willi A. Brand, Paul De Bièvre, Manfred Gröning, Robert D. Loss, Juris Meija, Takafumi Hirata, Thomas Prohaska, Ronny Schoenberg, Glenda O’Connor, Thomas Walczyk, Shige Yoneda, Xiang‑Kun Zhu. Atomic weights of the elements 2011 (IUPAC Technical Report) (англ.) // Pure and Applied Chemistry. — 2013. — Vol. 85, no. 5. — P. 1047-1078. — DOI:10.1351/PAC-REP-13-03-02.
- ↑ Химическая энциклопедия: в 5 т / Редкол.: Кнунянц И. Л. (гл. ред.). — М.: Советская энциклопедия, 1990. — Т. 2. — С. 284. — 671 с. — 100 000 экз.
- ↑ 1 2 Davy, H. (1808). «The Bakerian Lecture, on some new Phenomena of chemical Changes produced by Electricity particularly the Decomposition of the fixed Alkalies, and the Exhibition of the new substances which constitute their bases; and on the general Nature of alkaline Bodies». Philosophical Transactions 98: 1-44.
- ↑ Davy, John. The Collected Works of Sir Humphry Davy. — London : Smith, Elder, and Company, 1839. — Vol. I. — P. 109.
- ↑ J. P. Riley and Skirrow G. Chemical Oceanography V. 1, 1965
- ↑ КАЛИЙНОЕ МЕСТОРОЖДЕНИЕ
- ↑ Химическое и агрохимическое сырье.
- ↑ А. Ф. Алабышев, К. Д Грачев, С. А. Зарецкий, М. Ф. Лантратов, Натрий и калий (получение, свойства, применение), Л: Гос. н-т. изд-во хим. лит., 1959, С. 321.
- ↑ Хим.энциклопедия, т.2, М.: Сов. энциклопедия, 1990, С.562.
- ↑ Элементы: проба на окрашивание пламени (рус.). Проверено 26 января 2010. Архивировано 22 августа 2011 года.
- ↑ P. D. Shidling et al. Precision half-life measurement of the β+ decay of 37K (англ.) // Physical Review C. — 2014. — Vol. 90. — P. 032501. — DOI:10.1103/PhysRevC.90.032501. — arXiv:1407.1742.
Литература
- Пилипенко А. Т. Натрий и калий // Справочник по элементарной химии. — 2-е изд. — Киев: Наукова думка, 1978. — С. 316—319.
- Дроздов А. Яростные металлы // Энциклопедия для детей. Химия. — М.: Аванта +, 2002. — С. 184—187. — ISBN 5-8483-0027-5.
- Ахметов Н. С. Общая и неорганическая химия. — М.: Высшая школа, 2001.
- Некрасов Б. В. Основы общей химии. — М.: Химия, 1974.
- Спицын В. И., Мартыненко Л. И. Неорганическая химия. — М.: МГУ, 1991, 1994.
- Лидин Р. А. и др. Элементы IA-группы. Калий // Химические свойства неорганических веществ: Уч. пособие для вузов. — 4-е изд. — М.: КолосС, 2003. — С. 29—40. — ISBN 5-9532-0095-1.
Ссылки
Eu, Sm, Li, Cs, Rb, K, Ra, Ba, Sr, Ca, Na, Ac, La, Ce, Pr, Nd, Pm, Gd, Tb, Mg, Y, Dy, Am, Ho, Er, Tm, Lu, Sc, Pu, | |
| |||||||
wikipedia.green
Характеристика, описание и строение калия
Калием называется элемент, находящийся в периодической системе Менделеева под 19-ым номером. Вещество принято обозначать заглавной буквой К (от латинского Kalium). В русской химической номенклатуре настоящее название элемента появилось благодаря Г.И. Гессу в 1831 году. Изначально калий называли «аль-кали», что в переводе с арабского означает «зола растений». Именно едкий кали стал материалом для самого первого получения вещества. Едкий кали, в свою очередь, добывался из поташа, который являлся продуктами горения растений (карбонат калия). Его первооткрывателем стал Х. Дэви. Стоит отметить, что карбонат калия является прототипом современного моющего средства. Позже он использовался для удобрений, используемых в сельском хозяйстве, в производстве стекла и других целей. В настоящее поташ – это пищевая добавка, прошедшая официальную регистрацию, а калий научились добывать совершенно другими путями.
В природе калий можно обнаружить только в виде соединений с другими элементами (например, морская вода, или минералы), свободный его вид не встречается вообще. Он способен в достаточно короткий промежуток времени окисляться на открытом воздухе, а также вступать в химические реакции (например, при взаимодействии калия с водой, образуется щелочь).
| Страна, часть света | Запасы общие | Запасы подтвержденные | Их % от мира | Среднее содержание |
|---|---|---|---|---|
| 1 | 2 | 3 | 4 | 5 |
| Россия | 19118 | 3658 | 31,4 | 17,8 |
| Европа | 3296 | 2178 | 18,5 | — |
| Беларусь | 1568 | 1073 | 9,1 | 16 |
| Великобритания | 30 | 23 | 0,2 | 14 |
| Германия | 1200 | 730 | 6,2 | 14 |
| Испания | 40 | 20 | 0,2 | 13 |
| Италия | 40 | 20 | 0,2 | 11 |
| Польша | 10 | 10 | 0,1 | 12 |
| Украина | 375 | 292 | 2,5 | 11 |
| Франция | 33 | 10 | 0,1 | 15 |
| Азия | 2780 | 1263 | 10,8 | – |
| Израиль | 600 | 44 | 0,4 | 1,4 |
| Иордания | 600 | 44 | 0,4 | 1,4 |
| Казахстан | 102 | 54 | 0,5 | 8 |
| Китай | 320 | 320 | 2,7 | 12 |
| Таиланд | 150 | 75 | 0,6 | 2,5 |
| Туркменистан | 850 | 633 | 5,4 | 11 |
| Узбекистан | 159 | 94 | 0,8 | 12 |
| Африка | 179 | 71 | 0,6 | – |
| Конго | 40 | 10 | 0,1 | 15 |
| Тунис | 34 | 19 | 0,2 | 1,5 |
| Эфиопия | 105 | 42 | >0,4 | 25 |
|
Америка |
14915 | 4548 | 38,7 | — |
| Аргентина | 20 | 15 | 0,1 | 12 |
| Бразилия | 160 | 50 | 0,4 | 15 |
| Канада | 14500 | 4400 | 37,5 | 23 |
| Мексика | 10 | — | 0 | 12 |
| США | 175 | 73 | 0,6 | 12 |
| Чили | 50 | 10 | 0,1 | 3 |
| Итого: | 40288 | 11744 | 100 | — |
Описание калия
Калий в виде простого вещества представляет собой щелочной металл. Для него характерен серебристо-белый окрас. На свежей поверхности моментально появляется блеск. Калий является мягким металлом, легко поддающимся плавлению. Если вещество или его соединения поместить в пламя горелки, то огонь приобретет розово-фиолетовый цвет.
Физические свойства калия
Калий очень мягкий металл, который легко разрезать обычным ножом. Его твердость по Бринеллю составляет 400 кн/м2 (или 0,04 кгс/мм2). Он имеет объемноцентрированную кубическую кристаллическую решетку (5=5,33 А). Его плотность составляет 0,862 г/см3 (200С). Вещество начинает плавиться при температуре в 63,550С, закипать – при 7600С. Имеет коэффициент термического расширения, который равняется 8,33*10-5 (0-500С). Его удельная теплоемкость при температуре в 200С составляет 741,2 дж/(кг*К) или же 0,177 кал/(г*0С). При той же температуре имеет удельное электросопротивление, равное 7,118*10-8ом*м. Температурный коэффициент электросопротивления металла составляет 5,8*10-15.
Калий образует кристаллы кубической сингонии, пространственная группа I m3m, параметры ячейки a = 0,5247 нм, Z = 2.
Химические свойства
Калий является щелочным металлом. В связи с этим, металлические свойства калия проявляются типично, так же, как и других подобных металлов. Элемент проявляет свою сильную химическую активность, а кроме этого, также выступает в роли сильного восстановителя Как уже говорилось выше, металл активно вступает в реакцию с воздухом, о чем свидетельствует появление пленок на его поверхности, в результате чего его цвет становится тусклым. Данную реакцию можно наблюдать невооруженным глазом. Если калий на протяжении достаточно длительного времени контактирует с атмосферой, то есть вероятность его полного разрушения. При вступлении в реакцию с водой, происходит характерный взрыв. Это связано с выделяющимся водородом, который воспламеняется характерным розовато-фиолетовым пламенем. А при добавлении в воду, реагирующую с калием фенолфталеина, она приобретает малиновый цвет, который свидетельствует о щелочной реакции образующегося гидроксида калия (КОН).
При взаимодействии металла с такими элементами, как Na, Tl, Sn, Pb, Bi, образуются интерметаллиды
Указанные характеристики калия говорят о необходимости соблюдений определенных правил безопасности и условий во время хранения вещества. Так, вещество следует покрывать слоем бензина, керосина или силикона. Это делается для полного исключения его контакта с воздухом или водой.
Стоит отметить, что в условиях комнатной температуры металл вступает в реакцию с галогенами. Если его немного нагреть, то он легко взаимодействует с серой. В случае же увеличения температуры, калий способен соединяться с селеном и теллуром. Если повысить температуру более 2000С в атмосфере водорода, то образуется гидрид КН, который способен воспламеняться без посторонней помощи, т.е. самостоятельно. Калий совершенно не взаимодействует с азотом, даже если для этого создать надлежащие условия (повышенные температуру и давление). Однако, контактировать эти два вещества можно заставить, повлияв на них электрическим разрядом. В данном случае получится азид калия KN3 и нитрид калия K3N. Если нагреть вместе графит и калий, то в результате получатся карбиды KC8 (при 300 °С) и KC16 (при 360 °C).
При взаимодействии калия и спиртов получаются алкоголяты. Кроме этого, калий делает существенно быстрее процесс полимеризации олефинов и диолефинов. Галогеналкилы и галогенарилы вместе с девятнадцатым элементом в результате дают калийалкилы и калийарилы.
| Характеристика | Значение |
|---|---|
| Свойства атома | |
| Название, символ, номер | Калий / Kalium (K), 19 |
| Атомная масса (молярная масса) | 39,0983(1)[1] а. е. м. (г/моль) |
| Электронная конфигурация | [Ar] 4s1 |
|
Радиус атома |
235 пм |
| Химические свойства | |
| Ковалентный радиус | 203 пм |
| Радиус иона | 133 пм |
| Электроотрицательность | 0,82 (шкала Полинга) |
| Электродный потенциал | −2,92 В |
| Степени окисления | 0; +1 |
|
Энергия ионизации (первый электрон) |
418,5 (4,34) кДж/моль (эВ) |
| Термодинамические свойства простого вещества | |
| Плотность (при н. у.) | 0,856 г/см³ |
| Температура плавления | 336,8К; 63,65 °C |
| Температура кипения | 1047К; 773,85 °C |
| Уд. теплота плавления | 2,33 кДж/моль |
| Уд. теплота испарения | 76,9 кДж/моль |
| Молярная теплоёмкость | 29,6[2] Дж/(K·моль) |
| Молярный объём | 45,3 см³/моль |
| Кристаллическая решётка простого вещества | |
| Структура решётки | Кубическая объёмно-центрированная |
| Параметры решётки | 5,332 Å |
| Температура Дебая | 100 K |
Электронное строение атома калия
Калий имеет положительно заряженное ядро атома (+19). В середине этого атома присутствуют 19 протонов и 19 нейтронов, которые окружаются четырьмя орбитами, где в постоянном движении находятся 19 электронов. Электроны распределены на орбиталях в следующем порядке:
1s22s22p63s23p64s1.
На внешнем энергетическом уровне атома металла находится всего 1 валентный электрон. Это объясняет тот факт, что абсолютно во всех соединениях калий имеет валентность 1. В отличие от лития и натрия, данный электрон располагается на более удаленном расстоянии от ядра атома. Это является причиной повышенной химической активностью калия, чего нельзя сказать об упомянутых двух металлах. Таким образом, внешняя электронная оболочка калия представлена следующей конфигурацией:
4s1.
Не смотря на присутствие вакантных 3p— и 3d-орбиталей, возбужденное состояние отсутствует.
mining-prom.ru
Калий — Мегаэнциклопедия Кирилла и Мефодия — статья
Калий встречается в природе в виде двух стабильных нуклидов: 39К (93, 10% по массе) и 41К (6, 88%), а также одного радиоактивного 40К (0, 02%). Период полураспада калия-40 Т1/2 примерно в 3 раза меньше, чем Т1/2 урана-238 и составляет 1, 28 миллиарда лет. При β-распаде калия-40 образуется стабильный кальций-40, а при распаде по типу электронного захвата образуется инертный газ аргон-40.Калий принадлежит к числу щелочных металлов. В периодической системе Менделеева калий занимает место в четвертом периоде в подгруппе IА. Конфигурация внешнего электронного слоя 4s1, поэтому калий всегда проявляет степень окисления +1 (валентность I).Атомный радиус калия 0, 227 нм, радиус иона K+ 0, 133 нм. Энергии последовательной ионизации атома калия 4, 34 и 31, 8 эВ. Электроотрицательность калия по Полингу 0, 82, что говорит о его ярко выраженных металлических свойствах.В свободном виде — мягкий, легкий, серебристый металл.
Соединения калия, как и его ближайшего химического аналога — натрия, были известны с древности и находили применение в различных областях человеческой деятельности. Однако сами эти металлы были впервые выделены в свободном состоянии только в 1807 году в ходе экспериментов английского ученого Г. Дэви. Дэви, используя гальванические элементы как источник электрического тока, провел электролиз расплавов поташа и каустической соды и таким образом выделил металлические калий и натрий, которые назвал «потассием» (отсюда сохранившееся в англоязычных странах и Франции название калия — potassium) и «содием». В 1809 году английский химик Л. В. Гильберт предложил название «калий» (от арабского аль-кали — поташ).Содержание калия в земной коре 2, 41% по массе, калий входит в первую десятку наиболее распространенных в земной коре элементов. Основные минералы, содержащие калий: сильвин KСl (52, 44% К), сильвинит (Na, K)Cl (этот минерал представляет собой плотно спрессованную механическую смесь кристалликов хлорида калия KCl и хлорида натрия NaCl), карналлит KCl·MgCl2·6H2O (35, 8% К), различные алюмосиликаты, содержащие калий, каинит KCl·MgSO4·3H2O, полигалит K2SO4·MgSO4·2CaSO4·2H2O, алунит KAl3(SO4)2(OH)6. В морской воде содержится около 0, 04% калия.В настоящее время калий получают при взаимодействии с жидким натрием расплавленных KOH (при 380-450°C) или KCl (при 760-890°C):
Na + KOH = NaOH + K
Калий также получают электролизом расплава KCl в смеси с K2CO3 при температурах, близких к 700°C:
2KCl = 2K + Cl2
От примесей калий очищают вакуумной дистилляцией.
Металлический калий мягок, он легко режется ножом и поддается прессованию и прокатке. Обладает кубической объемно центрированной кубической решеткой, параметр а = 0, 5344 нм. Плотность калия меньше плотности воды и равна 0, 8629 г/см3. Как и все щелочные металлы, калий легко плавится (температура плавления 63, 51°C) и начинает испаряться уже при сравнительно невысоком нагревании (температура кипения калия 761°C).
Калий, как и другие щелочные металлы, химически очень активен. Легко взаимодействует с кислородом воздуха с образованием смеси, преимущественно состоящей из пероксида К2О2 и супероксида KO2 (К2О4):
2K + O2 = K2O2, K + O2 = KO2.
При нагревании на воздухе калий сгорает фиолетово-красным пламенем. С водой и разбавленными кислотами калий взаимодействует со взрывом (воспламеняется образующийся водород):
2K + 2H2O = 2KOH + H2
Кислородсодержащие кислоты при таком взаимодействии могут восстанавливаться. Например, атом серы серной кислоты восстанавливается до S, SO2 или S2–:
8К + 4Н2SO4 = K2S + 3K2SO4 + 4H2O.
При нагревании до 200-300 °C калий реагирует с водородом с образованием солеподобного гидрида КН:
2K + H2 = 2KH
С галогенами калий взаимодействует со взрывом. Интересно отметить, что с азотом калий не взаимодействует.Как и другие щелочные металлы, калий легко растворяется в жидком аммиаке с образованием голубых растворов. В таком состоянии калий используют для проведения некоторых реакций. При хранении калий медленно реагирует с аммиаком с образованием амида KNH2:
2K + 2NH3 жидк. = 2KNH2 + H2
Важнейшие соединения калия: оксид К2О, пероксид К2О2, супероксид К2О4, гидроксид КОН, иодид KI, карбонат K2CO3 и хлорид KCl.
Оксид калия К2О, как правило, получают косвенным путем за счет реакции пероксида и металлического калия:
2K + K2O2 = 2K2O
Этот оксид проявляет ярко выраженные основные свойства, легко реагирует с водой с образованием гидроксида калия КОН:
K2O + H2O = 2KOH
Гидроксид калия, или едкое кали, хорошо растворим в воде (до 49, 10% массе при 20°C). Образующийся раствор — очень сильное основание, относящееся к щелочам. КОН реагирует с кислотными и амфотерными оксидами:SO2 + 2KOH = K2SO3 + H2O,
Al2O3 + 2KOH + 3H2O = 2K[Al(OH)4] (так реакция протекает в растворе) и
Al2O3 + 2KOH = 2KAlO2 + H2O (так реакция протекает при сплавлении реагентов).
В промышленности гидроксид калия KOH получают электролизом водных растворов KCl или K2CO3 c применением ионообменных мембран и диафрагм:
2KCl + 2H2O = 2KOH + Cl2+ H2,
или за счет обменных реакций растворов K2CO3 или K2SO4 с Ca(OH)2 или Ba(OH)2:
K2CO3 + Ba(OH)2 = 2KOH + BaCO3
Попадание твердого гидроксида калия или капель его растворов на кожу и в глаза вызывает тяжелые ожоги кожи и слизистых оболочек, поэтому работать с этими едкими веществами следует только в защитных очках и перчатках. Водные растворы гидроксида калия при хранении разрушают стекло, расплавы — фарфор.
Карбонат калия K2CO3 (обиходное название поташ) получают при нейтрализации раствора гидроксида калия углекислым газом:
2KOH + CO2 = K2CO3 + Н2О.
В значительных количествах поташ содержится в золе некоторых растений.
Металлический калий — материал для электродов в химических источниках тока. Сплав калия с другим щелочным металлом — натрием находит применение в качестве теплоносителя в ядерных реакторах.В гораздо больших масштабах, чем металлический калий, находят применение его соединения. Калий — важный компонент минерального питания растений, он необходим им в значительных количествах для нормального развития, поэтому широкое применение находят калийные удобрения: хлорид калия КСl, нитрат калия, или калийная селитра, KNO3, поташ K2CO3 и другие соли калия. Поташ используют также при производстве специальных оптических стекол, как поглотитель сероводорода при очистке газов, как обезвоживающий агент и при дублении кож.В качестве лекарственного средства находит применение иодид калия KI. Иодид калия используют также в фотографии и в качестве микроудобрения. Раствор перманганата калия КMnO4 («марганцовку») используют как антисептическое средство.
По содержанию в горных породах радиоактивного 40К определяют их возраст.
Калий — один из важнейших биогенных элементов, постоянно присутствующий во всех клетках всех организмов. Ионы калия К+ участвуют в работе ионных каналов и регуляции проницаемости биологических мембран, в генерации и проведении нервного импульса, в регуляции деятельности сердца и других мышц, в различных процессах обмена веществ. Содержание калия в тканях животных и человека регулируется стероидными гормонами надпочечников. В среднем организм человека (масса тела 70 кг) содержит около 140 г калия. Поэтому для нормальной жизнедеятельности с пищей в организм должно поступать 2-3 г калия в сутки. Богаты калием такие продукты, как изюм, курага, горох и другие.Металлический калий может вызвать очень сильные ожоги кожи, при попадании мельчайших частичек калия в глаза возникают тяжелые поражения с потерей зрения, поэтому работать с металлическим калием можно только в защитных перчатках и очках. Загоревшийся калий заливают минеральным маслом или засыпают смесью талька и NaCl. Хранят калий в герметично закрытых железных контейнерах под слоем обезвоженного керосина или минерального масла.
- Коренман И. М. Аналитическая химия калия. М. 1964.
megabook.ru
Калий
Ка́лий — элемент главной подгруппы первой группы, четвёртого периода периодической системы химических элементов, с атомным номером 19. Обозначается символом K (лат. Kalium). Простое вещество калий (CAS-номер: 7440-09-7) — мягкий щелочной металл серебристо-белого цвета. В природе калий встречается только в соединениях с другими элементами, например, в морской воде, а также во многих минералах. Очень быстро окисляется на воздухе и очень легко вступает в химические реакции, особенно с водой, образуя щёлочь. Во многих отношениях химические свойства калия очень близки к натрию, но с точки зрения биологической функции и использования их клетками живых организмов они всё же отличаются.
История и происхождение названия
Калий (точнее, его соединения) использовался с давних времён. Так, производство поташа (который применялся как моющее средство) существовало уже в XI веке. Золу, образующуюся при сжигании соломы или древесины, обрабатывали водой, а полученный раствор (щёлок) после фильтрования выпаривали. Сухой остаток, помимо карбоната калия, содержал сульфат калия K2SO4, соду и хлорид калия KCl. В 1807 году английский химик Дэви электролизом расплава едкого кали (KOH) выделил калий и назвал его «потассий» (лат. potassium; это название до сих пор употребительно в английском, французском, испанском, португальском и польском языках). В 1809 году Л. В. Гильберт предложил название «калий» (лат. kalium, от араб. аль-кали — поташ). Это название вошло в немецкий язык, оттуда в большинство языков Северной и Восточной Европы (в том числе русский) и «победило» при выборе символа для этого элемента — K.
Получение
Калий, как и другие щелочные металлы, получают электролизом расплавленных хлоридов или щелочей. Так как хлориды имеют более высокую температуру плавления (600—650 °C), то чаще проводят электролиз расправленных щелочей с добавкой к ним соды или поташа (до 12 %). При электролизе расплавленных хлоридов на катоде выделяется расплавленный калий, а на аноде — хлор: K+ + e— → K 2Cl— − 2e— → Cl2 При электролизе щелочей на катоде также выделяется расплавленный калий, а на аноде — кислород: 4OH— − 4e— → 2H2O + O2 Вода из расплава быстро испаряется. Чтобы калий не взаимодействовал с хлором или кислородом, катод изготовляют из меди и над ним помещают медный цилиндр. Образовавшийся калий в расплавленном виде собирается в цилиндре. Анод изготовляют также в виде цилиндра из никеля (при электролизе щелочей) либо из графита (при электролизе хлоридов).
Физические свойства
Калий — серебристое вещество с характерным блеском на свежеобразованной поверхности. Очень лёгок и легкоплавок. Относительно хорошо растворяется в ртути, образуя амальгамы. Будучи внесённым в пламя горелки калий (а также его соединения) окрашивает пламя в характерный розово-фиолетовый цвет.
Химические свойства
Элементарный калий, как и другие щелочные металлы, проявляет типичные металлические свойства и очень химически активен, является сильным восстановителем. На воздухе свежий срез быстро тускнеет из-за образования плёнок соединений (оксиды и карбонат). При длительном контакте с атмосферой способен полностью разрушиться. С водой реагирует со взрывом. Хранить его необходимо под слоем бензина, керосина или силикона, дабы исключить контакт воздуха и воды с его поверхностью. С Na, Tl, Sn, Pb, Bi калий образует интерметаллиды.
Источник: Википедия
Другие заметки по химии
edu.glavsprav.ru
КАЛИЙ | Энциклопедия Кругосвет
Содержание статьиКАЛИЙ (Kalium) K, химический элемент 1 (Ia) группы Периодической системы, относится к щелочным элементам. Атомный номер 19, атомная масса 39,0983. Состоит из двух стабильных изотопов 39K (93,259%) и 41K (6,729%), а также радиоактивного изотопа 40K с периодом полураспада ~109 лет. Этот изотоп играет в природе особую роль. Его доля в смеси изотопов составляет всего 0,01%, однако именно он является источником практически всего содержащегося в земной атмосфере аргона 40Ar, который образуется при радиоактивном распаде 40K. Кроме того, 40K присутствует во всех живых организмах, что, возможно, оказывает определенное влияние на их развитие.
Изотоп 40K служит для определения возраста горных пород калий-аргоновым методом. Искусственный изотоп 42K с периодом полураспада 15,52 года используется в качестве радиоактивного индикатора в медицине и биологии.
Степень окисления +1.
Соединения калия известны с древних времен. Поташ – карбонат калия K2CO3 – издавна выделяли из древесной золы.
Металлический калий был получен электролизом расплавленного едкого кали (KOH) в 1807 английским химиком и физиком Гемфри Дэви. Название «potassium», выбранное Дэви, отражает происхождение этого элемента из поташа. Латинское название элемента образовано от арабского названия поташа – «аль-кали». В русскую химическую номенклатуру слово «калий» введено в 1831 петербургским академиком Германом Гессом (1802–1850).
Распространение калия в природе и его промышленное извлечение.
Содержание калия в земной коре составляет 1,84%. Он – следующий по распространенности элемент после натрия. В литосфере калий находится, главным образом, в виде алюмосиликатов, например, полевого шпата ортоклаза K2O·Al2O3·6SiO2, на долю которого приходится почти 18% массы земной коры.
Большие отложения солей калия в сравнительно чистом виде образовались в результате испарения древних морей. Наиболее важными минералами калия для химической промышленности являются сильвин (KCl) и сильвинит (смешанная соль NaCl и KCl). Калий встречается также в виде двойного хлорида KCl·MgCl2·6H2O (карналлит) и сульфата K2Mg2(SO4)3 (лангбейнит). Массивные слои солей калия были впервые обнаружены в Стассфурте (Германия) в 1856. Из них с 1861 по 1972 в промышленных масштабах добывали поташ.
Океанская вода содержит около 0,06% хлорида калия. В некоторых внутренних водоемах, таких как озеро Солт-Лейк или Мертвое море, его концентрация может достигать 1,5%, что делает экономически целесообразной добычу элемента. В Иордании построен огромный завод, способный добывать миллионы тонн солей калия из Мертвого моря.
Хотя натрий и калий почти одинаково распространены в горных породах, в океане калия примерно в 30 раз меньше, чем натрия. Это связано, в частности, с тем, что соли калия, содержащие больший катион, менее растворимы, чем соли натрия, и калий более прочно связывается в комплексных силикатах и алюмосиликатах в почве за счет ионного обмен в глинах. Кроме того, калий, который выщелачивается из горных пород, в большей степени поглощается растениями. Подсчитано, что из тысячи атомов калия, освобождающихся при химическом выветривании, только два достигают морских бассейнов, а 998 остаются в почве. «Почва поглощает калий, и в этом ее чудодейственная сила», – писал академик Александр Евгеньевич Ферсман (1883–1945).
Калий является важным элементом жизни растений, и развитие диких растений часто ограничивается доступностью калия. При недостатке калия растения медленнее растут, их листья, особенно старые, желтеют и буреют по краям, стебель становится тонким и непрочным, а семена теряют всхожесть. Плоды такого растения – это особенно заметно на фруктах – будут менее сладкими, чем у растений, получивших нормальную дозу калия. Недостаток калия возмещают удобрениями.
Калийные удобрения являются основным видом калиесодержащей продукции (95%). Больше всего используется KCl, на его долю приходится более 90% калия, используемого в качестве удобрений.
Мировое производство калийных удобрений в 2003 оценено в 27,8 млн т (в пересчете на K2O, содержание калия в калийных удобрениях принято пересчитывать на K2O). Из них 33% было произведено в Канаде. По 13% мирового производства калийных удобрений приходится на производственные объединения «Уралкалий» и «Беларуськалий».
Характеристика простого вещества и промышленное получение металлического калия.
Калий – мягкий серебристо-белый металл с температурой плавления 63,51° С и температурой кипения 761° С. Придает пламени характерную красно-фиолетовую окраску, что связано с легкостью возбуждения его внешних электронов.
Химически очень активен, легко взаимодействует с кислородом, при нагревании на воздухе загорается. Основным продуктом этой реакции является надпероксид калия KO2.
С водой и разбавленными кислотами калий взаимодействует со взрывом и воспламенением. Серную кислоту восстанавливает до сероводорода, серы и диоксида серы, а азотную – до оксидов азота и N2.
При нагревании до 200–350° С калий реагирует с водородом с образованием гидрида KH. Металлический калий воспламеняется в атмосфере фтора, слабо взаимодействует с жидким хлором, но взрывается при соприкосновении с бромом и растирании с иодом. Калий реагирует с халькогенами и фосфором. С графитом при 250–500° С он образует слоистые соединения состава C8K–C60K.
Калий растворяется в жидком аммиаке (35,9 г в 100 мл при –70° С) с образованием ярко-голубых метастабильных растворов с необычными свойствами. Впервые это явление наблюдал, по-видимому, сэр Гемфри Дэви в 1808. Растворы калия в жидком аммиаке широко изучались с того момента, как они были получены Т.Вейлем в 1863.
Калий не растворяется в жидких литии, магнии, кадмии, цинке, алюминии и галлии и не реагирует с ними. С натрием образует интерметаллическое соединение KNa2, которое плавится с разложением при 7° С. С рубидием и цезием калий дает твердые растворы с минимальными температурами плавления около 35° С. С ртутью он образует амальгаму, содержащую два меркурида KHg2 и KHg с температурами плавления 270 и 180° С, соответственно.
Калий энергично взаимодействует со многими оксидами, восстанавливая их до простых веществ. Со спиртами он образует алкоголяты.
В отличие от натрия, калий не удается получать электролизом расплава хлорида, так как калий очень хорошо растворяется в расплавленном хлориде и не всплывает на поверхность. Дополнительную трудность создает образование надпероксида, который реагирует с металлическим калием с взрывом, поэтому способ промышленного производства металлического калия заключается в восстановлении расплавленного хлорида калия металлическим натрием при 850° С.
Восстановление хлорида калия натрием, на первый взгляд, противоречит обычному порядку реакционной способности (калий более реакционноспособен, чем натрий). Однако, при 850–880° С устанавливается равновесие:
Na(г) + K+(ж)  Na+(ж) + K(г)
Na+(ж) + K(г)
Так как калий более летуч, он испаряется раньше, это смещает равновесие и способствует протеканию реакции. Фракционной перегонкой в насадочной колонне можно получить калий 99,5%-ной чистоты, но обычно для перевозки используют смесь калия с натрием. Сплавы, содержащие 15–55% натрия, являются (при комнатной температуре) жидкими, поэтому их легче транспортировать.
Иногда калий восстанавливают из хлорида другими элементами, образующими устойчивые оксиды:
6KCl + 2Al + 4CaO = 3CaCl2 + CaO·Al2O3 + 6K
Металлический калий, производство которого является более трудным и дорогим, чем производство натрия, вырабатывается в гораздо меньших количествах (мировое производство составляет около 500 т в год). Одна из важнейших областей применения – получение надпероксида KO2 прямым сжиганием металла.
Металлический калий используют как катализатор в производстве некоторых видов синтетического каучука, а также в лабораторной практике. Сплав калия с натрием служит теплоносителем в атомных реакторах. Он же является восстановителем в производстве титана.
Калий вызывает сильные ожоги кожи. При попадании даже мельчайших его крошек в глаза возможна потеря зрения. Загоревшийся калий заливают минеральным маслом или засыпают смесью талька и хлорида натрия.
Хранят калий в герметически закрытых коробках под слоем обезвоженного керосина или минерального масла. Отходы калия утилизируют обработкой их сухим этанолом или пропанолом с последующим разложением образовавшихся алкоголятов водой.
Соединения калия.
Калий образует многочисленные бинарные соединения и соли. Почти все соли калия хорошо растворимы. Исключениями являются:
KHC4H4O6 – гидротартрат калия
KClO4 – перхлорат калия
K2Na[Co(NO2)6]·6H2O – гидрат гексанитрокобальтата(III) натрия-дикалия
K2[PtCl6] – гексахлороплатинат(IV) калия
Оксид калия K2O образует желтоватые кристаллы. Его получают при нагревании калия с гидроксидом, пероксидом, нитратом или нитритом калия:
2KNO2 + 6K = 4K2O + N2
Используют также нагревание смеси азида калия KN3 и нитрита калия или окисление калия, растворенного в жидком аммиаке, рассчитанным количеством кислорода.
Оксид калия – активатор губчатого железа, которое используется как катализатор в синтезе аммиака.
Пероксид калия K2O2 получить из простых веществ сложно, так как он легко окисляется до надпероксида KО2, оэтому используют окисление металла с помощью NO. Однако наилучшим методом его получения является количественное окисление металла, растворенного в жидком аммиаке.
Пероксид калия можно рассматривать как соль двухосновной кислоты Н2О2. Поэтому при его взаимодействии с кислотами или водой на холоде количественно образуется пероксид водорода.
Надпероксид калия KO2 (оранжевый) образуется при обычном сжигании металла на воздухе. Это соединение используется как запасной источник кислорода в дыхательных масках в шахтах, подводных лодках и космических кораблях.
При осторожном термическом разложении KO2 образуется полуторный оксид «K2О3» в виде темного парамагнитного порошка Его можно получить также окислением металла, растворенного в жидком аммиаке, или контролируемым окислением пероксида. Предполагается, что он является динадпероксид-пероксидом [(K+)4(O22–)(O2–)2].
Озонид калия KО3 можно получить при действии озона на безводный порошок гидроксида калия при низкой температуре с последующей экстракцией продукта (красного цвета) жидким аммиаком. Он используется в качестве компонента составов для регенерации воздуха в замкнутых системах.
Гидроксид калия KOH – сильное основание, относится к щелочам. Его традиционное название «едкое кали» отражает разъедающее действие этого вещества на живые ткани.
В промышленности гидроксид калия получают электролизом водных растворов хлорида или карбоната калия с железным или ртутным катодом (мировое производство составляет около 0,7 млн. т в год). Гидроксид калия можно выделить из фильтрата после отделения осадков, образующихся при взаимодействии карбоната калия с гидроксидом кальция или сульфата калия с гидроксидом бария.
Гидроксид калия применяют для получения жидкого мыла и различных соединений калия. Кроме того, он служит электролитом в щелочных аккумуляторах.
Фторид калия KF образует редкий минерал кароббиит. Получают фторид калия взаимодействием водных растворов фтороводорода или фторида аммония с гидроксидом калия или его солями.
Применяют фторид калия для синтеза различных фторсодержащих соединений калия, как фторирующий агент в органическом синтезе, а также как компонент кислотоупорных замазок и специальных стекол.
Хлорид калия KCl встречается в природе. Сырьем для его выделения служат сильвин, сильвинит, карналлит.
Из сильвинита хлористый калий получают методами галургии и флотации. Галургия (в переводе с греческого – «соляное дело») включает изучение состава и свойств природного солевого сырья и разработку способов промышленного получения из него минеральных солей. Галургический метод разделения основан на различной растворимости KCl и NaCl в воде при повышенных температурах. При нормальной температуре растворимость хлоридов калия и натрия почти одинакова. С повышением температуры растворимость хлорида натрия почти не меняется, а растворимость хлорида калия резко возрастает. На холоде готовят насыщенный раствор обеих солей, затем его нагревают и обрабатывают им сильвинит. При этом раствор дополнительно насыщается хлоридом калия, а часть хлорида натрия вытесняется из раствора, выпадает в осадок и отделяется фильтрованием. Раствор охлаждают, и из него выкристаллизовывается избыточный хлорид калия. Кристаллы отделяют на центрифугах и сушат, а маточный раствор идет на обработку новой порции сильвинита. Для выделения хлорида калия этот метод используется шире метода флотации, который базируется на разной смачиваемости веществ.
Хлорид калия является наиболее распространенным калийным удобрением. Кроме использования в качестве удобрений, он применяется, в основном, для производства гидроксида калия электролизом. Из него получают и другие соединения калия.
Бромид калия KBr получают взаимодействием брома с гидроксидом калия в присутствии аммиака, а также реакциями брома или бромидов с солями калия.
Бромид калия широко используется в фотографии. Он часто служит источником брома в органическом синтезе. Раньше бромид калия применялся как седативное средство в медицине («бром»). Монокристаллы бромида калия используют при изготовлении призм для ИК-спектрометров, а также в качестве матрицы при снятии ИК спектров твердых веществ.
Иодид калия KI образует бесцветные кристаллы, которые на свету приобретают желтоватую окраску за счет окисления кислородом воздуха и выделения иода. Поэтому иодид калия хранят в склянках из темного стекла.
Получают иодид калия взаимодействием иода с гидроксидом калия в присутствии муравьиной кислоты или пероксида водорода, а также обменными реакциями иодидов с солями калия. Он окисляется азотной кислотой до иодата калия KIO3. Иодид калия взаимодействует с иодом с образованием растворимого в воде комплекса K[I(I)2], а с хлором и бромом дает, соответственно, K[ICl2] и K[IBr2].
Иодид калия применяется в качестве лекарственного средства в медицине и ветеринарии. Он является реактивом в иодометрии. Иодид калия – противовуалирующее вещество в фотографии, компонент электролита в электрохимических преобразователях, добавка для повышения растворимости иода в воде и полярных растворителях, микроудобрение.
Сульфид калия K2S хорошо растворим в воде. При гидролизе создает в растворе щелочную среду:
K2S = 2K+ + S2–; S2– + H2O  HS– + OH–
HS– + OH–
Сульфид калия легко окисляется на воздухе, при поджигании сгорает. Получают его взаимодействием калия или карбоната калия с серой без доступа воздуха, а также восстановлением сульфата калия углеродом.
Сульфид калия является компонентом светочувствительных эмульсий в фотографии. Его используют как аналитический реагент для разделения сульфидов металлов и как компонент составов для обработки шкур.
При насыщении водного раствора сероводородом образуется гидросульфид калия KHS, который можно выделить в виде бесцветных кристаллов. Его применяют в аналитической химии для разделения тяжелых металлов.
Нагреванием сульфида калия с серой получают желтые или красные полисульфиды калия KSn (n = 2–6). Водные растворы полисульфидов калия можно получить кипячением растворов гидроксида или сульфида калия с серой. При спекании карбоната калия с избытком серы на воздухе образуется так называемая серная печень – смесь KSn и K2S2O3.
Применяют полисульфиды для сульфидирования стали и чугуна. Серная печень используется как лекарственное средство для лечения кожных заболеваний и как пестицид.
Сульфат калия K2SO4 встречается в природе в месторождениях калийных солей и в водах соленых озер. Его можно получить обменной реакцией между хлоридом калия и серной кислотой или сульфатами других элементов.
Сульфат калия применяют как удобрение. Это вещество более дорогое, чем хлорид калия, но не гигроскопичное и не слеживающееся, в отличие от хлорида калия, сульфат калия можно применять на любых почвах, в том числе и засоленных.
Из сульфата калия получают квасцы и другие соединения калия. Он входит в состав шихты в производстве стекла.
Нитрат калия KNO3 – сильный окислитель. Его часто называют калийной селитрой. В природе образуется при разложении органических веществ в результате жизнедеятельности нитрифицирующих бактерий.
Получают нитрат калия обменной реакцией между хлоридом калия и нитратом натрия, а также действием азотной кислоты или нитрозных газов на карбонат или хлорид калия.
Нитрат калия – отличное удобрение, содержащее одновременно калий и азот, однако применяется меньше, чем хлорид калия, из-за высокой стоимости производства. Нитрат калия используется и для изготовления черного пороха и пиротехнических составов, в производстве спичек и стекла. Кроме того, он применяется при консервировании мясных продуктов.
Карбонат калия K2CO3 называют также поташом. Получают при действии диоксида углерода на растворы гидроксида калия или суспензии карбоната магния в присутствии хлорида калия. Является побочным продуктом при переработке нефелина в глинозем.
Значительное количество карбоната калия содержится в растительной золе. Больше всего калия в золе подсолнечника – 36,3%. В золе дров оксида калия значительно меньше – от 3,2% (еловые дрова) до 13,8% (березовые дрова). Еще меньше калия в золе торфа.
Карбонат калия используется, главным образом, для производства высококачественного стекла, используемого в оптических линзах, трубках цветных телевизоров и флуоресцентных лампах. Применяется и в производстве фарфора, красителей и пигментов.
Перманганат калия KMnO4 образует темно-фиолетовые кристаллы. Растворы этого вещества имеют красно-фиолетовый цвет. Перманганат калия получают анодным окислением марганца или ферромарганца в сильно щелочной среде.
Перманганат калия – сильный окислитель. Его используют как обесцвечивающее, отбеливающее и очищающее средство. Применяется и в органическом синтезе, например, при производстве сахарина.
Гидрид калия KH – белое твердое вещество, при нагревании разлагается на простые вещества. Гидрид калия является сильнейшим восстановителем. Он воспламеняется во влажном воздухе и в среде фтора или хлора. Гидрид калия может быть окислен даже такими слабыми окислителями, как вода и диоксид углерода:
KH + H2O = KOH + H2
KH + CO2 = K(HCOO) (формиат калия)
Гидрид калия вступает также в реакции с кислотами и спиртами, при этом возможно воспламенение. Он восстанавливают сероводород, хлороводород и другие вещества, содержащие водород(I):
2KH + H2S = K2S + 2H2
KH + HCl = KCl + H2
Гидрид калия используется как восстановитель при проведении неорганических и органических синтезов.
Цианид калия KCN, известный под названием цианистый калий, образует бесцветные кристаллы, хорошо растворимые в воде и некоторых неводных растворителях. В водном растворе он постепенно гидролизуется с выделением циановодорода HCN, а при кипячении водных растворов разлагается на формиат калия и аммиак.
В присутствии цианида калия могут идти не совсем обычные реакции, например, медь реагирует с водой, выделяя из нее водород и образуя дицианокупрат(I) калия:
2Cu + 4KCN + 2H2O = 2K[Cu(CN)2] + H2
В подобных условиях идет взаимодействие и в случае золота. Правда, этот менее активный металл не способен окисляться водой, однако в присутствии кислорода переходит в раствор в виде цианокомплекса – дицианоаурата(I) калия:
4Au + 8KCN + 2H2O + O2 = 4K[Au(CN)2] + 4NaOH
Получают цианид калия взаимодействием циановодорода с избытком гидроксида калия. Он является реагентом для извлечения серебра и золота из бедных руд, компонентом электролитов для очистки платины от серебра и для гальванического золочения и серебрения. Цианид калия применяют как реактив в химическом анализе для определения серебра, никеля и ртути.
Цианид калия очень токсичен. Смертельная доза для человека 120 мг.
Комплексные соединения. Наиболее устойчивые комплексные соединения калий образует с полидентатными лигандами (молекулами или ионами, которые могут соединяться с атомом несколькими связями), например, с макроциклическими полиэфирами (краун-эфирами).
Краун-эфиры (от английского crown – корона) содержат в цикле свыше 11 атомов, из которых не менее четырех –атомы кислорода. В тривиальных названиях краун-эфиров общее число атомов в цикле и число атомов кислорода обозначают цифрами, которые ставят, соответственно, до и после слова «краун». Такие названия намного короче систематических. Например, 12-краун-4 (рис. 1) по международной номенклатуре называется 1,4,7,10,13-тетраоксоциклододекан.
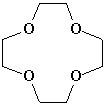
Рис. 1. ГРАФИЧЕСКАЯ ФОРМУЛА соединения 12-краун-4.
Краун-эфиры образуют устойчивые комплексы с катионами металлов. При этом катион включается во внутримолекулярную полость краун-эфира и удерживается там благодаря ион-дипольному взаимодействию с атомами кислорода. Наиболее устойчивы комплексы с катионами, геометрические параметры которых соответствуют полости краун-эфира. С катионом калия наиболее устойчивые комплексы образуют краун-эфиры, содержащие 6 атомов кислорода, например, 18-краун-6 (рис. 2).

Рис. 2. ГРАФИЧЕСКАЯ ФОРМУЛА комплекса калия с 18-краун-6.
Биологическая роль калия (и натрия). Калий вместе с натрием регулируют процессы обмена веществ в живых организмах. В организме человека внутри клеток содержится большое количество ионов калия (0,12–0,16 моль/л), но относительно мало ионов натрия (0,01 моль/л). Содержание ионов натрия значительно выше во внеклеточной жидкости (около 0,12 моль/л), поэтому ионы калия контролируют внутриклеточную активность, а ионы натрия – межклеточную. Эти ионы не могут заменить друг друга.
Существование натрий-калиевого градиента с внутренней и внешней стороны клеточной мембраны приводит к возникновению разности потенциалов на противоположных сторонах мембраны. Нервные волокна способны передавать импульсы, а мышцы – сокращаться именно благодаря существованию внутреннего отрицательного заряда по отношению к внешней поверхности мембраны. Таким образом, в организме ионы натрия и калия осуществляют физиологический контроль и пусковые механизмы. Они способствуют передаче нервного импульса. Психика человека зависит от баланса ионов натрия и калия в организме. Концентрацию ионов натрия и калия, задерживаемых и выделяемых через почки, контролируют некоторые гормоны. Так, минералокортикоиды способствуют увеличению выброса ионов калия и уменьшению выброса ионов натрия.
Ионы калия входят в состав ферментов, катализирующих перенос (транспорт) ионов через биомембраны, окислительно-восстановительные и гидролитические процессы. Они служат и для поддержания структуры клеточных стенок и контролируют их состояние. Ион натрия активирует несколько ферментов, которые калий не может активировать, так же как ион натрия не может действовать на калиезависимые ферменты. Когда эти ионы попадают внутрь клетки, они связываются подходящими лигандами в соответствии с их химической активностью. Роль таких лигандов выполняют макроциклические соединения, модельными аналогами которых являются краун-эфиры. Некоторые антибиотики (подобные валиномицину) транспортируют ионы калия в митохондрии.
Установлено, что для работы (Na+–K+)–АТФ-азы (аденозинтрифосфатазы) – мембранного фермента, катализирующего гидролиз АТФ, нужны одновременно ионы натрия и калия. Транспортная АТФ-аза связывает и высвобождает ионы натрия и калия на определенных стадиях ферментативной реакции, поскольку сродство активных центров фермента к ионам натрия и калия изменяется по мере протекания реакции. При этом структурные изменения фермента этом приводят к тому, что катионы натрия и калия принимаются по одну сторону от мембраны, а высвобождаются по другую. Таким образом, одновременно с гидролизом АТФ происходит и селективное перемещение катионов щелочных элементов (работа так называемого Na–K-насоса).
Суточная потребность в калии у ребенка составляет 12–13 мг на 1 кг веса, а у взрослого – 2–3 мг, т.е. в 4–6 раз меньше. Большую часть необходимого ему калия человек получает из пищи растительного происхождения.
Елена Савинкина
www.krugosvet.ru
