Иодид калия — Википедия
Материал из Википедии — свободной энциклопедии
| Иодид калия | |
|---|---|
 ( ({{{картинка3D}}}) | |
 ( ({{{изображение}}})( {{{изображение2}}}) | |
| Хим. формула | KI |
| Состояние | бесцветные кубические кристаллы |
| Молярная масса | 166,00277 г/моль |
| Плотность | 3,13 г/см³ |
| Температура | |
| • плавления | 681 °C |
| • кипения | 1324 °C |
| Мол. теплоёмк. | 52,73 Дж/(моль·К) |
| Энтальпия | |
| • образования | -327,6 кДж/моль |
| Растворимость | |
| • в воде | 127,8 (0 °C), 144,5 г (20 °C), 209 г (100 °C) |
| Показатель преломления | 1,667 |
| Рег. номер CAS | 7681-11-0 |
| PubChem | 4875 |
| Рег. номер EINECS | 231-659-4 |
| SMILES | |
| InChI | |
| RTECS | TT2975000 |
| ChEBI | 8346 |
| Номер ООН | 2056 |
| ChemSpider | 4709 |
| ЛД50 | 2779 мг/кг |
| Пиктограммы СГС |   |
| NFPA 704 |  |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |
 Медиафайлы на Викискладе Медиафайлы на Викискладе | |
Иоди́д ка́лия (иодистый калий) — неорганическое соединение, калиевая соль иодоводородной кислоты с химической формулой KI. Бесцветная кристаллическая соль, желтеющая на свету. Широко используется в качестве источника иодид-ионов. Менее гигроскопична чем иодид натрия. Применяется в медицине как лекарственное средство, в сельском хозяйстве как удобрение, а также в фотографии и аналитической химии.
Бесцветные кристаллы, имеющие кубическую сингонию (a = 0,7066 нм, z = 4, пространственная группа Fm3¯m{\displaystyle Fm{\bar {3}}m}). Плотность 3,115 г/см3. Соединение имеет температуру плавления 681 °C, кипения 1324 °C. Растворимость в 100 г воды: 127,8 г (0 °C), 144,5 г (20 °C), 209 г (100 °C). Также растворим в ацетоне, метаноле, этаноле, жидком аммиаке и глицерине[1].
На свету окисляется кислородом воздуха, желтея из-за выделяющегося свободного иода[1].
Иодид калия является мягким восстановителем и легко может быть окислен в растворе таким окислителем как бром:
- 2KI+Br2⟶2KBr+I2{\displaystyle {\mathsf {2KI+Br_{2}\longrightarrow 2KBr+I_{2}}}}
Иодид калия реагирует с иодом, образуя раствор Люголя, содержащий трииодид-анион, который обладает лучшей растворимостью в воде, чем элементарный иод:
- KI+I2⟶KI3{\displaystyle {\mathsf {KI+I_{2}\longrightarrow KI_{3}}}}
Разлагается в водных растворах с выделением иода при действии ультразвука.
Получают взаимодействием иода с гидроксидом калия в присутствии муравьиной кислоты или перекиси водорода[1]:
- 6KOH+3I2→HCOOH/h3O25KI+KIO3+3h3O{\displaystyle {\mathsf {6KOH+3I_{2}{\xrightarrow {HCOOH/H_{2}O_{2}}}5KI+KIO_{3}+3H_{2}O}}}
или восстановлением иодата калия углём:
- 2KIO3+3C⟶2KI+3CO2{\displaystyle {\mathsf {2KIO_{3}+3C\longrightarrow 2KI+3CO_{2}}}}
Используется для окислительно-восстановительного титрования в аналитической химии (иодометрия)[1].
В малых количествах наряду с иодатом калия добавляется в поваренную соль (иодированная соль).
Применяют в медицине и ветеринарии, как лекарственное средство[1].
Применяется как индикатор для обнаружения некоторых окислителей, например, хлора и озона. Для этого используют бумагу, смоченную раствором иодида калия и крахмала.
- Cl2+2KI→2KCl+I2{\displaystyle {\mathsf {Cl_{2}+2KI\rightarrow 2KCl+I_{2}}}}
При этом крахмал образует окрашенный в синий цвет аддукт с иодом.
В фотографии используют для приготовления светочувствительных материалов. Также применяется при обработке фотоматериалов в составе проявителя, как сильное антивуалирующее средство и в составе усиливающих и ослабляющих растворов[2].
- Гурлев Д.С. Справочник по фотографии (обработка фотоматериалов). — К.: Тэхника, 1988.
- Ксензенко В. И., Стасиневич Д. С. Калия иодид : статья // Химическая энциклопедия / Редкол.: Кнунянц И. Л. и др.. —
Ацетат калия — Википедия
Материал из Википедии — свободной энциклопедии
Текущая версия страницы пока не проверялась опытными участниками и может значительно отличаться от версии, проверенной 8 июня 2019; проверки требуют 2 правки. Текущая версия страницы пока не проверялась опытными участниками и может значительно отличаться от версии, проверенной 8 июня 2019; проверки требуют 2 правки.| Ацетат калия | |
|---|---|
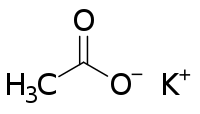 ( {{{картинка}}}) | |
| Систематическое наименование | Ацетат калия |
| Традиционные названия | уксуснокислый калий |
| Хим. формула | C2H3KO2 |
| Рац. формула | CH3COOK |
| Состояние | твёрдое кристаллическое |
| Молярная масса | 98,15 г/моль |
| Плотность | 1,57 г/см³ |
| Твёрдость | 2 |
| Температура | |
| • плавления | 292 °C |
| • разложения | ~230 °C |
| Энтальпия | |
| • образования | -722,6 кДж/моль |
| • плавления | 22 кДж/моль |
| Растворимость | |
| • в воде (25°C) | 269,4 г/100 мл |
| • в воде (80°C) | 380 г/100 мл |
| • в глицерине (20°C) | 70 г/100 мл |
| Рег. номер CAS | 127-08-2 |
| PubChem | 517044 |
| Рег. номер EINECS | 204-822-2 |
| SMILES | |
| InChI | |
| Кодекс Алиментариус | E261 |
| ChEBI | 32029 |
| ChemSpider | 29104 |
| ЛД50 | 3250 мг/кг |
| Токсичность | Малотоксично. Пыль, попадая в лёгкие, глаза и длительно находясь на коже, вызывает раздражение. |
| Фразы риска (R) | R36/37/38 |
| NFPA 704 |  |
| Приведены данные для стандартных условий (25 °C, 100 кПа), если не указано иное. | |
 Медиафайлы на Викискладе Медиафайлы на Викискладе | |
Ацета́т ка́лия (калий уксуснокислый, CH3COOK) — органическое соединение, калиевая соль уксусной кислоты.
Может быть получен при реакции основных соединений калия, таких как KOH (едкое кали, гидроксид калия) или карбонат калия — K2CO3, с уксусной кислотой:
- 2Ch4COOH+K2CO3 → 2Ch4COOK+CO2↑+h3O{\displaystyle {\mathsf {2CH_{3}COOH+K_{2}CO_{3}\ {\xrightarrow {}}\ 2CH_{3}COOK+CO_{2}\uparrow +H_{2}O}}}
Хранение и предосторожность[править | править код]
Рекомендуется избегать контакта ацетата калия с источниками воды, тепла, искр, открытым огнём и с сильными окисляющими средами.
- Ацетат калия может использоваться как реагент-антиобледенитель, заменяющий хлориды, такие как хлорид кальция или хлорид магния. Его преимущество заключается в менее агрессивном воздействии на состав почвы и он менее коррозивен, что и является причиной его применения для очистки полос в аэропортах. Однако при этом он и дороже.
- Ацетат калия применяется в составе средств пожаротушения класса K (огнегаситель) — по классификации средств пожаротушения США из-за его способности охлаждать и образовывать корку над горящим горючим (основное применение по классификации — тушение горящих масел).
- Ацетат калия используется при заместительной терапии при диабетическом кетоацидозе из-за его способности разлагаться на бикарбонаты и снижать уровень кислотности
- Диабетический кетоацидоз — угрожающее жизни осложнение у пациентов с нелеченным диабетом (при хроническом высоком содержании сахара в крови). Чаще встречается у больных диабетом I типа, но может быть и у больных диабетом II типа при длительном стрессовом воздействии и/или инфекциях. Характеризуется кислой реакцией крови (при pH ниже 6,7 это несовместимо с жизнью) высоким уровнем кетоновых тел в крови и высокой концентрацией сахара в крови. Лечение состоит в снижении осмотического давления крови (вводится внутривенно много жидкости), замещении недостающих электролитов (обычное осложнение гипокалиемия — недостаток ионов калия), инъекция инсулина в смеси с глюкозой для нормализации обменных процессов.
- Ацетат калия применяется как консервант и регулятор кислотности в пищевой промышленности. Как пищевая добавка, обозначается индексом E261 (вместе с диацетатом калия)[1]. Входит в список пищевых добавок, разрешённых к применению в Российской Федерации[2].
- Ацетат калия используется в составе консервирующих растворов, закрепителей и для мумификации. В большинстве музеев мира сегодня применяют для этого формальдегидный метод, рекомендованный Кайзерлингом в 1897 году, при этом также используется ацетат калия[3]. Например, тело В. И. Ленина было законсервировано в ванне раствора, в состав которого входил ацетат калия[4].
Ацетат калия малотоксичен, однако при попадании в лёгкие, в глаза и на кожу является довольно сильным раздражителем.
Фторид калия — Википедия
Материал из Википедии — свободной энциклопедии
Текущая версия страницы пока не проверялась опытными участниками и может значительно отличаться от версии, проверенной 2 марта 2018; проверки требуют 10 правок. Текущая версия страницы пока не проверялась опытными участниками и может значительно отличаться от версии, проверенной 2 марта 2018; проверки требуют 10 правок.Фтори́д калия, фтористый калий — KF, калиевая соль плавиковой кислоты.
Фторид калия встречается в природе в виде редкого минерала кароббиитa.
Термодинамические параметры[править | править код]
Растворимость[править | править код]
- Дипольный момент молекулы фторида калия равен 7,33 Дб.
- Молярная электропроводность при бесконечном разведении при 25 °C равна 128,9 См·см2/моль.
- Проявляет диамагнитные свойства.[3]
- Простым лабораторным методом получения фторида калия является растворение KOH или K2CO3 в плавиковой кислоте HF.
- В природе фторид калия встречается редко, и поэтому для промышленного получения KF часто используют природный минерал флюорит (CaF2), который спекают с поташом (K2CO3), затем выщелачивают, и после выпаривания воды получают достаточно чистый фторид калия.[4]
- Типичная соль. В водном растворе подвергается диссоциации:
- KF ↔ K+ + F−.
- Применяется при изготовлении кислотоупорных замазок и специальных стёкол.
- В металлургии в качестве флюса.
- Как реагент при фторировании органических соединений.
- Для получения фторсодержащих соединений калия.
- Кислые соли — гидрофториды, легкоплавкие кристаллические вещества, используемые как электролиты при получении элементарного фтора.
Фторид калия токсичен при ингаляции и проглатывании, при попадании на кожу вызывает раздражение. Смертельная доза фторида калия для крыс (LD50), полученная орально, составляет 245 мг/кг массы тела[5]
Нитрит калия — Википедия
Материал из Википедии — свободной энциклопедии
Текущая версия страницы пока не проверялась опытными участниками и может значительно отличаться от версии, проверенной 6 октября 2018; проверки требуют 2 правки. Текущая версия страницы пока не проверялась опытными участниками и может значительно отличаться от версии, проверенной 6 октября 2018; проверки требуют 2 правки.Нитри́т ка́лия (азотистокислый калий) — калиевая соль азотистой кислоты с формулой KNO2. Представляет собой белый или слегка желтоватый кристаллический гигроскопический порошок. Очень хорошо растворим в воде. На воздухе медленно окисляется до нитрата калия КNO3. Пищевая добавка E249. Используется как улучшитель окраски и консервант в пищевой промышленности в изделиях из мяса и рыбы.
Нитрит калия образует бесцветные или слегка желтоватые высоко гигроскопичные кристаллы, моноклинной сингонии, пространственная группа I m, параметры ячейки a = 0,677 нм, b = 0,499 нм, c = 0,445 нм, β = 101,75°, Z = 2.
Очень хорошо растворим в воде, растворение сопровождается понижением температуры. Раствор имеет слабо щелочную реакцию из-за гидролиза по аниону.
Кристаллы разрушаются при 360 °C (до достижения точки плавления которая равна 440 °C или 441 °C, при 100 КПа по данным польской и английской Википедии и 438 °C при давлении в 101325 Па [1], энтальпия плавления — 17 кДж/моль[1]).
Выше этой температуры разлагается по схеме:
- 4KNO2⟶2K2O+2N2+3O2{\displaystyle {\mathsf {~4KNO_{2}\,\longrightarrow \,2K_{2}O+2N_{2}+3O_{2}}}}
Как и нитрит натрия является окислителем особенно при повышенных температурах и реагирует с металлами такими как алюминий (особенно в порошкообразной форме), обезвоженными соединениями аммония такими как сульфат аммония, цианидами и многими органическими соединениями.
На воздухе медленно доокисляется до нитрата калия KNO3{\displaystyle {\mathsf {~KNO_{3}}}}:
- 2KNO2+O2⟶ 2KNO3{\displaystyle {\mathsf {~2\,KNO_{2}+O_{2}\longrightarrow ~2\,KNO_{3}}}}
Нитриты можно выявить по характеристической реакции с сульфатом железа (II) в присутствии концентрированной серной кислоты (по образованию коричневого окрашивания).
Нахождение в природе и способы получения[править | править код]
В природе, нитриты появляются на промежуточных этапах азотного цикла — как при нитрификации (присоединении азота к соединениям) так и при денитрификации (отсоединении азота от соединений). В промышленности нитрит калия получают при реакции оксидов азота с гидроксидом калия.
Получается при окислении свинца нитратом калия:
- KNO3+Pb⟶KNO2+PbO{\displaystyle {\mathsf {~KNO_{3}+Pb\,\longrightarrow \,KNO_{2}+PbO}}}
или в процессе термического разложения:
- 2KNO3⟶2KNO2+O2{\displaystyle {\mathsf {~2KNO_{3}\,\longrightarrow \,2KNO_{2}+O_{2}}}}
- Нитрит калия как пищевая добавка Е249 (консервант) используется аналогично другим нитритам и солям (хлоридом натрия и нитритом натрия) — предотвращает образование ботулотоксина (образуется при жизнедеятельности палочки Clostridium botulinum). При добавлении к мясу образует нитрозомиоглобин, имеющий характерный красный цвет, который можно наблюдать в большинстве продуктов питания (колбасы, сосиски, и др.). Употребление продуктов, содержащих нитрит калия, вызывает жажду.
- В Европейском союзе продажа нитрита калия для пищевых целей разрешена только в виде смеси с пищевой солью, с содержанием нитрита около 0,6 %[2]. C 2013 года сходные правила действуют в России.
- Нитрит калия применяется для диазотирования при производстве азо-красителей.
- Нитрит калия применяется в аналитической химии для распознавания аминов.
- Нитрит калия применяется в фотографии как сенсибилизатор.
Токсичен при проглатывании, при получении больших доз вызывает раздражение, цианоз, конвульсии, смерть (образует метгемоглобин). Раздражает кожу и глаза. Летальная доза LD50 для кроликов 200 мг/кг[3][4].
Поступление нитритов с пищей оценивается в 31-185 или 40-100 мг в день[5].
В питьевой воде, согласно требованиям ВОЗ 1970 и 2004 гг[6][7], допускается содержание нитритов не более 44-50 мг на литр[8].
Приемлемые уровни потребления нитритов для людей 3,7 — 7 мг / кг.[8]
- ↑ 1 2 Физические величины: Справочник/А. П. Бабичев, Н. А. Бабушкина, А. М. Братковский и др.; Под ред. И. С. Григорьева, Е. З. Мейлихова. — М.; Энергоатомиздат, 1991 −1232 с — ISBN 5-283-04013-5
- ↑ OPINIONS OF THE SCIENTIFIC COMMITTEE FOR FOOD ON: Nitrates and Nitrite / REPORTS OF THE SCIENTIFIC COMMITTEE FOR FOOD; European Commission, 1997
- ↑ Material Safety Data Sheet Potassium nitrite MSDS# 19480 . Fisher Scientific. 2005
- ↑ http://www.cdc.gov/niosh/ipcsneng/neng1069.html POTASSIUM NITRITE — The National Institute for Occupational Safety and Health (NIOSH), CDC
- ↑ Food sources of nitrates and nitrites: the physiologic context for potential health benefits Am J Clin Nutr July 2009 vol. 90 no. 1 1-10, doi:10.3945/ajcn.2008.27131. «DIETARY NITRATE AND NITRITE INTAKE ESTIMATES»
- ↑ World Health Organization. Recommendations; nitrate and nitrite. In: Guidelines for drinking water quality. 3rd ed. Geneva, Switzerland: WHO, 2004:417-20.
- ↑ Nitrate and nitrite in drinking-water (WHO/SDE/WSH/07.01/16/Rev/1), 2011
- ↑ 1 2 Food sources of nitrates and nitrites: the physiologic context for potential health benefits Am J Clin Nutr July 2009 vol. 90 no. 1 1-10, doi:10.3945/ajcn.2008.27131. POTENTIAL HEALTH RISKS OF EXCESSIVE NITRATE AND NITRITE EXPOSURE
- Справочник химика / Редкол.: Никольский Б.П. и др.. — 2-е изд., испр. — М.-Л.: Химия, 1966. — Т. 1. — 1072 с.
- Справочник химика / Редкол.: Никольский Б.П. и др.. — 3-е изд., испр. — Л.: Химия, 1971. — Т. 2. — 1168 с.
- IARC Monographs on the Evaluation of Carcinogenic Risks to Humans VOLUME 94 «Ingested Nitrate and Nitrite, and Cyanobacterial Peptide Toxins», IARC, 2010 ISBN 978-92-832-1294-2, ISSN 1017-1606 (англ.)
Бензоат калия — Википедия
Материал из Википедии — свободной энциклопедии
Текущая версия страницы пока не проверялась опытными участниками и может значительно отличаться от версии, проверенной 21 августа 2016; проверки требуют 5 правок. Текущая версия страницы пока не проверялась опытными участниками и может значительно отличаться от версии, проверенной 21 августа 2016; проверки требуют 5 правок.Бензоат калия (калийная соль бензойной кислоты) — химическое соединение, соль калия и бензойной кислоты с формулой C6H5COOK.
Твердый гигроскопичный порошок белого цвета, без запаха, растворимый в этиловом спирте. Малорастворим в метаноле, а в эфирах не растворяется.
Растворяется в воде, образует кристаллогидрат состава C6H5COOK•3H2O, который теряет воду при 110°С.
- Действие бензойной кислоты на карбонат калия: K2CO3+2C6H5COOH→100oC2C6H5COOK+CO2↑+h3O{\displaystyle K_{2}CO_{3}+2C_{6}H_{5}COOH{\xrightarrow {100^{o}C}}2C_{6}H_{5}COOK+CO_{2}\uparrow +H_{2}O}
- Окисление толуола в водном растворе перманганата калия.
- C6H5Ch4+2KMnO4→h3OC6H5COOK+2MnO2+KOH+h3O{\displaystyle C_{6}H_{5}CH_{3}+2KMnO_{4}{\xrightarrow {H_{2}O}}C_{6}H_{5}COOK+2MnO_{2}+KOH+H_{2}O}
Применение
- Пищевая добавка E212, используется для подавления плесени и роста бактерий.
- Добавка в пиротехнических составах.
- Справочник химика / Редкол.: Никольский Б.П. и др.. — 3-е изд., испр. — Л.: Химия, 1971. — Т. 2. — 1168 с.
Тартрат калия — Википедия
Материал из Википедии — свободной энциклопедии
Тартрат калия — органическое соединение, соль калия и винной кислоты с формулой K2C4H4O6, бесцветные кристаллы, растворяется в воде, образует кристаллогидраты, имеет оптические изомеры.
- 2KOH+C4H6O6 → K2C4h5O6+2h3O{\displaystyle {\mathsf {2KOH+C_{4}H_{6}O_{6}\ {\xrightarrow {}}\ K_{2}C_{4}H_{4}O_{6}+2H_{2}O}}}
Тартрат калия образует бесцветные кристаллы.
Хорошо растворяется в воде, слабо растворяется в этаноле.
Образует кристаллогидраты:
- K2C4H4O6•2H2O, триклинная сингония, параметры ячейки a = 0,702 нм, b = 0,690 нм, c = 1,120 нм, α = 95,73°, β = 102,87°, γ = 61,77°, Z = 2.
- K2C4H4O6•0,5H2O, моноклинная сингония, пространственная группа I 2, параметры ячейки a = 1,278 нм, b = 0,5049 нм, c = 1,260 нм, β = 104,75°, Z = 4.
- Входит в состав пищевой добавки Е336, которая используется в пищевых продуктах в качестве антиоксиданта, подкислителя, регулятора кислотности, эмульгатора, стабилизирует окраску продуктов, усиливает действие антиоксидантов.
- Химическая энциклопедия / Редкол.: Кнунянц И.Л. и др.. — М.: Советская энциклопедия, 1988. — Т. 1. — 623 с.
- Справочник химика / Редкол.: Никольский Б.П. и др.. — 2-е изд., испр. — М.-Л.: Химия, 1966. — Т. 1. — 1072 с.
- Справочник химика / Редкол.: Никольский Б.П. и др.. — 3-е изд., испр. — Л.: Химия, 1971. — Т. 2. — 1168 с.
