Теория биопоэза. Коацерваты и пробионты
Задание 1. 38. На какой гипотезе основана теория биопоэза? Назовите стадии возникновения жизни по Д. Берналу.
Задание 2. 38. Кто такие «пробионты»? Каким путём они образовались? В чем особенность их типа питания?
Задание 3. 38. Какие организмы первыми на заре развития жизни на Земле начали фотосинтезировать? Каковы последствия возникновения фотосинтеза?
Ответы.
Задание 1.
1. Теория биопоэза основана на гипотезе биохимической эволюции Опарина-Холдейна.
2. В теории выделяют три этапа: абиогенное возникновение органических веществ, образование биологических полимеров, формирование мембранных структур и первичных организмов — пробионтов.
Задание 2.
1. Пробионты — примитивные клетки, образовались в процессе биологической эволюции, при объединении коацерватов, мембран, и РНК в центре клетки.
2. Пробионты были анаэробными гетеротрофами, близкими к бактериям.
Задание 3.
1. Первыми были пурпурные и зелёные бактерии, но они не использовали воду и не выделяли кислород, так как имели 1 фотосистему.
2. Далее, появились цианобактерии, которые определили накопление кислорода в атмосферу, вследствие чего появилось аэробное дыхание, сформировался озоновый слой, организмы вышли на сушу.
Смотреть еще: курсы ЕГЭ в Москве по биологии, подготовка к ЕГЭ по биологии онлайн, подготовка к ГИА по биологии.
Пробионты и их дальнейшая эволюция
Пробионты и их дальнейшая эволюция
Наиболее трудная часть проблемы возникновения жизни - переход от биополимеров к первым живым существам. Ученые пытаются найти ее решение на модельных экспериментах. Наибольшую известность получили опыты А.И. Опарина и его сотрудников. А.И. Опарин предположил, что переход от химической эволюции к биологической связан с возникновением простейших фазовообособленных органических систем — пробионтов, способных использовать из окружащей среды вещества и энергию и на этой основе осуществлять важнейшие жизненные функции — расти и подвергаться естественному отбору.
Наиболее перспективным объектом для моделирования подобной системы могут
служить коацерватные капли. А.И. Опарин наблюдал, как в коллоидных
растворах полипептидов, полисахаридов, РНК и других высокомолекулярных
соединений при определенных условиях образуются сгустки объемом от 10 в -8
степени до 10 в -6 степени куб.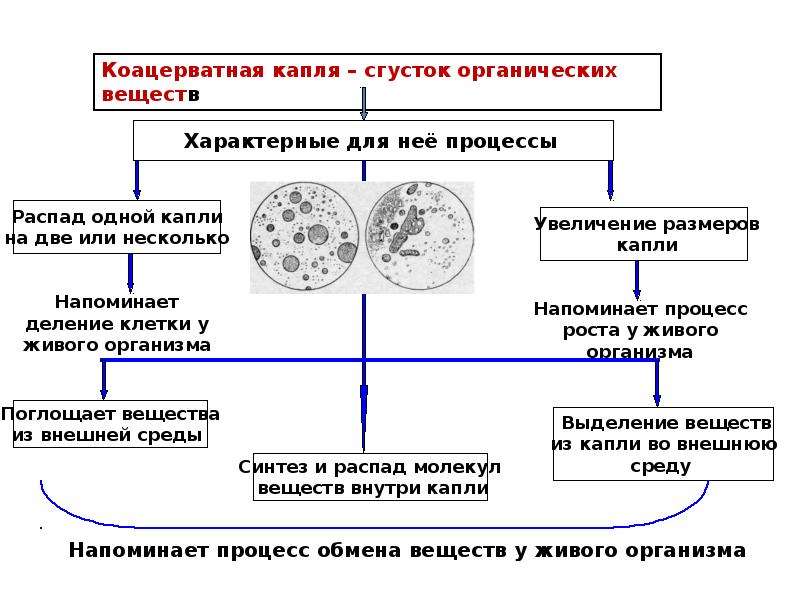 см. Эти сгустки называются коацерватными
каплями, или
коацерватами
. Вокруг капель имеется граница раздела, хорошо видимая в микроскоп.
Коацерваты способны адсорбировать различные вещества. В них осмотически
могут поступать из окружающей среды химические соединения и идти синтез
новых соединений. Под действием механических сил коацерватные капли
дробятся. Но коацерваты — еще не живые существа. Это лишь простейшие модели
пробионтов, проявляющие лишь внешнее сходство с такими свойствами живого,
как рост и обмен веществ с окружающей средой.
см. Эти сгустки называются коацерватными
каплями, или
коацерватами
. Вокруг капель имеется граница раздела, хорошо видимая в микроскоп.
Коацерваты способны адсорбировать различные вещества. В них осмотически
могут поступать из окружающей среды химические соединения и идти синтез
новых соединений. Под действием механических сил коацерватные капли
дробятся. Но коацерваты — еще не живые существа. Это лишь простейшие модели
пробионтов, проявляющие лишь внешнее сходство с такими свойствами живого,
как рост и обмен веществ с окружающей средой.
Особое значение в эволюции пробионтов сыграло формирование каталитических
систем. Первыми катализаторами были простейшие соединения, соли железа,
меди, других тяжелых металлов, но их действие было очень слабым. Постепенно
на основе предбиологического отбора эволюционно формировались биологические
катализаторы. Из огромного количества химических соединений, присутствующих
в «первичном бульоне», отбирались наиболее эффективные в
каталитическом отношении комбинации молекул.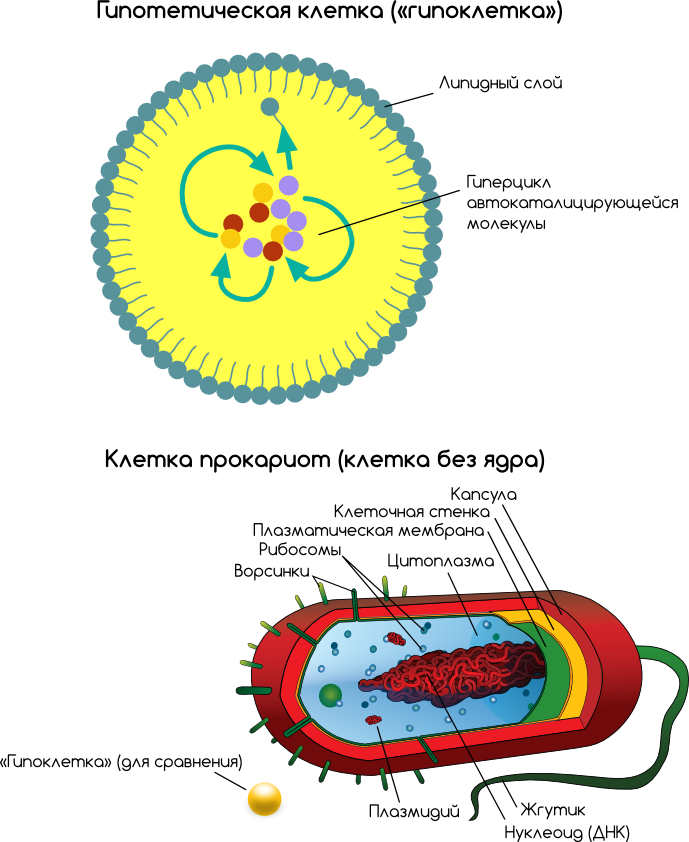
Подлинное начало биологической эволюции ознаменовано возникновением
нробионтов с кодовыми отношениями между белками и нуклеиновыми кислотами.
Взаимодействие белков и нуклеиновых кислот обусловило возникновение таких
свойств живого, как самовоспроизведение, сохранение наследственной
информации и ее передача последующим поколениям. Вероятно, на более ранних
этапах преджизни существовали независимые друг от друга молекулярные
системы полипептидов и полинуклеидов с весьма несовершенным обменом веществ
и механизмом самовоспроизведения. Огромный шаг вперед был сделан именно в
тот момент, когда произошло их объединение: способность к
самовоспроизводству нуклеиновых кислот дополнилась каталитической
активностью белков. Пробионты, в которых обмен веществ сочетался со
способностью к самовоспроизведению, имели наилучшую перспективу сохраниться
в предбиологическом отборе.
Кроме теории Опарина, существует теория, согласно которой жизнь началась с возникновения самовоспроизводящихся молекул нуклеиновых кислот. Следующим этапом было установление связей между ДНК и РНК и способность РНК синтезироваться на матрице ДНК. Установление связи ДНК и РНК с возникшими в результате абиогенного синтеза молекулами белков есть третий этап эволюции жизни.
появлении асимметрии живых организмов ,
возникновении и эволюции каталитической активности и
возникновении матричного синтеза .
Ссылки:
3.2. Возникновение генетического кода. Коацерваты и пробионты. Дальнейшее развитие жизни.
Наибольшее
признание и распространение в XX столетии
получила гипотеза происхождения жизни
на Земле, предложенная известным
отечественным биохимиком академиком
А. И. Опариным (1894-1980) и английским
биохимиком Дж. Холдёйном (1892-1964). Суть
их гипотезы, сформулированной ими
независимо друг от друга в 1924-1928 гг. и
развиваемой в последующее время, сводится
к существованию на Земле продолжительного
периода абиогенного образования большого
числа органических соединений. Данные
органические вещества насыщали воды
древнейших океанов, сформировав (по
представлениям Дж. Холдейна) так
называемый «первичный бульон».
Впоследствии в силу многочисленных
процессов локальных обмелений и иссушений
океанов концентрация «первичного
бульона» могла возрастать в десятки и
сотни раз. Эти процессы происходили на
фоне интенсивной вулканической
активности, частых грозовых разрядов
в атмосфере и мощного космического
излучения. В этих условиях могло
происходить постепенное усложнение
молекул органических веществ, появление
простых белков, полисахаридов, липидов,
нуклеиновых кислот. На протяжении многих
сотен и тысяч лет они могли образовать
сгустки органических веществ (коацерваты).
И. Опариным (1894-1980) и английским
биохимиком Дж. Холдёйном (1892-1964). Суть
их гипотезы, сформулированной ими
независимо друг от друга в 1924-1928 гг. и
развиваемой в последующее время, сводится
к существованию на Земле продолжительного
периода абиогенного образования большого
числа органических соединений. Данные
органические вещества насыщали воды
древнейших океанов, сформировав (по
представлениям Дж. Холдейна) так
называемый «первичный бульон».
Впоследствии в силу многочисленных
процессов локальных обмелений и иссушений
океанов концентрация «первичного
бульона» могла возрастать в десятки и
сотни раз. Эти процессы происходили на
фоне интенсивной вулканической
активности, частых грозовых разрядов
в атмосфере и мощного космического
излучения. В этих условиях могло
происходить постепенное усложнение
молекул органических веществ, появление
простых белков, полисахаридов, липидов,
нуклеиновых кислот. На протяжении многих
сотен и тысяч лет они могли образовать
сгустки органических веществ (коацерваты).
1) абиогенное возникновение органических мономеров;
2) формирование биологических полимеров;
3) развитие мембранных структур и первых организмов.
Этап полимеризации органических мономеров.
Значительная
часть образующихся мономеров разрушалась
под действием высоких температур и
многочисленных химических реакций,
происходивших в «первичном бульоне».
Летучие соединения переходили в атмосферу
и практически исчезали из водоемов.
Периодическое подсыхание водоемов
приводило к многократному увеличению
концентрации растворенных органических
соединений.

Формирование коацерватов.
Следующим
этапом в происхождении жизни стало
образовывание коацерватов, то есть
больших скоплений сложных органических
полимеров. Причины и механизмы этого
явления во многом еще не ясны. Коацерваты
этого периода представляли еще
механическую смесь органических
соединений, лишенную каких-либо признаков
жизни. В какой-то период времени между
молекулами РНК и пептидами возникли
связи, напоминающие реакции матричного
синтеза белка. Однако до сих пор непонятно,
каким образом РНК стала кодировать
синтез пептидов. Позже появились молекулы
ДНК, которые в силу наличия двух спиралей
и возможности к более точному (по
сравнению с РНК) самокопированию
(репликации) стали главными носителями
информации о синтезе пептидов, передавая
эту информацию на РНК. Такие системы
(коацерваты) уже напоминали живые
организмы, однако еще не являлись
таковыми, так как не имели упорядоченной
внутренней структуры, присущей живым
организмам, и не были способны размножаться. Ведь определенные реакции синтеза
пептидов могут происходить и в неклеточных
гомогенатах.
Ведь определенные реакции синтеза
пептидов могут происходить и в неклеточных
гомогенатах.
Появление биологических мембран.
Упорядоченные биологические структуры невозможны без биологических мембран. Поэтому следующим этапом в образовании жизни стало формирование именно этих структур, изолирующих и защищающих коацерваты от окружающей среды, превращающих их в автономные образования. Мембраны могли образоваться из липидных пленок, появлявшихся на поверхности водоемов. К молекулам липидов могли присоединяться пептиды, приносимые дождевыми потоками в водоемы или образовавшиеся в этих водоемах. При волнении водоемов или выпадении на их поверхность осадков могли возникать пузырьки, окруженные мембраноподобными соединениями. Для возникновения и эволюции жизни важны были те пузырьки, которые окружали коацерваты с белково-нуклеидными комплексами. Но и такие образования еще не были живыми организмами.
Возникновение
пробионтов — первых самовоспроизводящихся
организмов.
В живые организмы могли превратиться только те коацерваты, которые были способны к саморегуляции и самовоспроизводству. Каким образом эти способности возникли — также пока неясно. Биологические мембраны обеспечили автономность и защиту коацерватам, что способствовало появлению существенной упорядоченности биохимических реакций, протекающих в этих телах. Следующим шагом стало появление самовоспроизводства, когда нуклеиновые кислоты (ДНК и/или РНК) стали не только обеспечивать синтез пептидов, но и с его помощью регулировать процессы самовоспроизводства и обмена веществ. Так возникла клеточная структура, обладающая обменом веществ и способностью к самовоспроизводству. Именно эти формы и смогли сохраниться в процессе естественного отбора. Так коацерваты превратились в первые живые организмы — пробионты.
Закончился
этап химической эволюции, и наступил
этап биологической эволюции уже живой
материи. Произошло это 3,5-3,8 млрд. лет
назад. Появление живой клетки — это
первый крупнейший ароморфоз в эволюции
органического мира. Первые живые
организмы были близки по строению к
прокариотам, не имели еще прочной
клеточной стенки и каких-то внутриклеточных
структур (были покрыты биологической
мембраной, внутренние изгибы которой
выполняли функции клеточных структур).
Возможно, первые пробионты имели
наследственный материал, представленный
РНК, а геномы с ДНК появились позже в
процессе эволюции. Существует мнение,
что дальнейшая эволюция жизни пошла от
общего предка, от которого произошли
первые прокариоты. Именно это обеспечило
большое сходство строения всех прокариот,
а впоследствии и эукариот.
Первые живые
организмы были близки по строению к
прокариотам, не имели еще прочной
клеточной стенки и каких-то внутриклеточных
структур (были покрыты биологической
мембраной, внутренние изгибы которой
выполняли функции клеточных структур).
Возможно, первые пробионты имели
наследственный материал, представленный
РНК, а геномы с ДНК появились позже в
процессе эволюции. Существует мнение,
что дальнейшая эволюция жизни пошла от
общего предка, от которого произошли
первые прокариоты. Именно это обеспечило
большое сходство строения всех прокариот,
а впоследствии и эукариот.
Теории происхождения жизни на Земле
Вопрос о возникновении жизни на Земле всегда волновал человечество. Строились всякие, в том числе и фантастические, гипотезы. Вплоть до XIX века бытовало представление о том, что живые существа могут появиться в гнилом мясе, в сенной настойке, в мясном бульоне.
Исследования Л. Пастера доказали ложность таких представлений. На основе опытов по пастеризации (обработка продуктов высокой температурой для предотвращения попадания извне спор микроорганизмов) он показал, что никаких организмов ни в бульонах, ни в других питательных средах не появляется.
В настоящее время доказано, что абиогенным путем жизнь на Земле в современных условиях возникнуть не может.
Ложным, не выдерживающим никакой критики, является представление о божественном происхождении жизни на Земле.
Идеи о занесении жизни на Землю из Космоса маловероятны и не подтверждаются анализом тел, попадающих на Землю из космического пространства.
Современные представления о происхождении жизни на Земле наиболее полно отражает гипотеза А. И. Опарина и Дж. Б. С. Холдейна, разработанная в 1924-1927 гг. Сущность этой гипотезы такова.
Жизнь на Земле возникла на соответствующем этапе развития планеты Земля в архейской эре. Более 6 млрд. лет назад Земля находилась в звездной стадии развития, которая постепенно перешла в планетную. Температура Земли постепенно снижалась, произошло перераспределение атомов химических элементов. Атомы тяжелых элементов переместились к центру планеты, а атомы легких — остались на поверхности.
Снижение температуры способствовало протеканию химических реакций с образованием бинарных соединений (состоят из двух химических элементов). Образовались вода, аммиак, оксиды углерода и другие вещества.
Образовались вода, аммиак, оксиды углерода и другие вещества.
Когда на поверхности Земли температура стала меньше 100 °С, вода стала конденсироваться и возникли гигантские горячие водоемы, т. е. первичный океан, наполненный горячей водой.
В первичном океане, в его горячей воде стали протекать разнообразные химические реакции, сопровождающиеся возникновением сложных неорганических и органических веществ, между которыми, в свою очередь, происходили химические взаимодействия. Подобные процессы были возможны еще и потому, что до поверхности Земли свободно доходили космические излучения с большой энергией.
Простые органические вещества постепенно усложнялись, что привело к возникновению жиров, углеводов, белков и нуклеиновых кислот. Эти органические вещества концентрировались в определенных местах водного пространства и образовывали коацерваты.
Коацерваты — открытые системы, способные к обмену веществ с окружающей средой, а также к росту.
В процессе длительного исторического развития из коацерватов возникли пробионты.
Пробионты — протоклетки, способные к самовоспроизведению, т. е. первичные организмы.
Возникновение пробионтов означает качественный переход, когда химическая эволюция перешла в биологическую.
Пробионты были гетеротрофными организмами, так как их жизнедеятельность осуществлялась за счет энергии, заключенной в органических веществах, поступающих в пробионт извне. Таких веществ в окружающей среде было немного, и это привело к возникновению автотрофного питания у некоторых из первичных организмов.
Автотрофное питание осуществлялось либо хемосинтетически, либо фотосинтетически. Фотосинтетический способ питания оказался наиболее перспективным, так как позволил усваивать солнечную энергию и привел к возникновению на Земле окислительной атмосферы. Окислительная атмосфера способствовала возникновению аэробных организмов. В результате первичных эволюционных процессов возникла жизнь на Земле, которая на том этапе представляла собой совокупность простейших одноклеточных или неклеточных организмов, способных и к автотрофному, и к гетеротрофному питанию. Гетеротрофное питание могло осуществляться как сапрофитно, так и паразитно. Среди первичных организмов были и аэробные, и анаэробные формы.
Гетеротрофное питание могло осуществляться как сапрофитно, так и паразитно. Среди первичных организмов были и аэробные, и анаэробные формы.
К концу архейской эры на Земле возникли предклеточные и предъядерные организмы — бактерии и сине-зеленые водоросли, а также возможно и вирусы.
В настоящее время теория происхождения жизни на Земле, созданная А. И. Опариным, стала фундаментом разработки космохимических исследований и поиска жизни во Вселенной. Кстати, моделирование предполагаемых условий, в которых протекала химическая эволюция соединений и проведение соответствующих процессов, показывает правильность идей о возможном ходе развития процессов возникновения жизни.
Теорию А. И. Опарина можно сформулировать в виде следующих постулатов.
1. Жизнь является одной из стадий эволюции Вселенной.
2. Возникновение жизни есть результат химической эволюции соединений углерода.
3. Для перехода от химической эволюции к биологической необходимы формирование целостных многомолекулярных систем и их естественный отбор.
Существуют альтернативные гипотезы происхождения жизни, отрицающие третий постулат данной теории. Взамен его выдвигают либо случайность, либо предопределенность возникновения первичной жизни. Так, шведский цитогенетик Лима-де-Фария отвергает роль биологического отбора. Такая крайность вряд ли может быть обоснована, так как объективные наблюдения и практическая деятельность человека доказывают обратное. Поэтому на современном этапе развития цивилизации теория происхождения жизни на Земле, выдвинутая А. И. Опариным, является наиболее приемлемой и объективной.
определение и синонимы слова Probiont в словаре немецкий языка
ЭТИМОЛОГИЯ СЛОВА PROBIONT
griechisch-neulateinisch.
ПРОИЗНОШЕНИЕ СЛОВА PROBIONT
ГРАММАТИЧЕСКАЯ КАТЕГОРИЯ СЛОВА PROBIONT
существительное
прилагательное
ЧТО ОЗНАЧАЕТ СЛОВО PROBIONT
Нажмите, чтобы посмотреть исходное определение слова «Probiont» в словаре немецкий языка.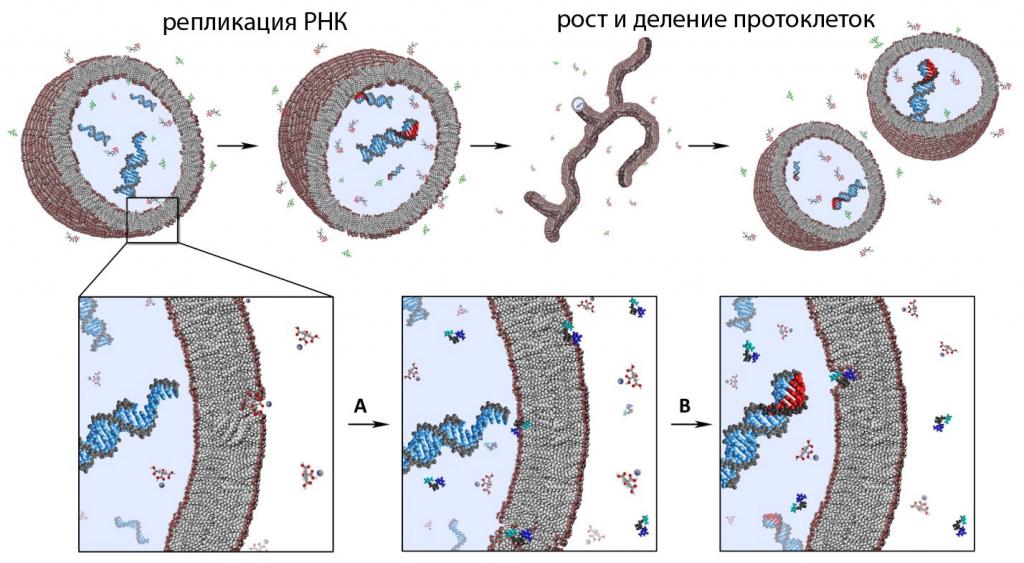 Нажмите, чтобы посмотреть автоматический перевод определения на русский языке.
Нажмите, чтобы посмотреть автоматический перевод определения на русский языке.Значение слова Probiont в словаре немецкий языка
примитивный предшественник высших форм жизни. primitiver Vorläufer höherer Lebensformen.
Нажмите, чтобы посмотреть исходное определение слова «Probiont» в словаре немецкий языка. Нажмите, чтобы посмотреть автоматический перевод определения на русский языке.
СЛОВА, РИФМУЮЩИЕСЯ СО СЛОВОМ PROBIONT
Aerobiọnt [aeroˈbi̯ɔnt]
stenoxybiọnt [ʃt…] , [st…]
Синонимы и антонимы слова Probiont в словаре немецкий языка
ПЕРЕВОД СЛОВА PROBIONT
Посмотрите перевод слова Probiont на 25 языков с помощью нашего многоязыкового переводчика c немецкий языка. Переводы слова Probiont с немецкий языка на другие языки, представленные в этом разделе, были выполнены с помощью автоматического перевода, в котором главным элементом перевода является слово «Probiont» на немецкий языке.
Переводы слова Probiont с немецкий языка на другие языки, представленные в этом разделе, были выполнены с помощью автоматического перевода, в котором главным элементом перевода является слово «Probiont» на немецкий языке.Переводчик с немецкий языка на
китайский язык Probiont1,325 миллионов дикторов
Переводчик с немецкий языка на
испанский язык Probiont570 миллионов дикторов
Переводчик с немецкий языка на
английский язык Probiont510 миллионов дикторов
Переводчик с немецкий языка на
хинди язык Probiont380 миллионов дикторов
Переводчик с немецкий языка на
арабский язык Probiont280 миллионов дикторов
Переводчик с немецкий языка на
русский язык Probiont278 миллионов дикторов
Переводчик с немецкий языка на
португальский язык Probiont270 миллионов дикторов
Переводчик с немецкий языка на
бенгальский язык Probiont260 миллионов дикторов
Переводчик с немецкий языка на
французский язык Probiont220 миллионов дикторов
Переводчик с немецкий языка на
малайский язык Probiont190 миллионов дикторов
немецкий Probiont
180 миллионов дикторов
Переводчик с немецкий языка на
японский язык Probiont130 миллионов дикторов
Переводчик с немецкий языка на
корейский язык Probiont85 миллионов дикторов
Переводчик с немецкий языка на
яванский язык Probiont85 миллионов дикторов
Переводчик с немецкий языка на
вьетнамский язык Probiont80 миллионов дикторов
Переводчик с немецкий языка на
тамильский язык Probiont75 миллионов дикторов
Переводчик с немецкий языка на
маратхи язык Probiont75 миллионов дикторов
Переводчик с немецкий языка на
турецкий язык Probiont70 миллионов дикторов
Переводчик с немецкий языка на
итальянский язык Probiont65 миллионов дикторов
Переводчик с немецкий языка на
польский язык Probiont50 миллионов дикторов
Переводчик с немецкий языка на
украинский язык Probiont40 миллионов дикторов
Переводчик с немецкий языка на
румынский язык Probiont30 миллионов дикторов
Переводчик с немецкий языка на
греческий язык Probiont15 миллионов дикторов
Переводчик с немецкий языка на
африкаанс язык Probiont14 миллионов дикторов
Переводчик с немецкий языка на
шведский язык Probiont10 миллионов дикторов
Переводчик с немецкий языка на
норвежский язык Probiont5 миллионов дикторов
ТЕНДЕНЦИИ ИСПОЛЬЗОВАНИЯ ТЕРМИНА «PROBIONT»
ЧАСТОТНОСТЬ
Слово используется редко
На показанной выше карте показана частотность использования термина «Probiont» в разных странах. Тенденции основных поисковых запросов и примеры использования слова Probiont Список основных поисковых запросов, которые пользователи ввели для доступа к нашему онлайн-словарю немецкий языка и наиболее часто используемые выражения со словом «Probiont».
Тенденции основных поисковых запросов и примеры использования слова Probiont Список основных поисковых запросов, которые пользователи ввели для доступа к нашему онлайн-словарю немецкий языка и наиболее часто используемые выражения со словом «Probiont».
Примеры использования в литературе на немецкий языке, цитаты и новости о слове Probiont
КНИГИ НА НЕМЕЦКИЙ ЯЗЫКЕ, ИМЕЮЩЕЕ ОТНОШЕНИЕ К СЛОВУ
«PROBIONT» Поиск случаев использования слова Probiont в следующих библиографических источниках. Книги, относящиеся к слову Probiont, и краткие выдержки из этих книг для получения представления о контексте использования этого слова в литературе на немецкий языке.1
Vom Neukantianismus zur Ontologie Aus Atomen setzt sich das Molekül, aus Molekülen (wahrscheinlich komplexester
Art) der Probiont zusammen, dem Roux bereits Assimilation und Regulation
zuschreibt. Der nächste Schritt aufwärts ergibt schon das erste Individuum, den …
Der nächste Schritt aufwärts ergibt schon das erste Individuum, den …
2
Biologie macchiato: Cartoon-Biologiekurs für Schüler und …… Phagozytose 33 Sekundärantwort 136 Phänotyp 41 semikonservative Replikation 87 Phylogenese 193 Silencer 110 pingpongartig 28 Sinneseindruck 144 Pinocytose 33 Sonnenpflanze 173 Population 182ff Soziobiologie 160 Probiont 196 …
Norbert Waldemar Hopf, 2009
3
«Scientia,»: Rivista di scientia. Organo internazionale di …Gradual complication of the probiont metabolism demanded, however, very accurate combination of a large number of metabolic reactions to a coordinated network of biochemical processes. Low catalytic activity and specificity of the …
4
Zentralblatt für Bakteriologie und Parasitenkunde . .. Bioblast, Probiont, Phaisoma, Mitochondria, Plastide. Bacterium bezeichnet
wurde, mit dem umfassenderen Namen Chthonoblast, Erdbildner. Xarhdruvk wer
/‚01a ‚ Zur Erwiderung von Dr. Max Münden. Herr Erwiderung auf die Arbeit über
…
.. Bioblast, Probiont, Phaisoma, Mitochondria, Plastide. Bacterium bezeichnet
wurde, mit dem umfassenderen Namen Chthonoblast, Erdbildner. Xarhdruvk wer
/‚01a ‚ Zur Erwiderung von Dr. Max Münden. Herr Erwiderung auf die Arbeit über
…
5
Zeitschrift für den Ausbau der Entwickslungslehre… welches bisher je nachdem Granulum, Cytoblast, Bioblast, Probiont, Phaisoma , Bakterium etc. bezeichnet wurde, mit dem umfassenderen Namen Chthonoblast (Erdbildner). Es gibt natürlich sehr verschiedenartige Chthonoblasten, welche …
6
Centralblatt für Bakteriologie, Parasitenkunde und … … Bioblast, Probiont, Phaisoma, Mitochondria, Plastide, Bacterium bezeichnet
wurde, mit dem umfassenderen Namen Chthonoblast, Erdbildner. Nachdruck
verbalen. Zur Erwiderung von Dr. Max Münden. Herr Mün Erwiderung auf die
Arbeit . ..
..
7
Archiv für Entwicklungsmechanik der OrganismenProbiont usw. bezeichnet wurde, mit dem umfassenderen Namen Chtonoblast ( Krdbildner). Es gibt natürlich sehr verschiedenartige Chtonoblasten, welche eben durch ihre Differenzen die Vielgestaltigkeit der organischen und mineralischen …
8
Zeitschrift für den Ausbau der Entwicklungslehre,…… welches bisher je nachdem Granulum, Cytoblast, Bioblast, Probiont, Phaisoma , Bakterium etc. bezeichnet wurde, mit dem umfassenderen Namen Chthonoblast (Erdbildner). Es gibt natürlich sehr verschiedenartige Chthonobiasten, welche …
9
Jahresberichte über die Fortschritte der Anatomie und … … welches bisher je nachdem Granulum, Cytoblast, Bioblast, Probiont, Phaisoma
, Mitochondria, Plastide, Bacterium bezeichnet wurde, mit dem umfassenden
Namen Erdbildner“. Inhaltsangabe seines Buches und Darstellung seines
Systems …
Inhaltsangabe seines Buches und Darstellung seines
Systems …
10
Zentralblatt für Bakteriologie, Parasitenkunde und …… so benannte ich dieses, welches bisher, je nachdem Granulum, Cytoblast, Bioblast, Probiont, Phaisoma, Mitochondria, Plastide, Bacterium bezeichnet wurde, mit dem umfassenderen Namen Chthono- blast, Erdbildner. Nachdruck verhola.
Тест с ответами: “Возникновение жизни”
1. Что такое пробионты:
а) примитивные формы жизни +
б) углеродные соединения
в) сформировавшаяся клетка
2. Согласно теории Опарина, из чего возникли пробионты:
а) из неорганических соединений
б) из биополимеров +
в) из простых органических соединений
3. Как называются собранные вместе органические вещества, отделившиеся от внешней среды и поддерживающие с ней обмен веществ:
а) коагулянты
б) аминокислоты
в) коацерваты +
4. Кто впервые ввёл понятие коацерватов:
Кто впервые ввёл понятие коацерватов:
а) Опарин +
б) Миллер
в) Холдейн
5. В каком году была сформулирована гипотеза о происхождении жизни из неживой материи:
а) 1929
б) 1979
в) 1924 +
6. Кто считал, что первыми образованными веществами были нуклеиновые кислоты:
а) Миллер
б) Холдейн +
в) Докинз
7. Какие вещества были обнаружены в колбе после эксперимента по воссозданию условий Земли:
а) водород
б) аммиак
в) сахара +
8. Что такое «первичный бульон»:
а) раствор биополимеров +
б) раствор нуклеиновых кислот
в) раствор неорганических соединений
9. Какое условие способствовало возникновению органических веществ:
а) бескислородная атмосфера Земли +
б) вулканы
в) отсутствие водорода
10. Какое условие способствовало возникновению органических веществ:
а) углерод
б) разряды молний +
в) отсутствие водорода
11. Какое условие способствовало возникновению органических веществ:
а) ультрафиолет +
б) вулканы
в) углерод
12. Кто экспериментально воссоздал условия Земли до появления жизни:
Кто экспериментально воссоздал условия Земли до появления жизни:
а) Докинз
б) Милле +
в) Холдейн
13. Из каких элементов состоит атом водорода:
а) из одного протона и одного электрона +
б) из трех протонов и двух электронов
в) из двух протонов
14. С чем связано возникновение звезд:
а) эволюцией солнечной системы
б) эволюцией звезд
в) эволюцией межзвездной пыли +
15. Простой элемент, широко распространенный в космическом пространстве:
а) водород +
б) углерод
в) гелий
16. Когда сформировалась Земля:
а) 5-6 млрд.лет назад
б) 4,5-5 млрд.лет назад +
в) 2,5-3 млрд.лет назад
17. Креоционизм-это:
а) возникновение жизни из живого
б) теория эволюции
в) божественное начало жизни +
18. Теория вечной жизни появилась при проведении опытов:
а) Реди
б) Пастера +
в) Опарина
19. Основатель экспериментальной физиологии и эмбриологии, изучивший систему кровообращения, врач, известный английский ученый:
а) Опарин
б) Аррениус
в) Гарвей +
20. Кто сформулировал знаменитую «теорию катастроф»:
Кто сформулировал знаменитую «теорию катастроф»:
а) Аррениус
б) Кювье +
в) Опарин
21. В чем заключается суть абиогенеза:
а) живое возникает из неживого +
б) инопланетное происхождение
в) живое возникает из живого
22. Чем является ультрафиолетовый свет в период возникновения жизни на Земле:
а) источником образования метана
б) источник энергии для синтеза органических веществ +
в) атмосферой
23. Как переводится понятие «креоционизм»:
а) «получение»
б) «вымирание»
в) «сотворение» +
24. Коацерват-это:
а) белок
б) сгусток из органических веществ +
в) живое существо
25. «Теория вечной жизни» открыл:
а) Опарин
б) Аррениус
в) Пастер +
26. Что определяет температуру звезды:
а) количество пыли
б) цвет +
в) поверхность
27. Результатом какой деятельности является наличие свободного кислорода в атмосфере:
а) фотосинтезирующей +
б) благодаря испарению
в) газовой
28. Как называется наибольшая единица геологического летоисчисления:
Как называется наибольшая единица геологического летоисчисления:
а) период
б) век
в) эра +
29. Когда на Земле появились первые живые организмы:
а) на границе между катархеем и археем +
б) на границе между археем и протерозоем
в) в катархее
30. Какие животные первыми освоили сушу:
а) черепахи
б) ракоскорпионы +
в) крокодилы
«Теория биопоэза»
Теория биопоэза
Биопоэз – это процесс возникновения живого из неживого в эволюции Земли.
Этапы возникновения жизни на Земле
- Абиогенный синтез органических соединений из неорганических
- Образование из органических мономеров биологических полимеров
- Формирование из биологических полимеров мембран и первых одноклеточных организмов – пробионтов.
1947 год Джон Бернал сформулировал теорию биопоэза.
Этапы неорганической эволюции
Стадии:
- Планетарная (геологическая) эволюция
- Химическая эволюция 1 млрд.
 лет
лет
Планетарная эволюция
Земля образовалась из газопылевого облака
около 5 млрд. лет назад , в состав которого входили атомы водорода и гелия.
в ходе термоядерных реакций сформировалась первичная атмосфера , в состав которой входили:
- Метан
- Аммиак
- Угарный газ
- Водород
- Пары воды
Химическая эволюция.
1 этап: Абиогенный синтез органических веществ
ФИО ученого
Год
Жак Лёб
Открытие
1912
Александ Иванович Опарин
Впервые получил аминокислоту глицин из смеси нагретых газов и электрических разрядов.
1924
Джон Холдейн
Стенли Миллер и
Выдвинул коацерватную гипотезу
1929
Сформулировал гипотезу первичного бульона. Первые органические вещества синтезировались из неорганических за счет солнечной радиации.
Гарольд Юри
1953
Т. Е. Павловская и А.Г.Пасынский
Е. Павловская и А.Г.Пасынский
Получили экспериментальные доказательства выдвинутых ранее гипотез. Сконструировали установку, в которой воспроизвели условия на древней Земле.
1957
Повторили опыт Миллера, заменив в газовой смеси водород на оксид углерода и использовали вместо электрических разрядов УФ излучение. В результате получили в смеси аминокислоты.
Опыт Стенли Миллера
Условия эксперимента:
- Газы: метан, аммиак, водород, пары воды
- Температура 80 °С
- Электрический разряд 60 000 В
Результат:
- Мочевина
- Молочная кислота
- Аминокислоты
2 этап: Образование полимеров из мономеров
По мнению А.И. Опарина полимеризация происходила за счет
коацервации – самопроизвольного разделения водного раствора мономеров на фазы с различной концентрацией.
Химическая эволюция шла в направлении: РНК белок;
РНК ДНК и-РНК белок
3 этап: Формирование мембран и возникновение пробионтов.
Пробионты – это молекулы РНК, окруженные белково-липидными мембранами. Не способны к обмену веществ.
В 1977 году в океанических желобах были обнаружены разломы «черные курильщики»:
- Глубина несколько тысяч метров
- Давление несколько сотен атмосфер
- Температура 300 °С
- Выделяют газы
Начало органической эволюции
Эволюция первых клеток
3,8 — 3,5 млрд. лет назад – появились первые доядерные организмы.
Формирование надцарств организмов
Надцарство Прокариоты
В настоящее время прокариоты представлены одноклеточными формами, принадлежащими к царству Дробянки.
Надцарство Эукариоты
Царства:
- Растения
- Животные
- Грибы
Ароморфозы:
- Ядро
- Органоиды
- Митоз
- Половой процесс
- Мейоз
- Многоклеточность
- Дифференцировка (специализация) клето к
Неклеточная форма жизни
Вирусы (от лат. Virus – яд) – организмы, сочетающие в себе признаки живой и неживой природы.
Virus – яд) – организмы, сочетающие в себе признаки живой и неживой природы.
- Обладают наследственность и изменчивостью
- Не способны к обмену веществ
- Не способны к самовоспроизведению
Основные этапы эволюции растительного мира
Первые растения — водоросли
- Произошли от древнейших прокариот – цианобактерий
- В жизненном цикле разделение на два поколения: бесполое (спорофит) и половое (гаметофит)
Лишайник – симбиоз гриба и водоросли (хлорелла)
Хлорококк
Красное «цветение» снега
Выход растений на сушу.
Первые споровые растения.
Необходимые условия:
- Почвообразование
- Накопление в атмосфере молекулярного кислорода
- Формирование озонового экрана
- Дифференцировка клеток и появление тканей.
Предковая форма зеленых водорослей
Риниофиты
Мхи
1. Занимали промежуточное положение между водорослями и наземными растениями.
Занимали промежуточное положение между водорослями и наземными растениями.
2. Появились покровная и проводящая ткани.
3. В жизненном цикле преобладал спорофит .
4. Появились ткани и органы.
5. Появились ризоиды.
- В жизненном цикле преобладает гаметофит.
- Для оплодотворения необходима вода.
- Нет проводящих тканей – приобрели свойство – гигроскопичность.
- Развитие специальных листьев – филлоидов.
- Произрастают только во влажных местах.
Псилофиты
Освоение и завоевание суши. Папоротникообразные.
- Неправильная форма побегов во много раз увеличила площадь поглощения солнечных лучей и углекислого газа
- Ризоиды и корни стали не только удерживать растения в почве, но и обеспечивать всасывание воды и минеральных веществ.
- В жизненном цикле преобладает спорофит.
Ароморфозы:
Семенные растения
- Преобразование женского спорангия в семязачаток, а мужского – в пыльцевые гнезда.

- Женский гаметофит представлен архегониями с яйцеклетками, а мужской – пыльцевыми зернами.
3.Половые клетки стали формироваться во внутренних тканях растений, вода утратила свою роль в оплодотворении
4. Размножение семенами, хорошо защищенными покровами и запасом питательных веществ.
Семенные папоротники
Ароморфозы цветковых:
1. Появление и развитие цветка, образующего мега- и микроспоры.
2. Развитие плода — органа, обеспечивающего защиту семян и их распространение.
Покрытосеменные
(Цветковые)
Голосеменные
Основные черты эволюции растительного мира
- Переход растений при размножении от гаплоидности к диплоидности. Редукция в жизненном цикле гаплоидного полового поколения (гаметофита) и преобладание спорофита.
- Переход растений от наружного оплодотворения к внутреннему и утрата зависимости полового размножения от наличия свободной воды.

- Разделение тела растения на корни, стебли и листья . Дифференцировка тканей.
- Приспособления семенных растений к разным способам опыления, распространения семян и плодов.
Основные этапы эволюции животного мира
Первые животные – простейшие.
Специализация и полимеризация органелл.
Предки всех животных – простейшие жгутиконосцы. Схожи с древними одноклеточными водорослями.
Простейшие – сложноорганизованные организмы, в которых находятся органеллы, аналогичные органам многоклеточных животных.
Специализация клеток.
Первые многоклеточные животные.
Пластинчатое животное — трихоплакс
Двухслойные животные – кишечнополостные
- Тело состоит из двух слоев клеток: наружного (эктодерма) и внутреннего (энтодерма)
- Ротовое отверстие ведет в гастральную полость .
 Окружено ловчими щупальцами со стрекательными клетками.
Окружено ловчими щупальцами со стрекательными клетками. - Нервная система диффузного (сетчатого) типа
- Лучевая симметрия.
- Отсутствие мускулатуры (только мышечные волоконца в клетках).
- Малоподвижный или прикрепленный образ жизни.
Первые трехслойные животные – плоские черви.
Ароморфозы:
- Промежуточный зародышевый листок – мезодерма.
- Двусторонняя (билатеральная) симметрия тела.
- Дифференциация переднего и заднего конца тела.
- Подвижность и хищный образ жизни
- Появление органов чувств – усложнение нервной системы.
- Разделение тела на брюшную и спинную стороны.
- Освоили водную, наземную среду обитания. Некоторые перешли к паразитическому образу жизни.
Цикл развития печеночного сосальщика.
Первый выход и завоевание животными суши.
Членистоногие.
Ароморфозы насекомых:
- Членение конечностей
- Развитие сложного ротового аппарата
- Появление крыльев
- Трахейное дыхание
- Социальные формы поведения
«-» Хитиновый покров препятствовал увеличению размеров тела
Ароморфозы:
- Развитие конечностей
- Хитиновый покров
Классы:
- Ракообразные
- Многоножки
- Паукообразные
- Насекомые
Ароморфозы:
- Появление внутреннего скелета
- Произошли от бесчелюстных рыб.

- Первая пара жаберных дуг преобразовалась в подвижные челюсти.
- Из кожных складок образовались плавники
Первые хордовые животные. Жизнь в воде. Рыбы.
Надкласс рыбы:
- Класс Хрящевые рыбы
- Класс Костные рыбы
Второй выход животных на сушу. Земноводные.
Отряды:
- Бесхвостые
- Хвостатые
- Безногие
Эволюционные приобретения земноводных:
- Легкие
- Трехкамерное сердце
- Два круга кровообращения
- Пятипалая конечность
- Развились подвижные суставы
«-» Развитие зависит от воды, не смогли широко освоить наземно-воздушную среду.
Ароморфозы:
- Развитие легких
- Парные конечности наземного типа
Завоевание суши. Пресмыкающиеся. Птицы. Млекопитающие.
Ароморфозы пресмыкающихся:
- Появление амниотического яйца.

- Развитие роговых чешуй, защищающих тело от обезвоживания.
- Появляются зачаточные лобные доли полушарий.
Отряды:
- Чешуйчатые (Змеи, ящерицы, хамелеоны)
- Черепахи
- Крокодилы
- Клювоголовые
Амниотическое яйцо – яйцеклетка, окруженная зародышевыми оболочками:
- Внутренняя оболочка (амнион) – заполнена жидкостью.
- Желточная – обеспечивает питание зародыша.
- Аллантоис – зародышевый мочевой пузырь, в который выделяются конечные продукты обмена веществ зародыша.
- Все три оболочки снаружи покрыты тонкой пленкой – хорионом , выстилает изнутри скорлупу, обеспечивает зародыша кислородом.
Ароморфозы птиц и млекопитающих:
- Теплокровность.
- Четырехкамерное сердце.
- Развитые легкие.
- Перьевой и волосяной покров.
- Развитые большие полушария головного мозга.
- Сложное поведение :
- Забота о потомстве.

- Способность к обучению.
- Социализация.
Основные черты эволюции
животного мира:
- Прогрессивное развитие многоклеточности, обеспечившей специализацию тканей, появление отдельных органов и их систем.
- Возникновение твердого наружного или внутреннего скелета, служащего для опоры тела и защиты внутренних органов.
- Развитие нервной системы и усложнение поведения, что способствовало быстрому приспособлению к изменениям окружающей среды.
- Появление различных форм группового взаимодействия (социализации), отделяющего биологическую форму эволюции от социальной.
Определение и синонимы слова Probiont в словаре немецкий языка
ЭТИМОЛОГИЯ СЛОВА ПРОБИОНТА
griechisch-neulateinisch.ПРОБИОНТ НА НЕМЕЦКОМ ЯЗЫКЕ
ГРАММАТИЧЕСКАЯ КАТЕГОРИЯ ПРОБИОНТА
Пробионт — существительное . Существительное — это тип слова, значение которого определяет реальность.Существительные дают имена всем вещам: людям, предметам, ощущениям, чувствам и т. Д.
Существительное — это тип слова, значение которого определяет реальность.Существительные дают имена всем вещам: людям, предметам, ощущениям, чувствам и т. Д.ЧТО ЗНАЧИТ ПРОБИОНТ НА НЕМЕЦКОМ?
Нажмите, чтобы увидеть , чтобы увидеть исходное определение слова «Probiont» в словаре немецкий языка. Щелкните по , чтобы увидеть автоматический перевод определения на английский язык.Значение слова Probiont в словаре немецкий языка
первобытный предшественник высших форм жизни. primitiver Vorläufer höherer Lebensformen.
Нажмите, чтобы увидеть , чтобы увидеть исходное определение слова «Probiont» в словаре немецкий языка.
 Щелкните по , чтобы увидеть автоматический перевод определения на английский язык.
Щелкните по , чтобы увидеть автоматический перевод определения на английский язык.СЛОВА, РИФМУЮЩИЕСЯ СО СЛОВОМ PROBIONT
Aerobint [aeroˈbi̯ɔnt]
stenoxybint [ʃt…], [st…]
ПЕРЕВОД ПРОБИОНТА
Узнайте, как можно перевести Probiont на 25 языков с помощью нашего многоязычного немецкого переводчика. переводов Probiont с немецкого на другие языки, представленные в этом разделе, были получены посредством автоматического статистического перевода; где основной единицей перевода является слово «Probiont» на немецком языке.Переводчик с немецкого на
китайский Пробионт1325 миллионов говорящих
Переводчик с немецкий языка на
испанский Пробионт570 миллионов говорящих
Переводчик немецкий —
английский Пробионт510 миллионов говорящих
Переводчик с немецкого языка на
хинди Пробионт380 миллионов говорящих
Переводчик с немецкого языка на
арабский Пробионт280 миллионов говорящих
Переводчик с немецкого на
, с русского на .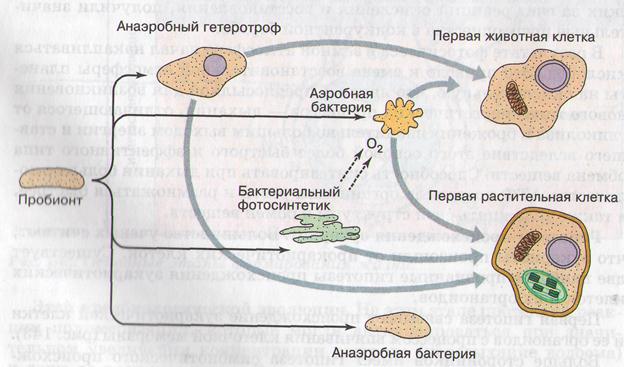 Пробионт
Пробионт 278 миллионов говорящих
Переводчик с немецкий языка на
португальский Пробионт270 миллионов говорящих
Переводчик с немецкий языка на
бенгальский Пробионт260 миллионов говорящих
Переводчик с немецкого языка на
с французского на Пробионт220 миллионов говорящих
Переводчик с немецкий языка на малайский
Пробионт190 миллионов говорящих
Немецкий Пробионт180 миллионов говорящих
Переводчик с немецкого на
японский Пробионт130 миллионов говорящих
Переводчик с немецкого на
корейский Пробионт85 миллионов говорящих
Переводчик с немецкого языка на
яванский Пробионт85 миллионов говорящих
Переводчик с немецкого языка на
вьетнамский Пробионт80 миллионов говорящих
Переводчик с немецкого языка на
тамильский Пробионт75 миллионов говорящих
Переводчик с немецкого языка —
маратхи Пробионт75 миллионов говорящих
Переводчик с немецкого на
турецкий Пробионт70 миллионов говорящих
Переводчик с немецкого языка на
с итальянского на Пробионт65 миллионов говорящих
Переводчик с немецкого на
польский Пробионт50 миллионов говорящих
Переводчик с немецкого на
украинский Пробионт40 миллионов говорящих
Переводчик с немецкого языка на
румынский Пробионт30 миллионов говорящих
Переводчик с немецкого языка на
греческий Пробионт15 миллионов говорящих
Переводчик с немецкого языка на язык
африкаанс Пробионт14 миллионов говорящих
Переводчик с немецкого языка на
шведский Пробионт10 миллионов говорящих
Переводчик с немецкого языка на
норвежский Пробионт5 миллионов говорящих
ТЕНДЕНЦИИ ИСПОЛЬЗОВАНИЯ ТЕРМИНА «ПРОБИОНТ»
Термин «Пробионт» используется очень мало и занимает номер 174. 504 позиция в нашем списке наиболее часто употребляемых терминов в словаре немецкого языка.
На показанной выше карте показана частотность использования термина «Probiont» в разных странах.
Тенденции основных поисковых запросов и примеры использования слова Probiont Список основных поисковых запросов, предпринимаемых пользователями для доступа к нашему онлайн-словарю немецкого языка, и наиболее часто используемых выражений со словом «Probiont».
504 позиция в нашем списке наиболее часто употребляемых терминов в словаре немецкого языка.
На показанной выше карте показана частотность использования термина «Probiont» в разных странах.
Тенденции основных поисковых запросов и примеры использования слова Probiont Список основных поисковых запросов, предпринимаемых пользователями для доступа к нашему онлайн-словарю немецкого языка, и наиболее часто используемых выражений со словом «Probiont».10 НЕМЕЦКИХ КНИГ, КАСАЮЩИХСЯ
«ПРОБИОНТ» Поиск случаев использования слова Probiont в следующих библиографических источниках. Книги, относящиеся к Probiont и краткие выдержки из них, чтобы показать контекст его использования в немецкой литературе.1
Vom Neukantianismus zur Ontologie Aus Atomen setzt sich das Molekül, aus Molekülen (wahrscheinlich komplexester
Art) der Probiont zusammen, dem Roux bereits Assimilation und Regulation
zuschreibt. Der nächste Schritt aufwärts ergibt schon das erste Individual, den …
Der nächste Schritt aufwärts ergibt schon das erste Individual, den …
2
Biologie macchiato: Cartoon-Biologiekurs für Schüler und …… Phagozytose 33 Sekundärantwort 136 Phänotyp 41 полуконсервант Репликация 87 Филогенез 193 Глушитель 110 pingpongartig 28 Sinneseindruck 144 Пиноцитоза 33 Sonnenpflanze 173 Население 182ff Soziobiologie 160 Пробионт 196 …
Норберт Вальдемар Хопф, 2009
3
«Scientia»: Rivista di scientia.Organo internazionale di …Постепенное усложнение метаболизма пробионта потребовало, однако, очень точное сочетание большого количества метаболических реакций с согласованной сеть биохимических процессов. Низкая каталитическая активность и специфичность …
4
Zentralblatt für Bakteriologie und Parasitenkunde . .. Биобласт, Пробионт , Фаизома, Митохондрии, Пластид.Бактерия безеичнет
wurde, mit dem umfassenderen Namen Chthonoblast, Erdbildner. Xarhdruvk wer
/ ‚01a‚ Zur Erwiderung von Dr Max Münden. Herr Erwiderung auf die Arbeit über
…
.. Биобласт, Пробионт , Фаизома, Митохондрии, Пластид.Бактерия безеичнет
wurde, mit dem umfassenderen Namen Chthonoblast, Erdbildner. Xarhdruvk wer
/ ‚01a‚ Zur Erwiderung von Dr Max Münden. Herr Erwiderung auf die Arbeit über
…
5
Zeitschrift für den Ausbau der Entwickslungslehre… Welches bisher je nachdem Granulum, Cytoblast, Bioblast, Probiont , Phaisoma , Бактериум и др. Bezeichnet wurde, mit dem umfassenderen Namen Chthonoblast (Эрдбильднер).Es gibt natürlich sehr verschiedenartige Chthonoblasten, welche …
6
Centralblatt für Bakteriologie, Parasitenkunde und … … Bioblast, Probiont , Phaisoma, Mitochondria, Plastide, Bacterium bezeichnet
wurde, mit dem umfassenderen Namen Chthonoblast, Erdbildner. Nachdruck
вербален. Zur Erwiderung von Dr. Max Münden. Herr Mün Erwiderung auf die
Арбейт . ..
..
7
Archiv für Entwicklungsmechanik der OrganismenПробионт usw.bezeichnet wurde, mit dem umfassenderen Namen Chtonoblast ( Крдбилднер). Es gibt natürlich sehr verschiedenartige Chtonoblasten, Welche eben durch ihre Differenzen die Vielgestaltigkeit der organischen und минеральный …
8
Zeitschrift für den Ausbau der Entwicklungslehre, …… Welches bisher je nachdem Granulum, Cytoblast, Bioblast, Probiont , Phaisoma , Бактериум и др. Bezeichnet wurde, mit dem umfassenderen Namen Chthonoblast (Эрдбильднер).Es gibt natürlich sehr verschiedenartige Chthonobiasten, welche …
9
Jahresberichte über die Fortschritte der Anatomie und … … Welches bisher je nachdem Granulum, Cytoblast, Bioblast, Probiont , Phaisoma
, Митохондрии, Пластид, Bacterium bezeichnet wurde, mit dem umfassenden
Намен Эрдбилднер ». Неводы Inhaltsangabe Buches und Darstellung Seines
Системы …
Неводы Inhaltsangabe Buches und Darstellung Seines
Системы …
10
Zentralblatt für Bakteriologie, Parasitenkunde und…… so benannte ich dieses, welches bisher, je nachdem Granulum, Cytoblast, Bioblast, Probiont , Phaisoma, Mitochondria, Plastide, Bacterium bezeichnet wurde, mit dem umfassenderen Namen Chthonoblast, Erdbildner. Nachdruck верхола.
Адгезия и колонизация потенциального пробионта Pseudomonas aeruginosa FARP 72 в кишечнике желтохвостого сома, Pangasius pangasius
.2021 июл; 203 (5): 2711-2717. DOI: 10.1007 / s00203-021-02188-8. Epub 2021 13 февраля.Принадлежности Расширять
Принадлежности
- 1 Кафедра здоровья водных животных, Факультет рыбных наук, Западно-Бенгальский университет наук о животных и рыболовстве, Чакгария, Калькутта, 700094, Западная Бенгалия, Индия.
 [email protected].
[email protected]. - 2 Региональная исследовательская станция, Центральный институт пресноводной аквакультуры ICAR, Рахара, Калькутта, 700118, Западная Бенгалия, Индия. [email protected].
- 3 Кафедра здоровья водных животных, Факультет рыбных наук, Западно-Бенгальский университет наук о животных и рыболовстве, Чакгария, Калькутта, 700094, Западная Бенгалия, Индия.
Элемент в буфере обмена
Фархана Хок и др.Arch Microbiol. 2021 июл.
Показать детали Показать вариантыПоказать варианты
Формат АннотацияPubMedPMID
. 2021 июл; 203 (5): 2711-2717.
DOI: 10.1007 / s00203-021-02188-8.
Epub 2021 13 февраля.
2021 июл; 203 (5): 2711-2717.
DOI: 10.1007 / s00203-021-02188-8.
Epub 2021 13 февраля.Принадлежности
- 1 Кафедра здоровья водных животных, Факультет рыбных наук, Западно-Бенгальский университет наук о животных и рыболовстве, Чакгария, Калькутта, 700094, Западная Бенгалия, Индия[email protected].
- 2 Региональная исследовательская станция, Центральный институт пресноводной аквакультуры ICAR, Рахара, Калькутта, 700118, Западная Бенгалия, Индия. [email protected].
- 3 Кафедра здоровья водных животных, Факультет рыбных наук, Западно-Бенгальский университет наук о животных и рыболовстве, Чакгария, Калькутта, 700094, Западная Бенгалия, Индия.

Элемент в буфере обмена
Полнотекстовые ссылки Опции CiteDisplayПоказать варианты
Формат АннотацияPubMedPMID
Абстрактный
Адгезия считается первым важным шагом пробионта для колонизации кишечника.В этом исследовании оценивалась способность антагониста Pseudomonas aeruginosa FARP 72 прилипать и колонизировать кишечник желтохвостого сома Pangasius pangasius как in vitro, так и in vivo. Для анализа in vitro весь кишечник каждого из двух голодных P. pangasius вводили отдельно в пробирки, содержащие синевато-зеленый пигмент P. aeruginosa FARP 72 при 8,00 log 10 КОЕ / мл и физиологический раствор (0,85 % хлорида натрия) и инкубировали 1 ч при 30 ± 1 ° C. Гомогенатные растворы слизи из образцов кишечника серийно разбавляли и высевали на агар для изоляции Pseudomonas, чтобы определить количество синевато-зеленых пигмент-продуцирующих P. aeruginosa (BPPAC). Разница между количеством BPPAC и предполагаемым количеством Pseudomonas (PPC) в обработанном и контрольном кишечнике объяснялась приверженностью P. aeruginosa FARP 72 . Уровни BPPAC и PPC в обработанном кишечнике составляли 6,09 ± 0,59 log 10 КОЕ / г. Точно так же через 30 дней кормления P.pangasius с добавкой P. aeruginosa FARP 72 , в кишечнике сома зарегистрировано BPPAC 5,83 ± 0,64 log КОЕ / г. В контрольных образцах BPPAC были зарегистрированы как <3,00 log 10 КОЕ / г. Сканирующая электронная микрофотография кишечника P. pangasius после анализов адгезии in vitro и in vivo подтвердила способность этой бактерии прочно прилипать к кишечнику, что делает ее наиболее подходящим кандидатом на пробионты для использования в аквакультуре пресноводных сомов.
Гомогенатные растворы слизи из образцов кишечника серийно разбавляли и высевали на агар для изоляции Pseudomonas, чтобы определить количество синевато-зеленых пигмент-продуцирующих P. aeruginosa (BPPAC). Разница между количеством BPPAC и предполагаемым количеством Pseudomonas (PPC) в обработанном и контрольном кишечнике объяснялась приверженностью P. aeruginosa FARP 72 . Уровни BPPAC и PPC в обработанном кишечнике составляли 6,09 ± 0,59 log 10 КОЕ / г. Точно так же через 30 дней кормления P.pangasius с добавкой P. aeruginosa FARP 72 , в кишечнике сома зарегистрировано BPPAC 5,83 ± 0,64 log КОЕ / г. В контрольных образцах BPPAC были зарегистрированы как <3,00 log 10 КОЕ / г. Сканирующая электронная микрофотография кишечника P. pangasius после анализов адгезии in vitro и in vivo подтвердила способность этой бактерии прочно прилипать к кишечнику, что делает ее наиболее подходящим кандидатом на пробионты для использования в аквакультуре пресноводных сомов.
Ключевые слова: Адгезия; Бактерии-антагонисты; Аквакультура сома; Пробионт; Pseudomonas aeruginosa.
Похожие статьи
- Pseudomonas aeruginosa FARP 72 Предлагает защиту от инфекции Aeromonas hydrophila у Labeo rohita.
Хоке Ф., Джавахар Абрахам Т., Нагеш Т.С., Камиля Д. Hoque F и др. Пробиотики, антимикробные белки. 2019 сентябрь; 11 (3): 973-980. DOI: 10.1007 / s12602-018-9456-1. Пробиотики, антимикробные белки. 2019. PMID: 30112591
- Оценка пробиотика Bacillus aerius B81e, выделенного из здорового гибридного сома, на рост, устойчивость к болезням и врожденный иммунитет Pla-mong Pangasius bocourti.

Мейдонг Р., Хотчаналеха К., Дулгиндачбапорн С., Нагасава Т., Накао М., Сакаи К., Тонгпим С. Meidong R, et al. Fish Shellfish Immunol. 2018 Февраль; 73: 1-10. DOI: 10.1016 / j.fsi.2017.11.032. Epub 2017 21 ноя. Fish Shellfish Immunol. 2018. PMID: 246
- Сканирующая электронная микроскопия биопленок сальмонелл на различных поверхностях, контактирующих с пищей, в слизи сома.
Доулагар Н., Бансал М., Шиллинг М.В., Наннапанени Р. Dhowlaghar N, et al. Food Microbiol. 2018 сентябрь; 74: 143-150. DOI: 10.1016 / j.fm.2018.03.013. Epub 2018 29 марта. Food Microbiol. 2018. PMID: 29706330
- Оценка риска синегнойной палочки в воде.
Mena KD, Gerba CP. Mena KD, et al. Rev Environ Contam Toxicol.2009; 201: 71-115.
 DOI: 10.1007 / 978-1-4419-0032-6_3.
Rev Environ Contam Toxicol. 2009 г.
PMID: 19484589
Рассмотрение.
DOI: 10.1007 / 978-1-4419-0032-6_3.
Rev Environ Contam Toxicol. 2009 г.
PMID: 19484589
Рассмотрение. - Применение антибиотиков и появление множественной устойчивости к антибиотикам (MAR) в глобальной аквакультуре сома.
Чуах Л.О., Эффариза М.Э., Гони А.М., Русул Г. Чуах ЛО и др. Curr Environ Health Rep.2016 июнь; 3 (2): 118-27. DOI: 10.1007 / s40572-016-0091-2.Curr Environ Health Rep., 2016 г. PMID: 27038482 Рассмотрение.
использованная литература
- Balcazar JL, Vendrell D, Blas ID, Ruiz-Zarzuela I., Girones O, Muzquiz JL (2008) Конкурентная адгезия in vitro и производство антагонистических соединений молочнокислыми бактериями против патогенов рыб.
 Vet Microbiol 122 (3-4): 373-380.
Vet Microbiol 122 (3-4): 373-380.
- Balcazar JL, Vendrell D, Blas ID, Ruiz-Zarzuela I., Girones O, Muzquiz JL (2008) Конкурентная адгезия in vitro и производство антагонистических соединений молочнокислыми бактериями против патогенов рыб.
- Collado MC, Meriluoto J, Salminen S (2008) Адгезионные и агрегационные свойства пробиотических и патогенных штаммов. Eur Food Res Technol 226: 1065–1073 — DOI
- Ekmekci H, Aslim B, Ozturk S (2009) Характеристика способности вагинальных лактобацилл коагрегации с Escherichia coli.Microbiol Immunol 53 (2): 59–65 — DOI
- Ferguson RM, Merrifield DL, Harper GM, Rawling MD, Mustafa S, Picchietti S, Balcazar JL, Davies SJ (2010) Влияние Pediococcus acidilactici на микробиоту кишечника и иммунный статус растущей красной тилапии (Oreochromis niloticus).
 J Appl Microbiol 109 (3): 851–862
—
DOI
J Appl Microbiol 109 (3): 851–862
—
DOI
- Ferguson RM, Merrifield DL, Harper GM, Rawling MD, Mustafa S, Picchietti S, Balcazar JL, Davies SJ (2010) Влияние Pediococcus acidilactici на микробиоту кишечника и иммунный статус растущей красной тилапии (Oreochromis niloticus).
- Fernandes IM, Bastos YF, Barreto DS, Lourenço LS, Penha JM (2017) Эффективность гвоздичного масла в качестве анестетика и при процедуре эвтаназии для тропических рыб небольшого размера. Braz J Biol 77 (3): 444–450. — DOI
Показать все 32 ссылки
Условия MeSH
- Бактериальная адгезия / физиология *
- Сомы / микробиология *
- Кишечник / микробиология *
- Pseudomonas aeruginosa / метаболизм *
LinkOut — дополнительные ресурсы
Источники полных текстов
Другие источники литературы
Защита восточной устрицы, Crassostrea virginica, личинок и молодых особей от бактериального заражения
ВВЕДЕНИЕ
Восточная устрица, Crassostrea virginica (Gmelin), двустворчатый вид, обитающий в Мексиканском заливе и на атлантических побережьях Северной Америки, имеет значительные экономические ресурсы. и экологическая ценность (Kennedy et al.1996). Однако этот вид страдает от воздействия различных бактериальных и паразитарных заболеваний, вызывающих высокую смертность в культурных и диких популяциях (Lee et al. 1996, Burreson & Ford 2004, Villalba et al. 2004). Бактериальные инфекции считаются серьезной проблемой для аквакультуры моллюсков и вызывают массовую смертность, особенно на личиночной и ювенильной стадиях (Paillard et al. 2004). Возбудители Roseovarius crassostreae и несколько видов Vibrio spp.являются одними из основных возбудителей бактериальных заболеваний в культуре восточных устриц. Как возбудитель молоди устриц или болезни устриц Roseovarius , R. crassostreae вызывает высокую сезонную смертность молоди устриц в северо-восточных штатах США (Boettcher et al. 2005, Maloy et al. 2007). Между тем, Vibrio tubiashii представляет собой возрождающийся патоген, который вызывает вибриоз и серьезные потери продуктивности у устриц на личиночных стадиях (Tubiash et al.1965 г., Элстон и др. 2008 г.).
и экологическая ценность (Kennedy et al.1996). Однако этот вид страдает от воздействия различных бактериальных и паразитарных заболеваний, вызывающих высокую смертность в культурных и диких популяциях (Lee et al. 1996, Burreson & Ford 2004, Villalba et al. 2004). Бактериальные инфекции считаются серьезной проблемой для аквакультуры моллюсков и вызывают массовую смертность, особенно на личиночной и ювенильной стадиях (Paillard et al. 2004). Возбудители Roseovarius crassostreae и несколько видов Vibrio spp.являются одними из основных возбудителей бактериальных заболеваний в культуре восточных устриц. Как возбудитель молоди устриц или болезни устриц Roseovarius , R. crassostreae вызывает высокую сезонную смертность молоди устриц в северо-восточных штатах США (Boettcher et al. 2005, Maloy et al. 2007). Между тем, Vibrio tubiashii представляет собой возрождающийся патоген, который вызывает вибриоз и серьезные потери продуктивности у устриц на личиночных стадиях (Tubiash et al.1965 г., Элстон и др. 2008 г.).
Вспышки болезней в аквакультуре моллюсков контролируются с использованием таких методов, как предотвращение болезней, частая подмена воды, хорошее содержание животных и использование иммуностимуляторов и антибиотиков (Elston & Ford 2011). Антибиотики широко используются в системах аквакультуры как метод борьбы с болезнями. Однако из-за появления устойчивости к антибиотикам и опасений по поводу загрязнения окружающей среды необходимы альтернативы использованию антибиотиков (Austin 1985, Verschuere et al.2000). Один из этих альтернативных методов — использование непатогенных микроорганизмов, называемых пробиотиками.
Пробиотик обычно определяется как пищевая добавка с живыми микробами, которая при введении в достаточном количестве приносит пользу здоровью хозяина (Продовольственная и сельскохозяйственная организация Соединенных Штатов, 2006 г.). В аквакультуре пробиотики можно вводить либо как пищевую добавку, либо как добавку к воде (Moriarty 1998). Было предложено, чтобы пробиотики в аквакультуре имели несколько способов действия: улучшение качества воды, усиление иммунных ответов видов-хозяев, улучшение питания видов-хозяев за счет производства дополнительных пищеварительных ферментов, конкуренция за пространство с патогенными бактериями и производство антимикробные соединения (Thompson et al.1999 г., Verschuere et al. 2000, Кесаркоди-Уотсон и др. 2008 г.). Потенциал благотворного воздействия использования пробиотических бактерий на аквакультуру моллюсков был продемонстрирован для многих различных видов, включая устриц. Douillet и Langdon (1994) продемонстрировали, что личинки тихоокеанских устриц питаются водорослями и Alteromonas sp. демонстрируют повышенную выживаемость и рост по сравнению с обработкой только водорослями. Они предполагают, что бактерии могут действовать как необходимое питательное вещество для личинок, которое не обеспечивается водорослями.Гибсон и др. (1998) успешно выделили бактерию, продуцирующую бактериоциноподобные ингибирующие вещества, способные подавлять рост нескольких патогенных бактерий. Этот пробионт, идентифицированный как Aeromonas media A199, значительно подавляет рост Vibrio tubiashii в культуре личинок тихоокеанских устриц. Добавление Vibrio sp. пробиотический кандидат OY15 оказывает положительный эффект в культуре личинок Crassostrea virginica с присутствием и без присутствия патогена моллюсков Vibrio sp.B183 (Капарейко и др., 2011). Совсем недавно использование Pseudoalteromonas sp. Было обнаружено, что D41 и Phaeobacter gallaeciensis обеспечивают повышение выживаемости на 50% и 40% соответственно у личинок тихоокеанских устриц после заражения Vibrio coralliilyticus (Kesarcodi-Watson et al. 2012). Внедрение выбранных полезных бактериальных изолятов для биологической борьбы с Roseovarius crassostreae и вибриозом может помочь в борьбе с болезнями в культуре восточных устриц.
В этом исследовании 2 потенциальных пробионта были выделены из 2 различных местных источников в Род-Айленде. Грамотрицательный Phaeobacter sp. S4 был выделен из внутренней раковины устриц, а грамположительный Bacillus pumilus RI06-95 был выделен из морской губки из Narrow River, приливного устья в Наррагансетте, Род-Айленд. Оба этих кандидата на пробионты показали многообещающие результаты во время in vitro, скрининга антибиотической активности против патогенов устриц и рыб, а также защитили личинок и молодь во время in vivo экспериментов по заражению с 2 бактериальными патогенами ( Vibrio tubiashii, RE22 и reovarius16 crassost CV919-312 Т ).Мы также описываем продолжительность защиты, обеспечиваемой лечением пробиотиками.
МАТЕРИАЛЫ И МЕТОДЫ
Бактериальные штаммы
Бактериальные штаммы Vibrio tubiashii RE22 (Hasegawa et al. 2008) и Roseovarius crassostreae CV919-312 T (Х. (Департамент биомедицинских наук, Государственный университет Орегона) и К. Бетчер (ранее работавший в Университете штата Мэн) соответственно. Штамм Vibrio harveyi BB120 (Bassler et al.1997) был получен от Б. Басслера (Принстонский университет). Морские бактерии Phaeobacter sp. S4 и Bacillus pumilus RI06-95 были идентифицированы как потенциальные пробиотики с помощью анализов на планшете in vitro , описанных ниже. Изоляты были охарактеризованы до уровня вида с использованием анализа последовательности 16S рДНК (Gauger & Gómez-Chiarri 2002) (номера доступа в GenBank KC625490 и KC625491). Все изоляты поддерживали и хранили в 50% глицериновой смеси при -80 ° C. Пробиотики-кандидаты и патогены обычно выращивали в течение ночи в дрожжевом пептоне с 3% бульоном NaCl (YP3) (5 г / л пептона, 1 г / л дрожжевого экстракта, 30 г / л океанской соли, Instant Ocean) при 28 ° C ( В.tubiashii, V. harveyi и R. crassostreae ) или 25 ° C ( B. pumilus RI06-95) при встряхивании.
Скрининг кандидатов в пробиотики in vitro
Анализ бактериальной конкуренции, описанный Teasdale et al. (2009) был использован в этом анализе с несколькими модификациями. В анализе «колония на поверхности» 5 мл 0,8% мягкого агара YP3, содержащего 50 мкл приблизительно 10 8 КОЕ / мл патогена из ночной культуры, выливали на чашки с агаром YP3.После охлаждения агара на планшет наносили 2 мкл раствора примерно 10 8 КОЕ / мл пробиотика-кандидата из ночной культуры и инкубировали при 30 ° C в течение 12–16 ч перед измерением зон ингибирования. Для анализа наложения мембран аликвоту 2 мкл раствора приблизительно 10 8 КОЕ / мл пробиотика-кандидата наносили на чашки с агаром YP3 и инкубировали при 23 ° C в течение 48 часов. После инкубации стерильная диализная мембрана с отсечкой по молекулярной массе 12–14 кДа (Spectra / Por; Spectrum Medical Industries, Inc., Хьюстон, Техас) помещали поверх колоний и покрывали 6 мл 0,8% агара YP3, содержащего 60 мкл приблизительно 10 8 КОЕ / мл патогена из ночной культуры. Планшеты инкубировали при 30 ° C в течение 12–16 ч после затвердевания агара и измеряли диаметр прозрачных (ингибирующих) зон вокруг колоний пробионтов с помощью линейки.
Характеристика Phaeobacter sp. S4 Рост и морфологияОдиночные колонии Phaeobacter sp.S4 инокулировали на среду YP3, выращивали в течение 48 ч при 27 ° C при встряхивании, а затем снова разводили свежей средой YP + 2% NaCl (YP2) или YP + 3% NaCl (YP3) при разведении 1: 1000. Культуры инкубировали при 27 ° C со встряхиванием в течение до 72 часов, и в выбранные моменты времени отбирали аликвоты для определения концентрации бактерий (измеренной в колониеобразующих единицах на миллилитр) путем посева серийных разведений. Аликвоты бактериальных клеток, взятых из культур, выросших до поздней экспоненциальной (36 ч) и стационарной (48 ч) фаз, помещали на покровные стекла и исследовали с помощью фазово-контрастной микроскопии в Центре геномики и секвенирования Род-Айленда при Университете Род-Айленда с помощью Микроскоп Zeiss Axio Imager 2 с фазово-контрастной оптикой.Образцы, содержащие биопленку, выращивали в статических условиях культивирования в течение 48 ч при 27 ° C и соскребали со стенок стеклянных культуральных пробирок (15 × 150 мм) перед помещением на предметные стекла и наблюдением с помощью фазово-контрастной микроскопии.
Приготовление бактериальных изолятов для заражения
Кандидаты в пробиотики и патогены культивировали в течение ночи при встряхивании в 10 мл бульона YP3. Ночные культуры переносили в 50-мл стерильные пробирки Falcon и центрифугировали при 2300 g в течение 10 минут для сбора клеток.Клетки дважды промывали 10 мл фильтрованной стерильной морской воды (FSSW), осадок клеток ресуспендировали в 10 мл FSSW и перемешивали с использованием вихревой мешалки. Плотность бактерий определяли путем измерения оптической плотности при 550 нм с использованием спектрофотометра (Synergy HT; BioTek) и предполагая, что оптическая плотность 1.000 соответствует 1,2 × 10 9 КОЕ / мл согласно стандарту МакФарланда (BioMerieux, Marcyl ‘). Этуаль, Франция). После определения концентрации бактерий бактериальную суспензию разбавляли до целевой концентрации в FSSW.Конечная целевая концентрация была подтверждена путем посева серийных разведений бактериальных культур для каждой обработки на соответствующие чашки с агаром и подсчета колониеобразующих единиц после инкубации в течение ночи при 25 ° C или 28 ° C. Коммерческую смесь пробиотиков (Sanolife MIC; INVE Aquaculture, Бельгия) смешивали, добавляя 0,1 г Sanolife к 50 мл FSSW в соответствии с протоколом производителя. Затем раствор доводили до исходной концентрации 5 × 10 6 КОЕ / мл и использовали при целевой концентрации 10 4 КОЕ / мл.
Бактериальные заражения личинок устриц
Экспериментальные испытания были выполнены, как описано ранее (Gómez-León et al. 2008) с небольшими модификациями. Личинки восточных устриц, Crassostrea virginica (возраст 12–20 дней; размер 50–150 мкм) были получены из инкубатория Blount Shellfish при Университете Роджера Уильяма (Бристоль, Род-Айленд). Устрицы (25–30 личинок) помещали в каждую лунку 6-луночного планшета, содержащего 5 мл FSSW при 28 psu. Изоляты-кандидаты пробиотиков S4 и RI06-95 добавляли в лунки до конечных концентраций в диапазоне 10 2 –10 6 КОЕ / мл.Коммерческий пробиотик Sanolife MIC использовали в конечной концентрации 10 4 КОЕ / мл. Личинок устриц кормили коммерческой пастой из водорослей (20 000 клеток / мл; Reed Mariculture Inc., Сан-Хосе, Калифорния) для стимулирования приема пробиотиков. Планшеты инкубировали при 22–23 ° C в течение 24 ч при осторожном покачивании. Затем воду в лунках меняли для удаления пробиотиков. Либо Vibrio tubiashii RE22, либо Roseovarius crassostreae CV919-312 T был добавлен к 5 мл FSSW, содержащего личинки, для достижения целевой концентрации патогена (10 5 КОЕ / мл или 10 6 КОЕ / мл) .Контрольные лунки включали необработанных личинок (с патогеном и без него) и личинок, инкубированных с пробиотиками, но не с патогеном. Каждую обработку проводили в трех экземплярах. Выживаемость личинок определяли через 24 часа после добавления патогена путем добавления 200 мкл нейтрального красного в каждую лунку до конечной концентрации 0,53 мг / л и инкубации в течение 2 часов перед подсчетом живых и мертвых устриц. Метод нейтрального красного окрашивания позволяет различать живых (окрашенных) и мертвых (неокрашенных) личинок (рис. 1) (Gómez-León et al.2008 г.). Выживаемость рассчитывалась по формуле Относительный процент выживаемости (RPS) (Amend 1981), предоставленный пробионтом (обработка) по отношению к зараженным личинкам (контроль), рассчитывали по формуле
Эти эксперименты проводили по крайней мере 3 раза в трех повторностях для пробионтов-кандидатов S4 и RI06-95 и один раз для коммерческого пробионта Sanolife MIC.Рисунок 1.
Эффект преинкубации с пробионтом-кандидатом Phaeobacter sp.S4 о морфологии личинок устриц через 24 ч после заражения бактериальным патогеном Vibrio tubiashii RE22. Пробионты-кандидаты вводили за 24 ч до заражения патогеном. (A) Личинка, зараженная RE22, показывает скопление ресничек (стрелка). (B) Группа личинок, зараженных RE22, показывает обломки клеток (толстая стрелка) и мертвые личинки, на что указывают пустые оболочки, не окрашенные нейтральным красным (стрелка). (C, D) Личинки, предварительно инкубированные с S4 и зараженные RE22, были жизнеспособными и показали окрашивание в нейтральный красный (стрелка) и нормальные реснички (стрелка).
Продолжительность защиты, обеспечиваемой кандидатами в пробионты
Личинки устриц помещали в 6-луночные планшеты, содержащие 5 мл FSSW; Пробионты-кандидаты вводили до конечной концентрации 10 4 КОЕ / мл. Планшеты инкубировали при 22–23 ° C в течение 24 ч при осторожном покачивании. Через 24 часа инкубации FSSW удаляли из лунок и заменяли 5 мл FSSW без пробиотиков. Патоген Vibrio tubiashii RE22 (конечная концентрация, 10 5 КОЕ / мл) вносили в лунки через 24 часа, 72 часа или 120 часов после добавления пробионтов-кандидатов (что эквивалентно 0 часам, 48 часам или 96 часам). ч после удаления пробионта).Через 24 часа инкубации с патогеном определяли выживаемость личинок устриц и RPS, как описано ранее. Личинок устриц ежедневно кормили коммерческой водорослевой пастой (20 000 клеток / мл). Этот анализ проводился только один раз, при этом каждое лечение проверялось в трех экземплярах.
Бактериальные вызовы молодых устриц
Десять молодых устриц (высота раковины 8–15 мм) на контейнер помещали в ведра емкостью 500 мл, содержащие 200 мл FSSW, и каждый контейнер подвергался непрерывной аэрации с помощью воздушных камней.Кандидаты в пробионты применяли до конечной концентрации 10 5 КОЕ / мл, а контейнеры инкубировали при 22–23 ° C на протяжении всего эксперимента. Через 24 часа инкубации с пробионтом наносили Vibrio tubiashii RE22 до конечной концентрации 10 5 КОЕ / мл. Смертность регистрировалась каждые 2–3 дня в течение 13 дней и рассчитывалась совокупная выживаемость в процентах. Воду заменяли каждые 2–3 дня, и устриц ежедневно кормили коммерческой пастой из водорослей (20 000 клеток / мл).Этот эксперимент проводился один раз с использованием дублирующих контейнеров на обработку.
Статистический анализ
Данные по выживаемости и кумулятивной смертности были проанализированы с использованием одно- или двухфакторного дисперсионного анализа (ANOVA), а тесты множественного сравнения (критерий Тьюки) были использованы для определения значимости среди групп. Данные, собранные в процентах, были преобразованы в арксинус квадратного корня перед анализом. Результаты считались значимыми при уровне достоверности 95% ( P <0.05). Вся статистика была проведена с использованием программного обеспечения SigmaStat 3.1 (Systat).
РЕЗУЛЬТАТЫ
Антибиотическая активность против бактериальных патогенов
В данном исследовании из 64 штаммов бактерий, выделенных из внутренней оболочки здоровых устриц, только Phaeobacter sp. Было обнаружено, что S4 обладает антибиотической активностью против Vibrio harveyi BB120 с использованием 2 различных анализов на планшетах. В тесте наложения мембраны использование мембраны предотвращает прямой контакт между пробионтом и патогеном, позволяя проходить только химическим веществам с молекулярной массой менее 12–14 кДа.Этот метод позволяет наблюдать химические взаимодействия между пробионтом и патогеном. Между тем, анализ «колония на поверхности» позволяет установить прямое бактериальное взаимодействие между пробионтом и патогеном. Кандидат в пробионты Bacillus pumilus RI06-95 подавлял рост патогенов V. harveyi BB120 при 28 ° C и Roseovarius crassostreae CV919-312 T при 20 ° C и 28 ° C с использованием обоих колоний. -top и анализ наложения мембран (Таблица 1). Однако этот изолят не проявил ингибирующей активности против Vibrio tubiashii RE22.Кандидат в пробионт Phaeobacter sp. S4 подавлял рост всех патогенов, за исключением V. tubiashii RE22 при 20 ° C в анализе «колония на вершине» (таблица 1). Различия в характере ингибирования между двумя анализами для этого пробионта, вероятно, являются результатом различий в продолжительности времени инкубации пробиотика с патогеном (12–16 часов для колонии сверху и 48 часов для покрытия мембраны). .
ТАБЛИЦА 1.
Антибиотическая активность кандидатов в пробионты Phaeobacter sp.S4 и Bacillus pumilus RI06-95 против избранных бактериальных патогенов рыб ( Vibrio harveyi BB120) и моллюсков ( Vibrio tubiashii RE22 и Roseovarius crassostreae CV919-312 на пластине диффузии) 2 температуры.
Характеристика Phaeobacter sp. S4 Рост и морфологияМы охарактеризовали Phaeobacter sp. S4 в отношении некоторых основных свойств, которые могут повлиять на его способность служить пробиотическим организмом в морской аквакультуре, а именно кривых роста в морской среде и способности образовывать биопленки.Вкратце, S4 хорошо рос в YP2 или YP3 при температурах от 18 до 30 ° C (не показано). Клетки не могли расти при 37 ° C. При 27 ° C не было разницы в скорости роста S4, когда клетки выращивали в YP2 или YP3 (рис. 2). Самое быстрое время удвоения клеток в YP2 и YP3 составило 2,2 часа и 1,9 часа соответственно. Среднее время удвоения для каждого условия составляло 3,1 ч для YP2 и 3,2 ч для YP3. Конечная плотность S4 либо в YP2, либо в YP3 составляла более 2,0 × 10 9 КОЕ / мл.
Рисунок 2.
Кривая роста Phaeobacter sp. S4 в YP2 и YP3 при 27 ° C. Клетки выращивали в течение 48 часов в YP3, а затем снова разводили свежим YP2 () или YP3 () в разведении 1: 1000. Образцы отбирали в указанное время, и плотность клеток определяли серийным разведением и посевом на YP3.
Хотя рост YP2 и YP3 приводит к практически идентичным скоростям роста и конечной плотности клеток, эти 2 условия привели к 2 различным морфологиям для Phaeobacter sp.S4 (рис.3). Рост YP3 приводит к появлению маленьких яйцевидных подвижных клеток (рис. 3А), которые, переходя в стационарную фазу, образуют розетки. Клетки, выросшие в YP2, удлиняются до веретеновидных клеток во время поздней стационарной фазы, теряют подвижность и образуют розетки (Fig. 3B, C). При выращивании в статической культуре клетки образовывали толстую биопленку на стеклянных поверхностях (рис. 3D). Пластиковые поверхности (поликарбонат, полистирол и полипропилен) не поддерживали образование биопленки под действием S4 (не показано).
Влияние предварительной обработки пробиотиками на выживаемость личинок устриц после бактериального заражения
Пробионты-кандидаты не были патогенными для хозяина, поскольку выживаемость личинок устриц, обработанных пробионтами-кандидатами, существенно не отличалась от контроля (рис.4). Быстрая гибель личинок устриц наблюдалась после контакта с патогенами Vibrio tubiashii RE22 и Roseovarius crassostreae CV919-312 T в течение 24 часов с выживаемостью от 14% до 31%, в зависимости от возбудителя и дозы (> 80 % для неоспоримых контролей). Выживаемость устриц, предварительно обработанных пробионтами-кандидатами в течение 24 часов, а затем подвергшихся воздействию бактериальных патогенов, была значительно выше, чем у личинок, которые не подвергались воздействию пробионта, и увеличивалась с 14–31% для необработанных личинок до 32–64 % для личинок, получавших пробиотики (рис.4).
Уровень защиты отличался в зависимости от относительных концентраций пробионтов-кандидатов и добавленных патогенов (таблица 2). Кандидат в пробионт Phaeobacter sp. Было обнаружено, что S4 более эффективно защищает личинок устриц от Vibrio tubiashii RE22, чем от Roseovarius crassostreae CV
2 T . Это исследование также продемонстрировало Phaeobacter sp. S4 обеспечивает более высокий уровень защиты от обоих патогенов, чем Bacillus pumilus RI06-95.Оптимальная концентрация для пробионтов Phaeobacter sp. S4 и B. pumilus RI06-95 составлял 10 4 КОЕ / мл. При этой концентрации оба пробиотика были способны обеспечить значительную выживаемость против V. tubiashii RE22 ( P <0,05) и R. crassostreae CV919-312 T (таблица 2). С другой стороны, не было обнаружено защитного эффекта у личинок устриц, обработанных коммерческим пробиотиком Sanolife MIC после заражения В.tubiashii RE22 (выживаемость зараженных личинок, предварительно обработанных МИК Sanolife 2 ± 2% по сравнению с 98 ± 2% для необработанных личинок, предварительно обработанных МИК Sanolife; Таблица 2).Рис. 3.
Фазово-контрастные микрофотографии, показывающие морфологию Phaeobacter sp. S4 в разных фазах роста. (A) Клетки с поздней экспоненциальной фазой, выращенные в YP3. (B) Клетки с поздней экспоненциальной фазой, выращенные в YP2. (C) Клетки, выращенные YP2 в розетках. (D) Клетки S4, выращенные в YP2 в биопленке. Размер планки = 10 мкм.
Рисунок 4.
Влияние преинкубации личинок устриц с кандидатами в пробионты RI06-95 и S4 при 10 4 КОЕ / мл на выживаемость (% ± SEM) через 24 часа после заражения бактериальными патогенами Roseovarius crassostreae CV
2 и Vibrio tubiashii RE22 при 10 5 КОЕ / мл. Кандидаты в пробионты вводили за 24 ч до заражения личинок. Представитель минимум 3 экспериментов; разные буквы указывают на статистическую значимость среди групп (однофакторный дисперсионный анализ, P <0.05).Продолжительность защиты, обеспечиваемой пробиотиками
Для определения продолжительности защиты, обеспечиваемой 24-часовым воздействием на личинок устриц потенциальных пробионтов, мы определили выживаемость личинок устриц, подвергнутых испытанию в различные моменты времени после воздействия пробионтов (0 ч, 48 ч и 96 ч после удаления пробионтов-кандидатов). Как отмечалось ранее, личинки устриц, инкубированных с пробионтами в течение 24 часов, были значительно защищены от 24-часового бактериального заражения с помощью Vibrio tubiashii , когда патоген был добавлен сразу после удаления пробионта (рис.5). Однако не было получено значительной защиты при заражении личинок через 48 и 96 часов после удаления пробионтов. RPS личинок устриц, подвергшихся воздействию Phaeobacter sp. S4 в течение 24 часов значительно снизился: с 78% при заражении устриц сразу после удаления пробионта до 14% и 13% при заражении устриц через 48 и 96 часов, соответственно, после удаления пробионта. RPS личинок устриц, подвергшихся воздействию Bacillus pumilus RI06-95, снизился с 44%, когда устрицы подверглись заражению сразу после удаления пробионта, до 1% (заражение через 48 часов) и 4% (заражение через 96 часов).
ТАБЛИЦА 2.
Эффект преинкубации с кандидатами на пробионты Bacillus pumilus RI06-95, Phaeobacter sp. S4 и коммерческой пробиотической смеси Sanolife MIC (INVE Aquaculture, Бельгия) на выживаемость личинок устриц через 24 часа после заражения бактериальными патогенами Roseovarius crassostreae CV919-312T и Vibrio tubiashii RE22.
Влияние предварительной обработки пробионтами на выживаемость молодых устриц после бактериального заражения
Мы хотели определить, может ли воздействие пробиотических бактерий защитить молодых устриц от Vibrio tubiashii аналогично тому, что наблюдалось для личинок устриц.Хотя молодые устрицы показали резкое увеличение смертности на 6-й день после заражения V. tubiashii RE22, устрицы в контейнерах, в которые были добавлены штаммы пробиотиков за 24 ч до заражения, показали относительно низкие уровни смертности (<15%) до 8-го дня. после провокации (рис. 6). В конце анализа (13 дней) воздействие пробионтов значительно снизило смертность молодых устриц после заражения V. tubiashii ( P <0,05; RPS: B.pumilus РИ06-95, 60 ± 0%; Phaeobacter sp. S4, 67 ± 0%). Совместная инкубация молодых устриц как с S4, так и с RI06-95 не дала дополнительных уровней защиты по сравнению с преинкубацией с одним из пробиотиков ( P > 0,05).
ОБСУЖДЕНИЕ
Это исследование успешно идентифицировало 2 потенциальных бактериальных кандидата для использования в качестве пробиотиков для контроля заболеваний в устричной аквакультуре. Бактериальные штаммы Phaeobacter sp.S4 и Bacillus pumilus RI06-95 были выбраны в качестве кандидатов в пробионты из-за их антагонистических свойств в отношении возбудителей устриц Roseovarius crassostreae и Vibrio tubiashii , а также патогенов морских рыб и моллюсков Vibriovey i. Мы демонстрируем здесь, что они также обеспечивали значительную защиту личинок устриц от экспериментального бактериального заражения. Кроме того, предварительная инкубация молодых устриц с этими пробионтами привела к значительному увеличению выживаемости молодых устриц через 13 дней после заражения V.tubiashii .
Рисунок 5.
Продолжительность защиты от бактериального заражения, обеспечиваемая преинкубацией личинок устриц с кандидатами на пробионты RI06-95 и S4. Личинки устриц предварительно инкубировали в течение 24 дней с 10 4 КОЕ / мл пробионта, промывали, помещали в фильтрованную стерильную морскую воду и затем заражали, добавляя 10 5 КОЕ / мл патогена Vibrio tubiashii RE22 0 ч, 48 ч, или 96 ч после удаления пробионтов. Разные буквы указывают на статистическую значимость между обработками и временами (2-way ANOVA, P <0.05).
Эти 2 кандидата на пробионты смогли защитить личинок устриц и молодь устриц от серьезных бактериальных проблем, использованных в нашем исследовании, и показали потенциал обеспечения защиты при профилактическом использовании в инкубаториях, где уровни патогенных бактерий в морской воде иногда приближаются к уровням, близким к уровню контрольные дозы, использованные в наших экспериментах (Elston et al. 2008). Бактериальные патогены Vibrio tubiashii и Roseovarius crassostreae вызвали быструю гибель личинок устриц в наших экспериментах; устрицы перестали плавать, и большая часть тканей была полностью переварена, оставив пустую раковину после 24 часов воздействия патогенов.Это согласуется с предыдущими исследованиями этих патогенов (Гибсон и др., 1998 г., Элстон и др., 2008 г., Гомес-Леон и др., 2008 г.).
Фиг. 6.
Влияние предварительной инкубации молодых устриц с кандидатами в пробионты на выживаемость устриц после бактериального заражения. Устрицы предварительно инкубировали с 10 4 КОЕ / мл пробионтов Bacillus pumilus RI06-95 или Phaeobacter sp. S4 на 24 ч. Затем в морскую воду инкубации добавляли 10 5 КОЕ / мл патогена Vibrio tubiashii RE22; Выживаемость определяли каждые 2–3 дня в течение 13 дней.Различные буквы указывают на статистическую значимость лечения (однофакторный дисперсионный анализ, P <0).
Пробионты-кандидаты, которые мы протестировали здесь, являются комменсалами морских организмов, и в наших экспериментах было доказано, что они безопасны для личинок и молодых устриц, поскольку они не оказали значительного влияния на выживаемость личинок или молоди в испытанных концентрациях (до 10 6 КОЕ / мл). Хотя мы не тестировали влияние этих пробионтов непосредственно на культуры водорослей, предыдущие исследования на другом Phaeobacter sp.( Phaeobacter gallaeciensis ) с пробиотической активностью на культурах личинок трески не показали отрицательного воздействия этого пробионта на выживаемость микроводорослей Tetraselmis suecica , вида, обычно используемого в инкубаториях аквакультуры (D’Alvise et al. 2012). Наши эксперименты также показали, что значительный уровень защиты был получен с дозой пробиотика 10 4 КОЕ / мл, что легко достигается даже в больших резервуарах для культивирования, используемых в коммерческих инкубаториях. Однако продолжительность защиты, обеспечиваемая личинкам устриц при воздействии пробионтов, является кратковременной (24 часа), что позволяет предположить, что эти пробиотики, возможно, потребуется ежедневно вводить личинкам в инкубаториях для поддержания их эффективности.Это не редкость для других пробиотиков, которые обычно ежедневно вводятся с кормом для организмов-хозяев, чтобы обеспечить максимальную пользу (Verschuere et al. 2000, Kesarcodi-Watson et al. 2008). Интересно, что однократная доза пробиотиков, добавленная в культуральную воду молодых устриц за 24 часа до бактериального заражения, обеспечивала значительный уровень защиты в течение как минимум 13 дней, что позволяет предположить, что пробионты могут сохраняться у молодых устриц дольше, чем у личинок устриц, или что дополнительные механизмы защиты задействованы у молодых устриц.Необходимо провести дополнительные исследования, чтобы определить эффективность и механизмы действия этих пробиотических бактериальных штаммов на разных стадиях развития устриц и в разных условиях выращивания.
Наше исследование показало, что отсутствие активности ингибирования роста in vitro в отношении конкретного патогена не обязательно является предиктором того, как пробионт-кандидат будет действовать in vivo . Кандидат в пробионт Bacillus pumilus RI06-95 не был способен ингибировать рост Vibrio tubiashii in vitro , но показал защитный эффект в отношении личинок и молодых устриц во время заражения in vivo , что свидетельствует о защите, обеспечиваемой B.pumilus RI06-95 против V. tubiashii может не быть результатом антибиотической активности или того, что анализы in vitro , используемые в процессе скрининга, не предсказывают продукцию антибиотика in vivo . Пробиотики способны улучшать выживаемость хозяев с помощью различных механизмов (Verschuere et al. 2000, Kesarcodi-Watson et al. 2008). Известно, что помимо секреции соединений антибиотиков пробиотики обладают различными другими способами действия, которые приносят пользу хозяину.В предыдущем исследовании Bacillus sp. Сообщалось, что S11 улучшает здоровье, стимулируя иммунитет организма-хозяина (Rengpipat et al. 2000). Это может быть одним из возможных механизмов, обеспечиваемых B. pumilus RI06-95 для защиты устриц от V. tubiashii в нашем анализе in vivo . Этот пробиотик также может способствовать улучшению пищеварения устриц. Исследования Olmos et al. (2011) продемонстрировали способность Bacillus subtilts улучшать переваривание углеводов и улучшать здоровье креветок ( Litopenaeus vannamei ).Кроме того, Sun et al. (2010) продемонстрировали, что морской окунь ( Epinephelus coioides ) лучше потреблял питательные вещества после добавления в корм B. pumilus или Bacillus clausii .
Напротив, результаты тестов in vitro с Phaeobacter sp. S4 показал ингибирующую рост активность против 2 патогенов устриц, и это совпало с повышенной защитой, наблюдаемой в анализах in vivo . Исследования, проведенные Porsby et al.(2008) показали, что представители клады Roseobacter , такие как Phaeobacter gallaeciensis и Phaeobacter ignens , продуцируют антибиотическое соединение, называемое троподитиетиновой кислотой, которое способно ингибировать рост бактериальных патогенов Vibplendibusrioillarum, cholerae, Bacillus subtilis и Halomonas spp. Кроме того, применение бактериальных культур или клеточных экстрактов Phaeobacter spp.улучшают выживаемость личинок рыб (Makridis et al. 2005, Planas et al. 2006) и моллюсков (Ruiz-Ponte et al. 1999, Balcázar et al. 2006) в резервуарах для выращивания. Недавно D’Alvise et al. (2012) продемонстрировали способность P. gallaeciensis защищать личинок трески от вибриоза. Помимо производства троподиетиновой кислоты, Phaeobacter spp. известны как основные колонизаторы различных неорганических и органических морских поверхностей, включая морские водоросли и динофлагелляты (Dang & Lovell 2002, Mayali et al.2008 г.). Наши наблюдения за этой бактерией подтверждают, что Phaeobacter sp. S4 активно образует розетки и биопленки на неорганических поверхностях, таких как стекло. Кроме того, наши результаты, которые показывают способность Phaeobacter sp. изолированные с внутренней стороны раковины взрослой устрицы (и, вероятно, члена естественного микробиома устриц) для защиты личинок устриц от бактериального заражения, являются дополнительными доказательствами потенциала Phaeobacter spp. как пробиотические виды.
В заключение, эти исследования успешно выделили 2 пробионтов-кандидатов для лечения заболеваний в устричных инкубаториях. Пробионт Phaeobacter sp. S4 является хорошим кандидатом в пробионты, который продемонстрировал явную антибиотическую активность in vitro, и защиту in vivo. Связь между активностью пробиотика in vivo и активностью антибиотика in vitro , однако, не столь сильна в случае защиты личинок устриц от Vibrio tubiashii , обеспечиваемой Bacillus pumilus RI06-95, что позволяет предположить, что другие механизмы способствуют пробиотической активности.Таким образом, помимо хороших кандидатов для использования в аквакультуре моллюсков, эти кандидаты в пробионты будут полезны при оценке взаимосвязи между активностями антибиотиков и пробиотиков, чтобы помочь разработать рациональные стратегии для скрининга потенциальных пробиотиков.
БЛАГОДАРНОСТИ
Мы благодарим B. Bassler, K. Boettcher и H. Hasegawa за предоставленные бактериальные изоляты; и К. Тамми и персоналу инкубатория Blount Shellfish в Университете Роджера Уильямса за предоставление личинок устриц.Это исследование финансировалось за счет гранта Род-Айлендского морского гранта. Исследования, представленные в этой публикации, были частично поддержаны Премией институционального развития (IDeA) Национального института общих медицинских наук Национальных институтов здравоохранения в рамках гранта No. 8 P20 GM103430-12. Это исследование также частично основано на работе, проведенной с использованием Центра геномики и секвенирования Род-Айленда, который частично поддерживается Национальным научным фондом в рамках грантов EPSCoR. 0554548 и EPS-1004057.Мурни Карим финансировался за счет стипендии правительства Малайзии и Universiti Putra Malaysia.
ЦИТИРОВАННАЯ ЛИТЕРАТУРА
1.
D. F. Изменить 1981. Проверка эффективности рыбных вакцин. В: Д. П. Андерсон И Х. Хеннессен , редакторы. Биология рыб: серодиагностика и вакцины. Стандарт биологии развития 49. Базель: Каргер. С. 447–454. Google ученый2.
Б. Остин 1985. Загрязнение рыбоводных хозяйств антибиотиками и его влияние на водную микрофлору. Microbiol. Sci . 2: 113–118. Google ученый3.
Х. Л. Балькасар , И. де Блас , И. Руис-Сарсуэла , Д. Каннингем , Д. Вендрелл & Дж. Л. Музквиз . 2006. Роль пробиотиков в аквакультуре. Вет. Микробиол . 114: 173–186. Google ученый4.
Б. Л. Басслер , Э. П. Гринберг & А.М. Стивенс . 1997. Межвидовая индукция люминесценции в кворум-чувствительной бактерии Vibrio harveyi . J. Бактериальные . 179: 4043–4045. Google ученый5.
К. Дж. Ботчер , К. К. Гейган , А. П. Малой & Б. Дж. Барбер . 2005 г. Roseovarius crassostreae sp. nov., член клады Roseobacter и очевидная причина ювенильной болезни устриц (JOD) у культивируемых восточных устриц. Внутр. J. Syst. Evol. Микробиол . 55: 1531–1537. Google Scholar6.
Э. М. Бурресон & С. Э. Форд . 2004. Обзор последней информации о Haplosporidia, со специальной ссылкой на Haplosporidium nelsoni (MSX). Aquat. Жилой ресурс . 17: 499–517. Google ученый7.
П. В. Д’Алвиз , С. Лиллебо , М. Дж. Прол-Гарсия , ПРИВЕТ.Wergeland , К. Ф. Нильсен , ø. Берг И Л. Грамм . 2012 г. Phaeobacter gallaeciensis уменьшает Vibrio anguillarum в культурах микроводорослей и коловраток и предотвращает вибриоз у личинок трески. PLoS ONE 7: e43996. Google ученый8.
Х. Я. Данг & К. Р. Ловелл . 2002. Сезонная динамика ассоциированных с частицами и свободноживущих морских протеобактерий в приливном ручье соляного марша, определенная с помощью флуоресцентной гибридизации in situ . Environ. Микробиол . 4: 287–295. Google ученый9.
П. А. Дуйе & К. Дж. Лэнгдон . 1994. Использование пробиотика для культивирования личинок тихоокеанской устрицы ( Crassostrea gigas Thunberg). Аквакультура 119: 25–40. Google ученый10.
А. Р. Элстон И С. Э. Форд . 2011. Болезни моллюсков и управление здоровьем, В: С.Шамуэй , редактор. Аквакультура моллюсков и окружающая среда. Эймс, ИА: Уайли-Блэквелл. С. 359–394. Google ученый11.
Р. А. Элстон , Х. Хасегава , К. Л. Хамфри , И. К. Поляк & К. К. Хезе . 2008. Повторное появление Vibrio tubiashii в аквакультуре двустворчатых моллюсков: серьезность, экологические факторы, географическое распространение и управление. Dis. Акват. Орган . 82: 119–134.Google ученый12.
Продовольственная и сельскохозяйственная организация Объединенных Наций. 2006. Пробиотики в пище: здоровье и питательные свойства пробиотиков в пище, включая сухое молоко с живыми молочнокислыми бактериями. Технический документ по пищевым продуктам и питанию 85. Рим: Всемирная организация здравоохранения. 53 стр. Google Scholar13.
Э. Дж. Гаугер & М. Гомес-Кьярри . 2002. Секвенирование рибосомальной ДНК 16S подтверждает синонимию Vibrio harveyi и V.carchariae . Dis. Акват. Орган . 52: 39–46. Google ученый14.
Л. Ф. Гибсон , Дж. Вудворт & А. М. Джордж . 1998. Пробиотическая активность Aeromonas media на тихоокеанской устрице, Crassostrea gigas при заражении Vibrio tubiashii . Аквакультура 169: 111–120. Google ученый15.
Х. Гомес-Леон , Л.Вилламил , С. А. Зальгер , Р. Х. Саллум , А. Ремача-Тривино , Д. Ф. Ливитт & М. Гомес-Кьярри . 2008. Выживание восточных устриц Crassostrea virginica из трех линий после экспериментального заражения бактериальными патогенами. Dis. Акват. Орган . 79: 95–105. Google ученый16.
Х. Хасегава , Э. Дж. Линд , М. А. Боин & С.Гнаться . 2008. Внеклеточная металлопротеиназа Vibrio tubiashii является основным фактором вирулентности для личинок тихоокеанских устриц ( Crassostrea gigas ). Заявл. Environ. Микробиол . 74: 4101–4110. Google ученый17.
Д. Капарейко , Х. Дж. Лим , Э. Дж. Шотт , А. Ханиф & Г. Х. Викфорс . 2011. Выделение и оценка новых пробиотических бактерий для использования в инкубаториях моллюсков: II.Воздействие Vibrio sp. кандидат в пробиотики при выживании личинок устриц ( Crassostrea virginica ) в пилотных испытаниях. J. Заявление о моллюсках . 30: 617–625. Google ученый18.
В. С. Кеннеди , Р. И. Ньюэлл И Э. Ф. Эбл . 1996. Восточная устрица, Crassostrea virginica . Колледж-Парк, Мэриленд: Морской Грант Колледж Мэриленда. 734 стр. Google Scholar19.
А.Кесаркоди-Уотсон , Х. Каспар , М. Дж. Латеган & Л. Гобсон . 2008. Пробиотики в аквакультуре: необходимость, принципы и механизмы действия и процессы скрининга. Аквакультура 274: 1–14. Google ученый20.
А. Кесаркоди-Уотсон , П. Майнер , Дж. Л. Николас & Р. Роберт . 2012. Защитный эффект четырех потенциальных пробиотиков против патогенов личинок трех двустворчатых моллюсков: тихоокеанской устрицы ( Crassostrea gigas ), плоской устрицы ( Ostrea edulis ) и морского гребешка ( Pecten maximus ). Аквакультура 344: 29–34. Google ученый21.
М. Ли , Г. Т. Тейлор , В. М. Бричель , С. Э. Форд & С. Зан . 1996. Оценка Vibrio spp. цветение микропланктона как возбудитель болезни молодых устриц в Crassostrea virginica (Gmelin). J. Заявление о моллюсках . 15: 319–329. Google ученый22.
П.Макридис , С. Мартинс , М. Цалавута , Л. К. Дионисио , Г. Котулас , А. Магулас & М. Т. Динис . 2005. Противомикробная активность бактерий, выделенных из сенегальской камбалы, Solea senegalensis , полученной от естественной добычи. Aquatic Res . 36: 1619–1627. Google ученый23.
А. П. Малой , С. Э. Форд , Р. Карни & К.Дж. Ботчер . 2007 г. Roseovarius crassostreae , этиологический агент болезни молодых устриц в Crassostrea virginica . Аквакультура 269: 71–83. Google ученый24.
X. Маяли , П. Дж. С. Фрэнкс & Ф. Азам . 2008. Культивирование и роль в экосистеме морской кластерной бактерии Roseobacter , связанной с кладой. Заявл. Environ. Микробиол .74: 2595–2603. Google ученый25.
Д. Дж. У. Мориарти 1998. Роль микроорганизмов в прудах аквакультуры. Аквакультура 151: 333–349. Google ученый26.
Дж. Олмос , Л. Очоа , П. Мишель & Р. Контрерас . 2011. Оценка функционального корма Litopenaeus vannamei с использованием 100% замены рыбной муки соевым шротом, высоким уровнем сложных углеводов и штаммами пробиотиков Bacillus . Мар. Наркотики 9: 1119–1132. Google ученый27.
К. Пайярд , Ф. Ле Ру & Дж. Дж. Боррег . 2004. Бактериальные заболевания морских двустворчатых моллюсков, обзор последних исследований: тенденции и эволюция. Aquat. Жилой ресурс . 17: 477–498. Google ученый28.
М. Планас , М. Перес-Лоренцо , М. Хьельм , Л. Грамм , Я.У. Фиксдал , ø. Берг & Х. Пинтадо . 2006. Пробиотический эффект in vivo штамма Roseobacter штамма 27-4 против инфекции Vibrio (Listonella) anguillarum у личинок камбалы ( Scophthalmus maximus L.). Аквакультура 255: 323–333. Google ученый29.
К. Х. Порсби , К. Ф. Нильсен & Л. Грамм . 2008 г. Phaeobacter и Ruegeria видов клады Roseobacter колонизируют отдельные ниши на датской ферме по выращиванию тюрбо ( Scophthalmus maximus ) и противодействуют Vibrio anguillarum в различных условиях роста. Заявл. Environ. Микробиол . 74: 7356–7364. Google ученый30.
С. Ренгпипат , С. Рукпратанпорн , С. Пиятыратитиворакуль & П. Менасавета . 2000. Повышение иммунитета у черной тигровой креветки ( Penaeus monodon ) с помощью бактерии-пробионта ( Bacillus S11). Аквакультура 191: 271–288. Google ученый31.
К. Руис-Понте , Дж.Ф. Самаин , Х. Л. Санчес & Дж. Л. Николас . 1999. Польза видов Roseobacter на выживаемость личинок гребешка. Mar. Biotechnol. (Нью-Йорк) 1: 52–59. Google ученый32.
Ю. З. Сунь , Х. Л. Ян , Р. Л. Ма & В. Ю. Линь . 2010. Применение пробиотиков двух доминирующих штаммов кишечника Bacillus с антагонистической активностью улучшило показатели роста и иммунные ответы групера Epinephelus coioides . Иммунол рыбных моллюсков . 29: 803–809. Google ученый33.
М. Э. Тисдейл , Дж. Лю , Дж. Уоллес , Ф. Ахлаги & Д. К. Роули . 2009. Вторичные метаболиты, продуцируемые морской бактерией Halobacillus salinus , которые ингибируют фенотипы, контролируемые чувствительностью кворума, у грамотрицательных бактерий. Заявл. Environ. Микробиол . 75: 567–572. Google ученый34.
Ф. Л. Томпсон , П. К. Абреу & Р. О. Кавалли . 1999. Использование микроорганизмов в качестве источника пищи для личинок Penaeus paulensis . Аквакультура 174: 139–153. Google ученый35.
Х. С. Тубиаш , П. Э. Ченли & Э. Лейфсон . 1965. Бациллярный некроз, болезнь личинок и молоди двустворчатых моллюсков: I. Этиология и эпизоотология. J. Бактериальные . 90: 1036–1044. Google ученый36.
Л. Вершуере , Г. Ромбо , П. Соргелоос & W. Verstraete . 2000. Пробиотические бактерии как агенты биологической борьбы в аквакультуре. Microbiol. Мол. Биол. Ред. . 64: 655–671. Google ученый37.
А. Вильяльба , К. С. Рис , М. К. Ордас , С.М. Касас & А. Фигерас . 2004. Перкинноз у моллюсков: обзор. Aquat. Жилой ресурс . 17: 411–432. Google ученыйАдгезия и колонизация потенциального пробионта Pseudomonas aeruginosa FARP72 в кишечнике желтохвостого сома, Pangasius pangasius
Balcazar JL, Vendrell D, Blas ID, Ruiz-Zarzuela I, Girones O, Muzquiz JL16 (2008) , конкурентоспособный адгезия и продукция антагонистических соединений молочнокислыми бактериями против патогенов рыб.Vet Microbiol 122 (3-4): 373-380
Google ученый
Collado MC, Meriluoto J, Salminen S (2008) Адгезионные и агрегационные свойства пробиотических и патогенных штаммов. Eur Food Res Technol 226: 1065–1073
CAS Статья Google ученый
Ekmekci H, Aslim B, Ozturk S (2009) Характеристика коагрегационной способности вагинальных лактобацилл с Escherichia coli .Microbiol Immunol 53 (2): 59–65
CAS Статья Google ученый
Ferguson RM, Merrifield DL, Harper GM, Rawling MD, Mustafa S, Picchietti S, Balcazar JL, Davies SJ (2010) Влияние Pediococcus acidilactici на микробиоту кишечника и иммунный статус растущей красной тилапии ( Oreochromis niloticus ). J Appl Microbiol 109 (3): 851–862
CAS Статья Google ученый
Fernandes IM, Bastos YF, Barreto DS, Lourenço LS, Penha JM (2017) Эффективность гвоздичного масла в качестве анестетика и при процедуре эвтаназии для тропических рыб небольшого размера.Braz J Biol 77 (3): 444–450
CAS Статья Google ученый
Ghosh K, Roy M, Kar N, Ringo E (2010) Желудочно-кишечные бактерии в rohu, Labeo rohita сканирующая электронная микроскопия и бактериологическое исследование. Acta Ichthyol Piscat 40 (2): 129–135
Статья Google ученый
Hoque F (2015) Скрининг и характеристика антагониста Pseudomonas aeruginosa FARP 72 в качестве потенциального пробиотического агента.Индийская рыба J 62 (4): 80–90
Google ученый
Hoque F, Abraham TJ, Nagesh TS, Kamilya D (2019) Pseudomonas aeruginosa FARP 72 предлагает защиту от инфекции Aeromonas hydrophila в Labeo rohita . Пробиотики Антимикробные белки 11 (3): 973–980
Статья Google ученый
Ибрагим Ф., Оувеханд А.С., Салминен С.Дж. (2004) Влияние температуры на адгезию in vitro потенциальных пробиотиков рыб.Microb Ecol Health Dis 16 (4): 222–227
CAS Google ученый
Kesarcodi-Watson A, Kaspar H, Lategan MJ, Gibson L (2008) Пробиотики в аквакультуре: необходимые принципы и механизмы действия и процессы скрининга. Аквакультура 274: 1–14
Статья Google ученый
Kos B, Suskovic J, Vukovic S, Simpraga M, Frece J, Matosic S (2003) Адгезионная и агрегационная способность пробиотического штамма Lactobacillus acidophilus M92.J Appl Microbiol 94: 981–987
CAS Статья Google ученый
Lehata S, Inagaki T, Okunishi S, Nakano M, Tanaka R, Maeda H (2010) Улучшенная среда кишечника морского ушка Haliotis gigantea — Pediococcus sp. Ab1 лечение. Аквакультура 305: 59–65
Статья Google ученый
Magariños B, Romalde JL, Noya M, Barja JL, Toranzo AE (1996) Адгезия и инвазивные способности патогена рыб Pasteurella piscicida .FEMS Microbiol Lett 138 (1): 29–34
Статья Google ученый
Merrifield W, Dimitroglou A, Foey A, Davies SJ, Baker RTM, Bøgwald J, Castex M, Ringø E (2010) Текущее состояние и будущее применение пробиотиков и пребиотиков для лососевых. Аквакультура 302 (1-2): 1–18
Статья Google ученый
Monteagudo-Mera A, Rastall RA, Gibson GR, Charalampopoulos D, Chatzifragkou A (2019) Механизмы адгезии, опосредованные пробиотиками и пребиотиками, и их потенциальное влияние на здоровье человека.Appl Microbiol Biotechnol 103: 6463–6472
CAS Статья Google ученый
Nikoskelainen S, Salminen S, Bylund G, Ouwehand A (2001) Характеристика свойств человеческих и молочных пробиотиков для профилактики инфекционных заболеваний у рыб. Appl Environ Microbiol 67: 2430–2435
CAS Статья Google ученый
Ouwehand AC, Kirjavainen PV, Gronlund MM, Isolauri E, Salminen S (1999) Адгезия пробиотических микробиотических микроорганизмов к кишечной слизи.Int Dairy J 9 (9): 623–630
Артикул Google ученый
Pan X, Wu T, Zhang L, Song Z, Tang H, Zhao Z (2008) Оценка in vitro адгезии и антимикробных свойств пробиотика-кандидата Clostridium butyricum CB2 для выращиваемых рыб. J Appl Microbiol 105: 1623–1629
CAS Статья Google ученый
Planas M, Perez-Lorenzo M, Hjelm M, Gram L, Fiksdal IU, Bergh Ø (2006) Пробиотический эффект in vivo штамма Roseobacter против Vibrio ( Listonella ) anguillarum anguillarum камбала ( Scophthalmus maximus L.) личинки. Аквакультура 255 (1–4): 323–333
Статья Google ученый
Ringø E, Olsen RE (1999) Влияние диеты на аэробную бактериальную флору, связанную с кишечником арктического гольца ( Salvelinus alpinus L.). J Appl Microbiol 86 (1): 22–28
Статья Google ученый
Ringø E, Olsen RE, Mayhew TM, Myklebust R (2003) Электронная микроскопия кишечной микрофлоры рыб.Аквакультура 227: 395–415
Статья Google ученый
Ringø E, Wesmajervi MS, Bendiksen HR, Berg A, Olsen RE, Johnsen T. et al (2001) Идентификация и характеристика карнобактерий, выделенных из кишечника рыб. Syst Appl Microbiol 24: 183–191
Статья Google ученый
Rinkinen M, Matto J, Salminen S, Westermarck E, Ouwehand AC (2000) Прилипание молочнокислых бактерий к слизи тонкого кишечника собак in vitro.J Anim Physiol Anim Nutr 84: 43–47
Статья Google ученый
Schaber JA, Hammond A, Carty NL, Williams SC, Colmer-Hamood JA, Burrowes BH, Dhevan V, Griswold JA, Hamood AN (2007) Разнообразие биопленок, образованных клиническими изолятами Pseudomonas aeruginosa с дефицитом кворум-чувствительности . J Med Microbiol 56: 738–748
CAS Статья Google ученый
Sugimura Y, Hagi T, Hoshino T (2011) Корреляция между адгезией слизи in vitro и способностью молочнокислых бактерий к колонизации in vivo: скрининг новых кандидатов в пробиотики карпа.Biosci Biotechnol Biochem 75 (3): 511–515
CAS Статья Google ученый
Thomas-Jinu S, Goodwin AE (2004) Острая инфекция столбчатой формы у канального сома Ictalurus punctatus ( Rafinesque ): эффективность практических методов обработки водоемов теплой воды для аквакультуры. J Fish Dis 27 (1): 23–28
CAS Статья Google ученый
Tuomola EM, Salminen SJ (1998) Адгезия некоторых пробиотических и молочных штаммов Lactobacillus к культурам клеток Caco-2.Int J Food Microbiol 41 (1): 45–51
CAS Статья Google ученый
Verschuere L, Rombaut G, Sorgeloos P, Verstraete W (2000) Пробиотические бактерии как агенты биологической борьбы в аквакультуре. Microbiol Mol Biol Res 64 (4): 655–671
CAS Статья Google ученый
Villamil L, Tafalla C, Figueras A, Novoa B (2002) Оценка иммуномодулирующих эффектов молочнокислых бактерий у камбалы ( Scophthalmus maximus ).J Clin Diag Lab Immunol 9 (6): 1318–1323
CAS Google ученый
Vine NG, Leukes WD, Kaiser H (2004) In vitro характеристики роста пяти пробиотиков-кандидатов для аквакультуры — двух рыбных патогенов, выращенных в кишечной слизи рыб. FEMS Lett Microbiol 231 (1): 145–152
CAS Статья Google ученый
Wang Y, Ren Z, Fu L, Su X (2016) Два высокоадгезивных штамма молочнокислых бактерий защищают рыбок данио, инфицированных Aeromonas hydrophila , вызывая иммунитет слизистой оболочки кишечника.J Appl Microbiol 120 (2): 441–451
CAS Статья Google ученый
Юсефиан М., Амири М.С. (2009) Обзор использования пребиотиков в аквакультуре для рыб и креветок. African J Biotechnol 8 (25): 7313–7318
CAS Google ученый
Термодинамический скачок от пребиотических микросистем к первичным живым клеткам [v1]
Препринт Статья Версия 1 Сохранено в Portico. Эта версия не рецензировалась.
Версия 1 : Получено: 25 июня 2019 г. / Утверждено: 28 июня 2019 г. / Онлайн: 4 июля 2019 г. (00:00:00 CEST)Версия 2 : Получено: 25 июня 2019 г. / Утверждено: 28 июня 2019 г. / Онлайн: 6 октября 2019 г. (00:00:00 CEST)
Также существует рецензируемая статья этого препринта.
Компаниченко В. Термодинамический скачок от пребиотических микросистем к первичным живым клеткам. Sci 2020 , 2 , 14. Компаниченко В. Термодинамический скачок от пребиотических микросистем к первичным живым клеткам. Sci 2020, 2, 14. Копировать
Ссылка на журнал: Sci 2020, 2, 14
DOI: 10.3390 / sci2010014
Цитируйте как:
Компаниченко В. Термодинамический скачок от пребиотических микросистем к первичным живым клеткам. Sci 2020 , 2 , 14.Компаниченко В. Термодинамический скачок от пребиотических микросистем к первичным живым клеткам. Sci 2020, 2, 14. Копировать
ОТМЕНА КОПИРОВАТЬ ДЕТАЛИ ЦИТАТЫ
Абстрактный
Предполагается, что первичные живые клетки («пробионты») не могут появиться из органического вещества просто в результате непрерывного химического усложнения макромолекул и микросистем пребиотиков. Осложнение должно сопровождаться радикальной термодинамической трансформацией («скачком») пребиотических микросистем, результатом которой стала приобретенная способность извлекать свободную энергию из окружающей среды и экспортировать энтропию.Это преобразование называется «термодинамической инверсией». Инверсия может происходить посредством эффективного (усиленного) отклика микросистем на колебания физико-химических параметров в гидротермальной среде. В этом случае избыток доступной свободной энергии в микросистеме в сочетании с информационной модальностью способствует ее преобразованию в новую микросистему — живого пробионта. Показано схематическое изображение осциллирующей пребиотической микросистемы, трансформирующейся в живой пробионт.Предлагается новый вид лабораторных и вычислительных экспериментов по химии пребиотиков в осциллирующих условиях для проверки концепции инверсии.
Ключевые слова
происхождение жизни; пребиотическая система; живая клетка; колебание; органическая молекула; эксперимент; гидротермальная система
Это статья в открытом доступе, распространяемая по лицензии Creative Commons Attribution License, которая разрешает неограниченное использование, распространение и воспроизведение на любом носителе при условии правильного цитирования оригинальной работы.
Комментарии (0)
Мы приветствуем комментарии и отзывы широкого круга читателей. См. Критерии для комментариев и наше заявление о разнообразии.
что это?
Добавьте запись об этом обзоре в Publons, чтобы отслеживать и демонстрировать свой опыт рецензирования в мировых журналах.
×Phaeobacter gallaeciensis Уменьшает Vibrio anguillarum в культурах микроводорослей и коловраток и предотвращает вибриоз у личинок трески
Abstract
Phaeobacter gallaeciensis может противодействовать патогенным рыбам бактериям in vitro , и целью этого исследования было оценить этот организм как пробионт для личинок морских рыб и их кормовых культур.Предполагается, что механизм действия in vivo антагонистической пробиотической бактерии основан на использовании неантагонистического мутанта. P. gallaeciensis был легко установлен в аксенических культурах двух микроводорослей Tetraselmis suecica и Nannochloropsis oculata и коловратки Brachionus plicatilis . P. gallaeciensis достиг плотности 10 7 КОЕ / мл и не оказал отрицательного воздействия на рост водорослей или коловраток. Vibrio anguillarum был значительно снижен диким типом P.gallaeciensis при интродукции в эти культуры. Мутант P. gallaeciensis , который не продуцировал антибактериальное соединение троподитиетиновая кислота (TDA), не уменьшал количество V. anguillarum , что позволяет предположить, что продукция антибактериального соединения важна для антагонистических свойств P. gallaeciensis . Способность P. gallaeciensis защищать личинок рыб от вибриоза определяли в эксперименте с заражением в ванне с использованием системы с несколькими порциями с 1 личинкой на лунку.Незараженные личинки достигли 40% накопленной смертности, которая увеличилась до 100% при заражении V. anguillarum . P. gallaeciensis снизил смертность зараженных личинок трески ( Gadus morhua ) до 10%, что значительно ниже уровней зараженных и незараженных личинок. Мутант TDA снижал смертность личинок трески в некоторых повторностях, хотя и в гораздо меньшей степени, чем у дикого типа. Сделан вывод, что P. gallaeciensis является многообещающим пробионтом для выращивания морских личинок и что продукция TDA, вероятно, способствует его пробиотическому эффекту.
Образец цитирования: D’Alvise PW, Lillebø S, Prol-Garcia MJ, Wergeland HI, Nielsen KF, Bergh Ø, et al. (2012) Phaeobacter gallaeciensis Снижает Vibrio anguillarum в культурах микроводорослей и коловраток и предотвращает вибриоз у личинок трески. PLoS ONE 7 (8): e43996. https://doi.org/10.1371/journal.pone.0043996
Редактор: Дэниел Меррифилд, Плимутский университет, Соединенное Королевство
Поступила: 26.03.2012; Одобрена: 27 июля 2012 г .; Опубликован: 22 августа 2012 г.
Авторские права: © D’Alvise, et al.Это статья в открытом доступе, распространяемая в соответствии с условиями лицензии Creative Commons Attribution License, которая разрешает неограниченное использование, распространение и воспроизведение на любом носителе при условии указания автора и источника.
Финансирование: Это исследование финансировалось Датским исследовательским советом по технологиям и производству в рамках проекта 09-066524 (Биоактивные бактериальные поверхности биопленок в аквакультуре — профилактика заболеваний без антибиотиков). Финансирующие организации не играли никакой роли в дизайне исследования, сборе и анализе данных, принятии решения о публикации или подготовке рукописи.
Конкурирующие интересы: Авторы заявили об отсутствии конкурирующих интересов.
Введение
Одной из основных задач морской аквакультуры является непрерывное и надежное производство молоди. Серьезные потери при выращивании морских личинок вызваны инфицированием условно-патогенными бактериями, в том числе несколькими членами семейства Vibrionaceae [1], [2], что составляет примерно 1,5% бактериального сообщества в океанах [3].Только около вида Vibrio являются патогенными для организмов, выращиваемых в морской аквакультуре, и одним из наиболее известных патогенов рыб и моллюсков является Vibrio (Listonella) anguillarum , вызывающий серьезные заболевания и смертность [2]. Основным источником патогенных бактерий в морской аквакультуре является питьевая вода [4], но также возможными источниками патогенов являются расплод, люди или заквасочные культуры [5]. Большинство личинок морских рыб интенсивно выращиваются в присутствии микроводорослей (зеленая вода), что улучшает питание, рост и выживаемость личинок [6] — [9].Личинкам нужен живой корм, и коловратки ( Brachionus plicatilis ) обычно используются в качестве первого корма. Сами коловратки питаются или обогащаются живыми микроводорослями, такими как Tetraselmis suecica , Nannochloropsis oculata и Isochrysis galbana . Оппортунистические патогены могут размножаться в личиночных кормовых культурах фитопланктона и беспозвоночных из-за высоких концентраций органического вещества. Таким образом, культуры водорослей, коловраток и артемии могут содержать высокие концентрации патогенных бактерий [1], [5], [10], [11].Профилактическая обработка личинок или их кормовых культур антибиотиками может снизить нагрузку патогенов, но этого следует избегать, поскольку это приводит к появлению устойчивых к антибиотикам патогенов и препятствует созданию нормальной непатогенной микробиоты [1], [12], [13].
Потенциальное использование пробиотических бактерий для ограничения вспышек или последствий бактериальных заболеваний в культурах рыб и беспозвоночных исследуется более двух десятилетий. Большинство исследований сосредоточено на кишечной микробиоте [14] — [19], хотя использование пробиотиков не ограничивается кишечным трактом культивируемых организмов [15], [20].Биотические и абиотические поверхности, водоросли и фекальные частицы, а также богатая питательными веществами вода служат средой обитания и резервуаром условно-патогенных бактерий в культурах личинок рыб или их пищевых организмов [1], [5], [10], [11], [20], и предполагается, что конкуренция со стороны непатогенных бактерий, которые лучше колонизируются и сохраняются в этих средах обитания, может снизить количество патогенных бактерий.
Phaeobacter gallaeciensis (ранее Roseobacter gallaeciensis ) представляет собой грамотрицательную протеобактерию α- из клады Roseobacter [21].Бактерия продуцирует антибактериальное соединение троподитиетиновая кислота (TDA), которая является эффективным ингибитором V. anguillarum и других патогенных для рыб бактерий [22] — [25]. Phaeobacter spp. обычно выделяются из культур личинок морских рыб и моллюсков [26] — [28] и, по-видимому, не оказывают неблагоприятного воздействия на личинок рыб [22], [29]. Ruegeria mobilis , близкий родственник Phaeobacter , также продуцирующий TDA, является космополитической морской бактерией, которую можно изолировать из большинства океанических вод, кроме полярных [30].
В предыдущем исследовании было продемонстрировано, что Phaeobacter и Ruegeria , выделенные из инкубатория камбалы [26], могут уничтожить V. anguillarum в комбинированной системе жидкость-поверхность на основе морской воды [22]. С использованием TDA-отрицательного мутанта было продемонстрировано, что продукция TDA, вероятно, является ключевым фактором ингибирования патогена. Цель настоящего исследования — определить, может ли P. gallaeciensis BS107 (DSM 17395) противодействовать V.anguillarum в личинках рыб и культурах их кормовых организмов. Насколько известно авторам, ни одно исследование антагонистических пробиотических бактерий еще не выяснило механизм действия in vivo . Поэтому неантагонистический TDA-отрицательный мутант P. gallaeciensis BS107 (DSM 17395) был создан для исследования механизма действия in vivo , как подчеркнули Tinh et al . [15]. Был выбран типовой штамм P. gallaeciensis BS107 (DSM17395) [28], поскольку он ингибирует V.anguillarum в культурах Tetraselmis был более выраженным, чем у других штаммов Phaeobacter и Ruegeria , по оценке в предварительном эксперименте (данные не показаны). Гнотобиотические водоросли и коловратки использовались для изучения пробиотических и пищевых эффектов интродуцированного организма в соответствии с рекомендациями [15], [31], [32].
Материалы и методы
Бактериальные штаммы и среды
Все штаммы и плазмиды перечислены в таблице 1. Phaeobacter (Roseobacter) gallaeciensis BS107 (DSM17395) был выделен из морской воды в культурах гребешка ( Pecten maximus ) [28]. Vibrio anguillarum штамм NB10 серотипа O1 был использован в экспериментах с водорослями и коловратками. Он был изолирован в Ботническом заливе и вызвал заболевание у радужной форели [33], [34]. Штамм был помечен вставкой плазмиды pNQFlaC4-gfp27 ( cat , gfp ) в межгенную область на хромосоме и любезно предоставлен D.Милтон, Университет Умео [35]. V. anguillarum серотип O2α HI610 использовали в контрольных испытаниях с личинками трески. Этот штамм был выделен Институтом морских исследований (IMR) Норвегии из больных молоди трески в закрытом бассейне с морской водой озера Парисватн и использовался в контрольных испытаниях с треской [36] — [39]. Он был выбран из группы, состоящей из штаммов V. anguillarum различных серотипов, являющихся штаммом, который вызвал самую высокую смертность в контрольных испытаниях с палтусом, палтусом и личинками трески [40].
Бактерии из замороженных исходных культур (-80 ° C) наносили штрихами на морской агар половинной концентрации (½MA; 27,6 г морского агара Difco 212185, 15 г растворимых морских солей океана, 7,5 г агара, 1 л деионизированной воды). ½MA также использовалось для подсчета P. gallaeciensis . V. anguillarum подсчитывали на триптон-соевом агаре (TSA; Oxoid CM0131), содержащем 6 мг / л хлорамфеникола. Предварительные культуры бактерий для экспериментов с водорослями и коловратками выращивали в 20 мл ½YTSS (2 г экстракта бакто-дрожжей, 1.25 г бакто триптона, 20 г солей Sigma Sea, 1 л деионизированной воды) [41] при 25 ° C с аэрацией (200 об / мин) до OD 600 = 1,0. Клетки собирали в количестве 5000 x г , дважды промывали и использовали в качестве инокулята для экспериментов с водорослями и коловратками. Бактерии разбавляли и промывали в искусственной морской воде (ASW; 2% Sigma Sea Salts). Аксеничность культур водорослей и коловраток контролировали, высевая 100 мкл на 1/2 МА и инкубируя в течение 7 дней при 25 ° C.
Для контрольных испытаний, В.anguillarum HI610 выращивали в триптон-соевом бульоне с дополнительным 0,5% NaCl при 20 ° C со встряхиванием при 60 об / мин до OD 600 примерно 0,5. Штаммы P. gallaeciensis выращивали в МБ без встряхивания при 20 ° C до достижения стационарной фазы. Все штаммы собирали центрифугированием (1825 x г, ), дважды промывали и ресуспендировали в аэрированной автоклавированной 80% морской воде. Концентрации бактерий в этих суспензиях определяли с помощью счетной камеры для В.anguillarum и для штаммов P. gallaeciensis путем измерения OD 600 после центрифугирования и растворения в 0,1 М NaOH.
Получение TDA-отрицательного мутанта
Phaeobacter Мутантная библиотека P. gallaeciensis BS107 была создана с помощью мутагенеза случайной вставки транспозонов с использованием набора транспозом EZ-Tn5
Флуоресцентное мечение
PhaeobacterP. gallaeciensis BS107 был хромосомно помечен кассетой miniTn7 (Gm) P A1 / 04/03 DsRedExpress-a с использованием системы тегирования mini-Tn7 [43], [44]. Доставляющую и вспомогательную плазмиды электропорировали в P. gallaeciensis с последующим отбором на 1/2MA, содержащей 75 мкг / мл гентамицина. pPDA11, транскрипционное слияние промотора tdaC с без промоторного гена gfp , лигированного с плазмидой pRK415 широкого диапазона хозяев, было сконструировано аналогично pHG1011, как описано в Geng et al .2010 [45].
Антагонизм Phaeobacter у водорослейTetraselmis suecica CCAP 66/4 ( Prasinophyceae ) был получен как аксеническая культура из Коллекции культур водорослей и простейших (Обан, Великобритания). Его культивировали на B-medium [46], минеральной среде для водорослей, основанной на ASW. Бутылки для культивирования на 250 мл закрывали ватными пробками и медленно аэрировали через шприц-фильтр 0,2 мкм и силиконовую трубку для предотвращения оседания частиц. Интенсивность света на бутылках составляла 13000 люкс (дневной спектр).Концентрации водорослей оценивали путем измерения поглощения при 665 нм и калибровки с помощью подсчета аксенических эталонных культур в счетной камере, усовершенствованной по Нойбауэру, с использованием формальдегида в качестве фиксатора (конечная концентрация 0,5%). Для каждого испытанного уровня инокулята V. anguillarum восемь бутылок по 150 мл B-среды инокулировали 6,6 × 10 4 клеток / мл аксеника T. suecica . Два флакона инокулировали примерно 10 7 КОЕ / мл промытого P. gallaeciensis BS107, два флакона с таким же уровнем промытого мутанта P.gallaeciensis BS107-Pda8, и четыре флакона были оставлены аксеническими. Культуры выращивали в течение 2 дней и проверяли аксеничность. Все культуры, за исключением двух аксенических отрицательных контролей, инокулировали V. anguillarum NB10 до концентраций 10, 100, 1000 или 10 4 КОЕ / мл. Уровни посевного материала проверяли подсчетом на чашках. Концентрацию водорослей и обоих видов бактерий наблюдали до 5 дня после инокуляции патогена. Два независимых эксперимента были выполнены для каждой начальной концентрации В.anguillarum . Nannochloropsis oculata CCMP525 ( Eustigmatophyceae ) был получен как аксеническая культура из Центра культуры морского фитопланктона (West Boothbay Harbor, ME). Поскольку он не рос в среде B на основе ASW, его культивировали в среде f / 2 [47] на основе атлантической морской воды, полученной от CCMP. N. oculata культуры не аэрировали. Эксперименты по антагонизму проводили, как и в случае T. suecica , но тестировали только одну исходную концентрацию V. anguillarum (10 4 КОЕ / мл).Были проведены два независимых эксперимента с двумя различными исходными плотностями водорослей (более низкая плотность: 4 × 10 6 клеток / мл, более высокая плотность: 2 × 10 7 клеток / мл).
Анализ TDA
Образцы совместных культур T. suecica — P. gallaeciensis (20 мл) экстрагировали в 50-миллилитровые пробирки с 30 мл этилацетата (степень чистоты для ВЭЖХ), содержащего 1% муравьиную кислоту (степень чистоты для ВЭЖХ), на встряхивающем столе для 1 ч. Образцы центрифугировали при 8000 x г , и 26 мл верхней фазы переносили в новую пробирку Falcon и упаривали досуха при 35 ° C в токе азота.Образцы ресуспендировали в 300 мкл 85% ацетонитрила, встряхивали в течение 5 секунд, помещали в ванну для ультразвуковой обработки на 10 минут, снова встряхивали в течение 5 секунд и фильтровали через стандартный 0,22 мкм шприцевой фильтр PFTE во флакон для ВЭЖХ. Затем подвыборки объемом 2 мкл анализировали с помощью УВЭЖХ-TOFMS на квадрупольном времяпролетном масс-спектрометре maXis G3 (Bruker Daltonics, Бремен, Германия), оборудованном источником ионов с электрораспылением (ESI), который был подключен к системе Ultimate 3000 UHPLC (Dionex, Саннивейл, Калифорния). Разделение проводили при 40 ° C на 100 мм × 2.Внутренний диаметр 1 мм, 2,6 мкм Колонка Kinetex C 18 (Phenomenex, Торранс, Калифорния), оборудованная предварительной колонкой Kinetex, с использованием градиента вода-ацетонитрил (оба забуферены 20 мМ муравьиной кислоты) при потоке 0,4 мл мин. -1 , начиная с 10% ацетонитрила и увеличиваясь до 100% за 10 минут, выдерживая это в течение 3 минут. МС работал в ESI + с диапазоном сбора данных m / z 100–1000 при разрешении 40 000 FMWH, МС был откалиброван с использованием 20 мМ формиата натрия, вводимого перед каждым аналитическим циклом, что обеспечивало точность измерения массы лучше 1 .5 частей на миллион. ТДА детектировали и количественно определяли по хроматограммам экстрагированных ионов [M + H] + (± m / z 0,001).
Для количественной оценки культур T. suecica были добавлены до конечной концентрации 4800, 2400, 1600, 800, 320, 160 и 0 нМ ТДА (BioViotica, Dransfeld, Германия) путем добавления максимум 80 мкл Раствор TDA-ацетонитрил и обрабатывают, как описано выше. Перед экстракцией образцы с добавками оставляли при комнатной температуре не менее чем на 1 час. Метод был проверен в 3 разных дня с использованием образцов с добавками, как описано, и не было зарегистрировано ни одного ложноположительного или отрицательного результата.Относительное стандартное отклонение составляло 30%, а предел обнаружения был оценен как <50 нМ (сигнал / шум 5∶1) на основе холостых образцов и нижних калибровочных точек. На чувствительность сильно влиял возраст колонки УВЭЖХ, так как TDA оставалась хвостовой (хотя использовалась новая предварительная колонка) на колонках, которые использовались всего несколько недель. Образцы из двух индивидуальных биологических экспериментов анализировали независимо.
Отсутствие TDA в статических культурах TDA-отрицательного мутанта BS107-Pda8 было подтверждено UHPLC-TOFMS анализом.
Антагонизм к Phaeobacter у коловраток, Brachionus plicatilis
Подвой коловратки B. plicatilis (L-тип) был получен от Reed Mariculture (Кэмпбелл, Калифорния). Аксенические коловратки были получены путем дезинфекции приблизительно 50 яиц амиктических коловраток в 1 мл сильного раствора антибиотика (150 мкг / мл тетрациклина, 300 мкг / мл канамицина, 60 мкг / мл хлорамфеникола, 1000 Ед / мл пенициллина в ASW) в течение 2 дней. Вылупившихся коловраток фильтровали через стерильную полиамидную сетку с размером пор 50 мкм, промывали ASW и с этого момента скармливали концентрированным аксеником T.suecica . Никаких экспериментов с N. oculata в качестве корма для коловраток не проводилось, поскольку выживаемость V. anguillarum в присутствии N. oculata была очень изменчивой (см. Раздел «Результаты»). Плотность коловраток определяли путем подсчета в счетной камере Sedgewick-Rafter. Перед подсчетом культуры тщательно перемешивали и к 1 мл образца добавляли 100 мкл 5% формальдегида. Для проведения экспериментов по совместному культивированию культуры аксенных коловраток были разделены на восемь 20-миллилитровых партий в 50-миллилитровых центрифужных пробирках.Начальные концентрации коловраток составляли 94 / мл (первый повтор) и 30 / мл (второй повтор). Для каждого повтора дублированные культуры инокулировали промытым диким типом и мутантом P. gallaeciensis в концентрации приблизительно 5 × 10 7 КОЕ / мл. На следующий день все культуры, кроме аксенических контролей, инокулировали 10 4 КОЕ / мл V. anguillarum . Все культуры коловраток ежедневно получали 10-кратную концентрацию T. suecica (1-2 мл в зависимости от средней плотности коловраток), так что концентрация водорослей после кормления составляла примерно 10 6 клеток / мл и не опускалась ниже 2 × 10 5 клеток / мл.Коловратки подсчитывали ежедневно, определяли концентрации V. anguillarum и P. gallaeciensis и проверяли аксеничность отрицательных контролей. Образцы культур коловраток для подсчета бактерий гомогенизировали измельчением и повторным пипетированием через наконечник пипетки на 100 мкл. Это сравнивали с гомогенизацией с помощью Ultra-Turrax T25 (IKA, Германия) при 16000 об / мин, и не было обнаружено значительных различий в количестве бактерий (P = 0,74).
Пробное испытание
Протокол был адаптирован из [39], [40].Эмбрионы трески ( Gadus morhua ) были получены из коммерческого инкубатория Havlandet AS во Флорё, Западная Норвегия. Транспортировка эмбрионов в контейнерах из полистирола при температуре около 8 ° C заняла в общей сложности от 4 до 5 часов на лодке и автомобиле. Были проведены две независимые повторы испытания с заражением. Эмбрионы, использованные в первом испытании, были продезинфицированы баффодином (Evans Vanodine, Престон, Великобритания), эмбрионы для второго испытания остались без лечения. По прибытии эмбрионы были случайным образом отобраны и распределены в лунки 24-луночных чашек (Nunc, Роскилле, Дания), заполненных 2 мл 80% автоклавированной аэрированной морской воды, помещая по одному эмбриону в каждую лунку.В каждом испытании готовили по три чашки для каждой обработки (72 эмбриона) и сразу же инокулировали. Шесть групп обработки перечислены в таблице 2. Все инокуляты были приготовлены в объеме 100 мкл, и штаммы не смешивались перед инокуляцией. Исходные бактериальные концентрации составляли 1 × 10 6 КОЕ / мл для V. anguillarum HI610 и около 10 7 КОЕ / мл для штаммов P. gallaeciensis . Планшеты инкубировали в темноте при 7 ° C. День, когда вылупилось 50% личинок, был определен как день 0, то есть через 6 дней после начала эксперимента.Ежедневно в течение 14 дней регистрировали погибших личинок.
Статистика
Различия между концентрациями бактерий или водорослей оценивали с помощью дисперсионного анализа с повторными измерениями после логарифмической трансформации. Для попарных сравнений использовался критерий множественного сравнения Тьюки. Чтобы устранить влияние присутствия P. gallaeciensis на концентрации V. anguillarum , исходные значения (день 0) не учитывались в анализе, и эксперименты анализировались отдельно. Перед применением дисперсионного анализа числа коловраток не преобразовывались в логарифм, и исходные значения не указывались.Количество P. gallaeciensis и методы гомогенизации сравнивали с использованием парных t-критериев после логарифмического преобразования.
Совокупную смертность в испытаниях с заражением сравнивали на 10-й день, до наступления голодания к концу эксперимента. Был реализован тест хи-квадрат для 2 2 таблиц сопряженности с использованием программного обеспечения R, версия 2.13.1 (R Foundation for Statistical Computing, Вена, Австрия).
Результаты
Антагонизм в культурах водорослей
Как дикий тип, так и мутант P.gallaeciensis колонизировал культуры T. suecica и N. oculata . В культурах T. suecica P. gallaeciensis достигло 10 7 КОЕ / мл (рис. 1). В плотных культурах N. oculata , P. gallaeciensis концентрации составляли приблизительно 5 × 10 6 КОЕ / мл, а в менее плотных культурах — приблизительно 8 × 10 5 КОЕ / мл (Рисунок S1). Дикий тип Phaeobacter достиг немного большего числа у T.suecica , чем TDA-отрицательный мутант (P = 0,0211). Такое же небольшое различие было замечено в одном из двух экспериментов Nannochloropsis (P = 0,0335, P = 0,9259). P. gallaeciensis не влиял на рост водорослей T. suecica (P = 0,9977) и N. oculata (P = 0,9919). Частицы, состоящие из мертвых T. suecica и клеточных стенок водорослей, которые были сброшены во время деления клеток, служили средой обитания для розетки, образующей P. gallaeciensis , которая образовывала плотные биопленки на частицах (Рисунок 2 A – D).
Рис. 1. Концентрации Tetraselmis suecica и Phaeobacter gallaeciensis в совместных культурах.
Средние значения и стандартные отклонения восьми экспериментов: колониеобразующие единицы P. gallaeciensis дикого типа (♦) и TDA-отрицательный мутант (•) и концентрации T. suecica с V. anguillarum ( ▾), T. suecica с P. gallaeciensis дикого типа (▪), T. suecica с P.gallaeciensis TDA-отрицательный мутант () и аксенический T. suecica (□). Штаммы P. gallaeciensis были инокулированы с концентрацией 10 7 КОЕ / мл и оставались стабильной популяцией, в то время как водоросли перешли из поздней логарифмической фазы в стационарную фазу.
https://doi.org/10.1371/journal.pone.0043996.g001
Рисунок 2. Локализация бактерий в культурах Tetraselmis suecica .
Фазово-контрастные (A, C) и флуоресцентные (B, D, E) микрофотографии.Совместное культивирование Tetraselmis suecica с Phaeobacter gallaeciensis dsRed (A, B), аксеническое T. suecica (C, D), совместное культивирование T. suecica с V. anguillarum gfp. ). На панелях A и B показаны две одиночные (слева) и одна делящаяся водорослевая клетка (справа), а также морская снежно-подобная частица, состоящая из остатков водорослей, которая заселена красными флуоресцентными P. gallaeciensis . Красная флуоресценция водорослей обусловлена хлорофиллом. Панели C и D показывают водорослевую клетку и частицы из аксенической культуры, записанные с использованием тех же настроек, что и для панелей выше.На панели E показаны красно-флуоресцентные клетки водорослей и зеленые флуоресцентные V. anguillarum , которые не колонизируют частицы, а остаются в суспензии в виде отдельных подвижных клеток.
https://doi.org/10.1371/journal.pone.0043996.g002
V. anguillarum эффективно колонизировал все культуры Tetraselmis , которые не были инокулированы P. gallaeciensis , и их количество увеличилось до 2,7 log единиц в течение первого дня (рис. 3, рис. S2) и достигла в среднем 3 × 10 6 КОЕ / мл через 5 дней. V. anguillarum не колонизировал частицы в культурах водорослей, но оставался в суспензии (рис. 2 E). Количество V. anguillarum заметно уменьшалось в присутствии P. gallaeciensis дикого типа (фиг. 3, фиг. S2). Снижение Vibrio было порядка 3 логарифмических единиц по сравнению с моноксенными контролями только с V. anguillarum , а полное устранение самого низкого посевного материала Vibrio было достигнуто в 3 из 4 повторов (рис. 3A).Эффекты дикого типа P. gallaeciensis на V. anguillarum были очень значимыми во всех экспериментах Tetraselmis по сравнению с контролем (P <0,001) и мутантом (P <0,001). Присутствие TDA-отрицательного мутанта действительно уменьшало концентрацию патогена примерно на одну логарифмическую единицу, хотя это было значимо только (α = 0,05) для двух из исходных концентраций Vibrio (10 1 : P = 0,0518, 10 2 : P = 0,0011, 10 3 : P = 0.0517, 10 4 : P = 0,0008).
Рисунок 3. Уменьшение V. anguillarum в культурах Tetraselmis suecica с помощью Phaeobacter gallaeciensis .
Колониеобразующие единицы V. anguillarum , инокулированные при 10 1 КОЕ / мл (A) и 10 4 КОЕ / мл (B) в присутствии P. gallaeciensis дикого типа (▪), в присутствии TDA-отрицательного мутанта P. gallaeciensis () и в моноксенном контроле ().
https://doi.org/10.1371/journal.pone.0043996.g003
Заметное различие в ингибировании V. anguillarum диким типом P. gallaeciensis и отрицательным мутантом TDA предполагает, что TDA является основным эффектором. молекула. Однако TDA не был обнаружен химическим анализом совместных культур Phaeobacter – Tetraselmis , где каждая из трех повторностей культур была проанализирована в трех повторностях с пределом обнаружения <50 нМ TDA. Эксперимент и анализ были повторены с тем же результатом.Чтобы определить, действительно ли дикий тип продуцирует TDA в культурах водорослей, P. gallaeciensis , несущий pPDA11 ( tdaCp :: gfp ), культивировали совместно с T . suecica. Промотор tdaC , свидетельствующий о продукции TDA, был индуцирован при выращивании на частицах в культуре T. suecica , на что указывает флуоресценция Gfp (фиг. 4). Добавление чистого TDA к культурам Tetraselmis , инокулированным V. anguillarum , привело к полному уничтожению популяции Vibrio , но также повлияло на выживаемость водорослей (50 мкМ TDA).Более низкая концентрация в 50 раз (1 мкМ) не оказала влияния на водоросли, но временно снизила уровень V. anguillarum ниже 10 КОЕ / мл. Концентрация 50 нМ TDA, которая была пределом обнаружения химического анализа, не имела никакого эффекта (данные не показаны).
Фиг.4. Экспрессия tdaC при совместном культивировании с Tetraselmis suecica .
Фазово-контрастные (A) и флуоресцентные (B) микрофотографии P. gallaeciensis pPDA11 ( tdaCp :: gfp ) в совместном культивировании с T.suecica . На двух панелях показаны одни и те же семь водорослевых клеток, некоторые из которых деляются, и морская снежно-подобная частица, которая колонизируется P. gallaeciensis , несущим слияние промотора на плазмиде. Зеленая флуоресценция P. gallaeciensis на частице показывает, что ген gfp экспрессируется с промотора tdaC, что указывает на продукцию TDA.
https://doi.org/10.1371/journal.pone.0043996.g004
V. anguillarum был полностью элиминирован в культурах Nannochloropsis oculata дикого типа P.gallaeciensis в течение одного или двух дней (рисунок S3). Однако V. anguillarum мог существовать только в плотных культурах N. oculata . В менее плотных культурах N. oculata V. anguillarum исчезли из моноксенного контроля в течение 3 дней. Следовательно, влияние дикого типа P. gallaeciensis на V. anguillarum по сравнению с контролем было значительным в эксперименте с высокой плотностью водорослей (P = 0,001), но не с низкой плотностью (P = 0). .2106).
Антагонизм в культурах коловраток
Концентрация P. gallaeciensis и его мутанта в культурах коловраток была стабильной и составляла примерно 10 6 –10 7 КОЕ / мл, и не наблюдалось значительной разницы между двумя штаммами (P = 0,3689). Коловратки росли быстрее и достигли более высокой плотности в присутствии P. gallaeciensis , чем в аксеническом или моноксенном ( V. anguillarum ) контроле (P <0,05) (Рисунок 5, Рисунок S4).Дикий тип P. gallaeciensis снизил концентрацию V. anguillarum на 3 log единицы (P <0,01), в среднем с 6 × 10 5 до 9 × 10 2 КОЕ / мл (рис. 6). Влияние TDA-отрицательного мутанта на концентрацию патогена было незначительным (P> 0,05).
Рисунок 5. Влияние штаммов бактерий на рост коловраток.
Число коловраток в совместном культивировании с P. gallaeciensis дикого типа (▾), с TDA-отрицательным мутантом P.gallaeciensis (♦), только с V. anguillarum (▴) и аксеническими коловратками (▪), первый эксперимент. Все бактерии были инокулированы в день 0. Оба штамма P. gallaeciensis способствовали росту коловраток, тогда как V. anguillarum не влияли.
https://doi.org/10.1371/journal.pone.0043996.g005
Рис. 6. Уменьшение Vibrio anguillarum на Phaeobacter gallaeciensis в культурах коловраток.
Средние значения двух повторных опытов: колониеобразующие единицы В.anguillarum в совместном культивировании с P. gallaeciensis дикого типа (), с TDA-отрицательным мутантом P. gallaeciensis () и в моноксенном контроле (▪).
https://doi.org/10.1371/journal.pone.0043996.g006
Пробное испытание
Через шесть дней после прибытия эмбрионов и инокуляции более 50% личинок вылупились. Общий совокупный успех вылупления составил 79,2% (первое испытание 79,6% и второе испытание 78,7%). Первоначальная смертность была ниже в первом испытании (16.6%), чем во втором (24,8%). В не зараженном и необработанном контроле 34,7% ± 9,8% (среднее ± стандартное отклонение) личинок погибли к 1-му дню, однако после начальной смертности только 2,8% ± 0% личинок погибли между 2-м и 2-м днями. на 10-й день, достигая к 10-му дню совокупной смертности 37,5% ± 9,8%. Личинки, зараженные V. anguillarum HI610, быстро погибли и достигли накопленной смертности 100% ± 0%. Обработка личинок Vibrio дикого типа P. gallaeciensis вызвала значительное снижение накопленной смертности к 10–12-му дню.5% ± 2,0%, что было не только ниже, чем у зараженных личинок, но и ниже, чем у не зараженных (37,5%). 96,1% ± 1,1% вылупившихся личинок, которые получили P. gallaeciensis дикого типа , дожили до 10-го дня, когда наступил голод (Рисунок 7, Рисунок S5). Личинки, подвергшиеся воздействию только P. gallaeciensis дикого типа или мутанта, имели кумулятивную смертность 12,1% ± 3,1% на 10-й день. TDA-отрицательный мутант P. gallaeciensis действительно снизил совокупную смертность зараженных личинок до 68.8% ± 30,4% (рис. 7, рис. S5), но не был таким эффективным, как дикий тип, продуцирующий TDA.
Рис. 7. Смертность личинок трески во время контрольных испытаний.
Средние значения двух независимых трехкратных экспериментов. Культуры одиночных личинок одновременно инокулировали P. gallaeciensis дикого типа и V. anguillarum (T5, •) или TDA-отрицательным мутантом P. gallaeciensis и V. anguillarum (T6, □). Необработанные личинки и личинки, подвергшиеся воздействию отдельных штаммов бактерий, выступали в качестве контроля: отрицательный контроль (T1, ▪), только V.anguillarum (T2, ▴), только P. gallaeciensis дикого типа (T3,) и только P. gallaeciensis TDA-отрицательный мутант (T4, ♦).
https://doi.org/10.1371/journal.pone.0043996.g007
Обсуждение
Настоящее исследование демонстрирует, что Phaeobacter gallaeciensis безвреден и полезен для трески на ранних этапах жизни. Не менее важно, что P. gallaeciensis очень эффективен в предотвращении инфекций, вызванных V.anguillarum , и этот пробиотический эффект может быть достигнут при низкой температуре (7 ° C), используемой для эмбрионов трески и личинок желточного мешка. Ранее было продемонстрировано, что Phaeobacter sp. может защитить личинок камбалы от вибриоза при более высоких температурах (18 ° C) [29]. Неинфицированные личинки показали некоторый уровень исходной смертности, которая могла быть связана с оппортунистическими бактериями, занесенными с эмбрионами. Как зараженные, так и необработанные личинки трески, подвергшиеся воздействию P. gallaeciensis , имели значительно более низкую исходную смертность, что указывает на то, что естественная микробиота хориона может контролироваться пробионтом.
Ключевым вопросом при использовании пробиотиков в аквакультуре является то, как и где пробионт следует вводить в систему. В нескольких исследованиях подчеркивалась потенциальная роль кормовых организмов как носителя для пробиотических бактерий [29], [48] — [51] или способность пробиотических бактерий контролировать патогенные бактерии в кормовых культурах [51] — [53]. Большинство исследований были сосредоточены на кишечных пробиотических бактериях и были направлены на улучшение здоровья либо выращиваемых животных, либо кормовых организмов.Напротив, в настоящем исследовании используется системный подход к предотвращению бактериальных заболеваний организмов аквакультуры, направленный на микробный контроль во всей среде выращиваемого организма и на более низких трофических уровнях продукции. Здесь было обнаружено, что культуры двух водорослей, имеющих отношение к аквакультуре, и коловратки B. plicatilis могут быть колонизированы P. gallaeciensis без ущерба для их роста, и что P. gallaeciensis в этих культурах будет сильно уменьшать или устранить рыб-патогенные В.anguillarum . Введение P. gallaeciensis на этом трофическом уровне очень многообещающе, поскольку живой корм является обычным источником условно-патогенных микроорганизмов [1], [5], [10], [11]. Эти результаты подтверждают гипотезу предыдущего исследования о том, что водоросли и коловратки в аквакультуре можно культивировать вместе с пробиотиком Roseobacters и, таким образом, предотвратить распространение патогенов [22]. Редукция патогенного возбудителя Vibrio sp. на 3 логарифмических единицы, как это было достигнуто в настоящем исследовании, является очень многообещающим с точки зрения укрепления здоровья личинок, поскольку только одно логарифмическое снижение бактериальной нагрузки у коловраток с помощью УФ-излучения привело к более высокой выживаемости личинок камбалы [54].Использование пробиотических бактерий по сравнению с УФ-обработкой дает то преимущество, что питательные вещества потребляются, ниши заняты, и предотвращается быстрый повторный рост патогенов. Следует отметить, что настоящее исследование было проведено с использованием систем гнотобиотиков, чтобы исключить влияние микробиоты, присущей водорослям и культурам коловраток. Таким образом, невозможно определить, повлияет ли P. gallaeciensis и в какой степени на внутренние микробные сообщества культур водорослей и коловраток.
Торможение В.anguillarum с помощью Phaeobacter sp. в модельной аквакультуре уже однажды изучались: Planas et al . [29] продемонстрировали, что смертность личинок камбала, инфицированных V. anguillarum , может быть снижена за счет Phaeobacter sp. 27-4. Использовали дублирующую установку резервуара, и патоген, и пробионт помещали в коловратки и скармливали личинкам. Несмотря на доставку с кормом, пробионт был обнаружен только в просвете личиночной кишки и не колонизировал кишечный эпителий.В отличие от этого, настоящее исследование не нацелено на пробиотический эффект в кишечном тракте личинок, а оценивает потенциал Phaeobacter для устранения патогена в среде личинок или эмбрионов. Следует отметить, что, поскольку личинки начинают пить вскоре после вылупления [55], в кишечнике могут встречаться патогены и пробионты. Phaeobacter sp. 27-4 является продуцентом TDA, однако, в отличие от P. gallaeciensis BS107, он продуцирует TDA только в застойной культуре [26], что позволяет предположить, что его продукция TDA может быть более ограничена и что BS107 может быть более антагонистическим в vivo .
В испытании контрольного заражения TDA-отрицательный мутант снижал исходную смертность так же эффективно, как и мутант дикого типа, но не мог предотвратить инфекцию у большинства личинок. Пробиотический эффект мутанта можно объяснить конкуренцией за питательные вещества, пространство или другие ресурсы или прямым иммуностимулирующим действием на личинок [56] — [59]. Мутировавший ген, который делает P. gallaeciensis BS107-Pda8 неспособным продуцировать TDA, принадлежит оперону, кодирующему части транспортного белка, который, как еще не сообщалось, участвует в производстве TDA [42].Роль этого трансмембранного белка в продукции TDA не исследовалась. Нельзя исключить, что эта мутация имеет плейотропные фенотипические эффекты, и другие функции, помимо продукции TDA, могут быть затронуты и могут повлиять на антагонистические свойства Phaeobacter gallaeciensis . Тем не менее, эксперимент с использованием чистого TDA показал, что это соединение действительно оказывает сильное ингибирующее действие против V. anguillarum в системе водорослей.
Различие в антагонизме Vibrio между TDA-отрицательным мутантом и диким типом предполагает, что продукция TDA является признаком, обеспечивающим P.gallaeciensis , чтобы противостоять V. anguillarum . Однако TDA не был обнаружен химическим анализом совместных культур Phaeobacter-Tetraselmis . Поскольку слияние tdaC с промотором ( tdaCp :: gfp ) продемонстрировало, что tdaC экспрессируется P. gallaeciensis в частицах в культурах водорослей, причина отсутствия химического обнаружения может заключаться в том, что концентрация TDA достигает ингибирующих концентраций только в Phaeobacter -колонизированных частицах.ТДА, вероятно, концентрируется внутри и вокруг частиц, прилипает к органической массе частицы или удерживается внутри EPS, производимого P. gallaeciensis . С экологической точки зрения, для морской бактерии, связанной с частицами, производство антагонистического соединения было бы более эффективным, если бы соединение не было диспергировано, а хранилось в непосредственной близости от возможных конкурентов.
Хотя TDA-продуцирующие Phaeobacter и Ruegeria spp.вероятно, уже присутствуют в системах выращивания личинок, их антагонистические свойства, которые могут зависеть от условий роста, вероятно, отличаются от P. gallaeciensis BS107 [22], [26]. Предварительный эксперимент этого исследования показал, что только некоторые из протестированных штаммов Phaeobacter и Ruegeria были антагонистами в культурах T. suecica , тогда как все они учитывали большие зоны ингибирования в анализах на агаровой основе. Таким образом, интродукция P.gallaeciensis BS107 в культурах водорослей и коловраток, вероятно, повысит выживаемость личинок, даже если другие Roseobacters уже присутствуют в системе. Его стимулирующий рост эффект на коловраток может дать неожиданное дополнительное преимущество. Неизвестно, связано ли это с питательной ценностью бактерий или с их потенциальной ролью в кишечнике коловраток. В настоящем исследовании на рост коловраток не повлиял V. anguillarum . Тем не менее, штамм V. anguillarum , как сообщается, вызывает выраженное ингибирование роста коловраток при неоптимальных схемах кормления [60], что, возможно, можно исправить с помощью P.gallaeciensis .
Невозможно предсказать, будут ли и как другие патогены в водорослях и культурах коловраток подавляются P. gallaeciensis , однако ряд патогенов рыб подавляется in vitro P. gallaeciensis [22], [25] ], что указывает на то, что он, вероятно, может защитить от других патогенов, кроме V. anguillarum . Порсби и др. . [61] рассмотрели опасения, что устойчивость к TDA может развиваться, и с помощью нескольких экспериментальных подходов обнаружили, что устойчивые мутанты или варианты не могут быть выделены ни из культур краткосрочной селекции, содержащих различные концентрации TDA, ни в результате долгосрочной адаптации. культуры (> 300 поколений), содержащие увеличивающиеся концентрации TDA.
Недавнее исследование показало, что P. gallaeciensis при инкубации с п-кумаровой кислотой продуцировал сильнодействующие альгициды, розеобактины, которые были эффективны против различных микроводорослей, среди которых T. suecica [62]. П-кумаровая кислота — продукт распада лигнина, который содержится не только в наземных растениях, но и в водорослях. Получение альгицидов было возможно только при концентрациях п-кумаровой кислоты выше 0,4 мМ. Авторы предположили, что P.gallaeciensis способствует здоровью и росту водорослей, выделяя ТДА и фенилуксусную кислоту, но производит альгициды в присутствии п-кумарата, который является индикатором старения водорослей, чтобы использовать биомассу водорослей для собственного роста [62]. Однако в настоящем исследовании не наблюдалось отрицательного воздействия P. gallaeciensis на рост водорослей. Возможно, уровни п-кумаровой кислоты в культурах микроводорослей были слишком низкими для производства розеобактицида. Экологическая экологическая ниша P.gallaeciensis еще не описан, хотя исследования Rao et al . [63] — [65] указывают на то, что он предпочитает поверхность макроводорослей, которые во время их разложения могут объяснять более высокие локальные концентрации п-кумаровой кислоты, чем микроводоросли. На аквакультурной ферме Phaeobacter spp. было обнаружено, что они «естественным образом» встречаются на твердых поверхностях, тогда как только Ruegeria spp. были изначально связаны с культурами водорослей [26].
На основании представленных данных предполагается, что P.gallaeciensis может использоваться в морском культивировании личинок в качестве средства борьбы с потенциально опасной микробиотой окружающей среды в культурах коловраток и микроводорослей, а также в качестве профилактики вибриоза у личинок рыб.
Вспомогательная информация
Рисунок S1.
Концентрации Nannochloropsis oculata и Phaeobacter gallaeciensis в совместных культурах. Колониеобразующие единицы P.gallaeciensis дикого типа (•) и TDA-отрицательного мутанта (□), а также концентрации N. oculata с V. anguillarum (▴), N. oculata с P. gallaeciensis дикого типа (▾ ), N. oculata с P. gallaeciensis TDA-отрицательным мутантом (♦) и аксеническим N. oculata (▪) в плотных (A) и менее плотных (B) культурах.
https://doi.org/10.1371/journal.pone.0043996.s001
(TIF)
Рисунок S2.
Уменьшение Vibrio anguillarum на Phaeobacter gallaeciensis в культурах Tetraselmis suecica . Колониеобразующие единицы V. anguillarum , инокулированные при 10 2 КОЕ / мл (A) и 10 3 КОЕ / мл (B) в присутствии P. gallaeciensis дикого типа (▪), в наличие TDA-отрицательного мутанта P. gallaeciensis () и в моноксенном контроле ().
https://doi.org/10.1371/journal.pone.0043996.s002
(TIF)
Рисунок S3.
Снижение Vibrio anguillarum на Phaeobacter gallaeciensis в культурах Nannochloropsis oculata . Колониеобразующие единицы V. anguillarum в присутствии P. gallaeciensis дикого типа (▴), в присутствии P.gallaeciensis TDA-отрицательный мутант (▾), а в моноксенном контроле (▪) в плотном (3 × 10 7 клеток / мл; A) и менее плотном (1–7 × 10 6 клеток / мл; Б) культуры N. oculata .
https://doi.org/10.1371/journal.pone.0043996.s003
(TIF)
Рисунок S4.
Влияние штаммов бактерий на рост коловраток. Число коловраток в совместном культивировании с P. gallaeciensis дикого типа (▾), с TDA-отрицательным мутантом P.gallaeciensis (♦), только с V. anguillarum (▴) и аксеническими коловратками (▪), второй эксперимент. Все бактерии были инокулированы в день 0. Оба штамма P. gallaeciensis способствовали росту коловраток, тогда как V. anguillarum не влияли.
https://doi.org/10.1371/journal.pone.0043996.s004
(TIF)
Рисунок S5.
Смертность личинок трески во время контрольных испытаний. Средние значения двух независимых трехкратных экспериментов с планками ошибок, указывающими на стандартные отклонения.Культуры одиночных личинок одновременно инокулировали P. gallaeciensis дикого типа и V. anguillarum (T5, •) или TDA-отрицательным мутантом P. gallaeciensis и V. anguillarum (T6, □). Неоткрытые личинки и личинки, подвергшиеся воздействию отдельных штаммов бактерий, выступали в качестве контроля: отрицательный контроль (T1, ▪), только V. anguillarum (T2, ▴), только P. gallaeciensis дикого типа (T3, ▾) и только P. gallaeciensis TDA-отрицательный мутант (T4, ♦).
https://doi.org/10.1371/journal.pone.0043996.s005
(TIF)
Благодарности
Мы хотели бы поблагодарить Дебру Милтон из Университета Умео за предоставление хромосомно-меченного Vibrio anguillarum NB10. Мы также благодарим Пола Хеннинга Левика за помощь в проведении экспериментов.
Вклад авторов
Задумал и спроектировал эксперименты: PD SL HIW KFN ØB LG. Проведены эксперименты: PD SL MJP KFN HIW ØB.Проанализированы данные: PD SL KFN HIW ØB LG. Написал бумагу: PD LG.
Список литературы
- 1. Олафсен Дж. А. (2001) Взаимодействие между личинками рыб и бактериями в морской аквакультуре. Aquacult 200: 223–247.
- 2. Торанцо А.Е., Магаринос Б., Ромальде Дж.Л. (2005) Обзор основных 3. бактериальных болезней рыб в системах марикультуры. Aquacult 246: 37–61.
- 3. Wietz M, Gram L, Jorgensen B, Schramm A (2010) Широтные закономерности численности основных групп морского бактериопланктона.Aquat Microb Ecol 61: 179–189.
- 4. Дуйе П.А., Пикеринг П.Л. (1999) Обработка морской водой для выращивания личинок рыб Sciaenops ocellatus Linnaeus (красный барабан). Aquacult 170: 113–126.
- 5. Эдди С.Д., Джонс С.Х. (2002) Микробиология выращивания летней камбалы Paralichthys dentatus на заводе по выращиванию морской рыбы. Aquacult 211: 9–28.
- 6. Salvesen I, Reitan KI, Skjermo J, Oie G (2000) Микробная среда в морском выращивании личинок: влияние скорости роста водорослей на бактериальную нагрузку в шести микроводорослях.Aquacult Int 8: 275–287.
- 7. Conceicao LEC, Юфера М., Макридис П., Мораис С., Динис М. Т. (2010) Живые корма для ранних стадий выращивания рыбы. Исследования аквакультуры 41: 613–640.
- 8. Naas KE, Naess T, Harboe T (1992) Улучшенное 1-е кормление личинок палтуса ( Hippoglossus hippoglossus, л) в зеленой воде. Aquacult 105: 143–156.
- 9. Skjermo J, Vadstein O (1999) Методы микробного контроля при интенсивном выращивании морских личинок.Aquacult 177: 333–343.
- 10. Munro PD, Barbour A, Birkbeck TH (1995) Сравнение роста и выживаемости личинок тюрбата в отсутствие культивируемых бактерий с бактериями в присутствии Vibrio anguillarum , Vibrio alginolyticus , или A Marine Aeromonas Sp. Appl Environ Microbiol 61: 4425–4428.
- 11. Reid HI, Treasurer JW, Adam B, Birkbeck TH (2009) Анализ бактериальных популяций в кишечнике развивающихся личинок трески и идентификация Vibrio logei , Vibrio anguillarum и Vibrio splendidus как возбудителей личинок трески.Aquacult 288: 36–43.
- 12. Cabello FC (2006) Интенсивное использование профилактических антибиотиков в аквакультуре: растущая проблема для здоровья человека и животных, а также для окружающей среды. Env Microbiol 8: 1137–1144.
- 13. Skjermo J, Salvesen I, Oie G, Olsen Y, Vadstein O (1997) Вода, созревшая на микробах: метод отбора неопортунистической бактериальной флоры в воде, которая может улучшить продуктивность морских личинок. Aquacult Int 5: 13–28.
- 14. Vine NG, Leukes WD, Kaiser H (2006) Пробиотики в морском гусенице.FEMS Microb Rev 30: 404–427.
- 15. Tinh NTN, Dierckens K, Sorgeloos P, Bossier P (2008) Обзор функциональности пробиотиков в пищевой цепи личинок. Mar Biotechnol 10: 1–12.
- 16. Ван Ю.Б., Ли Дж. Р., Линь Дж. Д. (2008) Пробиотики в аквакультуре: проблемы и перспективы. Aquacult 281: 1–4.
- 17. Kesarcodi-Watson A, Kaspar H, Lategan MJ, Gibson L (2008) Пробиотики в аквакультуре: необходимость, принципы и механизмы действия и процессы скрининга.Aquacult 274: 1–14.
- 18. Ирианто А., Остин Б. (2002) Пробиотики в аквакультуре. J? Fish Dis 25: 633–642.
- 19. Balcazar JL, de Blas I, Ruiz-Zarzuela I, Cunningham D, Vendrell D, et al. (2006) Роль пробиотиков в аквакультуре. Ветеринарная микробиология 114: 173–186.
- 20. Verschuere L, Rombaut G, Sorgeloos P, Verstraete W (2000) Пробиотические бактерии как агенты биологической борьбы в аквакультуре. Microbiol Mol Biol Rev 64: 655–671.
- 21. Мартенс Т., Хайдорн Т., Пукалл Р., Саймон М., Тиндалл Б.Дж. и др. (2006) Реклассификация Roseobacter gallaeciensis Ruiz-Ponte, et al. 1998 как Phaeobacter gallaeciensis gen. нов., гребешок. nov., описание Phaeobacter ignens sp nov., реклассификация Ruegeria algicola (Lafay, et al. 1995) Uchino, et al. 1999 как Marinovum algicola gen. нов., гребешок. nov., и исправленные описания родов Roseobacter , Ruegeria и Leisingera .Международный журнал систематической и эволюционной микробиологии 56: 1293–1304.
- 22. D’Alvise PW, Melchiorsen J, Porsby CH, Nielsen KF, Gram L (2010) Инактивация Vibrio anguillarum прикрепленными и планктонными клетками Roseobacter . Appl Environ Microbiol 76: 2366–2370.
- 23. Брун Дж. Б., Нильсен К. Ф., Хьельм М., Хансен М., Брешиани Дж. И др. (2005) Экология, ингибирующая активность и морфогенез морской антагонистической бактерии, принадлежащей к кладе Roseobacter .Appl Environ Microbiol 71: 7263–7270.
- 24. Брун Дж. Б., Грам Л., Белас Р. (2007) Производство антибактериальных соединений и формирование биопленок видами Roseobacter На видов влияют условия культивирования. Appl Environ Microbiol 73: 442–450.
- 25. Prado S, Montes J, Romalde JL, Barja JL (2009) Ингибирующая активность штаммов Phaeobacter против патогенных бактерий аквакультуры. Int Microbiol 12: 107–114.
- 26. Porsby CH, Nielsen KF, Gram L (2008) Phaeobacter и Ruegeria вида клады Roseobacter колонизируют отдельные ниши в датской тюрбо ( Scophthalmus maximus ), выращивающей ферму, и противодействуют 1492 разному росту Vibrio условия.Appl Environ Microbiol 74: 7356–7364.
- 27. Hjelm M, Bergh O, Riaza A, Nielsen J, Melchiorsen J и др. (2004) Селекция и идентификация автохтонных потенциальных пробиотических бактерий из личинок камбала ( Scophthalmus maximus ), выращивающих особи. Syst Appl Microbiol 27: 360–371.
- 28. Ruiz-Ponte C, Cilia V, Lambert C, Nicolas JL (1998) Roseobacter gallaeciensis sp. nov., новая морская бактерия, выделенная из выращиваний и собирателей гребешка Pecten maximus .Инт? J? Системный бактериол 48: 537–542.
- 29. Planas M, Perez-Lorenzo M, Hjelm M, Gram L, Fiksdal IU и др. (2006) Пробиотический эффект in vivo Roseobacter штамма 27-4 против Vibrio ( Listonella ) anguillarum , инфицированных личинками камбала ( Scophthalmus maximus L.). Aquacult 255: 323–333.
- 30. Грам Л., Мельхиорсен Дж., Брюн Дж. Б. (2010) Антибактериальная активность морских культивируемых бактерий, собранных из глобального отбора проб поверхностных вод океана и поверхностных мазков морских организмов.Mar Biotechnol 12: 439–451.
- 31. Tinh NTN, Phuoc NN, Dierckens K, Sorgeloos P, Bossier P (2006) Гнотобиотически выращенная коловратка Brachionus plicatilis sensu strictu как инструмент для оценки микробных функций и питательной ценности различных типов пищи. Aquacult 253: 421–432.
- 32. Мартинес-Диас С.Ф., Варес-Гонсалес К.А., Легоррета М.М., Васкес-Хуарес Р., Барриос-Гонсалес Дж. (2003) Устранение ассоциированного микробного сообщества и биоинкапсуляция бактерий в коловратке Brachionus plicatilis .Aquacult Int 11: 95–108.
- 33. Norqvist A, Norrman B, Wolfwatz H (1990) Идентификация и характеристика металлопротеиназы цинка, связанной с инвазией патогена рыб Vibrio anguillarum . Заражение иммунной 58: 3731–3736.
- 34. Norqvist A, Hagstrom A, Wolfwatz H (1989) Защита радужной форели от вибриоза и фурункулеза с помощью ослабленных штаммов Vibrio anguillarum . Appl Environ Microbiol 55: 1400–1405.
- 35. Croxatto A, Lauritz J, Chen C, Milton DL (2007) Vibrio anguillarum для колонизации покровов радужной форели требуется локус ДНК, участвующий в транспорте и биосинтезе экзополисахаридов. Env Microbiol 9: 370–382.
- 36. Samuelsen OB, Bergh O (2004) Эффективность перорального приема флорфеникола и оксолиновой кислоты для лечения вибриоза трески ( Gadus morhua ). Aquacult 235: 27–35.
- 37. Vik-Mo FT, Bergh O, Samuelsen OB (2005) Эффективность перорального введения флумекина при лечении вибриоза, вызванного Listonella anguillarum у атлантической трески Gadus morhua.Dis Aquat Org 67: 87–92.
- 38. Seljestokken B, Bergh O, Melingen GO, Rudra H, Olsen RH и др. (2006) Лечение экспериментально индуцированного вибриоза ( Listonella anguillarum ) трески Gadus morhua L. с помощью флорфеникола. Журнал болезней рыб 29: 737–742.
- 39. Sandlund N, Bergh O (2008) Скрининг и характеристика потенциально патогенных бактерий, связанных с личинками атлантической трески Gadus morhua : испытания в ванне с использованием системы с несколькими чашками.Dis Aquat Org 81: 203–217.
- 40. Sandlund N, Rodseth OM, Knappskog DH, Fiksdal IU, Bergh O (2010) Сравнительная восприимчивость личинок камбалы, палтуса и желточного мешка трески к заражению Vibrio spp. Dis Aquat Org 89: 29–37.
- 41. Sobecky PA, Mincer TJ, Chang MC, Helinski DR (1997) Плазмиды, выделенные из микробных сообществ морских отложений, содержат области репликации и несовместимости, не связанные с таковыми из известных групп плазмид. Appl Environ Microbiol 63: 888–895.
- 42. Geng HF, Bruhn JB, Nielsen KF, Gram L, Belas R (2008) Генетическое вскрытие биосинтеза троподитиетиновой кислоты морскими розеобактерами. Appl Environ Microbiol 74: 1535–1545.
- 43. Lambertsen L, Sternberg C, Molin S (2004) Транспозоны Mini-Tn7 для сайт-специфической маркировки бактерий флуоресцентными белками. Env Microbiol 6: 726–732.
- 44. Бао Ю., Лиз Д.П., Фу Х., Робертс Г.П. (1991) Улучшенная система на основе Tn7 для вставки одной копии клонированных генов в хромосомы грамотрицательных бактерий.Ген 109: 167–168.
- 45. Geng HF, Belas R (2010) Экспрессия биосинтеза троподитиетиновой кислоты контролируется новым аутоиндуктором. Журнал бактериологии 192: 4377–4387.
- 46. Хансен П.Дж. (1989) Динофлагеллята красного прилива Alexandrium tamarense — Влияние на поведение и рост инфузорий тинтиннид. Морская экология-Прогресс. Серия 53: 105–116.
- 47. Guillard RR, Ryther JH (1962) Исследования морских планктонных диатомовых водорослей.1. Cyclotella nana Hustedt и Detonula confervacea (Cleve) Gran. Канадский журнал микробиологии 8: 229– &.
- 48. Gatesoupe FJ (2002) Обработка пробиотиками и формальдегидом науплий Artemia в качестве корма для личинок минтая, Pollachius pollachius . Aquacult 212: 347–360.
- 49. Prol MJ, Bruhn JB, Pintado J, Gram L (2009) ПЦР-обнаружение в реальном времени и количественная оценка рыбьего пробиотика Phaeobacter , штамм 27-4 и патогенного рыбьего Vibrio в микроводорослях, коловратке, Artemia и первой кормовой палтусе ( Psetta maxima ) личинки.J? Appl Microbiol 106: 1292–1303.
- 50. Карневали О., Зампони М.К., Сульпицио Р., Ролло А., Нарди М. и др. (2004) Введение пробиотического штамма для улучшения здоровья морского леща во время развития. Aquacult Int 12: 377–386.
- 51. Planas M, Vazquez JA, Marques J, Perez-Lomba R, Gonzalez MP, et al. (2004) Увеличение роста коловраток ( Brachionus plicatilis ) с помощью наземных молочнокислых бактерий. Aquacult 240: 313–329.
- 52.Marques A, Dinh T, Ioakeimidis C, Huys G, Swings J и др. (2005) Влияние бактерий на Artemia franciscana , культивируемую в различных гнотобиотических средах. Appl Environ Microbiol 71: 4307–4317.
- 53. Marques A, Thanh TH, Sorgeloos P, Bossier P (2006) Использование микроводорослей и бактерий для усиления защиты гнотобиотика Artemia от различных патогенов. Aquacult 258: 116–126.
- 54. Манро П.Д., Хендерсон Р.Дж., Барбур А., Бирбек Т.Х. (1999) Частичная дезактивация коловраток ультрафиолетовым излучением: влияние изменений бактериальной нагрузки и флоры коловраток на смертность в начале кормления личинками камбала.Aquacult 170: 229–244.
- 55. Мангор-Йенсен А., Адофф Г.Р. (1987) Поовая активность только что вылупившихся личинок трески Gadus morhua L. Физиология и биохимия рыб. 3: 99–103.
- 56. Picchietti S, Mazzini M, Taddei AR, Renna R, Fausto AM и др. (2007) Влияние введения пробиотических штаммов на GALT личинок морского леща морского леща: иммуногистохимические и ультраструктурные исследования. Иммунология рыб и моллюсков 22: 57–67.
- 57.Dimitroglou A, Merrifield DL, Carnevali O, Picchietti S, Avella M и др. (2011) Манипуляции с микробами для улучшения здоровья и продуктивности рыб — Средиземноморская перспектива. Иммунология рыб и моллюсков 30: 1–16.
- 58. Ролло А., Сульпицио Р., Нарди М., Сильви С., Орпианези С. и др. (2006) Живая микробная кормовая добавка в аквакультуре для улучшения стрессоустойчивости. Физиология и биохимия рыб 32: 167–177.
- 59. Перес-Санчес Т., Бальказар Дж. Л., Меррифилд Д.Л., Карневали О., Джоаккини Дж. И др.(2011) Экспрессия иммунных генов у радужной форели ( Oncorhynchus mykiss ), индуцированная пробиотическими бактериями во время инфекции Lactococcus garvieae . Иммунология рыб и моллюсков 31: 196–201.
- 60. Harzevili ARS, VanDuffel H, Defoort T, Dhert P, Sorgeloos P, et al. (1997) Влияние выбранного штамма бактерий Vibrio anguillarum TR 27 на скорость роста коловраток в различных условиях культивирования. Aquacult Int 5: 183–188.
- 61. Porsby CH, Webber MA, Nielsen KF, Piddock LJV, Gram L (2011) Трудно выбрать устойчивость и толерантность к троподитиетовой кислоте, противомикробному препарату в аквакультуре. Противомикробные агенты и химиотерапия 55: 1332–1337.
- 62. Seyedsayamdost MR, Case RJ, Kolter R, Clardy J (2011) Химия Джекилла-и-Хайда Phaeobacter gallaeciensis . Химия природы 3: 331–335.
- 63. Рао Д., Уэбб Дж. С., Кьеллеберг С. (2005) Конкурентные взаимодействия в биопленках смешанного вида, содержащих морскую бактерию Pseudoalteromonas tunicata .Appl Environ Microbiol 71: 1729–1736.
- 64. Рао Д., Уэбб Дж. С., Кьеллеберг С. (2006) Микробная колонизация и конкуренция на морских водорослях Ulva australis . Appl Environ Microbiol 72: 5547–5555.
- 65. Рао Д., Уэбб Дж. С., Холмстром С., Случай R, Лоу А и др. (2007) Низкая плотность эпифитных бактерий из морских водорослей Ulva australis препятствует расселению организмов-обрастателей. Appl Environ Microbiol 73: 7844–7852.
Происхождение жизни до сих пор остается загадкой, потому что там не было никого, кто мог бы документировать историю происхождения жизни для нас.Однако некоторые возможные объяснения происхождения жизни давались эволюционистами в разное время. Какой из f
Вопрос:
Происхождение жизни до сих пор остается загадкой, потому что там не было никого, кто мог бы документировать историю происхождения жизни для нас. Однако некоторые возможные объяснения происхождения жизни давались эволюционистами в разное время. Что из следующего соответствует истории возникновения жизни на Земле?
А.Трудно точно определить происхождение жизни, но маленькие неживые существа могут быть синтезированы случайным образом за миллионы лет, а затем объединены в макромолекулы и, наконец, упакованы в протобионт, который, возможно, дал начало жизни.
B. Некоторые метеориты могли упасть на Землю и оставить простые молекулы, которые дали начало жизни на Земле.
C. Поскольку теперь мы знаем, что РНК может служить генетическим материалом и катализатором и способна к самовоспроизведению, РНК могла дать начало жизни.
Д.Жизнь могла начаться как химический суп из различных простых молекул (газов): аммиака, метана, водорода и водяного пара, которые были источником энергии молнии для реакции.
E. Все вышеперечисленное.
Происхождение жизни
Земля возникла 4,5 миллиарда лет назад, когда гравитационные силы притягивали облака пыли из космоса к планете. Земля не могла поддерживать жизнь в течение миллиарда лет, однако после длительной вулканической активности, похолодания и образования газов жизнь внезапно возникла из неживых компонентов.С тех пор жизнь на Земле превратилась в жизнь, существующую сейчас на Земле.
Ответ и пояснение: 1
Из представленных возможностей наиболее подходящей для истории происхождения жизни на Земле является A. Трудно точно определить …
См. Полный ответ ниже.
.
 лет
лет

 Окружено ловчими щупальцами со стрекательными клетками.
Окружено ловчими щупальцами со стрекательными клетками.
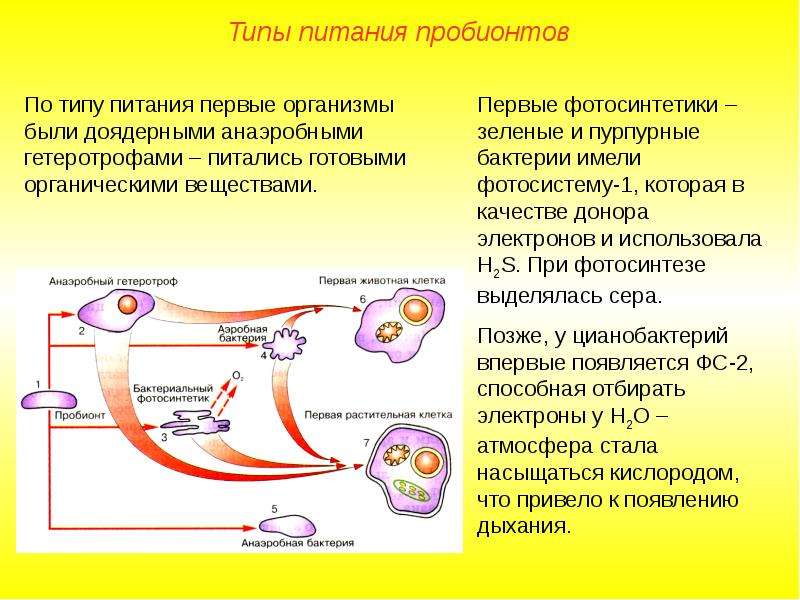
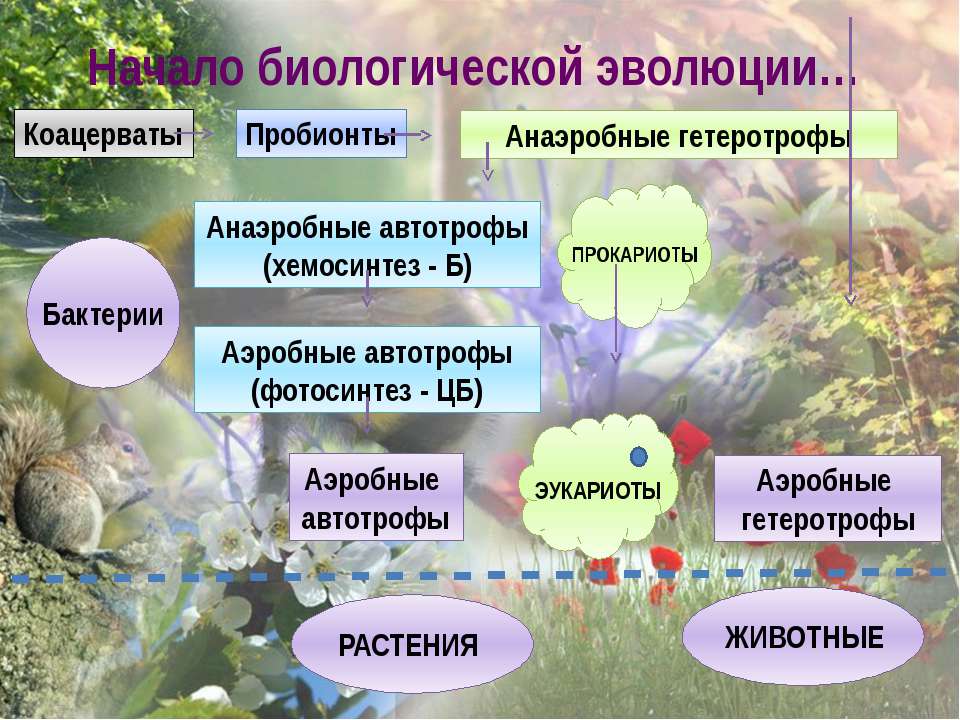


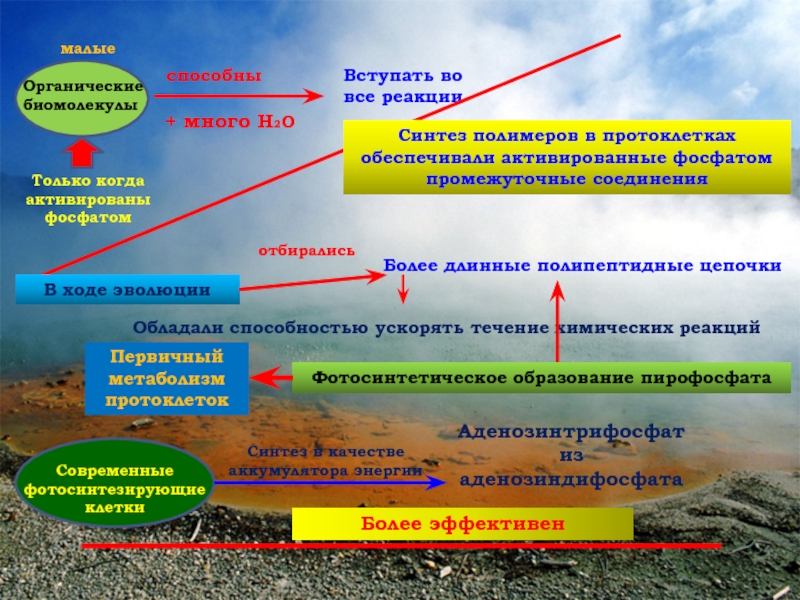
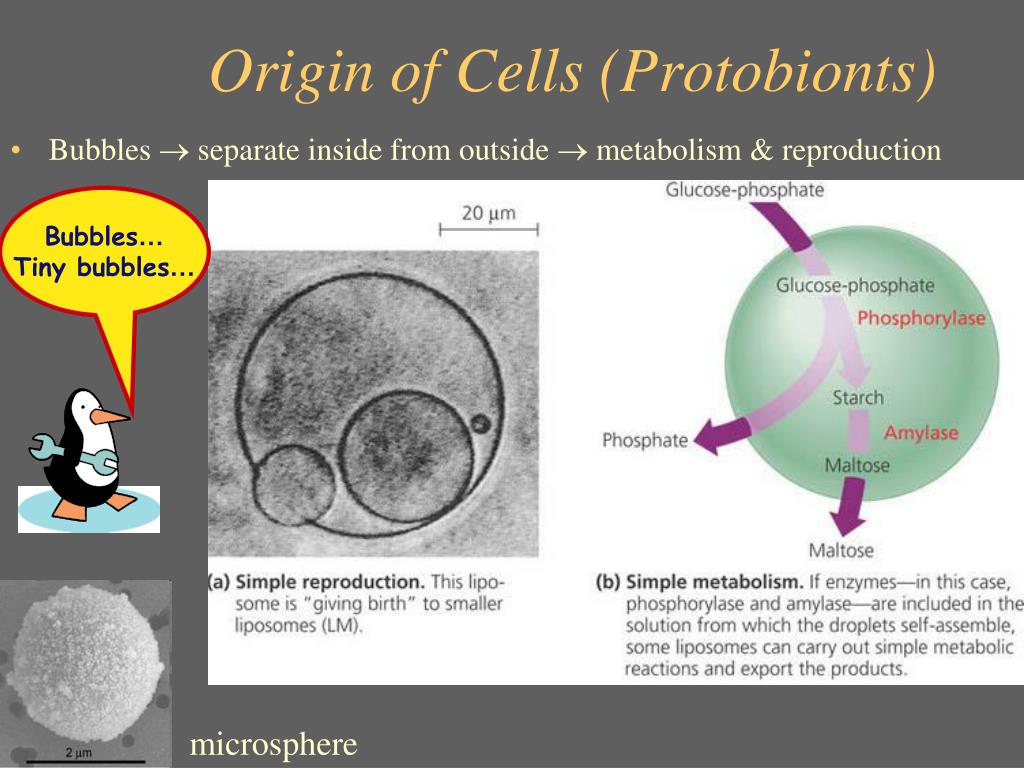 DOI: 10.1007 / 978-1-4419-0032-6_3.
Rev Environ Contam Toxicol. 2009 г.
PMID: 19484589
Рассмотрение.
DOI: 10.1007 / 978-1-4419-0032-6_3.
Rev Environ Contam Toxicol. 2009 г.
PMID: 19484589
Рассмотрение. Vet Microbiol 122 (3-4): 373-380.
Vet Microbiol 122 (3-4): 373-380. J Appl Microbiol 109 (3): 851–862
—
DOI
J Appl Microbiol 109 (3): 851–862
—
DOI