Скайраннинг — советы чайникам | АЛЬПИНДУСТРИЯ
17 ноября 2011 | Иван Григорьев
Советы и инструкции
Начало
Часть II
Продолжаю серию статей, посвящённых физиологии скайраннинга. Сегодня мы рассмотрим классификацию мышечных волокон и их изменение под воздействием различных видов нагрузки. К сожалению, многие люди не знакомы с этой информацией. Это очень грустно, потому что альпинисты должны быть сведущи в вопросах физиологии и подготовки.
Что такое альпинизм – это в первую очередь выносливость, терпилово, акклиматизация, технические прибамбасы. Всё это невозможно без грамотной подготовки — скалолазной, велосипедной, беговой, лыжной, кому как приятнее, но бег — это всё-таки основа. С помощью бега вы всегда сможете подготовить своё сердце и мышцы к любому восхождению.
Информация, публикуемая ниже, написана замечательным физиологом, нашим соотечественником Виктором Николаевичем Селуяновым. Его статьи доступны в интернете, как и большинство других материалов на тему физиологии и тренировок, но к сожалению, человек так устроен, что часто не в состоянии найти нужную информацию: некоторые материалы кажутся слишком сложными, некоторые слишком объёмными или простыми. Так произошло с моим тренером, который 12 лет бегал марафоны, «убивал» себя и не имел ни малейшего представления о физиологии. Он знал что такое интервальная работа, пано, темповик, углеводный обмен, длительная, в каких объёмах и когда нужно выполнять, но всё это происходило на уровне подсознания.
Если раньше наши тренировки носили угнетающий характер, мы молотили, что есть мочи, считали, что этого не достаточно, и молотили ещё. То теперь, помимо того, что мы не чувствовали такой усталости, за счёт того, что грамотно распределяли нагрузку, наши результаты полезли вверх. Через несколько месяцев после начала тренировок по Селуянову мы уже могли бежать по 4 минуты на км на пульсе всего-лишь 140 ударов. Правда, потом мы стали готовиться к суточному бегу и в результате измотали себя, потому что не следили за мышцами, но уже тогда мы поняли что к чему. Именно поэтому я публикую то, что проверено мной и моими друзьями, на себе, за годы тренировок.
Помимо Селуяновских статей я хотел порекомендовать ещё две книги: первая Питт Фитзингер и Скотт Дуглас «Бег по шоссе для серьёзных бегунов» и вторая Дэнни Дрэйер «Ци бег». Последнюю кстати я прочитал по рекомендации известного российского марафонца Леонида Швецова. В его словах звучали сожаления, что эта книга не попалась ему тогда, когда он только начинал свою беговую карьеру. Если у кого-то возникнут проблемы с поиском этих материалов, я могу выслать их по электронной почте, пишите.
А теперь, собственно, по делу.
Словарь чайника
МВ – мышечное волокно (волокна)
ММВ – медленные мышечные волокна
БМВ – быстрые мышечные волокна
ОМВ – окислительные мышечные волокна
ГМВ – гликолитические мышечные волокна
АэП – аэробный порог
АнП – анаэробный порог
МПК – максимальное потребление кислорода
КФ — креатинфосфат
АТФ – аденозинтрифосфорная кислота (основная «энергетическая валюта» клетки)
Миофибриллы — сократимые элементы мышечной клетки (цилиндрические нити толщиной 1 — 2 мкм, идущие вдоль от одного конца мышечного волокна до другого), сокращаются в присутствии АТФ.
Митохондрии – клеточные органеллы (элементы), в которых синтезируется АТФ за счет окислительного фосфорилирования.
Окислительное фосфорилирование – функция клеточного дыхания, при которой происходит синтез АТФ (идет в митохондриях).
Цикл Кребса (цикл трикарбоновых кислот, цикл лимонной кислоты) представляет собой серию химических реакций, протекающих в митохондриях, и является общим конечным путем окисления углеводов, липидов и белков.
Миокард – сердечная мышца
Классификация мышечных волокон. Изменение мышечной композиции под действием тренировки
Остановимся подробнее на классификации мышечных волокон. Первый способ — на быстрые мышечные волокна (БМВ) и медленные мышечные волокна (ММВ), эта классификация идет по ферменту АТФаза миофибрилл (сократительных элементов), тип которого может быть быстрым или медленным. Отсюда быстро сокращающиеся и медленно сокращающиеся МВ. Соотношение быстрых и медленных волокон определяется наследственной информацией, и изменить его мы практически не можем.
Соотношение быстрых и медленных волокон определяется наследственной информацией, и изменить его мы практически не можем.
Второй способ – разделение МВ на окислительные и гликолитические, а они делятся уже не по миофибрилле, а по количеству митохондрий (структур клетки, где происходит потребление кислорода). Если есть митохондрии, то МВ окислительные, мало митохондрий или почти нет — гликолитические. Способность МВ к гликолизу также наследуется и определяется количеством ферментов гликолитического типа. Но вот количество митохондрий достаточно легко изменяется под воздействием тренировок. И с увеличением числа митохондрий МВ, бывшее гликолитическим, становится окислительным.
К сожалению, в этом вопросе существует путаница. Обычно смешивают обе классификации. Говорят о медленных, а подразумевают окислительные, смешивают гликолитические и быстрые. На самом деле медленные тоже могут быть гликолитическими, хотя этот вариант в литературе не описывается. Но мы знаем, что если человек лежит в больнице предоперационный период, а потом ещё и послеоперационный период, то потом уже и встать не может, ходить не может.
Поэтому с точки зрения тренировочного процесса для данного спортсмена не интересно деление МВ на медленные и быстрые – это имеет значение на этапе отбора. Вся логика построения тренировки идет не с точки зрения сокращения мышц по скорости, а направлена на превращение ГМВ в окислительные. Ибо в этом случае мы изменяем конкретного человека.
Цель тренировки в циклических видах спорта — создавать митохондрии. Только митохондрии потребляют кислород, значит, спортивная форма растет по мере накопления митохондрий. Возьмем мышечное волокно. У него есть миофибриллы, каждая миофибрилла оплетается митохондриями, и больше определенного предела они не могут образоваться, только в один слой, если условно так говорить.
Вот вы начинаете правильно тренироваться и набираете митохондрий всё больше, больше и больше, мышцы переходят из формы гликолитической в окислительную, то есть с обилием митохондрий. И когда все мышечные волокна становятся окислительными — это предел спортивной формы, больше ничего не получится. Хотя тут есть одна хитрость. Дело в том, что окислительные волокна потребляют только жиры (пока есть запас жиров), а мощность при окислении жиров теряется. Отсюда получается некий парадокс — не надо делать так, чтобы мышцы были только окислительные, надо оставить немного гликолитических, иначе будете на жирах бежать, а мощность функционирования на жирах меньше примерно на 15%. Тогда те же самые мышцы будут более мощно работать. Понятно, что к лыжному спорту это тоже относится.
Хотя тут есть одна хитрость. Дело в том, что окислительные волокна потребляют только жиры (пока есть запас жиров), а мощность при окислении жиров теряется. Отсюда получается некий парадокс — не надо делать так, чтобы мышцы были только окислительные, надо оставить немного гликолитических, иначе будете на жирах бежать, а мощность функционирования на жирах меньше примерно на 15%. Тогда те же самые мышцы будут более мощно работать. Понятно, что к лыжному спорту это тоже относится.
Влияние гликолитических и окислительных мышечных волокон на результат
Так вот, вы начинаете бежать среднюю дистанцию, разбегаетесь, и выходите на порог анаэробного обмена, он как раз соответствует моменту, когда функционирует все ОМВ и даже часть гликолитических. При этом получается, что человек выходит на крейсерскую скорость. Если у него только ОМВ, то он так и будет стабильно молотить. Прибавить не может и убавить не может (убавить, конечно, может, но это ему не надо, а прибавить не может, потому что не чем добавить), он прибежит с той же самой скоростью на финиш. Если с ним будет бежать точно такой же человек, но у которого будет запас ГМВ, то он на финише всегда прибавит. Значит, получается, средневик — это человек, у которого есть запас мышечных волокон, которые он может включить в работу, и лучше быстрых гликолитических, тогда финиш будет еще быстрее. Так же и у лыжников: тот, у кого есть запас ГМВ, на финише выиграет, если дистанция будет ровная. Но, увы, так не бывает.
Если с ним будет бежать точно такой же человек, но у которого будет запас ГМВ, то он на финише всегда прибавит. Значит, получается, средневик — это человек, у которого есть запас мышечных волокон, которые он может включить в работу, и лучше быстрых гликолитических, тогда финиш будет еще быстрее. Так же и у лыжников: тот, у кого есть запас ГМВ, на финише выиграет, если дистанция будет ровная. Но, увы, так не бывает.
Снова перейдем на более простой вид спорта, велосипедный (мне ближе). Рассмотрим спортсмена, у которого ОМВ только 15-20%, остальные — гликолитические. На равнине он набирает критическую скорость, превышает её, и начинает постепенно закисляться. Проходит 5-6 минут, он попадает в мертвую точку, пульс запредельный, дышать невозможно. Спортсмен начинает мощность снижать, и через 2-3 км выходит, наконец, на ту самую скорость, которая нужна. Вот классический вариант развития физиологических процессов на равнине. А если это не равнина, а холмистая местность, и холмы короткие, по длине такие, что на подъем затрачивается не больше 30 секунд? Тогда в этот холм спортсмен включает свои ГМВ, их хватает ровно на 30 секунд. В холм влетает, скорость большая, а со спуска работать уже практически не надо, ГМВ восстанавливаются, потом опять подъём, спуск и т.д. При этом он может влететь в этот подъём быстро и мощно, а другой, у кого только одни окислительные, такой мощности не получит, попытается отыграть на спуске, но это очень трудно и особенно добавить не удастся. В этих условиях спортсмен, у которого много ГМВ, начинает выигрывать.
В холм влетает, скорость большая, а со спуска работать уже практически не надо, ГМВ восстанавливаются, потом опять подъём, спуск и т.д. При этом он может влететь в этот подъём быстро и мощно, а другой, у кого только одни окислительные, такой мощности не получит, попытается отыграть на спуске, но это очень трудно и особенно добавить не удастся. В этих условиях спортсмен, у которого много ГМВ, начинает выигрывать.
Рассмотрим двух спортсменов в равных условиях, но у первого мышцы покрупнее (больше ГМВ), а у второго поменьше. Если это равнина, первый, скорее всего, выиграет, потому что включит на финише гликолитические волокна. По дистанции они будут одинаково ехать, а на финише первый выиграет с разницей в 1-2 секунды. Если холмистая местность, но с короткими холмами, выиграет первый, у которого больше гликолитических МВ, может еще больше выиграет, потому что он в каждую горку 1-2 секунды отыграет, а со спуска еще быстрее уедет. Но как только горка превращается в минутную, то на первой он 2 секунды отыграет за 30 секунд, второй немножко отстал, а потом на следующей горке второй ему 10 секунд ввезет, потому что у первого ГМВ перестанут нормально работать, закислятся, а у второго ничего не закисляется, он со стабильной скоростью до верха и доедет.
Вот тут эти нюансы и возникают.
Теперь переключимся на лыжи. Если спринт будет с короткими подъёмами или же длинная дистанция с короткими подъёмами, выиграет тот, у кого есть запас ГМВ и очень большой. Но в лыжном спорте коротких подъемов почти не бывает. А как только подъёмы по длительности уходят за 30 секунд, всё меняется, к 40-й секунде ноги начинают здорово болеть, а к 1 минуте дыхание резко учащается, потому что ГМВ начинают накапливать ионы водорода, молочную кислоту, начинается значительное выделение углекислого газа, он заставляет интенсивно дышать, пульс за 200 и страшные мучения. Если всё время выходить на пульс 200-240, повторять его по ходу гонки 10 – 15 — 20 раз, то и соперника не увидишь… (состояние будет предельно тяжелым).
Физиология мышечного сокращения. Закон рекрутирования мышечных волокон
Напомним современные знания физиологии мышечного сокращения. Начнем с учебных знаний. В учебнике пишется, что существует процесс сокращения мышцы, и он обеспечивается некими механизмами энергообеспечения. Сам механизм сокращения связан с затратой молекул АТФ, молекулы АТФ должны быть внутри синтезированы с помощью молекулы КФ, а свободный креатин и свободный фосфат являются стимулом для разворачивания либо анаэробного гликолиза, либо аэробного гликолиза, либо окисления жиров. Вот классическая схема, современная, которая сейчас принята. Эта уточненная схема предложена Саксом, нашим ученым (у Чазова работает), для миокарда. В схеме существует КФ шунт, или, другими словами, все метаболические и энергетические пути, гликолиз и окисление жиров идут только через ресинтез КФ, а уже КФ идет непосредственно на ресинтез АТФ. Вот современные учебные знания.
Сам механизм сокращения связан с затратой молекул АТФ, молекулы АТФ должны быть внутри синтезированы с помощью молекулы КФ, а свободный креатин и свободный фосфат являются стимулом для разворачивания либо анаэробного гликолиза, либо аэробного гликолиза, либо окисления жиров. Вот классическая схема, современная, которая сейчас принята. Эта уточненная схема предложена Саксом, нашим ученым (у Чазова работает), для миокарда. В схеме существует КФ шунт, или, другими словами, все метаболические и энергетические пути, гликолиз и окисление жиров идут только через ресинтез КФ, а уже КФ идет непосредственно на ресинтез АТФ. Вот современные учебные знания.
В соответствии с ними, если спортсмен начинает двигаться в режиме «во всю», в течение примерно 15 секунд тратятся запасы АТФ и КФ (фосфагенов). Потом должен развернуться процесс, который стимулируется свободным креатином. Это, в первую очередь, процесс анаэробного гликолиза, который продолжается одну, может быть, полторы минуты, а вслед за этим должен развернуться процесс окислительного фосфорилирования, то есть начинается уже аэробный гликолиз. У нормального человека запасы углеводов снижаются где-то после 20-30 мин, а полностью заканчиваются через 45 мин. И только тогда, когда заканчиваются запасы углеводов в мышце и глюкоза в крови, начинает интенсивно развиваться процесс, связанный с окислением жиров. В случае передвижения со средней интенсивностью, при недостатке кислорода в крови, разворачивается анаэробный гликолиз. Это классическая схема.
У нормального человека запасы углеводов снижаются где-то после 20-30 мин, а полностью заканчиваются через 45 мин. И только тогда, когда заканчиваются запасы углеводов в мышце и глюкоза в крови, начинает интенсивно развиваться процесс, связанный с окислением жиров. В случае передвижения со средней интенсивностью, при недостатке кислорода в крови, разворачивается анаэробный гликолиз. Это классическая схема.
Но эта схема не выдерживает критики, когда мы переходим с представлений уровня пробирки или одного единственного мышечного волокна к мышце в целом. Для единственного изолированного МВ это более или менее правильное описание. Но у нас не одно МВ, а множество, еще есть множество мышц и, следовательно, в нашу модель мы должны включить и эти элементы. Кроме того, у нас есть ОМВ и ГМВ, у нас есть те МВ, которые раньше рекрутируются при определенной интенсивности: если интенсивность меняется, то дополнительные мышечные волокна включаются. Короче говоря, есть закон рекрутирования МВ. Если все эти компоненты учесть, то мы построим новую модель, которая состоит из центральной нервной системы, которая управляет мотонейронами в спинном мозге, а мотонейроны управляют мышцами. И вот в зависимости от импульсации, которая идет сверху, рекрутируются сначала низкопороговые двигательные единицы, а потом всё более высокопороговые, когда, допустим, увеличивается сила отталкивания. И в этом случае получается совсем другая картина.
Если все эти компоненты учесть, то мы построим новую модель, которая состоит из центральной нервной системы, которая управляет мотонейронами в спинном мозге, а мотонейроны управляют мышцами. И вот в зависимости от импульсации, которая идет сверху, рекрутируются сначала низкопороговые двигательные единицы, а потом всё более высокопороговые, когда, допустим, увеличивается сила отталкивания. И в этом случае получается совсем другая картина.
Например, вы начинаете двигаться с усилием 50% от максимума, максимум — это спринт (3-7 секунд), а 50% — это, условно говоря, бег на 1500 м или на 3000 м. Что будет происходить в организме? Вы рекрутируете столько мышечных волокон, сколько необходимо, чтобы держать скорость. Допустим, у вас 75% ОМВ. Допустим, вы рекрутировали половину всех мышечных волокон. Рекрутированные ОМВ отрабатывают 15 сек за счет АТФ и КФ, затем мощность их начинает падать где-то наполовину, и дальше эти ОМВ работают только в аэробном режиме, и пока используют только жиры. Не через 40 минут, а прямо сейчас, на 1-й минуте будут работать за счет окисления жиров! Потому что в ОМВ митохондрии, когда работают, выделяют наружу цитрат, который ингибирует (подавляет) гликолиз, поэтому могут окисляться только жиры (химию процесса окисления описывает цикл Кребса). Значит, не прошло и 15 секунд, как начали окисляться жиры. И вот мощность упала, а вам-то задание держать 50% от максимальной. Тогда вы обязаны рекрутировать еще порцию мышечных волокон. Допустим, дополнительные 25% вы рекрутируете, тоже окислительные, только они еще не работали, и они свои первые 15 секунд отрабатывают на АТФ и КФ. Получается, что на АТФ и КФ вы бежите уже не 15 секунд, а 30. То есть вы 15 секунд бежали на АТФ рекрутированных вначале МВ, и еще 15 секунд на следующих, но часть работы уже выполняется за счет аэробной продукции. Эти окислительные включились в работу, истратили свои запасы АТФ и КФ, не полностью, а наполовину, а вот эта половина поддерживается за счёт ресинтеза, то есть уже за счёт окислительных процессов, за счет жиров.
Не через 40 минут, а прямо сейчас, на 1-й минуте будут работать за счет окисления жиров! Потому что в ОМВ митохондрии, когда работают, выделяют наружу цитрат, который ингибирует (подавляет) гликолиз, поэтому могут окисляться только жиры (химию процесса окисления описывает цикл Кребса). Значит, не прошло и 15 секунд, как начали окисляться жиры. И вот мощность упала, а вам-то задание держать 50% от максимальной. Тогда вы обязаны рекрутировать еще порцию мышечных волокон. Допустим, дополнительные 25% вы рекрутируете, тоже окислительные, только они еще не работали, и они свои первые 15 секунд отрабатывают на АТФ и КФ. Получается, что на АТФ и КФ вы бежите уже не 15 секунд, а 30. То есть вы 15 секунд бежали на АТФ рекрутированных вначале МВ, и еще 15 секунд на следующих, но часть работы уже выполняется за счет аэробной продукции. Эти окислительные включились в работу, истратили свои запасы АТФ и КФ, не полностью, а наполовину, а вот эта половина поддерживается за счёт ресинтеза, то есть уже за счёт окислительных процессов, за счет жиров. И при заданной 50-процентной мощности вы обеспечиваете где-то 30-35% за счет окислительного фосфорилирования. При такой мощности где-то через 30-40 секунд вы выходите на предельные возможности этой мышцы в потреблении кислорода (она равна как раз 35% от максимальной мощности, которую эта мышца может развить). Это соответствует как раз АнП. Если нарисовать кривую потребления кислорода, то вы обнаружите плато, которое будет соответствовать АнП уже через 40 сек.
И при заданной 50-процентной мощности вы обеспечиваете где-то 30-35% за счет окислительного фосфорилирования. При такой мощности где-то через 30-40 секунд вы выходите на предельные возможности этой мышцы в потреблении кислорода (она равна как раз 35% от максимальной мощности, которую эта мышца может развить). Это соответствует как раз АнП. Если нарисовать кривую потребления кислорода, то вы обнаружите плато, которое будет соответствовать АнП уже через 40 сек.
Далее спортсмен будет рекрутировать ГМВ, но маленькими порциями, исходя из нормы мощности, которую вы задали. Вот он в течение минуты будет рекрутировать гликолитические. Они тоже сначала на АТФ и КФ работают, а потом за счет гликолиза. Включенные ГМВ минуту отработают, закислятся и снизят мощность почти до нуля. Поэтому придется включать новые ГМВ до тех пор, пока у вас есть их запас. Если он у вас большой, то можно минуты 3-4 так поработать. А тот, у кого запаса ГМВ нет, начнет снижать мощность, и откажется от выполнения задания.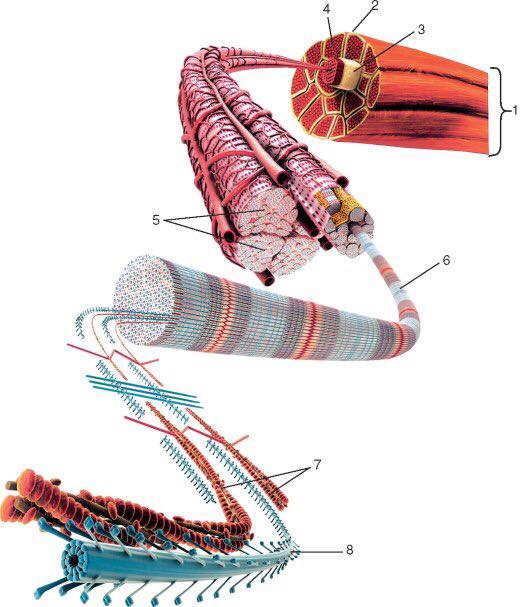
В итоге у тех, у кого ОМВ много, а гликолитических мало, кривая мощности поднимется, продержится где-то минуты полторы – две, и обязательно упадет на уровень АнП, и так будет держаться долго. Тот, кто имеет больший запас ГМВ, при прочих равных условиях сможет дольше проработать на высокой мощности, и на какой-то определенной дистанции выиграет. Получается, что человек, имеющий много ГМВ, но мало окислительных, на относительно коротких дистанциях, допустим, 1 — 1,5 минуты, ещё может выигрывать запасом гликолитических. Но чем длиннее дистанция, тем менее важна вот эта лишняя мышечная масса (ГМВ). И когда время на дистанции уходит, допустим, за 5 минут, то получается, что надо на себе везти лишнюю массу.
Из-за чего появляется специализация
В велосипедном спорте на равнине лишний вес не имеет принципиального значения. А если это гора, то даже в велосипедном спорте начинает играть роль собственный вес, спортсмен начинает тратить энергию на то, чтобы везти в подъем лишнюю мышечную массу.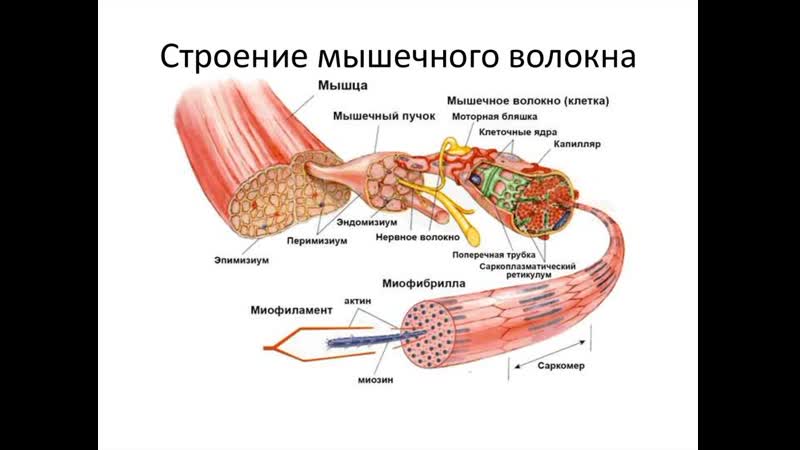 Поэтому чем длиннее дистанция, тем «вреднее» эта лишняя масса, и надо от нее всеми способами избавляться.
Поэтому чем длиннее дистанция, тем «вреднее» эта лишняя масса, и надо от нее всеми способами избавляться.
То же и в конькобежном спорте. Конечно, спортсмен в основном работает против ветра, но еще надо много энергии тратить, чтобы перемещать свое тело поперек дорожки, держать позу, а именно — везти свой собственный вес. Значит, и здесь вес начинает играть свою роль. Поэтому, если конькобежец везет на себе лишнюю мышечную массу, она мешает. На дистанциях в 500 и 1000 м некоторая «лишняя» масса помогает, потому что мощный толчок помогают сделать еще и мышцы рук и туловища. Но чем длиннее дистанция, тем больше «лишняя» масса мешает. Поэтому там, где возникают проблемы «лишней» массы, и появляется какая-то специализация (спринтер — стайер). Но иногда это не принципиально, если у спортсмена сильные мышцы ног с большой долей ОМВ (как у Хайдена).
Как и везде, существует простая модель и сложная. В сложной модели, вы видите, процессы по-другому разворачиваются, и даже можно объяснить, зачем нужны гликолитические волокна. Пока дистанция относительно короткая, и если эта лишняя масса не очень мешает, то это очень выгодно. Чем длиннее дистанция и чем больше нагрузка, связанная с преодолением собственного веса, тем вреднее становится избыток ГМВ.
Пока дистанция относительно короткая, и если эта лишняя масса не очень мешает, то это очень выгодно. Чем длиннее дистанция и чем больше нагрузка, связанная с преодолением собственного веса, тем вреднее становится избыток ГМВ.
Центральные и периферические аэробные компоненты, их вклад в работоспособность
Теперь рассмотрим зависимость работоспособности от центрального и периферического факторов (сердечно-сосудистой системы и мышц). Если рассматривать какое-то конкретное двигательное действие — велосипед, коньки, легкую атлетику (бег) или лыжи, то мы увидим, что в каждом конкретном упражнении участвуют определенные мышечные группы. Если посчитать их массу, то окажется, что в велосипедном спорте одна мышечная масса, в легкой атлетике побольше, а в лыжном спорте еще больше. Возникает вопрос: сколько эти мышцы потребляют кислорода? Чисто теоретически это очень просто посчитать: 1 кг мышечной массы, если она находится на пределе подготовленности, потребляет кислорода где-то 0,2-0,3 л/мин, если в работе участвуют все ОМВ. Дальше надо просто умножить эту цифру на ту массу, которая есть, при условии, что она максимально подготовлена. Что значит максимально подготовлена?
Внутри этой мышечной массы одни ОМВ, миофибриллы и митохондрии находятся в таком соотношении, что больше уже ничего прибавить нельзя (миофибриллы все оплетены митохондриями, как в миокарде). И тогда получается, что для потребления 3 л кислорода нужно иметь 10 кг активной мышечной массы, а если нужно потреблять 6 л — достаточно иметь только 20 кг активной мышечной массы.
Теперь посчитаем, сколько кислорода может доставить сердце. Если принять, что 1 литр крови переносит 160 мл кислорода (при нормальном уровне гемоглобина), то, умножив это количество на минутный объём кровообращения, мы получим возможности сердца по доставке кислорода. У обычного человека, мужчины, ударный объём составляет порядка 120-130 мл за один выброс крови. При пульсе 190 ударов в минуту получим 190 уд/мин * 130 мл * 160 мл = около 4 л/мин. Всё так и считается, достаточно просто. У супер-атлетов за один ударный цикл выбрасывается 240 мл, это соответствует 7-8 л/мин кислорода.
Мы определили, что 20 кг мышечной массы могут потребить около 6 литров кислорода в минуту. Если у лыжника на ногах мышечная масса 20 — 25 кг, и к этому добавить мышцы живота, спины, рук, то мы уйдем за цифру 30 с лишним килограммов. Сделаем поправку на то, что не вся эта мышечная масса будет потреблять кислород на пределе возможностей, и получим, что 40 кг активных мышц могут потребить кислорода около 8 л/мин. Вот столько должно перекачать сердце, чтобы полностью обеспечить мышцы кислородом, если эти мышцы максимально готовы.
Таким образом, мы получили два предела. Первый — из литературы известно, что перекачать 8 л/мин кислорода через организм с помощью сердца — это цифра предельная, этой цифры практически ни у кого нет. В то же время, 8 л/мин кислорода потребить мышцами — таких цифр тоже никто ещё не зафиксировал. Обычно потребляют где-то 6 л/мин, ну — 6,5 л/мин, цифры в 7 л/мин кислорода почти не появляется.
Тестирование уровней потребления кислорода поможет построить планы тренировок
Поскольку работоспособность может лимитировать либо одно, либо другое, то для того, чтобы разобраться с тем, чего не хватает конкретному спортсмену — его надо обязательное тестировать. Например, мы начинаем тестировать лыжников на уровне сборной команды, и получаем очень печальные цифры. Фиксируем показатели неоднократного победителя крупных российских марафонов (спортсмен каждый год в «десятке» на чемпионатах России), и видим: мышцы ног потребляют кислорода только 3,5 л/мин на уровне АнП — это результат порядка 1 разряда в велосипедном спорте. А лыжник должен потреблять ногами столько же, сколько велосипедист МСМК, причем это абсолютная цифра, не на килограмм веса. (В велосипедном спорте это не принципиально, там больше важно, что приходится на лобовую площадь.)
Спрашивается, а какое у него сердце? Если взять график ступенчатого теста, то на начальном участке, когда рекрутируются только ОМВ, наблюдается некая прямая между пульсом и мощностью. Потом эта кривая зависимости (потом кривая получается) начинает как-то изменяться. И, как правило, происходит увеличение темпа прироста пульса. Если продолжить начальный отрезок линии дальше, и вывести на пульс 190, то можно предсказать, что бы было с этим человеком, если бы он вышел на пульс 190, и при этом у него были бы только ОМВ. И тогда мы определили бы потенциальные возможности сердца по доставке кислорода к мышцам. (Подробнее об этом можно прочитать в следующем номере в разделе, посвященном интерпретации данных ступенчатого теста).
Так вот, потенциальная производительность сердца оказывается у него 7 л/мин. Это означает, что наш спортсмен имеет прекрасное сердце, огромное сердце, его тренировать специально не надо, а мышцы, прежде всего ног, — очень слабые, они в очень плохом состоянии, их надо готовить, чтобы они соответствовали нормативам международного класса.
Чтобы этот лыжник показал хорошие результаты, ему надо где-то 4,5 л/мин потреблять ногами. С показателем 4,5 л/мин он бы в сборной уже устойчиво стоял. При этом пульс у него при потреблении кислорода 4,5 л/мин должен быть не 190 уд/мин, а 150, потому что должен быть запас, на котором руки будут работать. Хорошо, предположим, мы с ним в тесте получаем 4,5 л/мин на пульсе 150 уд/мин, и после этого начинается закисление, и он отказывается от работы. Тогда мы говорим, что ноги у него в хорошем состоянии (4,5 л/мин для лыжника вполне достаточно). Потом начинаем тестировать руки, и оказывается, что руки у него потребляют где-то 1,5 л/мин, больше не будут потреблять (это из нашего опыта известно). Он потребляет руками 1,5 л/мин, мы прибавляем их к 4,5 л/мин ног, и получаем потребление кислорода равное 6 л/мин. Затем делим на его вес 70 кг и получаем 85 мл/кг/мин — это уровень олимпийских достижений.
Дальше разбираемся, что с ним нужно делать, чтобы достичь таких показателей. Так вот, первый вывод: поскольку сердце у него большое, и может перекачать кислорода 7 л/мин, то этому человеку не надо делать вкатывание. Под вкатыванием понимаются объёмные длительные тренировки продолжительностью от 3 до 6-8 часов в день на относительно низком пульсе (100-150 уд/мин, близко к 120). Если человек будет по 8 часов в день кататься при таком пульсе, то сердце начнет дилятировать (расширяться) и может значительно увеличиться в объеме. А этому человеку нужно заниматься в первую очередь мышцами ног — именно они ограничивают его возможности.
А у другого может оказаться наоборот. Вот вам следующий пример: еще один молодой перспективный лыжник, мы его тестируем, у него картина такая: пульс 190 уд/мин и 4,5 л/мин потребляет ногами, но пульс-то — 190. Всё, ему руки нельзя добавлять, он на пределе, сердце маленькое, слабое. Это было как раз в 2000 году, когда он ряд гонок выиграл и, как говорят, «капнул». Его больше в сборную брать не стали — сердце не держит. Никто же этого не знает, но чувствуют — спортсмен начинает проигрывать, не держит тренировочных нагрузок. Сердце маленькое. Наконец, дали ему отдохнуть, выбросили все объёмные нагрузки, оставили только интенсивные, спринтерского характера. Сердце постепенно вылечилось, за 4-5 месяцев стало нормальным, стало свои 8 л/мин качать, вместо 4,5 л/мин. Потребление кислорода в руках добавили, чуть ли не в 2 раза, а ноги у него и так хорошие. Он свои 4,5 л/мин ногами как потреблял, так и потребляет, но на пульсе не 190 уд/мин, а 160, потом руки еще добавляет, и он выходит на пульс 190, на этом пульсе можно бежать 10 км. У него был явный недостаток сердца, но причина не в том, что сердце плохое, ему надо было просто дать восстановиться, чтобы прекратились дистрофические явления, и он вернулся в нормальное состояние.
Заключение
Хочется добавить о роли интуиции и знания. Про роль знания особо говорить не станем – этому посвящена вся статья. Что касается интуиции, приведем выдержку из книги Виктора Николаевича «Подготовка бегуна на средние дистанции»:
«Принцип интуиции. Каждый спортсмен должен опираться в тренировке не только на правила, но и на интуицию, поскольку имеются индивидуальные особенности адаптационных реакций».
Принцип интуиции можно переформулировать иначе – «Природа «умнее» любого ученого». Поэтому можно планировать тренировочный процесс, но при его реализации спортсмен должен «прислушиваться» к своим ощущениям, сопоставлять их с ожиданиями своими и тренера. Разумеется, необходимо как можно чаще контролировать состояние готовности различных систем и органов. Эта информация, вместе со знаниями, является основой продуктивной интуиции, творческих озарений в построении тренировочного процесса. В связи с этим действительно можно принять утверждение «Знание слепо без интуиции», когда идет работа с конкретным спортсменом, когда приходится вводить коррекцию в тренировочный процесс.
Тяжёлый изнурительный бег вверх по горной тропе, использовавшийся Бьорном Дали и Вегардом Ульвангом, чем-то напоминает бег по холмам в Новозеландии учеников Лидьярда.
При подготовке статьи использованы разработки В. Н. Селуянова
Обсудить на форуме
комментарии к статье
Ученые выяснили, как ремонтируются поврежденные мышцы
Восстановление поврежденной мышечной ткани происходит благодаря клеткам-сателлитам. А они не могут функционировать без специального белка, выяснили ученые.
Мышцы имеют замечательную способность к самовосстановлению. С помощью тренировок можно восстановить их после травмы, да и возрастная атрофия преодолевается при активном образе жизни. При растяжении мышцы болят, но обычно боль проходит через несколько дней.
Этой способностью мышцы обязаны клеткам-сателлитам — особым клеткам мышечной ткани, которые соседствуют с миоцитами, или мышечными волокнами. Сами же мышечные волокна — основные структурно-функциональные элементы мышцы — представляют собой длинные многоядерные клетки, обладающие свойством сокращения, так как в их состав входят сократительные белковые нити — миофибриллы.
Клетки-сателлиты — это, собственно, стволовые клетки мышечной ткани. При повреждениях мышечных волокон, которые возникают из-за травм или с возрастом, клетки-сателлиты интенсивно делятся.
Они ремонтируют повреждения, сливаясь вместе и образуя новые многоядерные мышечные волокна.
С возрастом количество клеток-сателлитов в мышечной ткани снижается, соответственно, снижается и способность мышц к восстановлению, а также сила мышц.
Ученые из Института изучения сердца и легких Общества Макса Планка (Германия) выяснили молекулярную механику мышечного самовосстановления при помощи клеток-сателлитов, которая до сих пор не была досконально известна. О результатах они написали в журнале Cell Stem Cell.
Их открытие, как считают ученые, поможет создать методику восстановления мышц, которую из лаборатории когда-нибудь можно будет перенести в клинику для лечения мышечной дистрофии. А может быть, и мышечной старости.
Исследователи выявили ключевой фактор — белок под названием Pax7, который играет основную роль в мышечной регенерации.
Собственно, этот белок в сателлитных клетках был известен давно, но специалисты считали, что основную роль белок играет сразу после рождения. Но оказалось, что он незаменим на всех этапах жизни организма.
Чтобы точно выяснить его роль, биологи создали генетически измененных мышей, у которых белок Pax7 в сателлитных клетках не работал. Это привело к радикальному сокращению самих сателлитных клеток в мышечной ткани. Затем ученые вызвали повреждения мышиных мышц путем инъекции токсина. У нормальных животных мышцы начинали интенсивно регенерировать, и повреждения заживали. Но у генетически измененных мышей без белка Pax7 мышечная регенерация стала почти невозможна. В результате биологи наблюдали в их мышцах большое количество мертвых и поврежденных мышечных волокон.
Ученые расценили это как доказательство ведущей роли белка Pax7 в мышечной регенерации.
Мышечную ткань мышей рассмотрели под электронным микроскопом. У мышей без белка Pax7 биологи обнаружили очень немногие сохранившиеся сателлитные клетки, которые по строению сильно отличались от нормальных стволовых клеток. В клетках отмечались повреждения органелл, и было нарушено состояние хроматина — ДНК в совокупности с белками, который в норме определенным образом структурирован.
Интересно, что сходные изменения появлялись в сателлитных клетках, которые культивировали долгое время в лаборатории в изолированном состоянии, без их «хозяев» — миоцитов. Клетки таким же образом деградировали, что и в организме генетически измененных мышей. А ученые обнаружили в этих деградировавших клетках признаки дезактивации белка Pax7, которая наблюдалась у мышей-мутантов. Дальше — больше: изолированные клетки-сателлиты через какое-то время переставали делиться, то есть стволовые клетки переставали быть стволовыми.
Если же, напротив, повысить активность белка Pax7 в сателлитных клетках, они начинают делиться более интенсивно. Все говорит о ключевой роли белка Pax7 в регенеративной функции сателлитных клеток. Остается придумать, как использовать его в потенциальной клеточной терапии мышечной ткани.
«Когда мышцы деградируют, например, при мышечной дистрофии, имплантация мышечных стволовых клеток будет стимулировать регенерацию, — объясняет Томас Браун, директор института.
— Понимание того, как работает Pax7, поможет модифицировать сателлитные клетки таким образом, чтобы сделать их как можно более активными.
Это может привести к революции в лечении мышечной дистрофии и, возможно, позволит сохранить силу мышц в старости».
А здоровые мышцы и физическая активность в пожилом возрасте — лучший способ отодвинуть возрастные болезни.
Сократительный аппарат мышечных волокон — Справочник химика 21
Принято считать, что процессом, непосредственно связанным с работающим механизмом поперечно-полосатого мышечного волокна, является распад АТФ с образованием АДФ и неорганического фосфата. Возникает вопрос каким образом мышечная клетка может обеспечить свой сократительный аппарат достаточным количеством энергии в форме АТФ, т.е. каким образом в процессе мышечной деятельности происходит непрерывный ресинтез этого соединения [c.654]Поперечно-полосатая структура мышечных волокон может наблюдаться под обычным микроскопом. Отдельное мышечное волокно имеет диаметр 20 — 80 мкм и окружено плазматической мембраной толщиной 10 нм. Каждое отдельное волокно -это сильно вытянутая клетка. Длина отдельных волокон (клеток) может существенно варьироваться, в зависимости от вида мышцы, от сотен микрон до нескольких сантиметров. Внутри волокна, кроме известных органелл (ядро, ядрышко, митохондрии, аппарат Гольджи и др.), находятся сократительный аппарат клетки, состоящий из 1000 — 2000 параллельно расположенных миофибрилл диаметром 1-2 мкм, а также клеточные органеллы саркоплазматический ретикулум и система поперечных трубочек — Т-система. [c.144]
Сократительный аппарат мышечных клеток — это не однородная система. Следует различать области, содержащие только актин или только миозин, и области, в которых волокна этих двух белков находятся во взаимном зацеплении. Более того, вода сама представляет собой непрерывную фазу, пронизывающую всю систему. Природа структуры воды, окружающей белки, обсуждается Берналом [67] представляется, что в ближайшем к белкам слое толщиной ЮЛ вода находится в льдообразном состоянии. [c.289]
Мышечными называют все типы клеток, функция которых состоитв сокращении, хотя в остальном эти клетки могут быть мало сходны между собой. Как уже говорилось в гл. 11, сократительный аппарат, включающий актин и миозин, — это фундаментальная особенность животных клеток вообще, но в мышечных клетках он особенно сильно развит. У млекопитающих имеются четыре главных типа клеток, специально приспособленных для сокращения волокна скелетных мышц, клетки сердечной мышцы, гладкомышечные и миоэпителиальные клетки (рис. 17-36). Они различаются по функции, структуре и пути развития. [c.189]
Клетки скелетных мышц, сократительный аппарат которых детально рассмотрен в гл. И, ответственны практически за все произвольные движения. Эти клетки могут иметь огромные размеры (до полуметра в длину и до 100 мкм в диаметре у взрослого человека) и за свою форму получили также название мышечных волокон. Каждая такая клетка представляет собой синцитий, содержащий много ядер в общей цитоплазме. В отличие от этого мышечные клетки трех других типов имеют более обычное строение — в них только по одному ядру. Клетки сердечной мышцы сходны с волокнами скелетной мускулатуры в том отношении, что нити актина и миозина в них образуют упорядоченные системы, придающие клетке исчерченный вид. Гладкомышечные клетки получили свое название потому, что они, напротив, не выглядят исчерченными. Функции у гладкой мускулатуры весьма разнообразны — от проталкивания пищи по пищеварительному тракту до поднятия шфсти дыбом при холоде или страхе. Миоэпителиальные клетки (тоже лишенные исчфченности) в отличие от клеток трех других типов лежат в эпителии и происходят из эктодермы. Эти клетки образуют мускулатуру радужной оболочки глаза, расширяющую зрачок, а также используются для выдавливания слюны, пота и молока из соответствующих желез (см. рис. 17-36, Д). [c.190]
Гистология.mp3 — Мышечные ткани
Слушать (13 464 Кб):
Общая гистология — скелетная, сердечная и гладкая мышечные ткани
Мышечными тканями называют ткани, различные по строению и происхождению, но сходные по способности к выраженным сокращениям. Они обеспечивают перемещения в пространстве всего организма в целом или его частей (пример – скелетная мускулатура) и движение органов внутри организма (пример – сердце, язык, кишечник).
Свойством изменения формы обладают клетки многих тканей, но в мышечных тканях эта способность становится главной функцией.
Общая характеристика и классификация
Основные морфологические признаки элементов мышечных тканей — удлиненная форма, наличие продольно расположенных миофибрилл и миофиламентов — специальных органелл, обеспечивающих сократимость, расположение митохондрий рядом с сократительными элементами, наличие включений гликогена, липидов и миоглобина.
Специальные сократительные органеллы — миофиламенты обеспечивают сокращение, которое возникает при взаимодействии в них двух основных фибриллярных белков — актина и миозина при обязательном участии ионов кальция. Митохондрии обеспечивают эти процессы энергией. Запас источников энергии образуют гликоген и липиды. Миоглобин — это белок-пигмент (наподобие гемоглобина), обеспечивающий связывание кислорода и создание его запаса на момент сокращения мышцы, когда сдавливаются кровеносные сосуды (и поступление кислорода при этом резко падает).
В основу классификации мышечных тканей положены два принципа — морфофункциональный и гистогенетический. В соответствии с морфофункциональным принципом, в зависимости от структуры органелл сокращения, мышечные ткани подразделяют на две подгруппы: исчерченные мышечные ткани и гладкие мышечные ткани.
Поперечнополосатые (исчерченные) мышечные ткани. В цитоплазме их элементов миозиновые филаменты постоянно полимеризованы, образуют с актиновыми нитями постоянно существующие миофибриллы. Последние организованы в характерные комплексы — саркомеры. В соседних миофибриллах структурные субъединицы саркомеров расположены на одинаковом уровне и создают поперечную исчерченность. Исчерченные мышечные ткани сокращаются быстрее, чем гладкие.
Гладкие (неисчерченные) мышечные ткани. Эти ткани характеризуются тем, что вне сокращения миозиновые филаменты деполимеризованы. В присутствии ионов кальция они полимеризуются и вступают во взаимодействие с филаментами актина. Образующиеся при этом миофибриллы не имеют поперечной исчерченности: при специальных окрасках они представлены равномерно окрашенными по всей длине нитями.
В соответствии с гистогенетическим принципом в зависимости от источников развития (т.е. эмбриональных зачатков) мышечные ткани подразделяются на 5 типов:
- мезенхимные (из десмального зачатка в составе мезенхимы)
- эпидермальные (из кожной эктодермы и из прехордальной пластинки)
- нейральные (из нервной трубки)
- целомические (из миоэпикардиальной пластинки висцерального листка спланхнотома)
- соматические (миотомные)
Первые три типа относятся к подгруппе гладких мышечных тканей, четвертый и пятый — к подгруппе поперечнополосатых.
Поперечнополосатые мышечные ткани
Имеется две основные разновидности поперечнополосатых (исчерченных) тканей — скелетная мышечная ткань и сердечная мышечная ткань.
Скелетная мышечная ткань
Гистогенез
Источником развития элементов скелетной (соматической) поперечнополосатой мышечной ткани являются клетки миотомов — миобласты. Одни из них дифференцируются на месте и участвуют в образовании так называемых аутохтонных мышц. Другие клетки мигрируют из миотомов в мезенхиму. Они уже детерминированы, хотя внешне не отличаются от других клеток мезенхимы. Их дифференцировка продолжается в местах закладки других мышц тела.
В ходе дифференцировки возникают две клеточные линии. Клетки одной из линий сливаются, образуя удлиненные симпласты — мышечные трубочки (миотубы). В них происходит дифференцировка специальных органелл — миофибрилл. В это время в миотубах отмечается хорошо развитая гранулярная эндоплазматическая сеть. Миофибриллы сначала располагаются под плазмолеммой, а затем заполняют большую часть миотубы. Ядра, напротив, из центральных отделов смещаются к периферии. Клеточные центры и микротрубочки при этом полностью исчезают. Гранулярная эндоплазматическая сеть редуцируется в значительной степени. Такие дефинитивные структуры называют миосимпластами.
Клетки другой линии остаются самостоятельными и дифференцируются в миосателлитоциты (или миосателлиты). Эти клетки располагаются на поверхности миосимпластов.
Строение
Основной структурной единицей скелетной мышечной ткани является мышечное волокно, состоящее из миосимпласта и миосателлитоцитов, покрытых общей базальной мембраной.
Длина всего волокна может измеряться сантиметрами при толщине всего 50—100 мкм. Комплекс, состоящий из плазмолеммы миосимпласта и базальной мембраны, называют сарколеммой.
Миосимпласт имеет множество продолговатых ядер, расположенных непосредственно под сарколеммой. Их количество в одном симпласте может достигать нескольких десятков тысяч. У полюсов ядер располагаются органеллы общего значения — аппарат Гольджи и небольшие фрагменты гранулярной эндоплазматической сети. Миофибриллы заполняют основную часть миосимпласта и расположены продольно.
Саркомер — это структурная единица миофибриллы. Каждая миофибрилла имеет поперечные темные и светлые диски, имеющие неодинаковое лучепреломление (анизотропные A-диски и изотропные I-диски). Каждая миофибрилла окружена продольно расположенными и анастомозирующими между собой петлями агранулярной эндоплазматической сети — саркоплазматической сети, или саркоплазматического ретикулума. Соседние саркомеры имеют общую пограничную структуру — Z-линию (или телофрагму). Она построена в виде сети из белковых фибриллярных молекул, среди которых существенную роль играет альфа-актинин. С этой сетью связаны концы тонких, актиновых, филаментов. От соседних Z-линий актиновые филаменты направляются к центру саркомера, но не доходят до его середины. Филаменты актина объединены с Z-линией и нитями миозина фибриллярными нерастяжимыми молекулами небулина. Посередине темного диска саркомера располагается сеть, построенная из миомезина. Она образует в сечении М-линию, или мезофрагму. В узлах этой М-линии закреплены концы толстых, миозиновых филаментов. Другие их концы направляются в сторону Z-линий и располагаются между филаментами актина, но до самих Z-линий тоже не доходят. Вместе с тем эти концы фиксированы по отношению к Z-линиям растяжимыми гигантскими белковыми молекулами титина.
Молекулы миозина имеют длинный хвост и на его конце две головки. При повышении концентрации ионов кальция в области присоединения головок (в своеобразном шарнирном участке) молекула миозина изменяет свою конфигурацию. При этом (поскольку между миозиновыми филаментами расположены актиновые) головки миозина связываются с актином (при участии вспомогательных белков — тропомиозина и тропонина). Затем головка миозина наклоняется и тянет за собой актиновую молекулу в сторону М-линии. Z-линии сближаются, саркомер укорачивается.
Альфа-актининовые сети Z-линий соседних миофибрилл связаны друг с другом промежуточными филаментами. Они подходят к внутренней поверхности плазмолеммы и закрепляются в кортикальном слое цитоплазмы, так что саркомеры всех миофибрилл располагаются на одном уровне. Это и создает при наблюдении в микроскоп впечатление поперечной исчерченности всего волокна.
Источником ионов кальция служат цистерны агранулярной эндоплазматической сети. Они вытянуты вдоль миофибрилл около каждого саркомера и образуют саркоплазматическую сеть. Именно в ней аккумулируются ионы кальция, когда миосимпласт находится в расслабленном состоянии. На уровне Z-линий (у амфибии) или на границе А- и I-дисков (у млекопитающих) канальцы сети меняют направление и располагаются поперечно, образуя расширенные терминальные или (латеральные) L-цистерны.
С поверхности миосимпласта плазмолемма образует длинные трубочки, идущие поперечно в глубину клетки (Т-трубочки) на уровне границ между темными и светлыми дисками. Когда клетка получает сигнал о начале сокращения, этот сигнал перемещается по плазмолемме в виде потенциала действия и распространяется отсюда на мембрану Т-трубочек. Поскольку эта мембрана сближена с мембранами саркоплазматической сети, состояние последних меняется, кальций освобождается из цистерн сети и взаимодействует с актино-миозиновыми комплексами (они сокращаются). Когда потенциал действия исчезает, кальций снова аккумулируется в цистернах саркоплазматического ретикулума и сокращение миофибрилл прекращается. Для развития усилия сокращения нужна энергия. Она освобождается за счет АТФ- АДФ-превращений. Роль АТФазы выполняет миозин. Источником АТФ служат главным образом митохондрии, поэтому они и располагаются непосредственно между миофибриллами.
Большую роль в деятельности миосимпластов играют включения миоглобина и гликогена. Гликоген служит источником энергии, необходимой не только для совершения мышечной работы, но и поддержания теплового баланса всего организма. Миоглобин связывает кислород, когда мышца расслаблена и через мелкие кровеносные сосуды свободно протекает кровь. Во время сокращения мышцы сосуды сдавливаются, а запасенный кислород освобождается из миоглобина и участвует в биохимических реакциях.
Миосателлитоциты — это малодифференцированные клетки, являющиеся источником регенерации мышечной ткани. Они прилежат к поверхности миосимпласта, так что их плазмолеммы соприкасаются. Миосателлитоциты одноядерны, их ядра овальной формы и мельче, чем в симпластах. Они обладают всеми органеллами общего значения (в том числе и клеточным центром).
Типы мышечных волокон. Разные мышцы (как органы) функционируют в неодинаковых биомеханических условиях. Поэтому и мышечные волокна в составе разных мышц обладают разной силой, скоростью и длительностью сокращения, а также утомляемостью. Ферменты в них обладают разной активностью и представлены в различных изомерных формах. Заметно различие в них содержания дыхательных ферментов — гликолитических и окислительных.
По соотношению миофибрилл, митохондрий и миоглобина различают белые, красные и промежуточные волокна. По функциональным особенностям мышечные волокна подразделяют на быстрые, медленные и промежуточные. Наиболее заметно мышечные волокна различаются особенностями молекулярной организации миозина. Среди различных его изоформ существуют две основных — «быстрая» и «медленная». При постановке гистохимических реакций их различают по АТФазной активности. С этими свойствами коррелирует и активность дыхательных ферментов. Обычно в быстрых волокнах преобладают гликолитические процессы, они более богаты гликогеном, в них меньше миоглобина, поэтому их называют также белыми. В медленных волокнах, напротив, выше активность окислительных ферментов, они богаче миоглобином, выглядят более красными.
Свойства мышечных волокон меняются при изменении нагрузок — спортивных, профессиональных, а также в экстремальных условиях (таких как невесомость). При возврате к обычной деятельности такие изменения обратимы. При некоторых заболеваниях (мышечные атрофии, дистрофии, последствия денервации) мышечные волокна с разными исходными свойствами изменяются неодинаково. Это позволяет уточнять диагноз, для чего исследуют биоптаты скелетных мышц.
Регенерация скелетной мышечной ткани
Ядра миосимпластов делиться не могут, так как у них отсутствуют клеточные центры. Камбиальными элементами служат миосателлитоциты. Пока организм растет, они делятся, а дочерние клетки встраиваются в концы симпластов. По окончании роста размножение миосателлитоцитов затухает. После повреждения мышечного волокна на некотором протяжении от места травмы оно разрушается и его фрагменты фагоцитируются макрофагами.
Восстановление любых тканей организма может осуществляется за счет двух механизмов: гипертрофии и гиперплазии. Под гипертрофией подразумевают компенсаторное увеличение объема самого симпласта, в т.ч. за счет увеличения количества миофибрилл. В симпласте активизируются гранулярная эндоплазматическая сеть и аппарат Гольджи. Происходит синтез веществ, необходимых для восстановления саркоплазмы и миофибрилл, а также сборка мембран, так что восстанавливается целостность плазмолеммы. Поврежденный конец миосимпласта при этом утолщается, образуя мышечную почку. Под гиперплазией понимают пролиферацию миосателлитоцитов. Сохранившиеся рядом с повреждением миосателлитоциты делятся. Одни из них мигрируют к мышечной почке и встраиваются в нее, другие сливаются (так же, как миобласты при гистогенезе) и образуют миотубы, которые затем входят в состав вновь образованных мышечных волокон или формируют новые волокна.
Скелетная мышца как орган
Передача усилий сокращения на скелет осуществляется посредством сухожилий или прикрепления мышц непосредственно к надкостнице. На конце каждого мышечного волокна плазмолемма образует глубокие узкие впячивания. В них со стороны сухожилия или надкостницы проникают тонкие коллагеновые волокна. Последние спирально оплетаются ретикулярными волокнами. Концы волокон направляются к базальной мембране, входят в нее, поворачивают назад и по выходе снова оплетают коллагеновые волокна соединительной ткани.
Между мышечными волокнами находятся тонкие прослойки рыхлой волокнистой соединительной ткани — эндомизий. Коллагеновые волокна наружного листка базальной мембраны вплетаются в него, что способствует объединению усилий при сокращении миосимпластов. Более толстые прослойки рыхлой соединительной ткани окружают по нескольку мышечных волокон, образуя перимизий и разделяя мышцу на пучки. Несколько пучков объединяются в более крупные группы, разделенные более толстыми соединительнотканными прослойками. Соединительную ткань, окружающую поверхность мышцы, называют эпимизием.
Васкуляризация. Артерии вступают в мышцу и распространяются по прослойкам соединительной ткани, постепенно истончаясь. Ветви 5—6-го порядка образуют в перимизии артериолы. В эндомизии расположены капилляры. Они идут вдоль мышечных волокон, анастомозируя друг с другом. Венулы, вены и лимфатические сосуды проходят рядом с приносящими сосудами. Как обычно, рядом с сосудами много тканевых базофилов, принимающих участие в регуляции проницаемости сосудистой стенки.
Иннервация. В мышцах выявлены миелинизированные эфферентные (двигательные), афферентные (чувствительные), а также немиелинизированные вегетативные нервные волокна. Отросток нервной клетки, приносящий импульс от моторного нейрона спинного мозга, ветвится в перимизии. Каждая его ветвь проникает сквозь базальную мембрану, и у поверхности симпласта на плазмолемме образует терминали, участвуя в организации так называемой моторной бляшки, или нервно-мышечного соединения. При поступлении нервного импульса из терминали выделяется ацетилхолин — медиатор, который вызывает возбуждающий потенциал действия, распространяющееся отсюда по плазмолемме миосимпласта.
Итак, каждое мышечное волокно иннервируется самостоятельно и окружено сетью гемокапилляров, образуя комплекс, именуемый мионом. Группа же мышечных волокон, иннервируемых одним мотонейроном, называется нервно-мышечной единицей. Характерно, что мышечные волокна, принадлежащие к одной нервно-мышечной единице, лежат не рядом, а расположены мозаично среди волокон, относящихся к другим единицам.
Чувствительные нервные окончания располагаются не на рабочих мышечных волокнах, а связаны со специализированными мышечными волокнами в так называемых мышечных веретенах, которые расположены в перимизии. Волокна в таких чувствительных мышечных веретенах именуются интрафузальными волокнами, а обычные рабочие мышечные волокна – экстрафузальными.
Интрафузальные мышечные волокна веретен значительно тоньше рабочих. Существует два их вида — волокна с ядерной сумкой и волокна с ядерной цепочкой. Каждое мышечное волокно веретена спирально обвито терминалью чувствительного нервного волокна. В результате сокращения или расслабления рабочих мышечных волокон изменяется натяжение соединительнотканной капсулы веретена, соответственно изменяется тонус интрафузальных мышечных волокон. Вследствие этого возбуждаются чувствительные нервные окончания, обвивающие их, и в области терминалей возникают афферентные нервные импульсы. На каждом миосимпласте располагается также своя моторная бляшка. Поэтому интрафузальные мышечные волокна постоянно находятся в напряжении, подстраиваясь к длине мышечного брюшка в целом.
Сердечная мышечная ткань
Гистогенез и виды клеток. Источники развития сердечной поперечнополосатой мышечной ткани — симметричные участки висцерального листка спланхнотома в шейной части зародыша — так называемые миоэпикардиалъные пластинки. Из них дифференцируются также клетки мезотелия эпикарда. В ходе гистогенеза возникает 3 вида кардиомиоцитов:
- рабочие, или типичные, или же сократительные, кардиомиоциты,
- атипичные кардиомиоциты (сюда входят пейсмекерные, проводящие и переходные кардиомиоциты, а также
- секреторные кардиомиоциты.
Рабочие (сократительные) кардиомиоциты образуют свои цепочки. Укорачиваясь, они обеспечивают силу сокращения всей сердечной мышцы. Рабочие кардиомиоциты способны передавать управляющие сигналы друг другу. Синусные (пейсмекерные) кардиомиоциты способны автоматически в определенном ритме сменять состояние сокращения на состояние расслабления. Они воспринимают управляющие сигналы от нервных волокон, в ответ на что изменяют ритм сократительной деятельности. Синусные (пейсмекерные) кардиомиоциты передают управляющие сигналы переходным кардиомиоцитам, а последние — проводящим. Проводящие кардиомиоциты образуют цепочки клеток, соединенных своими концами. Первая клетка в цепочке воспринимает управляющие сигналы от синусных кардиомиоцитов и передает их далее — другим проводящим кардиомиоцитам. Клетки, замыкающие цепочку, передают сигнал через переходные кардиомиоциты рабочим.
Секреторные кардиомиоциты выполняют особую функцию. Они вырабатывают гормон — натрийуретический фактор, участвующий в процессах регуляции мочеобразования и в некоторых других процессах.
Сократительные кардиомиоциты имеют удлиненную (100—150 мкм) форму, близкую к цилиндрической. Их концы соединяются друг с другом, так что цепочки клеток составляют так называемые функциональные волокна (толщиной до 20 мкм). В области контактов клеток образуются так называемые вставочные диски. Кардиомиоциты могут ветвиться и образуют трехмерную сеть. Их поверхности покрыты базальной мембраной, в которую снаружи вплетаются ретикулярные и коллагеновые волокна. Ядро кардиомиоцита (иногда их два) овальное и лежит в центральной части клетки. У полюсов ядра сосредоточены немногочисленные органеллы общего значения. Миофибриллы слабо обособлены друг от друга, могут расщепляться. Их строение аналогично строению миофибрилл миосимпласта скелетного мышечного волокна. От поверхности плазмолеммы в глубь кардиомиоцита направлены Т-трубочки, находящиеся на уровне Z-линии. Их мембраны сближены, контактируют с мембранами гладкой эндоплазматической (т.е. саркоплазматической) сети. Петли последней вытянуты вдоль поверхности миофибрилл и имеют латеральные утолщения (L-системы), формирующие вместе с Т-трубочками триады или диады. В цитоплазме имеются включения гликогена и липидов, особенно много включений миоглобина. Механизм сокращения кардиомиоцитов такой же, как у миосимпласта.
Кардиомиоциты соединяются друг с другом своими торцевыми концами. Здесь образуются так называемые вставочные диски: эти участки выглядят как тонкие пластинки при увеличении светового микроскопа. Фактически же концы кардиомиоцитов имеют неровную поверхность, поэтому выступы одной клетки входят во впадины другой. Поперечные участки выступов соседних клеток соединены друг с другом интердигитациями и десмосомами. К каждой десмосоме со стороны цитоплазмы подходит миофибрилла, закрепляющаяся концом в десмоплакиновом комплексе. Таким образом, при сокращении тяга одного кардиомиоцита передается другому. Боковые поверхности выступов кардиомиоцитов объединяются нексусами (или щелевыми соединениями). Это создает между ними метаболические связи и обеспечивает синхронность сокращений.
Возможности регенерации сердечной мышечной ткани. При длительной усиленной работе (например, в условиях постоянно повышенного артериального давления крови) происходит рабочая гипертрофия кардиомиоцитов. Стволовых клеток или клеток-предшественников в сердечной мышечной ткани не обнаружено, поэтому погибающие кардиомиоциты (в частности, при инфаркте миокарда) не восстанавливаются, а замещаются элементами соединительной ткани.
Гладкие мышечные ткани
По происхождению различают три группы гладких (или неисчерченных) мышечных тканей — мезенхимные, эпидермальные и нейральные.
Мышечная ткань мезенхимного происхождения
Гистогенез. Стволовые клетки и клетки-предшественники гладкой мышечной ткани, будучи уже детерминированными, мигрируют к местам закладки органов. Дифференцируясь, они синтезируют компоненты матрикса и коллаген базальной мембраны, а также эластин. У дефинитивных клеток (миоцитов) синтетическая способность снижена, но не исчезает полностью.
Структурно-функциональной единицей гладкой, или неисчерченной, мышечной ткани является гладко-мышечная клетка, или гладкий миоцит — это веретеновидная клетка длиной 20—500 мкм, шириной 5—8 мкм. Ядро клетки палочковидное, находится в ее центральной части. Когда миоцит сокращается, его ядро изгибается и даже закручивается. Органеллы общего значения, среди которых много митохондрий, сосредоточены в цитоплазме около полюсов ядра. Аппарат Гольджи и гранулярная эндо плазматическая сеть развиты слабо, что свидетельствует о малой активности синтетических функций. Рибосомы в большинстве своем расположены свободно.
Филаменты актина образуют в цитоплазме трехмерную сеть, вытянутую преимущественно продольно, точнее косо-продольно. Концы филаментов скреплены между собой и с плазмолеммой специальными сшивающими белками. Эти участки хорошо видны на электронных микрофотографиях как плотные тельца.
Миозиновые филаменты находятся в деполимеризованном состоянии. Мономеры миозина располагаются рядом с филаментами актина. Сигнал к сокращению обычно поступает по нервным волокнам. Медиатор, который выделяется из их терминалей, изменяет состояние плазмолеммы. Она образует впячивания — кавеолы, в которых концентрируются ионы кальция. Кавеолы отшнуровываются в сторону цитоплазмы в виде пузырьков (здесь из пузырьков освобождается кальций). Это влечет за собой как полимеризацию миозина, так и взаимодействие миозина с актином. Актиновые филаменты смещаются друг другу навстречу, плотные пятна сближаются, усилие передается на плазмолемму, и вся клетка укорачивается. Когда поступление сигналов со стороны нервной системы прекращается, ионы кальция эвакуируются из кавеол, миозин деполимеризуется и «миофибриллы» распадаются. Таким образом, актино-миозиновые комплексы существуют в гладких миоцитах только в период сокращения.
Гладкие миоциты располагаются без заметных межклеточных пространств и разделены базальной мембраной. На отдельных участках в ней образуются «окна», поэтому плазмолеммы соседних миоцитов сближаются. Здесь формируются нексусы, и между клетками возникают не только механические, но и метаболические связи. Поверх «чехликов» из базальной мембраны между миоцитами проходят эластические и ретикулярные волокна, объединяющие клетки в единый тканевой комплекс. Ретикулярные волокна проникают в щели на концах миоцитов, закрепляются там и передают усилие сокращения клетки всему их объединению.
Регенерация. Физиологическая регенерация гладкой мышечной ткани проявляется в условиях повышенных функциональных нагрузок. Наиболее отчетливо это видно в мышечной оболочке матки при беременности. Такая регенерация осуществляется не столько на тканевом, сколько на клеточном уровне: миоциты растут, в цитоплазме активизируются синтетические процессы, количество миофиламентов увеличивается (рабочая гипертрофия клеток). Не исключена, однако, и пролиферация клеток (т.е. гиперплазия).
В составе органов миоциты объединяются в пучки, между которыми располагаются тонкие прослойки соединительной ткани. В эти прослойки вплетаются ретикулярные и эластические волокна, окружающие миоциты. В прослойках проходят кровеносные сосуды и нервные волокна. Терминали последних оканчиваются не непосредственно на миоцитах, а между ними. Поэтому после поступления нервного импульса медиатор распространяется диффузно, возбуждая сразу многие клетки. Гладкая мышечная ткань мезенхимного происхождения представлена главным образом в стенках кровеносных сосудов и многих трубчатых внутренних органов, а также образует отдельные мелкие мышцы.
Гладкая мышечная ткань в составе конкретных органов имеет неодинаковые функциональные свойства. Это обусловлено тем, что на поверхности органов имеются разные рецепторы к конкретным биологически активным веществам. Поэтому и на многие лекарственные препараты их реакция неодинакова.
Гладкая мышечная ткань эпидермального происхождения
Миоэпителиальные клетки развиваются из эпидермального зачатка. Они встречаются в потовых, молочных, слюнных и слезных железах и имеют общих предшественников с железистыми секреторными клетками. Миоэпителиальные клетки непосредственно прилежат к собственно эпителиальным и имеют общую с ними базальную мембрану. При регенерации те и другие клетки восстанавливаются из общих малодифференцированных предшественников. Большинство миоэпителиальных клеток имеют звездчатую форму. Эти клетки нередко называют корзинчатыми: их отростки охватывают концевые отделы и мелкие протоки желез. В теле клетки располагаются ядро и органеллы общего значения, а в отростках — сократительный аппарат, организованный, как и в клетках мышечной ткани мезенхимного типа.
Гладкая мышечная ткань нейрального происхождения
Миоциты этой ткани развиваются из клеток нейрального зачатка в составе внутренней стенки глазного бокала. Тела этих клеток располагаются в эпителии задней поверхности радужки. Каждая из них имеет отросток, который направляется в толщу радужки и ложится параллельно ее поверхности. В отростке находится сократительный аппарат, организованный так же, как и во всех гладких миоцитах. В зависимости от направления отростков (перпендикулярно или параллельно краю зрачка) миоциты образуют две мышцы — суживающую и расширяющую зрачок.
Некоторые термины из практической медицины:
- лейомиома — доброкачественная опухоль, развивающаяся из гладкой мышечной ткани;
- миогелез — образование в мышцах болезненных очагов уплотнения, обусловленное переходом коллоидов миофибрилл в фазу геля, их гомогенизацией и восковидным некрозом; наблюдается, напр., при охлаждении тела, травмах;
- миоциты Аничкова — клетки с характерным расположением ядерного хроматина в виде зубчатой полоски, проявляющие фагоцитарную активность; встречаются в миокарде, напр. при миокардитах;
В чём отличия медлнных (ST) и быстрых (FT-A и FT-B) мышечных волокон
Типы мышц, их строение являются той причиной, по которой один атлет может бежать быстрее и наращивать мышечную массу легче других, а другой — способен бежать длительное время без признаков утомления.
Такую разницу создают процессы, которые происходят в мышечной ткани. Важно понимать их, например, для того чтобы выстроить правильную тренировочную программу, которая подойдет для конкретно выбранного спортсмена.
почему сокращаются мышцы?
- Пресинаптическое окончание.
- Сарколемма.
- Синаптический пузырек.
- Никотиновый ацетилхолиновый рецептор.
- Митохондрия
К волокнам скелетных мышц подходят толстые нервные волокна, которые отходят от передних отделов спинного мозга. После попадания в мышцу, каждое нервное волокно делится и снабжает своими разветвлениями до нескольких сотен мышечных волокон.
Соединение нерва и мышечного волокна образует так называемый синапс, или нервно-мышечное соединение (причем на каждом мышечном волокне формируется только один такой синапс). Под влиянием нервного сигнала возникает так называемый потенциал действия, который распространяется от спинного мозга по нервам к мышце и синапсу.
То, как скелетная мускулатура будет адаптироваться к повторяющимся стимулам, в большей степени зависит от внутренних характеристик самой мышцы. Именно типы мышечных волокон вносят наибольший вклад в возможность выполнения спортсменом той или иной тренировочной программы.
Типы мышечных волокон
У людей выделяют три типа мышечных волокон:
- Медленносокращающиеся (slow-twitch, ST или I тип) волокна характеризуются медленным временем сокращения, а также большой сопротивляемостью усталости. В своей структуре эти волокна имеют маленький мотонейрон и диаметр нервного волокна, высокую плотность митохондрий и капилляров, большое содержание миоглобина.
Этот тип волокон имеет небольшое количество креатин фосфата — высокоэнергетического субстрата, необходимого для быстрого, взрывного движения, — а значит, эти волокна не способны сокращаться быстро.
Функционально, ST-волокна используются при аэробной активности, не требующей большого приложения силы, например — ходьба и поддержание позы. Большая часть повседневной активности задействует именно ST-волокна.
- Быстросокращающиеся (fast-twitch, FT или II тип) волокна характеризуются быстрым сокращением и низкой сопротивляемостью усталости. Разница в скорости сокращения, от которой произошло разделение волокон, может быть отчасти объяснена скоростью выделения кальция из саркоплазматического ретикулума (место в клетке, где хранится кальций), а также активностью фермента, который расщепляет АТФ внутри головки миозина (один из сократительных белков). Обе эти характеристики быстрее и в большей степени присутствуют в FT-волокнах.
Сами FT-волокна делятся на два типа: тип А (FT-A или IIA тип) и тип В (FT-B или IIB тип).
- Волокна FT-A имеют умеренную сопротивляемость усталости и представляют собой переходный тип между медленносокращающимися волокнами и волокнами типа FT -B. Функционально они используются при длительной анаэробной активности с относительно большой продукцией силы, например, беге на 400 метров.
- С другой стороны, быстросокращающиеся волокна типа B, очень чувствительны к усталости и используются для коротких анаэробных нагрузок с большой продукцией силы, такие как: спринтерские забеги, бег с барьерами, прыжки. Эти волокна также способны продуцировать больше энергии, чем ST волокна.
Краткие характеристики волокон приведены в таблице ниже.
| Тип волокна | Медленносокр. (ST) | Быстросокр. тип А (FT—A) | Быстросокр. тип B (FT—b) |
| Время сокращения | Медленное | Быстрое | Очень быстрое |
| Размер мотонейрона | Маленький | Большой | Очень большой |
| Сопротивляемость усталости | Высокая | Средняя | Низкая |
| Активность | Аэробная | Длительная анаэробная | Короткая анаэробная |
| Продукция силы | Низкая | Высокая | Очень высокая |
| Плотность митохондрий | Высокая | Высокая | Низкая |
| Плотность капилляров | Высокая | Средняя | Низкая |
| Окислительная способность | Высокая | Высокая | Низкая |
| Гликолитическая емкость | Низкая | Высокая | Высокая |
| Преимущественный запас топлива | Триглицериды (жиры) | Креатинфосфат, гликоген | Креатинфосфат, гликоген |
При конкретной скорости движения, количество продуцируемой силы определяется типом вовлеченного в движение мышечного волокна. Во время динамического сокращения, когда волокно укорачивается или удлиняется, быстросокращающиеся волокна продуцируют больше силы, чем медленносокращающиеся волокна.
В условиях, когда длина мышечного волокна не изменяется при сокращении, ST-волокна продуцируют столько же силы, как и FT-волокна. Разница в продукции силы наблюдается только при активном сокращении, когда изменяется длина волокна.
При конкретной скорости движения, сила, продуцируемая мышцей, возрастает с повышением содержания FT-волокон, и наоборот, при конкретной продукции силы, скорость повышается при увеличении количества FT-волокон.
Существует большой разброс в процентном соотношении волокон у атлетов. Например, хорошо известно, что участвующие в соревнованиях на выносливость имеют большее содержание медленносокращающихся волокон, тогда как спринтеры и прыгуны имеют больше быстросокращающихся волокон.
Больший процент FT-волокон у спринтеров позволяет им продуцировать большую силу и мощность, чем у атлетов с повышенным содержанием ST-волокон.
Разница в составе мышц у атлетов подняла вопрос о том, наследуется ли такой состав генетически или он может быть изменен с помощью тренировок. Исследования, проведенные на близнецах, показали, что в основном состав мышц и процент содержания в них разных типов волокон определяется генетически.
Тем не менее, есть ряд данных, доказывающих, что как структура, так и метаболическая емкость мышечных волокон может изменяться в ответ на различные типы тренировок.
Вовлечение мышечных волокон в работу
Мышца продуцирует силу путем вовлечения так называемых моторных единиц — группы мышечных волокон, которую «обслуживает» одно двигательное нервное окончание. Во время произвольного изометрического и концентрического сокращения, обычный порядок вовлечения моторных единиц контролируется их размерами — это состояние известно под названием «принцип размера».
Маленькие моторные единицы, содержащие медленносокращающиеся мышечные волокна, имеют наименьший порог активизации, т.е. для их активизации достаточно самого слабого стимула, поэтому они вовлекаются первыми. Потребность в выработке большей силы удовлетворяется вовлечением более крупных моторных единиц.
Самые большие моторные единицы, содержащие быстросокращающиеся волокна типа B имеют наивысший порог активизации, и поэтому вовлекаются последними. Вне зависимости от интенсивности работы, первыми в нее вовлекаются медленносокращающиеся волокна.
Если интенсивность работы низкая, то медленносокращающиеся волокна остаются единственными, вовлеченными в нее. Если интенсивность работы высокая, например, подъем тяжелого веса, или интервальная работа на стадионе, первыми вовлекаются медленносокращающиеся волокна, затем подключаются быстросокращающиеся волокна типа A, а затем, при необходимости, волокна типа B.
Существуют данные о том, что принцип размера может быть нарушен или даже полностью изменен во время некоторых типов движений, особенно тех, которые содержат эксцентрические (с удлинением мышцы) компоненты. При этом быстросокращающиеся волокна могут активизироваться раньше медленносокращающихся.
Определение типа волокон
Поскольку единственным способом напрямую определить состав мышечного волокна у атлета является проведение биопсии мышцы (прямой метод), то некоторые исследования попробовали определить состав мышечного волокна непрямым методом, путем выявления взаимосвязей между различными свойствами типа волокна и состава волокон мышц.
Интересные данные, полученные в этих исследованиях, показывают значимую взаимосвязь между содержанием быстросокращающихся волокон и мышечной силой или мощностью.
Непрямой метод, который можно использовать для определения состава волокон мышц, состоит в определении максимального веса, который спортсмен может поднять всего один раз.
После этого производится максимальное количество повторов с весом в 80% от максимального. Если общее количество повторений меньше семи, скорее всего мышцы более чем на 50% состоят из FT-волокон. Если же удается сделать двенадцать и более повторов, скорее всего, мышца более чем на 50% состоит из ST-волокон. Если число повторений между 7 и 12 — скорее всего, мышцы состоят поровну из FT и ST-волокон.
Поскольку подъем веса вовлекает большое количество групп, этот метод не работает при определении состава изолированных мышц, а только мышечных групп.
Для определения состава волокон отдельной мышцы может потребоваться игольчатая биопсия интересующей мышцы. Другим непрямым методом, который можно использовать, является участие в различных соревнованиях. Доминантные волокна можно выявить, исходя из успеха в определенных соревнованиях, что позволит в дальнейшем развивать именно эти способности мышц.
Применение на практике
Пропорция типов волокон в мышцах будет влиять не на то, какой вес вы сможете поднять, какое количество повторений вы сможете сделать в интервальной работе, а на конечный результат — повышение силы/мощности мышц или выносливости.
Например, атлет, в мышцах которого большое содержание быстросокращающихся волокон, будет неспособен выполнить такое же количество повторений с весом, как атлет, в мышцах которого содержатся преимущественно медленносокращающиеся волокна.
Таким образом, атлет с FT-волокнами никогда не достигнет той мышечной выносливости, которая будет у атлета с ST-волокнами. Аналогично, атлет с большей пропорцией ST-волокон в мышцах не сможет поднять такой же вес, или пробежать интервалы так же быстро, как и атлет с большей пропорцией FT-волокон в мышцах. Следовательно, атлет с ST-волокнами не будет таким же сильным и мощным, как атлет с FT-волокнами.
Однако необходимо помнить, что даже внутри группы спринтеров или бегунов на длинные дистанции будет большой разброс по типам волокон в мышцах. Не все спринтеры имеют одинаковый процент FT-волокон, не все бегуны на длинные дистанции имеют одинаковый процент ST-волокон. Поэтому, одни спринтеры могут сделать работу 12х200 м, тогда как другие устанут после 8 повторов.
В зависимости от типа волокна и быстроты наступления утомления (из-за большего количества FT-волокон) необходимо решить, нужно ли больше отдыхать между интервалами для того, чтобы закончить работу, или необходимо уменьшить количество интервалов и увеличить скорость в серии.
Тренировка FT-волокон мышцы для выносливости не увеличит количество ST-волокон, а тренировка ST-волокон для силы и мощности не приведет к увеличению количества FT-волокон.
При соответствующем тренинге, FT-B волокна могут принять на себя некоторую часть выносливости, характерную для FT-BA волокон, а FT-A волокна могут принять на себя некоторую часть силы и мощности, характерной для FT-B волокон.
Однако, не существует полной взаимозаменяемости волокон. FT-волокна не могут стать ST-волокнами, и наоборот. Другими словами, то, с каким процентным соотношением волокон родился человек, с таким он будет жить и тренироваться.
Несмотря на то, что тип волокон не может быть изменен с одного на другой, тренировки могут изменить ту площадь, которую занимает определенный тип волокон в мышце. Другими словами, может произойти выборочное увеличение волокон, путем воздействия на них тренировками.
Например, у атлета в мышце может быть соотношение FT/ST-волокон 50/50, но поскольку площадь поперечного сечения FT волокон обычно больше, чем у ST-волокон, 65% площади мышцы могут занимать быстросокращающиеся, а 35% — медленносокращающиеся волокна.
При тренировках с отягощениями для повышения силы мышц, соотношение FT/ST-волокон останется таким же — 50/50, однако изменится площадь поперечного сечения, занимаемая двумя типами волокон. Это произойдет, потому что ST-волокна атрофируются, а FT-волокна гипертрофируются.
В зависимости от интенсивности тренировки, площадь мышцы может состоять на 75% из FT-волокон, и на 25% из ST-волокон. Эти изменения повлекут за собой повышение силы, но уменьшение выносливости.
Кроме этого, поскольку масса FT-волокон больше, чем ST-волокон, атлет будет набирать массу, если измерить окружности мышц. Напротив, если атлет тренируется для повышения выносливости, FT-волокна атрофируются, а ST-волокна гипертрофируются, вызывая увеличение площади поперечного сечения ST-волокон.
Площадь мышцы, изначально состоявшая на 65% из FT и на 35% из ST-волокон, может измениться под влиянием тренировок, и соотношение будет 50% на 50%. Кроме того, из-за того, что масса ST-волокон меньше, чем FT, наряду с повышением выносливости, произойдет снижение силы, а также потеря некоторой части мышечной массы.
Известный факт: если необходим прирост силы мышц, нужно тренироваться с тяжелыми весами и небольшим количеством повторов.
Этот режим тренировок приводит к рекрутированию FT-B волокон, которые могут развивать большее усилие, чем ST или FT-A волокна. Гипертрофия развивается только в перегруженной мышце, поэтому во время тренировки будет происходить рекрутмент FT-B волокон и их дальнейшая гипертрофия.
Тренировки с низкой или умеренной интенсивностью не всегда приводят к рекрутменту FT-B волокон, следовательно, для вовлечения этих волокон интенсивность должна быть высокой.
Выводы
Необходимо помнить, что для максимального результата необходимо тренироваться в соответствии со своей генетической предрасположенностью или на основании того, на каких соревнованиях вы показываете лучшие результаты.
Например, для атлета с преобладанием медленносокращающихся волокон, большую пользу принесет увеличение километража и тренировки с небольшими весами и большим количеством повторов.
С другой стороны, те атлеты, у которых преобладают быстросокращающиеся волокна, извлекут больше пользы из «спринтерских» методов тренировок и тренировок с тяжелыми весами и небольшим количеством повторов.
Было доказано, что длинные пробежки способствуют развитию медленносокращающихся волокон, улучшая их аэробные качества, тренируя их устойчивость к утомлению. Темповые тренировки влияют на ST и FT-A волокна, среди прочих эффектов улучшая работу этих типов волокон в связке.
Интервальная работа вовлекает FT-A и FT-B волокна, тренируя их взаимодействие и улучшая нейромышечную координацию. Скоростная работа: набегания, спринт в горку, короткие спринты на дорожке стадиона позволяют по максимуму нагрузить FT-B волокна.
Возможно, это не принесет большой пользы тем, кто бегает марафон, но увеличение силы позволит вам бежать более плавно и эффективно.
Автор статьи: доцент кафедры анестезиологии и реаниматологии СЗГМУ им. Мечникова Евгений Суборов
Как работает мышечное волокно?
Хорошие результаты в бодибилдинге, вопреки расхожему мнению, возможны только при наличии знаний касающихся основных биохимических процессов организма.
Принято считать, что для увеличения мускулатуры достаточно регулярно посещать тренажерный зал, выполняя сгибания и разгибания конечностей с тем или иным отягощением. Увы, не все так просто, как кажется на первый взгляд.
Для получения желаемого телосложения, прежде всего, необходимо овладеть базовой теорией, как и в любом другом виде спорта. Одной из основополагающих тем является работа мышечного волокна.
Мышечное волокно (мышечная клетка, симпласт) – это своеобразный «цилиндр», который заполнен огромным количеством внутренних органов, таких как митохондрии, лизосомы, ферменты, рибосомы, и, конечно же, миофибриллы.
Довольно часто мышечную клетку представляют как огромное количество пучков миофибрилл. Их особое строение позволяет нашим мышцам сокращаться и расслабляться. Рассмотрим этот процесс более подробно.
Миофибриллы – это сократительные элементы с особым строением клеток. Их главное свойство – возможность менять свою длину. Общее число миофибрилл в одном волокне может достигать нескольких тысяч.
Основные элементы миофибрилл — актин и миозин
Сами миофибриллы представлены толстыми (миозин) и тонкими белковыми нитями (актин). Темный участок одной миофибриллы, окруженный вокруг двумя светлыми участками принято называть саркомером.
Сокращение мышц происходит благодаря уменьшению длины саркомера. Дело в том, что миозин содержится только в темных участках, в светлых — он попросту отсутствует.
Изменение структуры саркомера происходит довольно простым способом: тонкие нити актина втягиваются между толстыми нитями миозина.
Скольжение вдоль возможно благодаря особым боковым ответвлениям миозина – мостикам белковой структуры. Грубо говоря, данные мостики проталкивают нить актина между миозиновыми волокнами. Смотрите видео:
Увы, это лишь общий взгляд на механизм работы мышечной клетки. Для более детального анализа следует рассмотреть этот процесс более подробно. Актин – это лишь условное название спирали закрученной из двух нитей тонкого типа.
Представьте аналогию с обыкновенной греблей на байдарках или каноэ. Тонкая нить актина в этом случае будет олицетворять плот с веслами. В то же время вода – это грубый пример толстых нитей миозина.
Для того чтобы продвинуться вперед, спортсменам на каноэ нужно производить гребковые поступательные движения. Аналогичное действие выполняет актин, с той лишь разницей, что как таковых весел у него нет.
Мостики располагаются на миозиновых нитях. Головки таких ответвлений при контакте с актином меняют свой угол, то есть проталкивают светлую нить вперед, так же как и вода позволяет байдарке плыть. Стоит отметить, что движения мостиков миозина происходят хаотично, т.е. полностью асинхронно. Именно так в общих чертах выглядит сокращение саркомера.
Также следует отметить, что в двойной спирали актина залегает другая двойная спираль меньшего размера, ее называют тропомиозином. В состоянии покоя именно тропомиозин мешает сцеплению актина с миозином. Без него, человек не смог бы контролировать сокращение тех или иных мышц. Грубо говоря, это предохранитель, снять который можно лишь при помощи сигналов ЦНС.
Создавая тот или иной частотный импульс, вы передаете его по каналам в мотонейроны, а оттуда он по аксонам поступает к мышце. Такой сигнал меняет полярность отсеков заполненных ионами кальция, расположенных вдоль всей миофибриллы.
Высвободившиеся ионы кальция (Ca++) вынуждают тропомиозин сократить свою длину, вследствие чего появляется место для сцепления актина и миозина.
Стоит отметить, что кальций буквально с первых секунд начинает возвращаться обратно в отсеки хранения. Вследствие чего концентрация его ионов в саркоплазме стремительно падает, а это ведет к постепенному удлинению тропомиозина. Именно так прекращается сокращение мышечной группы.
Во время выполнения упражнения, ЦНС посылает множество сигналов, каждый из которых вновь высвобождает кальций. При довольно сильной частоте (более 20 Гц) все отдельные сокращения сливаются в одно непрерывное движение, которое известно в физиологии как тетанус – безостановочная работа мышц в любой фазе движения.
Энергетический обмен
Разумеется, на все вышеперечисленные процессы нужна энергия, а как известно, универсальным «топливом» являются молекулы АТФ (аденозинтрифосфата).
Миозиновые мостики на конце имеют так называемую головку, которая обладает АТФазной активностью, то есть она может расщеплять АТФ и получать таким образом энергию. Стоит отметить, что она несет в себе заряд АТФ еще до контакта с актином.
При сокращении мышечной группы происходит высвобождение АТФ за счет гидролиза, что способствует соответствующему изменение угла мостика. Именно это заставляет актин двигаться вперед.
Для того чтобы продолжить движение, нить актина должна отцепить от себя недавно прикрепленные мостики миозина, а на это разумеется, нужна энергия.
Увы, весь имеющийся запас АТФ тратится на сцепление тонкой и толстой нити. Для того чтобы отделиться актин использует АТФ полученный благодаря системе креатинфосфата (КрФ) или гликолиза, т.е. не из головки миозина.
Необходимо понимать, что радиус действия АТФазы миозиновой головки ограничен, и низкий уровень КрФ колоссально замедляет процесс последующего движения нити актина. В то же время, наличие множества свободного АТФ, которое наблюдается при высоком уровне КрФ, позволяет актину выполнять быстрое движение вперед, без всевозможных задержек. Именно так количество АТФ и КрФ влияет на силу человека.
При наличии огромного количества энергетических фосфатов, актин за единицу времени может преодолеть гораздо большее расстояние, так как практически не тратит время на отсоединение мостиков миозина. При равной нагрузке, мышечной волокно с высоким уровнем АТФ всегда будет сильнее.
Практические выводы
Многим читателям вышеприведенная теория покажется абсолютно бесполезной в свете их основной цели – построение невероятных мышечных объемов. Однако такое суждение будет ошибочным. Как вы наверняка знаете, цель любой тренировки заключается в банальном нанесении травм мышечному волокну на клеточном уровне, но мало кто знает, что на самом деле является такой травмой. На данный момент одной из самых основных гипотез является теория повреждения миозиновых мостиков.
Как уже говорилось выше, для отцепления от актина мостиков миозина нужна энергия. Однако, что будет, если этой энергии нет?!
Такую картину можно наблюдать при достаточно большом рабочем весе, который за считанные секунды тратит весь запас КрФ. Итогом такого дефицита энергии станет обыкновенный отказ мышцы!
Проанализировав этот процесс на клеточном уровне, эксперты обнаружили, что не отсоединённые мостики попросту ломаются во время тренировки, ведь нить актина в любом случае вернется в исходную позицию. Принято считать, что именно такие повреждения ведут к заветным микротравмам, которые впоследствии вызывают рост мышц.
На эту гипотезу опираются все те, кто верят в феномен гиперплазии – увеличение числа мышечных клеток. Считается, что такие травмы ведут к самой агрессивной адаптационной реакции – высвобождению клеток сателлитов (миобластов), которые перерождаются и тем самым создают новое мышечное волокно. К сожалению, прямых доказательств существования или отсутствия таких процессов пока нет. Наука попросту не шагнула настолько далеко.
Несмотря на все это, вы можете подчерпнуть большой опыт из данной статьи. Если мышечная гипертрофия(работа в режиме 8-12 повторений) не вызывает у вас активного роста мышц, можете смело пробовать силовой диапазон повторений (4-6-8). Теоретически, это поспособствует гиперплазии, что разумеется, положительно скажется на общем объеме мускулатуры, ведь вклад мышечных волокон в общий объем мышцы является самым весомым.Структура мышечных волокон | opace.ru
Особенностью движений человека является то, что звенья его тела перемещаются под действием мышц, активность которых вызвана биохимическими реакциями, протекающими внутри них. Движения человека осуществляют скелетные мышцы, также называемые поперечно-полосатыми.
Мышца является исключительно разнородной тканью, состоящей преимущественно из мышечных волокон, соединительнотканных, нервных и сосудистых элементов, которые в комплексе обеспечивают её главную функцию – активное сокращение. В структуре мышечной ткани различают два типа мышечных волокон – медленно сокращающиеся (МС) и быстросокращающиеся (БС).
МС-волокна обладают следующими свойствами: небольшой скоростью сокращения, большим количеством митохондрий («энергоцентр» клетки), большим количеством капилляров, высоким потенциалом накопления гликогена. Эти волокна связаны с аэробным механизмом энергообразования. БС-волокна имеют менее развитую сеть капилляров, меньшее число митохондрий, высокую гликолитическую способность, более высокую скорость сокращения.
В одной и той же мышце содержатся БС- и МС-волокна. Различают две подгруппы БС-волокон: БСа и БСб. БСа-волокна называют быстросокращающимися анаэробно-гликолитическими волокнами. Они отличаются высокими сократительными способностями и одновременно обладают высокой сопротивляемостью утомлению. Эти волокна хорошо подвержены тренировке на выносливость. БСб-волокна – классический тип быстросокращающихся волокон, работа которых связана с использованием анаэробно-алактатного (креатинфосфатного) механизма источника энергии.
Соотношение мышечных волокон разных типов детерминировано генетически. Вероятно, структура мышечного волокна, соотношение волокон разного типа заложены на уровне ДНК и в значительной мере определяются особенностями нейромышечной регуляции. Таким образом, генетически заданный тип иннервации обеспечивает формирование фенотипа мышечной ткани, которая лишь в относительно узких границах может быть модифицирована напряжённой тренировкой.
Мышечные волокна объединяются в двигательные единицы (группы мышечных волокон, иннервируемых одним мотонейроном), каждая из которых состоит из мышечных волокон определённого типа. Строение и функции мотонейрорнов соответствуют строению и функциям объединяемых ими мышечных волокон. Мотнейрон медленносокращающейся двигательной единицы объединяет группы из 10 – 180 МС-волокон и имеет небольшое клеточное тело. Мотнейрон быстросокращающейся двигательной единицы иннервирует от 300 до 800 БС-волокон и отличается большим клеточным телом и большим количеством нервных отростков.
Говоря о пропорциях различных мышечных волокон у человека, следует отметить, что и у мужчин, и у женщин МС-волокон несколько больше – от 52 до 55%. Среди БС-волокон преобладают волокна типа БСа (30 – 35%). БСб-волокон значительно меньше – 12 – 15%.
Важно отметить, что структура и возможности мышечных волокон не зависят от пола спортсменов. Зависимость между площадью поперечного сечения и силой является идентичной у мужчин и женщин: на единицу площади поперечного сечения мышцы у мужчин и женщин приходится один и тот же уровень силы (6 кг/см²), в то время как возраст на уровень силовых качеств мышцы существенно не влияет.
У спортсменов высокого класса наблюдаются различные соотношения мышечных волокон в мышцах, несущих основную нагрузку в данном виде спорта. У бегунов-спринтеров отмечается высокий процент БС-волокон, у лыжников, бегунов на длинные дистанции преобладают МС-волокна, у бегунов на средние дистанции и метателей отмечается относительно равномерное распределение БС и МС-волокон. Существует строгая зависимость между количеством БС- и МС-волокон в мышечной ткани и спортивными достижениями на спринтерских и стайерских дистанциях. У стайеров количество МС-волокон может доходить до 90 %, а у спринтеров до 90 % БС-волокон.
Таким образом, количество мышечных волокон определённого типа в значительной мере обусловливают достижения спортсменов в различных видах соревнований. В спринтерской работе скоростно-силового характера (бег на 100 м, бег на коньках на 500 м, плавание на 50 м, легкоатлетические прыжки и др.) большое значение имеют БСб-волокна. В беге на 400 и 800 м, плавании на 100 и 200 м и др. очень велика роль БСа-волокон. Успех в стайерских дисциплинах разных видов спорта в решающей мере определяется количеством МС-волокон.
Специалисты склоняются к мнению, что соотношения мышечных волокон различного типа у человека обусловлено генетически. Что касается влияния интенсивной тренировки определённой направленности (развитие выносливости к длительной работе, скоростно-силовой), то она приводит к существенному изменению морфологических, физиологических и биомеханических свойств мышечных волокон. Под влиянием длительных тренировочных воздействий, направленных на повышение выносливости аэробного характера, трансформация свойств мышечных волокон различных типов происходит в следующем порядке: БСб-волокна приобретают свойства БСа-волокон, а БСа-волокна – свойства МС-волокон. Под влиянием длительных и интенсивных тренировочных нагрузок, направленных на повышение скоростных и скоростно-силовых качеств, происходит обратный процесс: МС-волокна приобретают свойства БСа-волокон, а БСа-волокна – соответственно свойства Бсб-волокон.
Оба типа мышечных волокон (МС-волокна и БС-волокна) имеют характеристики, которые могут быть изменены в процессе тренировки. Эффект напряжённой тренировки аэробного и смешанного (аэробно-анаэробного) характера проявляется в увеличении количества капилляров на мышечное волокно или на квадратный миллиметр мышечной ткани. Здесь выявляются два механизма: увеличение количества капилляров; если же возможности этого механизма исчерпаны или невелики, то происходит уменьшение размера мышечных волокон.
МС-волокна очень слабо подвержены скоростной тренировке. Так, спортсмены, в мышцах которых содержится малое количество БС-волокон, слабо приспосабливаются к скоростной работе даже после напряжённой тренировки скоростного характера. Например, высота прыжка вверх у спортсменов, специализирующихся в плавании на длинные дистанции, обычно не превышает 45 – 50 см, в то время как у спортсменов с большим количеством БСа- и БСб-волокон она редко бывает ниже 70 см.
Мышечное волокно — обзор
Мышечные волокна имеют высокоорганизованную структуру
Мышечные волокна обычно представляют собой крупные клетки, примерно 20–100 мкм в диаметре и многие сантиметры в длину, причем самые длинные волокна составляют около 12 см. Эти клетки являются многоядерными , потому что им нужно много ядер для управления синтезом и деградацией белка. Ядра обычно расположены около периферии клетки и часто более концентрированы около мионеврального или нервно-мышечного соединения.Наиболее яркой особенностью мышечных клеток, наблюдаемых под световым микроскопом, является их полосатый вид. Волокна имеют полосы или полосок , которые являются результатом высокоорганизованного расположения белков в мышечном волокне. Эти полосы состоят из чередующихся A-полос и I-полос , названных потому, что I-полосы изотропны поляризованному свету (что означает, что они кажутся одинаковыми со всех направлений), тогда как A-полосы анизотропны к поляризованному свету.Поперечные бороздки перпендикулярны длинной оси мышечного волокна. На рис. 3.5.1 показано микроскопическое изображение волокон скелетных мышц лягушки с помощью фазово-контрастной микроскопии.
Рисунок 3.5.1. Микроскопический вид скелетных мышц. Пучок мышечных волокон портняжной мышцы лягушки извлекали и рассматривали под фазово-контрастной микроскопией. На этих неокрашенных мышечных волокнах хорошо видны поперечные полосы.
Мышечные клетки также имеют поперечно-полосатую форму за счет организации сократительных белков в крошечные нити, называемые миофибриллами .Обычно это цилиндры из материала диаметром около 1 мкм, на которых также отчетливо видны поперечные бороздки. Миофибриллы сохраняются в регистре по всей клетке, что приводит к появлению поперечно-полосатой формы. Электронная микрофотография на рис. 3.5.2 показывает, как полосы миофибрилл выстраиваются в линию поперек клетки.
Рисунок 3.5.2. Электронная микрофотография мышцы. Пространства между миофибриллами заполнены мембранами саркоплазматического ретикулума, митохондриями и гранулами гликогена.Миофибриллы представляют собой пучки нитей, расположенных продольно параллельно длинной оси мышечного волокна. Различные полосы названы в соответствии с их положением, внешним видом или тем, как они вращают плоскость поляризованного света.
Так же, как каждое мышечное волокно содержит множество миофибрилл, каждая миофибрилла, в свою очередь, состоит из множества волокон. Эти нити бывают двух основных разновидностей: тонкие нити и толстые нити . Основным компонентом тонкого филамента является актин ; основной компонент толстого филамента — миозин .Микроскопически-полосатый вид мышцы обусловлен тем, как волокна перекрывают друг друга.
Толстые волокна определяют начало и конец A-диапазона. Миозиновый компонент A-полосы вызывает анизотропное поведение в поляризованном свете. Поскольку толстые волокна имеют длину 1,6 мкм, длина полосы А также составляет 1,6 мкм. На рисунке 3.5.3 схематически показано строение мышечных волокон и миофибрилл.
Рисунок 3.5.3. Строение мышечного волокна и миофибрилл.Полоса А соответствует длине толстых нитей 1,6 мкм. I-полоса соответствует тонким нитям, где они не перекрываются с толстыми нитями. Его ширина зависит от активации мышцы. Z-линия или диск — это место, где прикрепляются тонкие нити от противоположных саркомеров. Линия M в середине полосы A удерживает толстые нити по центру и совмещает их. Чистая зона в середине полосы А — это область, где тонкие волокна не перекрывают толстые волокна.
Тонкие нити имеют длину около 1,0 мкм, но их длина варьируется в зависимости от типа и вида мышц. При биопсии дельтовидной мышцы человека длина тонкой нити в среднем составляет 1,19 мкм, тогда как в большой грудной мышце она составляет 1,37 мкм. Противоположные тонкие нити соединены спиной к спине в структуре, называемой Z-line (от немецкого «zwischen», что означает «между»). Поскольку миофибриллы имеют цилиндрическую форму, Z-линия на самом деле представляет собой диск из материала, и его также называют Z-диском .Тонкие нити обычно перекрывают толстые нити. H-зона — более четкая область в середине толстых волокон. Его название происходит от немецкого helles, что означает «ясный». Это часть А-полосы, в которой тонкие волокна не перекрывают толстые волокна. Толстые нити соединены в центре материалом, образующим линию M-line (от немецкого «mittel», что означает «середина»; см. Рисунки 3.5.2 и 3.5.3).
Электронные микрофотографии показывают, что толстые нити образуют гексагонально-центрированную решетку.Тонкие волокна также образуют гексагональную решетку, но она повернута на 30 ° относительно решетки толстых волокон. Каждая толстая нить находится в центре шестиугольника из тонких нитей, тогда как каждая тонкая нить расположена на равном расстоянии от треугольника из трех толстых нитей. Таким образом, каждая тонкая нить окружена тремя толстыми нитями, а каждая толстая нить окружена шестью тонкими нитями. На некоторых электронных микрофотографиях можно увидеть поперечных мостиков между толстыми и тонкими нитями. Взаимодействие волокон через эти поперечные мостики вызывает либо укорачивание, либо силу.
Функциональная единица сокращения или создания силы — это саркомер , простирающийся от одного Z-диска к другому. Миофибриллы состоят из тысяч этих саркомеров, нанизанных до конца. Длина саркомера зависит от активации мышц. Обычно остаточная длина составляет около 2,0–2,2 мкм, в зависимости от длины тонкой нити. Эта остаточная длина меньше, чем у толстой нити (1,6 мкм) плюс две тонкие нити (1,0–1,37 мкм каждая) из-за перекрытия нитей в состоянии покоя.
Через равные промежутки времени поверхностная мембрана мышечного волокна, сарколемма , инвагинируется с образованием длинного канальца, идущего перпендикулярно поверхности и проникающего в самые дальние части внутренней части волокна. Это поперечные канальцы или Т-канальцы. Функция этих Т-канальцев — переносить потенциал действия на сарколемму внутрь клетки. Т-канальцы обеспечивают быстрое распространение возбуждения на все части саркоплазмы.
Рядом с Т-канальцами и вокруг каждой миофибриллы находится мембранная сеть, называемая саркоплазматической сетью или SR . Эта органелла окружает миофибриллы, как свободный свитер, окружающий вашу руку. Он образует внутренний отсек, люмен , отдельный от цитоплазмы мышечного волокна. SR делится на продольных SR и терминальных цистерн . Концевые цистерны представляют собой мешочки, которые контактируют с Т-канальцами, тогда как продольные SR представляют собой тонкие мембранные трубочки, которые соединяют концевые цистерны от одной стороны саркомера к другой.Продольные SR и терминальные цистерны соединены между собой и образуют единое замкнутое пространство. В скелетных мышцах соединение Т-канальца и SR образует триаду , потому что это место соединения одного Т-канальца и двух терминальных цистерн. В скелетных мышцах млекопитающих триады встречаются на стыке А-диапазона и I-диапазона, так что на саркомер приходится две триады. Расположение Т-канальцев и соединения SR зависит от вида и типа мышц. На рисунке 3.5.4 показано анатомическое отношение SR к миофибриллам.
Рисунок 3.5.4. Структура SR вокруг миофибриллы.
Влияние на сократительные и метаболические свойства
Образец цитирования: Зиерат Дж. Р., Хоули Дж. А. (2004) Тип волокна скелетных мышц: влияние на сократительные и метаболические свойства. PLoS Biol 2 (10): e348. https://doi.org/10.1371/journal.pbio.0020348
Опубликовано: 12 октября 2004 г.
Авторские права: © 2004 Juleen R.Зиерат и Джон А. Хоули. Это статья в открытом доступе, распространяемая в соответствии с условиями лицензии Creative Commons Attribution License, которая разрешает неограниченное использование, распространение и воспроизведение на любом носителе при условии правильного цитирования оригинальной работы.
Сокращения: футов, быстросокращающийся; FT a , аэробное волокно FT; FT b , анаэробное волокно FT; HIF-1α, Фактор, индуцируемый гипоксией-1α; МАПК, митоген-активированная протеинкиназа; MEF2, фактор усиления миоцитов 2; PGC-1, γ-коактиватор пролифератора пероксисом 1; PPARδ, рецептор, активируемый пролифератором пероксисом; ST, медлительный; ВО 2 макс., максимальное поглощение O 2
Скелетные мышцы демонстрируют замечательную пластичность, приспосабливаясь к множеству внешних раздражителей (Booth and Thomason 1991; Chibalin et al.2000; Hawley 2002; Flück and Hoppeler 2003), включая привычный уровень сократительной активности (например, тренировка на выносливость), состояние нагрузки (например, тренировка с отягощениями), доступность субстрата (например, поступление макронутриентов) и преобладающие условия окружающей среды (например, тепловой стресс). . Этот феномен пластичности характерен для всех позвоночных (Schiaffino and Reggiani 1996). Однако существует большая разница в степени приспособляемости между видами и между особями внутри вида.Такая вариабельность частично объясняет заметные различия в аспектах физической работоспособности, таких как выносливость или сила, между людьми, а также взаимосвязь между типом волокон скелетных мышц и некоторыми хроническими заболеваниями, включая ожирение и инсулинорезистентность.
У большинства млекопитающих скелетные мышцы составляют около 55% индивидуальной массы тела и играют жизненно важную роль в передвижении, выработке тепла в периоды холодового стресса и общем метаболизме (рис. 1).Таким образом, знание молекулярных и клеточных событий, которые регулируют пластичность скелетных мышц, может определить потенциал для адаптации в работе и метаболизме, а также привести к открытию новых генов и путей в общих клинических болезненных состояниях.
Рисунок 1. Анатомия скелетной мышцы
Отдельные пучки мышечных волокон называются пучками. Клеточная мембрана, окружающая мышечную клетку, — это сарколемма, а под сарколеммой находится саркоплазма, которая содержит клеточные белки, органеллы и миофибриллы.Миофибриллы состоят из двух основных типов белковых нитей: более тонкой актиновой нити и более толстой миозиновой нити. Расположение этих двух белковых нитей придает скелетным мышцам полосатый вид.
https://doi.org/10.1371/journal.pbio.0020348.g001
Как классифицируется тип волокна скелетных мышц?
Большая часть нашего раннего понимания пластичности скелетных мышц была получена из исследований, проведенных физиологами, занимающимися физическими упражнениями (например,г., Холлоши 1967). С применением хирургических методов к физиологии упражнений в конце 1960-х (Bergstrom and Hultman, 1966) стало возможным получить образцы биопсии (~ 150 мг) скелетных мышц человека, а также с помощью гистологических и биохимических анализов, специфических морфологических, сократительных , и метаболические свойства. В 1873 году французский анатом Луи Антуан Ранвье уже заметил, что некоторые мышцы кролика были более красного цвета и сокращались медленнее и устойчивее, чем более светлые мышцы того же животного.Эти ранние наблюдения легли в основу классической терминологии красных и белых мышечных волокон, которая, как впоследствии выяснилось, связана с содержанием миоглобина (железосодержащий белок, транспортирующий кислород в красных кровяных тельцах) (Needham 1926). Основываясь на гистохимическом окрашивании (Engel 1962), мышечные волокна в настоящее время обычно различают на медленные (ST), которые окрашиваются в темный или красный цвет, и на быстро сокращающиеся (FT), которые окрашиваются в светлые или бледные цвета. У людей производят дополнительное подразделение волокон FT (Brooke and Kasier, 1970), при этом более аэробное (или окислительное) волокно FT обозначается FT a , а более анаэробное (гликолитическое) волокно обозначается FT b . .В аэробных условиях (достаточное поступление кислорода к работающим мышцам) энергия вырабатывается без производства лактата. В анаэробных условиях (недостаточное поступление кислорода к работающим мышцам) энергия вырабатывается через гликолитический путь, что приводит к накоплению лактата и, в свою очередь, ограничивает анаэробные упражнения. Таким образом, мышечные волокна можно классифицировать по сократительным и метаболическим свойствам (таблица 1).
Все люди обладают разной способностью выполнять аэробные или анаэробные упражнения, частично в зависимости от состава их мышечных волокон.У нетренированных людей доля ST-волокон в мышце broadus lateralis (самая большая из четырехглавой мышцы и наиболее часто исследуемая мышца у людей) обычно составляет около 55%, причем волокна FT и встречаются в два раза чаще, чем FT b волокон (Салтин и др., 1977). Хотя заметные различия в метаболических потенциалах между волокнами FT a и FT b наблюдаются у нетренированных людей, абсолютный уровень активности окислительных и гликолитических ферментов во всех типах волокон достаточно велик, чтобы обеспечить существенный аэробный и анаэробный метаболизм ( Saltin et al.1977). В то время как отдельные скелетные мышцы грызунов в значительной степени однородны (Delp and Duan 1996), это не относится к людям (Saltin et al. 1977). Резкая неоднородность состава волокон у разных людей может объяснить их поразительные различия в выполнении упражнений.
Влияет ли состав мышечных волокон на спортивные результаты?
В 1970-х и 1980-х годах было популярно определять состав мышечных волокон спортсменов, участвующих в различных спортивных мероприятиях.Эти исследования показали, что у успешных спортсменов на выносливость в тренированной мускулатуре относительно больше ST, чем FT-волокон (Костилл и др., 1976; Финк и др., 1977; Салтин и др., 1977). Напротив, у спринтеров есть мышцы, которые состоят преимущественно из волокон FT (Costill et al. 1976). Соответственно, завоевало доверие мнение о том, что тип мышечных волокон может предсказать успехи в спорте. В частности, было предложено представление о том, что доля ST-волокон может быть фактором, определяющим успех в соревнованиях на выносливость (Gollnick et al.1972; Costill et al. 1976).
В этом отношении результаты Fink et al. (1977) важны. Эти исследователи определили состав волокон из икроножной мышцы (мышцы голени) 14 элитных бегунов на длинные дистанции мужского пола, 18 хороших (но не мирового класса) бегунов на длинные дистанции мужского пола и 19 нетренированных мужчин. В элитную группу вошли олимпийские медалисты (рис. 2) и американские рекордсмены того времени. Мышцы элитных бегунов содержат большую долю ST-волокон, чем у хороших бегунов или нетренированных мужчин (79.0% ± 3,5% против 61,8% ± 2,9% против 57,7% ± 2,5% соответственно; p <0,05). Значения, обнаруженные для нескольких элитных бегунов, были самыми высокими для мышц человека (> 92% ST). Более того, волокна ST у элитных бегунов были на 29% больше, чем волокна FT ( p <0,05), а волокна ST и FT были больше у хороших бегунов, чем у нетренированных мужчин. Из-за заметной гипертрофии (увеличения объема) волокон ST у элитных бегунов площадь поперечного сечения, состоящая из этих волокон, была больше, чем у хороших бегунов или нетренированных участников (82.9% ± 3,1% против 62,1% ± 2,6% против 60,0% ± 2,7% соответственно; p <0,05). Когда данные от элитных и хороших бегунов были объединены, была отмечена положительная корреляция между долей волокон ST и лучшим временем выполнения 6 миль ( r = -0,62, p <0,05).
Рисунок 2. Микроскопический вид скелетной мышцы Gastrocnemius от марафонца мирового класса, Фрэнк Шортер (золотой медалист Олимпийских игр, 1972 год; серебряный призер Олимпийских игр, 1976 год)
Темно окрашенные волокна имеют относительно низкую скорость сокращения и являются ST.Эти волокна демонстрируют более высокую аэробную (окислительную) способность и более низкий анаэробный (гликолитический) потенциал, чем более светлые окрашенные волокна FT. Мышца Шортера содержит примерно 80% волокон ST. Воспроизведено с любезного разрешения Дэвида Л. Костилла и Уильяма Дж. Финка.
https://doi.org/10.1371/journal.pbio.0020348.g002
Однако только тип волокна не определял результаты профессиональных спортсменов. Например, два спортсмена со схожими лучшими результатами за 42 года.Марафонская дистанция 2 км (приблизительно 2 часа 18 минут) содержала 50% мышечных волокон ST по сравнению с 98%. Последующая работа (Фостер и др., 1978) показала, что результативность бега на выносливость лучше связана с максимальным потреблением O 2 атлетом (VO 2max ; r = -0,84, -0,87 и -0,88 для 1-, 2). — и 6 миль соответственно). Действительно, хотя тип мышечного волокна спортсмена является важным морфологическим компонентом и связан с несколькими сократительными и метаболическими свойствами (см. Таблицу 1), другие физиологические факторы (например,g., VO 2max , максимальный сердечный выброс и скорость / мощность на пороге лактата) с большей вероятностью определяют верхние пределы выносливости (Coyle 1995; Hawley and Stepto 2001).
Способствуют ли изменения типа волокон скелетных мышц метаболическому заболеванию?
Тесная связь между типом мышечного волокна и соответствующими морфологическими, метаболическими и функциональными свойствами не ограничивается спортивными способностями. Чувствительность к инсулину также коррелирует с долей окислительных волокон ST (Lillioja et al.1987). В частности, стимулированный инсулином транспорт глюкозы больше в скелетных мышцах, обогащенных мышечными волокнами ST (Henriksen et al. 1990; Song et al. 1999; Daugaard et al. 2000), таким образом, стимулируя ST-мышцы для ускоренного поглощения глюкозы и метаболизма. Сдвиг в распределении волокон от ST к FT-волокнам приводит к изменению активности ключевых окислительных и гликолитических ферментов (Pette and Hofer 1980). Действительно, соотношение между гликолитической и окислительной активностями ферментов в скелетных мышцах инсулиннезависимых диабетиков или лиц с ожирением связано с инсулинорезистентностью (Simoneau et al.1995; Симоно и Келли 1997). Точно так же со старением и отсутствием физической активности уменьшаются два других состояния, связанных с преобразованием типа волокон ST-toFT, окислительная способность и чувствительность к инсулину (Papa 1996).
Гены, определяющие фенотип скелетных мышц
Фенотип скелетных мышечных волокон регулируется несколькими независимыми сигнальными путями (рис. 3). К ним относятся пути, связанные с Ras / митоген-активируемой протеинкиназой (MAPK) (Murgia et al.2000), кальциневрин (Chin et al. 1998; Naya et al. 2000), кальций / кальмодулин-зависимая протеинкиназа IV (Wu et al. 2002) и коактиватор 1 пролифератора пероксисом γ (PGC-1) (Lin et al. 2002 г.). Сигнальный путь Ras / MAPK связывает двигательные нейроны и сигнальные системы, связывая возбуждение и регуляцию транскрипции, чтобы способствовать нервно-зависимой индукции медленной программы в регенерирующих мышцах (Murgia et al. 2000). Кальциневрин, Ca 2+ / кальмодулин-активируемая фосфатаза, участвующая в спецификации типа волокна, зависящей от нервной активности, в скелетных мышцах, непосредственно контролирует состояние фосфорилирования фактора транскрипции NFAT, позволяя его транслокацию в ядро и приводя к активации мышечных белков медленного типа в сотрудничестве с белками фактора усиления миоцитов 2 (MEF2) и другими регуляторными белками (Chin et al.1998; Серрано и др. 2001). Кальций-зависимая активность Ca 2+ / кальмодулин-киназы также повышается за счет медленной активности двигательных нейронов, возможно, потому, что она усиливает медленные реакции, генерируемые кальциневрином, стимулируя функции трансактиватора MEF2 и увеличивая окислительную способность за счет стимуляции биогенеза митохондрий (Wu et al. al.2002).
Рисунок 3. Включенные в упражнения сигнальные пути в скелетных мышцах, которые определяют специальные характеристики мышечных волокон ST и FT
Изменения внутриклеточного кальция или активных форм кислорода, вызванные сокращением, обеспечивают сигналы для различных путей, которые включают MAPK, кальциневрин и кальций / кальмодулин. -зависимая протеинкиназа IV для активации факторов транскрипции, регулирующих экспрессию генов и активность ферментов в скелетных мышцах.
https://doi.org/10.1371/journal.pbio.0020348.g003
PGC1-α, транскрипционный коактиватор ядерных рецепторов, важный для регуляции ряда митохондриальных генов, участвующих в окислительном метаболизме, напрямую взаимодействует с MEF2, оказывая синергетическое воздействие. активируют селективные гены мышц ST, а также служат мишенью для передачи сигналов кальциневрина (Lin et al. 2002; Wu et al. 2001). Новые данные, представленные в этом выпуске PLoS Biology (Wang et al. 2004), показывают, что транскрипционный путь, опосредованный рецептором δ (PPARδ), активируемым пролифератором пероксисом, участвует в регуляции фенотипа волокон скелетных мышц.Мыши, несущие активированную форму PPARd, демонстрируют фенотип «выносливости» с координированным увеличением окислительных ферментов и митохондриального биогенеза и увеличенной долей ST волокон. Таким образом, посредством функциональной геномики кальциневрин, кальмодулин-зависимая киназа, PGC-1α и активированный PPARδ образуют основу сигнальной сети, которая контролирует трансформацию волокон скелетных мышц и метаболические профили, защищающие от инсулинорезистентности и ожирения.
Переход от аэробного к анаэробному метаболизму во время интенсивной работы требует быстрой активации нескольких систем для обеспечения постоянного снабжения АТФ работающими мышцами.К ним относятся переход с топлива на основе жиров на топливо на основе углеводов, перераспределение кровотока от неработающих к тренированным мышцам и удаление некоторых побочных продуктов анаэробного метаболизма, таких как углекислый газ и молочная кислота. Некоторые из этих ответов регулируются транскрипционным контролем гликолитического фенотипа FT. Например, перепрограммирование скелетных мышц из гликолитического фенотипа ST в гликолитический фенотип FT включает комплекс Six1 / Eya1, состоящий из членов семейства белков Six (Grifone et al.2004 г.). Более того, индуцируемый гипоксией фактор-1α (HIF-1α) был идентифицирован как главный регулятор экспрессии генов, участвующих в основных гипоксических ответах, которые поддерживают уровни АТФ в клетках. В этом выпуске PLoS Biology (Mason et al. 2004) раскрывается ключевая роль HIF-1α в опосредовании индуцированных физической нагрузкой генных регуляторных реакций гликолитических ферментов. Удаление HIF-1α в скелетных мышцах было связано с увеличением активности ограничивающих скорость ферментов митохондрий, что указывает на то, что цикл лимонной кислоты и повышенное окисление жирных кислот могут компенсировать снижение потока через гликолитический путь у этих животных.Однако опосредованные гипоксией ответы HIF-1α также связаны с регуляцией митохондриальной дисфункции через образование избыточных активных форм кислорода в митохондриях.
Можете ли вы стать медлительным?
Учитывая, что Олимпийские игры 2004 года все еще свежи в наших умах, многие спросят: у кого есть все необходимое для преодоления дистанции? Такие спортсмены, как олимпийский чемпион Фрэнк Шортер, явно исключительны и представляют собой крайность фенотипа скелетных мышц человека. На самом деле, немногие из нас когда-либо могут надеяться пробежать марафон за время мирового уровня.Тем не менее, у среднего смертного может быть повод для некоторого оптимизма, поскольку тренировки на выносливость у здоровых людей приводят к специфическому для типа волокон увеличению содержания белка PGC-1 и PPAR-α в скелетных мышцах (Russell et al. 2003). . Более того, функциональная геномика поддерживает идею о том, что ремоделирование скелетных мышц до фенотипа ST посредством активированного кальциневрина или PPARδ может защитить от развития индуцированной диетой резистентности к инсулину (Ryder et al., 2003) и ожирения (Wang et al.2004 г.). Результаты этих исследований имеют клиническое значение, поскольку у инсулинорезистентных пожилых людей и потомков пациентов с сахарным диабетом 2 типа наблюдается митохондриальная дисфункция скелетных мышц (Petersen et al. 2003; Petersen et al. 2004). Очевидно, что необходимы дальнейшие трансляционные исследования на людях, чтобы проверить гипотезу о том, что увеличение доли окислительных мышечных волокон ST преодолеет митохондриальную дисфункцию и метаболические дефекты, связанные с инсулинорезистентными состояниями.
Список литературы
- 1. Bergstrom J, Hultman E (1966) Синтез мышечного гликогена после упражнений: усиливающий фактор, локализованный в мышечных клетках человека. Природа 210: 309–310.
- 2. Бут FW, Thomason DB (1991) Молекулярная и клеточная адаптация мышц в ответ на упражнения: перспективы различных моделей. Physiol Rev 71: 541–585.
- 3. Brooke MH, Kasier KK (1970) Три системы «миозин-АТФазы»: природа их pH-чувствительности и сульфгидрильной зависимости.J. Histochem Cytochem 18: 670–672.
- 4. Чибалин А.В., Ю. М., Райдер Дж. В., Сонг Х. М., Галуска Д. и др. (2000) Изменения экспрессии и активности белков, участвующих в передаче инсулинового сигнала в скелетных мышцах, вызванные упражнениями: дифференциальные эффекты на субстраты рецепторов инсулина 1 и 2. Proc Natl Acad Sci U S. A 97: 38–43.
- 5. Чин Э. Р., Олсон Э. Н., Ричардсон Дж. А., Янг К., Хамфрис С. и др. (1998) Зависимый от кальциневрина путь транскрипции контролирует тип волокон скелетных мышц.Genes Dev 12: 2499–2509.
- 6. Костилл Д.Л., Дэниэлс Дж., Эванс В., Финк В., Крахенбуль Г. (1976) Ферменты скелетных мышц и состав волокон у легкоатлетов мужского и женского пола. J Appl Physiol 40: 149–154.
- 7. Койл Э.Ф. (1995) Интеграция физиологических факторов, определяющих выносливость. Exerc Sport Sci Rev 23: 25–63.
- 8. Daugaard JR, Nielsen JN, Kristiansen S, Andersen JL, Hargreaves M, Richter EA (2000) Специфическая для типа волокна экспрессия GLUT4 в скелетных мышцах человека: влияние тренировок.Диабет 49: 1092–1095.
- 9. Delp MD, Duan CC (1996) Состав и размер волокон типа I, IIA, IID / X и IIB и активность цитрат-синтазы в мышцах крысы. J Appl Physiol 80: 261–270.
- 10. Engel WK (1962) Важность гисто- и цитохимических исследований скелетных мышц в исследовании нервно-мышечных заболеваний. Неврология 12: 778–784.
- 11. Финк В.Дж., Костилл Д.Л., Поллок М.Л. (1977) Субмаксимальная и максимальная работоспособность элитных бегунов на длинные дистанции.Часть II: Состав мышечных волокон и активность ферментов. Ann N Y Acad Sci 301: 323–327.
- 12. Flück M, Hoppeler H (2003) Молекулярная основа пластичности скелетных мышц — от гена к форме и функции. Rev Physiol Biochem Pharmacol 146: 159–216.
- 13. Foster C, Costill DL, Daniels JT, Fink WJ (1978) Активность ферментов скелетных мышц, волокна в зависимости от состава дистанции и VO 2 максимальная беговая производительность. Eur J Appl Physiol Occup Physiol 39: 73–80.
- 14. Gollnick PD, Armstrong RB, Saubert CW, Piehl K, Saltin B (1972) Активность ферментов и состав волокон в скелетных мышцах нетренированных и тренированных мужчин. J Appl Physiol 33: 312–319.
- 15. Grifone R, Laclef C, Spitz F, Lopez S, Demignon J и др. (2004) Экспрессия Six1 и Eya1 может репрограммировать взрослые мышцы из медленно сокращающегося фенотипа в быстро сокращающийся фенотип. Mol Cell Biol 24: 6253–6267.
- 16. Хоули Дж. А. (2002) Адаптация скелетных мышц к длительным интенсивным тренировкам на выносливость.Clin Exp Pharmacol Physiol 29: 218–222.
- 17. Хоули Дж. А., Степто Н. К. (2001). Адаптация к тренировкам велосипедистов на выносливость: влияние на производительность. Sports Med 31: 511–520.
- 18. Henriksen EJ, Bourey RE, Rodnick KJ, Koranyi L, Permutt MA (1990) Содержание белка-переносчика глюкозы и транспортная способность глюкозы в скелетных мышцах крыс. Am J Physiol 259: E593 – E598.
- 19. Holloszy JO (1967) Биохимические адаптации в мышцах.Влияние упражнений на поглощение кислорода митохондриями и активность дыхательных ферментов в скелетных мышцах. J Biol Chem 242: 2278–2282.
- 20. Lillioja S, Young AA, Culter CL, Ivy JL, Abbott WG, et al. (1987) Плотность капилляров скелетных мышц и тип волокон являются возможными детерминантами инсулинорезистентности in vivo у человека. Дж. Клин Инвест 80: 415–424.
- 21. Lin J, Wu H, Tarr PT, Zhang CY, Wu Z (2002) Коактиватор транскрипции PGC-1 alpha управляет образованием медленно сокращающихся мышечных волокон.Природа 418: 797–801.
- 22. Мейсон С.Д., Хоулетт Р.А., Ким М.Дж., Олферт М., Хоган М.С. и др. (2004) Потеря HIF-1α в скелетных мышцах приводит к изменению выносливости при физической нагрузке. PLoS Biol 2: e288.
- 23. Murgia M, Serrano A, Calabria E, Pallafacchina G, Lono T (2000) Ras участвует в зависимой от нервной активности регуляции мышечных генов. Nat Cell Biol 2: 142–147.
- 24. Найя Ф.Дж., Мерсер Б., Шелтон Дж., Ричардсон Дж. А., Уильямс Р.С. и др. (2000) Стимуляция медленной экспрессии гена волокон скелетных мышц кальциневрином in vivo.J Biol Chem 275: 4545–4548.
- 25. Needham DM (1926) Красные и белые мышцы. Physiol Rev 6: 1-27.
- 26. Папа С. (1996) Изменения окислительного фосфорилирования митохондрий в течение жизни. Молекулярные аспекты и физиопатологические последствия. Biochim Biophys Acta 1276: 87–105.
- 27. Петерсен К.Ф., Бефрой Д., Дюфур С., Дзюра Дж., Ариян С. и др. (2003) Митохондриальная дисфункция у пожилых людей: возможная роль в инсулинорезистентности.Наука 300: 1140–1142.
- 28. Петерсен KF, Dufour S, Befroy D, Garcia R, Shulman GI (2004) Нарушение митохондриальной активности у инсулинорезистентных потомков пациентов с диабетом 2 типа. N Engl J Med 350: 664–671.
- 29. Pette D, Hofer HW (1980) Концепция группы ферментов с постоянной пропорцией при выборе эталонных ферментов в метаболизме. Ciba Found Symp 73: 231–244.
- 30. Ранвье Л. (1873) Собственники и структуры, отличающиеся от красных мускулов и белых мускулов.CR Hebd Acad Sci (Париж) 77: 1030–1043.
- 31. Рассел А.П., Фейлхенфельдт Дж., Шрайбер С., Праз М., Креттенанд А. и др. (2003) Тренировка на выносливость у людей приводит к специфическому для типа волокна увеличению уровней рецептора-гамма-коактиватора-1, активируемого пролифератором пероксисом, и рецептора-альфа, активируемого пролифератором пероксисом, в скелетных мышцах. Диабет 52: 2874–2881.
- 32. Ryder JW, Bassel-Duby R, Olson EN, Zierath JR (2003) Перепрограммирование скелетных мышц путем активации кальциневрина улучшает действие инсулина на метаболические пути.J Biol Chem 278: 44298–44304.
- 33. Saltin B, Henriksson J, Nygaard E, Andersen P (1977) Типы волокон и метаболические потенциалы скелетных мышц у малоподвижных мужчин и бегунов на выносливость. Ann N Y Acad Sci 301: 3–44.
- 34. Серрано А., Мурджа М., Паллафаккина Г., Калабрия Е., Конильо П. и др. (2001) Кальциневрин контролирует зависящую от нервной активности спецификацию медленных волокон скелетных мышц, но не рост мышц. Proc Natl Acad Sci U S A 98: 13108–13113.
- 35. Simoneau JA, Kelley DE (1997) Измененные гликолитические и окислительные способности скелетных мышц способствуют инсулинорезистентности при NIDDM. J Appl Physiol 83: 166–171.
- 36. Simoneau JA, Colberg SR, Thaete FL, Kelley DE (1995) Гликолитические и окислительные ферменты скелетных мышц являются определяющими факторами чувствительности к инсулину и состава мышц у женщин с ожирением. FASEB J 9: 273–278.
- 37. Сонг XM, Райдер JW, Кавано Y, Чибалин А.В., Крук А. и др.(1999) Специфичность мышечных волокон в передаче сигнала инсулина. Am J Physiol 277: R1690 – R1696.
- 38. Ван YX, Zhang CL, Yu RT, Cho HK, Nelson MC и др. (2004) Регулирование типа мышечных волокон и беговой выносливости с помощью PPARd. PLoS Biol 2: e294.
- 39. Wu H, Rothermel B, Kanatous S, Rosenberg P, Naya FJ (2001) Активация MEF2 мышечной активностью опосредуется кальциневрин-зависимым путем. EMBO J 20: 6414–6423.
- 40. Wu H, Kanatous SB, Thurmond FA, Gallardo T., Isotani E, et al.(2002) Регулирование митохондриального биогенеза в скелетных мышцах с помощью CaMK. Наука 296: 349–352.
Влияние на сократительные и метаболические свойства
PLoS Biol. 2004 Oct; 2 (10): e348.
Автор, ответственный за переписку. Авторские права: © 2004 Джулин Р. Зиерат и Джон А. Хоули.Это статья в открытом доступе, распространяемая в соответствии с условиями лицензии Creative Commons Attribution License, которая разрешает неограниченное использование, распространение и воспроизведение на любом носителе при условии надлежащего указания автора и источника.
Эта статья цитируется в других статьях в PMC.Скелетные мышцы демонстрируют замечательную пластичность, приспосабливаясь к множеству внешних раздражителей (Бут и Томасон, 1991; Чибалин и др., 2000; Хоули, 2002; Флюк и Хоппелер, 2003), включая привычный уровень сократительной активности (например, тренировки на выносливость), состояние нагрузки (например, тренировка с отягощениями), доступность субстрата (например, поступление макроэлементов) и преобладающие условия окружающей среды (например, термическое напряжение).Этот феномен пластичности характерен для всех позвоночных (Schiaffino and Reggiani 1996). Однако существует большая разница в степени приспособляемости между видами и между особями внутри вида. Такая вариабельность частично объясняет заметные различия в аспектах физической работоспособности, таких как выносливость или сила, между людьми, а также взаимосвязь между типом волокон скелетных мышц и некоторыми хроническими заболеваниями, включая ожирение и инсулинорезистентность.
У большинства млекопитающих скелетные мышцы составляют около 55% индивидуальной массы тела и играют жизненно важную роль в передвижении, выработке тепла в периоды холодового стресса и общем метаболизме (). Таким образом, знание молекулярных и клеточных событий, которые регулируют пластичность скелетных мышц, может определить потенциал для адаптации в работе и метаболизме, а также привести к открытию новых генов и путей в общих клинических болезненных состояниях.
Анатомия скелетной мышцыОтдельные пучки мышечных волокон называются пучками.Клеточная мембрана, окружающая мышечную клетку, — это сарколемма, а под сарколеммой находится саркоплазма, которая содержит клеточные белки, органеллы и миофибриллы. Миофибриллы состоят из двух основных типов белковых нитей: более тонкой актиновой нити и более толстой миозиновой нити. Расположение этих двух белковых нитей придает скелетным мышцам полосатый вид.
Как классифицируется тип волокна скелетных мышц?
Большая часть нашего раннего понимания пластичности скелетных мышц была получена из исследований, проведенных физиологами, занимающимися физическими упражнениями (например,г., Холлоши 1967). С применением хирургических методов к физиологии упражнений в конце 1960-х (Bergstrom and Hultman, 1966) стало возможным получить образцы биопсии (~ 150 мг) скелетных мышц человека, а также с помощью гистологических и биохимических анализов, специфических морфологических, сократительных , и метаболические свойства. В 1873 году французский анатом Луи Антуан Ранвье уже заметил, что некоторые мышцы кролика были более красного цвета и сокращались медленнее и устойчивее, чем более светлые мышцы того же животного.Эти ранние наблюдения легли в основу классической терминологии красных и белых мышечных волокон, которая, как впоследствии выяснилось, связана с содержанием миоглобина (железосодержащий белок, транспортирующий кислород в красных кровяных тельцах) (Needham 1926). Основываясь на гистохимическом окрашивании (Engel 1962), мышечные волокна в настоящее время обычно различают на медленные (ST), которые окрашиваются в темный или красный цвет, и на быстро сокращающиеся (FT), которые окрашиваются в светлые или бледные цвета. У людей производят дополнительное подразделение волокон FT (Brooke and Kasier, 1970), при этом более аэробное (или окислительное) волокно FT обозначается FT a , а более анаэробное (гликолитическое) волокно обозначается FT b . .В аэробных условиях (достаточное поступление кислорода к работающим мышцам) энергия вырабатывается без производства лактата. В анаэробных условиях (недостаточное поступление кислорода к работающим мышцам) энергия вырабатывается через гликолитический путь, что приводит к накоплению лактата и, в свою очередь, ограничивает анаэробные упражнения. Таким образом, мышечные волокна можно классифицировать по сократительным и метаболическим свойствам ().
Таблица 1
Сократительные характеристики, отдельные ферментные активности, морфологические и метаболические свойства типов волокон скелетных мышц человека
Все люди обладают разной способностью выполнять аэробные или анаэробные упражнения, частично в зависимости от состава их мышечных волокон.У нетренированных людей доля ST-волокон в мышце broadus lateralis (самая большая из четырехглавой мышцы и наиболее часто исследуемая мышца у людей) обычно составляет около 55%, причем волокна FT и встречаются в два раза чаще, чем FT b волокон (Салтин и др., 1977). Хотя заметные различия в метаболических потенциалах между волокнами FT a и FT b наблюдаются у нетренированных людей, абсолютный уровень активности окислительных и гликолитических ферментов во всех типах волокон достаточно велик, чтобы обеспечить существенный аэробный и анаэробный метаболизм ( Saltin et al.1977). В то время как отдельные скелетные мышцы грызунов в значительной степени однородны (Delp and Duan 1996), это не относится к людям (Saltin et al. 1977). Резкая неоднородность состава волокон у разных людей может объяснить их поразительные различия в выполнении упражнений.
Влияет ли тип мышечных волокон на спортивные результаты?
В 1970-х и 1980-х годах было популярно определять состав мышечных волокон спортсменов, участвующих в различных спортивных мероприятиях.Эти исследования показали, что у успешных спортсменов на выносливость в тренированной мускулатуре относительно больше ST, чем FT-волокон (Костилл и др., 1976; Финк и др., 1977; Салтин и др., 1977). Напротив, у спринтеров есть мышцы, которые состоят преимущественно из волокон FT (Costill et al. 1976). Соответственно, завоевало доверие мнение о том, что тип мышечных волокон может предсказать успехи в спорте. В частности, было предложено представление о том, что доля ST-волокон может быть фактором, определяющим успех в соревнованиях на выносливость (Gollnick et al.1972; Costill et al. 1976).
В этом отношении результаты Fink et al. (1977) важны. Эти исследователи определили состав волокон из икроножной мышцы (мышцы голени) 14 элитных бегунов на длинные дистанции мужского пола, 18 хороших (но не мирового класса) бегунов на длинные дистанции мужского пола и 19 нетренированных мужчин. В элитную группу вошли олимпийские медалисты () и американские рекордсмены того времени. Мышцы элитных бегунов содержат большую долю ST-волокон, чем у хороших бегунов или нетренированных мужчин (79.0% ± 3,5% против 61,8% ± 2,9% против 57,7% ± 2,5% соответственно; p <0,05). Значения, обнаруженные для нескольких элитных бегунов, были самыми высокими для мышц человека (> 92% ST). Более того, волокна ST у элитных бегунов были на 29% больше, чем волокна FT ( p <0,05), а волокна ST и FT были больше у хороших бегунов, чем у нетренированных мужчин. Из-за заметной гипертрофии (увеличения объема) волокон ST у элитных бегунов площадь поперечного сечения, состоящая из этих волокон, была больше, чем у хороших бегунов или нетренированных участников (82.9% ± 3,1% против 62,1% ± 2,6% против 60,0% ± 2,7% соответственно; p <0,05). Когда данные от элитных и хороших бегунов были объединены, была отмечена положительная корреляция между долей волокон ST и лучшим временем выполнения 6 миль ( r = -0,62, p <0,05).
Микроскопическое изображение Gastrocnemius Скелетной мышцы марафонца мирового класса, Фрэнк Шортер (золотой медалист Олимпийских игр, 1972 год; серебряный призер Олимпийских игр, 1976 год)Темно окрашенные волокна имеют относительно низкую скорость сокращения и имеют ST.Эти волокна демонстрируют более высокую аэробную (окислительную) способность и более низкий анаэробный (гликолитический) потенциал, чем более светлые окрашенные волокна FT. Мышца Шортера содержит примерно 80% волокон ST. Воспроизведено с любезного разрешения Дэвида Л. Костилла и Уильяма Дж. Финка.
Однако один тип волокна не определял результаты профессиональных спортсменов. Например, у двух спортсменов с одинаковым лучшим временем на марафонской дистанции 42,2 км (примерно 2 часа 18 минут) было 50% мышечных волокон ST по сравнению с 98%.Последующая работа (Фостер и др., 1978) показала, что результативность бега на выносливость лучше связана с максимальным потреблением O 2 атлетом (VO 2max ; r = -0,84, -0,87 и -0,88 для 1-, 2). — и 6 миль соответственно). Действительно, хотя тип мышечных волокон спортсмена является важным морфологическим компонентом и связан с несколькими сократительными и метаболическими свойствами (см.), Другие физиологические факторы (например, VO 2max , максимальный сердечный выброс и скорость / мощность на пороге лактата) ) с большей вероятностью определяют верхние пределы выносливости (Coyle 1995; Hawley and Stepto 2001).
Способствуют ли изменения типа волокон скелетных мышц метаболическому заболеванию?
Тесная связь между типом мышечного волокна и соответствующими морфологическими, метаболическими и функциональными свойствами не ограничивается спортивными способностями. Чувствительность к инсулину также коррелирует с долей окислительных волокон ST (Lillioja et al. 1987). В частности, стимулируемый инсулином транспорт глюкозы больше в скелетных мышцах, обогащенных мышечными волокнами ST (Henriksen et al. 1990; Song et al.1999; Daugaard et al. 2000), тем самым прививая ST-мышцу для ускоренного усвоения глюкозы и метаболизма. Сдвиг в распределении волокон от ST к FT-волокнам приводит к изменению активности ключевых окислительных и гликолитических ферментов (Pette and Hofer 1980). Действительно, соотношение между гликолитической и окислительной активностями ферментов в скелетных мышцах инсулиннезависимых диабетиков или лиц с ожирением связано с инсулинорезистентностью (Simoneau et al. 1995; Simoneau and Kelley 1997). Точно так же со старением и отсутствием физической активности уменьшаются два других состояния, связанных с преобразованием типа волокон ST-toFT, окислительная способность и чувствительность к инсулину (Papa 1996).
Гены, определяющие фенотип скелетных мышц
Фенотип волокон скелетных мышц регулируется несколькими независимыми сигнальными путями (). К ним относятся пути, связанные с Ras / митоген-активируемой протеинкиназой (MAPK) (Murgia et al. 2000), кальциневрином (Chin et al. 1998; Naya et al. 2000), кальций / кальмодулин-зависимой протеинкиназой IV (Wu et al. al. 2002) и коактиватор 1 пролифератора пероксисом γ (PGC-1) (Lin et al. 2002). Сигнальный путь Ras / MAPK связывает двигательные нейроны и сигнальные системы, связывая возбуждение и регуляцию транскрипции, чтобы способствовать нервно-зависимой индукции медленной программы в регенерирующих мышцах (Murgia et al.2000). Кальциневрин, Ca 2+ / кальмодулин-активируемая фосфатаза, участвующая в спецификации типа волокна, зависящей от нервной активности, в скелетных мышцах, непосредственно контролирует состояние фосфорилирования фактора транскрипции NFAT, позволяя его транслокацию в ядро и приводя к активации мышечных белков медленного типа в сотрудничестве с белками фактора усиления миоцитов 2 (MEF2) и другими регуляторными белками (Chin et al. 1998; Serrano et al. 2001). Кальций-зависимая активность Ca 2+ / кальмодулин-киназы также повышается за счет медленной активности двигательных нейронов, возможно, потому, что она усиливает медленные реакции, генерируемые кальциневрином, стимулируя функции трансактиватора MEF2 и увеличивая окислительную способность за счет стимуляции биогенеза митохондрий (Wu et al. al.2002).
Включенные в упражнения сигнальные пути в скелетных мышцах, которые определяют специальные характеристики мышечных волокон ST и FTВызванные сокращением изменения внутриклеточного кальция или активных форм кислорода обеспечивают сигналы для различных путей, которые включают MAPK, кальциневрин и кальций / кальмодулин-зависимые протеинкиназа IV для активации факторов транскрипции, регулирующих экспрессию генов и активность ферментов в скелетных мышцах.
PGC1-α, коактиватор транскрипции ядерных рецепторов, важных для регуляции ряда митохондриальных генов, участвующих в окислительном метаболизме, напрямую взаимодействует с MEF2 для синергетической активации селективных генов ST в мышцах, а также служит мишенью для передачи сигналов кальциневрина (Lin et al. al.2002; Wu et al. 2001). Новые данные, представленные в этом выпуске PLoS Biology (Wang et al. 2004), показывают, что транскрипционный путь, опосредованный рецептором δ (PPARδ), активируемым пролифератором пероксисом, участвует в регуляции фенотипа волокон скелетных мышц. Мыши, несущие активированную форму PPARd, демонстрируют фенотип «выносливости» с координированным увеличением окислительных ферментов и митохондриального биогенеза и увеличенной долей ST волокон. Таким образом, посредством функциональной геномики кальциневрин, кальмодулин-зависимая киназа, PGC-1α и активированный PPARδ образуют основу сигнальной сети, которая контролирует трансформацию волокон скелетных мышц и метаболические профили, защищающие от инсулинорезистентности и ожирения.
Переход от аэробного к анаэробному метаболизму во время интенсивной работы требует быстрой активации нескольких систем для обеспечения постоянного снабжения АТФ работающими мышцами. К ним относятся переход с топлива на основе жиров на топливо на основе углеводов, перераспределение кровотока от неработающих к тренированным мышцам и удаление некоторых побочных продуктов анаэробного метаболизма, таких как углекислый газ и молочная кислота. Некоторые из этих ответов регулируются транскрипционным контролем гликолитического фенотипа FT.Напр., Перепрограммирование скелетных мышц из гликолитического фенотипа ST в гликолитический фенотип FT задействует комплекс Six1 / Eya1, состоящий из членов семейства белков Six (Grifone et al. 2004). Более того, индуцируемый гипоксией фактор-1α (HIF-1α) был идентифицирован как главный регулятор экспрессии генов, участвующих в основных гипоксических ответах, которые поддерживают уровни АТФ в клетках. В этом выпуске PLoS Biology (Mason et al. 2004) раскрывается ключевая роль HIF-1α в опосредовании индуцированных физической нагрузкой генных регуляторных реакций гликолитических ферментов.Удаление HIF-1α в скелетных мышцах было связано с увеличением активности ограничивающих скорость ферментов митохондрий, что указывает на то, что цикл лимонной кислоты и повышенное окисление жирных кислот могут компенсировать снижение потока через гликолитический путь у этих животных. Однако опосредованные гипоксией ответы HIF-1α также связаны с регуляцией митохондриальной дисфункции через образование избыточных активных форм кислорода в митохондриях.
Можете ли вы стать медлительным?
Учитывая, что Олимпийские игры 2004 года все еще свежи в наших умах, многие спросят: у кого есть все необходимое для преодоления дистанции? Такие спортсмены, как олимпийский чемпион Фрэнк Шортер, явно исключительны и представляют собой крайность фенотипа скелетных мышц человека.На самом деле, немногие из нас когда-либо могут надеяться пробежать марафон за время мирового уровня. Тем не менее, у среднего смертного может быть повод для некоторого оптимизма, поскольку тренировки на выносливость у здоровых людей приводят к специфическому для типа волокон увеличению содержания белка PGC-1 и PPAR-α в скелетных мышцах (Russell et al. 2003). . Более того, функциональная геномика поддерживает концепцию о том, что ремоделирование скелетных мышц до фенотипа ST посредством активированного кальциневрина или PPARδ может защитить от развития резистентности к инсулину, индуцированной диетой (Ryder et al.2003) и ожирение (Wang et al. 2004). Результаты этих исследований имеют клиническое значение, поскольку у инсулинорезистентных пожилых людей и потомков пациентов с сахарным диабетом 2 типа наблюдается митохондриальная дисфункция скелетных мышц (Petersen et al. 2003; Petersen et al. 2004). Очевидно, что необходимы дальнейшие трансляционные исследования на людях, чтобы проверить гипотезу о том, что увеличение доли окислительных мышечных волокон ST преодолеет митохондриальную дисфункцию и метаболические дефекты, связанные с инсулинорезистентными состояниями.
Сокращения
| FT | быстросокращающийся | |||
| FT a | аэробное FT-волокно | |||
| FT b | HIF39 HIF39 анаэробное | |||
| MAPK | митоген-активируемая протеинкиназа | |||
| MEF2 | фактор усиления миоцитов 2 | |||
| PGC-1 | PPoxisomepoliferatorпролифератор пероксизома 1 -активированный рецептор δ | |||
| ST | медленный | |||
| VO 2 max | максимальный O 2 поглощение |
Сноски
Джулин Р.Зиерат работает в отделении хирургических наук, отделении интегративной физиологии Каролинского института в Стокгольме, Швеция. Джон А. Хоули работает в группе по метаболизму упражнений Школы медицинских наук факультета естественных наук Университета RMIT в Бундура, Австралия.
Ссылки
- Bergstrom J, Hultman E. Синтез мышечного гликогена после упражнений: усиливающий фактор, локализованный в мышечных клетках человека. Природа. 1966; 210: 309–310. [PubMed] [Google Scholar]
- Booth FW, Thomason DB.Молекулярная и клеточная адаптация мышц в ответ на упражнения: перспективы различных моделей. Physiol Rev.1991; 71: 541–585. [PubMed] [Google Scholar]
- Brooke MH, Kasier KK. Три системы «миозин-АТФазы»: природа их pH-предрасположенности и сульфгидрильной зависимости. J Histochem Cytochem. 1970; 18: 670–672. [PubMed] [Google Scholar]
- Чибалин А.В., Ю. М., Райдер Дж. У., Сонг Х. М., Галуска Д. и др. Вызванные упражнениями изменения экспрессии и активности белков, участвующих в передаче сигнала инсулина в скелетных мышцах: дифференциальные эффекты на субстраты 1 и 2 рецепторов инсулина.Proc Natl Acad Sci U S. A. 2000; 97: 38–43. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Chin ER, Olson EN, Richardson JA, Yang Q, Humphries C, et al. Зависимый от кальциневрина путь транскрипции контролирует тип волокон скелетных мышц. Genes Dev. 1998; 12: 2499–2509. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Костилл Д.Л., Дэниэлс Дж., Эванс В., Финк В., Крахенбуль Г. Ферменты скелетных мышц и состав волокон у легкоатлетов мужского и женского пола. J Appl Physiol. 1976; 40: 149–154.[PubMed] [Google Scholar]
- Coyle EF. Интеграция физиологических факторов, определяющих выносливость. Exerc Sport Sci Rev. 1995; 23: 25–63. [PubMed] [Google Scholar]
- Даугард Дж. Р., Нильсен Дж. Н., Кристиансен С., Андерсен Дж. Л., Харгривз М., Рихтер Е. А.. Специфическая для типа волокна экспрессия GLUT4 в скелетных мышцах человека: влияние тренировок. Диабет. 2000; 49: 1092–1095. [PubMed] [Google Scholar]
- Delp MD, Duan CC. Состав и размер волокон типа I, IIA, IID / X и IIB и активность цитрат-синтазы в мышцах крысы.J Appl Physiol. 1996; 80: 261–270. [PubMed] [Google Scholar]
- Engel WK. Актуальность гисто- и цитохимических исследований скелетных мышц при исследовании нервно-мышечных заболеваний. Неврология. 1962; 12: 778–784. [PubMed] [Google Scholar]
- Финк В.Дж., Костилл Д.Л., Поллок М.Л. Субмаксимальная и максимальная работоспособность элитных бегунов на длинные дистанции. Часть II: Состав мышечных волокон и активность ферментов. Ann N Y Acad Sci. 1977; 301: 323–327. [PubMed] [Google Scholar]
- Флюк М., Хоппелер Х.Молекулярная основа пластичности скелетных мышц — от гена к форме и функции. Rev Physiol Biochem Pharmacol. 2003. 146: 159–216. [PubMed] [Google Scholar]
- Фостер К., Костилл Д.Л., Дэниэлс Дж. Т., Финк В. Дж.. Активность ферментов скелетных мышц, волокна в зависимости от состава дистанции и VO 2 максимальной беговой производительности. Eur J Appl Physiol Occup Physiol. 1978; 39: 73–80. [PubMed] [Google Scholar]
- Голлник П.Д., Армстронг Р.Б., Зауберт К.В., Пил К., Салтин Б. Активность ферментов и состав волокон в скелетных мышцах нетренированных и тренированных мужчин.J Appl Physiol. 1972; 33: 312–319. [PubMed] [Google Scholar]
- Grifone R, Laclef C, Spitz F, Lopez S, Demignon J, et al. Экспрессия Six1 и Eya1 может перепрограммировать взрослые мышцы из фенотипа с медленным сокращением в фенотип с быстрым сокращением. Mol Cell Biol. 2004; 24: 6253–6267. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Hawley JA. Адаптация скелетных мышц к длительным интенсивным тренировкам на выносливость. Clin Exp Pharmacol Physiol. 2002; 29: 218–222. [PubMed] [Google Scholar]
- Хоули Дж. А., Степто Н. К..Адаптация к тренировкам велосипедистов на выносливость: влияние на производительность. Sports Med. 2001; 31: 511–520. [PubMed] [Google Scholar]
- Хенриксен Э. Дж., Буре Р. Э., Родник К. Дж., Корани Л., Пермутт Массачусетс. Содержание белка-переносчика глюкозы и транспортная способность глюкозы в скелетных мышцах крыс. Am J Physiol. 1990; 259: E593 – E598. [PubMed] [Google Scholar]
- Holloszy JO. Биохимические адаптации в мышцах. Влияние упражнений на поглощение кислорода митохондриями и активность дыхательных ферментов в скелетных мышцах.J Biol Chem. 1967; 242: 2278–2282. [PubMed] [Google Scholar]
- Lillioja S, Young AA, Culter CL, Ivy JL, Abbott WG, et al. Плотность капилляров скелетных мышц и тип волокон являются возможными детерминантами инсулинорезистентности in vivo у человека. J Clin Invest. 1987. 80: 415–424. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Lin J, Wu H, Tarr PT, Zhang CY, Wu Z. Коактиватор транскрипции PGC-1 alpha управляет образованием медленно сокращающихся мышечных волокон. Природа. 2002; 418: 797–801. [PubMed] [Google Scholar]
- Мейсон С.Д., Хоулетт Р.А., Ким М.Дж., Олферт М., Хоган М.С. и др.Потеря HIF-1α скелетных мышц приводит к изменению выносливости при физической нагрузке. PLoS Biol. 2004; 2: e288. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Murgia M, Serrano A, Calabria E, Pallafacchina G, Lono T. Рас участвует в зависимой от нервной активности регуляции мышечных генов. Nat Cell Biol. 2000. 2: 142–147. [PubMed] [Google Scholar]
- Найя Ф. Дж., Мерсер Б., Шелтон Дж., Ричардсон Дж. А., Уильямс Р. С. и др. Стимуляция медленной экспрессии гена волокон скелетных мышц кальциневрином in vivo.J Biol Chem. 2000; 275: 4545–4548. [PubMed] [Google Scholar]
- Needham DM. Красно-белая мышца. Physiol Rev.1926; 6: 1-27. [Google Scholar]
- Папа С. Изменения окислительного фосфорилирования митохондрий в течение жизни. Молекулярные аспекты и физиопатологические последствия. Biochim Biophys Acta. 1996; 1276: 87–105. [PubMed] [Google Scholar]
- Петерсен К.Ф., Бефрой Д., Дюфур С., Дзиура Дж., Ариян С. и др. Дисфункция митохондрий у пожилых людей: возможная роль в инсулинорезистентности.Наука. 2003; 300: 1140–1142. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Petersen KF, Dufour S, Befroy D, Garcia R, Shulman GI. Нарушение митохондриальной активности у инсулинорезистентных потомков пациентов с диабетом 2 типа. N Engl J Med. 2004; 350: 664–671. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Pette D, Hofer HW. Концепция группы ферментов постоянной пропорции при выборе эталонных ферментов в метаболизме. Ciba Found Symp. 1980; 73: 231–244. [PubMed] [Google Scholar]
- Ранвье Л.Собственные структуры и разные структуры мускулов, румяна и бланки, шез ле ляпины и шез ле поднимает. CR Hebd Acad Sci (Париж) 1873; 77: 1030–1043. [Google Scholar]
- Russell AP, Feilchenfeldt J, Schreiber S, Praz M, Crettenand A, et al. Тренировка на выносливость у людей приводит к специфическому для типа волокна увеличению уровней рецептора-гамма-коактиватора-1, активируемого пролифератором пероксисом, и рецептора-альфа, активируемого пролифератором пероксисом, в скелетных мышцах. Диабет. 2003. 52: 2874–2881.[PubMed] [Google Scholar]
- Райдер Дж. У., Бассель-Дуби Р., Олсон Э. Н., Зиерат Дж. Р. Перепрограммирование скелетных мышц путем активации кальциневрина улучшает действие инсулина на метаболические пути. J Biol Chem. 2003; 278: 44298–44304. [PubMed] [Google Scholar]
- Салтин Б., Хенрикссон Дж., Найгаард Э., Андерсен П. Типы волокон и метаболические потенциалы скелетных мышц у людей, ведущих малоподвижный образ жизни, и бегунов на выносливость. Ann N Y Acad Sci. 1977; 301: 3–44. [PubMed] [Google Scholar]
- Серрано А., Мурджа М., Паллафаккина Г., Калабрия Е., Конильо П. и др.Кальциневрин контролирует зависящую от нервной активности спецификацию медленных волокон скелетных мышц, но не рост мышц. Proc Natl Acad Sci U S. A. 2001; 98: 13108–13113. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Simoneau JA, Kelley DE. Измененные гликолитические и окислительные способности скелетных мышц способствуют инсулинорезистентности при NIDDM. J Appl Physiol. 1997; 83: 166–171. [PubMed] [Google Scholar]
- Simoneau JA, Colberg SR, Thaete FL, Kelley DE. Гликолитическая и окислительная способность скелетных мышц являются определяющими факторами чувствительности к инсулину и состава мышц у женщин с ожирением.FASEB J. 1995; 9: 273–278. [PubMed] [Google Scholar]
- Song XM, Ryder JW, Kawano Y, Chibalin AV, Krook A, et al. Специфичность типа мышечных волокон в передаче сигнала инсулина. Am J Physiol. 1999; 277: R1690 – R1696. [PubMed] [Google Scholar]
- Ван YX, Zhang CL, Yu RT, Cho HK, Nelson MC, et al. Регулирование типа мышечных волокон и беговой выносливости с помощью PPARd. PLoS Biol. 2004; 2: e294. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Wu H, Rothermel B, Kanatous S, Rosenberg P, Naya FJ.Активация MEF2 мышечной активностью опосредуется кальциневрин-зависимым путем. EMBO J. 2001; 20: 6414–6423. [Бесплатная статья PMC] [PubMed] [Google Scholar]
- Wu H, Kanatous SB, Thurmond FA, Gallardo T., Isotani E, et al. Регуляция митохондриального биогенеза в скелетных мышцах с помощью CaMK. Наука. 2002. 296: 349–352. [PubMed] [Google Scholar]
Развитие мышц
Развитие мышцМышца
Мышечные клетки , как и нейроны, могут возбуждаться химически, электрически, механически для создания потенциала действия вдоль их клеточной мембраны.
В отличие от нейронов у них есть сократительный механизм, активируемый потенциалом действия и опосредованный сократительными белками , актином и миозином .
Мышца делится на 3 типа:
скелетная (как соматическая мускулатура)
сердечная (составляющая миокард)
гладкая (как внутренние органы)
Скелетная мышца состоит из отдельных мышечных волокон, многоядерных, длинных и цилиндрических по форме.
Мышечные волокна расположены параллельно между концами сухожилий, так что сила сокращения каждой отдельной единицы складывается.
Каждое волокно состоит из фибрилл , а они — из филаментов, организованных в саркомеров , состоящих из белков: миозина и актина (во время сокращения миозин и актин разрушают и реформируют сшивки), тропомиозин и тропонин (последние 2 «расслабляющих белка» образуют комплекс, который ингибирует взаимодействие миозина и актина)
Шаги сокращения
1) разряд мотонейрона на мионевральной пластинке (замыкательной пластине)2) высвобождение нейромедиатора ацетилхолина на замыкательной пластинке
3) связывание ацетилхолина с его рецепторами
4) повышенная проводимость Na + и K + в мембране замыкательной пластинки
5) образование потенциал действия на замыкательной пластинке
6) генерирование потенциала действия вдоль мышечных волокон
7) распространение потенциала вдоль мышечных волокон
8) высвобождение Са ++ из саркоплазматического ретикулума (внеклеточное пространство, окружающее мышечные волокна) и диффузия в толстые и тонкие волокна
9) связывание Са ++ в тропонин и тем самым раскрывает сайты связывания миозина на актине
10) образование перекрестных связей между актином и миозином и скольжение тонких волокон по толстым нитям, вызывая укорачивание мышц
Шаги в релаксации
1) Са ++ закачивается обратно в саркоплазматический ретикулум2) высвобождение Са ++ из тропонина
3) прекращение взаимодействия между актином и миозином
В скелетных мышцах есть как минимум 2 типа волокон:
ТИП 1, МЕДЛЕННЫЕ, КРАСНЫЕ МЫШЦЫ (e.грамм. длинные мышцы спины):
с длительным латентным периодом
адаптированы для медленных сокращений с поддержанием осанки и имеют средний диаметр
высокая окислительная способность
большое кровоснабжение
ТИП IIB, БЫСТРЫЕ, БЕЛЫЕ МЫШЦЫ (например, мышцы рук):
с короткой задержкой
адаптированы для тонких, умелых движений и имеют большой диаметр
низкая окислительная способность
меньше кровоснабжения
Мышца отличается от мезодермы
Первая мышечная активность, зарегистрированная у 8-недельного эмбриона
Узнаваемые сокращения, наблюдаемые через 16-18 недель плода, когда:
* нервные волокна к мышцам развиваются
* нервные волокна достигли контакта с мышечными клетками (мио -невральное соединение) и нейротрансмиссионный аппарат (ацетилхолин / холинэстераза) разработано
Эксперименты с перекрестной иннервацией:
* определенное вещество секретируется в нервных окончаниях, или
* набор нервных импульсов на мышечных волокнах действует, чтобы ограничить скорость сокращения
Скелетно-мышечное (M-S) развитие в подростковом возрасте
Разработка MS включает несколько систем:
Мышцы : размер, сила, метаболизм, мощность
ЦНС : координация двигательной активности, произвольная, автономная, мотивация, усталость
Дыхание : обеспечивает O2, удаляет CO2
Циркуляция : циркулирует O2, питательные вещества
Регулирование температуры : во время упражнений выработка тепла X20 выше, чем в состоянии покоя
Стресс : кортикоиды
Гормоны : инсулин, GH, IGF-I, T3, кальцитонин, ПТГ, андрогены, эстрогены
Число мышечных волокон при рождении практически не меняется. От 75 до более 1000)
Способность к пластичности и регенерации в ответ на нервные, гормональные и пищевые воздействия
Развитие мышечных клеток
Читатель, стр 287-293
С ранним развитием:
мезодермальное происхождение:
* миобласты (без различимых признаков)
* 4-й месяц, миотубулы (миофибриллы, некоторая двигательная активность)
* увеличение миозина, актина, каналов Са ++
С дальнейшим развитием:
* 1-7 лет, медленный рост
* 8-17 лет, ускоренный рост
* 18-25 лет, медленный рост
* увеличение количества миофибрилл
* увеличение количества ядер
* гиперплазия, гипертрофия
* без встроенного ограничения по времени на потенциал толщины / силы (повышенные физические нагрузки, гимнастика)
При рождении все мышцы конечностей имеют одинаковую скорость сокращения
После рождения скорость различается в быстрых и медленных мышцах в зависимости от иннервации, уровня / активности ACh, AChE, повышения электролитов, метаболических изменений
Развитие мионеврального соединения (MJ)
* Количество MJ увеличивается с развитием
* повышенный уровень ацетилхолина (ACh)
* рецепторов
Перед рождением чувствительность Ach распространяется по всей длине мышцы;
После рождения локализуется у MJ.
Выходная мощность = скорость выполнения работы
Работа: перемещение силы на расстояние
Сокращение может быть:
изометрическим: мышца не укорачивается, но создает силу
изотоническая: сила остается постоянной, но мышца укорачивается
Сократительные свойства отдельных мышечных волокон у женщин, которые занимаются аэробикой на протяжении всей жизни.
Число женщин, занимающихся физическими упражнениями, растет, поскольку поколение «спортивного бума» приближается к восьмому десятилетию жизни.Под влиянием законодательства Раздела IX в 1972 году и женщин-первопроходцев, включая Роберту Гиббс, Кэтрин Свитцер и Джоан Бенуа Самуэльсон, культурные сдвиги привели к увеличению числа женщин, которые сделали физические упражнения своей привычкой на всю жизнь. В поддержку этого культурного сдвига число женщин, участвующих в соревнованиях по бегу, теперь превышает число мужчин (4). Наряду с ростом числа женщин, занимающихся физическими упражнениями на протяжении всей жизни, все более впечатляющие результаты демонстрируются как в легкой атлетике, так и в плавании (2, 30, 50). Тем не менее, мало исследований было проведено в отношении этой новой когорты женщин, которые в течение своей жизни занимались рекреационными и более ориентированными на результат режимами упражнений, чтобы получить представление об их физиологических особенностях, особенно на миоклеточном уровне.
Старение приводит к общему снижению физиологической функции, при этом привычные упражнения показывают положительное влияние на замедление различных аспектов процесса старения (50). Недавно мы сообщили, что у тех, кто занимается аэробикой на протяжении всей жизни (возраст> 70 лет), наблюдается существенное улучшение состояния сердечно-сосудистой системы [максимальное потребление кислорода (V̇o 2max )] и метаболической подготовки скелетных мышц (плотность капилляров и аэробные ферменты) (20). В настоящем отчете представлен комплексный профиль размеров одномышечных волокон и сократительной функции (сила, скорость и мощность) той же группы женщин, которые занимались аэробными упражнениями почти 50 лет.Это особенно важно, учитывая, что старение приводит к потере мышечной массы и функции, что более выражено в быстро сокращающихся мышечных волокнах [тяжелая цепь миозина (MHC) IIa] (5, 31). Поскольку мышечные волокна MHC IIa в четыре-шесть раз мощнее медленных (MHC I) мышечных волокон, возрастная потеря функции волокон MHC IIa имеет решающее значение для работоспособности всей мышцы (8, 38, 43, 58). На сегодняшний день влияние различных парадигм краткосрочных упражнений на улучшение функции и профиля здоровья быстро сокращающихся мышечных волокон у пожилых людей (> 70 лет) неоднозначно (24, 25, 43, 45, 46, 56, 60).Ограниченные данные, полученные от тех, кто занимается спортом на протяжении всей жизни, и спортсменов категории Masters (стареющих спортсменов, которые не обязательно тренировались на протяжении всей своей жизни), как правило, подтверждают идею о том, что есть некоторая польза для быстро сокращающихся мышечных волокон, хотя эти исследования, как правило, проводились на мужчинах моложе 70 лет. (14, 15, 29, 42, 61, 68). Рабочая гипотеза заключалась в том, что аэробные упражнения на протяжении всей жизни будут эффективным средством противодействия (по крайней мере частично) здоровью быстро сокращающихся волокон и улучшат их свойства из-за их набора во время упражнений на протяжении всей жизни.Насколько нам известно, это первое исследование, которое дает представление о сократительной функции отдельных мышечных волокон у женщин, которые на протяжении всей жизни тренируются.
Субъекты
Люди, занимающиеся физическими упражнениями на протяжении всей жизни (LLE; n = 7), пожилые здоровые люди, не занимавшиеся спортом (OH; n = 10), и молодые люди, занимающиеся физическими упражнениями (YE; n = 10), были включены в это исследование. (Таблица 1). Испытуемые набирались из района Большого Манси, штат Индиана, с рекламными объявлениями в газетах, рассылаемыми по почте листовками и личным общением.Перед участием все субъекты прошли обширное медицинское обследование, которое включало историю болезни, образцы крови на общие маркеры здоровья, электрокардиограмму в состоянии покоя и при физической нагрузке, а также измерение артериального давления. Субъекты не имели острых или хронических заболеваний (сердечные, легочные, печеночные или почечные аномалии, рак, неконтролируемая гипертензия, инсулинозависимый или инсулинозависимый диабет или другие известные метаболические нарушения) и не имели ортопедических ограничений (включая любые искусственные суставов) и не курили и не участвовали в других формах употребления табака.Участники выполнили тесты с максимальной нагрузкой для оценки V̇o 2max (20), а также измерения размера и функции всей мышцы. Исследование было одобрено институциональным наблюдательным советом Государственного университета Болла. Все процедуры исследования, риски и преимущества были объяснены субъектам до того, как они дали письменное информированное согласие на участие.
| Молодые люди, занимающиеся спортом ( n = 10) | Здоровые упражнения на всю жизнь ( n = 7) | = 10) | ||||
|---|---|---|---|---|---|---|
| Возраст, лет | 25 ± 1 | 72 ± 2 | 75 ± 1 | |||
| Рост, см | 167 ± 2 | 164 ± 2 | 8 157 | |||
| Масса, кг | 60 ± 2 | 61 ± 4 | 65 ± 1 | |||
| ИМТ, кг / м 2 | 21 ± 1 | 23 ± 1 | 27 ± 1 * | |||
| Телесный жир,% | 23 ± 1 * | 30 ± 2 † | 41 ± 2 | |||
| V̇o 2max , мл · кг −1 · min −1 | 44 ± 2 * | 26 ± 2 † | 18 ± 1 | |||
| 59 ± 2 * | 42 ± 2 | 40 ± 1 | ||||
| Сила четырехглавой мышцы, Нм | 138 ± 10 † | 105 ± 9 | 82 ± 4 | 82 ± 4 | ||
| Квадрицепс 1ПМ, кг | 80 ± 6 * | 54 ± 4 | 42 ± 2 | |||
| Мощность квадрицепса, Вт | 404 ± 38 * | 221 ± 20 | 146401 | Шагов в день11,518 ± 1,404 * | 7,463 ± 683 | 6,801 ± 823 |
История упражнений субъектов LLE была проанализирована на предмет частоты, продолжительности, интенсивности и спортивных достижений (20).Субъектами группы LLE были аэробные упражнения (в основном бегуны и велосипедисты), которые в прошлом участвовали в структурированных упражнениях в среднем 5 ± 1 дней в неделю в течение 7 ± 1 часов в неделю в течение 48 ± 2 лет (Таблица 2). В группу LLE были включены несколько человек, которые продолжают соревноваться в местных, региональных и национальных гонках, в том числе один субъект, который проехал на велосипеде ~ 4000 миль за год до тестирования, и легкоатлет национального уровня в категории Masters. Хотя субъекты контроля OH не участвовали в каких-либо структурированных физических упражнениях, участие в досуге (например,g., гольф, неспешные прогулки и общественные работы) не были основанием для исключения. YE состояла из активных людей, которые тренировались 4–6 дней в неделю в течение ~ 7 часов в неделю.
| Молодые люди, занимающиеся спортом ( n = 10) | Практикующие всю жизнь ( n = 750 Старые 9075) = 10) | |||||
|---|---|---|---|---|---|---|
| Общее количество лет обучения | 5 ± 1 | 48 ± 2 | — | |||
| Среднее время жизни | ||||||
| Частота, дней / нед. .6 ± 0,3 | — | |||||
| Продолжительность, ч / нед | — | 6,6 ± 0,6 | — | |||
| Интенсивность * | — | 1,9 ± 0,1 | — | |||
| Частота, дней / нед | 5,4 ± 0,5 | 4,7 ± 0,4 | — | |||
| Продолжительность, ч / нед | 7,3 ± 1,1 | 6,8 ± 1,0 | —||||
| — | ||||||
| 2.6 ± 0,1 | 2,1 ± 0,2 | — |
Функция и размер всей мышцы
Для оценки силы и мощности четырехглавой мышцы среди YE, LLE и OH во всех трех группах были выполнены изометрические и динамические тесты сократительной функции. . Оценка мышечной функции была распределена на три посещения с интервалом не менее 48 часов. Субъекты были ознакомлены со всеми процедурами тестирования во время первого посещения. Магнитно-резонансная томография (МРТ) использовалась для анализа площади поперечного сечения четырехглавой мышцы (CSA) во всех трех когортах.
Изометрическая прочность.
Максимальная изометрическая сила четырехглавой мышцы была определена при разгибании колена 90 ° на специально изготовленном ребристом кресле со специальной манжетой для ног, прикрепленной к датчику нагрузки (Omegadyne, Sundbury, OH), подключенному к компьютерному программному обеспечению (LabVIEW) для рекордная сила (12, 27). Испытуемых удерживали в кресле, чтобы изолировать вклад четырехглавой мышцы в измерение. Всего для левой и правой ноги было выполнено три максимальных повторения, разделенных периодами отдыха.Наивысшее наблюдаемое значение считалось максимальной изометрической силой.
1РМ.
Максимальная изотоническая сила [максимум 1 повторения (1ПМ)] четырехглавой мышцы (двусторонняя) была определена на стандартном устройстве для разгибания ног (модель 4107; Cybex Eagle, Медуэй, Массачусетс), оснащенном датчиком положения настраиваемого диапазона, который обеспечивает звуковое подтверждение успешного повторения (43, 64). После 10-минутной разминки на велоэргометре (Monark Ergomedic 828 E; Vansbro, Швеция; 25–50 Вт) испытуемые выполнили два подхода по пять повторений с низкой нагрузкой (~ 40% от 1ПМ).За этим последовали отдельные попытки поднять все более тяжелый вес, начиная с нагрузки, оцениваемой в 70–80% от 1ПМ. Попытки были разделены 2-минутным периодом отдыха, и подход был разработан для определения 1ПМ за две-четыре попытки. Самым тяжелым весом, который был успешно поднят, считался 1ПМ.
Мощность.
Двусторонняя сила четырехглавой мышцы измерялась на стандартном устройстве для разгибания ног (модель 4107; Cybex Eagle, Медуэй, Массачусетс), оборудованном тензодатчиком в полумостовой конфигурации, мостовым датчиком (Omega Engineering, Стэмфорд, Коннектикут) для определения крутящего момента. производится на опоре устройства, и потенциометр (Vishay Americas, Онтарио, Калифорния) для регистрации углового смещения, все они связаны с программным обеспечением LabVIEW для определения выходной мощности.Мощность была определена на уровне 40% от 1ПМ каждого испытуемого, что, как показано, вызывает почти максимальную выходную мощность (27, 52, 55). Три повторения были выполнены на максимальном уровне, и наибольшее наблюдаемое значение считалось пиковой мощностью.
МРТ.
После 1 часа отдыха на спине для контроля влияния сдвигов жидкости, связанных с осанкой, на размер мышц (9), МРТ четырехглавой мышцы была получена с использованием неметаллического фиксатора стопы для контроля угла сустава (длины мышцы) и угла сканирования и чтобы свести к минимуму компрессию ноги, как мы описали ранее (63–65).Все сканирования были выполнены утром, и в день сканирования не разрешалось никаких физических упражнений или физических нагрузок. Визуализацию проводили на 1,5-Тл сканере (Siemens, Мюнхен, Германия) с последовательными чередующимися изображениями толщиной 8 мм (TR: 2000 мс; TE: 8 мс; матрица 512 × 512; поле зрения: 480 × 480 мм).
Четырехглавая мышца CSA.
МРТ-изображения были переданы электронным способом со сканера на персональный компьютер (iMac) в лаборатории Human Performance Laboratory и проанализированы с помощью программного обеспечения NIH image Software (ImageJ, версия 1.49). ППС четырехглавой мышцы (см 2 ) определяли с помощью ручной планиметрии, и подробное описание этих измерений было представлено в наших исследованиях старения и постельного режима (63, 64). Четырехглавая мышца правой ноги каждого испытуемого использовалась для определения CSA, которую оценивал тот же исследователь.
Биопсия мышц
Поскольку физическая активность, диета и время суток могут влиять на различные аспекты физиологии скелетных мышц, перед биопсией мышц были внедрены стандартизованные условия.Испытуемых просили воздерживаться от структурированных упражнений и физической активности за пределами нормальной повседневной жизни в течение 72 часов до биопсии мышц. Субъекты ели свой обычный ужин, и им было сказано не принимать никакой дополнительной пищи или калорийных напитков до прибытия в лабораторию на следующее утро (~ 6:30 утра). Оказавшись в лаборатории, пациенты спокойно отдыхали в положении лежа на спине в течение 30 минут перед тем, как пройти биопсию латеральной широкой мышцы бедра в состоянии покоя (6, 64). Образцы мышц были обработаны и разделены на продольные пучки.Часть мышцы, которая использовалась для физиологии одиночных мышечных волокон, помещали в холодный раствор для снятия шкур и хранили при -20 ° C для последующего анализа. Часть мышцы, которая будет использоваться для типа волокна, сразу же хранилась в 0,5 мл РНК , позже (Ambion, Остин, Техас) при 4 ° C в течение 24-часового инкубационного периода, а затем переносилась при -20 ° C до анализа. .
Растворы для снятия шкур, расслабления и активации
Раствор для снятия шкур содержал (в мМ) 125,0 K пропионата, 2,0 EGTA, 4.0 АТФ, 1,0 MgCl 2 и 20,0 имидазола (pH 7,0) с 50% (об. / Об.) Глицерина. Состав расслабляющих и активирующих растворов рассчитывали с помощью интерактивной компьютерной программы, описанной Фабиато и Фабиато (17). Растворы были скорректированы по температуре, pH и ионной силе с использованием констант устойчивости в расчетах (19). Каждый раствор содержал (в мМ) 7,0 EGTA, 20,0 имидазола, 14,5 креатинфосфата, 1,0 свободного Mg 2+ , 4,0 свободного MgATP, KCl и KOH для получения ионной силы 180 мМ и pH 7.0. Расслабляющий и активирующий растворы имели концентрацию свободного Ca 2+ ([Ca 2+ ]), равную pCa 9,0 и pCa 4,5, соответственно (pCa = −log [Ca 2+ ]).
Процедура эксперимента с одним мышечным волокном
В день эксперимента сегмент мышечного волокна размером от 2,5 до 3,0 мм случайным образом выделяли из мышечного пучка и переносили в экспериментальную камеру, заполненную расслабляющим раствором. Концы волокна были надежно закреплены между датчиком силы (модель 400A; Cambridge Technology, Watertown, MA) и моментным двигателем постоянного тока (модель 308B; Cambridge Technology), как описано Moss (39).Датчик силы и моментный двигатель калибровались перед каждым экспериментом. Аппаратура была устроена так, чтобы мышечное волокно можно было быстро перемещать туда и обратно между экспериментальными камерами, заполненными расслабляющим или активирующим раствором. Аппарат был установлен на микроскопе для просмотра волокна (× 800) во время эксперимента. С помощью окулярного микрометра длина саркомера вдоль изолированного мышечного волокна была доведена до 2,5 мкм (60). Все эксперименты с одним волокном проводились при 15 ° C.
Неусиленные сигналы силы и длины были отправлены на цифровой осциллограф (310; Николет, Мэдисон, Висконсин), что позволило контролировать работу мышечных волокон на протяжении всего сбора данных.Аналоговые сигналы силы и положения были усилены (Dual Differential Amplifier, 300-DIF2; Positron Development, Inglewood, CA), преобразованы в цифровые сигналы (National Instruments, Austin, TX) и переданы в компьютер (Micron Electronics, Nampa, ID). для анализа с использованием специализированного программного обеспечения. Плечо серводвигателя и зажимы изотонической силы контролировались с помощью контроллера силы-положения с компьютерным интерфейсом (Force Controller, 300-FC1; Positron Development, Inglewood, CA).
Для каждого эксперимента с одним мышечным волокном волокно с податливостью [рассчитано как длина волокна (FL), деленная на интервал y , полученный из оценки скорости укорочения без нагрузки]> 10% и / или уменьшение при пиковой силе> 10% был отброшен и не использовался для анализа.Изменчивость внутриклеточного теста / повторного тестирования одного мышечного волокна в нашей лаборатории для измерений размера, соотношения силы и скорости, силы и скорости сокращения составляла <1%. Коэффициенты вариации для датчика силы, рычага двигателя и камеры в течение ~ 4-летнего периода времени этого исследования были <1%. После завершения экспериментов по физиологии одиночных мышечных волокон каждое волокно солюбилизировали в 80 мкл 1% буфера для образцов SDS и хранили при -20 ° C до анализа на тип волокна MHC.
Физиологические эксперименты с одним мышечным волокном
), зависимости силы от скорости и мощности, а также типа волокна. Экспериментальные процедуры были идентичны тем, которые использовались ранее в наших исследованиях на людях (55, 60). Все измерения размеров и сократимости проводились одним и тем же исследователем в течение 4-недельного периода с момента получения биопсии, чтобы гарантировать жизнеспособность тканей и надежность данных.Размер одномышечного волокна.
Видеокамера (CCD-IRIS, DXC-107A; Sony, Япония), подключенная к микроскопу и компьютерному интерфейсу, позволяла просматривать и хранить цифровые изображения однокорпусных волокон. Диаметр волокна определяли в трех точках по длине сегмента из изображения, полученного с помощью общедоступного программного обеспечения NIH (Scion Image, версия Beta 4.0.2, для Windows), при этом волокно ненадолго подвешивалось в воздухе (<5 с). Для переменных, зависящих от размера волокна (т. Е. Удельного натяжения и нормированной мощности), CSA была определена с предположением, что волокно имеет цилиндрическую форму во время подвешивания в воздухе (36).
Одномышечное волокно P
o .Выходы датчиков силы и положения были усилены и отправлены на микрокомпьютер через 16-битную плату сбора данных Lab-PC + (National Instruments, Остин, Техас). Отслеживали силу покоя, после чего волокно максимально активировали в активирующем растворе. P o определяли в каждом волокне путем компьютерного вычитания базовой силы из максимальной силы в растворе pCa 4.5. Затем максимальную силу нормировали на CSA для определения удельного натяжения.
Одномышечное волокно V
o .V o измеряли методом испытания на провисание, как описано Эдманом (16). При полной активации применялся этап укорачивания, и волокно удерживалось на укороченной длине до тех пор, пока не было обнаружено восстановление силы. Компьютерный анализ определил продолжительность укорочения без нагрузки или время между появлением слабины и восстановлением силы. Четыре различных шага активации и длины [150, 200, 250 и 300 мкм; ≤15% длины волокна (FL)] использовались для каждого волокна, причем расстояние провисания было нанесено как функция продолжительности V o .Вертикальное пересечение (пересечение y ) определялось от того места, где результирующая зависимость времени от расстояния пересекала ось y . V o (FL / s) вычисляли путем деления наклона подобранной линии на длину сегмента волокна (данные были нормализованы к длине саркомера 2,5 мкм). Наклон этой линии определяет скорость укорочения волокна без нагрузки ( V o ).
Сила одномышечных волокон.
Зажимы субмаксимальной изотонической нагрузки были выполнены на каждом волокне для определения силово-скоростных параметров и мощности.Каждый сегмент волокна был полностью активирован в активирующем растворе и подвергся серии из трех этапов изотонической нагрузки. Эту процедуру выполняли при различных нагрузках, так что каждое волокно претерпело в общей сложности 15–18 изотонических сокращений.
Для результирующих соотношений силы и скорости нагрузка была выражена как P / P o (P = сила во время зажима нагрузки, P o = пиковая изометрическая сила, развиваемая перед зажимом субмаксимальной нагрузки). Точки данных по силе и скорости укорачивания были получены из изотонических сокращений и аппроксимированы гиперболическим уравнением Хилла (28).Для анализа были включены только отдельные эксперименты, в которых R 2 ≥ 0,98.
Пиковая мощность волокна была рассчитана на основе подобранных параметров сила-скорость [P o и максимальная скорость укорачивания ( V max )]. Абсолютная мощность (мкН · FL / с) определялась как произведение силы (мкН) и скорости сокращения (FL / s). Нормализованная мощность (Вт на литр, Вт / л) была приведена к объему волокна и определена как произведение удельного натяжения и скорости укорачивания.
Анализ типа волокна
После измерения сократимости отдельных волокон профиль изоформы MHC был проанализирован для каждого сегмента волокна с помощью SDS-PAGE. Анализ типов волокон был дополнен извлечением дополнительных волокон (~ 360 волокон / субъект) из РНК , позже для определения MHC (YE = 8, LLE = 7, OH = 9). Вкратце, образцы обрабатывали в течение ночи при 4 ° C на установке для гель-электрофореза Hoefer SE 600 (Сан-Франциско, Калифорния), используя 3,5% (мас. / Об.) Акриламидный укладывающий гель с 5.0% разделяющий гель (69). После электрофореза гели окрашивали серебром, как описано Giulian et al. (18). Изоформы MHC (I, I / IIa, IIa, IIa / IIx, IIx, I / IIa / IIx) каждого отдельного мышечного волокна были идентифицированы в соответствии со скоростью миграции, как описано ранее (69).
Статистический анализ
Статистический анализ проводился с помощью программного обеспечения статистического анализа (SAS; версия 9.3; Кэри, Северная Каролина), и статистические тесты, дающие P значений ≤ 0,05, считались статистически значимыми.Двусторонний вложенный дисперсионный анализ был использован для сравнения интересующих переменных одиночных мышечных волокон (CSA, P o , P o / CSA, V o , V max , абсолютная и нормализованная мощность ) от мышечных волокон MHC I и IIa среди участников YE, LLE и OH, с апостериорным тестом Тьюки для множественных сравнений. Для каждого параметра одиночного мышечного волокна у субъекта определяли среднее значение для каждого типа волокна. Среднее значение затем использовалось для представления всех волокон этого типа для данного человека и взвешивалось в зависимости от количества волокон, изученных для каждого человека, для расчета группового (YE, LLE и OH) среднего значения, которое представлено в результатах.Из-за небольшого количества гибридов (т.е. волокон, экспрессирующих несколько изоформ MHC) и мышечных волокон чистого MHC IIx, анализы были ограничены волокнами MHC I и IIa. Односторонний дисперсионный анализ ANOVA использовался для сравнения распределения типов мышечных волокон среди групп, а апостериорный тест Тьюки был проведен, когда была отмечена значимость. Все данные представлены как средние значения ± стандартная ошибка.
Женщинам, которые постоянно занимались физическими упражнениями в качестве образа жизни в результате культурных мероприятий, включая бум физических упражнений 1970-х годов и законодательство Раздела IX, сейчас> 70 лет.Это дало уникальную возможность оценить влияние старения и продолжительных физических упражнений путем сравнения сократительных свойств одиночных мышечных волокон у тех, кто занимался всю жизнь, с молодыми спортсменами и людьми, не занимающимися спортом по возрасту. Насколько нам известно, это первое исследование по оценке сократительных свойств одиночных мышечных волокон у женщин, постоянно занимающихся аэробикой. Основные результаты этого исследования заключались в том, что 1 ) упражнения на протяжении всей жизни не давали очевидного преимущества для волокон MHC I или IIa размера, 2 ) LLE увеличивал мощность волокна MHC I и сохранял мощность волокна MHC IIa, которая обычно снижается с старение (49, 55) и 3 ), адаптация миоклеточной мощности когорты LLE была обусловлена силой волокон MHC I и скоростью волокон MHC IIa (рис.4). Сократительные свойства одиночных мышечных волокон, наблюдаемые при продолжительных аэробных упражнениях, уникальны и позволяют по-новому взглянуть на пластичность стареющих скелетных мышц у женщин на миоклеточном уровне.
Рис. 4. Разница в процентах функции одномышечных волокон у тех, кто занимается спортом на протяжении всей жизни (LLE), и у пожилых здоровых людей, не занимающихся спортом (OH), по сравнению с молодыми спортсменами (YE). MHC, тяжелая цепь миозина. * P <0,05 по сравнению с другими группами; ‡ P <0,05 по сравнению с YE; † P = 0.056 против YE.
Из новаторской работы Лекселла в 1980-х годах до настоящего исследования четко установлено, что старение в первую очередь нацелено на волокна MHC IIa, что приводит к уменьшению размера, прочности и мощности (11, 31, 40, 49, 55). Эта связанная с возрастом потеря мощности волокон MHC IIa имеет значительные последствия для всей мышечной функции, поскольку волокна MHC IIa лучше всего подходят для взрывных задач и производят в четыре-шесть раз больше энергии, чем волокна MHC I (55, 68). Настоящее исследование показывает, что аэробные упражнения на протяжении всей жизни, по-видимому, сохраняют силу волокон MHC IIa, поскольку те, кто занимался аэробикой на протяжении всей жизни, были похожи на молодых людей и на 16% (8 мкН · FL / с) сильнее, чем те, кто не тренировался по возрасту.Предыдущие исследования, посвященные высокоинтенсивным тренировкам, таким как упражнения с отягощениями, показали, что они увеличивают мощность волокон MHC IIa на 20–60% у молодых и пожилых людей (44, 56, 60, 66). Аналогичным образом, аэробные упражнения также увеличивают мощность волокон MHC IIa после программы сужения (снижение тренировочной нагрузки) у пловцов (53) и бегунов (32, 57). Кроме того, 12 недель умеренных и интенсивных циклических тренировок у пожилых мужчин также привели к увеличению выходной мощности волокон MHC IIa (25). Вместе эти данные подтверждают идею о том, что различные парадигмы упражнений улучшают мощность волокон MHC IIa, и настоящее исследование расширяет эти данные, чтобы указать, что 50-летние последовательные аэробные упражнения полезны для мощности волокон MHC IIa и предотвращают типичное снижение, которое наблюдается с возрастом. .
Сохранение силы волокон MHC IIa в LLE, по-видимому, обусловлено повышенной скоростью сокращения, так как волокна MHC IIa когорты LLE были аналогичны по размеру и силе в когорте OH. Эта комбинация увеличения скорости и уменьшения размера / силы, по-видимому, является механизмом ремоделирования в результате продолжающихся на протяжении всей жизни аэробных упражнений. Интересно, что лучшие спортсмены в когорте LLE [~ 4000 миль / год велосипедисты и бегуны национального уровня; оба показали наивысшую метаболическую пригодность скелетных мышц в когорте LLE (20)] были самыми быстрыми ( V o = 3.95 и 4,15 FL / s) и наименьшее (CSA = 2460 и 2700 мкм) волокна MHC IIa у тех, кто занимается спортом на протяжении всей жизни. Кроме того, их нормализованные значения мощности (21,1 и 21,0 Вт / л) также были самыми высокими в когорте LLE, предполагая, что выполнение упражнений на высоком уровне в течение всей жизни может уменьшить размер волокна MHC IIa, одновременно увеличивая скорость, чтобы в конечном итоге сохранить мощность. Более высокая скорость сокращения не совсем удивительна, поскольку ее можно изменять с помощью различных режимов упражнений (41, 53, 60, 68), но в контексте того, что она компенсирует уменьшение размера волокон и силы с возрастом для сохранения силы волокон, новая находка.Хотя механизм этого миоклеточного ремоделирования не совсем понятен, изменения в конкретных белках (т. Е. В составе, количестве, посттрансляционных модификациях), кинетике кальция и плотности упаковки клетки являются правдоподобными гипотезами (7, 10, 48). В целом, миоклеточное ремоделирование, вероятно, отражает баланс между размером волокон, сократительной способностью и метаболическими потребностями, который возник в результате ~ 50 лет постоянных аэробных упражнений.
Упражнения на протяжении всей жизни также были полезны для питания волокон MHC I, поскольку когорта LLE была на 17% более мощной, чем когорта YE.Наряду с тренировкой с отягощениями (44, 56, 60, 66), аэробные упражнения у относительно нетренированных людей могут увеличить мощность волокон MHC I от икроножной мышцы посредством марафонской тренировки (57) и большой мышцы бедра через циклическую тренировку (24, 25). Интересно, что у студенческих бегунов, которые находятся в фазе базовой тренировки, волокна MHC I примерно на 130% мощнее, чем у бегунов-любителей (26). Однако, когда эти университетские бегуны включают в себя более высокоинтенсивные тренировки по ходу сезона, мощность волокон MHC I падает почти на 40%, по существу устраняя различия, наблюдаемые в фазе базовой тренировки (23).Таким образом, тренировочный фон и интенсивность могут играть большую роль в динамике отдельных мышечных волокон. У элитных бегунов среднего возраста в категории Masters мощность волокон MHC I на 13% ниже, чем у тех, кто ведет сидячий образ жизни, что отражает парадигму студенческого бегуна во время тяжелых тренировок (68). На основе доступной литературы мы интерпретируем улучшенную мощность волокон MHC I за ~ 50 лет аэробных упражнений на протяжении всей жизни как более отражающую тип тренировки, который обычно классифицируется как базовая тренировка среди молодых спортсменов на выносливость, что имеет смысл, учитывая возраст и модели тренировок этих людей.
В отличие от волокон MHC IIa, более высокая мощность волокна MHC I, наблюдаемая в когорте LLE, была вызвана прежде всего повышенным производством силы, а не скоростью. Этот миоцеллюлярный профиль MHC I, по-видимому, уникален для упражнений на протяжении всей жизни, поскольку в предыдущих программах тренировок, упомянутых выше, увеличение мощности волокон MHC I является результатом скорости (24, 26, 60) и / или гипертрофии волокон (24–26, 44, 56, 60, 66). Поскольку когорта LLE имела большую силу и такой же размер, как YE и OH, ~ 50 лет аэробных упражнений привели к улучшению удельного напряжения (т.е. качество мышечных волокон). Ранее сообщалось об увеличении удельного напряжения волокон MHC I при тренировках на выносливость у молодых бегунов, поскольку эти волокна становились меньше по мере тренировки (23, 57). Удельное натяжение, по-видимому, является функцией плотности упаковки сократительных белков и / или пассивной жесткости (37). Следовательно, поскольку размер волокон был одинаковым в группах в настоящем исследовании, аэробные упражнения на протяжении всей жизни могут увеличивать количество белков или изменять функцию белка (т. Е. Посттрансляционные модификации), вызывая эти функциональные адаптации, вероятно, увеличивая мощность этих устойчивых к усталости волокон. .
Хотя на некоторые функциональные свойства мышечных волокон MHC I и IIa положительно повлияли аэробные упражнения на протяжении всей жизни, никаких преимуществ для размера волокон не наблюдалось. В наших когортах и YE, и OH имели типичные размеры волокон, которые в целом можно было бы ожидать (55), поскольку волокна MHC I и IIa от YE были схожими по размеру (в пределах 10%), тогда как волокна MHC IIa от OH были на 38%. меньше, чем их волокна MHC I. Женщины LLE отражали ОН, поскольку их волокна MHC IIa были на 35% меньше, чем их волокна MHC I, и почти идентичны по размеру с OH.Хотя волокна MHC IIa были меньше среди LLE и OH, эти волокна имели большую функцию на единицу размера (то есть удельное натяжение и нормированную мощность). Это повышение качества мышечных волокон с возрастом наблюдалось ранее в нашей лаборатории (21, 43) и других (48, 49), и теперь оно может быть распространено на пожилых людей, занимающихся физическими упражнениями.
Мы предположили, что волокна MHC IIa, которые атрофируются в большей степени с возрастом (5, 31), получат некоторую пользу от аэробных упражнений на протяжении всей жизни из-за общего использования / задействования во время упражнений (3).Эта идея, как правило, подтверждается предыдущими исследованиями спортсменов среднего и старшего возраста (от 45 до 70 лет) в категории ветеранов (14, 29, 61, 67). Было показано, что аэробные упражнения являются анаболическими (синтез белка и миогенные генные сети) после интенсивных упражнений (22, 34, 70). Кроме того, аэробные упражнения продолжительностью от 12 недель до 12 месяцев доказали свою эффективность в индукции гипертрофии быстро сокращающихся мышечных волокон у молодых и пожилых людей (13, 24, 25). Когда аэробные упражнения сочетаются с упражнениями с отягощениями, они усиливают гипертрофию во время краткосрочных тренировок (5 недель) и предотвращают атрофию во время длительного (60 дней) постельного режима (33, 54).Однако эти анаболические преимущества аэробных тренировок, по-видимому, не привели к увеличению размера волокон у тех, кто занимается физическими упражнениями на протяжении всей жизни, что аналогичным образом было показано у женщин-велосипедисток ( n = 2) (42), женщины-бегуны (~ 80 лет) (47), ~ 70-летние мужчины, начавшие велотренировки в возрасте тридцати лет (35), и мужчины, тренировавшиеся на выносливость всю жизнь (~ 70 лет) (1). Мы предполагаем, что волокна MHC IIa были оптимизированы для аэробных упражнений, поскольку размер волокон MHC IIa, возможно, способствовал повышению метаболической эффективности, как было ранее показано у лиц, занимающихся спортом на протяжении всей жизни (15), и требует дальнейших исследований.
Хотя мы наблюдали улучшенную функциональную адаптацию обоих типов волокон при аэробных упражнениях на протяжении всей жизни по сравнению с ОГ, они, по-видимому, не влияли на размер и функцию всей мышцы (Таблица 1). Для размера всей мышцы это, по-видимому, в основном объясняется схожим профилем размера волокон в когортах LLE и OH. Сходную функцию всей мускулатуры в старших когортах можно частично объяснить профилями типов волокон, поскольку у тех, кто на протяжении всей жизни имел тенденцию иметь большее распределение относительно менее мощных, хотя и устойчивых к усталости, волокон MHC I (61% и 47% в LLE и OH соответственно).Бегуны категории Elite Masters (~ 50 лет) также не показали различий в размере или силе всей мускулатуры в течение 20–25 лет беговой тренировки по сравнению с теми, кто не занимался спортом по возрасту (62). Хотя у бегунов среднего возраста из категории Masters были менее мощные волокна MHC IIa (-27%), чем у не бегунов, у них было большое количество медленных волокон (~ 75%) по сравнению с теми, кто не тренировался (~ 50%), что, вероятно, объясняет аналогичные данные о силе всей мускулатуры (67). Этот феномен изменения распределения типов волокон, влияющий на работу всей мускулатуры, был обнаружен более 40 лет назад (51).Наша команда расширила эту идею, включив в нее сократительные свойства, показав, что крупный переход от медленных к быстро сокращающимся волокнам во время 90-дневного постельного режима привел к составным профилям мощности миофибрилл, которые были замаскированы на уровне всей мышцы (59). Взятые вместе, эти данные показывают, что изменения в мышечных волокнах не всегда отражаются на уровне всей мышцы, что, по-видимому, имеет место в настоящем исследовании.
Поколение бума физических упражнений привело к увеличению числа людей, занимающихся физическими упражнениями, которые превратились в образ жизни.У нас была уникальная возможность изучить потенциальную пользу для здоровья на миоклеточном уровне у женщин, находящихся сейчас на восьмом десятилетии жизни, которые регулярно занимались спортом в течение почти 50 лет. Ключевой вывод этого исследования заключался в том, что аэробные упражнения на протяжении всей жизни не приносили очевидной пользы для волокон MHC I или IIa. Однако LLE увеличивал силу мышечных волокон с медленным сокращением (MHC I) и сохранял силу волокон с быстрым сокращением (MHC IIa). Механизмы, лежащие в основе этих адаптаций к аэробным упражнениям на протяжении всей жизни, варьировались между волокнами MHC I (сила) и волокнами MHC IIa (скорость).Сократительные свойства одиночных мышечных волокон, наблюдаемые при продолжительных аэробных упражнениях, уникальны и позволяют по-новому взглянуть на пластичность стареющих скелетных мышц у женщин на миоклеточном уровне. Мы признаем ограничение, заключающееся в том, что эти люди, занимавшиеся спортом всю жизнь, участвовали в различных формах аэробных упражнений на протяжении всей своей жизни, и поэтому мы не смогли провести сравнения по конкретным режимам. Тем не менее, эти испытуемые были репрезентативными для поколения физических упражнений, учитывая, что люди, вероятно, изменили свои привычки к упражнениям по разным причинам (например,g., травмы или изменение интересов). В будущих исследованиях следует рассмотреть другие режимы упражнений (например, упражнения с отягощениями) и потенциальный широкий спектр преимуществ для различных физиологических систем при упражнениях на протяжении всей жизни.
U.R., T.A.T. и S.T. задуманное и спланированное исследование; K.J.G., K.M., U.R., G.J.G., G.B., B.G., T.A.T. и S.T. проведенные эксперименты; K.J.G., K.M., U.R., G.J.G., G.B., W.H.F., T.A.T. и S.T. проанализированные данные; К.Дж.Г. и С. интерпретированные результаты экспериментов; К.J.G. и С. подготовленные фигурки; К.Дж.Г. и С. составленная рукопись; K.J.G., K.M., U.R., G.J.G., G.B., W.H.F., B.G., T.A.T. и S.T. отредактированная и исправленная рукопись; K.J.G., K.M., U.R., G.J.G., G.B., W.H.F., B.G., T.A.T. и S.T. утверждена окончательная версия рукописи.
Потеря кусочков без распада: потеря сократительного белка во время мышечной атрофии
Скелетная мышца — это пластичная ткань, которая может увеличиваться в размере (гипертрофия) в ответ на физическую нагрузку или уменьшаться в размере (атрофия) при бездействии (1).Атрофия мышц возникает системно при физиологических состояниях, таких как голодание или старение, и при различных патологических состояниях, включая кахексию рака, сердечную недостаточность, почечную недостаточность и хроническую обструктивную болезнь легких. Очаговая атрофия определенных мышц или групп мышц может быть вызвана иммобилизацией гипсовой повязкой или травматическим повреждением периферических нервов. Удивительным аспектом потери мышечной ткани в этих условиях является тот факт, что мышечные волокна сохраняют в основном свою нормальную структуру и функцию во время атрофии, по крайней мере, на ранних стадиях.Рассмотрим голодание, когда мышцы подвергаются быстрой деградации белка и высвобождают аминокислоты, которые превращаются в глюкозу печенью, что позволяет выжить организму. Однако, несмотря на потерю мышечной массы, сократительная сила, нормализованная на мышечную массу, сохраняется (2), и голодное животное может преследовать свою добычу или перемещаться в отдаленные места для поиска пищи, подчеркивая запрограммированный характер этой эволюционно сохраненной адаптивной реакции. Исследование атрофических волокон, выделенных из денервированных мышц, также показало, что сила, нормализованная на площадь поперечного сечения, не снижается через 7 и 14 дней после перерезки седалищного нерва (3).Как может мышечная машина терять части, не теряя функции, чего не могут сделать машины, созданные руками человека?
Отличительной особенностью сократительного аппарата является модульная конструкция, повышающая его сопротивляемость после повреждений и позволяющая сохранить сократительную функцию при атрофии. В мышечных волокнах, которые представляют собой гигантские удлиненные клетки, содержащие сотни ядер, сократительный материал организован в миофибриллы, расположенные параллельно и состоящие из модульных единиц, расположенных последовательно, саркомеров (рис.1). Одно мышечное волокно человека, которое в длинных мышцах может достигать 10–20 см в длину и 0,1 мм в ширину, может содержать миллионы саркомеров, каждый ∼2 мкм в длину и 1 мкм в ширину. Саркомеры состоят из двух наборов нитей, толстой (миозин) и тонкой (актин), которые могут скользить одна по другой благодаря АТФазной активности молекулярного мотора, молекулы миозина, таким образом вызывая укорочение и / или генерацию силы. Толстые и тонкие филаменты содержатся внутри саркомерного цитоскелета, состоящего из жестких Z-дисков и эластичных филаментов тайтина, которые проходят между двумя Z-дисками.Внесаркомерный цитоскелет, состоящий из промежуточных филаментов десмина и других белков, обеспечивает поперечный каркас, окружающий миофибриллы на уровне Z-дисков и связывающий соседние миофибриллы, таким образом удерживая саркомеры и создавая типичный полосатый вид волокон скелетных мышц.
Рис. 1.На верхней панели показан продольный разрез волокна скелетных мышц крысы, визуализированный с помощью электронной микроскопии. Цитоплазма заполнена миофибриллами, которые состоят из саркомеров, расположенных последовательно и окаймленных Z-дисками (Z).На нижней панели представлена схема двух соседних саркомеров с толстыми (миозин) и тонкими (актиновыми) филаментами. Z-диски соединены поперечно ориентированными десминовыми нитями (D). Проиллюстрированы два важных этапа разрушения саркомеров во время мышечной атрофии: во-первых, TRIM32-индуцированное убиквитинирование (u) десминовых филаментов, тонких филаментов и белков Z-диска, за которым следует PAX4-зависимая регуляция p97, который отвечает за экстракцию убиквитинированных белков (uP) из саркомеров до их деградации в протеасоме.
Механизм, приводящий к потере сократительных белков во время мышечной атрофии, плохо изучен, но недавние исследования, такие как PNAS, проведенные Volodin et al. (4) проливают свет на этот процесс. Система убиквитин-протеасома, основной путь деградации белков, присутствующий во всех клетках, участвует в деградации сократительных белков мышц (5). В этой системе белки сначала конъюгируются с убиквитином посредством трехэтапного процесса, при этом фермент E1 сначала связывает убиквитин, который затем переносится на фермент E2 и, наконец, конъюгируется с субстратом с помощью лигазы E3.Убиквитинированные белки распознаются протеасомными рецепторами и расщепляются протеасомными протеазами. Идентифицировано большое количество лигаз E3 с отчетливой субстратной специфичностью. В частности, две мышечно-специфичные убиквитинлигазы, мышечный RING-finger 1 (MuRF1) и Atrogin1 / MAFbx, быстро индуцируются при различных типах мышечной атрофии (6, 7), и их потеря снижает мышечное истощение (6). Экспрессия как MuRF1, так и Atrogin1 регулируется фактором транскрипции FoxO3, который вызывает драматическую атрофию мышц при сверхэкспрессии в мышечных волокнах взрослых (8).Общий набор многих генов, называемых атрогенами, индуцируется факторами транскрипции FoxO в различных условиях истощения мышц (9).
Последующие исследования показали, что толстые и тонкие волокна разлагаются разными механизмами. MuRF1 убиквитинирует белки толстых филаментов, сначала легкие цепи миозина и миозин-связывающий белок C, а затем тяжелые цепи миозина, что приводит к их протеасомной деградации (10, 11). Напротив, отдельная убиквитинлигаза, белок 32, содержащий трехкомпонентный мотив (Trim32), отвечает за деградацию белков тонких филаментов, актина, тропомиозина и тропонина, а также белка Z-диска, α-актинина, потеря которого составляет очевидно, предшествует Trim32-зависимая деградация десминных филаментов (12).Однако эти анализы деградации тонких волокон проводились во время чрезвычайно быстрой мышечной атрофии, вызванной голоданием; поэтому точная последовательность событий, ведущих к атрофии мышц, не могла быть четко определена. В PNAS Володин и др. (4) повторно исследовать тонкие волокна и изменения десмина во время более медленной атрофии, вызванной денервацией. Они сообщают, что ранним изменением в течение первой недели после перерезки нерва является фосфорилирование и убиквитинирование десмина, за которым в течение второй недели следует диссоциация десминных филаментов и их убиквитинирование, за которым следует убиквитинирование и деградация сократительных белков.Полученные данные указывают на то, что деполимеризация сети десмина, процесс, ускоренный электропорацией денервированных мышц с доминантно-отрицательным ингибитором сборки десмина, является условием разрушения миофибрилл, предположительно потому, что он делает белки тонких филаментов более восприимчивыми к убиквитинированию. С другой стороны, общее количество десмина не уменьшилось через 14 дней после денервации, в отличие от исчезновения десмина после голодания в течение 2 дней (12).
Первым важным результатом настоящего исследования (4) является идентификация двух фаз транскрипционной программы, индуцированной атрофией денервации: ранняя фаза, характеризующаяся повышающей регуляцией различных атрогенов, которая происходит через несколько дней после перерезки нерва под воздействием атрофии. контроль факторов транскрипции FoxO и вторая фаза через 10–14 дней, характеризующаяся повышающей регуляцией других ферментов, включая p97 / VCP, которая не регулируется FoxO.В самом деле, уровень p97 не изменяется из-за сверхэкспрессии конститутивно активного FoxO3 в мышечных трубках, хотя доминантно-отрицательный мутант p97 блокирует увеличение деградации долгоживущих белков с помощью конститутивно активного FoxO3 (13). Известно, что ААА-АТФаза p97 / VCP взаимодействует с убиквитинированными белками, связанными с мембранами эндоплазматического ретикулума, хроматином или митохондриями, с помощью убиквитин-связывающих кофакторов и способна извлекать эти целевые белки из этих структур, чтобы обеспечить деградацию протеасомами ( 14).По аналогии было высказано предположение, что p97, который в мышцах образует комплексы с кофакторами Ufd1 и p47, ассоциирует и извлекает убиквитинированные белки из миофибрилл перед доставкой в протеасому (13). Эта интерпретация подтверждается открытием, что накопление p97, Ufd1 и p47 в атрофированных мышечных волокнах совпадает с быстрым распадом миофибриллярных белков через 10-14 дней после денервации (4).
Для определения фактора (ов) транскрипции, ответственного за экспрессию P97 и других транскриптов, активируемую в течение второй недели после перерезки нерва, Volodin et al.(4) проанализировали промоторы этих генов и обнаружили, что все они содержат мотивы связывания для фактора транскрипции PAX4. Это открытие является совершенно неожиданным, во-первых, потому, что факторы транскрипции PAX известны своей ролью в работе Volodin et al. дают общую, хотя, конечно, еще не полную, картину пути, участвующего в контролируемом разрушении цитоскелетных и миофибриллярных структур во время мышечной атрофии.
органогенез во время развития и обычно подавляется у взрослых, во-вторых, потому что Pax4 контролирует дифференцировку продуцирующих инсулин бета-клеток в поджелудочной железе (15), тогда как два других члена семейства PAX, Pax 3 и Pax7, регулируют мышечных предшественников. ячейки (16).Володин и др. (4) показывают, что Pax4 экспрессируется в скелетных мышцах и что экспрессия p97 заметно снижается, когда уровни PAX4 снижены путем электропорации мышц натощак со специфическими shРНК. В этих условиях убиквитинированные белки сохраняются в миофибриллярной фракции, эффект подобен тому, который вызывается доминантно-негативным p97, подтверждая критическую роль оси PAX4-p97 в экстракции и деградации миофибриллярных компонентов. Интересно, что PAX4 также индуцирует экспрессию MuRF1 через 10 дней после перерезки нерва, тем самым способствуя деградации толстых филаментов.
В заключение Володин и др. (4) предоставляют общую, хотя, конечно, еще не полную картину пути, участвующего в контролируемом демонтаже цитоскелетных и миофибриллярных структур во время атрофии мышц (Рис. 1). Первая стадия менее хорошо охарактеризована, поскольку киназа, ответственная за фосфорилирование десмина во время атрофии in vivo, еще не идентифицирована. За этим следует убиквитинирование и разборка десмина с помощью убиквитинлигазы TRIM32, которая, в свою очередь, способствует последующему убиквитинированию белков тонких филаментов и Z-дисков с помощью TRIM32.На более поздней стадии PAX4-зависимая регуляция p97 делает возможным связывание и экстракцию миофибриллярных белков с помощью p97, предположительно с последующим их переносом в протеасому. Эта схема была проверена как после голодания, так и после перерезки нервов, хотя прогрессирование изменений намного быстрее после голодания по сравнению с денервацией. Будет интересно определить, как многочисленные другие факторы, которые, как известно, участвуют в распаде миофибрилл, вписываются в эту схему, и имеет ли подобная последовательность изменений в других моделях мышечного истощения, таких как раковая кахексия или сердечная недостаточность.
Другой открытый вопрос заключается в том, затрагиваются ли миофибриллы и цитоскелет однородно по всему мышечному волокну во время атрофии или процесс деградации происходит преимущественно в определенных областях. Ранние ультраструктурные исследования показали, что в течение первых 2 недель после денервации периферические миофибриллы часто оказывались разрушенными, тогда как внутренние миофибриллы демонстрировали «хорошую сохранность и выравнивание полос» (17). Будет важно повторно исследовать эту проблему путем иммуноокрашивания соответствующими антителами для картирования областей разрушения цитоскелета и миофибрилл.Например, можно спросить, происходит ли рекрутирование протеасом в определенных регионах, например, на периферии волокон или на периферии миофибрилл. Можно также попытаться визуализировать убиквитинирование миофибрилл и разрушение живых мышечных волокон, подход, ранее использовавшийся для визуализации дислокации белков из эндоплазматического ретикулума (18). Визуализация живых клеток позволила бы определить, является ли деградация сократительного белка однородным и медленно прогрессирующим процессом или скорее характеризуется спорадическими катастрофическими событиями, вызванными очаговой дестабилизацией миофибрилл.
Сноски
Вклад авторов: С.С. написал статью.
Автор заявляет об отсутствии конфликта интересов.
См. Сопутствующую статью на странице E1375.
10.3: Сокращение и расслабление мышечных волокон
Цели обучения
- Опишите компоненты, участвующие в сокращении мышц
- Объясните, как мышцы сокращаются и расслабляются
- Опишите модель мышечного сокращения со скользящей нитью
Последовательность событий, которые приводят к сокращению отдельного мышечного волокна, начинается с сигнала — нейротрансмиттера, ACh — от мотонейрона, иннервирующего это волокно.Локальная мембрана волокна будет деполяризоваться по мере поступления положительно заряженных ионов натрия (Na + ), вызывая деполяризацию потенциала действия, который распространяется на остальную часть мембраны, включая Т-канальцы. Это вызывает высвобождение ионов кальция (Ca ++ ) из хранилища в саркоплазматическом ретикулуме (SR). Затем Ca ++ инициирует сокращение, которое поддерживается АТФ (рис. \ (\ PageIndex {1} \)). Пока ионы Ca ++ остаются в саркоплазме для связывания с тропонином, который сохраняет сайты связывания актина «незащищенными», и пока доступен АТФ для управления циклическим переключением мостиков и вытягиванием актиновых цепей посредством миозин, мышечное волокно будет продолжать сокращаться до анатомического предела.
Рисунок \ (\ PageIndex {1} \): сокращение мышечного волокна. Между актином и головками миозина образуется поперечный мостик, запускающий сокращение. Пока ионы Ca ++ остаются в саркоплазме для связывания с тропонином, и пока доступен АТФ, мышечное волокно будет продолжать укорачиваться.Сокращение мышц обычно прекращается, когда заканчивается передача сигнала от двигательного нейрона, который реполяризует сарколемму и Т-канальцы и закрывает потенциалзависимые кальциевые каналы в SR. Затем ионы Ca ++ закачиваются обратно в SR, что заставляет тропомиозин повторно защищать (или повторно закрывать) сайты связывания на актиновых цепях.Мышца также может перестать сокращаться, когда у нее заканчивается АТФ и она устает (Рисунок \ (\ PageIndex {2} \)).
Рисунок \ (\ PageIndex {2} \): Расслабление мышечного волокна. Ионы Ca ++ перекачиваются обратно в SR, что заставляет тропомиозин повторно защищать сайты связывания на актиновых цепях. Мышца также может перестать сокращаться, когда у нее заканчивается АТФ и она устает.Высвобождение ионов кальция вызывает мышечные сокращения. Посмотрите это видео, чтобы узнать больше о роли кальция.а) Что такое «Т-канальцы» и какова их роль? (b) Пожалуйста, опишите, как сайты связывания актина становятся доступными для перекрестного связывания с головками миозина во время сокращения.
Молекулярные процессы укорочения мышечных волокон происходят внутри саркомеров волокна (см. Рисунок \ (\ PageIndex {3} \)). Сокращение поперечно-полосатых мышечных волокон происходит, когда саркомеры, линейно расположенные внутри миофибрилл, укорачиваются, когда миозиновые головки тянут актиновые нити.
Область, в которой перекрываются толстые и тонкие волокна, имеет более плотный вид, так как между ними мало места.Эта зона, где тонкие и толстые волокна перекрываются, очень важна для сокращения мышц, так как именно здесь начинается движение волокон. Тонкие нити, закрепленные на концах Z-дисками, не проходят полностью в центральную область, которая содержит только толстые нити, закрепленные у своих оснований в точке, называемой М-линией. Миофибрилла состоит из множества саркомеров, расположенных вдоль ее длины; таким образом, миофибриллы и мышечные клетки сокращаются по мере сокращения саркомеров.
Модель сокращения скользящей нити
По сигналу двигательного нейрона волокно скелетных мышц сокращается, когда тонкие нити вытягиваются, а затем скользят мимо толстых нитей внутри саркомеров волокна.Этот процесс известен как модель мышечного сокращения скользящей нити (рис. \ (\ PageIndex {3} \)). Скольжение может происходить только тогда, когда миозин-связывающие сайты на актиновых филаментах открываются серией этапов, которые начинаются с проникновения Ca ++ в саркоплазму.
Рисунок \ (\ PageIndex {3} \): Модель сокращения мышц со скользящей нитью. Когда саркомер сокращается, линии Z сближаются, а полоса I становится меньше. Полоса А остается той же ширины. При полном сокращении тонкие и толстые нити перекрываются.Тропомиозин — это белок, который обвивает цепи актинового филамента и покрывает миозин-связывающие участки, предотвращая связывание актина с миозином. Тропомиозин связывается с тропонином с образованием комплекса тропонин-тропомиозин. Комплекс тропонин-тропомиозин предотвращает связывание миозиновых «головок» с активными участками актиновых микрофиламентов. Тропонин также имеет сайт связывания для ионов Ca ++ .
Чтобы инициировать сокращение мышц, тропомиозин должен обнажить миозин-связывающий сайт на актиновой нити, чтобы обеспечить образование поперечных мостиков между актиновыми и миозиновыми микрофиламентами.Первым шагом в процессе сокращения является связывание Ca ++ с тропонином, так что тропомиозин может ускользать от сайтов связывания на актиновых цепях. Это позволяет головкам миозина связываться с этими открытыми участками связывания и образовывать поперечные мостики. Затем тонкие волокна тянутся головками миозина, чтобы скользить мимо толстых волокон к центру саркомера. Но каждая голова может тянуть только очень короткое расстояние, прежде чем достигнет своего предела, и должна быть «взведена», прежде чем она сможет тянуть снова, шаг, который требует АТФ.
АТФ и сокращение мышц
Для того, чтобы тонкие нити продолжали скользить мимо толстых нитей во время сокращения мышц, миозиновые головки должны тянуть актин в местах связывания, отсоединяться, повторно взводиться, прикрепляться к большему количеству участков связывания, тянуть, отсоединять, повторно — кран и т. д. Это повторяющееся движение известно как цикл поперечного моста. Это движение миозиновых головок похоже на движение весел, когда человек гребет на лодке: весла (миозиновые головки) тянутся, поднимаются из воды (отсоединяются), перемещаются (повторно взведены) и затем снова погружаются, чтобы потяните (Рисунок \ (\ PageIndex {4} \)).Каждый цикл требует энергии, и действие головок миозина в саркомерах, которые постоянно натягивают тонкие волокна, также требует энергии, которую обеспечивает АТФ.
Рисунок \ (\ PageIndex {4} \): сокращение скелетных мышц. (а) Активный сайт актина обнажается, когда кальций связывается с тропонином. (b) Головка миозина притягивается к актину, и миозин связывает актин в своем сайте связывания с актином, образуя поперечный мостик. (c) Во время рабочего такта высвобождается фосфат, образовавшийся в предыдущем цикле сжатия.Это приводит к повороту головки миозина к центру саркомера, после чего присоединенные АДФ и фосфатная группа высвобождаются. (d) Новая молекула АТФ прикрепляется к головке миозина, вызывая отсоединение поперечного мостика. (e) Миозиновая головка гидролизует АТФ до АДФ и фосфата, что возвращает миозин в взведенное положение.Образование поперечного мостика происходит, когда миозиновая головка прикрепляется к актину, в то время как аденозиндифосфат (АДФ) и неорганический фосфат (P i ) все еще связаны с миозином (рис.3.4.а, б.). Затем высвобождается P и , в результате чего миозин формирует более сильное прикрепление к актину, после чего головка миозина перемещается к М-линии, увлекая за собой актин. Когда актин вытягивается, филаменты перемещаются примерно на 10 нм к M-линии. Это движение называется рабочим ходом , так как на этом этапе происходит движение тонкой нити (рисунок \ (\ PageIndex {4} \). C.). В отсутствие АТФ головка миозина не отделяется от актина.
Одна часть головки миозина прикрепляется к сайту связывания на актине, но у головки есть другой сайт связывания для АТФ.Связывание АТФ заставляет миозиновую головку отделяться от актина (Рисунок \ (\ PageIndex {4} \). D). После этого АТФ превращается в АДФ и P i за счет собственной активности миозина АТФазы . Энергия, высвобождаемая во время гидролиза АТФ, изменяет угол наклона головки миозина во взведенное положение (Рисунок \ (\ PageIndex {4} \). E). Головка миозина теперь в положении для дальнейшего движения.
Когда миозиновая головка наклонена, миозин находится в высокоэнергетической конфигурации. Эта энергия расходуется, когда миозиновая головка движется через силовой удар, и в конце силового удара миозиновая головка находится в низкоэнергетическом положении.После силового удара ADP высвобождается; однако сформированный поперечный мостик все еще на месте, а актин и миозин связаны вместе. Пока АТФ доступен, он легко присоединяется к миозину, цикл поперечного моста может повторяться, и сокращение мышц может продолжаться.
Обратите внимание, что каждая толстая нить из примерно 300 молекул миозина имеет несколько миозиновых головок, и многие поперечные мостики образуются и непрерывно разрываются во время сокращения мышц. Умножьте это на все саркомеры в одной миофибрилле, на все миофибриллы в одном мышечном волокне и на все мышечные волокна в одной скелетной мышце, и вы поймете, почему для поддержания работы скелетных мышц требуется столько энергии (АТФ).Фактически, именно потеря АТФ приводит к трупному окоченению, наблюдаемому вскоре после смерти человека. Поскольку дальнейшее производство АТФ невозможно, у миозиновых головок нет АТФ, который мог бы отделиться от участков связывания актина, поэтому поперечные мостики остаются на месте, вызывая жесткость в скелетных мышцах.
Источники АТФ
АТФ поставляет энергию для сокращения мышц. В дополнение к своей прямой роли в цикле поперечных мостиков, АТФ также обеспечивает энергию для активных транспортных насосов Ca ++ в SR.Сокращение мышц не происходит без достаточного количества АТФ. Количество АТФ, хранящегося в мышцах, очень мало, его достаточно только для нескольких секунд сокращений. По мере того, как он расщепляется, АТФ необходимо быстро регенерировать и заменять, чтобы обеспечить устойчивое сокращение. Существует три механизма регенерации АТФ: метаболизм креатинфосфата, анаэробный гликолиз, ферментация и аэробное дыхание.
Креатинфосфат — это молекула, которая может накапливать энергию в своих фосфатных связях.В покоящейся мышце избыток АТФ передает свою энергию креатину, производя АДФ и креатинфосфат. Это действует как запас энергии, который можно использовать для быстрого создания большего количества АТФ. Когда мышца начинает сокращаться и ей требуется энергия, креатинфосфат передает свой фосфат обратно в АДФ с образованием АТФ и креатина. Эта реакция катализируется ферментом креатинкиназой и происходит очень быстро; таким образом, АТФ, полученный из креатинфосфата, приводит в действие первые несколько секунд мышечного сокращения. Однако креатинфосфат может обеспечить энергию примерно за 15 секунд, после чего необходимо использовать другой источник энергии (Рисунок \ (\ PageIndex {5} \)).
Рисунок \ (\ PageIndex {5} \): метаболизм мышц. (а) Некоторое количество АТФ хранится в мышце в состоянии покоя. Когда начинается сокращение, он расходуется за секунды. Больше АТФ вырабатывается из креатинфосфата примерно за 15 секунд. (b) Каждая молекула глюкозы производит две молекулы АТФ и две молекулы пировиноградной кислоты, которые могут использоваться при аэробном дыхании или превращаться в молочную кислоту. Если кислород недоступен, пировиноградная кислота превращается в молочную кислоту, что может способствовать мышечной усталости. Это происходит во время напряженных упражнений, когда требуется большое количество энергии, но кислород не может быть доставлен в мышцы в достаточной степени.(c) Аэробное дыхание — это расщепление глюкозы в присутствии кислорода (O 2 ) с образованием углекислого газа, воды и АТФ. Примерно 95 процентов АТФ, необходимого для покоящихся или умеренно активных мышц, обеспечивается аэробным дыханием, которое происходит в митохондриях.Когда АТФ, продуцируемый креатинфосфатом, истощается, мышцы превращаются в гликолиз в качестве источника АТФ. Гликолиз — это анаэробный (не зависимый от кислорода) процесс, который расщепляет глюкозу (сахар) с образованием АТФ; однако гликолиз не может производить АТФ так же быстро, как креатинфосфат.Таким образом, переключение на гликолиз приводит к более медленному доступу АТФ к мышцам. Сахар, используемый в гликолизе, может поступать из глюкозы в кровь или за счет метаболизма гликогена, который хранится в мышцах. При распаде одной молекулы глюкозы образуются две молекулы АТФ и две молекулы пировиноградной кислоты , которые можно использовать при аэробном дыхании или преобразовать в молочную кислоту при низком уровне кислорода (рисунок \ (\ PageIndex {5} \). B) .
При наличии кислорода пировиноградная кислота используется при аэробном дыхании.Однако, если кислород недоступен, пировиноградная кислота превращается в молочную кислоту , что может способствовать мышечной усталости. Это преобразование позволяет рециркулировать фермент NAD + из NADH, который необходим для продолжения гликолиза. Это происходит во время напряженных упражнений, когда требуется большое количество энергии, но кислород не может быть доставлен в мышцы в достаточной степени. Сам по себе гликолиз не может продолжаться очень долго (примерно 1 минута мышечной активности), но он полезен для облегчения коротких всплесков высокоинтенсивной выработки.Это связано с тем, что гликолиз не очень эффективно использует глюкозу, производя чистый прирост в два АТФ на молекулу глюкозы и конечный продукт — молочную кислоту, которая может способствовать мышечной усталости по мере ее накопления.
Аэробное дыхание — это расщепление глюкозы или других питательных веществ в присутствии кислорода (O 2 ) с образованием углекислого газа, воды и АТФ. Примерно 95 процентов АТФ, необходимого для покоящихся или умеренно активных мышц, обеспечивается аэробным дыханием, которое происходит в митохондриях.Входы для аэробного дыхания включают глюкозу, циркулирующую в кровотоке, пировиноградную кислоту и жирные кислоты. Аэробное дыхание намного эффективнее анаэробного гликолиза, производя примерно 36 АТФ на молекулу глюкозы по сравнению с четырьмя за счет гликолиза. Однако аэробное дыхание не может поддерживаться без постоянной подачи O 2 к скелетным мышцам и происходит намного медленнее (Рисунок \ (\ PageIndex {5} \). C). Чтобы компенсировать это, мышцы накапливают небольшое количество избыточного кислорода в белках, называемых миоглобином, что способствует более эффективному сокращению мышц и снижению утомляемости.Аэробные тренировки также повышают эффективность системы кровообращения, так что O 2 может поставляться в мышцы в течение более длительных периодов времени.
Мышечная усталость возникает, когда мышца больше не может сокращаться в ответ на сигналы нервной системы. Точные причины мышечной усталости полностью не известны, хотя некоторые факторы коррелируют со снижением мышечного сокращения, которое происходит во время утомления. АТФ необходим для нормального сокращения мышц, и, поскольку запасы АТФ уменьшаются, функция мышц может снижаться.Это может быть скорее фактором кратковременной интенсивной работы мышц, чем продолжительных усилий с меньшей интенсивностью. Накопление молочной кислоты может снизить внутриклеточный pH, влияя на активность ферментов и белков. Дисбаланс уровней Na + и K + в результате деполяризации мембраны может нарушить отток Ca ++ из SR. Длительные периоды продолжительных упражнений могут повредить SR и сарколемму, что приведет к нарушению регуляции Ca ++ .
Интенсивная мышечная активность приводит к дефициту кислорода , то есть количеству кислорода, необходимому для компенсации АТФ, производимого без кислорода во время сокращения мышц.Кислород необходим для восстановления уровней АТФ и креатинфосфата, преобразования молочной кислоты в пировиноградную кислоту, а в печени — для преобразования молочной кислоты в глюкозу или гликоген. Другие системы, используемые во время упражнений, также требуют кислорода, и все эти комбинированные процессы приводят к учащению дыхания после тренировки. До тех пор, пока кислородная задолженность не будет покрыта, потребление кислорода повышается даже после прекращения упражнений.
Расслабление скелетных мышц
Расслабление волокон скелетных мышц и, в конечном итоге, скелетных мышц начинается с двигательного нейрона, который перестает передавать свой химический сигнал, ACh, в синапс в NMJ.Мышечное волокно переполяризуется, что закрывает ворота в SR, где высвобождается Ca ++ . Насосы с АТФ перемещают Ca ++ из саркоплазмы обратно в SR. Это приводит к «повторному экранированию» сайтов связывания актина на тонких филаментах. Без способности образовывать поперечные мостики между тонкими и толстыми волокнами мышечное волокно теряет напряжение и расслабляется.
Сила мышц
Количество волокон скелетных мышц в данной мышце определяется генетически и не изменяется.Сила мышц напрямую зависит от количества миофибрилл и саркомеров в каждом волокне. Факторы, такие как гормоны и стресс (и искусственные анаболические стероиды), действующие на мышцы, могут увеличивать производство саркомеров и миофибрилл в мышечных волокнах — изменение, называемое гипертрофией, которое приводит к увеличению массы и объема скелетных мышц. Точно так же уменьшение использования скелетных мышц приводит к атрофии, когда количество саркомеров и миофибрилл исчезает (но не количество мышечных волокон).При снятии гипса на конечности в гипсе обычно появляются атрофированные мышцы, а при некоторых заболеваниях, таких как полиомиелит, появляются атрофированные мышцы.
НАРУШЕНИЯ …
Мышечная система
Мышечная дистрофия Дюшенна (МДД) — прогрессирующее ослабление скелетных мышц. Это одно из нескольких заболеваний, вместе называемых «мышечной дистрофией». МДД вызван нехваткой протеина дистрофина, который помогает тонким филаментам миофибрилл связываться с сарколеммой.Без достаточного количества дистрофина мышечные сокращения вызывают разрыв сарколеммы, вызывая приток Са ++, что приводит к повреждению клеток и деградации мышечных волокон. Со временем по мере накопления мышечных повреждений мышечная масса теряется и развиваются более серьезные функциональные нарушения.
МДД — это наследственное заболевание, вызванное аномальной Х-хромосомой. Это в первую очередь поражает мужчин и обычно диагностируется в раннем детстве. МДД обычно сначала проявляется как нарушение равновесия и движения, а затем прогрессирует до неспособности ходить.Он продолжает двигаться вверх по телу от нижних конечностей к верхней части тела, где воздействует на мышцы, отвечающие за дыхание и кровообращение. В конечном итоге это приводит к смерти из-за дыхательной недостаточности, и люди, страдающие этим заболеванием, обычно не доживают до 20 лет.
Поскольку МДД вызывается мутацией в гене, кодирующем дистрофин, считалось, что введение здоровых миобластов пациентам может быть эффективным лечением. Миобласты — это эмбриональные клетки, отвечающие за развитие мышц, и в идеале они должны нести здоровые гены, которые могут вырабатывать дистрофин, необходимый для нормального сокращения мышц.Этот подход оказался в значительной степени неудачным у людей. Недавний подход включал попытку увеличить выработку мышцами утрофина, белка, подобного дистрофину, который может играть роль дистрофина и предотвращать повреждение клеток.
Обзор главы
Саркомер — это самая маленькая сократительная часть мышцы. Миофибриллы состоят из толстых и тонких нитей. Толстые нити состоят из белкового миозина; тонкие нити состоят из белка актина.Тропонин и тропомиозин — регуляторные белки.
Сокращение мышц описывается моделью сокращения скользящей нити. ACh является нейротрансмиттером, который связывается в нервно-мышечном соединении (NMJ), чтобы вызвать деполяризацию, и потенциал действия перемещается по сарколемме, чтобы вызвать высвобождение кальция из SR. Сайты актина открываются после того, как Са ++ попадает в саркоплазму из хранилища SR для активации комплекса тропонин-тропомиозин, так что тропомиозин перемещается от сайтов.Перекрестное соединение головок мипозина, стыкующихся с актин-связывающими сайтами, сопровождается «силовым ударом» — скольжением тонких нитей толстыми нитями. Силовые удары приводятся в действие АТФ. В конечном итоге саркомеры, миофибриллы и мышечные волокна укорачиваются, чтобы вызвать движение.
Вопросы по интерактивной ссылке
Высвобождение ионов кальция вызывает мышечные сокращения. Посмотрите это видео, чтобы узнать больше о роли кальция. а) Что такое «Т-канальцы» и какова их роль? (b) Также опишите, как сайты связывания актина становятся доступными для перекрестного связывания с головками миозина во время сокращения.
Ответ: (a) Т-канальцы — это внутренние продолжения сарколеммы, которые запускают высвобождение Ca ++ из SR во время потенциала действия. (b) Ca ++ связывается с тропомиозином, и это отодвигает стержни тропомиозина от участков связывания.
Обзорные вопросы
Q. В расслабленной мышце сайт связывания миозина на актине блокируется ________.
A. тайтин
B. тропонин
C.миоглобин
D. тропомиозин
Q. Согласно модели скользящего филамента, сайты связывания на актине открываются, когда ________.
A. Повышение уровня креатинфосфата
B. Повышение уровня АТФ
C. Повышение уровня ацетилхолина
D. Повышение уровня ионов кальция
Q. Клеточная мембрана мышечного волокна называется ________.
A. миофибрилла
B. sarcolemma
C. саркоплазма
D.миофиламент
В. Мышечное расслабление происходит, когда ________.
A. Ионы кальция активно переносятся из саркоплазматического ретикулума
B. Ионы кальция диффундируют из саркоплазматического ретикулума
C. Ионы кальция активно переносятся в саркоплазматический ретикулум
D. Ионы кальция диффундируют в саркоплазматический ретикулум
В. Во время сокращения мышцы поперечная перемычка отсоединяется, когда ________.
А.головка миозина связывается с молекулой АДФ
B. головка миозина связывается с молекулой АТФ
C. ионы кальция связываются с тропонином
D. ионы кальция связываются с актином
Q. Тонкие и толстые нити организованы в функциональные единицы, называемые ________.
A. миофибриллы
B. миофиламенты
C. Т-канальцы
D. саркомеры
Вопросы о критическом мышлении
В. Как бы изменились мышечные сокращения, если бы волокна скелетных мышц не имели Т-канальцев?
А.Без Т-канальцев проводимость потенциала действия внутрь клетки происходила бы намного медленнее, вызывая задержки между нервной стимуляцией и сокращением мышц, что приводило бы к более медленным и слабым сокращениям.
В. Что вызывает поперечнополосатую окраску скелетных мышц?
A. Темные полосы A и светлые полосы I повторяются вдоль миофибрилл, и выравнивание миофибрилл в клетке приводит к тому, что вся клетка выглядит полосатой.
В. Как бы изменились мышечные сокращения, если бы в мышечном волокне полностью истощился АТФ?
А.Без АТФ головки миозина не могут отделиться от сайтов связывания актина. Все «застрявшие» поперечные мосты приводят к ригидности мышц. У живого человека это может вызвать состояние вроде «писательских спазмов». У недавно умершего человека это приводит к трупному окоченению.
Глоссарий
- аэробное дыхание
- производство АТФ в присутствии кислорода
- АТФаза
- Фермент, гидролизующий АТФ до АДФ
- креатинфосфат
- фосфаген, используемый для хранения энергии от АТФ и передачи ее в мышцы
- гликолиз
- анаэробное расщепление глюкозы до АТФ
- молочная кислота
- продукт анаэробного гликолиза
- кислородный долг
- количество кислорода, необходимое для компенсации АТФ, произведенного без кислорода во время мышечного сокращения
- ход мощности
- действие миозина, втягивающее актин внутрь (к линии M)
- пировиноградная кислота
- продукт гликолиза, который можно использовать при аэробном дыхании или преобразовать в молочную кислоту
