| Хлорид натрия | |
|---|---|
 ( ({{{картинка3D}}}) | |
 ( ({{{изображение}}}) | |
| Систематическое наименование | Хлорид натрия |
| Традиционные названия | Соль, поваренная соль, столовая соль, пищевая соль, каменная соль, галит[1] |
| Хим. формула | NaCl |
| Молярная масса | 58,44277 г/моль |
| Плотность | 2,165 г/см³ |
| Температура | |
| • плавления | 800,8 °C |
| • кипения | 1465 °C |
| Мол. теплоёмк. | 50,8 Дж/(моль·К) |
| Энтальпия | |
| • образования | −234,8 кДж/моль |
| Удельная теплота испарения | 170,85 кДж/моль |
| Удельная теплота плавления | 28,68 кДж/моль |
| Растворимость | |
| • в воде | 35,6 г/100 мл (0 °C) 35,9 г/100 мл (+25 °C) 39,1 г/100 мл (+100 °C) |
| • в метаноле | 1,49 г/100 мл |
| • в аммиаке | 21,5 г/100 мл |
| Показатель преломления | 1,544202 (589 нм) |
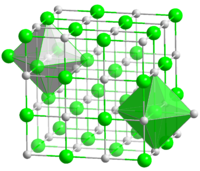
| Координационная геометрия | Октаэдральная (Na +) Октаэдральная (Cl -) |
| Кристаллическая структура | гранецентрированная кубическая, cF8 |
| Рег. номер CAS | 7647-14-5 |
| PubChem | 5234 |
| Рег. номер EINECS | 231-598-3 |
| SMILES | |
| InChI | |
| RTECS | VZ4725000 |
| ChEBI | 26710 |
| ChemSpider | 5044 |
Потребление соли
Норма потребления соли
Соль состоит из натрия и хлора. Вместе они называются хлорид натрия (Na Cl).
Поваренная соль состоит из 97,5% хлорида натрия и 2,5% химических веществ, таких как абсорбенты и йода.
Соль содержит 40% натрия и 60% хлорида, что означает каждая чайная ложка соли, содержит 2000 миллиграммов натрия.
Поваренную соль очищают путем удаления микроэлементов и нагрева соли до 12000 F и добавляют агент от слипания соли в качестве связующего вещества.
Бикарбонат натрия, бензоат натрия и моно глутамат натрия лишь некоторые из этих добавок.
Натрий представляет собой мягкий положительно заряженный металл, хлор отрицательно заряженное газообразное вещество.
Он переходит в жидкое состояние под давлением.
Он стал твердым телом с натрием и микроэлементами. Хлор в виде твердого вещества называется хлоридом.
Сколько натрия в соли?
Около 90% потребления натрия человеку поступает из хлорида натрия.
Более 75% натрия поступает от обработанных продуктов, а не из солонки.
Сколько натрия в поваренной соли?
Ниже приведены приблизительные количества натрия в заданном количестве поваренной соли:
- ¼ чайной ложки соли = 575 мг натрия
- ½ чайной ложки соли = 1,150 мг натрия
- ¾ чайной ложки соли = 1725 мг натрия
- 1 чайная ложка соли = 2 300 мг натрия
Понимание, как много натрия в поваренной соли может помочь вам принять меры и контролировать, сколько вы принимаете ее.
Знаете ли вы, насколько больше натрия (соли) в вашем рационе, чем положено.
Считают, что одна чайная ложка поваренной соли, которая представляет собой комбинацию натрия и хлорида, имеет 2325 миллиграмм (мг) натрия.
Большая часть натрия потребляется из обработанных продуктов, в то время как лишь небольшая часть добавляется во время приготовления пищи или за столом.
Ваши почки естественным образом сбалансируют количество натрия, находящегося в вашем организме для оптимального здоровья.
Когда в вашем организме натрия мало, ваши почки в основном задерживают его.
Когда в организме натрия много, почки выделяют избыток с мочой.
Но если по какой-то причине ваши почки не могут устранить достаточное количество натрия, натрий начинает накапливаться в крови.
Поскольку натрий притягивает и удерживает воду, объем вашей крови увеличивается, что заставляет ваше сердце работать быстрее и повышает давление в артериях.
Такие заболевания, как сердечная недостаточность, цирроз печени и хроническое заболевание почек способствуют разбалансировке натрия в организме.
Функции натрия в организме человека
Ваше тело нуждается в некотором количестве натрия, чтобы функционировать должным образом потому, что он:
- помогает поддерживать правильный баланс жидкости в вашем организме
- помогает передавать нервные импульсы
- влияет на сокращение и расслабление мышц
Тело не может функционировать без натрия.
Натрия хлорид другое название
Вкус в одиночку не может сказать вам, какие продукты с высоким содержанием натрия.
Например, вы не можете знать, что рогалик имеет соленый вкус, но даже кусочек хлеба из цельного зерна содержит около 100 мг натрия.
Так как вы можете сказать, какие продукты с высоким содержанием натрия?
Читайте этикетки продуктов питания.
На этикетке можно найти количество натрия в каждой порции.
В ней также перечислены ингредиенты, которые включают соль или натрий, такие как:
- глутамат натрия
- выпечки соды (также называемый бикарбонат натрия)
- порошок для выпечки
- динатрийфосфат
- альгинат натрия
- цитрат натрия
- нитрат натрия
Старайтесь избегать продуктов с более чем 200 мг натрия на порцию, и смотрите сколько порций в пакете.
Следите за натрием в своем рационе.
Содержание натрия воде
Должны ли вы быть обеспокоены натрием из умягченной воды?
Водопроводная вода содержит очень мало натрия. Количество натрия для умягчения воды зависит от ее «жесткости».
Жесткая вода содержит большое количество кальция и магния.
Некоторые системы умягчения воды замещают ионы кальция и магния ионами натрия.
Чем выше концентрация кальция и магния, тем больше натрия, необходимого для смягчения воды.
Тем не менее, добавление натрия не должно быть проблемой для большинства здоровых взрослых людей.
Уровни натрия в порции питьевой воды очень низки в большинстве систем водоснабжения. В большинстве водных систем менее 50 мг натрия на литр.
На основании этих данных, четверть литра или стакан воды будет содержать менее 12,5 мг натрия.
Тем не менее, если вы на диете с очень низким содержанием натрия, и вы обеспокоены количеством натрия в смягченной воде.
Вы можете рассмотреть систему очистки воды, которая использует хлорид калия вместо натрия.
Другим вариантом является, чтобы смягчить только горячую воду и использовать несмягченной холодную воду для питья и приготовления пищи.
В любом случае, важно иметь в виду, что большинство натрия в рационе среднего человека поступает из поваренной соли и переработанных продуктов питания.
Таким образом, лучший способ уменьшить натрия в вашем рационе путем убирания солонки со стола и обработанных пищевых продуктов.
Натрий и сердце
Как натрий влияет на сердце?
Когда есть дополнительный натрий в крови, он тянет воду в кровеносные сосуды, увеличивая общее количество (объем) крови внутри кровеносных сосудов.
Чем больше течет крови через ваши кровеносные сосуды, повышается артериальное давление.
Но есть еще много факторов, которые могут оказать влияние на кровяное давление в еще большей степени, чем ограничение натрия.
Некоторые из них включают в себя магний и калий минералы, которые вы получаете, когда едите растительную и животную пищу.
Низкоуглеводная диета снижает уровень инсулина, что заставляет почки выводить избыток натрия из организма.
Поэтому низкоуглеводные диеты являются отличным способом, чтобы снизить кровяное давление и улучшить здоровье.
И последнее, но не менее важное, физические упражнения являются очень мощным способом снижения кровяного давления, и улучшить свое здоровье.
По некоторым оценкам, если предположить, что население США будет в среднем потреблять 1500 мг / сут натрия от текущего уровня.
Это может привести к общему снижению на 25,6% кровяного давления и может с экономить 26,2 млрд $.
По другим оценкам, прогнозируется, что достижение этой цели приведет к сокращению смертности от сердечно-сосудистых заболеваний от 500000 до 1,2 млн человек в течение следующих 10 лет.
Таким образом, снижение натрия имеет огромный потенциал для снижения артериального давления, связанного с сердечно-сосудистыми заболеваниями
Хлорид натрия вред
Неужто, натрий, так действительно плох?
Есть исследования, которые показывают, что сокращение потребления натрия на самом деле приводит к улучшению здоровья?
Хлорид натрия — это… Что такое Хлорид натрия?
| Хлорид натрия | |
 | |
 | |
| Общие | |
|---|---|
| Традиционные названия | обычная соль, поваренная соль, столовая соль, пищевая соль, каменная соль, галит[1] |
| Химическая формула | NaCl |
| Физические свойства | |
| Молярная масса | 58,44277 г/моль |
| Плотность | 2,165 г/см³ |
| Термические свойства | |
| Температура плавления | 800,8 °C |
| Температура кипения | 1465 °C |
| Молярная теплоёмкость (ст. усл.) | 50,8 Дж/(моль·К) |
| Удельная теплота испарения | 170,85 кДж/моль Дж/кг |
| Удельная теплота плавления | 28,68 кДж/моль Дж/кг |
| Химические свойства | |
| pKa | 6,7–7,3 |
| Растворимость в воде | 35,6 (0 °C) 35,9 (25 °C) 39,1 (100 °C) г/100 мл |
| Растворимость в метаноле | 14,9 г/100 мл |
| Растворимость в аммиаке | 21,5 г/100 мл |
| Оптические свойства | |
| Показатель преломления | 1,5442 (589 нм) |
| Структура | |
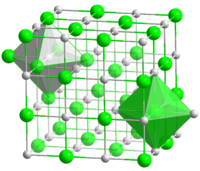
| Координационная геометрия | Октаэдральная (Na +) Октаэдральная (Cl -) |
| Кристаллическая структура | гранецентрированная кубическая, cF8 |
| Классификация | |
| Рег. номер CAS | [7647-14-5] |
| Рег. номер PubChem | 5234 |
| Рег. номер EINECS | 231-598-3 |
| SMILES | [Na+].[Cl-] |
| RTECS | VZ4725000 |
| Безопасность | |
| ЛД50 | 3000–8000 мг/кг |
| NFPA 704 |  |
Хлори́д на́трия — химическое соединение NaCl, натриевая соль соляной кислоты, хлористый натрий.
Хлорид натрия известен в быту под названием поваренной соли, основным компонентом которой он является. Хлорид натрия в значительном количестве содержится в морской воде, создавая её солёный вкус. Встречается в природе в виде минерала галита (каменная соль).
Чистый хлорид натрия имеет вид бесцветных кристаллов, но с различными примесями его цвет может принимать голубой, фиолетовый, розовый, жёлтый или серый оттенок.
Нахождение в природе и производство
В природе хлорид натрия встречается в виде минерала галита, который образует залежи каменной соли среди осадочных горных пород, прослойки и линзы на берегах солёных озёр и лиманов, соляные корки в солончаках и на стенках кратеров вулканов и в сольфатарах. Огромное количество хлорида натрия растворено в морской воде. Мировой океан содержит 4 × 10 15 тонн NaCl, то есть из каждой тысячи тонн морской воды можно получить в среднем 1,3 тонны хлорида натрия. Следы NaCl постоянно содержатся в атмосфере в результате испарения брызг морской воды. В облаках на высоте полтора километра 30 % капель, больших 10 мкм по размеру, состоят из NaCl. Также он найден в кристаллах снега[2].
Наиболее вероятно, что первое знакомство человека с солью произошло в лагунах теплых морей или на соляных озёрах, где на мелководье соленая вода интенсивно испарялась под действием высокой температуры и ветра, а в осадке накапливалась соль. По образному выражению Пифагора, «соль была рождена благородными родителями: солнцем и морем»[3].
Галит
В природе хлорид натрия чаще всего встречается в виде минерала галита. Он имеет гранецентрированную кубическую решетку и содержит 39,34 % Na, 60,66 % Cl. Другими химическими элементами, входящими в состав примесей, являются: Br, N, H, Mn, Cu, Ga, As, I, Ag, Ba, Tl, Pb, K, Ca, S, O. Плотность 2,1—2, 2 г / см ³, а твёрдость по шкале Мооса — 2. Бесцветный, прозрачный минерал, со стеклянным блеском. Распространённый минерал соленосных толщ. Образуется при осаждении в замкнутых водоёмах, а также как продукт сгона на стенках кратеров вулканов. Составляет пласты в осадочных породах лагунных и морских фаций, штокоподобные тела в соляных куполах и т. п.[4]
Каменная соль
Каменной солью называют осадочную горную породу из группы эвапоритов, состоящую более чем на 90 % из галита. Галит также часто называют каменной солью. Эта осадочная горная порода может быть бесцветной или снежно-белой, но чаще она окрашена примесями глин, талька (серый цвет), оксидами и гидроксидами железа (желтый, оранжевый, розовый, красный), битумами (бурая). Каменная соль содержит хлориды и сульфаты натрия, калия, магния и кальция, бромиды, йодиды, бораты, гипс, примеси карбонатно-глинистого материала, доломита, анкериту, магнезита, битумов и т. д.[4]
По условиям формирования месторождений каменную соль подразделяют на следующие виды[4]:
- рассолы современных соляных бассейнов
- соляные подземные воды
- залежи минеральных солей современных соляных бассейнов
- ископаемые залежи (важнейшие для промышленности).
Морская соль
Морская соль является смесью солей (хлориды, карбонаты, сульфаты и т. д.), образующейся при полном испарении морской воды. Среднее содержание солей в морской воде составляет:
| Соединение | Масс. доля, % |
|---|---|
| NaCl | 77,8 |
| MgCl2 | 10,9 |
| MgSO4 | 4,7 |
| KCl | 2,5 |
| K2SO4 | 2,5 |
| CaCO3 | 0,3 |
| Ca(HCO3)2 | 0,3 |
| другие соли | 0,2 |
 Очищенная кристаллическая морская соль
Очищенная кристаллическая морская сольПри испарении морской воды при температуре 20 — 35 ° C в осадке сначала кристаллизуются наименее растворимые соли — карбонаты кальция и магния и сульфат кальция. Затем выпадают более растворимые сульфаты натрия и магния, хлориды натрия, калия и магния, и после них — сульфаты калия и магния. Последовательность кристаллизации солей и состав осадка может несколько варьироваться в зависимости от температуры, скорости испарения и других условий. В промышленности морскую соль получают из морской воды, в основном методом обычного выпаривания. Она отличается от каменной соли значительно большим содержанием других химических солей, минералов и различных микроэлементов, в первую очередь йода, калия, магния и марганца. Соответственно, она отличается от хлорида натрия и по вкусу — горько-солёный привкус ей придают соли магния. Она используется в медицине: при лечении кожных заболеваний, таких как псориаз. Как лечебное вещество в аптечной и обычной торговой сети, распространённым продуктом является соль с Мёртвого моря. В очищенном виде этот вид соли также предлагается в продуктовой торговой сети — как натуральная и богатая йодом пищевая[5].
Залежи
Залежи каменной соли найдены во всех геологических системах. Важнейшие из них сосредоточены в кембрийских, девонских, пермских и третичных отложениях. Каменная соль составляет мощные пластовые залежи и ядра сводчатых структур (соляных куполов и штоков), образует прослойки, линзы, гнезда и вкрапления в других породах[4]. Среди озёрных месторождений России крупнейшие — Эльтонское, Баскунчак в Прикаспии, Кучукское озеро, о. Кулундинское, Эбейты и др. озера в Зап. Сибири.
Производство
В древности технология добычи соли заключалась в том, что соляную рапу вытаскивали лошадиным приводом из шахт, которые назывались «колодцами» или «окнами», и были достаточно глубокими — 60—90 м. Извлечённую соль выливали в особый резервуар — творило, откуда она через отверстия стекала в нижний резервуар, и системой желобов подавалась в деревянные башни. Там её разливали в большие чаны, на которых соль вываривали.
На Руси поморы вываривали соль на побережье Белого моря и называли её морянка. В 1137 новгородский князь Святослав определил налог на соляные варницы[6]:
 | …на мори от чрена и от салгы по пузу… |  |
[7]
Беломорской солью, называемой «морянкой», торговали по всей Российской империи до начала XX века, пока её не вытеснила более дешёвая поволжская соль.
Современная добыча хлорида натрия механизирована и автоматизирована. Соль массово добывается выпариванием морской воды (тогда её называют морской солью) или рассола с других ресурсов, таких как соляные источники и соляные озера, а также разработкой соляных шахт и добычей каменной соли. Для добычи хлорида натрия из морской воды необходимы условия жаркого климата с низкой влажностью воздуха, наличие значительных низменных территорий, лежащих ниже уровня моря, или затопляемых приливом, слабая водопроницаемость почвы испарительных бассейнов, малое количество осадков в течение сезона активного испарения, отсутствие влияния пресных речных вод и наличие развитой транспортной инфраструктуры.
Мировое производство соли в 2009 году оценивается в 260 миллионов тонн. Крупнейшими мировыми производителями являются Китай (60,0 млн тонн), США (46,0 млн тонн), Германия (16,5 млн тонн), Индия (15,8 млн тонн) и Канада (14 млн тонн)[8].
-

Добыча соли в южной части Мертвого моря, Израиль
-

Кристаллы каменной соли
-

Плантация морской соли в Дакаре
-

Соляные кучи на солончаке Уюни, Боливия
Применение
В пищевой промышленности и кулинарии
Соль повареннаяВ пищевой промышленности и кулинарии используют хлорид натрия, чистота которого должна быть не менее 97 %. Его применяют как вкусовую добавку и для консервирования пищевых продуктов. Такой хлорид натрия имеет товарное название поваренная соль, порой также употребляются названия пищевая, столовая, а также уточнение названия в зависимости от её происхождения — каменная, морская, и по составу добавок — йодированная, фторированная и т. д. Такая соль является кристаллическим сыпучим продуктом с солёным вкусом без привкуса, без запаха (за исключением йодированной соли), в котором не допускаются посторонние примеси, не связанные с методом добывании соли. Кроме хлорида натрия, поваренная соль содержит небольшое количество солей кальция, магния, калия, которые придают ей гигроскопичности и жёсткости. Чем меньше этих примесей в соли, тем выше её качество.
Выделяют сорта: экстра, высший, первый и второй. Массовая доля хлористого натрия в сортах,%:
- экстра — не менее 99,5;
- высший — 98,2;
- первый — 97,5;
- второй — 97,0.
Массовая доля влаги в выварочной соли сорта «экстра» 0,1 %, в высшем сорте — 0,7 %. Допускают добавки йодида калия (йодистого калия), йодата калия, фторидов калия и натрия. Массовая доля йода должна составлять (40,0 ± 15,0) × 10 −4 %, фтора (25,0 ± 5,0) × 10 −3 %. Цвет экстра и высшего сортов — белый, однако для первого и второго допускается серый, желтоватый, розовый и голубоватый оттенки в зависимости от происхождения соли. Пищевую поваренную соль производят молотой и сеяной. По размеру зёрен молотую соль подразделяют на номера: 0, 1, 2, 3. Чем больше номер, тем больше зерна соли.
В кулинарии хлорид натрия потребляют как важнейшую приправу. Соль имеет характерный вкус, без которого пища кажется человеку пресной. Такая особенность соли обусловлена физиологией человека. Однако зачастую люди потребляют соли больше, чем нужно для физиологических процессов.
Хлорид натрия имеет слабые антисептические свойства — 10-15 % содержание соли предотвращает размножение гнилостных бактерий. Этот факт обусловливает её широкое применение как консерванта.
В медицине
Изотонический раствор хлорида натрия в воде (0,9 %) применяется как дезинтоксикационное средство, для коррекции состояния систем организма в случае обезвоживания, как растворитель других лекарственных препаратов. Гипертонические растворы (10 % р-р) используют как вспомогательный осмотический диуретик при лёгочных, желудочных и кишечных кровотечениях для обеспечения форсированного диуреза, в состояниях, характеризующихся дефицитом ионов натрия и хлора, при отравлении нитратом серебра, для обработки гнойных ран (местно). В офтальмологии как местное средство раствор хлорида натрия обладает противоотёчным действием[9].
В коммунальном хозяйстве. Техническая соль
Зимой хлорид натрия, смешанный с другими солями, песком или глиной — так называемая техническая соль — применяется как антифриз против гололеда. Ею посыпают тротуары, хотя это отрицательно влияет на кожаную обувь и техническое состояние автотранспорта в виду коррозийных процессов.
Регенерация Nа-катионитовых фильтров
Nа-катионитовые фильтры широко применяются в котельных установках всех мощностей для смягчения воды при водоподготовке. Катионитовым материалом на современных водоподготовительных установках служат в основном глауконит, сульфанованные угли и синтетические смолы. Наиболее распространены сульфоугли.
Регенерацию Nа-катионитовых фильтров осуществляют 6—8%-м раствором поваренной соли, в результате действие сульфоуголя восстанавливается. Реакции идут по уравнениям:
- CaR2 + 2NаСl = 2NаR + CaСl2.
- МgR2 + 2NаСl = 2NаR + МgСl2.
Химическая промышленность
Соль, наряду с каменным углем, известняками и серой, образует «большую четвёрку» продуктов минерального сырья, которые являются важнейшими для химической промышленности[10]. Из неё получают соду, хлор, соляную кислоту, гидроксид натрия, сульфат натрия и металлический натрий. Кроме этого соль используется также для промышленного получения легкорастворимого в воде хлората натрия, который является средством для уничтожения сорняков[11]. Суммарное уравнение реакции электролиза горячего раствора хлорида натрия[12]:
- NaCl + 3 H2O → NaClO3 + 3 H2↑
Получение хлора и гидроксида натрия
В промышленности путём электролиза раствора хлорида натрия получают хлор. Процессы, происходящие на электродах[13][14]:
- на катоде как побочный продукт выделяется водород вследствие восстановления ионов H +, образованных в результате электролитической диссоциации воды:
- H2O ⇆ H+ + OH−
- 2 H+ + 2 e− → H2↑
- поскольку (вследствие практически полной электролитической диссоциации NaCl), хлор в растворе находится в виде хлорид-ионов, они окисляются на аноде до свободного хлора в виде газа:
- NaCl → Na+ + Cl−
- 2 Cl− − 2 e− → Cl2↑
- суммарная реакция:
- 2 NaCl + 2 H2O → 2 NaOH + Cl2↑ + H2↑
Как видно из уравнения суммарной реакции, ещё одним продуктом является гидроксид натрия. Расход электроэнергии на 1 т хлора составляет примерно 2700 кВт × час. Полученный хлор сжижается на жёлтую жидкость уже при обычной температуре[15].
Если между анодом и катодом нет диафрагмы, то растворенный в воде хлор начинает реагировать с гидроксидом натрия, образуя хлорид и гипохлорит натрия NaClO[14]:
- 2 NaOH + Cl2 → NaCl + NaClO + H2O
Поэтому для получения гидроксида натрия применяют диафрагму и соответствующий метод получения NaOH называют диафрагменным. В качестве диафрагмы применяют асбестовый картон. В процессе электролиза раствор хлорида натрия постоянно подается в анодное пространство, а из катодного пространства непрерывно вытекает раствор хлорида и гидроксида натрия. Во время выпаривания последнего хлорид кристаллизуется, поскольку его растворимость в 50 % растворе NaOH ничтожно мала (0,9 %). Полученный раствор NaOH выпаривают в железных чанах, затем сухой остаток переплавляют.
Для получения чистого гидроксида натрия (без добавок хлорида натрия) применяют ртутный метод, где используют графитовый анод и ртутный катод. Вследствие того, что перенапряжение выделения водорода на ртути очень большое, на ней вновь появляются ионы натрия и образуется амальгама натрия[14][16]:
- Na+ + e− → Na(Hg)
Амальгаму позже разлагают горячей водой с образованием гидроксида натрия и водорода, а ртуть перекачивают насосом обратно в электролизер:
- 2 Na(Hg) + 2 H2O → 2 NaOH + H2↑
Суммарная реакция процесса такая же, как и в случае диафрагменного метода.
Получение металлического натрия
Металлический натрий получают электролизом расплава хлорида натрия. Происходят следующие процессы:
- на катоде выделяется натрий:
- 2 Na+ + 2 e− → 2 Na
- на аноде выделяется хлор (как побочный продукт):
- 2 Cl− − 2 e− → Cl2
- суммарная реакция:
- 2 Na+ + 2 Cl− → 2 Na + Cl2
Ванна электролизера состоит из стального кожуха с футеровкой, графитового анода и кольцевого железного катода. Между катодом и анодом располагается сетчатая диафрагма. Для снижения температуры плавления NaCl (800 ° C), электролитом является не чистый хлорид натрия, а его смесь с хлоридом кальция CaCl 2 (40:60) с температурой плавления 580 ° C. Металлический натрий, который собирается в верхней части катодного пространства, содержит до 5 % примесь кальция, но последний со временем почти полностью отделяется, поскольку его растворимость в жидком натрии при температуре его плавления (371 ° C) составляет всего 0,01 %. С расходованием NaCl его постоянно добавляют в ванну. Затраты электроэнергии составляют примерно 15 кВт × ч на 1 кг натрия[17].
Получение соляной кислоты и сульфата натрия
Среди многих промышленных методов получения соляной кислоты, то есть водного раствора хлороводорода (HCl), применяется реакция обмена между хлоридом натрия и серной кислотой:
- NaCl + H2SO4 → NaHSO4 + HCl↑
- NaCl + NaHSO4 → Na2SO4 + HCl↑
Первая реакция происходит в значительной степени уже при обычных условиях, а при слабом нагреве идет почти до конца. Вторая происходит лишь при высоких температурах. Процесс осуществляется в специальных механизированных печах большой мощности. Хлороводород, который выделяется, обеспыливают, охлаждают и поглощают водой с образованием соляной кислоты. Как побочный продукт образуется сульфат натрия Na2SO4[18][19].
Этот метод применяется также для получения хлороводорода в лабораторных условиях.
Физические и физико-химические свойства
Температура плавления 800,8 С, кипения 1465 С.
Умеренно растворяется в воде, растворимость мало зависит от температуры: коэффициент растворимости NaCl (в г на 100 г воды) равен 35,9 при 21 °C и 38,1 при 80 °C. Растворимость хлорида натрия существенно снижается в присутствии хлороводорода, гидроксида натрия, солей — хлоридов металлов. Растворяется в жидком аммиаке, вступает в реакции обмена. В чистом виде хлорид натрия не гигроскопичен. Однако соль часто бывает загрязнена примесями (преимущественно ионами Ca 2 +, Mg 2 + и SO2−4), и такая соль на воздухе сыреет[20]. Кристаллогидрат NaCl · 2H 2 O можно выделить при температуре ниже +0,15 ° C[21].
Смесь измельченного льда с мелким порошком хлорида натрия является эффективным охладителем. Так, смесь состава 30 г NaCl на 100 г льда охлаждается до температуры −20 ° C. Это происходит потому, что водный раствор соли замерзает при температуре ниже 0 ° C. Лед, имеющий температуру около 0 ° C, плавится в таком растворе, поглощая тепло окружающей среды.
| Термодинамические характеристики | |
|---|---|
| ΔfH0g | −181,42 кДж/моль |
| ΔfH0l | −385,92 кДж/моль |
| ΔfH0s | −411,12 кДж/моль |
| ΔfH0aq | −407 кДж/моль |
| S0g, 1 bar | 229,79 Дж/(моль·K) |
| S0l, 1 bar | 95,06 Дж/(моль·K) |
| S0s | 72,11 Дж/(моль·K) |
Диэлектрическая проницаемость NaCl — 6,3
Плотность и концентрация водных растворов NaCl
| Концентрация, % | Концентрация, г/л | Плотность, г/мл |
|---|---|---|
| 1 | 10,05 | 1,005 |
| 2 | 20,25 | 1,012 |
| 4 | 41,07 | 1,027 |
| 6 | 62,47 | 1,041 |
| 8 | 84,47 | 1,056 |
| 10 | 107,1 | 1,071 |
| 12 | 130,2 | 1,086 |
| 14 | 154,1 | 1,101 |
| 16 | 178,5 | 1,116 |
| 18 | 203,7 | 1,132 |
| 20 | 229,5 | 1,148 |
| 22 | 256 | 1,164 |
| 24 | 283,2 | 1,18 |
| 26 | 311,2 | 1,197 |
Лабораторное получение и химические свойства
При действии серной кислоты выделяет хлороводород. С раствором нитрата серебра образует белый осадок хлорида серебра.
Учитывая огромные природные запасы хлорида натрия, необходимости в его промышленном или лабораторном синтезе нет. Однако, его можно получить различными химическими методами как основной или побочный продукт.
- получение из простых веществ натрия и хлора является экзотермической реакцией[22]:
- Na(тв) + 1/2Cl2(г) → NaCl(тв) + 410 кДж
- нейтрализация щелочи гидроксида натрия соляной кислотой[23]:
- NaОН + НCl → NaCl + Н2О
Поскольку хлорид натрия в водном растворе почти полностью диссоциирован на ионы: NaCl → Na+ + Cl−, его химические свойства в водном растворе определяются соответствующими химическими свойствами катионов натрия и хлорид-анионов.
Структура
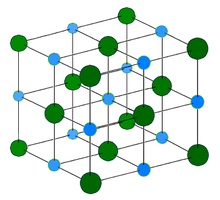 Кристаллическая решётка хлорида натрия.
Кристаллическая решётка хлорида натрия.Голубой цвет = Na+
Зелёный цвет = Cl−
Хлорид натрия образует бесцветные кристаллы кубической сингонии, пространственная группа F m3m, a = 0,563874 нм, d = 2,17 г/см³. Каждый из ионов Cl− окружен шестью ионами Na+ в октаедральний конфигурации, и наоборот. Если мысленно отбросить, например, ионы Na+, то останется плотно упакованная кубическая структура с ионов Cl−, называемая гранецентрированной кубической решеткой. Ионы Na+ тоже образуют плотно упакованную кубическую решетку. Таким образом, кристалл состоит из двух подрешеток, сдвинутых друг относительно друга на полупериод. Такая же решетка характерна для многих других минералов.
В кристаллической решетке между атомами преобладает ионная химическая связь, что является следствием действия электростатического взаимодействия противоположных по заряду ионов
См. также
Примечания
- ↑ Натрия хлорид на сайте Национального института стандартов и технологии (англ. National Institute of Standards and Technology) (англ.)
- ↑ Б. В. Некрасов. Основы общей химии. Т. 2. Изд. 3-е, испр. и доп. Москва, издательство «Химия», 1973 г. 688 с.; 270 табл.; 426 рис.; Список литературы, ссылок. С. 218
- ↑ Пифагор. Золотой канон. Фигуры эзотерики. — М.: Изд-во Эксмо, 2003. — 448 с. (Антология мудрости).
- ↑ 1 2 3 4 Малая горная энциклопедия. В 3-х т. / Под ред. В. С. Белецкого . — Донецк: «Донбасс», 2004. — ISBN 966-7804-14-3
- ↑ УНИАН: Морская соль для красоты и здоровья кожи
- ↑ Российское законодательство Х-ХХ веков. Законодательство Древней Руси. т. 1. М, 1984. С. 224—225. (рус.)
- ↑ В переводе с поморской «говори» слово чрен (црен) означает четырёхугольный ящик, кованный из листового железа, а салга — котёл, в котором варили соль. Пузом в беломорских солеварнях называли мешок соли в два четверика, то есть, объёмом около 52 литров.
- ↑ Соль (PDF), Геологический обзор США на сайте Программы минеральных ресурсов (англ.)
- ↑ Энциклопедия здоровья
- ↑ Онлайн Энциклопедия кругосвет. Натрий
- ↑ Б. В. Некрасов. Основы общей химии. Т. 1. Изд. 3-е, испр. и доп. Москва, издательство «Химия», 1973 г. 656 с.; 160 табл.; 391 рис. С. 261
- ↑ Синтез хлората натрия (англ.)
- ↑ Б. В. Некрасов. Основы общей химии. Т. 1. Изд. 3-е, испр. и доп. Москва, издательство «Химия», 1973 г. 656 с.; 160 табл.; 391 рис. С. 249
- ↑ 1 2 3 М. Л. Глинка Общая химия (Учебник), изд. 2-е изд., Перераб. и доп .. — С. 608, Киев: «Высшая школа», 1982.
- ↑ Б. В. Некрасов. Основы общей химии. Т. 1. Изд. 3-е, испр. и доп. Москва, издательство «Химия», 1973 г. 656 с.; 160 табл.; 391 рис. С. 254
- ↑ Б. В. Некрасов. Основы общей химии. Т. 2. Изд. 3-е, испр. и доп. Москва, издательство «Химия», 1973 г. 688 с.; 270 табл.; 426 рис.; Список литературы, ссылок. С. 231
- ↑ Б. В. Некрасов. Основы общей химии. Т. 2. Изд. 3-е, испр. и доп. Москва, издательство «Химия», 1973 г. 688 с.; 270 табл.; 426 рис.; Список литературы, ссылок. С. 219
- ↑ Б. В. Некрасов. Основы общей химии. Т. 1. Изд. 3-е, испр. и доп. Москва, издательство «Химия», 1973 г. 656 с.; 160 табл.; 391 рис. С. 250
- ↑ Б. В. Некрасов. Основы общей химии. Т. 1. Изд. 3-е, испр. и доп. Москва, издательство «Химия», 1973 г. 656 с.; 160 табл.; 391 рис. С. 257—258
- ↑ Б. В. Некрасов. Основы общей химии. Т. 2. Изд. 3-е, испр. и доп. Москва, издательство «Химия», 1973 г. 688 с.; 270 табл.; 426 рис.; Список литературы, ссылок. С. 215—216
- ↑ Б. В. Некрасов. Основы общей химии. Т. 2. Изд. 3-е, испр. и доп. Москва, издательство «Химия», 1973 г. 688 с.; 270 табл.; 426 рис.; Список литературы, ссылок. С. 234
- ↑ Б. В. Некрасов. Основы общей химии. Т. 1. Изд. 3-е, испр. и доп. Москва, издательство «Химия», 1973 г. 656 с.; 160 табл.; 391 рис. С. 255
- ↑ Б. В. Некрасов. Основы общей химии. Т. 1. Изд. 3-е, испр. и доп. Москва, издательство «Химия», 1973 г. 656 с.; 160 табл.; 391 рис. С. 191
Ссылки
Шаблон:АТХ код A07
Плазмозамещающие и перфузионные растворы — АТХ код: B05
| B05A |
| ||
|---|---|---|---|
| B05B |
| ||
| B05C |
| ||
| B05D |
| ||
| B05X |
| ||
| B05Z |
| Хлорид натрия | |
|---|---|
 ( ({{{картинка3D}}}) | |
 ( ({{{изображение}}}) | |
| Систематическое наименование | Хлорид натрия |
| Традиционные названия | Соль, поваренная соль, столовая соль, пищевая соль, каменная соль, галит[1] |
| Хим. формула | NaCl |
| Молярная масса | 58,44277 г/моль |
| Плотность | 2,165 г/см³ |
| Температура | |
| • плавления | 800,8 °C |
| • кипения | 1465 °C |
| Мол. теплоёмк. | 50,8 Дж/(моль·К) |
| Энтальпия | |
| • образования | −234,8 кДж/моль |
| Удельная теплота испарения | 170,85 кДж/моль |
| Удельная теплота плавления | 28,68 кДж/моль |
| Растворимость | |
| • в воде | 35,6 г/100 мл (0 °C) 35,9 г/100 мл (+25 °C) 39,1 г/100 мл (+100 °C) |
| • в метаноле | 1,49 г/100 мл |
| • в аммиаке | 21,5 г/100 мл |
| Показатель преломления | 1,544202 (589 нм) |
| Координационная геометрия | Октаэдральная (Na +) Октаэдральная (Cl -) |
| Кристаллическая структура | гранецентрированная кубическая, cF8 |
| Рег. номер CAS | 7647-14-5 |
| PubChem | 5234 |
| Рег. номер EINECS | 231-598-3 |
| SMILES | |
| InChI | |
| RTECS | VZ4725000 |
| ChEBI | 26710 |
| ChemSpider | 5044 |
Хлорид натрия: формула и применение
Всем привет!
Не так давно я рассказывала о физрастворе, его свойствах, применении и пообещала, что расскажу про основной его компонент – хлорид натрия. Начала писать статью, но увлеклась воспоминаниями об инструментах блоггинга и… получилась совсем другая статья.
Сегодня каюсь, исправляюсь и возвращаюсь к основной теме блога – химии.
Главным действующим лицом сегодняшней статьи будет хлорид натрия. Кстати, довольно интересное химическое вещество. Пусть вас не смущает его кажущаяся простота – здесь, на мой взгляд, успешно работает поговорка «Все гениальное просто».
Что это такое
Соль, да-да, самая обычная поваренная соль, которую мы употребляем в пищу, так что хлорид натрия – это физраствор и поваренная соль, самый что ни на есть природный продукт, к которому не придерется ни один хемофоб, которому нужно, чтобы все было «без химии».
И, тем не менее, это самая настоящая химия!

Это химическое вещество, в сухом виде – белые кристаллы, без запаха, с соленым вкусом, растворяется в воде. За соленый вкус отвечают именно ионы натрия, которые воздействуют на вкусовые рецепторы языка, за счет чего человек и ощущает соленый привкус.
В природе натрия хлорид — это минерал галит (от греческого слова «галос» — «соль»), а также соленая вода морей, озер и океанов. Соленая морская вода содержит около 76% этого вещества.
Например, у нас в Восточном Казахстане есть соленое озеро Алаколь, с потрясающей лечебной водой, о которой ходят только восхищенные отзывы.

Примечание: фото не мое, взято из интернета.
Вместе с тем, не менее эмоциональные отзывы, только со знаком «минус», ходят и о дороге туда. Именно это меня и пугает. Я очень плохо переношу машины и автобусы даже на хорошей дороге, меня хватает, максимум, на час-два. Так что, одна только мысль о 12-ти часах в автобусе на полуразбитой дороге вгоняет меня в ужас.
Увы, пока что страх перед дорогой пересиливает желание съездить в это чудесное место.
Что же касается минерала галита, то чаще всего он желтоватого или коричневого цвета из-за примесей, входящих в его состав. Изредка встречаются голубые кристаллы, чей цвет обусловлен примесями металлического натрия.

Примечание: фото не мое, взято из интернета.
Химические свойства хлорида натрия я долго рассказывать не буду, чтобы не слишком загружать вас формулами, упомяну только наиболее важные.
Например, способность водного раствор хлористого натрия подвергаться электролизу, то есть разложению под действием электрического тока. При этом образуются газы водород и хлор, а также гидроксид натрия.
Если же для электролиза брать не раствор, а сухое вещество, то получится металлический натрий и газообразный хлор.
Существует интересная реакция для обнаружения ионов хлора, которые входят в состав соли: взаимодействие с нитратом серебра. Происходит реакция обмена и выпадает белый осадок хлорида серебра. Химики еще называют его творожистым осадком из-за его внешнего вида:

Для чего хлорид натрия нужен в организме
Во-первых, он входит в состав крови. Много миллионов лет назад, когда первые живые организмы вышли из Мирового океана, они взяли с собой на сушу его частицу – соленый раствор, которые тек у них в венах. С тех пор этот раствор так и остался – наша соленая кровь.
Во-вторых, хлористый натрий участвует в образовании соляной кислоты, из которой состоит желудочный сок, это ее основной источник.
Регулирует водный и солевой обмен в организме, выводится, в основном, через почки.
Натрия хлорид – это один из главных электролитов в организме, ионы натрия (а также кальция, магния и многих других) участвуют в передаче нервных импульсов и сокращении мышечных волокон. Так что, если вы чувствуете слабость, сильную утомляемость, вялый тонус мышц, возможно, это следствие нехватки какого-то из этих ионов.
Ну а переизбыток ионов натрия приводит к задержке жидкости в организме и, как следствие, повышению давления.
Кроме того, хлорид натрия – это не только компонент крови, но еще слез и пота. Вот почему при обильном потоотделении необходимо увеличивать количество поступающего в организм этого вещества.
Применение
Кто сходу сможет назвать как можно больше областей применения хлорида натрия то бишь поваренной соли? Самое первое, что приходит на ум, в пищевой промышленности и в медицине.
В группе «Пирожки+» в ВКонтакте мне попалось славное стихотворение авторства Sansonnet:
захожу на кухню
а жена не спит
в борщ мне подсыпает
натрия хлорид
Думаю, те, кто никак не может запомнить формулу и химическое название пищевой соли, теперь легко смогут это сделать
Можно дополнить, что в пищевой промышленности это не только специя, придающая вкус блюдам, но и консервант. И не только в домашних заготовках типа соленых огурчиков, но и во вполне промышленных масштабах в производстве консервов, колбас, солении рыбы, грибов и многого-многого другого.
Кроме того, хлористый натрий используют в химической промышленности для получения кальцинированной соды, газообразного хлора, гидроксида натрия, хлорной извести и многого-многого другого.
Сейчас, зимой, актуально еще одно применение хлорида натрия – посыпание дорог солью для уменьшения их обледенения. Не спорю, есть специальные реагенты для этого, но достаточно часто коммунальные службы, не мудрствуя лукаво и экономя деньги, используют для этого техническую соль – смесь натрия хлорида с песком, щебнем и глиной.
Об этом я писала в группе «Занимательная химия», ссылки на которую в различных социальных сетях вы можете найти под статьей.
Применение в медицине
В основном, используются растворы трех концентраций:
- 0,9% — изотонический раствор;
- 1% и более (обычно 3, 5 и 10%) – гипертонический раствор;
- менее 0,85% — гипотонический раствор.
Вроде бы разница между цифрами небольшая, но в реальности ошибка может привести к печальным последствиям.
Про изотонический раствор (другое название – физраствор) я уже рассказывала, поэтому не буду повторяться и коротко скажу об остальных двух.
Гипертонические растворы применяются как внутривенно, так и наружно. При внутривенном применении они восполняют дефицит ионов хлора и натрия в крови и повышают кровяное давление. Наружное применение способствует выделению гноя, при этом хлорид натрия проявляет противомикробную активность.
Как ни странно, про гипотонические раствор хлорида натрия мне не удалось ничего найти. Может, кто-то из вас знает, для чего они применяются? Или подскажите, где про это можно почитать, а то прямо какой-то заговор молчания вокруг них.
Вот на этом, пожалуй, и закончу свой сегодняшний рассказ о хлориде натрия как о химическом веществе. Но на этом не заканчивается рассказ о поваренной соли! Все еще только начинается. Я уже готовлю несколько статей о ней, в том числе и подборку домашних опытов с солью, которые можно провести, не отходя далеко от источника соли, то есть вашей кухни.
Всем хорошего окончания рабочей недели!
Наталья Брянцева
KidsChemistry теперь есть и в социальных сетях. Присоединяйтесь прямо сейчас! Google+, В контакте, Одноклассники , Facebook, Twitter




