Соль натрия – польза или вред здоровью
Внимание! Предварительный просмотр слайдов используется исключительно в ознакомительных целях и может не давать представления о всех возможностях презентации. Если вас заинтересовала данная работа, пожалуйста, загрузите полную версию.
Цель:
- познакомить учащихся с информацией о значении соли натрия для нашего организма,
- продолжить формирование понятия о здоровом образе жизни
Оборудование: медиапроектор, презентация ppt
План
1. Зачем нужна соль натрия для нашего организма?
2. Суточная потребность в натрии
3. Избыток натрия в организме
4. Недостаток натрия в организме
5. Применение соли в народной медицине
6. Пословицы и поговорки о соли и народные приметы
7. Откуда организм получает соль
8. Вывод
1. Зачем нужна соль натрия для нашего организма?
Обязательными компонентами пищи являются минеральные соли, а их отсутствие или нехватка могут привести к возникновению заболеваний, или гибели организма. Известно, что человеку необходимо около 20 минеральных веществ и получает он их с продуктами питания, и с водой.
Огромное значение при этом принадлежит натрию. Основным источником натрия является поваренная соль. Роль натрия в организме человека крайне важна, ведь без него просто немыслимо нормальное состояние и рост нашего организма, он активно влияет на наш организм и сам по себе и в совокупности с другими элементами. Натрий в организме человека нужен для того, чтобы поддерживать в клетках водно-солевой баланс, нормализовывать функции почек и нервно мышечную деятельность. Натрий обеспечивает сохранение в крови минеральных веществ в растворимом состоянии. Он присутствует во всех внутренних органах, жидкостях и тканях
организма человека. Всем известно, что изотонические растворы, как кровезаменители изготавливают из поваренной соли и когда у человека большая кровопотеря, то ему вводят изотонический раствор, параллельно с кровью. Кровь, лимфа, тканевая жидкость, пищеварительные соки включают в себя натрий в виде различных солей. Кроме того, ионы натрия принимают участие в транспорте аминокислот, сахаров и калия в клетках. Ионы натрия и хлора участвуют в образовании соляной кислоты в желудке. Только благодаря натрию железо может присоединять кислород. Натрий участвует в переносе сахара крови, в каждую клетку нашего организма, это наш генератор нормального функционирования сигналов нервной системы. Ведь глюкоза является основным источником энергии для клетки. Оптимальное количество натрия к нормализации артериального давления. При взаимодействии натрия, калия и хлора создаётся электролитическая среда, обеспечивающая нервным окончаниям правильное функционирование, что способствует сокращению мышц. Натрий усиливает действие адреналина. Кроме того, натрий уменьшает риск возникновения солнечного и теплового удара, а также оказывает сосудорасширяющее действие.
Обмен натрия в нашем организме регулируется гормонами, в первую очередь альдостероном. Почки надпочечники регулируют количество хлорида натрия в нашем организме
2. Суточная потребность с соли натрия
Взрослому человеку в сутки нужно 4-6 граммов натрия. Такое количество содержится примерно в 10-15 граммах поваренной соли. У большинства людей в дневном рационе содержится 10-12г поваренной соли, хотя врачи считают, что это количество должно быть значительно меньше. Иногда человеку требуется до 20 г поваренной соли в сутки, но здесь речь может идти об экстремальных ситуациях( тяжёлый физический труд в горячем цеху, долгое пребывание на жаре)
3. Избыток соли натрия в организме
Избыток натрия в организме возникает из-за употребления большого количества солёных блюд. Он приводит к задержке жидкости в организме, что затрудняет работу сердца и почек. При переизбытке натрия характерны следующие признаки :отёки лица и ног, повышенное кровяное давление. Поэтому больным с сердечно-сосудистыми заболеваниями и болезнями почек резко ограничивают поваренную соль.
4. Недостаток соли натрия в организме
Недостаток натрия в организме встречается довольно редко. Он возникает в основном по трём причинам: недостаточное поступление с пищей, выведение с потом или мочой в большом количестве, в результате обезвоживания при пищевых отравлениях. Недостаток натрия может быть опасным для здоровья человека. Малое потребление соли приводит к сухости кожи, появлению судорог на ногах, появлению тошноты и рвоты, к понижению артериального давления и малому выделению выделяемой мочи. Появляется апатия, сонливость, нарушение сознания, ослабление мышц, снижение веса и болезненность
5. Применение соли в народной медицине .
1. Использование ванн с морской или обычной поваренной солью
2. От целлюлита растирают тело
3. Для очищения кожи лица делают маски
4. Промывают кишечник солевым раствором, после отравлений
5. При болезни суставов и радикулите
6. Промывание носа физиологическим раствором( 0,9% раствор поваренной соли)
7. Гноятся глаза — их следует промыть подсоленной водой
8. Нарывает палец- следует привязать салфетку, смоченную в крепком растворе соли
Во время Великой Отечественной войны, когда не хватало лекарств, пользовались салфетками смоченными в густом соляном растворе, их прикладывали к ранам и они быстрее заживали
Пословицы, поговорки и народные приметы о соли
Громадное значение соли и та роль, которую она занимала и занимает в жизни людей. Особенно сильно она проявляется у наших предков-славян, для которых соль считалась священной. Она являлась символом верности и дружбы, благополучия и почиталась наряду с хлебом, как источник богатства и жизни.
- Мы вместе пуд соли съели
- Без соли не обед
- Чтобы узнать человека — с ним надо пуд соли съесть
- Как стол не накрывай, а без соли не обойдёшься
- Без соли и хлеб не естся
- Помяни соль, чтоб дали хлеба
ПРИМЕТЫ:
- Подавая соль — смейся, не то поссоришься
- Нельзя передавать соль через стол
- Нельзя давать соль в долг
- Просыпать соль к ссоре
- Соль в солонке влажная — к несчастью
7. Откуда организм получает соль
Основной источник соли, как говорилось - поваренная соль, которую мы добавляем в пищу при кулинарной обработке, из хлеба и хлебобулочных изделий, из различного вида сыров, молочных продуктов, твороге, из всех мясных и рыбных блюд, колбасных изделий, сосисок, сарделек, буженины, карбоната. Особенно много соли в соусах, солениях, маринадах.
Соль натрия мы можем получать и из растений : моркови, томатах, сельдерее, артишоке, сельдерее, морской капусте, горохе, сое, фасоли, чечевице.
8 Вывод
1. Соль натрия является необходимым веществом для нормальной жизнедеятельности нашего организма.
2. Избыток и недостаток соли натрия в организме человека наносит вред нашему здоровью. Бережно относитесь к своему здоровью.
ИСТОЧНИКИ ИНФОРМАЦИИ
1. www.skalpil.ru
2. www.inflora.ru
3. www.sotvori-sebia.ru
4. www.sbornik-mudrosti.ru
5. www.o-soli.ru
6. Фотографии и картинки- www.yandex.ru
Натрий и соль 2019
Натрий против соли
Когда вы говорите соль, вы обычно относитесь к поваренной соли. Собственно, соль представляет собой хлорид натрия (NaCl), и это была большая часть человеческого существования. Археологические данные свидетельствуют о том, что соль была добыта более 8000 лет. Это даже стало очень ценным товаром, а также стало важной частью различных религиозных и культурных традиций.
Соль, по сути, стала одним из основных вкусов «этот вкус называют« соленым ». Существуют различные виды солей для потребления человеком, такие как морская соль, рафинированная соль и йодированная соль. В настоящее время люди часто используют термин «соль» как взаимозаменяемый с «натрием». Это в первую очередь связано с химическим составом соли, но, замечательно, соль, которая является хлоридом натрия, составляет всего 40 процентов натрия. Большинство (60 процентов) являются хлоридом. Несмотря на это, соль часто более тесно связана с натрием.
Натрий — это минерал или металлический элемент, который символизируется Na. Он считается основным питательным веществом, но, как и все, слишком много натрия может быть плохо для вас. Многие люди думают, что натрий поступает в основном из соли, но на самом деле натрий практически повсеместен. С солью или без соли, продукты питания, которые мы потребляем, могут все еще иметь много натрия. Обработанные продукты, морские продукты, замороженные и консервированные продукты — все они содержат натрий, чего более чем достаточно для нашего диетического пособия. Чрезмерное потребление натрия может быть очень плохо для нашего здоровья, так как это может привести к гипертонии и другим сердечно-сосудистым заболеваниям.
Когда люди отказываются от соли в своих рационах, то, что они на самом деле означают, заключается в том, что они обеспокоены потреблением натрия, потому что это убивает натрий, а не соль. Следует отметить, что даже когда люди избегают употребления соли, они все равно могут получать много натрия из других источников. Так что, по сути, оставаться в стороне от соли — НЕ единственное решение.
Рекомендуемый объем потребления натрия в сутки составляет 2400 мг. Такая рекомендация для средних здоровых взрослых, потому что люди с предрасположенными склонностями к сердечно-сосудистым заболеваниям должны потреблять меньше. То, что 2400 мг натрия можно найти в одной чайной ложке соли. Это означает, по крайней мере теоретически, что средний здоровый человек должен потреблять около одной чайной ложки соли ежедневно, чтобы заполнить их диетическое пособие. Однако это не так просто, потому что натрий также присутствует в других продуктах питания, и это, по сути, натрий, которого следует избегать.
Тем не менее, натрий по-прежнему жизненно важен в наших телах. Это помогает правильно распределять воду в наших телах и помогает поддерживать объем жидкости в клетках и тканях. Это также касается наших мышечных и неврологических функций. Тем не менее, натрий адекватно получают из сегодняшней пищи, и, возможно, лю
ru.esdifferent.com
Хлорид натрия — Википедия
| Хлорид натрия | |
 | |
 | |
| Общие | |
|---|---|
| Систематическое наименование | Хлорид натрия |
| Традиционные названия | Соль, поваренная соль, столовая соль, пищевая соль, каменная соль, галит[1] |
| Хим. формула | NaCl |
| Физические свойства | |
| Молярная масса | 58,44277 г/моль |
| Плотность | 2,165 г/см³ |
| Термические свойства | |
| Т. плав. | 800,8 °C |
| Т. кип. | 1465 °C |
| Мол. теплоёмк. | 50,8 Дж/(моль·К) |
| Энтальпия образования | −234,8 кДж/моль |
| Удельная теплота испарения | 170,85 кДж/моль |
| Удельная теплота плавления | 28,68 кДж/моль |
| Химические свойства | |
| Растворимость в воде | 35,6 г/100 мл (0 °C) 35,9 г/100 мл (+25 °C) 39,1 г/100 мл (+100 °C) |
| Растворимость в метаноле | 1,49 г/100 мл |
| Растворимость в аммиаке | 21,5 г/100 мл |
| Оптические свойства | |
| Показатель преломления | 1,544202 (589 нм) |
| Структура | |
| Координационная геометрия | Октаэдральная (Na +) Октаэдральная (Cl -) |
| Кристаллическая структура | гранецентрированная кубическая, cF8 |
| Классификация | |
| Рег. номер CAS | 7647-14-5 |
| PubChem | 5234 |
| Рег. номер EINECS | 231-598-3 |
| SMILES | |
| InChI | |
| RTECS | VZ4725000 |
| ChEBI | 26710 |
| ChemSpider | 5044 |
| Безопасность | |
| ЛД50 | 3000–8000 мг/кг |
| NFPA 704 |  |
| Приводятся данные для стандартных условий (25 °C, 100 кПа), если не указано иного. | |
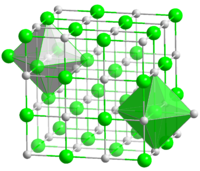
 Кристалл хлорида натрия
Кристалл хлорида натрияХлори́д на́трия или хлористый натрий (NaCl) — натриевая соль соляной кислоты. Известен в быту под названием поваренной соли, основным компонентом которой и является. Хлорид натрия в значительном количестве содержится в морской воде, придавая ей солёный вкус. Встречается в природе в виде минерала галита (каменной соли). Чистый хлорид натрия представляет собой бесцветные кристаллы, но с различными примесями его цвет может принимать голубой, фиолетовый, розовый, жёлтый или серый оттенок.
Нахождение в природе и производство
В природе хлорид натрия встречается в виде минерала галита, который образует залежи каменной соли среди осадочных горных пород, прослойки и линзы на берегах солёных озёр и лиманов, соляные корки в солончаках и на стенках кратеров вулканов и в сольфатарах. Огромное количество хлорида натрия растворено в морской воде. Мировой океан содержит 4 × 1015 тонн NaCl, то есть из каждой тонны морской воды можно получить в среднем 1,3 кг хлорида натрия. Следы NaCl постоянно содержатся в атмосфере в результате испарения брызг морской воды. В облаках на высоте полтора километра 30 % капель, больших 10 мкм по размеру, содержат NaCl. Также он найден в кристаллах снега[2].
Наиболее вероятно, что первое знакомство человека с солью произошло в лагунах тёплых морей или на соляных озёрах, где на мелководье солёная вода интенсивно испарялась под действием высокой температуры и ветра, а в осадке накапливалась соль. По образному выражению Пифагора, «соль была рождена благородными родителями: солнцем и морем»[3].
Галит
В природе хлорид натрия чаще всего встречается в виде минерала галита. Он имеет гранецентрированную кубическую решётку и содержит 39,34 % Na, 60,66 % Cl. Другими химическими элементами, входящими в состав примесей, являются: Br, N, H, Mn, Cu, Ga, As, I, Ag, Ba, Tl, Pb, K, Ca, S, O. Плотность 2,1—2, 2 г/см³, а твёрдость по шкале Мооса — 2. Бесцветный прозрачный минерал со стеклянным блеском. Распространённый минерал соленосных толщ. Образуется при осаждении в замкнутых водоёмах, а также как продукт сгона на стенках кратеров вулканов. Составляет пласты в осадочных породах лагунных и морских фаций, штокоподобные тела в соляных куполах и тому подобных.[4]
Каменная соль
Каменной солью называют осадочную горную породу из группы эвапоритов, состоящую более чем на 90 % из галита. Галит также часто называют каменной солью. Эта осадочная горная порода может быть бесцветной или снежно-белой, но чаще она окрашена примесями глин, талька (серый цвет), оксидами и гидроксидами железа (жёлтый, оранжевый, розовый, красный), битумами (бурая). Каменная соль содержит хлориды и сульфаты натрия, калия, магния и кальция, бромиды, иодиды, бораты, гипс, примеси карбонатно-глинистого материала, доломита, анкериту, магнезита, битумов и так далее[4].
По условиям формирования месторождений каменную соль подразделяют на следующие виды[4]:
- рассолы современных соляных бассейнов
- соляные подземные воды
- залежи минеральных солей современных соляных бассейнов
- ископаемые залежи (важнейшие для промышленности).
Морская соль
Морская соль является смесью солей (хлориды, карбонаты, сульфаты и т. д.), образующейся при полном испарении морской воды. Среднее содержание солей в морской воде составляет:
| Соединение | Масс. доля, % |
|---|---|
| NaCl | 77,8 |
| MgCl2 | 10,9 |
| MgSO4 | 4,7 |
| KCl | 2,5 |
| K2SO4 | 2,5 |
| CaCO3 | 0,3 |
| Ca(HCO3)2 | 0,3 |
| другие соли | 0,2 |
 Очищенная кристаллическая морская соль
Очищенная кристаллическая морская сольПри испарении морской воды при температуре от +20 до +35 °C в осадке сначала кристаллизуются наименее растворимые соли — карбонаты кальция и магния и сульфат кальция. Затем выпадают более растворимые сульфаты натрия и магния, хлориды натрия, калия и магния, и после них — сульфаты калия и магния. Последовательность кристаллизации солей и состав осадка может несколько варьироваться в зависимости от температуры, скорости испарения и других условий. В промышленности морскую соль получают из морской воды, в основном методом обычного выпаривания. Она отличается от каменной соли значительно большим содержанием других химических солей, минералов и различных микроэлементов, в первую очередь йода, калия, магния и марганца. Соответственно, она отличается от хлорида натрия и по вкусу — горько-солёный привкус ей придают соли магния. Она используется в медицине: при лечении кожных заболеваний, таких как псориаз. Как лечебное вещество в аптечной и обычной торговой сети, распространённым продуктом является соль из Мёртвого моря. В очищенном виде этот вид соли также предлагается в продуктовой торговой сети — как натуральная и богатая йодом пищевая[5].
Залежи
Залежи каменной соли найдены во всех геологических системах. Важнейшие из них сосредоточены в кембрийских, девонских, пермских и третичных отложениях. Каменная соль составляет мощные пластовые залежи и ядра сводчатых структур (соляных куполов и штоков), образует прослойки, линзы, гнезда и вкрапления в других породах[4]. Среди озёрных месторождений России крупнейшие — Эльтонское, Баскунчак в Прикаспии, Кучукское озеро, Кулундинское озеро, Эбейты и другие озёра в Западной Сибири.
Производство
В древности технология добычи соли заключалась в том, что соляную рапу (раствор) вытаскивали лошадиным приводом из шахт, которые назывались «колодцами» или «окнами», и были достаточно глубокими — 60—90 м. Извлечённый солевой раствор выливали в особый резервуар — творило, откуда она через отверстия стекала в нижний резервуар, и системой жёлобов подавалась в деревянные башни. Там её разливали в большие чаны, на которых соль вываривали.
На Руси поморы вываривали соль на побережье Белого моря и называли её морянка. В 1137 году новгородский князь Святослав определил налог на соляные варницы[6]:
 | …на мори от чрена и от салгы по пузу…[7] |  |
Беломорской солью, называемой «морянкой», торговали по всей Российской империи до начала XX века, пока её не вытеснила более дешёвая поволжская соль.
Современная добыча хлорида натрия механизирована и автоматизирована. Соль массово добывается выпариванием морской воды (тогда её называют морской солью) или рассола с других ресурсов, таких как соляные источники и соляные озера, а также разработкой соляных шахт и добычей каменной соли.
Для добычи хлорида натрия из морской воды необходимы условия жаркого климата с низкой влажностью воздуха, наличие значительных низменных территорий, лежащих ниже уровня моря, или затопляемых приливом, слабая водопроницаемость почвы испарительных бассейнов, малое количество осадков в течение сезона активного испарения, отсутствие влияния пресных речных вод и наличие развитой транспортной инфраструктуры.
Мировое производство соли в 2009 году оценивается в 260 миллионов тонн. Крупнейшими мировыми производителями являются Китай (60,0 млн тонн), США (46,0 млн тонн), Германия (16,5 млн тонн), Индия (15,8 млн тонн) и Канада (14 млн тонн)[8].
-

Добыча соли в южной части Мертвого моря, Израиль
-

Кристаллы каменной соли
-

Плантация морской соли в Дакаре
-

Соляные кучи на солончаке Уюни, Боливия
Видео по теме
Применение
В пищевой промышленности и кулинарии
Соль повареннаяВ пищевой промышленности и кулинарии используют хлорид натрия, чистота которого должна быть не менее 97 %. Его применяют как вкусовую добавку и для консервирования пищевых продуктов. Такой хлорид натрия имеет товарное название поваренная соль, порой также употребляются названия пищевая, столовая, а также уточнение названия в зависимости от её происхождения — каменная, морская, и по составу добавок — йодированная, фторированная и т. д. Такая соль является кристаллическим сыпучим продуктом с солёным вкусом без привкуса, без запаха (за исключением йодированной соли), в котором не допускаются посторонние примеси, не связанные с методом добывания соли. Кроме хлорида натрия, поваренная соль содержит небольшое количество солей кальция, магния, калия, которые придают ей гигроскопичности и жёсткости. Чем меньше этих примесей в соли, тем выше её качество.
Выделяют сорта: экстра, высший, первый и второй. Массовая доля хлористого натрия в сортах, %:
- экстра — не менее 99,5;
- высший — 98,2;
- первый — 97,5;
- второй — 97,0.
Массовая доля влаги в выварочной соли сорта «экстра» 0,1 %, в высшем сорте — 0,7 %. Допускают добавки йодида калия (йодистого калия), йодата калия, фторидов калия и натрия. Массовая доля йода должна составлять (40,0 ± 15,0) × 10−4 %, фтора (25,0 ± 5,0) × 10−3 %. Цвет экстра и высшего сортов — белый, однако для первого и второго допускается серый, желтоватый, розовый и голубоватый оттенки в зависимости от происхождения соли. Пищевую поваренную соль производят молотой и сеяной. По размеру зёрен молотую соль подразделяют на номера: 0, 1, 2, 3. Чем больше номер, тем больше зерна соли.
В кулинарии хлорид натрия потребляют как важнейшую приправу. Соль имеет характерный вкус, без которого пища кажется человеку пресной. Такая особенность соли обусловлена физиологией человека. Однако зачастую люди потребляют соли больше, чем нужно для физиологических процессов.
Хлорид натрия имеет слабые антисептические свойства — 10-15%-ное содержание соли предотвращает размножение гнилостных бактерий. Этот факт обусловливает её широкое применение как консерванта.
В медицине
Изотонический раствор хлорида натрия в воде (0,9 %) применяется как дезинтоксикационное средство, для коррекции состояния систем организма в случае обезвоживания, как растворитель других лекарственных препаратов. Гипертонические растворы (10 % раствор) используют как вспомогательный осмотический диуретик при отёке головного мозга, для поднятия давления при кровотечениях, в состояниях, характеризующихся дефицитом ионов натрия и хлора, при отравлении нитратом серебра, для обработки гнойных ран (местно). В офтальмологии как местное средство раствор хлорида натрия обладает противоотёчным действием[9].
В коммунальном хозяйстве. Техническая соль
Зимой хлорид натрия, смешанный с другими солями, песком или глиной — так называемая техническая соль — применяется как антифриз против гололёда. Ею посыпают тротуары, хотя это отрицательно влияет на кожаную обувь и техническое состояние автотранспорта ввиду коррозийных процессов.
Регенерация Nа-катионитовых фильтров
Nа-катионитовые фильтры широко применяются в установках умягчения воды всех мощностей при водоподготовке. Катионитным материалом на современных водоподготовительных установках служат в основном глауконит, полимерные ионообменные смолы и сульфированные угли. Наиболее распространены сульфокатионитные ионообменные смолы.
Регенерацию Nа-катионитовых фильтров осуществляют 6—10%-м раствором поваренной соли, в результате катионит переводится в Na-форму, регенерируется. Реакции идут по уравнениям:
- CaR2+2NaCl→2NaR+CaCl2{\displaystyle {\mathsf {CaR_{2}+2NaCl\rightarrow 2NaR+CaCl_{2}}}}
- MgR2+2NaCl→2NaR+MgCl2{\displaystyle {\mathsf {MgR_{2}+2NaCl\rightarrow 2NaR+MgCl_{2}}}}
Химическая промышленность
Соль, наряду с каменным углем, известняками и серой, образует «большую четвёрку» продуктов минерального сырья, которые являются важнейшими для химической промышленности[10]. Из неё получают соду, хлор, соляную кислоту, гидроксид натрия, сульфат натрия и металлический натрий. Кроме этого соль используется также для промышленного получения легкорастворимого в воде хлората натрия, который является средством для уничтожения сорняков[11]. Суммарное уравнение реакции электролиза горячего раствора хлорида натрия[12]:
- NaCl+3h3O→NaClO3+3h3{\displaystyle {\mathsf {NaCl+3H_{2}O\rightarrow NaClO_{3}+3H_{2}}}}
Получение хлора и гидроксида натрия
В промышленности путём электролиза раствора хлорида натрия получают хлор. Процессы, происходящие на электродах[13][14]:
- на катоде как побочный продукт выделяется водород вследствие восстановления ионов H+, образованных в результате электролитической диссоциации воды:
- h3O⇄H++OH−{\displaystyle {\mathsf {H_{2}O\rightleftarrows H^{+}+OH^{-}}}}
- 2H++2e−→h3{\displaystyle {\mathsf {2H^{+}+2e^{-}\rightarrow H_{2}}}}
- поскольку (вследствие практически полной электролитической диссоциации NaCl), хлор в растворе находится в виде хлорид-ионов, они окисляются на аноде до свободного хлора в виде газа:
- NaCl→Na++Cl−{\displaystyle {\mathsf {NaCl\rightarrow Na^{+}+Cl^{-}}}}
- 2Cl−→Cl2+2e−{\displaystyle {\mathsf {2Cl^{-}\rightarrow Cl_{2}+2e^{-}}}}
- суммарная реакция:
- 2NaCl+2h3O→2NaOH+Cl2+h3{\displaystyle {\mathsf {2NaCl+2H_{2}O\rightarrow 2NaOH+Cl_{2}+H_{2}}}}
Как видно из уравнения суммарной реакции, ещё одним продуктом является гидроксид натрия. Расход электроэнергии на 1 т хлора составляет примерно 2700 кВт × час. Полученный хлор при повышенном давлении сжижается в жёлтую жидкость уже при обычной температуре[15].
Если между анодом и катодом нет диафрагмы, то растворённый в воде хлор начинает реагировать с гидроксидом натрия, образуя хлорид и гипохлорит натрия NaClO[14]:
- 2NaOH+Cl2→NaCl+NaOCl+h3O{\displaystyle {\mathsf {2NaOH+Cl_{2}\rightarrow NaCl+NaOCl+H_{2}O}}}
Поэтому для получения гидроксида натрия применяют диафрагму и соответствующий метод получения NaOH называют диафрагменным. В качестве диафрагмы применяют асбестовый картон. В процессе электролиза раствор хлорида натрия постоянно подаётся в анодное пространство, а из катодного пространства непрерывно вытекает раствор хлорида и гидроксида натрия. Во время выпаривания последнего хлорид кристаллизуется, поскольку его растворимость в 50 % растворе NaOH крайне мала (0,9 %). Полученный раствор NaOH выпаривают в железных чанах, затем сухой остаток переплавляют.
Для получения чистого гидроксида натрия (без добавок хлорида натрия) применяют ртутный метод, где используют графитовый анод и ртутный катод. Вследствие того, что перенапряжение выделения водорода на ртути очень большое, на ней вновь появляются ионы натрия и образуется амальгама натрия[14][16]:
- Na++e−→Na(Hg){\displaystyle {\mathsf {Na^{+}+e^{-}\rightarrow Na_{(Hg)}}}}
Амальгаму позже разлагают горячей водой с образованием гидроксида натрия и водорода, а ртуть перекачивают насосом обратно в электролизер:
- 2Na(Hg)+2h3O→2NaOH+h3{\displaystyle {\mathsf {2Na_{(Hg)}+2H_{2}O\rightarrow 2NaOH+H_{2}}}}
Суммарная реакция процесса такая же, как и в случае диафрагменного метода.
Получение металлического натрия
Металлический натрий получают электролизом расплава хлорида натрия. Происходят следующие процессы:
- на катоде выделяется натрий:
- Na++e−→Na{\displaystyle {\mathsf {Na^{+}+e^{-}\rightarrow Na}}}
- на аноде выделяется хлор (как побочный продукт):
- 2Cl−→Cl2+2e−{\displaystyle {\mathsf {2Cl^{-}\rightarrow Cl_{2}+2e^{-}}}}
- суммарная реакция:
- 2Na++2Cl−→2Na+Cl2{\displaystyle {\mathsf {2Na^{+}+2Cl^{-}\rightarrow 2Na+Cl_{2}}}}
Ванна электролизера состоит из стального кожуха с футеровкой, графитового анода и кольцевого железного катода. Между катодом и анодом располагается сетчатая диафрагма. Для снижения температуры плавления NaCl (+800 °C), электролитом является не чистый хлорид натрия, а его смесь с хлоридом кальция CaCl 2 (40:60) с температурой плавления +580 °C. Металлический натрий, который собирается в верхней части катодного пространства, содержит до 5 % примесь кальция, но последний со временем почти полностью отделяется, поскольку его растворимость в жидком натрии при температуре его плавления (+371 K = 98º C) составляет всего 0,01 %. С расходованием NaCl его постоянно добавляют в ванну. Затраты электроэнергии составляют примерно 15 кВт × ч на 1 кг натрия[17].
Получение соляной кислоты и сульфата натрия
Среди многих промышленных методов получения соляной кислоты, то есть водного раствора хлороводорода (HCl), применяется реакция обмена между хлоридом натрия и серной кислотой:
- NaCl+h3SO4→NaHSO4+HCl↑{\displaystyle {\mathsf {NaCl+H_{2}SO_{4}\rightarrow NaHSO_{4}+HCl\uparrow }}}
- NaCl+NaHSO4→Na2SO4+HCl↑{\displaystyle {\mathsf {NaCl+NaHSO_{4}\rightarrow Na_{2}SO_{4}+HCl\uparrow }}}
Первая реакция происходит в значительной степени уже при обычных условиях, а при слабом нагреве идёт почти до конца. Вторая происходит лишь при высоких температурах. Процесс осуществляется в специальных механизированных печах большой мощности. Хлороводород, который выделяется, обеспыливают, охлаждают и поглощают водой с образованием соляной кислоты. Как побочный продукт образуется сульфат натрия Na2SO4[18][19].
Этот метод применяется также для получения хлороводорода в лабораторных условиях.
Физические и физико-химические свойства
Температура плавления +800,8 °С, кипения +1465 °С.
Умеренно растворяется в воде, растворимость мало зависит от температуры: коэффициент растворимости NaCl (в граммах на 100 г воды) равен 35,9 при +21 °C и 38,1 при +80 °C. Растворимость хлорида натрия существенно снижается в присутствии хлороводорода, гидроксида натрия, солей — хлоридов металлов. Растворяется в жидком аммиаке, вступает в реакции обмена. В чистом виде хлорид натрия не гигроскопичен. Однако соль часто бывает загрязнена примесями (преимущественно ионами Ca2+, Mg2+ и SO2−
4), и такая соль на воздухе сыреет[20]. Кристаллогидрат NaCl · 2H2O можно выделить при температуре ниже +0,15 °C[21].
Смесь измельчённого льда с мелким порошком хлорида натрия является эффективным охладителем. Так, смесь состава 30 г NaCl на 100 г льда охлаждается до температуры −20 °C. Это происходит потому, что водный раствор соли замерзает при температуре ниже 0 °C. Лёд, имеющий температуру около 0 °C, плавится в таком растворе, поглощая тепло окружающей среды.
| Термодинамические характеристики | |
|---|---|
| ΔfH0g | −181,42 кДж/моль |
| ΔfH0l | −385,92 кДж/моль |
| ΔfH0s | −411,12 кДж/моль |
| ΔfH0aq | −407 кДж/моль |
| S0g, 1 bar | 229,79 Дж/(моль·K) |
| S0l, 1 bar | 95,06 Дж/(моль·K) |
| S0s | 72,11 Дж/(моль·K) |
Диэлектрическая проницаемость NaCl — 6,3
Плотность и концентрация водных растворов NaCl
| Концентрация, % | Концентрация, г/л | Плотность, г/мл |
|---|---|---|
| 1 | 10,05 | 1,005 |
| 2 | 20,25 | 1,012 |
| 4 | 41,07 | 1,027 |
| 6 | 62,47 | 1,041 |
| 8 | 84,47 | 1,056 |
| 10 | 107,1 | 1,071 |
| 12 | 130,2 | 1,086 |
| 14 | 154,1 | 1,101 |
| 16 | 178,5 | 1,116 |
| 18 | 203,7 | 1,132 |
| 20 | 229,5 | 1,148 |
| 22 | 256 | 1,164 |
| 24 | 283,2 | 1,18 |
| 26 | 311,2 | 1,197 |
Лабораторное получение и химические свойства
При действии серной кислоты выделяет хлороводород.
- 2NaCl+h3SO4→Na2SO4+2HCl{\displaystyle {\mathsf {2NaCl+H_{2}SO_{4}\rightarrow Na_{2}SO_{4}+2HCl}}}
С раствором нитрата серебра образует белый осадок хлорида серебра (качественная реакция на хлорид-ион).
- NaCl+AgNO3→NaNO3+AgCl{\displaystyle {\mathsf {NaCl+AgNO_{3}\rightarrow NaNO_{3}+AgCl}}}
при смешивании с сульфатом меди в растворе получается тетрахлоркупрат натрия, при этом синий раствор зеленеет:
- CuSO4+4NaCl⇄Na2CuCl4+Na2SO4{\displaystyle {\mathsf {CuSO_{4}+4NaCl\rightleftarrows Na_{2}CuCl_{4}+Na_{2}SO_{4}}}}
Учитывая огромные природные запасы хлорида натрия, необходимости в его промышленном или лабораторном синтезе нет. Однако, его можно получить различными химическими методами как основной или побочный продукт.
- получение из простых веществ натрия и хлора является экзотермической реакцией[22]:
- 2Na+Cl2→2NaCl+410 kJ/mol{\displaystyle {\mathsf {2Na+Cl_{2}\rightarrow 2NaCl+410\ kJ/mol}}}
- нейтрализация щелочи гидроксида натрия соляной кислотой[23]:
- NaOH+HCl→NaCl+h3O{\displaystyle {\mathsf {NaOH+HCl\rightarrow NaCl+H_{2}O}}}
Поскольку хлорид натрия в водном растворе почти полностью диссоциирован на ионы:
- NaCl→Na++Cl−{\displaystyle {\mathsf {NaCl\rightarrow Na^{+}+Cl^{-}}}}
Его химические свойства в водном растворе определяются соответствующими химическими свойствами катионов натрия и хлорид-анионов.
Структура
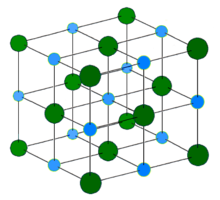 Кристаллическая решётка хлорида натрия.
Кристаллическая решётка хлорида натрия. Голубой цвет = Na+
Зелёный цвет = Cl−
Хлорид натрия образует бесцветные кристаллы кубической сингонии, пространственная группа Fm3m, параметры ячейки a = 0,563874 нм, d = 2,17 г/см3. Каждый из ионов Cl− окружён шестью ионами Na+ в октаэдрической конфигурации, и наоборот. Если мысленно отбросить, например, ионы Na+, то останется плотно упакованная кубическая структура ионов Cl−, называемая гранецентрированной кубической решёткой. Ионы Na+ тоже образуют плотно упакованную кубическую решётку. Таким образом, кристалл состоит из двух подрешёток, сдвинутых друг относительно друга на полупериод. Такая же решётка характерна для многих других минералов.
В кристаллической решётке между атомами преобладает ионная химическая связь, что является следствием действия электростатического взаимодействия противоположных по заряду ионов.
См. также
Примечания
- ↑ Натрия хлорид на сайте Национального института стандартов и технологии США (англ. National Institute of Standards and Technology) (англ.)
- ↑ Некрасов Б. В. Основы общей химии. Т. 2. Изд. 3-е, испр. и доп., М.: Химия, 1973. — 688 с.; 270 табл.; 426 рис.; Список литературы, ссылок. С. 218
- ↑ Пифагор. Золотой канон. Фигуры эзотерики. — М.: Изд-во Эксмо, 2003. — 448 с. (Антология мудрости).
- ↑ 1 2 3 4 Малая горная энциклопедия. В 3 т. = Мала гірнича енциклопедія / (На укр. яз.). Под ред. В. С. Белецкого. — Донецк: Донбасс, 2004. — ISBN 966-7804-14-3.
- ↑ УНИАН: Морская соль для красоты и здоровья кожи
- ↑ Российское законодательство Х—XX веков. Законодательство Древней Руси. Т. 1. М., 1984. С. 224—225.
- ↑ В переводе с поморской «говори» слово чрен (црен) означает четырёхугольный ящик, кованный из листового железа, а салга — котёл, в котором варили соль. Пузом в беломорских солеварнях называли мешок соли в два четверика, то есть, объёмом около 52 литров.
- ↑ Соль (PDF), Геологический обзор США на сайте Программы минеральных ресурсов (англ.)
- ↑ Энциклопедия здоровья
- ↑ Онлайн Энциклопедия кругосвет. Натрий (недоступная ссылка — история)
- ↑ Некрасов Б. В. Основы общей химии. Т. 1. Изд. 3-е, испр. и доп., М.: Химия, 1973. — 656 с.; 160 табл.; 391 рис. С. 261
- ↑ Синтез хлората натрия (англ.)
- ↑ Некрасов Б. В. Основы общей химии. Т. 1. Изд. 3-е, испр. и доп., М.: Химия, 1973. — 656 с.; 160 табл.; 391 рис. С. 249
- ↑ 1 2 3 Глинка М. Л. Общая химия (учебник), изд. 2-е изд., перераб. и доп., К.: Высшая школа, 1982. — С. 608
- ↑ Некрасов Б. В. Основы общей химии. Т. 1. Изд. 3-е, испр. и доп., М.: Химия, 1973. — 656 с.; 160 табл.; 391 рис. С. 254
- ↑ Некрасов Б. В. Основы общей химии. Т. 2. Изд. 3-е, испр. и доп., М.: Химия, 1973. — 688 с.; 270 табл.; 426 рис.; Список литературы, ссылок. С. 231
- ↑ Некрасов Б. В. Основы общей химии. Т. 2. Изд. 3-е, испр. и доп., М.: Химия, 1973. — 688 с.; 270 табл.; 426 рис.; Список литературы, ссылок. С. 219
- ↑ Некрасов Б. В. Основы общей химии. Т. 1. Изд. 3-е, испр. и доп., М.: Химия, 1973. — 656 с.; 160 табл.; 391 рис. С. 250
- ↑ Некрасов Б. В. Основы общей химии. Т. 1. Изд. 3-е, испр. и доп., М.: Химия, 1973. — 656 с.; 160 табл.; 391 рис. С. 257—258
- ↑ Некрасов Б. В. Основы общей химии. Т. 2. Изд. 3-е, испр. и доп., М.: Химия, 1973. — 688 с.; 270 табл.; 426 рис.; Список литературы, ссылок. С. 215—216
- ↑ Некрасов Б. В. Основы общей химии. Т. 2. Изд. 3-е, испр. и доп., М.: Химия, 1973. — 688 с.; 270 табл.; 426 рис.; Список литературы, ссылок. С. 234
- ↑ Некрасов Б. В. Основы общей химии. Т. 1. Изд. 3-е, испр. и доп., М.: Химия, 1973. — 656 с.; 160 табл.; 391 рис. С. 255
- ↑ Некрасов Б. В. Основы общей химии. Т. 1. Изд. 3-е, испр. и доп., М.: Химия, 1973. — 656 с.; 160 табл.; 391 рис. С. 191
Литература
- Клевцов П. В., Леммлейн Г. Г. Поправки на давление к температурам гомогенизации водных растворов NaCl // Доклады АН СССР. 1959. Т. 128. № 6. С. 1250-1253.
Ссылки
wiki2.red
Хлорид натрия — это… Что такое Хлорид натрия?
| Хлорид натрия | |
 | |
 | |
| Общие | |
|---|---|
| Традиционные названия | обычная соль, поваренная соль, столовая соль, пищевая соль, каменная соль, галит[1] |
| Химическая формула | NaCl |
| Физические свойства | |
| Молярная масса | 58,44277 г/моль |
| Плотность | 2,165 г/см³ |
| Термические свойства | |
| Температура плавления | 800,8 °C |
| Температура кипения | 1465 °C |
| Молярная теплоёмкость (ст. усл.) | 50,8 Дж/(моль·К) |
| Удельная теплота испарения | 170,85 кДж/моль Дж/кг |
| Удельная теплота плавления | 28,68 кДж/моль Дж/кг |
| Химические свойства | |
| pKa | 6,7–7,3 |
| Растворимость в воде | 35,6 (0 °C) 35,9 (25 °C) 39,1 (100 °C) г/100 мл |
| Растворимость в метаноле | 14,9 г/100 мл |
| Растворимость в аммиаке | 21,5 г/100 мл |
| Оптические свойства | |
| Показатель преломления | 1,5442 (589 нм) |
| Структура | |
| Координационная геометрия | Октаэдральная (Na +) Октаэдральная (Cl -) |
| Кристаллическая структура | гранецентрированная кубическая, cF8 |
| Классификация | |
| Рег. номер CAS | [7647-14-5] |
| Рег. номер PubChem | 5234 |
| Рег. номер EINECS | 231-598-3 |
| SMILES | [Na+].[Cl-] |
| RTECS | VZ4725000 |
| Безопасность | |
| ЛД50 | 3000–8000 мг/кг |
| NFPA 704 |  |
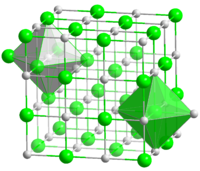
Хлори́д на́трия — химическое соединение NaCl, натриевая соль соляной кислоты, хлористый натрий.
Хлорид натрия известен в быту под названием поваренной соли, основным компонентом которой он является. Хлорид натрия в значительном количестве содержится в морской воде, создавая её солёный вкус. Встречается в природе в виде минерала галита (каменная соль).
Чистый хлорид натрия имеет вид бесцветных кристаллов, но с различными примесями его цвет может принимать голубой, фиолетовый, розовый, жёлтый или серый оттенок.
Нахождение в природе и производство
В природе хлорид натрия встречается в виде минерала галита, который образует залежи каменной соли среди осадочных горных пород, прослойки и линзы на берегах солёных озёр и лиманов, соляные корки в солончаках и на стенках кратеров вулканов и в сольфатарах. Огромное количество хлорида натрия растворено в морской воде. Мировой океан содержит 4 × 10 15 тонн NaCl, то есть из каждой тысячи тонн морской воды можно получить в среднем 1,3 тонны хлорида натрия. Следы NaCl постоянно содержатся в атмосфере в результате испарения брызг морской воды. В облаках на высоте полтора километра 30 % капель, больших 10 мкм по размеру, состоят из NaCl. Также он найден в кристаллах снега[2].
Наиболее вероятно, что первое знакомство человека с солью произошло в лагунах теплых морей или на соляных озёрах, где на мелководье соленая вода интенсивно испарялась под действием высокой температуры и ветра, а в осадке накапливалась соль. По образному выражению Пифагора, «соль была рождена благородными родителями: солнцем и морем»[3].
Галит
В природе хлорид натрия чаще всего встречается в виде минерала галита. Он имеет гранецентрированную кубическую решетку и содержит 39,34 % Na, 60,66 % Cl. Другими химическими элементами, входящими в состав примесей, являются: Br, N, H, Mn, Cu, Ga, As, I, Ag, Ba, Tl, Pb, K, Ca, S, O. Плотность 2,1—2, 2 г / см ³, а твёрдость по шкале Мооса — 2. Бесцветный, прозрачный минерал, со стеклянным блеском. Распространённый минерал соленосных толщ. Образуется при осаждении в замкнутых водоёмах, а также как продукт сгона на стенках кратеров вулканов. Составляет пласты в осадочных породах лагунных и морских фаций, штокоподобные тела в соляных куполах и т. п.[4]
Каменная соль
Каменной солью называют осадочную горную породу из группы эвапоритов, состоящую более чем на 90 % из галита. Галит также часто называют каменной солью. Эта осадочная горная порода может быть бесцветной или снежно-белой, но чаще она окрашена примесями глин, талька (серый цвет), оксидами и гидроксидами железа (желтый, оранжевый, розовый, красный), битумами (бурая). Каменная соль содержит хлориды и сульфаты натрия, калия, магния и кальция, бромиды, йодиды, бораты, гипс, примеси карбонатно-глинистого материала, доломита, анкериту, магнезита, битумов и т. д.[4]
По условиям формирования месторождений каменную соль подразделяют на следующие виды[4]:
- рассолы современных соляных бассейнов
- соляные подземные воды
- залежи минеральных солей современных соляных бассейнов
- ископаемые залежи (важнейшие для промышленности).
Морская соль
Морская соль является смесью солей (хлориды, карбонаты, сульфаты и т. д.), образующейся при полном испарении морской воды. Среднее содержание солей в морской воде составляет:
| Соединение | Масс. доля, % |
|---|---|
| NaCl | 77,8 |
| MgCl2 | 10,9 |
| MgSO4 | 4,7 |
| KCl | 2,5 |
| K2SO4 | 2,5 |
| CaCO3 | 0,3 |
| Ca(HCO3)2 | 0,3 |
| другие соли | 0,2 |
 Очищенная кристаллическая морская соль
Очищенная кристаллическая морская сольПри испарении морской воды при температуре 20 — 35 ° C в осадке сначала кристаллизуются наименее растворимые соли — карбонаты кальция и магния и сульфат кальция. Затем выпадают более растворимые сульфаты натрия и магния, хлориды натрия, калия и магния, и после них — сульфаты калия и магния. Последовательность кристаллизации солей и состав осадка может несколько варьироваться в зависимости от температуры, скорости испарения и других условий. В промышленности морскую соль получают из морской воды, в основном методом обычного выпаривания. Она отличается от каменной соли значительно большим содержанием других химических солей, минералов и различных микроэлементов, в первую очередь йода, калия, магния и марганца. Соответственно, она отличается от хлорида натрия и по вкусу — горько-солёный привкус ей придают соли магния. Она используется в медицине: при лечении кожных заболеваний, таких как псориаз. Как лечебное вещество в аптечной и обычной торговой сети, распространённым продуктом является соль с Мёртвого моря. В очищенном виде этот вид соли также предлагается в продуктовой торговой сети — как натуральная и богатая йодом пищевая[5].
Залежи
Залежи каменной соли найдены во всех геологических системах. Важнейшие из них сосредоточены в кембрийских, девонских, пермских и третичных отложениях. Каменная соль составляет мощные пластовые залежи и ядра сводчатых структур (соляных куполов и штоков), образует прослойки, линзы, гнезда и вкрапления в других породах[4]. Среди озёрных месторождений России крупнейшие — Эльтонское, Баскунчак в Прикаспии, Кучукское озеро, о. Кулундинское, Эбейты и др. озера в Зап. Сибири.
Производство
В древности технология добычи соли заключалась в том, что соляную рапу вытаскивали лошадиным приводом из шахт, которые назывались «колодцами» или «окнами», и были достаточно глубокими — 60—90 м. Извлечённую соль выливали в особый резервуар — творило, откуда она через отверстия стекала в нижний резервуар, и системой желобов подавалась в деревянные башни. Там её разливали в большие чаны, на которых соль вываривали.
На Руси поморы вываривали соль на побережье Белого моря и называли её морянка. В 1137 новгородский князь Святослав определил налог на соляные варницы[6]:
 | …на мори от чрена и от салгы по пузу… |  |
[7]
Беломорской солью, называемой «морянкой», торговали по всей Российской империи до начала XX века, пока её не вытеснила более дешёвая поволжская соль.
Современная добыча хлорида натрия механизирована и автоматизирована. Соль массово добывается выпариванием морской воды (тогда её называют морской солью) или рассола с других ресурсов, таких как соляные источники и соляные озера, а также разработкой соляных шахт и добычей каменной соли. Для добычи хлорида натрия из морской воды необходимы условия жаркого климата с низкой влажностью воздуха, наличие значительных низменных территорий, лежащих ниже уровня моря, или затопляемых приливом, слабая водопроницаемость почвы испарительных бассейнов, малое количество осадков в течение сезона активного испарения, отсутствие влияния пресных речных вод и наличие развитой транспортной инфраструктуры.
Мировое производство соли в 2009 году оценивается в 260 миллионов тонн. Крупнейшими мировыми производителями являются Китай (60,0 млн тонн), США (46,0 млн тонн), Германия (16,5 млн тонн), Индия (15,8 млн тонн) и Канада (14 млн тонн)[8].
-

Добыча соли в южной части Мертвого моря, Израиль
-

Кристаллы каменной соли
-

Плантация морской соли в Дакаре
-

Соляные кучи на солончаке Уюни, Боливия
Применение
В пищевой промышленности и кулинарии
Соль повареннаяВ пищевой промышленности и кулинарии используют хлорид натрия, чистота которого должна быть не менее 97 %. Его применяют как вкусовую добавку и для консервирования пищевых продуктов. Такой хлорид натрия имеет товарное название поваренная соль, порой также употребляются названия пищевая, столовая, а также уточнение названия в зависимости от её происхождения — каменная, морская, и по составу добавок — йодированная, фторированная и т. д. Такая соль является кристаллическим сыпучим продуктом с солёным вкусом без привкуса, без запаха (за исключением йодированной соли), в котором не допускаются посторонние примеси, не связанные с методом добывании соли. Кроме хлорида натрия, поваренная соль содержит небольшое количество солей кальция, магния, калия, которые придают ей гигроскопичности и жёсткости. Чем меньше этих примесей в соли, тем выше её качество.
Выделяют сорта: экстра, высший, первый и второй. Массовая доля хлористого натрия в сортах,%:
- экстра — не менее 99,5;
- высший — 98,2;
- первый — 97,5;
- второй — 97,0.
Массовая доля влаги в выварочной соли сорта «экстра» 0,1 %, в высшем сорте — 0,7 %. Допускают добавки йодида калия (йодистого калия), йодата калия, фторидов калия и натрия. Массовая доля йода должна составлять (40,0 ± 15,0) × 10 −4 %, фтора (25,0 ± 5,0) × 10 −3 %. Цвет экстра и высшего сортов — белый, однако для первого и второго допускается серый, желтоватый, розовый и голубоватый оттенки в зависимости от происхождения соли. Пищевую поваренную соль производят молотой и сеяной. По размеру зёрен молотую соль подразделяют на номера: 0, 1, 2, 3. Чем больше номер, тем больше зерна соли.
В кулинарии хлорид натрия потребляют как важнейшую приправу. Соль имеет характерный вкус, без которого пища кажется человеку пресной. Такая особенность соли обусловлена физиологией человека. Однако зачастую люди потребляют соли больше, чем нужно для физиологических процессов.
Хлорид натрия имеет слабые антисептические свойства — 10-15 % содержание соли предотвращает размножение гнилостных бактерий. Этот факт обусловливает её широкое применение как консерванта.
В медицине
Изотонический раствор хлорида натрия в воде (0,9 %) применяется как дезинтоксикационное средство, для коррекции состояния систем организма в случае обезвоживания, как растворитель других лекарственных препаратов. Гипертонические растворы (10 % р-р) используют как вспомогательный осмотический диуретик при лёгочных, желудочных и кишечных кровотечениях для обеспечения форсированного диуреза, в состояниях, характеризующихся дефицитом ионов натрия и хлора, при отравлении нитратом серебра, для обработки гнойных ран (местно). В офтальмологии как местное средство раствор хлорида натрия обладает противоотёчным действием[9].
В коммунальном хозяйстве. Техническая соль
Зимой хлорид натрия, смешанный с другими солями, песком или глиной — так называемая техническая соль — применяется как антифриз против гололеда. Ею посыпают тротуары, хотя это отрицательно влияет на кожаную обувь и техническое состояние автотранспорта в виду коррозийных процессов.
Регенерация Nа-катионитовых фильтров
Nа-катионитовые фильтры широко применяются в котельных установках всех мощностей для смягчения воды при водоподготовке. Катионитовым материалом на современных водоподготовительных установках служат в основном глауконит, сульфанованные угли и синтетические смолы. Наиболее распространены сульфоугли.
Регенерацию Nа-катионитовых фильтров осуществляют 6—8%-м раствором поваренной соли, в результате действие сульфоуголя восстанавливается. Реакции идут по уравнениям:
- CaR2 + 2NаСl = 2NаR + CaСl2.
- МgR2 + 2NаСl = 2NаR + МgСl2.
Химическая промышленность
Соль, наряду с каменным углем, известняками и серой, образует «большую четвёрку» продуктов минерального сырья, которые являются важнейшими для химической промышленности[10]. Из неё получают соду, хлор, соляную кислоту, гидроксид натрия, сульфат натрия и металлический натрий. Кроме этого соль используется также для промышленного получения легкорастворимого в воде хлората натрия, который является средством для уничтожения сорняков[11]. Суммарное уравнение реакции электролиза горячего раствора хлорида натрия[12]:
- NaCl + 3 H2O → NaClO3 + 3 H2↑
Получение хлора и гидроксида натрия
В промышленности путём электролиза раствора хлорида натрия получают хлор. Процессы, происходящие на электродах[13][14]:
- на катоде как побочный продукт выделяется водород вследствие восстановления ионов H +, образованных в результате электролитической диссоциации воды:
- H2O ⇆ H+ + OH−
- 2 H+ + 2 e− → H2↑
- поскольку (вследствие практически полной электролитической диссоциации NaCl), хлор в растворе находится в виде хлорид-ионов, они окисляются на аноде до свободного хлора в виде газа:
- NaCl → Na+ + Cl−
- 2 Cl− − 2 e− → Cl2↑
- суммарная реакция:
- 2 NaCl + 2 H2O → 2 NaOH + Cl2↑ + H2↑
Как видно из уравнения суммарной реакции, ещё одним продуктом является гидроксид натрия. Расход электроэнергии на 1 т хлора составляет примерно 2700 кВт × час. Полученный хлор сжижается на жёлтую жидкость уже при обычной температуре[15].
Если между анодом и катодом нет диафрагмы, то растворенный в воде хлор начинает реагировать с гидроксидом натрия, образуя хлорид и гипохлорит натрия NaClO[14]:
- 2 NaOH + Cl2 → NaCl + NaClO + H2O
Поэтому для получения гидроксида натрия применяют диафрагму и соответствующий метод получения NaOH называют диафрагменным. В качестве диафрагмы применяют асбестовый картон. В процессе электролиза раствор хлорида натрия постоянно подается в анодное пространство, а из катодного пространства непрерывно вытекает раствор хлорида и гидроксида натрия. Во время выпаривания последнего хлорид кристаллизуется, поскольку его растворимость в 50 % растворе NaOH ничтожно мала (0,9 %). Полученный раствор NaOH выпаривают в железных чанах, затем сухой остаток переплавляют.
Для получения чистого гидроксида натрия (без добавок хлорида натрия) применяют ртутный метод, где используют графитовый анод и ртутный катод. Вследствие того, что перенапряжение выделения водорода на ртути очень большое, на ней вновь появляются ионы натрия и образуется амальгама натрия[14][16]:
- Na+ + e− → Na(Hg)
Амальгаму позже разлагают горячей водой с образованием гидроксида натрия и водорода, а ртуть перекачивают насосом обратно в электролизер:
- 2 Na(Hg) + 2 H2O → 2 NaOH + H2↑
Суммарная реакция процесса такая же, как и в случае диафрагменного метода.
Получение металлического натрия
Металлический натрий получают электролизом расплава хлорида натрия. Происходят следующие процессы:
- на катоде выделяется натрий:
- 2 Na+ + 2 e− → 2 Na
- на аноде выделяется хлор (как побочный продукт):
- 2 Cl− − 2 e− → Cl2
- суммарная реакция:
- 2 Na+ + 2 Cl− → 2 Na + Cl2
Ванна электролизера состоит из стального кожуха с футеровкой, графитового анода и кольцевого железного катода. Между катодом и анодом располагается сетчатая диафрагма. Для снижения температуры плавления NaCl (800 ° C), электролитом является не чистый хлорид натрия, а его смесь с хлоридом кальция CaCl 2 (40:60) с температурой плавления 580 ° C. Металлический натрий, который собирается в верхней части катодного пространства, содержит до 5 % примесь кальция, но последний со временем почти полностью отделяется, поскольку его растворимость в жидком натрии при температуре его плавления (371 ° C) составляет всего 0,01 %. С расходованием NaCl его постоянно добавляют в ванну. Затраты электроэнергии составляют примерно 15 кВт × ч на 1 кг натрия[17].
Получение соляной кислоты и сульфата натрия
Среди многих промышленных методов получения соляной кислоты, то есть водного раствора хлороводорода (HCl), применяется реакция обмена между хлоридом натрия и серной кислотой:
- NaCl + H2SO4 → NaHSO4 + HCl↑
- NaCl + NaHSO4 → Na2SO4 + HCl↑
Первая реакция происходит в значительной степени уже при обычных условиях, а при слабом нагреве идет почти до конца. Вторая происходит лишь при высоких температурах. Процесс осуществляется в специальных механизированных печах большой мощности. Хлороводород, который выделяется, обеспыливают, охлаждают и поглощают водой с образованием соляной кислоты. Как побочный продукт образуется сульфат натрия Na2SO4[18][19].
Этот метод применяется также для получения хлороводорода в лабораторных условиях.
Физические и физико-химические свойства
Температура плавления 800,8 С, кипения 1465 С.
Умеренно растворяется в воде, растворимость мало зависит от температуры: коэффициент растворимости NaCl (в г на 100 г воды) равен 35,9 при 21 °C и 38,1 при 80 °C. Растворимость хлорида натрия существенно снижается в присутствии хлороводорода, гидроксида натрия, солей — хлоридов металлов. Растворяется в жидком аммиаке, вступает в реакции обмена. В чистом виде хлорид натрия не гигроскопичен. Однако соль часто бывает загрязнена примесями (преимущественно ионами Ca 2 +, Mg 2 + и SO2−4), и такая соль на воздухе сыреет[20]. Кристаллогидрат NaCl · 2H 2 O можно выделить при температуре ниже +0,15 ° C[21].
Смесь измельченного льда с мелким порошком хлорида натрия является эффективным охладителем. Так, смесь состава 30 г NaCl на 100 г льда охлаждается до температуры −20 ° C. Это происходит потому, что водный раствор соли замерзает при температуре ниже 0 ° C. Лед, имеющий температуру около 0 ° C, плавится в таком растворе, поглощая тепло окружающей среды.
| Термодинамические характеристики | |
|---|---|
| ΔfH0g | −181,42 кДж/моль |
| ΔfH0l | −385,92 кДж/моль |
| ΔfH0s | −411,12 кДж/моль |
| ΔfH0aq | −407 кДж/моль |
| S0g, 1 bar | 229,79 Дж/(моль·K) |
| S0l, 1 bar | 95,06 Дж/(моль·K) |
| S0s | 72,11 Дж/(моль·K) |
Диэлектрическая проницаемость NaCl — 6,3
Плотность и концентрация водных растворов NaCl
| Концентрация, % | Концентрация, г/л | Плотность, г/мл |
|---|---|---|
| 1 | 10,05 | 1,005 |
| 2 | 20,25 | 1,012 |
| 4 | 41,07 | 1,027 |
| 6 | 62,47 | 1,041 |
| 8 | 84,47 | 1,056 |
| 10 | 107,1 | 1,071 |
| 12 | 130,2 | 1,086 |
| 14 | 154,1 | 1,101 |
| 16 | 178,5 | 1,116 |
| 18 | 203,7 | 1,132 |
| 20 | 229,5 | 1,148 |
| 22 | 256 | 1,164 |
| 24 | 283,2 | 1,18 |
| 26 | 311,2 | 1,197 |
Лабораторное получение и химические свойства
При действии серной кислоты выделяет хлороводород. С раствором нитрата серебра образует белый осадок хлорида серебра.
Учитывая огромные природные запасы хлорида натрия, необходимости в его промышленном или лабораторном синтезе нет. Однако, его можно получить различными химическими методами как основной или побочный продукт.
- получение из простых веществ натрия и хлора является экзотермической реакцией[22]:
- Na(тв) + 1/2Cl2(г) → NaCl(тв) + 410 кДж
- нейтрализация щелочи гидроксида натрия соляной кислотой[23]:
- NaОН + НCl → NaCl + Н2О
Поскольку хлорид натрия в водном растворе почти полностью диссоциирован на ионы: NaCl → Na+ + Cl−, его химические свойства в водном растворе определяются соответствующими химическими свойствами катионов натрия и хлорид-анионов.
Структура
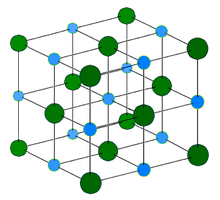 Кристаллическая решётка хлорида натрия.
Кристаллическая решётка хлорида натрия.Голубой цвет = Na+
Зелёный цвет = Cl−
Хлорид натрия образует бесцветные кристаллы кубической сингонии, пространственная группа F m3m, a = 0,563874 нм, d = 2,17 г/см³. Каждый из ионов Cl− окружен шестью ионами Na+ в октаедральний конфигурации, и наоборот. Если мысленно отбросить, например, ионы Na+, то останется плотно упакованная кубическая структура с ионов Cl−, называемая гранецентрированной кубической решеткой. Ионы Na+ тоже образуют плотно упакованную кубическую решетку. Таким образом, кристалл состоит из двух подрешеток, сдвинутых друг относительно друга на полупериод. Такая же решетка характерна для многих других минералов.
В кристаллической решетке между атомами преобладает ионная химическая связь, что является следствием действия электростатического взаимодействия противоположных по заряду ионов
См. также
Примечания
- ↑ Натрия хлорид на сайте Национального института стандартов и технологии (англ. National Institute of Standards and Technology) (англ.)
- ↑ Б. В. Некрасов. Основы общей химии. Т. 2. Изд. 3-е, испр. и доп. Москва, издательство «Химия», 1973 г. 688 с.; 270 табл.; 426 рис.; Список литературы, ссылок. С. 218
- ↑ Пифагор. Золотой канон. Фигуры эзотерики. — М.: Изд-во Эксмо, 2003. — 448 с. (Антология мудрости).
- ↑ 1 2 3 4 Малая горная энциклопедия. В 3-х т. / Под ред. В. С. Белецкого . — Донецк: «Донбасс», 2004. — ISBN 966-7804-14-3
- ↑ УНИАН: Морская соль для красоты и здоровья кожи
- ↑ Российское законодательство Х-ХХ веков. Законодательство Древней Руси. т. 1. М, 1984. С. 224—225. (рус.)
- ↑ В переводе с поморской «говори» слово чрен (црен) означает четырёхугольный ящик, кованный из листового железа, а салга — котёл, в котором варили соль. Пузом в беломорских солеварнях называли мешок соли в два четверика, то есть, объёмом около 52 литров.
- ↑ Соль (PDF), Геологический обзор США на сайте Программы минеральных ресурсов (англ.)
- ↑ Энциклопедия здоровья
- ↑ Онлайн Энциклопедия кругосвет. Натрий
- ↑ Б. В. Некрасов. Основы общей химии. Т. 1. Изд. 3-е, испр. и доп. Москва, издательство «Химия», 1973 г. 656 с.; 160 табл.; 391 рис. С. 261
- ↑ Синтез хлората натрия (англ.)
- ↑ Б. В. Некрасов. Основы общей химии. Т. 1. Изд. 3-е, испр. и доп. Москва, издательство «Химия», 1973 г. 656 с.; 160 табл.; 391 рис. С. 249
- ↑ 1 2 3 М. Л. Глинка Общая химия (Учебник), изд. 2-е изд., Перераб. и доп .. — С. 608, Киев: «Высшая школа», 1982.
- ↑ Б. В. Некрасов. Основы общей химии. Т. 1. Изд. 3-е, испр. и доп. Москва, издательство «Химия», 1973 г. 656 с.; 160 табл.; 391 рис. С. 254
- ↑ Б. В. Некрасов. Основы общей химии. Т. 2. Изд. 3-е, испр. и доп. Москва, издательство «Химия», 1973 г. 688 с.; 270 табл.; 426 рис.; Список литературы, ссылок. С. 231
- ↑ Б. В. Некрасов. Основы общей химии. Т. 2. Изд. 3-е, испр. и доп. Москва, издательство «Химия», 1973 г. 688 с.; 270 табл.; 426 рис.; Список литературы, ссылок. С. 219
- ↑ Б. В. Некрасов. Основы общей химии. Т. 1. Изд. 3-е, испр. и доп. Москва, издательство «Химия», 1973 г. 656 с.; 160 табл.; 391 рис. С. 250
- ↑ Б. В. Некрасов. Основы общей химии. Т. 1. Изд. 3-е, испр. и доп. Москва, издательство «Химия», 1973 г. 656 с.; 160 табл.; 391 рис. С. 257—258
- ↑ Б. В. Некрасов. Основы общей химии. Т. 2. Изд. 3-е, испр. и доп. Москва, издательство «Химия», 1973 г. 688 с.; 270 табл.; 426 рис.; Список литературы, ссылок. С. 215—216
- ↑ Б. В. Некрасов. Основы общей химии. Т. 2. Изд. 3-е, испр. и доп. Москва, издательство «Химия», 1973 г. 688 с.; 270 табл.; 426 рис.; Список литературы, ссылок. С. 234
- ↑ Б. В. Некрасов. Основы общей химии. Т. 1. Изд. 3-е, испр. и доп. Москва, издательство «Химия», 1973 г. 656 с.; 160 табл.; 391 рис. С. 255
- ↑ Б. В. Некрасов. Основы общей химии. Т. 1. Изд. 3-е, испр. и доп. Москва, издательство «Химия», 1973 г. 656 с.; 160 табл.; 391 рис. С. 191
Ссылки
Шаблон:АТХ код A07
Плазмозамещающие и перфузионные растворы — АТХ код: B05
| B05A |
| ||
|---|---|---|---|
| B05B |
| ||
| B05C |
| ||
| B05D |
| ||
| B05X |
| ||
| B05Z |
dic.academic.ru
Хлорид натрия — Википедия
| Хлорид натрия | |
| Общие | |
|---|---|
| Систематическое наименование | Хлорид натрия |
| Традиционные названия | Соль, поваренная соль, столовая соль, пищевая соль, каменная соль, галит[1] |
| Хим. формула | NaCl |
| Физические свойства | |
| Молярная масса | 58,44277 г/моль |
| Плотность | 2,165 г/см³ |
| Термические свойства | |
| Т. плав. | 800,8 °C |
| Т. кип. | 1465 °C |
| Мол. теплоёмк. | 50,8 Дж/(моль·К) |
| Энтальпия образования | −234,8 кДж/моль |
| Удельная теплота испарения | 170,85 кДж/моль |
| Удельная теплота плавления | 28,68 кДж/моль |
| Химические свойства | |
| Растворимость в воде | 35,6 г/100 мл (0 °C) 35,9 г/100 мл (+25 °C) 39,1 г/100 мл (+100 °C) |
| Растворимость в метаноле | 1,49 г/100 мл |
| Растворимость в аммиаке | 21,5 г/100 мл |
| Оптические свойства | |
| Показатель преломления | 1,544202 (589 нм) |
| Структура | |
| Координационная геометрия | Октаэдральная (Na +) Октаэдральная (Cl -) |
| Кристаллическая структура | гранецентрированная кубическая, cF8 |
| Классификация | |
| Рег. номер CAS | 7647-14-5 |
| PubChem | 5234 |
| Рег. номер EINECS | 231-598-3 |
| SMILES | |
| InChI | |
| RTECS | VZ4725000 |
| ChEBI | 26710 |
| ChemSpider | 5044 |
| Безопасность | |
| ЛД50 | 3000–8000 мг/кг |
| NFPA 704 | |
| Приводятся данные для стандартных условий (25 °C, 100 кПа), если не указано иного. | |
Хлори́д на́трия или хлористый натрий (NaCl) — натриевая соль соляной кислоты. Известен в быту под названием поваренной соли, основным компонентом которой и является. Хлорид натрия в значительном количестве содержится в морской воде, придавая ей солёный вкус. Встречается в природе в виде минерала галита (каменной соли). Чистый хлорид натрия представляет собой бесцветные кристаллы, но с различными примесями его цвет может принимать голубой, фиолетовый, розовый, жёлтый или серый оттенок.
Нахождение в природе и производство
В природе хлорид натрия встречается в виде минерала галита, который образует залежи каменной соли среди осадочных горных пород, прослойки и линзы на берегах солёных озёр и лиманов, соляные корки в солончаках и на стенках кратеров вулканов и в сольфатарах. Огромное количество хлорида натрия растворено в морской воде. Мировой океан содержит 4 × 1015 тонн NaCl, то есть из каждой тонны морской воды можно получить в среднем 1,3 кг хлорида натрия. Следы NaCl постоянно содержатся в атмосфере в результате испарения брызг морской воды. В облаках на высоте полтора километра 30 % капель, больших 10 мкм по размеру, содержат NaCl. Также он найден в кристаллах снега[2].
Наиболее вероятно, что первое знакомство человека с солью произошло в лагунах тёплых морей или на соляных озёрах, где на мелководье солёная вода интенсивно испарялась под действием высокой температуры и ветра, а в осадке накапливалась соль. По образному выражению Пифагора, «соль была рождена благородными родителями: солнцем и морем»[3].
Галит
В природе хлорид натрия чаще всего встречается в виде минерала галита. Он имеет гранецентрированную кубическую решётку и содержит 39,34 % Na, 60,66 % Cl. Другими химическими элементами, входящими в состав примесей, являются: Br, N, H, Mn, Cu, Ga, As, I, Ag, Ba, Tl, Pb, K, Ca, S, O. Плотность 2,1—2, 2 г/см³, а твёрдость по шкале Мооса — 2. Бесцветный прозрачный минерал со стеклянным блеском. Распространённый минерал соленосных толщ. Образуется при осаждении в замкнутых водоёмах, а также как продукт сгона на стенках кратеров вулканов. Составляет пласты в осадочных породах лагунных и морских фаций, штокоподобные тела в соляных куполах и тому подобных.[4]
Каменная соль
Каменной солью называют осадочную горную породу из группы эвапоритов, состоящую более чем на 90 % из галита. Галит также часто называют каменной солью. Эта осадочная горная порода может быть бесцветной или снежно-белой, но чаще она окрашена примесями глин, талька (серый цвет), оксидами и гидроксидами железа (жёлтый, оранжевый, розовый, красный), битумами (бурая). Каменная соль содержит хлориды и сульфаты натрия, калия, магния и кальция, бромиды, иодиды, бораты, гипс, примеси карбонатно-глинистого материала, доломита, анкериту, магнезита, битумов и так далее[4].
По условиям формирования месторождений каменную соль подразделяют на следующие виды[4]:
- рассолы современных соляных бассейнов
- соляные подземные воды
- залежи минеральных солей современных соляных бассейнов
- ископаемые залежи (важнейшие для промышленности).
Морская соль
Морская соль является смесью солей (хлориды, карбонаты, сульфаты и т. д.), образующейся при полном испарении морской воды. Среднее содержание солей в морской воде составляет:
| Соединение | Масс. доля, % |
|---|---|
| NaCl | 77,8 |
| MgCl2 | 10,9 |
| MgSO4 | 4,7 |
| KCl | 2,5 |
| K2SO4 | 2,5 |
| CaCO3 | 0,3 |
| Ca(HCO3)2 | 0,3 |
| другие соли | 0,2 |
При испарении морской воды при температуре от +20 до +35 °C в осадке сначала кристаллизуются наименее растворимые соли — карбонаты кальция и магния и сульфат кальция. Затем выпадают более растворимые сульфаты натрия и магния, хлориды натрия, калия и магния, и после них — сульфаты калия и магния. Последовательность кристаллизации солей и состав осадка может несколько варьироваться в зависимости от температуры, скорости испарения и других условий. В промышленности морскую соль получают из морской воды, в основном методом обычного выпаривания. Она отличается от каменной соли значительно большим содержанием других химических солей, минералов и различных микроэлементов, в первую очередь йода, калия, магния и марганца. Соответственно, она отличается от хлорида натрия и по вкусу — горько-солёный привкус ей придают соли магния. Она используется в медицине: при лечении кожных заболеваний, таких как псориаз. Как лечебное вещество в аптечной и обычной торговой сети, распространённым продуктом является соль из Мёртвого моря. В очищенном виде этот вид соли также предлагается в продуктовой торговой сети — как натуральная и богатая йодом пищевая[5].
Залежи
Залежи каменной соли найдены во всех геологических системах. Важнейшие из них сосредоточены в кембрийских, девонских, пермских и третичных отложениях. Каменная соль составляет мощные пластовые залежи и ядра сводчатых структур (соляных куполов и штоков), образует прослойки, линзы, гнезда и вкрапления в других породах[4]. Среди озёрных месторождений России крупнейшие — Эльтонское, Баскунчак в Прикаспии, Кучукское озеро, Кулундинское озеро, Эбейты и другие озёра в Западной Сибири.
Производство
В древности технология добычи соли заключалась в том, что соляную рапу (раствор) вытаскивали лошадиным приводом из шахт, которые назывались «колодцами» или «окнами», и были достаточно глубокими — 60—90 м. Извлечённый солевой раствор выливали в особый резервуар — творило, откуда она через отверстия стекала в нижний резервуар, и системой жёлобов подавалась в деревянные башни. Там её разливали в большие чаны, на которых соль вываривали.
На Руси поморы вываривали соль на побережье Белого моря и называли её морянка. В 1137 году новгородский князь Святослав определил налог на соляные варницы[6]:
| …на мори от чрена и от салгы по пузу…[7] |
Беломорской солью, называемой «морянкой», торговали по всей Российской империи до начала XX века, пока её не вытеснила более дешёвая поволжская соль.
Современная добыча хлорида натрия механизирована и автоматизирована. Соль массово добывается выпариванием морской воды (тогда её называют морской солью) или рассола с других ресурсов, таких как соляные источники и соляные озера, а также разработкой соляных шахт и добычей каменной соли.
Для добычи хлорида натрия из морской воды необходимы условия жаркого климата с низкой влажностью воздуха, наличие значительных низменных территорий, лежащих ниже уровня моря, или затопляемых приливом, слабая водопроницаемость почвы испарительных бассейнов, малое количество осадков в течение сезона активного испарения, отсутствие влияния пресных речных вод и наличие развитой транспортной инфраструктуры.
Мировое производство соли в 2009 году оценивается в 260 миллионов тонн. Крупнейшими мировыми производителями являются Китай (60,0 млн тонн), США (46,0 млн тонн), Германия (16,5 млн тонн), Индия (15,8 млн тонн) и Канада (14 млн тонн)[8].
Добыча соли в южной части Мертвого моря, Израиль
Кристаллы каменной соли
Плантация морской соли в Дакаре
Соляные кучи на солончаке Уюни, Боливия
Применение
В пищевой промышленности и кулинарии
Соль повареннаяВ пищевой промышленности и кулинарии используют хлорид натрия, чистота которого должна быть не менее 97 %. Его применяют как вкусовую добавку и для консервирования пищевых продуктов. Такой хлорид натрия имеет товарное название поваренная соль, порой также употребляются названия пищевая, столовая, а также уточнение названия в зависимости от её происхождения — каменная, морская, и по составу добавок — йодированная, фторированная и т. д. Такая соль является кристаллическим сыпучим продуктом с солёным вкусом без привкуса, без запаха (за исключением йодированной соли), в котором не допускаются посторонние примеси, не связанные с методом добывания соли. Кроме хлорида натрия, поваренная соль содержит небольшое количество солей кальция, магния, калия, которые придают ей гигроскопичности и жёсткости. Чем меньше этих примесей в соли, тем выше её качество.
Выделяют сорта: экстра, высший, первый и второй. Массовая доля хлористого натрия в сортах, %:
- экстра — не менее 99,5;
- высший — 98,2;
- первый — 97,5;
- второй — 97,0.
Массовая доля влаги в выварочной соли сорта «экстра» 0,1 %, в высшем сорте — 0,7 %. Допускают добавки йодида калия (йодистого калия), йодата калия, фторидов калия и натрия. Массовая доля йода должна составлять (40,0 ± 15,0) × 10−4 %, фтора (25,0 ± 5,0) × 10−3 %. Цвет экстра и высшего сортов — белый, однако для первого и второго допускается серый, желтоватый, розовый и голубоватый оттенки в зависимости от происхождения соли. Пищевую поваренную соль производят молотой и сеяной. По размеру зёрен молотую соль подразделяют на номера: 0, 1, 2, 3. Чем больше номер, тем больше зерна соли.
В кулинарии хлорид натрия потребляют как важнейшую приправу. Соль имеет характерный вкус, без которого пища кажется человеку пресной. Такая особенность соли обусловлена физиологией человека. Однако зачастую люди потребляют соли больше, чем нужно для физиологических процессов.
Хлорид натрия имеет слабые антисептические свойства — 10-15%-ное содержание соли предотвращает размножение гнилостных бактерий. Этот факт обусловливает её широкое применение как консерванта.
В медицине
Изотонический раствор хлорида натрия в воде (0,9 %) применяется как дезинтоксикационное средство, для коррекции состояния систем организма в случае обезвоживания, как растворитель других лекарственных препаратов. Гипертонические растворы (10 % раствор) используют как вспомогательный осмотический диуретик при отёке головного мозга, для поднятия давления при кровотечениях, в состояниях, характеризующихся дефицитом ионов натрия и хлора, при отравлении нитратом серебра, для обработки гнойных ран (местно). В офтальмологии как местное средство раствор хлорида натрия обладает противоотёчным действием[9].
В коммунальном хозяйстве. Техническая соль
Зимой хлорид натрия, смешанный с другими солями, песком или глиной — так называемая техническая соль — применяется как антифриз против гололёда. Ею посыпают тротуары, хотя это отрицательно влияет на кожаную обувь и техническое состояние автотранспорта ввиду коррозийных процессов.
Регенерация Nа-катионитовых фильтров
Nа-катионитовые фильтры широко применяются в установках умягчения воды всех мощностей при водоподготовке. Катионитным материалом на современных водоподготовительных установках служат в основном глауконит, полимерные ионообменные смолы и сульфированные угли. Наиболее распространены сульфокатионитные ионообменные смолы.
Регенерацию Nа-катионитовых фильтров осуществляют 6—10%-м раствором поваренной соли, в результате катионит переводится в Na-форму, регенерируется. Реакции идут по уравнениям:
- CaR2+2NaCl→2NaR+CaCl2{\displaystyle {\mathsf {CaR_{2}+2NaCl\rightarrow 2NaR+CaCl_{2}}}}
- MgR2+2NaCl→2NaR+MgCl2{\displaystyle {\mathsf {MgR_{2}+2NaCl\rightarrow 2NaR+MgCl_{2}}}}
Химическая промышленность
Соль, наряду с каменным углем, известняками и серой, образует «большую четвёрку» продуктов минерального сырья, которые являются важнейшими для химической промышленности[10]. Из неё получают соду, хлор, соляную кислоту, гидроксид натрия, сульфат натрия и металлический натрий. Кроме этого соль используется также для промышленного получения легкорастворимого в воде хлората натрия, который является средством для уничтожения сорняков[11]. Суммарное уравнение реакции электролиза горячего раствора хлорида натрия[12]:
- NaCl+3h3O→NaClO3+3h3{\displaystyle {\mathsf {NaCl+3H_{2}O\rightarrow NaClO_{3}+3H_{2}}}}
Получение хлора и гидроксида натрия
В промышленности путём электролиза раствора хлорида натрия получают хлор. Процессы, происходящие на электродах[13][14]:
- на катоде как побочный продукт выделяется водород вследствие восстановления ионов H+, образованных в результате электролитической диссоциации воды:
- h3O⇄H++OH−{\displaystyle {\mathsf {H_{2}O\rightleftarrows H^{+}+OH^{-}}}}
- 2H++2e−→h3{\displaystyle {\mathsf {2H^{+}+2e^{-}\rightarrow H_{2}}}}
- поскольку (вследствие практически полной электролитической диссоциации NaCl), хлор в растворе находится в виде хлорид-ионов, они окисляются на аноде до свободного хлора в виде газа:
- NaCl→Na++Cl−{\displaystyle {\mathsf {NaCl\rightarrow Na^{+}+Cl^{-}}}}
- 2Cl−→Cl2+2e−{\displaystyle {\mathsf {2Cl^{-}\rightarrow Cl_{2}+2e^{-}}}}
- суммарная реакция:
- 2NaCl+2h3O→2NaOH+Cl2+h3{\displaystyle {\mathsf {2NaCl+2H_{2}O\rightarrow 2NaOH+Cl_{2}+H_{2}}}}
Как видно из уравнения суммарной реакции, ещё одним продуктом является гидроксид натрия. Расход электроэнергии на 1 т хлора составляет примерно 2700 кВт × час. Полученный хлор при повышенном давлении сжижается в жёлтую жидкость уже при обычной температуре[15].
Если между анодом и катодом нет диафрагмы, то растворённый в воде хлор начинает реагировать с гидроксидом натрия, образуя хлорид и гипохлорит натрия NaClO[14]:
- 2NaOH+Cl2→NaCl+NaOCl+h3O{\displaystyle {\mathsf {2NaOH+Cl_{2}\rightarrow NaCl+NaOCl+H_{2}O}}}
Поэтому для получения гидроксида натрия применяют диафрагму и соответствующий метод получения NaOH называют диафрагменным. В качестве диафрагмы применяют асбестовый картон. В процессе электролиза раствор хлорида натрия постоянно подаётся в анодное пространство, а из катодного пространства непрерывно вытекает раствор хлорида и гидроксида натрия. Во время выпаривания последнего хлорид кристаллизуется, поскольку его растворимость в 50 % растворе NaOH крайне мала (0,9 %). Полученный раствор NaOH выпаривают в железных чанах, затем сухой остаток переплавляют.
Для получения чистого гидроксида натрия (без добавок хлорида натрия) применяют ртутный метод, где используют графитовый анод и ртутный катод. Вследствие того, что перенапряжение выделения водорода на ртути очень большое, на ней вновь появляются ионы натрия и образуется амальгама натрия[14][16]:
- Na++e−→Na(Hg){\displaystyle {\mathsf {Na^{+}+e^{-}\rightarrow Na_{(Hg)}}}}
Амальгаму позже разлагают горячей водой с образованием гидроксида натрия и водорода, а ртуть перекачивают насосом обратно в электролизер:
- 2Na(Hg)+2h3O→2NaOH+h3{\displaystyle {\mathsf {2Na_{(Hg)}+2H_{2}O\rightarrow 2NaOH+H_{2}}}}
Суммарная реакция процесса такая же, как и в случае диафрагменного метода.
Получение металлического натрия
Металлический натрий получают электролизом расплава хлорида натрия. Происходят следующие процессы:
- на катоде выделяется натрий:
- Na++e−→Na{\displaystyle {\mathsf {Na^{+}+e^{-}\rightarrow Na}}}
- на аноде выделяется хлор (как побочный продукт):
- 2Cl−→Cl2+2e−{\displaystyle {\mathsf {2Cl^{-}\rightarrow Cl_{2}+2e^{-}}}}
- суммарная реакция:
- 2Na++2Cl−→2Na+Cl2{\displaystyle {\mathsf {2Na^{+}+2Cl^{-}\rightarrow 2Na+Cl_{2}}}}
Ванна электролизера состоит из стального кожуха с футеровкой, графитового анода и кольцевого железного катода. Между катодом и анодом располагается сетчатая диафрагма. Для снижения температуры плавления NaCl (+800 °C), электролитом является не чистый хлорид натрия, а его смесь с хлоридом кальция CaCl 2 (40:60) с температурой плавления +580 °C. Металлический натрий, который собирается в верхней части катодного пространства, содержит до 5 % примесь кальция, но последний со временем почти полностью отделяется, поскольку его растворимость в жидком натрии при температуре его плавления (+371 K = 98º C) составляет всего 0,01 %. С расходованием NaCl его постоянно добавляют в ванну. Затраты электроэнергии составляют примерно 15 кВт × ч на 1 кг натрия[17].
Получение соляной кислоты и сульфата натрия
Среди многих промышленных методов получения соляной кислоты, то есть водного раствора хлороводорода (HCl), применяется реакция обмена между хлоридом натрия и серной кислотой:
- NaCl+h3SO4→NaHSO4+HCl↑{\displaystyle {\mathsf {NaCl+H_{2}SO_{4}\rightarrow NaHSO_{4}+HCl\uparrow }}}
- NaCl+NaHSO4→Na2SO4+HCl↑{\displaystyle {\mathsf {NaCl+NaHSO_{4}\rightarrow Na_{2}SO_{4}+HCl\uparrow }}}
Первая реакция происходит в значительной степени уже при обычных условиях, а при слабом нагреве идёт почти до конца. Вторая происходит лишь при высоких температурах. Процесс осуществляется в специальных механизированных печах большой мощности. Хлороводород, который выделяется, обеспыливают, охлаждают и поглощают водой с образованием соляной кислоты. Как побочный продукт образуется сульфат натрия Na2SO4[18][19].
Этот метод применяется также для получения хлороводорода в лабораторных условиях.
Физические и физико-химические свойства
Температура плавления +800,8 °С, кипения +1465 °С.
Умеренно растворяется в воде, растворимость мало зависит от температуры: коэффициент растворимости NaCl (в граммах на 100 г воды) равен 35,9 при +21 °C и 38,1 при +80 °C. Растворимость хлорида натрия существенно снижается в присутствии хлороводорода, гидроксида натрия, солей — хлоридов металлов. Растворяется в жидком аммиаке, вступает в реакции обмена. В чистом виде хлорид натрия не гигроскопичен. Однако соль часто бывает загрязнена примесями (преимущественно ионами Ca2+, Mg2+ и SO2−
4), и такая соль на воздухе сыреет[20]. Кристаллогидрат NaCl · 2H2O можно выделить при температуре ниже +0,15 °C[21].
Смесь измельчённого льда с мелким порошком хлорида натрия является эффективным охладителем. Так, смесь состава 30 г NaCl на 100 г льда охлаждается до температуры −20 °C. Это происходит потому, что водный раствор соли замерзает при температуре ниже 0 °C. Лёд, имеющий температуру около 0 °C, плавится в таком растворе, поглощая тепло окружающей среды.
| Термодинамические характеристики | |
|---|---|
| ΔfH0g | −181,42 кДж/моль |
| ΔfH0l | −385,92 кДж/моль |
| ΔfH0s | −411,12 кДж/моль |
| ΔfH0aq | −407 кДж/моль |
| S0g, 1 bar | 229,79 Дж/(моль·K) |
| S0l, 1 bar | 95,06 Дж/(моль·K) |
| S0s | 72,11 Дж/(моль·K) |
Диэлектрическая проницаемость NaCl — 6,3
Плотность и концентрация водных растворов NaCl
| Концентрация, % | Концентрация, г/л | Плотность, г/мл |
|---|---|---|
| 1 | 10,05 | 1,005 |
| 2 | 20,25 | 1,012 |
| 4 | 41,07 | 1,027 |
| 6 | 62,47 | 1,041 |
| 8 | 84,47 | 1,056 |
| 10 | 107,1 | 1,071 |
| 12 | 130,2 | 1,086 |
| 14 | 154,1 | 1,101 |
| 16 | 178,5 | 1,116 |
| 18 | 203,7 | 1,132 |
| 20 | 229,5 | 1,148 |
| 22 | 256 | 1,164 |
| 24 | 283,2 | 1,18 |
| 26 | 311,2 | 1,197 |
Лабораторное получение и химические свойства
При действии серной кислоты выделяет хлороводород.
- 2NaCl+h3SO4→Na2SO4+2HCl{\displaystyle {\mathsf {2NaCl+H_{2}SO_{4}\rightarrow Na_{2}SO_{4}+2HCl}}}
С раствором нитрата серебра образует белый осадок хлорида серебра (качественная реакция на хлорид-ион).
- NaCl+AgNO3→NaNO3+AgCl{\displaystyle {\mathsf {NaCl+AgNO_{3}\rightarrow NaNO_{3}+AgCl}}}
при смешивании с сульфатом меди в растворе получается тетрахлоркупрат натрия, при этом синий раствор зеленеет:
- CuSO4+4NaCl⇄Na2CuCl4+Na2SO4{\displaystyle {\mathsf {CuSO_{4}+4NaCl\rightleftarrows Na_{2}CuCl_{4}+Na_{2}SO_{4}}}}
Учитывая огромные природные запасы хлорида натрия, необходимости в его промышленном или лабораторном синтезе нет. Однако, его можно получить различными химическими методами как основной или побочный продукт.
- получение из простых веществ натрия и хлора является экзотермической реакцией[22]:
- 2Na+Cl2→2NaCl+410 kJ/mol{\displaystyle {\mathsf {2Na+Cl_{2}\rightarrow 2NaCl+410\ kJ/mol}}}
- нейтрализация щелочи гидроксида натрия соляной кислотой[23]:
- NaOH+HCl→NaCl+h3O{\displaystyle {\mathsf {NaOH+HCl\rightarrow NaCl+H_{2}O}}}
Поскольку хлорид натрия в водном растворе почти полностью диссоциирован на ионы:
- NaCl→Na++Cl−{\displaystyle {\mathsf {NaCl\rightarrow Na^{+}+Cl^{-}}}}
Его химические свойства в водном растворе определяются соответствующими химическими свойствами катионов натрия и хлорид-анионов.
Структура
Кристаллическая решётка хлорида натрия.Голубой цвет = Na+
Зелёный цвет = Cl−
Хлорид натрия образует бесцветные кристаллы кубической сингонии, пространственная группа Fm3m, параметры ячейки a = 0,563874 нм, d = 2,17 г/см3. Каждый из ионов Cl− окружён шестью ионами Na+ в октаэдрической конфигурации, и наоборот. Если мысленно отбросить, например, ионы Na+, то останется плотно упакованная кубическая структура ионов Cl−, называемая гранецентрированной кубической решёткой. Ионы Na+ тоже образуют плотно упакованную кубическую решётку. Таким образом, кристалл состоит из двух подрешёток, сдвинутых друг относительно друга на полупериод. Такая же решётка характерна для многих других минералов.
В кристаллической решётке между атомами преобладает ионная химическая связь, что является следствием действия электростатического взаимодействия противоположных по заряду ионов.
См. также
Примечания
- ↑ Натрия хлорид на сайте Национального института стандартов и технологии США (англ. National Institute of Standards and Technology) (англ.)
- ↑ Некрасов Б. В. Основы общей химии. Т. 2. Изд. 3-е, испр. и доп., М.: Химия, 1973. — 688 с.; 270 табл.; 426 рис.; Список литературы, ссылок. С. 218
- ↑ Пифагор. Золотой канон. Фигуры эзотерики. — М.: Изд-во Эксмо, 2003. — 448 с. (Антология мудрости).
- ↑ 1 2 3 4 Малая горная энциклопедия. В 3 т. = Мала гірнича енциклопедія / (На укр. яз.). Под ред. В. С. Белецкого. — Донецк: Донбасс, 2004. — ISBN 966-7804-14-3.
- ↑ УНИАН: Морская соль для красоты и здоровья кожи
- ↑ Российское законодательство Х—XX веков. Законодательство Древней Руси. Т. 1. М., 1984. С. 224—225.
- ↑ В переводе с поморской «говори» слово чрен (црен) означает четырёхугольный ящик, кованный из листового железа, а салга — котёл, в котором варили соль. Пузом в беломорских солеварнях называли мешок соли в два четверика, то есть, объёмом около 52 литров.
- ↑ Соль (PDF), Геологический обзор США на сайте Программы минеральных ресурсов (англ.)
- ↑ Энциклопедия здоровья
- ↑ Онлайн Энциклопедия кругосвет. Натрий (недоступная ссылка — история)
- ↑ Некрасов Б. В. Основы общей химии. Т. 1. Изд. 3-е, испр. и доп., М.: Химия, 1973. — 656 с.; 160 табл.; 391 рис. С. 261
- ↑ Синтез хлората натрия (англ.)
- ↑ Некрасов Б. В. Основы общей химии. Т. 1. Изд. 3-е, испр. и доп., М.: Химия, 1973. — 656 с.; 160 табл.; 391 рис. С. 249
- ↑ 1 2 3 Глинка М. Л. Общая химия (учебник), изд. 2-е изд., перераб. и доп., К.: Высшая школа, 1982. — С. 608
- ↑ Некрасов Б. В. Основы общей химии. Т. 1. Изд. 3-е, испр. и доп., М.: Химия, 1973. — 656 с.; 160 табл.; 391 рис. С. 254
- ↑ Некрасов Б. В. Основы общей химии. Т. 2. Изд. 3-е, испр. и доп., М.: Химия, 1973. — 688 с.; 270 табл.; 426 рис.; Список литературы, ссылок. С. 231
- ↑ Некрасов Б. В. Основы общей химии. Т. 2. Изд. 3-е, испр. и доп., М.: Химия, 1973. — 688 с.; 270 табл.; 426 рис.; Список литературы, ссылок. С. 219
- ↑ Некрасов Б. В. Основы общей химии. Т. 1. Изд. 3-е, испр. и доп., М.: Химия, 1973. — 656 с.; 160 табл.; 391 рис. С. 250
- ↑ Некрасов Б. В. Основы общей химии. Т. 1. Изд. 3-е, испр. и доп., М.: Химия, 1973. — 656 с.; 160 табл.; 391 рис. С. 257—258
- ↑ Некрасов Б. В. Основы общей химии. Т. 2. Изд. 3-е, испр. и доп., М.: Химия, 1973. — 688 с.; 270 табл.; 426 рис.; Список литературы, ссылок. С. 215—216
- ↑ Некрасов Б. В. Основы общей химии. Т. 2. Изд. 3-е, испр. и доп., М.: Химия, 1973. — 688 с.; 270 табл.; 426 рис.; Список литературы, ссылок. С. 234
- ↑ Некрасов Б. В. Основы общей химии. Т. 1. Изд. 3-е, испр. и доп., М.: Химия, 1973. — 656 с.; 160 табл.; 391 рис. С. 255
- ↑ Некрасов Б. В. Основы общей химии. Т. 1. Изд. 3-е, испр. и доп., М.: Химия, 1973. — 656 с.; 160 табл.; 391 рис. С. 191
Литература
- Клевцов П. В., Леммлейн Г. Г. Поправки на давление к температурам гомогенизации водных растворов NaCl // Доклады АН СССР. 1959. Т. 128. № 6. С. 1250-1253.
Ссылки
wikipedia.green
Хлорид натрия — Википедия. Что такое Хлорид натрия
| Хлорид натрия | |
 | |
 | |
| Общие | |
|---|---|
| Систематическое наименование | Хлорид натрия |
| Традиционные названия | Соль, поваренная соль, столовая соль, пищевая соль, каменная соль, галит[1] |
| Хим. формула | NaCl |
| Физические свойства | |
| Молярная масса | 58,44277 г/моль |
| Плотность | 2,165 г/см³ |
| Термические свойства | |
| Т. плав. | 800,8 °C |
| Т. кип. | 1465 °C |
| Мол. теплоёмк. | 50,8 Дж/(моль·К) |
| Энтальпия образования | −234,8 кДж/моль |
| Удельная теплота испарения | 170,85 кДж/моль |
| Удельная теплота плавления | 28,68 кДж/моль |
| Химические свойства | |
| Растворимость в воде | 35,6 г/100 мл (0 °C) 35,9 г/100 мл (+25 °C) 39,1 г/100 мл (+100 °C) |
| Растворимость в метаноле | 1,49 г/100 мл |
| Растворимость в аммиаке | 21,5 г/100 мл |
| Оптические свойства | |
| Показатель преломления | 1,544202 (589 нм) |
| Структура | |
| Координационная геометрия | Октаэдральная (Na +) Октаэдральная (Cl -) |
| Кристаллическая структура | гранецентрированная кубическая, cF8 |
| Классификация | |
| Рег. номер CAS | 7647-14-5 |
| PubChem | 5234 |
| Рег. номер EINECS | 231-598-3 |
| SMILES | |
| InChI | |
| RTECS | VZ4725000 |
| ChEBI | 26710 |
| ChemSpider | 5044 |
| Безопасность | |
| ЛД50 | 3000–8000 мг/кг |
| NFPA 704 |  |
| Приводятся данные для стандартных условий (25 °C, 100 кПа), если не указано иного. | |
 Кристалл хлорида натрия
Кристалл хлорида натрияХлори́д на́трия или хлористый натрий (NaCl) — натриевая соль соляной кислоты. Известен в быту под названием поваренной соли, основным компонентом которой и является. Хлорид натрия в значительном количестве содержится в морской воде, придавая ей солёный вкус. Встречается в природе в виде минерала галита (каменной соли). Чистый хлорид натрия представляет собой бесцветные кристаллы, но с различными примесями его цвет может принимать голубой, фиолетовый, розовый, жёлтый или серый оттенок.
Нахождение в природе и производство
В природе хлорид натрия встречается в виде минерала галита, который образует залежи каменной соли среди осадочных горных пород, прослойки и линзы на берегах солёных озёр и лиманов, соляные корки в солончаках и на стенках кратеров вулканов и в сольфатарах. Огромное количество хлорида натрия растворено в морской воде. Мировой океан содержит 4 × 1015 тонн NaCl, то есть из каждой тонны морской воды можно получить в среднем 1,3 кг хлорида натрия. Следы NaCl постоянно содержатся в атмосфере в результате испарения брызг морской воды. В облаках на высоте полтора километра 30 % капель, больших 10 мкм по размеру, содержат NaCl. Также он найден в кристаллах снега[2].
Наиболее вероятно, что первое знакомство человека с солью произошло в лагунах тёплых морей или на соляных озёрах, где на мелководье солёная вода интенсивно испарялась под действием высокой температуры и ветра, а в осадке накапливалась соль. По образному выражению Пифагора, «соль была рождена благородными родителями: солнцем и морем»[3].
Галит
В природе хлорид натрия чаще всего встречается в виде минерала галита. Он имеет гранецентрированную кубическую решётку и содержит 39,34 % Na, 60,66 % Cl. Другими химическими элементами, входящими в состав примесей, являются: Br, N, H, Mn, Cu, Ga, As, I, Ag, Ba, Tl, Pb, K, Ca, S, O. Плотность 2,1—2, 2 г/см³, а твёрдость по шкале Мооса — 2. Бесцветный прозрачный минерал со стеклянным блеском. Распространённый минерал соленосных толщ. Образуется при осаждении в замкнутых водоёмах, а также как продукт сгона на стенках кратеров вулканов. Составляет пласты в осадочных породах лагунных и морских фаций, штокоподобные тела в соляных куполах и тому подобных.[4]
Каменная соль
Каменной солью называют осадочную горную породу из группы эвапоритов, состоящую более чем на 90 % из галита. Галит также часто называют каменной солью. Эта осадочная горная порода может быть бесцветной или снежно-белой, но чаще она окрашена примесями глин, талька (серый цвет), оксидами и гидроксидами железа (жёлтый, оранжевый, розовый, красный), битумами (бурая). Каменная соль содержит хлориды и сульфаты натрия, калия, магния и кальция, бромиды, иодиды, бораты, гипс, примеси карбонатно-глинистого материала, доломита, анкериту, магнезита, битумов и так далее[4].
По условиям формирования месторождений каменную соль подразделяют на следующие виды[4]:
- рассолы современных соляных бассейнов
- соляные подземные воды
- залежи минеральных солей современных соляных бассейнов
- ископаемые залежи (важнейшие для промышленности).
Морская соль
Морская соль является смесью солей (хлориды, карбонаты, сульфаты и т. д.), образующейся при полном испарении морской воды. Среднее содержание солей в морской воде составляет:
| Соединение | Масс. доля, % |
|---|---|
| NaCl | 77,8 |
| MgCl2 | 10,9 |
| MgSO4 | 4,7 |
| KCl | 2,5 |
| K2SO4 | 2,5 |
| CaCO3 | 0,3 |
| Ca(HCO3)2 | 0,3 |
| другие соли | 0,2 |
 Очищенная кристаллическая морская соль
Очищенная кристаллическая морская сольПри испарении морской воды при температуре от +20 до +35 °C в осадке сначала кристаллизуются наименее растворимые соли — карбонаты кальция и магния и сульфат кальция. Затем выпадают более растворимые сульфаты натрия и магния, хлориды натрия, калия и магния, и после них — сульфаты калия и магния. Последовательность кристаллизации солей и состав осадка может несколько варьироваться в зависимости от температуры, скорости испарения и других условий. В промышленности морскую соль получают из морской воды, в основном методом обычного выпаривания. Она отличается от каменной соли значительно большим содержанием других химических солей, минералов и различных микроэлементов, в первую очередь йода, калия, магния и марганца. Соответственно, она отличается от хлорида натрия и по вкусу — горько-солёный привкус ей придают соли магния. Она используется в медицине: при лечении кожных заболеваний, таких как псориаз. Как лечебное вещество в аптечной и обычной торговой сети, распространённым продуктом является соль из Мёртвого моря. В очищенном виде этот вид соли также предлагается в продуктовой торговой сети — как натуральная и богатая йодом пищевая[5].
Залежи
Залежи каменной соли найдены во всех геологических системах. Важнейшие из них сосредоточены в кембрийских, девонских, пермских и третичных отложениях. Каменная соль составляет мощные пластовые залежи и ядра сводчатых структур (соляных куполов и штоков), образует прослойки, линзы, гнезда и вкрапления в других породах[4]. Среди озёрных месторождений России крупнейшие — Эльтонское, Баскунчак в Прикаспии, Кучукское озеро, Кулундинское озеро, Эбейты и другие озёра в Западной Сибири.
Производство
В древности технология добычи соли заключалась в том, что соляную рапу (раствор) вытаскивали лошадиным приводом из шахт, которые назывались «колодцами» или «окнами», и были достаточно глубокими — 60—90 м. Извлечённый солевой раствор выливали в особый резервуар — творило, откуда она через отверстия стекала в нижний резервуар, и системой жёлобов подавалась в деревянные башни. Там её разливали в большие чаны, на которых соль вываривали.
На Руси поморы вываривали соль на побережье Белого моря и называли её морянка. В 1137 году новгородский князь Святослав определил налог на соляные варницы[6]:
 | …на мори от чрена и от салгы по пузу…[7] |  |
Беломорской солью, называемой «морянкой», торговали по всей Российской империи до начала XX века, пока её не вытеснила более дешёвая поволжская соль.
Современная добыча хлорида натрия механизирована и автоматизирована. Соль массово добывается выпариванием морской воды (тогда её называют морской солью) или рассола с других ресурсов, таких как соляные источники и соляные озера, а также разработкой соляных шахт и добычей каменной соли.
Для добычи хлорида натрия из морской воды необходимы условия жаркого климата с низкой влажностью воздуха, наличие значительных низменных территорий, лежащих ниже уровня моря, или затопляемых приливом, слабая водопроницаемость почвы испарительных бассейнов, малое количество осадков в течение сезона активного испарения, отсутствие влияния пресных речных вод и наличие развитой транспортной инфраструктуры.
Мировое производство соли в 2009 году оценивается в 260 миллионов тонн. Крупнейшими мировыми производителями являются Китай (60,0 млн тонн), США (46,0 млн тонн), Германия (16,5 млн тонн), Индия (15,8 млн тонн) и Канада (14 млн тонн)[8].
-

Добыча соли в южной части Мертвого моря, Израиль
-

Кристаллы каменной соли
-

Плантация морской соли в Дакаре
-

Соляные кучи на солончаке Уюни, Боливия
Применение
В пищевой промышленности и кулинарии
Соль повареннаяВ пищевой промышленности и кулинарии используют хлорид натрия, чистота которого должна быть не менее 97 %. Его применяют как вкусовую добавку и для консервирования пищевых продуктов. Такой хлорид натрия имеет товарное название поваренная соль, порой также употребляются названия пищевая, столовая, а также уточнение названия в зависимости от её происхождения — каменная, морская, и по составу добавок — йодированная, фторированная и т. д. Такая соль является кристаллическим сыпучим продуктом с солёным вкусом без привкуса, без запаха (за исключением йодированной соли), в котором не допускаются посторонние примеси, не связанные с методом добывания соли. Кроме хлорида натрия, поваренная соль содержит небольшое количество солей кальция, магния, калия, которые придают ей гигроскопичности и жёсткости. Чем меньше этих примесей в соли, тем выше её качество.
Выделяют сорта: экстра, высший, первый и второй. Массовая доля хлористого натрия в сортах, %:
- экстра — не менее 99,5;
- высший — 98,2;
- первый — 97,5;
- второй — 97,0.
Массовая доля влаги в выварочной соли сорта «экстра» 0,1 %, в высшем сорте — 0,7 %. Допускают добавки йодида калия (йодистого калия), йодата калия, фторидов калия и натрия. Массовая доля йода должна составлять (40,0 ± 15,0) × 10−4 %, фтора (25,0 ± 5,0) × 10−3 %. Цвет экстра и высшего сортов — белый, однако для первого и второго допускается серый, желтоватый, розовый и голубоватый оттенки в зависимости от происхождения соли. Пищевую поваренную соль производят молотой и сеяной. По размеру зёрен молотую соль подразделяют на номера: 0, 1, 2, 3. Чем больше номер, тем больше зерна соли.
В кулинарии хлорид натрия потребляют как важнейшую приправу. Соль имеет характерный вкус, без которого пища кажется человеку пресной. Такая особенность соли обусловлена физиологией человека. Однако зачастую люди потребляют соли больше, чем нужно для физиологических процессов.
Хлорид натрия имеет слабые антисептические свойства — 10-15%-ное содержание соли предотвращает размножение гнилостных бактерий. Этот факт обусловливает её широкое применение как консерванта.
В медицине
Изотонический раствор хлорида натрия в воде (0,9 %) применяется как дезинтоксикационное средство, для коррекции состояния систем организма в случае обезвоживания, как растворитель других лекарственных препаратов. Гипертонические растворы (10 % раствор) используют как вспомогательный осмотический диуретик при отёке головного мозга, для поднятия давления при кровотечениях, в состояниях, характеризующихся дефицитом ионов натрия и хлора, при отравлении нитратом серебра, для обработки гнойных ран (местно). В офтальмологии как местное средство раствор хлорида натрия обладает противоотёчным действием[9].
В коммунальном хозяйстве. Техническая соль
Зимой хлорид натрия, смешанный с другими солями, песком или глиной — так называемая техническая соль — применяется как антифриз против гололёда. Ею посыпают тротуары, хотя это отрицательно влияет на кожаную обувь и техническое состояние автотранспорта в виду коррозийных процессов.
Регенерация Nа-катионитовых фильтров
Nа-катионитовые фильтры широко применяются в установках умягчения воды всех мощностей при водоподготовке. Катионитным материалом на современных водоподготовительных установках служат в основном глауконит, полимерные ионообменные смолы и сульфированные угли. Наиболее распространены сульфокатионитные ионообменные смолы.
Регенерацию Nа-катионитовых фильтров осуществляют 6—10%-м раствором поваренной соли, в результате катионит переводится в Na-форму, регенерируется. Реакции идут по уравнениям:
- CaR2+2NaCl→2NaR+CaCl2{\displaystyle {\mathsf {CaR_{2}+2NaCl\rightarrow 2NaR+CaCl_{2}}}}
- MgR2+2NaCl→2NaR+MgCl2{\displaystyle {\mathsf {MgR_{2}+2NaCl\rightarrow 2NaR+MgCl_{2}}}}
Химическая промышленность
Соль, наряду с каменным углем, известняками и серой, образует «большую четвёрку» продуктов минерального сырья, которые являются важнейшими для химической промышленности[10]. Из неё получают соду, хлор, соляную кислоту, гидроксид натрия, сульфат натрия и металлический натрий. Кроме этого соль используется также для промышленного получения легкорастворимого в воде хлората натрия, который является средством для уничтожения сорняков[11]. Суммарное уравнение реакции электролиза горячего раствора хлорида натрия[12]:
- NaCl+3h3O→NaClO3+3h3{\displaystyle {\mathsf {NaCl+3H_{2}O\rightarrow NaClO_{3}+3H_{2}}}}
Получение хлора и гидроксида натрия
В промышленности путём электролиза раствора хлорида натрия получают хлор. Процессы, происходящие на электродах[13][14]:
- на катоде как побочный продукт выделяется водород вследствие восстановления ионов H+, образованных в результате электролитической диссоциации воды:
- h3O⇄H++OH−{\displaystyle {\mathsf {H_{2}O\rightleftarrows H^{+}+OH^{-}}}}
- 2H++2e−→h3{\displaystyle {\mathsf {2H^{+}+2e^{-}\rightarrow H_{2}}}}
- поскольку (вследствие практически полной электролитической диссоциации NaCl), хлор в растворе находится в виде хлорид-ионов, они окисляются на аноде до свободного хлора в виде газа:
- NaCl→Na++Cl−{\displaystyle {\mathsf {NaCl\rightarrow Na^{+}+Cl^{-}}}}
- 2Cl−→Cl2+2e−{\displaystyle {\mathsf {2Cl^{-}\rightarrow Cl_{2}+2e^{-}}}}
- суммарная реакция:
- 2NaCl+2h3O→2NaOH+Cl2+h3{\displaystyle {\mathsf {2NaCl+2H_{2}O\rightarrow 2NaOH+Cl_{2}+H_{2}}}}
Как видно из уравнения суммарной реакции, ещё одним продуктом является гидроксид натрия. Расход электроэнергии на 1 т хлора составляет примерно 2700 кВт × час. Полученный хлор при повышенном давлении сжижается в жёлтую жидкость уже при обычной температуре[15].
Если между анодом и катодом нет диафрагмы, то растворённый в воде хлор начинает реагировать с гидроксидом натрия, образуя хлорид и гипохлорит натрия NaClO[14]:
- 2NaOH+Cl2→NaCl+NaOCl+h3O{\displaystyle {\mathsf {2NaOH+Cl_{2}\rightarrow NaCl+NaOCl+H_{2}O}}}
Поэтому для получения гидроксида натрия применяют диафрагму и соответствующий метод получения NaOH называют диафрагменным. В качестве диафрагмы применяют асбестовый картон. В процессе электролиза раствор хлорида натрия постоянно подаётся в анодное пространство, а из катодного пространства непрерывно вытекает раствор хлорида и гидроксида натрия. Во время выпаривания последнего хлорид кристаллизуется, поскольку его растворимость в 50 % растворе NaOH крайне мала (0,9 %). Полученный раствор NaOH выпаривают в железных чанах, затем сухой остаток переплавляют.
Для получения чистого гидроксида натрия (без добавок хлорида натрия) применяют ртутный метод, где используют графитовый анод и ртутный катод. Вследствие того, что перенапряжение выделения водорода на ртути очень большое, на ней вновь появляются ионы натрия и образуется амальгама натрия[14][16]:
- Na++e−→Na(Hg){\displaystyle {\mathsf {Na^{+}+e^{-}\rightarrow Na_{(Hg)}}}}
Амальгаму позже разлагают горячей водой с образованием гидроксида натрия и водорода, а ртуть перекачивают насосом обратно в электролизер:
- 2Na(Hg)+2h3O→2NaOH+h3{\displaystyle {\mathsf {2Na_{(Hg)}+2H_{2}O\rightarrow 2NaOH+H_{2}}}}
Суммарная реакция процесса такая же, как и в случае диафрагменного метода.
Получение металлического натрия
Металлический натрий получают электролизом расплава хлорида натрия. Происходят следующие процессы:
- на катоде выделяется натрий:
- Na++e−→Na{\displaystyle {\mathsf {Na^{+}+e^{-}\rightarrow Na}}}
- на аноде выделяется хлор (как побочный продукт):
- 2Cl−→Cl2+2e−{\displaystyle {\mathsf {2Cl^{-}\rightarrow Cl_{2}+2e^{-}}}}
- суммарная реакция:
- 2Na++2Cl−→2Na+Cl2{\displaystyle {\mathsf {2Na^{+}+2Cl^{-}\rightarrow 2Na+Cl_{2}}}}
Ванна электролизера состоит из стального кожуха с футеровкой, графитового анода и кольцевого железного катода. Между катодом и анодом располагается сетчатая диафрагма. Для снижения температуры плавления NaCl (+800 °C), электролитом является не чистый хлорид натрия, а его смесь с хлоридом кальция CaCl 2 (40:60) с температурой плавления +580 °C. Металлический натрий, который собирается в верхней части катодного пространства, содержит до 5 % примесь кальция, но последний со временем почти полностью отделяется, поскольку его растворимость в жидком натрии при температуре его плавления (+371 K = 98º C) составляет всего 0,01 %. С расходованием NaCl его постоянно добавляют в ванну. Затраты электроэнергии составляют примерно 15 кВт × ч на 1 кг натрия[17].
Получение соляной кислоты и сульфата натрия
Среди многих промышленных методов получения соляной кислоты, то есть водного раствора хлороводорода (HCl), применяется реакция обмена между хлоридом натрия и серной кислотой:
- NaCl+h3SO4→NaHSO4+HCl↑{\displaystyle {\mathsf {NaCl+H_{2}SO_{4}\rightarrow NaHSO_{4}+HCl\uparrow }}}
- NaCl+NaHSO4→Na2SO4+HCl↑{\displaystyle {\mathsf {NaCl+NaHSO_{4}\rightarrow Na_{2}SO_{4}+HCl\uparrow }}}
Первая реакция происходит в значительной степени уже при обычных условиях, а при слабом нагреве идёт почти до конца. Вторая происходит лишь при высоких температурах. Процесс осуществляется в специальных механизированных печах большой мощности. Хлороводород, который выделяется, обеспыливают, охлаждают и поглощают водой с образованием соляной кислоты. Как побочный продукт образуется сульфат натрия Na2SO4[18][19].
Этот метод применяется также для получения хлороводорода в лабораторных условиях.
Физические и физико-химические свойства
Температура плавления +800,8 °С, кипения +1465 °С.
Умеренно растворяется в воде, растворимость мало зависит от температуры: коэффициент растворимости NaCl (в граммах на 100 г воды) равен 35,9 при +21 °C и 38,1 при +80 °C. Растворимость хлорида натрия существенно снижается в присутствии хлороводорода, гидроксида натрия, солей — хлоридов металлов. Растворяется в жидком аммиаке, вступает в реакции обмена. В чистом виде хлорид натрия не гигроскопичен. Однако соль часто бывает загрязнена примесями (преимущественно ионами Ca2+, Mg2+ и SO2−
4), и такая соль на воздухе сыреет[20]. Кристаллогидрат NaCl · 2H2O можно выделить при температуре ниже +0,15 °C[21].
Смесь измельчённого льда с мелким порошком хлорида натрия является эффективным охладителем. Так, смесь состава 30 г NaCl на 100 г льда охлаждается до температуры −20 °C. Это происходит потому, что водный раствор соли замерзает при температуре ниже 0 °C. Лёд, имеющий температуру около 0 °C, плавится в таком растворе, поглощая тепло окружающей среды.
| Термодинамические характеристики | |
|---|---|
| ΔfH0g | −181,42 кДж/моль |
| ΔfH0l | −385,92 кДж/моль |
| ΔfH0s | −411,12 кДж/моль |
| ΔfH0aq | −407 кДж/моль |
| S0g, 1 bar | 229,79 Дж/(моль·K) |
| S0l, 1 bar | 95,06 Дж/(моль·K) |
| S0s | 72,11 Дж/(моль·K) |
Диэлектрическая проницаемость NaCl — 6,3
Плотность и концентрация водных растворов NaCl
| Концентрация, % | Концентрация, г/л | Плотность, г/мл |
|---|---|---|
| 1 | 10,05 | 1,005 |
| 2 | 20,25 | 1,012 |
| 4 | 41,07 | 1,027 |
| 6 | 62,47 | 1,041 |
| 8 | 84,47 | 1,056 |
| 10 | 107,1 | 1,071 |
| 12 | 130,2 | 1,086 |
| 14 | 154,1 | 1,101 |
| 16 | 178,5 | 1,116 |
| 18 | 203,7 | 1,132 |
| 20 | 229,5 | 1,148 |
| 22 | 256 | 1,164 |
| 24 | 283,2 | 1,18 |
| 26 | 311,2 | 1,197 |
Лабораторное получение и химические свойства
При действии серной кислоты выделяет хлороводород.
- 2NaCl+h3SO4→Na2SO4+2HCl{\displaystyle {\mathsf {2NaCl+H_{2}SO_{4}\rightarrow Na_{2}SO_{4}+2HCl}}}
С раствором нитрата серебра образует белый осадок хлорида серебра (качественная реакция на хлорид-ион).
- NaCl+AgNO3→NaNO3+AgCl{\displaystyle {\mathsf {NaCl+AgNO_{3}\rightarrow NaNO_{3}+AgCl}}}
при смешивании с сульфатом меди в растворе получается тетрахлоркупрат натрия, при этом синий раствор зеленеет:
- CuSO4+4NaCl⇄Na2CuCl4+Na2SO4{\displaystyle {\mathsf {CuSO_{4}+4NaCl\rightleftarrows Na_{2}CuCl_{4}+Na_{2}SO_{4}}}}
Учитывая огромные природные запасы хлорида натрия, необходимости в его промышленном или лабораторном синтезе нет. Однако, его можно получить различными химическими методами как основной или побочный продукт.
- получение из простых веществ натрия и хлора является экзотермической реакцией[22]:
- 2Na+Cl2→2NaCl+410 kJ/mol{\displaystyle {\mathsf {2Na+Cl_{2}\rightarrow 2NaCl+410\ kJ/mol}}}
- нейтрализация щелочи гидроксида натрия соляной кислотой[23]:
- NaOH+HCl→NaCl+h3O{\displaystyle {\mathsf {NaOH+HCl\rightarrow NaCl+H_{2}O}}}
Поскольку хлорид натрия в водном растворе почти полностью диссоциирован на ионы:
- NaCl→Na++Cl−{\displaystyle {\mathsf {NaCl\rightarrow Na^{+}+Cl^{-}}}}
Его химические свойства в водном растворе определяются соответствующими химическими свойствами катионов натрия и хлорид-анионов.
Структура
 Кристаллическая решётка хлорида натрия.
Кристаллическая решётка хлорида натрия. Голубой цвет = Na+
Зелёный цвет = Cl−
Хлорид натрия образует бесцветные кристаллы кубической сингонии, пространственная группа Fm3m, параметры ячейки a = 0,563874 нм, d = 2,17 г/см3. Каждый из ионов Cl− окружён шестью ионами Na+ в октаэдрической конфигурации, и наоборот. Если мысленно отбросить, например, ионы Na+, то останется плотно упакованная кубическая структура ионов Cl−, называемая гранецентрированной кубической решёткой. Ионы Na+ тоже образуют плотно упакованную кубическую решётку. Таким образом, кристалл состоит из двух подрешёток, сдвинутых друг относительно друга на полупериод. Такая же решётка характерна для многих других минералов.
В кристаллической решётке между атомами преобладает ионная химическая связь, что является следствием действия электростатического взаимодействия противоположных по заряду ионов.
См. также
Примечания
- ↑ Натрия хлорид на сайте Национального института стандартов и технологии США (англ. National Institute of Standards and Technology) (англ.)
- ↑ Некрасов Б. В. Основы общей химии. Т. 2. Изд. 3-е, испр. и доп., М.: Химия, 1973. — 688 с.; 270 табл.; 426 рис.; Список литературы, ссылок. С. 218
- ↑ Пифагор. Золотой канон. Фигуры эзотерики. — М.: Изд-во Эксмо, 2003. — 448 с. (Антология мудрости).
- ↑ 1 2 3 4 Малая горная энциклопедия. В 3 т. = Мала гірнича енциклопедія / (На укр. яз.). Под ред. В. С. Белецкого. — Донецк: Донбасс, 2004. — ISBN 966-7804-14-3.
- ↑ УНИАН: Морская соль для красоты и здоровья кожи
- ↑ Российское законодательство Х—XX веков. Законодательство Древней Руси. Т. 1. М., 1984. С. 224—225.
- ↑ В переводе с поморской «говори» слово чрен (црен) означает четырёхугольный ящик, кованный из листового железа, а салга — котёл, в котором варили соль. Пузом в беломорских солеварнях называли мешок соли в два четверика, то есть, объёмом около 52 литров.
- ↑ Соль (PDF), Геологический обзор США на сайте Программы минеральных ресурсов (англ.)
- ↑ Энциклопедия здоровья
- ↑ Онлайн Энциклопедия кругосвет. Натрий (недоступная ссылка — история)
- ↑ Некрасов Б. В. Основы общей химии. Т. 1. Изд. 3-е, испр. и доп., М.: Химия, 1973. — 656 с.; 160 табл.; 391 рис. С. 261
- ↑ Синтез хлората натрия (англ.)
- ↑ Некрасов Б. В. Основы общей химии. Т. 1. Изд. 3-е, испр. и доп., М.: Химия, 1973. — 656 с.; 160 табл.; 391 рис. С. 249
- ↑ 1 2 3 Глинка М. Л. Общая химия (учебник), изд. 2-е изд., перераб. и доп., К.: Высшая школа, 1982. — С. 608
- ↑ Некрасов Б. В. Основы общей химии. Т. 1. Изд. 3-е, испр. и доп., М.: Химия, 1973. — 656 с.; 160 табл.; 391 рис. С. 254
- ↑ Некрасов Б. В. Основы общей химии. Т. 2. Изд. 3-е, испр. и доп., М.: Химия, 1973. — 688 с.; 270 табл.; 426 рис.; Список литературы, ссылок. С. 231
- ↑ Некрасов Б. В. Основы общей химии. Т. 2. Изд. 3-е, испр. и доп., М.: Химия, 1973. — 688 с.; 270 табл.; 426 рис.; Список литературы, ссылок. С. 219
- ↑ Некрасов Б. В. Основы общей химии. Т. 1. Изд. 3-е, испр. и доп., М.: Химия, 1973. — 656 с.; 160 табл.; 391 рис. С. 250
- ↑ Некрасов Б. В. Основы общей химии. Т. 1. Изд. 3-е, испр. и доп., М.: Химия, 1973. — 656 с.; 160 табл.; 391 рис. С. 257—258
- ↑ Некрасов Б. В. Основы общей химии. Т. 2. Изд. 3-е, испр. и доп., М.: Химия, 1973. — 688 с.; 270 табл.; 426 рис.; Список литературы, ссылок. С. 215—216
- ↑ Некрасов Б. В. Основы общей химии. Т. 2. Изд. 3-е, испр. и доп., М.: Химия, 1973. — 688 с.; 270 табл.; 426 рис.; Список литературы, ссылок. С. 234
- ↑ Некрасов Б. В. Основы общей химии. Т. 1. Изд. 3-е, испр. и доп., М.: Химия, 1973. — 656 с.; 160 табл.; 391 рис. С. 255
- ↑ Некрасов Б. В. Основы общей химии. Т. 1. Изд. 3-е, испр. и доп., М.: Химия, 1973. — 656 с.; 160 табл.; 391 рис. С. 191
Литература
- Клевцов П. В., Леммлейн Г. Г. Поправки на давление к температурам гомогенизации водных растворов NaCl // Доклады АН СССР. 1959. Т. 128. № 6. С. 1250-1253.
Ссылки
wiki.sc
| Хлорид натрия | |
|---|---|
 ( ({{{картинка3D}}}) | |
 ( ({{{изображение}}}) | |
| Систематическое наименование | Хлорид натрия |
| Традиционные названия | Соль, поваренная соль, столовая соль, пищевая соль, каменная соль, галит[1] |
| Хим. формула | NaCl |
| Молярная масса | 58,44277 г/моль |
| Плотность | 2,165 г/см³ |
| Температура | |
| • плавления | 800,8 °C |
| • кипения | 1465 °C |
| Мол. теплоёмк. | 50,8 Дж/(моль·К) |
| Энтальпия | |
| • образования | −234,8 кДж/моль |
| Удельная теплота испарения | 170,85 кДж/моль |
| Удельная теплота плавления | 28,68 кДж/моль |
| Растворимость | |
| • в воде | 35,6 г/100 мл (0 °C) 35,9 г/100 мл (+25 °C) 39,1 г/100 мл (+100 °C) |
| • в метаноле | 1,49 г/100 мл |
| • в аммиаке | 21,5 г/100 мл |
| Показатель преломления | 1,544202 (589 нм) |
| Координационная геометрия | Октаэдральная (Na +) Октаэдральная (Cl -) |
| Кристаллическая структура | гранецентрированная кубическая, cF8 |
| Рег. номер CAS | 7647-14-5 |
| PubChem | 5234 |
| Рег. номер EINECS | 231-598-3 |
| SMILES | |
| InChI | |
| RTECS | VZ4725000 |
| ChEBI | 26710 |
| ChemSpider | |
ruwikiorg.ru








