СТЕРОИДНЫЕ ГОРМОНЫ — это… Что такое СТЕРОИДНЫЕ ГОРМОНЫ?
- СТЕРОИДНЫЕ ГОРМОНЫ
- СТЕРОИДНЫЕ ГОРМОНЫ
группа физиологически активных веществ стероидной природы (половые гормоны, прогестины, кортикостероиды, экдизоны), регулирующих процессы жизнедеятельности у животных и человека. У позвоночных С. г. синтезируются из холестерина в коре надпочечников, клетках Лейдига семенников, в фолликулах и жёлтом теле яичников, а также в плаценте. Гормональная форма витамина D3 достраивается из экзогенного витамина в печени и почках. Характерная особенность синтеза С. г.— ряд последовательно протекающих процессов гидроксилирования молекул стероидов, происходящих в митохондриях и микросомах. Эти процессы осуществляются спец. ферментами клеток из класса гидролаз или оксидаз смешанного типа. С. г. содержатся в составе липидных капель в цитоплазме в свободном виде. В связи с высокой липофильностью стероидов С.

.(Источник: «Биологический энциклопедический словарь.» Гл. ред. М. С. Гиляров; Редкол.: А. А. Бабаев, Г. Г. Винберг, Г. А. Заварзин и др. — 2-е изд., исправл. — М.: Сов. Энциклопедия, 1986.)
.
- СТЕРНИТ
- СТЕРОИДЫ
Смотреть что такое «СТЕРОИДНЫЕ ГОРМОНЫ» в других словарях:
Стероидные гормоны — Стероидные гормоны группа физиологически активных веществ (половые гормоны, кортикостероиды и др.), регулирующих процессы жизнедеятельности у животных и человека. У позвоночных стероидные гормоны синтезируются из холестерина в коре… … Википедия
СТЕРОИДНЫЕ ГОРМОНЫ — группа физиологически активных в в стероидной природы.
 По хим. строению и биол. действию разделяются на С 21 стероиды, обладающие скелетом прегнана ( гестагены и кортикоиды),С 19 стероиды со скелетом андростана ( андрогепы) и С 18 стероиды со… … Химическая энциклопедия
По хим. строению и биол. действию разделяются на С 21 стероиды, обладающие скелетом прегнана ( гестагены и кортикоиды),С 19 стероиды со скелетом андростана ( андрогепы) и С 18 стероиды со… … Химическая энциклопедияСтероидные гормоны — группа физиологически активных веществ (половые гормоны, кортикостероиды и др.), регулирующих процессы жизнедеятельности у животных и человека. У позвоночных С.г. синтезируются из холестерина в коре надпочечников, клетках Лейдига семенников, в… … Словарь по психогенетике
Гормоны — (др. греч. ὁρμάω возбуждаю, побуждаю) биологически активные вещества органической природы, вырабатывающиеся в специализированных клетках желёз внутренней секреции, поступающие в кровь и оказывающие регулирующее влияние на обмен… … Википедия
гормоны — ов; мн. (ед. гормон, а; м.). [от греч. hormaō двигаю, возбуждаю]. 1. Физиол. Биологически активные вещества, вырабатываемые в организме и влияющие на все жизненно важные процессы.

Гормоны щитовидной железы — представлены двумя различными классами биологически активных веществ: йодтиронинами и полипептидным гормоном кальцитонином. Эти классы веществ выполняют разные физиологические функции: йодтиронины регулируют состояние основного обмена, а… … Википедия
Гормоны и поведение (hormones and behavior) — Г. это хим. вещества, синтезируемые и секретируемые эндокринными железами. Г. доставляются к органам мишеням, деятельность к рых они регулируют, по кровеносному руслу вместе с кровью. Они выполняют функцию передачи информ. внутри организма,… … Психологическая энциклопедия
ГОРМОНЫ — (от греч. hormao привожу в движение, побуждаю), биологически активные вещества, выделяемые железами внутр. секреции или скоплениями специа лизир. клеток организма и оказывающие целенаправленное действие на др.
 органы и ткани. Термин «Г.»… … Биологический энциклопедический словарь
органы и ткани. Термин «Г.»… … Биологический энциклопедический словарьгормоны — * гармоны * hormones высокоспецифичные биологически активные органические вещества, являющиеся регуляторами важнейших жизненных процессов. Г. вырабатываются в организме высокоспециализированными клетками или органами (эндокринными железами, или… … Генетика. Энциклопедический словарь
ГОРМОНЫ — животных (от греч. hormao привожу в движение, побуждаю), в ва, вырабатываемые специализиров. клетками и железами внутр. секреции и регулирующие обмен в в отдельных органов и всего организма в целом. Для всех Г. характерна большая специфичность… … Химическая энциклопедия
Анализ профиля стероидных гормонов (кровь, слюна) в Самаре, цены и расшифровка
Поскольку стероидные гормоны, это физиологически активные вещества, отвечающие в организме за основные процессы жизнедеятельности, то по результатам анализа можно выяснить, на каком звене цепи происходит сбой.
Важно не просто сдать анализ, а сдать правильно. Поэтому запомните, что все стероидные гормоны – кортизол, эстрогены, андрогены и др. – нужно сдавать только методом МАСС-СПЕКТРОМЕТРИЯ, где в качестве биоматериала должна использоваться только СЛЮНА!
Профиль стероидных гормонов (слюна)Анализ проводится методом ХРОМАТО-МАСС-СПЕКТРОМЕТРИИ
Что входит (состав профиля):
17-ОН-прогестерон, Андростендион, ДГЭА, Кортизон, Кортизол, Эстрадиол, Прогестерон, Тестостерон, Прегненолон.
Почему именно масс-спектрометрия?
⠀
Потому что классический метод ИФА, использующийся в других лабораториях для определения уровня стероидных гормонов, не корректен. Он не позволяет в процессе реакции «антиген-антитело» распознать количественные отличия всех стероидных гормонов – только лишь на глазок. Более того, значения на выходе получаются всегда завышенные. И получается, что по факту реальная картина искажена.
Более того, значения на выходе получаются всегда завышенные. И получается, что по факту реальная картина искажена.
Почему именно слюна?
⠀В крови гормоны почти полностью находятся в связанном с транспортными белками состоянии. Они НЕ активны, пока не дошли до ткани, где должны работать. Только там они освобождаются от белков и оказывают свое действие. А важно определение именно свободных (АКТИВНЫХ) гормонов, чтобы оценить истинную функциональную активность гормональной системы.
⠀
Клеточные мембраны слюнных желез являются природными разделительными фильтрами, и в слюнной проток проникают соединения только с низкой молекулярной массой (<400 Д), к которым как раз и относятся тестостерон и все другие стероиды, не связанные с альбумином и специфическим глобулином. ⠀ В нашей клинике вы можете сдать стероидный профиль слюны, который выполняется согласно всем условиям выше. Более того, каждый наш Д-доктор работает с этим анализом и задаст вам правильный вектор в терапии.
Как подготовиться к сдаче?
Для анализа не требуется специальной подготовки. Есть несколько условий для успешного проведения:
- За 60 минут не курите, не употребляйте жевательный табак и курительные смеси.
- За полчаса воздержитесь от еды, жевательной резинки, чистки зубов и использования предметов гигиены полости рта.
Половые гормоны
- Прогестерон
- Тестостерон
- Пролактин
- Лютеинизирующий гормон (ЛГ)
- Фолликулостимулирующий гормон (ФСГ)
- Хорионический гонадотропин человека (ХГЧ)
- Свободный В-ХГЧ
- Эстрадиол
- Андростендион
Репродуктивная функция у обоих полов полностью контролируется и регулируется гормонами. Основные половые гормоны разделены на два класса – эстрогены (женские) и андрогены (мужские).
Прогестерон – основная функция состоит в подготовке организма женщины к беременности. Он необходим для поддержания беременности и тонуса гладкой мускулатуры матки. Предотвращает избыточное разрастание слизистой матки и оказывает влияние на ткань молочных желез (стимулирует рост и развитие железистой ткани молочных желез, способствует подготовке их к лактации).
Он необходим для поддержания беременности и тонуса гладкой мускулатуры матки. Предотвращает избыточное разрастание слизистой матки и оказывает влияние на ткань молочных желез (стимулирует рост и развитие железистой ткани молочных желез, способствует подготовке их к лактации).
Каждый месяц эстроген заставляет внутренний выстилающий слой матки – эндометрий – расти и обновляться, в то время как лютеинизирующий гормон (ЛГ) способствует высвобождению яйцеклетки в одном из яичников. На месте высвободившейся яйцеклетки образуется так называемое жёлтое тело, которое вырабатывает прогестерон. Прогестерон вместе с гормоном, выделяемым надпочечниками, останавливает рост эндометрия и подготавливает матку к возможной имплантации оплодотворенной яйцеклетки. Если оплодотворения не происходит, желтое тело исчезает, уровень прогестерона падает и наступает менструальное кровотечение. Если же оплодотворенная яйцеклетка прикрепляется к стенке матки, желтое тело продолжает производить прогестерон. Через несколько недель плацента берет на себя функцию желтого тела по выработке прогестерона, являясь основным источником этого гормона во время беременности.
Через несколько недель плацента берет на себя функцию желтого тела по выработке прогестерона, являясь основным источником этого гормона во время беременности.
Анализ используется для выявления причин бесплодия, диагностики внематочной или патологической беременности, контроля за состоянием плода и плаценты во время беременности и чтобы определить, была ли у пациентки овуляция.
Тестостерон – основной мужской половой гормон, отвечающий за формирование вторичных половых признаков и половую функцию. Его синтез стимулируется и контролируется лютеинизирующим гормоном (ЛГ), вырабатываемым гипофизом. Уровень тестостерона подвержен значительным колебаниям в течение суток, своего пика он достигает между 4 и 8 часами утра, а минимум приходится на вечерние часы (между 16:00 и 20:00).
Кроме того, его концентрация возрастает после физических нагрузок и уменьшается с возрастом. В особенно большом количестве он вырабатывается у подростков в период полового созревания. У мужчин тестостерон синтезируется яичками и надпочечниками, а у женщин – надпочечниками и в небольшом количестве яичниками.
У мужчин тестостерон синтезируется яичками и надпочечниками, а у женщин – надпочечниками и в небольшом количестве яичниками.
Тестостерон способствует развитию вторичных половых признаков, таких как увеличение полового члена, рост волос на теле, развитие мышечной массы и низкий голос. У взрослых мужчин он регулирует сексуальные инстинкты и поддержание мышечной массы. Тестостерон также присутствует в организме женщины, хотя и в меньшей концентрации. От него зависят либидо (сексуальное влечение), способность к оргазмам, уровень инсулина, стройная фигура, развитие мышечной массы, костная ткань. Тестостерон отвечает за активность и переносимость эмоциональных нагрузок. В постменопаузу, когда исчезнут эстрогены и гестагены, именно тестостерон будет еще некоторое время поддерживать плотность костной ткани, сердечно-сосудистую систему и поможет легче переносить климактерический синдром.
Анализ назначается при мужском и женском бесплодии или пониженном половом влечении, замедленном либо преждевременном половом созревании у мальчиков и эректильной дисфункции у мужчин, при болезнях гипоталамуса, гипофиза, опухолях яичек.
Лютеинизирующий гормон (ЛГ) – гормон передней доли гипофиза, отвечает за бесперебойную работу всей системы половых желез, равно как и за выработку мужских и женских половых гормонов — прогестерона и тестостерона. У женщин ЛГ воздействует на клетки оболочки яичника и жёлтое тело, стимулирует овуляцию и активирует в клетках яичников синтез эстрогенов и прогестерона, у мужчин — на клетки семенников, активируя в них синтез тестостерона, благодаря чему, в частности, происходит созревание сперматозоидов.
Анализ проводится для диагностики бесплодия и оценки функционального состояния репродуктивной системы.
ФСГ (фолликулостимулирующий гормон) регулирует выработку половых гормонов, но сам не является таковым, поскольку вырабатывается не половыми железами, а гипофизом. В организме ФСГ регулирует деятельность половых желез: способствует образованию и созреванию половых клеток (яйцеклеток и сперматозоидов), влияет на синтез женских половых гормонов (эстрогенов).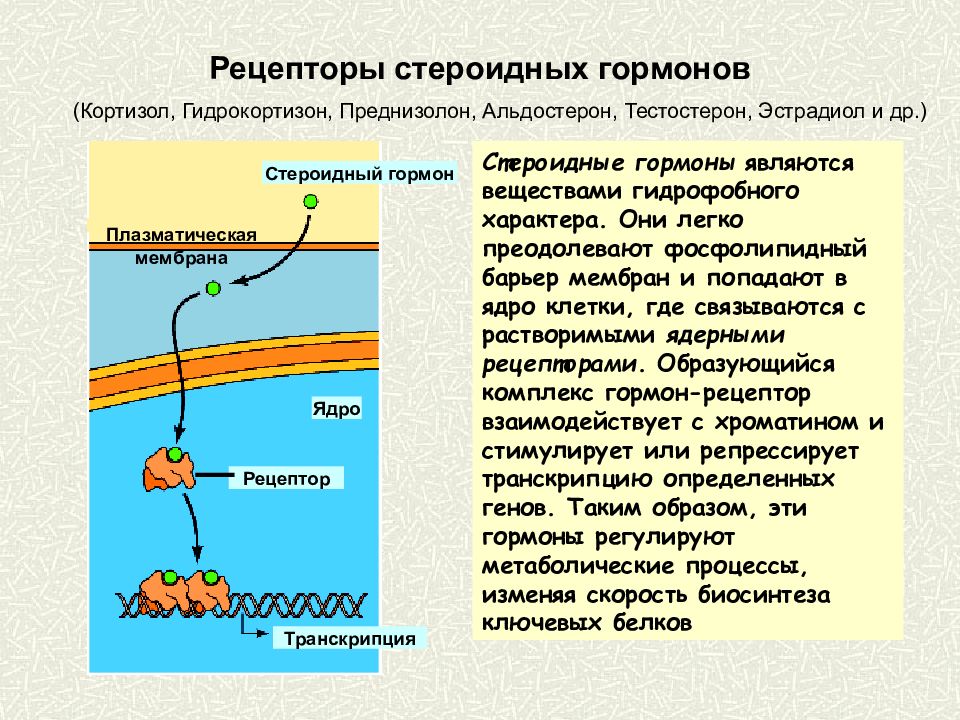
У женщин ФСГ влияет на формирование фолликула. Достижение максимального уровня ФСГ приводит к овуляции. У мужчин ФСГ стимулирует рост семявыносящих канальцев, увеличивает уровень тестостерона в крови, тем самым обеспечивая процесс созревания сперматозоидов и либидо. У мужчин ФСГ стимулирует рост семявыносящих канальцев, увеличивает уровень тестостерона в крови, тем самым обеспечивая процесс созревания сперматозоидов и либидо.
Определение уровня фолликулостимулирующего гормона (ФСГ) проводится для оценки функции гипофиза, репродуктивной функции (как женщин, так и мужчин), а так же при нарушениях полового созревания у детей и подростков. Анализ назначается для определения причин нарушения менструального цикла различного генеза, диагностика дисфункциональных маточных кровотечений, дифференциальная диагностика центральных и периферических форм заболеваний женской половой системы, контроля эффективности гормонотерапии.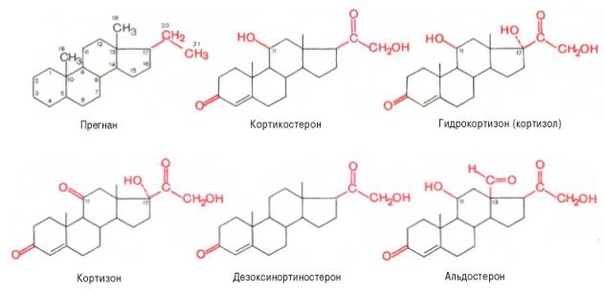
Пролактин – один из гормонов, синтезируемых гипофизом – железой контролирующей метаболизм, а также процессы роста и развития организма. Пролактин необходим для нормального развития молочных желез и обеспечения лактации — он увеличивает выработку молозива, способствует его созреванию и превращению в зрелое молоко. Он также стимулирует рост и развитие молочных желез, увеличение числа долек и протоков в них. Также он контролирует секрецию прогестерона и тормозит выработку фолликулостимулирующего гормона (ФЛГ), обеспечивая нормальный менструальный цикл, тормозя овуляцию и наступление новой беременности. В норме этот физиологический механизм предотвращает беременность следующим ребенком в период кормления грудью предыдущего и может предотвращать менструации в период кормления. В крови мужчин и небеременных женщин пролактин, обычно, присутствует в малых количествах. В повседневной жизни пролактин повышается во время сна, физической нагрузки и полового акта. Но у мужчин чрезмерное повышение его уровня способно нарушать половую функцию угнетая созревание сперматозоидов в яичках и вызывая бесплодие.
Но у мужчин чрезмерное повышение его уровня способно нарушать половую функцию угнетая созревание сперматозоидов в яичках и вызывая бесплодие.
Анализ используется для диагностики бесплодия и нарушения половой функции, исследования функции гипофиза, выяснения причины галактореи (выделения молока или молозива вне связи с процессом кормления ребёнка), головных болей и ухудшения зрения.
Хорионический гонадотропин человека (ХГЧ) – это гормон, который вырабатывается в плодной оболочке человеческого эмбриона. ХГЧ является важным показателем развития беременности и её отклонений. Его производят клетки хориона (оболочки зародыша) сразу после его прикрепления к стенке матки (это происходит лишь через несколько дней после оплодотворения). Зародыш на этом этапе беременности представляет собой заполненный жидкостью микроскопический пузырёк, стенки которого состоят из быстро размножающихся клеток. Из одной части этих клеток и развивается будущий ребёнок (эмбриобласт), в то время как из клеток, находящихся снаружи зародыша, образуется трофобласт – та часть плодного яйца, с помощью которого оно прикрепляется к стенке матки.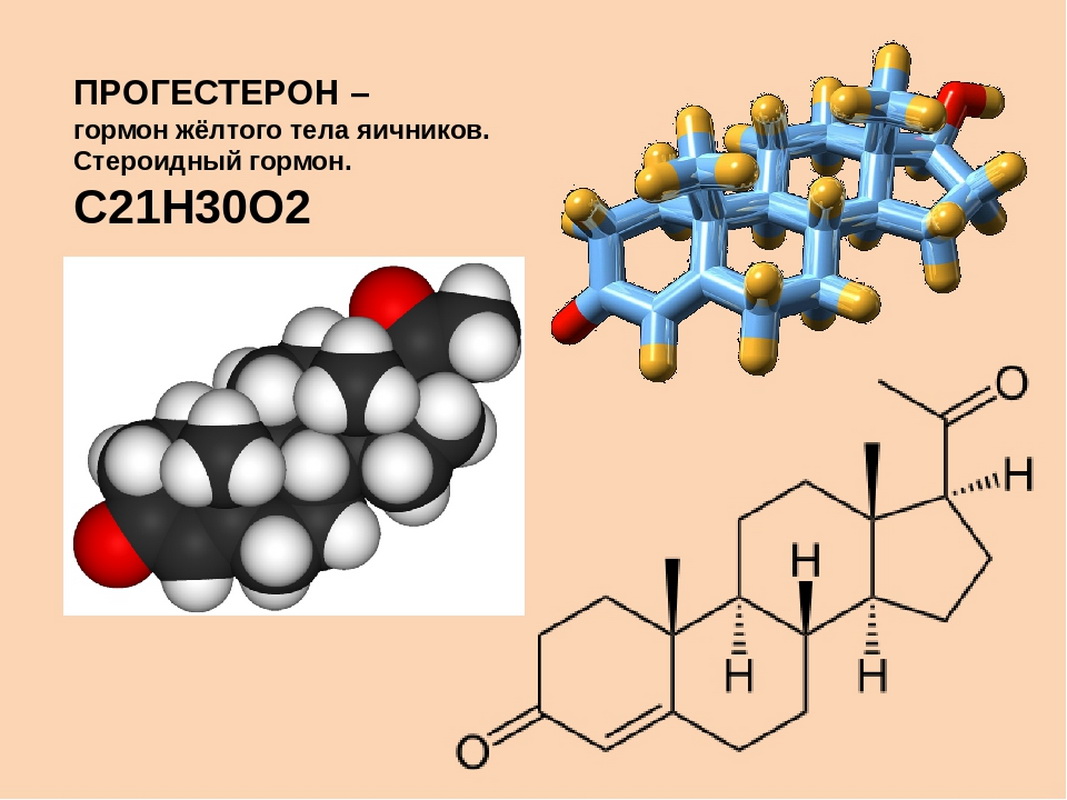 В дальнейшем из трофобласта образуется хорион.
В дальнейшем из трофобласта образуется хорион.
Хорион выполняет функцию питания зародыша, являясь посредником между организмом матери и ребенка. Кроме того, он вырабатывает хорионический гонадотропин, который, с одной стороны, влияет на формирование ребенка, с другой – специфическим образом воздействует на организм матери, обеспечивая благополучное протекание беременности. Появление этого гормона в организме будущей матери на начальной стадии беременности и объясняет важность теста для ранней диагностики беременности.
Хорионический гонадотропин стимулирует секреторную функцию жёлтого тела яичников, которое должно продуцировать гормон прогестерон, поддерживающий нормальное состояние внутренней оболочки стенки матки – эндометрия. Эндометрий обеспечивает надёжное прикрепление плодного яйца к организму матери и его питание всеми необходимыми веществами. Благодаря достаточному количеству хорионического гонадотропина жёлтое тело, в норме существующее лишь около 2 недель в течение каждого менструального цикла, при успешном зачатии не подвергается рассасыванию и остаётся функционально активным в течение всего срока беременности.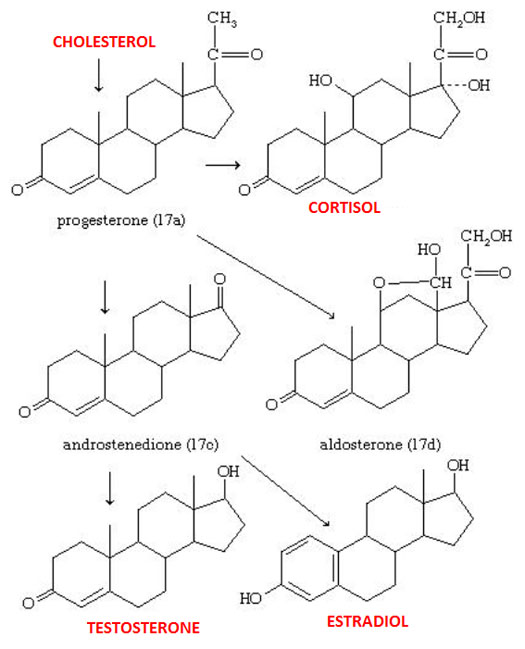 Причём именно у беременных под влиянием хорионического гонадотропина оно производит очень большие количества прогестерона. Кроме того, ХГЧ стимулирует продукцию эстрогенов и слабых андрогенов клетками яичников и способствует развитию функциональной активности самого хориона, а в дальнейшем и плаценты, которая образуется в результате созревания и разрастания хориональной ткани, улучшая её собственное питание и увеличивая количество ворсин хориона.
Причём именно у беременных под влиянием хорионического гонадотропина оно производит очень большие количества прогестерона. Кроме того, ХГЧ стимулирует продукцию эстрогенов и слабых андрогенов клетками яичников и способствует развитию функциональной активности самого хориона, а в дальнейшем и плаценты, которая образуется в результате созревания и разрастания хориональной ткани, улучшая её собственное питание и увеличивая количество ворсин хориона.
Таким образом, роль хорионического гонадотропина заключается в специфическом и многостороннем воздействии на организм женщины и плода в целях успешного протекания беременности.
На основании анализа на хорионический гонадотропин определяется присутствие в организме женщины хорионической ткани, а значит, и беременность. Анализ используется, в том числе, для диагностики многоплодной, внематочной и неразвивающейся беременности, выявления задержек в развитии плода, угрозы самопроизвольного аборта, недостаточности функции плаценты. Может назначаться, как часть комплексного обследования по выявлению пороков развития плода, а также для контроля за эффективностью искусственного аборта.
Свободный В-ХГЧ – Бета-субъединица хорионического гонадотропина человека – одна из составляющих молекулы специфического гормона – хорионического гонадотропина, образующегося в оболочке человеческого эмбриона. При отсутствии беременности результат теста на бета-ХГЧ будет отрицательным. Обнаружение бета-ХГЧ позволяет предположить, что после оплодотворения прошло уже как минимум 5-6 дней.
Анализ проводят в целях ранней диагностики беременности (3–5-дневной задержки менструации), выявления её осложнений и диагностики заболеваний, связанных с нарушением секреции ХГЧ.
Эстрадиол — пожалуй, основной и один из наиболее активных женских половых гормонов группы эстрогенов. Относится к типично женским гормонам, поскольку, в женском организме в значительном количестве, вырабатывается яичниками, реализуя большое количество физиологических функций. У мужчин эстрадиол тоже вырабатывается, но в очень малом количестве, и имеет скорее вспомогательные функции.
В женском организме эстрадиол играет исключительно важную роль в регуляции менструального цикла и функционировании всей половой системы. В детском и пубертатном периодах, гормон отвечает за рост и развитие всех органов, относящиеся к репродуктивной сфере. Под его влиянием происходят циклические изменения в тканях половых органов, а также формирование вторичных женских половых признаков (рост молочных желез, оволосение лобка и подмышек и т.д.). У взрослых женщин эстрадиол стимулирует течение первой фазы менструального цикла, вызывает рост и пролиферацию (активное деление клеток) эндометрия, таким образом, подготавливая его к внедрению плодного яйца, и наступлению беременности. Во время беременности эстрадиол усиливает обмен веществ во всех тканях организма. По мере развития беременности он начинает вырабатываться плацентой всё в большем и большем количестве, обеспечивая т.о. повышенные потребности в скорости обмена веществ и кровотоке у женщины. В мужском организме эстрадиол участвует в формировании спермы, т. е. необходим для зачатия. Но, всё же, для мужчин его роль не настолько значительна, как для женщин.
е. необходим для зачатия. Но, всё же, для мужчин его роль не настолько значительна, как для женщин.
Определение уровня эстрадиола у женщин фертильного возраста проводится при диагностике большого числа заболеваний и состояний, таких как бесплодие, нарушения менструального цикла, отсутствие овуляций, поликистозе и опухолях яичников и т.п, а также для оценка функций плаценты на ранних сроках беременности и мониторинга при экстракорпоральном оплодотворении. Используется при диагностике и лечении остеопороза. У мужчин анализ проводится при низком качестве спермы и бесплодии, заболеваниях надпочечников и печени.
Андростендион – основной стероидный гормон, является промежуточным продуктом и основой для образования тестостерона и эстрона. Синтезируется, у мужчин и женщин, корой надпочечников и половыми железами. У обоих полов, уровень андростендиона имеет выраженные колебания, как в течении суток (максимум в утренние часы), так и с возрастом (увеличивается, примерно, с 7-и, и плавно снижается после 30 лет). У женщин показатель также зависит от фазы менструального цикла (максимум в середине) и значительно возрастает при беременности. Определение уровня андростендиона используется для оценки синтеза андрогенов (избытка секреции мужских гормонов) и диагностики различных нарушений функционирования половой и эндокринной систем.
У женщин показатель также зависит от фазы менструального цикла (максимум в середине) и значительно возрастает при беременности. Определение уровня андростендиона используется для оценки синтеза андрогенов (избытка секреции мужских гормонов) и диагностики различных нарушений функционирования половой и эндокринной систем.
Цены на исследования можно узнать в разделе «Прейскурант» клинической лаборатории. Кровь на исследования принимается ежедневно (кроме воскресенья) с 7 до 11 часов. Строго натощак.
Прочтите так же о Гормонах надпочечников и Гормонах щитовидной железы
Анаболические стероиды и тестостерон | Dopinglinkki
C поправками от 02.04.2020
Тестостерон, так называемый мужской гормон, — это самый важный андроген в организме. У мужчин большая часть тестостерона вырабатывается в яичках клетками Лейдигина.Некоторое количество тестостерона производится также в коре надпочечников и на периферии путем преобразования андростендиона. У женщин уровень тестостерона гораздо меньше, чем у мужчин. Однако он оказывает важное воздействие и на женский организм. У женщин тестостерон производится в яичниках и коре надпочечников [1, 2]. Гормональная регуляция тестостерона поддерживается и контролируется осью гипоталамус-гипофиз-гонад.
У женщин уровень тестостерона гораздо меньше, чем у мужчин. Однако он оказывает важное воздействие и на женский организм. У женщин тестостерон производится в яичниках и коре надпочечников [1, 2]. Гормональная регуляция тестостерона поддерживается и контролируется осью гипоталамус-гипофиз-гонад.
Андрогены оказывают андрогенное, анаболическое и психологическое воздействие на организм. Андрогенные эффекты включают рост полового члена и простаты, рост волос в различных областях и облысение. Анаболические эффекты включают увеличение гортани, утолщение голосовых связок, изменения липидов, рост мышц, потерю жира, увеличение сальных желез и образование клеток крови. Психологические эффекты андрогенов включают изменения в либидо, потенции, сексуальном поведении, а также агрессию [3].
Анаболические стероиды — это синтетические производные тестостерона. В медицине анаболические стероиды использовались для попытки добиться анаболического воздействия тестостерона без вирилизирующих побочных эффектов андрогенов для того, чтобы дети и женщины также могли их применять.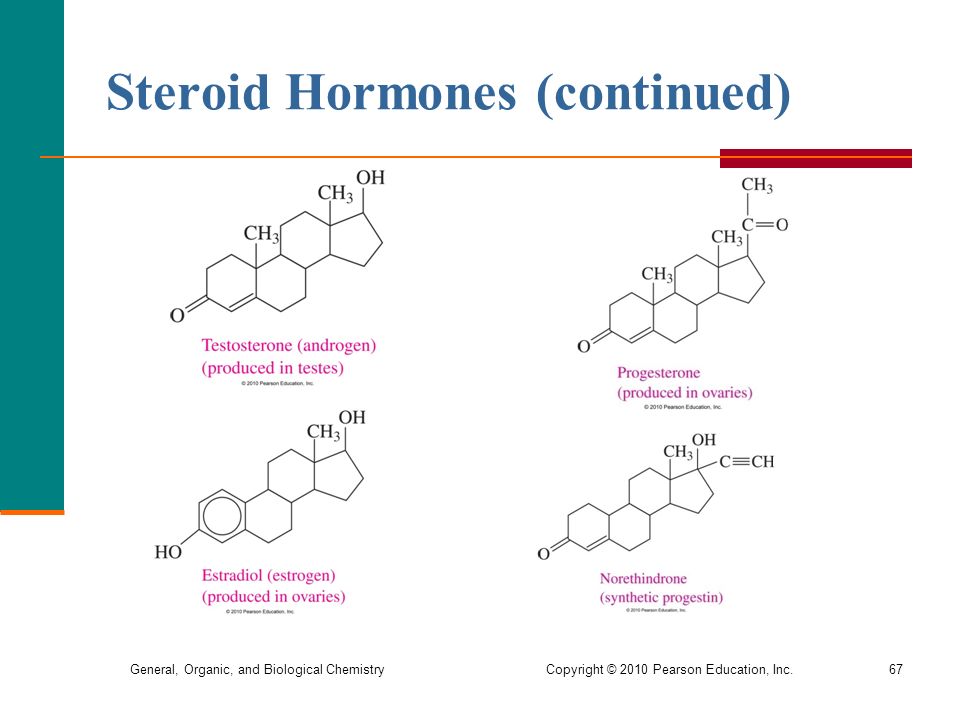 Однако попытка не удалась. По этой причине термин «анаболический стероид» вводит в заблуждение. Правильнее использовать термин «анаболический андрогенный стероид» [4].
Однако попытка не удалась. По этой причине термин «анаболический стероид» вводит в заблуждение. Правильнее использовать термин «анаболический андрогенный стероид» [4].
Тестостерон является естественным анаболическим андрогенным стероидом в организме. Тестостерон и другие анаболические стероиды имеют одинаковую химическую структуру. Предпринимались попытки изменить структуру синтетических анаболических стероидов путем увеличения анаболического эффекта и снижения андрогенного эффекта [5]. Соотношение анаболической и андрогенной активности тестостерона составляет 1:1, и каждая имеет сильное влияние. У других анаболических стероидов это соотношение варьируется с преобладанием анаболического эффекта [2, 6]. Кроме того, меняли структуру анаболических стероидов, чтобы можно было корректировать способ введения, абсорбцию, длительность воздействия и ароматизацию вещества. Таким образом, анаболические стероиды различаются по своему анаболическому и андрогенному соотношению, способу введения (пероральный, внутримышечный, кожный), времени абсорбции, продолжительности действия в организме и их ароматизации до эстрогена [7, 8].
Историю применения тестостерона можно проследить до 1935 года, когда тестостерон был успешно выделен из яичек быка. Было довольно быстро обнаружено, что пероральный тестостерон является гепатотоксичным и имеет быстрый период полувыведения. После синтезирования тестостерона на рынке появился инъекционный пропионат, а позднее, в 1950-х годах, энантат более длительного действия. В 1950-х и 1960-х годах фармацевтическая промышленность все больше интересовалась новыми андрогенами, и к концу 1980-х годов было разработано огромное количество анаболических стероидов, свыше тысячи [9, 10].
Механизм воздействия
Тестостерон и все анаболические стероиды действуют через андрогенные рецепторы. Андрогенные рецепторы расположены на х-хромосоме клеток и находятся в организме повсеместно. Помимо мышц, андрогенные рецепторы влияют на сердце, иммунитет и нервную систему [11].
Популярность тестостерона в качестве допинга объясняется его сильным влиянием на мышечную силу и массу. Тестостерон также влияет на липолиз, т. е. на расщепление жировых клеток. Как краткосрочное, так и долгосрочное использование анаболических стероидов приводит к увеличению роста клеток из-за увеличения синтеза белка. Вызванный тестостероном рост мышечных клеток обусловлен активацией сателлитных клеток и ростом ядер мышечных клеток [2].
Тестостерон также влияет на липолиз, т. е. на расщепление жировых клеток. Как краткосрочное, так и долгосрочное использование анаболических стероидов приводит к увеличению роста клеток из-за увеличения синтеза белка. Вызванный тестостероном рост мышечных клеток обусловлен активацией сателлитных клеток и ростом ядер мышечных клеток [2].
Количество андрогенных рецепторов ограничено, и обычно нормального уровня тестостерона им достаточно. Следовательно, рост мышц не обязательно объясняется избытком анаболических стероидов. Другим механизмом, объясняющим рост мышц, может быть влияние анаболических стероидов на кортизол. Кортизол является катаболическим гормоном, и анаболические стероиды могут ослабить его эффект. Ингибирующее действие анаболических стероидов на ген миостатина также считается механизмом роста мышц. Миостатин регулирует рост мышц [8]. Тестостерон также увеличивает секрецию гормона роста и инсулиноподобного фактора роста [12].
Применение в медицине
По классификации данные вещества относятся к рецептурным препаратам, применение которых разрешено только для лечения заболеваний, подтвержденных органами по контролю лекарственных средств. К этим заболеваниям относятся, помимо прочего, синдром дефицита тестостерона (СДТ), который развивается из-за нарушения функции гипофиза или яичек, различные виды анемии, остеопороз и хронические заболевания с дефицитом белков, а также замедление заживления тканей. Тестостерон также используется для лечения симптомов мужского эквивалента менопаузы. Использование тестостерона по рецепту значительно возросло за последние несколько десятилетий, как в Финляндии, так и в других странах [13, 14, 15].
К этим заболеваниям относятся, помимо прочего, синдром дефицита тестостерона (СДТ), который развивается из-за нарушения функции гипофиза или яичек, различные виды анемии, остеопороз и хронические заболевания с дефицитом белков, а также замедление заживления тканей. Тестостерон также используется для лечения симптомов мужского эквивалента менопаузы. Использование тестостерона по рецепту значительно возросло за последние несколько десятилетий, как в Финляндии, так и в других странах [13, 14, 15].
Тестостерон применяется в инъекционной форме в виде смеси различных эфиров тестостерона (например, тестостерона пропионата, тестостерона энантата, тестостерона фенилпропионата, тестостерона изокапроата, тестостерона деканоата, тестостерона ундеканоата) или внутрь, в форме капсул, содержащих тестостерона ундеканоат. Анаболические стероиды доступны в форме инъекций и таблеток.
Применение в качестве допинга
В соответствии с Уголовным кодексом, и тестостерон, и анаболические стероиды являются допинговыми веществами. Они являются наиболее популярными допинговыми веществами.
Они являются наиболее популярными допинговыми веществами.
Например, следующие вещества (торговые наименования в скобках) незаконно продаются в Интернете и в других местах на черном рынке:
- нандролон (Deca-Durabolin, Retabolin, Laurobolin)
- метандиенон (Dianabol, Danabol, Anabol, Metabolin)
- станозолол (Stromba, Winstrol, Winstrol Depot)
- тренболол (Parabolan, Finajet)
- оксиметолон (Anapolon, Anadrol, Androlic)
- оксандролон (Anavar)
- болденон (Equipose)
- флюоксиместерон (Halotestin)
- метенолол (Primobolan, Primobolan Depot)
- тестостерон с производными (Sustanon, Panteston)
Наиболее важной причиной употребления препаратов тестостерона и анаболических стероидов является стремление улучшить атлетическую форму. Быстрые результаты и замедление развития мышечного роста, естественно, могут, безусловно, мотивировать на применение. Мотивация тяжелоатлетов — улучшить спортивные результаты. Другие мотивы использования включают повышение эффективности тренировки, сжигание жира, замедление изменений, вызываемых старением, повышение уверенности в себе и улучшение настроения [8, 16, 17, 18, 19, 20].
Другие мотивы использования включают повышение эффективности тренировки, сжигание жира, замедление изменений, вызываемых старением, повышение уверенности в себе и улучшение настроения [8, 16, 17, 18, 19, 20].
Анаболические стероиды часто используются курсами. Курс применения может длиться от нескольких недель до нескольких лет, но в среднем несколько месяцев. Между периодами использования часто делаются перерывы в несколько месяцев. В начальной фазе применения доза стероидов повышается постепенно. В заключительной фазе применение стероидов постепенно прекращается в течение 1–2 недель. Целью перерывов является уменьшение побочных эффектов и восстановление гормональной функции организма. Еще один метод применения — это т. н. «blast and cruise». Он подразумевает, что прием больших доз (blast) чередуется с малыми дозами (cruise). Во время курса «Blast and cruise» стероиды принимают постоянно, без перерывов. Для злоупотребления характерно применение чрезмерных доз анаболических стероидов и одновременное применение разных видов стероидов (stacking) [8, 16, 17, 20, 21]. Оральные анаболические стероиды используются ежедневно из-за их быстрого периода полураспада. Анаболические стероиды, вводимые внутримышечно, часто используются еженедельно [22].
Оральные анаболические стероиды используются ежедневно из-за их быстрого периода полураспада. Анаболические стероиды, вводимые внутримышечно, часто используются еженедельно [22].
Медицинское использование анаболических стероидов направлено на достижение физиологических концентраций в организме, но допинг часто нацелен на достижение концентраций примерно в 40–100 раз выше (супрафизиологические концентрации) [8].
Побочные эффекты
Андрогенные рецепторы присутствуют в организме повсеместно, и поэтому анаболические стероиды воздействуют на работы разных внутренних органов. Из-за этого имеется ряд возможных побочных эффектов. Некоторые — легкие и проходящие, а некоторые опасны для жизни. Риск побочных эффектов возрастает при длительном применении высоких доз.
Изучение побочных эффектов анаболических андрогенных стероидов и получение научных данных затрудняется рядом факторов. В некоторых странах применять анаболические стероиды запрещено, и в этом случае человек вряд ли сообщит об их использовании. Из-за того, что вещество приобретено на черном рынке, пользователь может не знать, в каких дозах и что именно он употребляет. По этическим причинам побочные эффекты от приема высоких доз не исследуются на людях. Кроме того, предназначенные для животных вещества используются не по назначению, и нет данных о воздействии этих веществ на человека. Таким образом, данные исследований в основном носят умозрительный характер, часто основаны на тематических исследованиях и исследованиях с использованием медицинских доз [8].
Из-за того, что вещество приобретено на черном рынке, пользователь может не знать, в каких дозах и что именно он употребляет. По этическим причинам побочные эффекты от приема высоких доз не исследуются на людях. Кроме того, предназначенные для животных вещества используются не по назначению, и нет данных о воздействии этих веществ на человека. Таким образом, данные исследований в основном носят умозрительный характер, часто основаны на тематических исследованиях и исследованиях с использованием медицинских доз [8].
Согласно проведенному в Финляндии популяционному исследованию, риск преждевременной смерти среди лиц, злоупотребляющих анаболическими стероидами и тестостероном, в 4,6 раза выше, чем в контрольной группе [23]. В аналогичном датском исследовании смертность среди потребителей анаболических стероидов была за семь лет в три раза выше, чем в контрольной группе. Потребители также гораздо чаще обращались за медицинской помощью [24].
Побочные эффекты: гормональные нарушения
При введении тестостерона и анаболических стероидов в количествах, которые превышают потребности организма, развиваются гормональные нарушения и нарушения репродуктивной функции.
У мужчин собственная выработка гормонов в организме снижается. Отмечаются сморщивание гормонпродуцирующих желез и органов, например яичек. После курсов применения гормонов могут развиться бесплодие и снижение половой функции [25, 26].
Эти изменения часто обратимы, но могут присутствовать много лет. Иногда организм вообще не восстанавливается.
У мужчин может развиться гинекомастия, то есть разрастание грудных желез, и появиться боль за грудиной. Это связано с тем, что тестостерон и некоторые анаболические стероиды ароматизируются в эстроген [27, 28, 29].
У женщин применение тестостерона и анаболических стероидов вызывают избыточный рост волос на теле, огрубение голоса, уменьшение размера молочных желез, облысение, увеличение размера клитора, заболевания кожи и нарушения менструального цикла. Некоторые из этих симптомов сохраняются даже после прекращения применения данных веществ [25].
У подростков в результате применения тестостерона и анаболических стероидов может остановиться рост, что может привести к развитию низкорослости [25]. В подростковом возрасте использование анаболических стероидов может быть более вредным, чем использование, начатое в зрелом возрасте [30].
В подростковом возрасте использование анаболических стероидов может быть более вредным, чем использование, начатое в зрелом возрасте [30].
Побочные эффекты: тяжелые заболевания
Тестостерон и анаболические стероиды, используемые в избыточных дозах, могут привести к значительным отклонениям содержания жира организма до уровней, опасных для здоровья. Они также оказывают влияние на факторы свертывания крови и гемоглобин. Таким образом, длительное применение этих гормонов может привести к повышению риска заболеваний сердца и сосудов, инфаркта миокарда и инсульта. Стероиды ослабляют сократительную способность сердца и приводят к дегенерации сердечной мышцы, что может привести к аритмии сердца и внезапной смерти [31, 32, 33, 34].
Злоупотребление анаболическими стероидами и препаратами тестостерона повышает риск развития сахарного диабета. Использование повышает резистентность к инсулину и риск диабета, может вызвать преддиабетное состояние [35]. Использование одних и тех же шприцев разными людьми повышает риск заболеваний, передаваемых с кровью, к которым относятся гепатит и ВИЧ-инфекция [36].
Злоупотребление препаратами тестостерона и анаболическими стероидами также повышает риск развития рака и поражения печени [16, 37]. Анаболические стероиды, принимаемые внутрь в форме таблеток, более опасны для печени, чем стероиды, используемые в инъекционной форме. Заболевания печени могут варьировать от обратимых легких клеточных нарушений до желтухи и злокачественных опухолей печени с плохим прогнозом, несмотря на проводимое лечение.
Побочные эффекты: нарушения со стороны психики
Препараты тестостерона и анаболических стероидов также влияют на центральную нервную систему. Участки в головном мозге, на которые они оказывают влияние, тесно связаны с центрами, регулирующими настроение, половое влечение и агрессивность [38].
На фоне использования стероидов у 20–30 % людей, применяющих избыточные дозы тестостерона и анаболических стероидов, отмечаются явные нарушения настроения, которые могут соответствовать критериям классификации психических заболеваний, к которым относятся депрессия, возбуждение, психотические реакции с галлюцинациями и снижение когнитивной функции [8, 25, 31]. Также подсчитано, что около трети потребителей анаболических стероидов испытывают зависимость от анаболических стероидов [39, 40].
Также подсчитано, что около трети потребителей анаболических стероидов испытывают зависимость от анаболических стероидов [39, 40].
Примерно у 30 % людей на фоне применениях избыточных доз тестостерона и анаболических стероидов отмечаются агрессивность, враждебность и раздражительность. В нескольких сообщениях о случаях было показано, что гормоны могут ослаблять контроль над побуждениями [31].
Расстройства настроения и изменения в поведении, вероятно, являются суммой многих факторов. Большое количество анаболических стероидов является одним из объясняющих факторов. Личность и психосоциальная среда пользователя также влияют на поведение, возникающее в результате использования анаболических стероидов. Убедительных доказательств т. н. приступов бешенства не имеется. В дополнение к анаболическим стероидам агрессивное и насильственное поведение часто ассоциируется с другими интоксикантами и подверженностью рискованному поведению в целом. Тем не менее, анаболические стероиды могут действовать как триггер [29, 41, 42, 43, 44].
Timo Seppälä (Тимо Сеппяля)
Директор по медицинским вопросам
Финский антидопинговый комитет FINADA (ныне — Финский центр этичного спорта SUEK ry)
Кем обновлено
Dopinglinkki
Стероиды и их влияние на организм человека
Анаболические стероиды являются очень эффективными для увеличения физической активности и роста мышц. Также очень распространено использование стероидов в медицинских целях. Чаще всего стероиды употребляют культуристы и спортсмены, нуждающиеся в большой мышечной массе, а также молодые люди, желающие выглядеть эффектно и привлекать внимание противоположного пола. Но так ли безопасно их использование, как думают спортсмены, желающие ускорить рост мышц? Как влияют стероиды на организм человека и обратимы ли последствия их употребления?
Стероиды — это биологические соединения, которые обычно являются производным от половых гормонов тестостерона и дигидротестостерона, которые имеют очень сильное воздействие на человеческий организм. В настоящее время имеется более 100 разновидностей стероидов, доступных как в форме таблеток, так и в инъекционной форме.
В настоящее время имеется более 100 разновидностей стероидов, доступных как в форме таблеток, так и в инъекционной форме.
Медицинское использование стероидов
По медицинским показаниям назначают лечение с использованием стероидов при раке, СПИДе, астме, некоторых болезнях сердца, гормональной дисфункции. Стероиды имеют ярко выраженное противовоспалительное действие, что способствует быстрому заживлению ран, снятию воспалительных процессов, отёков и нормализации работы иммунной системы человека. Также они помогают регулировать метаболизм и контролировать уровень электролитов в крови. Употребление стероидов проводится под контролем врача и риск развития побочных эффектов сводится практически к 0%
Немедицинское использование стероидов
Стероиды, обычно в форме тестостерона, частично отвечают за развитие организма, особенно среди подростков. Они имеют андрогенный эффект, связанный с изменениями в первичных и вторичных сексуальных признаках, таких как изменение голоса, рост волос на теле, развитие мускулатуры и рост костей. Стероиды, попадая в клетки, активируют определённые гены, отвечающие за создание и использование протеина. В итоге весь протеин идёт на развитие и увеличение мышечной массы человека. Так как употребление стероидов у спортсменов проходит без контроля и в дозах, которые в десятки раз превышают допустимые, риск развития побочных эффектов достигает 70%. Люди, постоянно употребляющие стероиды, в семь раз больше подвержены заболеванию рака печени, в десять раз больше заболеваниям сердечно-сосудистой системы, в пять раз больше заболеваниям репродуктивного характера, во много раз больше психическим заболеваниям и психологическим расстройствам, чем люди, не употребляющие стероиды.
Стероиды, попадая в клетки, активируют определённые гены, отвечающие за создание и использование протеина. В итоге весь протеин идёт на развитие и увеличение мышечной массы человека. Так как употребление стероидов у спортсменов проходит без контроля и в дозах, которые в десятки раз превышают допустимые, риск развития побочных эффектов достигает 70%. Люди, постоянно употребляющие стероиды, в семь раз больше подвержены заболеванию рака печени, в десять раз больше заболеваниям сердечно-сосудистой системы, в пять раз больше заболеваниям репродуктивного характера, во много раз больше психическим заболеваниям и психологическим расстройствам, чем люди, не употребляющие стероиды.
Побочные эффекты от краткосрочного употребления стероидов:
Угревая сыпь, атрофия яичек, снижение выработки спермы, гинекомастия, высокое кровяное давление, увеличение уровня плохого холестерина, расширение простаты, ухудшение работы печени, необоснованная агрессия.
Побочные эффекты от длительного употребления стероидов:
Гепатит и цирроз печени, неврологические проблемы, заторможенность, при отмене употребления — ожирение, агрессия.
Сторонники употребления стероидов считают, что выгоды от этих препаратов больше чем вреда. Но взгляните на перечень побочных эффектов, многие из которых имеют необратимые последствия. Занимайтесь «чистым» спортом и живите полноценной здоровой жизнью.
Базис.Эндокринология. Половые стероиды
Гиперэстрогения — состояние, при котором наблюдается избыток эстрогенов. Именно эстрогены являются катализатором пролиферации эндометрия и клеток молочной железы. От них зависит не только репродуктивная система, но и мозг, кости, волосы, волосяные фолликулы. Гиперэстрогения может приводить к таким серьезным последствиям, как нарушение или отсутствие менструаций, инсулинорезистентность, бесплодие, невынашивание беременности, гипертония и атеросклероз до 50 лет, остеопороз, депрессия. У мужчин может развиться гинекомастия и нарушение репродуктивной системы: снижение либидо, импотенция, нарушение полового акта, бесплодие (нарушение сперматогенеза), ожирение по женскому типу, метаболический синдром, снижение мышечной массы, депрессия, апатия, слабость, утомляемость.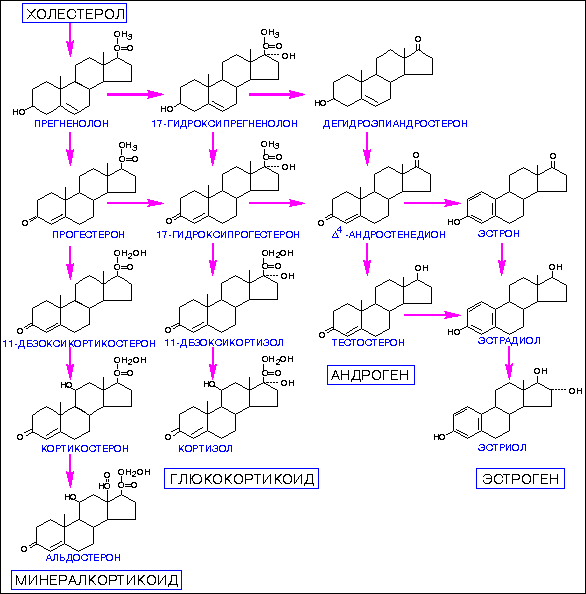
Гиперандрогения — синдром, обусловленный повышенным количеством андрогенов в периферической крови и/или их активностью, находящейся за пределами нормы (повышенной). Среди симптомов этого заболевания — нарушение правильного функционирования волосяных фолликулов и сальных желез, которое выражается в акне, себорейном дерматите, гирсутизме, а также определенные репродуктивные проблемы (альгодисменорея, олигоменорея, полименорея, аменорея, бесплодие), у мужчин: метаболический синдром. инсулинорезистентность, гипертония, атеросклероз, депрессия, нарушение сна, утренний дискомфорт в мышцах.
В этом разделе мы анализируем два гена: 17-альфа гидроксилазу и ароматазу. Оба этих фермента относятся к классу цитохромов. 17- альфа гидроскилаза участвует в синтезе всех половых гормонов (андрогенов и эстрогенов). Полиморфизм АА приводит к увеличению синтеза гормонов, то есть к гиперандрогении и гиперэстрогении.
Второй фермент — ароматаза — переводит тестостерон в эстрадиол (все женские половые гормоны синтезируются из мужских с помощью фермента ароматазы). Если его работа усилена, это приводит к повышенному синтезу эстрадиола и гиперэстрогении
Если его работа усилена, это приводит к повышенному синтезу эстрадиола и гиперэстрогении
Эксперт объяснил, как именно стероиды вредят здоровью
В чем заключается вред стероидов, сегодня спросим у главного фармаколога Санкт-Петербурга, профессора, Александра Хаджидиса.
— Здравствуйте, Александр Киариакович!
— Здравствуйте.
— Постоянно пишут, что умер этот бодилдер, умер этот культурист. Это действительно может быть каким-то образом связано с употреблением стероидных препаратов?
— Имеет место наращивание мышечной массы, в том числе, и мышцы сердечной. И тогда проблемы сердечные могут возникать. Гипертрофированная увеличенная мышца сердечная она больше, а функциональная способность, она меньше.
— Сколько примерно времени должно пройти, чтобы вот это метаморфоза случилась сердцем?
— Это месяцы. Годы уж тем более.
— Стероидный препарат — можно сказать, что это гормональный препарат?
— Это и есть гормональный препарат. Любой человек вырабатывает в течение суток утром побольше, днем поменьше, эти самые гормоны. Кроме прочего, гормоны обуславливают многие функции. В том числе и функцию потенциальную. Либидо. Это же и есть утреннее настроение. Хотят стать красивыми для того, чтобы иметь успех, в том числе, у женщин, да, в первую очередь.
Любой человек вырабатывает в течение суток утром побольше, днем поменьше, эти самые гормоны. Кроме прочего, гормоны обуславливают многие функции. В том числе и функцию потенциальную. Либидо. Это же и есть утреннее настроение. Хотят стать красивыми для того, чтобы иметь успех, в том числе, у женщин, да, в первую очередь.
— Каким образом эти препараты могут сыграть злую шутку с функцией либидо?
— Мне трудно это комментировать, наверняка, не все оставите для эфира. Имеет место быть, так называемые, циркадные или циркогенные циклы выработки гормонов. В естественном состоянии организма. Вот этот прием лекарственных препаратов, он, наоборот, может обладать супрессивным действием, то есть подавляющим на выработку собственных гормонов. Все лекарственные средства опасны. И только некоторые могут быть полезны. Здесь профиль безопасности настолько плохой, что такое нерадивое употребление их с целью накачки мышц, красоты, это очень плохо. Поставьте любое слово. Может быть этот разговор будет полезен для каких-то людей, может быть не очень созревших умственно в плане предостережения.
Стероидный гормон Определение и примеры
Определение
существительное, множественное число: стероидные гормоны
Тип стероида, который действует как гормон, примером которого являются половые стероиды, кортикостероиды и анаболические стероиды
Дополнение
Стероиды — это органические соединения, полученные из ланостерола у животных и грибов и из циклоартенола у растений. У животных стероиды включают те, что содержатся у позвоночных и насекомых. Стероиды у позвоночных, включая человека, включают холестерин и стероидные гормоны.
Стероидный гормон — это стероид, который действует как гормон. Стероидные гормоны включают половые стероиды (например, андрогены, эстрогены и прогестероны), кортикостероиды (например, глюкокортикоиды и минералокортикоиды) и анаболические стероиды. Следовательно, они участвуют в регулировании развития половых признаков, воспаления, иммунных функций и гомеостаза.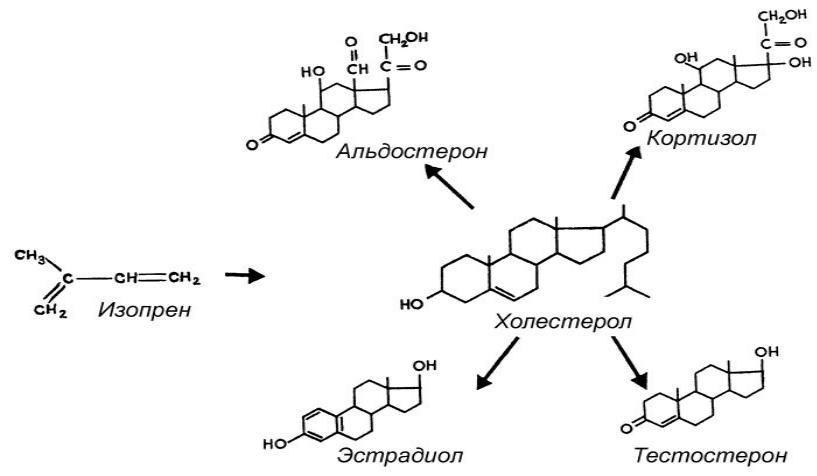
Стероидные гормоны обычно получают из стерола, холестерина. В зависимости от типа они вырабатываются гонадами или надпочечниками.Когда они секретируются, они попадают в кровоток, будучи связанными с белками-носителями (например, глобулин, связывающий половые гормоны, для половых гормонов, белок, связывающий кортикостероиды, для кортикостероидов, альбумин и т. Д.). Затем они достигают своей целевой ячейки. В гипотезе о свободном гормоне предполагается, что стероидный гормон свободно проходит через клеточную мембрану клетки-мишени, поскольку они являются липидами. Внутри клетки они становятся активными, когда белок-носитель высвобождает их и связывается с рецепторами стероидных гормонов в ядре или в цитозоле.Это взаимодействие приведет к изменениям внутри клетки.
Согласно другой гипотезе, комплекс стероидного гормона-белка-носителя стыкуется с мегалином , мембранным рецептором. Затем это приводит к его эндоцитозу, который попадает внутрь клетки-мишени. Находясь внутри, комплекс попадает в лизосому для разложения белка-носителя и высвобождения стероидного гормона в цитозоль. Затем стероидный гормон оказывает свое действие на клетку через геномный путь.
Находясь внутри, комплекс попадает в лизосому для разложения белка-носителя и высвобождения стероидного гормона в цитозоль. Затем стероидный гормон оказывает свое действие на клетку через геномный путь.
См. Также:
Последнее обновление 24 июня 2021 г.
4 Репродуктивные стероидные гормоны: синтез, структура и биохимия | Клиническая полезность комбинированной биоидентичной гормональной терапии: обзор безопасности, эффективности и использования
Кампа, м., В. Пелекану и Э. Кастанас. 2008. Мембранно-инициированное действие стероидов при раке груди и простаты. Стероиды 73 (9-10): 953–960.
Keller, P. 1974. Беременность. В Клиническая эндокринология: теория и практика . 2-е изд. Под редакцией А. Лабхарта. Берлин, Германия: Springer-Verlag. Стр. 667–706.
Kleine, B., and W.G. Rossmanith. 2016. Гормоны и эндокринная система . 1-е изд. Нью-Йорк: Спрингер.
Kuhl, H. 2005. Фармакология эстрогенов и прогестагенов: влияние различных путей введения. Climacteric 8 (Приложение 1): 3–63.
Liegibel, U.M., U. Sommer, I. Boercsoek, U. Hilscher, A. Bierhaus, H.U. Schweikert, P. Nawroth, and C. Kasperk. 2003. Изоформы рецепторов андрогенов ar-a и ar-b обнаруживают функциональные различия в культивируемых костных клетках человека и фибробластах кожи гениталий. Стероиды 68 (14): 1179–1187.
Lonard, D. M., and B. W. O’Malley. 2007. Корегуляторы ядерных рецепторов: судьи, присяжные и исполнители клеточной регуляции. Молекулярная ячейка 27 (5): 691-700.
Lonard, D. M., and B. W. O’Malley. 2012. Корегуляторы ядерных рецепторов: Модуляторы патологии и терапевтические мишени. Nature Reviews Endocrinology 8 (10): 598–604.
Мани, С. К., П. Г. Мермельштейн, М. Дж. Тетель и Г. Анесетти. 2012. Конвергенция множества механизмов действия стероидных гормонов. Гормоны и метаболические исследования 44 (8): 569–576.
Дж. Тетель и Г. Анесетти. 2012. Конвергенция множества механизмов действия стероидных гормонов. Гормоны и метаболические исследования 44 (8): 569–576.
С. Мелмед, К. Полонский, П. Ларсен и Х. Кроненберг. 2016. Учебник эндокринологии Вильямса .13-е изд. Филадельфия, Пенсильвания: Эльзевир.
NABP (Национальная ассоциация советов фармацевтов). 2019. Составлен список пяти наиболее распространенных рецептур из аптек 503A и аутсорсинговых предприятий 503B с 2016 по 2018 год. Ответ NABP на запрос относительно распространенных рецептур, выдаваемых пациентам (доступен через общедоступный файл национальных академий).
Нильсен, Дж. И Р. Д. Бринтон. 2003. Дивергентное влияние прогестерона и медроксипрогестерона ацетата (Провера) на передачу сигналов ядерной митоген-активируемой протеинкиназы. Слушания Национальной академии наук 100 (18): 10506–10511.
NLM (Национальная медицинская библиотека). 2020a. Ципионат эстрадиола . https://pubchem.ncbi.nlm.nih.gov/compound/9403 (по состоянию на 15 мая 2020 г.).
2020a. Ципионат эстрадиола . https://pubchem.ncbi.nlm.nih.gov/compound/9403 (по состоянию на 15 мая 2020 г.).
NLM. 2020b. Пропионат тестостерона . https://pubchem.ncbi.nlm.nih.gov/compound/5995 (по состоянию на 15 мая 2020 г.).
Порку П., А. М. Бэррон, К. А. Фрай, А. А. Вальф, С. Ю. Янг, X. Й. Хе, А. Л. Морроу, Г. К. Панзика и Р.C. Melcangi. 2016. Нейростероидогенез сегодня: новые цели для синтеза и действия нейроактивных стероидов и их актуальность для трансляционных исследований. Журнал нейроэндокринологии 28 (2).
Ратнер, М. Х., В. Кумаресан и Д. Х. Фарб. 2019. Действие нейростероидов при памяти и неврологических / психоневрологических расстройствах. Границы эндокринологии 10 (169).
Rubinow, D. R., and P. J. Schmidt. 2018. Есть ли роль репродуктивных стероидов в этиологии и лечении аффективных расстройств? Диалоги в клинической неврологии 20 (3): 187–196.
Рубинов, К. Б. 2018. Внутрикринный взгляд на половые стероиды, иммунитет и регуляцию метаболизма. Молекулярный метаболизм 15: 92–103.
Салахудин, М.С. и П.С. Ништала. 2017. Обзор фармакодинамического моделирования, лиганд-связывающего подхода и его применения в клинической практике. Саудовский фармацевтический журнал 25 (2): 165–175.
Шиффер, Л., Л. Барнард, Э. С. Барановски, Л. К. Гиллиган, А. Э. Тейлор, У. Арльт, К. Х. Л. Шеклтон и К.-ЧАС. Сторбек. 2019. Биосинтез, метаболизм и экскреция стероидов человека по-разному отражаются метаболомами стероидов в сыворотке и моче: всесторонний обзор. Журнал биохимии стероидов и молекулярной биологии 194: 105439.
Шварц, Н., А. Верма, К. Б. Бивенс, З. Шварц и Б. Д. Боян. 2016. Быстрое действие стероидных гормонов через мембранные рецепторы. Biochimica Biophysica Acta 1863 (9): 2289–2298.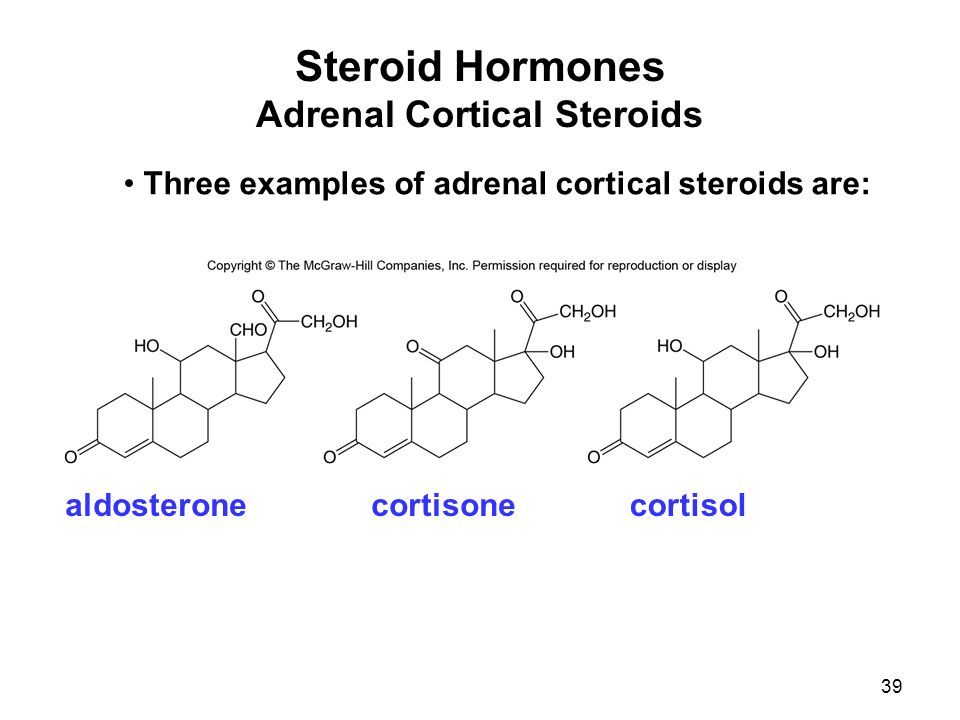
Специальный выпуск: стероидные гормоны и здоровье человека
Уважаемые коллеги,
Стероидные гормоны — это небольшие липофильные соединения, полученные из холестерина, которые играют ряд жизненно важных и важных физиологических ролей.Обычно они обнаруживаются в организме либо в конъюгированной форме в виде производных сульфата или глюкуронида, либо в виде связанных с белками. Стероидные гормоны синтезируются в основном железами внутренней секреции, такими как гонады (яички и яичники), надпочечники (глюкокортикоиды, минералокртикоиды и предшественники андрогенов) и плацента во время беременности. ЦНС также способна вырабатывать ряд биологически активных стероидов, называемых «нейростероидами», которые отвечают за ключевые пути ЦНС, участвующие в долгосрочном контроле симпатической и нейроэндокринной функции, сердечно-сосудистого гомеостаза и некоторых других физиологических функций.Биологическая активность стероидной молекулы зависит от ее способности взаимодействовать со специфическим сайтом связывания на соответствующем рецепторе.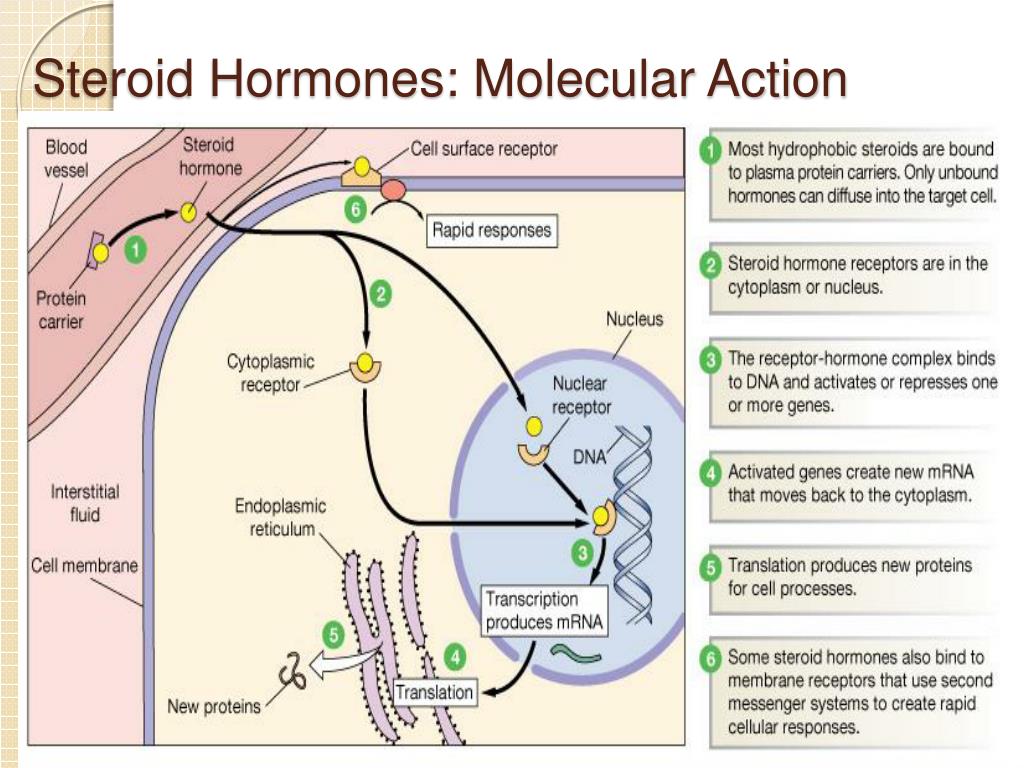 Стероидные гормоны помогают контролировать обмен веществ, воспаление, иммунные функции, солевой и водный баланс, развитие половых признаков и способность противостоять болезням и травмам.
Стероидные гормоны помогают контролировать обмен веществ, воспаление, иммунные функции, солевой и водный баланс, развитие половых признаков и способность противостоять болезням и травмам.
Различные классы стероидных гормонов регулируют и координируют биохимические, физиологические и поведенческие реакции различных видов биологической активности, например, глюкокортикоиды с их известным влиянием на метаболизм углеводов, липидов и белков (ожирение, метаболический синдром и т. Д.)) реакция на стресс и иммунная система, Половые стероиды и их влияние на репродуктивную функцию и поведение человека. Было доказано, что витамин D как стероидный гормон необходим для хорошего здоровья из-за его мультипотентного физиологического и биохимического воздействия на весь организм. Предшественник андрогенов, дегидроэпиандростерон, является одним из самых распространенных стероидных гормонов в организме человека, который обладает множеством действий, которые необходимо полностью изучить. DHEA был связан с улучшением когнитивной функции, укреплением иммунной системы и оказанием антагонистического действия по отношению к гормону стресса кортизолу.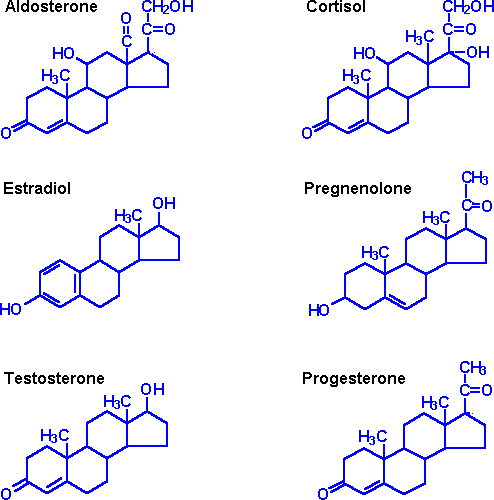 Обнаружено, что биоактивные андрогены (11b-ОН-тестостерон, оксотестостерон и ОН-андростерон) имеют потенциальное физиологическое значение для человека. Фактически, стероиды могут действовать как корегуляторы и коактиваторы при здоровье и болезнях. Метаболизм играет важную роль в действии стероидных гормонов, а образование активных метаболитов в тканях-мишенях важно для регуляции их клеточных и физиологических действий (многие нарушения являются результатом дефектов метаболизма тканей-мишеней). Некоторые ферменты участвуют в биосинтезе стероидов, и, таким образом, ряд эндокринных нарушений можно отнести к определенным дефектам ферментов.
Обнаружено, что биоактивные андрогены (11b-ОН-тестостерон, оксотестостерон и ОН-андростерон) имеют потенциальное физиологическое значение для человека. Фактически, стероиды могут действовать как корегуляторы и коактиваторы при здоровье и болезнях. Метаболизм играет важную роль в действии стероидных гормонов, а образование активных метаболитов в тканях-мишенях важно для регуляции их клеточных и физиологических действий (многие нарушения являются результатом дефектов метаболизма тканей-мишеней). Некоторые ферменты участвуют в биосинтезе стероидов, и, таким образом, ряд эндокринных нарушений можно отнести к определенным дефектам ферментов.
Питание можно использовать для лечения нескольких заболеваний, например стресса, за счет снижения уровня кортизола, в то время как витамины группы B могут стимулировать утомление надпочечников. «Питательная диета, наполненная антиоксидантами из ярко окрашенных фруктов и овощей, также может поддерживать здоровье иммунной системы, что может быть хорошо оценено при стрессе». В нескольких исследованиях изучалось, влияет ли тип макроэлементов на постпрандиальную реакцию кортизола. Исследования и клинические исследования теперь связаны потребление растительной диеты с различными полезными для здоровья и биологическими видами деятельности.Функциональные питательные вещества стали важными не только для производства энергии и веществ в организме классического метаболизма, но и для создания кондиционирующей среды, которая модулирует активность эпигенома и влияет на адаптивные реакции к стрессу, энергетический метаболизм, иммунный гомеостаз и профилактику заболеваний. Мы сообщали, что полифенолы в гранате и зеленом кофе могут подавлять активность 11B-HSD1, тем самым улучшая настроение и снижая стресс, вызывая небольшое снижение артериального давления и уровня гормона стресса кортизола.Следовательно, диета, богатая полифенолами, может оказывать благотворное влияние на здоровье за счет нескольких способов воздействия, влияющих на различные клеточные пути, и, скорее всего, важным фактором является модуляция стероидных гормонов.
В нескольких исследованиях изучалось, влияет ли тип макроэлементов на постпрандиальную реакцию кортизола. Исследования и клинические исследования теперь связаны потребление растительной диеты с различными полезными для здоровья и биологическими видами деятельности.Функциональные питательные вещества стали важными не только для производства энергии и веществ в организме классического метаболизма, но и для создания кондиционирующей среды, которая модулирует активность эпигенома и влияет на адаптивные реакции к стрессу, энергетический метаболизм, иммунный гомеостаз и профилактику заболеваний. Мы сообщали, что полифенолы в гранате и зеленом кофе могут подавлять активность 11B-HSD1, тем самым улучшая настроение и снижая стресс, вызывая небольшое снижение артериального давления и уровня гормона стресса кортизола.Следовательно, диета, богатая полифенолами, может оказывать благотворное влияние на здоровье за счет нескольких способов воздействия, влияющих на различные клеточные пути, и, скорее всего, важным фактором является модуляция стероидных гормонов.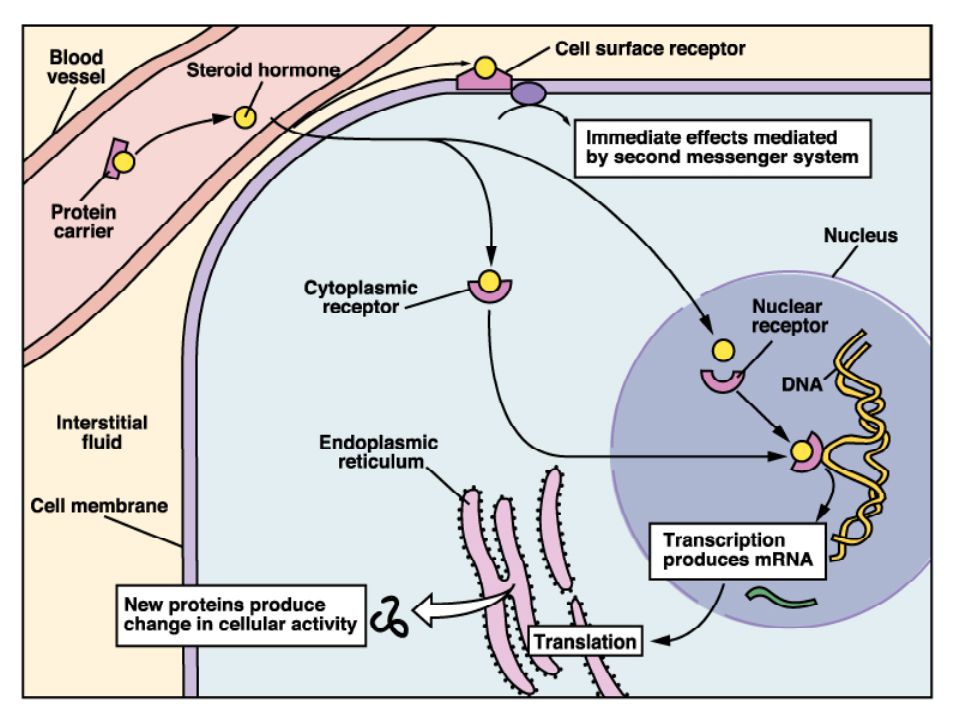
Темы:
- Пищевая регуляция метаболизма / действия стероидных гормонов
- Физиологическое значение биоактивных андрогенов
- Секс-стероиды и поведение
- Роль витамина D в здоровье человека
- Стероидные гормоны, когнитивные функции и здоровое старение
- Стероидные гормоны в молочных продуктах и влияние на здоровье населения
Приглашенный редактор
Информация для подачи рукописей
Рукописи должны быть представлены онлайн по адресу www.mdpi.com, зарегистрировавшись и войдя на этот сайт. После регистрации щелкните здесь, чтобы перейти к форме отправки. Рукописи можно подавать до установленного срока. Все статьи будут рецензироваться. Принятые статьи будут постоянно публиковаться в журнале (как только они будут приняты) и будут перечислены вместе на веб-сайте специального выпуска.Приглашаются исследовательские статьи, обзорные статьи, а также короткие сообщения. Для запланированных статей название и краткое резюме (около 100 слов) можно отправить в редакцию для объявления на этом сайте.
Для запланированных статей название и краткое резюме (около 100 слов) можно отправить в редакцию для объявления на этом сайте.
Представленные рукописи не должны были публиковаться ранее или рассматриваться для публикации в другом месте (кроме трудов конференции). Все рукописи проходят тщательное рецензирование путем слепого рецензирования. Руководство для авторов и другая важная информация для подачи рукописей доступна на странице Инструкции для авторов. Nutrients — это международный рецензируемый ежемесячный журнал с открытым доступом, публикуемый MDPI.
Пожалуйста, посетите страницу Инструкции для авторов перед отправкой рукописи.
Плата за обработку статьи (APC) для публикации в этом журнале с открытым доступом составляет 2400 CHF (швейцарских франков).
Представленные документы должны быть хорошо отформатированы и написаны на хорошем английском языке. Авторы могут использовать MDPI
Услуги редактирования на английском языке перед публикацией или во время редактирования автора.
Роль половых стероидных гормонов во взаимодействиях бактерий и хозяев
Половые стероидные гормоны играют важную физиологическую роль в репродуктивных и непродуктивных тканях, включая иммунные клетки.Эти гормоны выполняют свои функции путем связывания либо со специфическими внутриклеточными рецепторами, которые действуют как лиганд-зависимые факторы транскрипции, либо с мембранными рецепторами, которые стимулируют несколько путей передачи сигнала. Повышенная восприимчивость мужчин к бактериальным инфекциям может быть связана с обычно более низкими иммунными реакциями у мужчин по сравнению с женщинами. Эта диморфная половая разница в основном связана с дифференциальной модуляцией иммунной системы половыми стероидными гормонами посредством контроля экспрессии провоспалительных и противовоспалительных цитокинов, а также экспрессии Toll-подобных рецепторов (TLR) и продукции антител.Кроме того, половые гормоны также могут влиять на метаболизм, рост или вирулентность патогенных бактерий. В свою очередь, патогенные, микробиотические и экологические бактерии способны метаболизировать и разлагать стероидные гормоны и родственные им соединения. Все эти данные свидетельствуют о том, что половые стероидные гормоны играют ключевую роль в модуляции взаимодействия бактерий с хозяином.
В свою очередь, патогенные, микробиотические и экологические бактерии способны метаболизировать и разлагать стероидные гормоны и родственные им соединения. Все эти данные свидетельствуют о том, что половые стероидные гормоны играют ключевую роль в модуляции взаимодействия бактерий с хозяином.
1. Введение
Половые стероидные гормоны, такие как прогестерон, эстрадиол и тестостерон, играют ряд важных физиологических ролей, включая воспроизводство, дифференциацию, развитие, пролиферацию клеток, апоптоз, воспаление, метаболизм, гомеостаз и функцию мозга [1].В основном они синтезируются гонадами, надпочечниками и плацентой и попадают в кровоток, чтобы действовать как в периферических тканях-мишенях, так и в центральной нервной системе [2]. Половые стероидные гормоны осуществляют свою функцию путем связывания либо со специфическими внутриклеточными рецепторами, которые действуют как лиганд-зависимые факторы транскрипции (классический механизм), либо с мембранными рецепторами, которые стимулируют несколько путей передачи сигналов (неклассический механизм) [1, 3–5].
Интересно, что половые стероидные гормоны также участвуют в коммуникации между микроорганизмами и млекопитающими-хозяевами.Этот тип коммуникации обычно называют «передачей сигналов между царством» и может использоваться микробными патогенами для активации их факторов вирулентности и контроля за течением и исходом инфекции [6]. Примечательно, что мужчины и животные в целом более восприимчивы к протозойным, грибковым, бактериальным и вирусным инфекциям, чем женщины [7]. Эта восприимчивость может быть связана с более низкими иммунными ответами, представленными у мужчин, чем у женщин, поскольку врожденные, опосредованные антителами и клеточные ответы у мужчин обычно ниже, чем у женщин [7–9].
В многочисленных исследованиях сообщалось о влиянии половых стероидных гормонов на диморфные половые различия в реакции на микробные и вирусные инфекции. Помимо воздействия на иммунитет хозяина, половые гормоны изменяют экспрессию генов и поведение, которые влияют на восприимчивость и устойчивость к инфекции [7].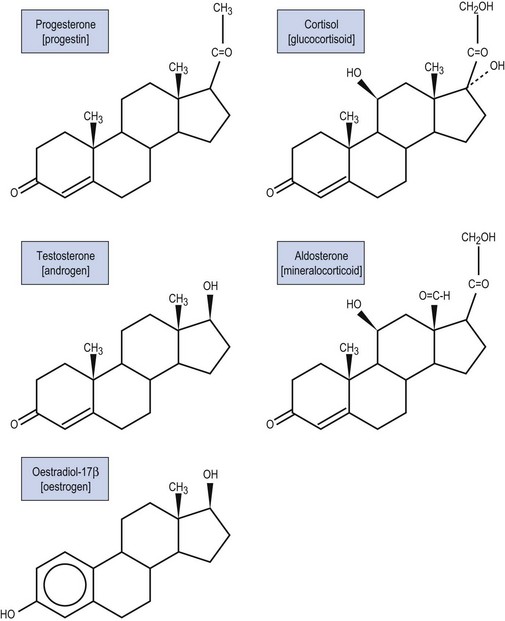 В этой статье основное внимание уделяется участию половых гормонов во взаимодействии между патогенными бактериями и их хозяевами, их участию в механизмах хозяина, используемых для минимизации и искоренения инфекции, а также в путях, используемых бактериями для уклонения от иммунного ответа.
В этой статье основное внимание уделяется участию половых гормонов во взаимодействии между патогенными бактериями и их хозяевами, их участию в механизмах хозяина, используемых для минимизации и искоренения инфекции, а также в путях, используемых бактериями для уклонения от иммунного ответа.
2. Механизм действия половых стероидных гормонов
Многие действия эстрадиола, прогестерона и тестостерона опосредуются классическим или геномным механизмом действия, который включает специфические внутриклеточные рецепторы, ER, PR и AR, соответственно, которые являются членами суперсемейства ядерных рецепторов лиганд-зависимых факторов транскрипции [11, 12]. Сообщалось о двух изоформах PR у людей, которые кодируются одним и тем же геном, но регулируются разными промоторами. Эти изоформы представляют собой PR-B с массой 114 кДа и укороченную на N-конце форму PR-A с массой 94 кДа [13].Также существуют два подтипа ER, ER- α 66 кДа и ER- β 55 кДа, которые транскрибируются с разных генов [14]. Точно так же существуют две изоформы AR, кодируемые одним геном, AR-A и AR-B; последний имеет молекулярную массу 110 кДа, тогда как первый имеет молекулярную массу 87 кДа и не имеет первых 187 аминокислот N-концевой области AR-B [15].
Точно так же существуют две изоформы AR, кодируемые одним геном, AR-A и AR-B; последний имеет молекулярную массу 110 кДа, тогда как первый имеет молекулярную массу 87 кДа и не имеет первых 187 аминокислот N-концевой области AR-B [15].
Рецепторы половых стероидов представляют собой модульные белки с отдельными функциональными доменами (рис. 1 (а)).N-концевая область содержит A / B-домен, который имеет функцию активации транскрипции (AF) -1. Средняя область (домен C) содержит ДНК-связывающий домен (DBD), который является наиболее консервативным, и область димеризации. За доменом C следует шарнирная область (D-домен), которая содержит сигнал ядерной локализации (NLS) и сайты связывания для белков-шаперонов, которые поддерживают рецепторы в неактивном состоянии. Домен E содержит область связывания лиганда (LBD), второй домен AF (AF-2), а также область ассоциации корегуляторов.Наконец, домен F расположен в крайней C-концевой области и содержит часть домена AF-2 [10, 11, 16] (Рисунок 1 (a)).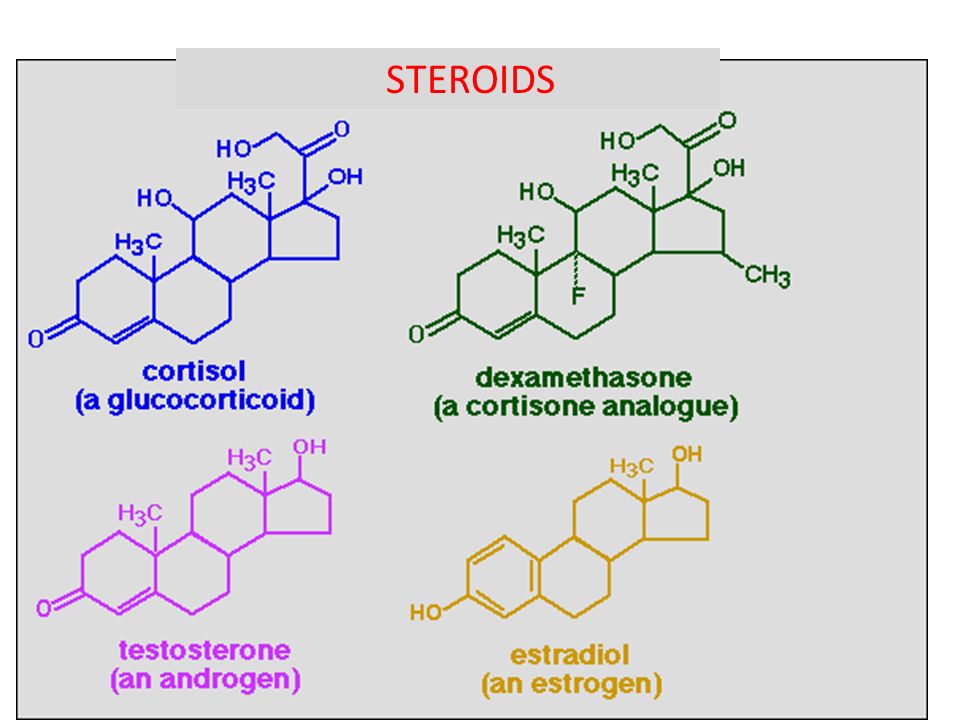
Согласно классической модели действия стероидных рецепторов в отсутствие лиганда ядерные рецепторы связаны с белками теплового шока Hsp70 и Hsp90. Когда гормон взаимодействует со своим специфическим внутриклеточным рецептором, он вызывает конформационные изменения, которые позволяют диссоциацию Hsp70 и Hsp90, способствуя димеризации, фосфорилированию и связыванию с высоким сродством с элементами гормонального ответа (HRE), расположенными в промоторной области генов-мишеней.Затем рецепторы модулируют транскрипцию, рекрутируя компоненты базального транскрипционного аппарата. Рецепторы половых гормонов также опосредуют транскрипционную активность, рекрутируя группу коактиваторных и адапторных белков, которые действуют как ацетилтрансферазы, лигазы, АТФазы, метилазы, регуляторы клеточного цикла, РНК-геликазы и стыковочные белки, соединяющиеся с базальными факторами транскрипции. В дополнение к коактиваторам было охарактеризовано несколько корепрессоров, которые активируют семейство гистоновых деацетилаз, активность которых приводит к неспособности задействовать базальный аппарат транскрипции и ингибированию экспрессии генов [5, 11] (Рисунок 1 (b)).
Помимо классического механизма действия, половые стероиды могут действовать в клетках посредством неклассического или негеномного механизма действия, в большинстве случаев опосредованного мембранными рецепторами. Таким образом, были идентифицированы мембранные рецепторы прогестерона (mPR). Прогестерон вызывает быстрые ответы в клетках-мишенях, таких как сперматозоиды, нейроны, клетки миометрия и иммунные клетки, посредством взаимодействия со своими mPR и опосредует передачу сигналов через пути, связанные с G-белком [17]. Эстрадиол может связываться с трансмембранным рецептором эстрогена-1, связанным с G-белком (GPR30), активируя тримерный G-белок.GPR30 играет важную роль в сердечно-сосудистой и иммунологической системах [18, 19]. Связанные с G-белком рецепторы для андрогенов также были идентифицированы в нескольких типах клеток, включая опухолевые клетки груди и простаты, сосудистые и иммунные клетки [20] (рис. 1 (b)).
Сигнальные пути негеномного действия половых стероидов включают ионные каналы, ферментно-связанные рецепторы, продукцию циклического AMP и циклического GMP, митоген-активируемые протеинкиназы (MAPK), тирозинкиназы и каскады липидкиназ (Рисунок 1 (b)) ) [21–24]. Таким образом, прогестерон изменяет приток кальция в сперматозоиды, открывая мембранные каналы Ca + 2 и активируя киназный путь Src / p21 ras / ERK. Кроме того, прогестерон может активировать путь MAPK в разных типах клеток [21, 25, 26]. Тестостерон может деполяризовать клетки Сертоли и вызывать приток кальция за счет ингибирования каналов АТФ K + ; этот гормон также может активировать каскады MAPK посредством активации киназ Ras, Raf, MEK (митоген-активируемая протеинкиназа / киназа ERK) и ERK (киназа, регулируемая внеклеточными сигналами) [27].В случае эстрадиола он может взаимодействовать с GPR в сосудистых клетках, которые активируют киназу Src, которая фосфорилирует рецептор эпидермального фактора роста (EGFR) и высвобождает металлопротеазы, которые запускают высвобождение лиганда EGF из гепарина. Затем EGF связывается с EGFR, активируя киназную систему Ras / Raf / MEK / ERK [11].
Таким образом, прогестерон изменяет приток кальция в сперматозоиды, открывая мембранные каналы Ca + 2 и активируя киназный путь Src / p21 ras / ERK. Кроме того, прогестерон может активировать путь MAPK в разных типах клеток [21, 25, 26]. Тестостерон может деполяризовать клетки Сертоли и вызывать приток кальция за счет ингибирования каналов АТФ K + ; этот гормон также может активировать каскады MAPK посредством активации киназ Ras, Raf, MEK (митоген-активируемая протеинкиназа / киназа ERK) и ERK (киназа, регулируемая внеклеточными сигналами) [27].В случае эстрадиола он может взаимодействовать с GPR в сосудистых клетках, которые активируют киназу Src, которая фосфорилирует рецептор эпидермального фактора роста (EGFR) и высвобождает металлопротеазы, которые запускают высвобождение лиганда EGF из гепарина. Затем EGF связывается с EGFR, активируя киназную систему Ras / Raf / MEK / ERK [11].
3. Модуляция иммунных ответов половыми стероидными гормонами
Половые стероидные гормоны заметно регулируют активность иммунных клеток, включая лимфоциты, макрофаги, гранулоциты и тучные клетки. Модуляция иммунной системы половыми стероидами имеет как физиологические, так и патологические последствия [8, 9].
Модуляция иммунной системы половыми стероидами имеет как физиологические, так и патологические последствия [8, 9].
Рецепторы андрогенов были идентифицированы в различных лимфоидных тканях, включая тимус и костный мозг, а также в селезенке и макрофагах [8]. Сообщалось, что тестостерон снижает активность естественных киллеров (NK) у мышей [28] и синтез провоспалительных цитокинов, включая фактор некроза опухоли альфа (TNF α ), посредством ингибирования факторов транскрипции, таких как ядерный фактор. каппа B (NF κ B) [29], тогда как этот гормон увеличивает синтез противовоспалительных цитокинов, таких как интерлейкин 10 (IL-10) [30].Тестостерон также снижает экспрессию Toll-подобного рецептора 4 макрофагов и моноцитов (TLR4), который сгруппирован в семейство рецепторов распознавания образов (PRR) и участвует в активации врожденной иммунной системы в ответ на заражение патогенами [31] .
С другой стороны, эстрогены могут усиливать клеточно-опосредованные и гуморальные иммунные ответы. ER экспрессируются в различных клетках лимфоидной ткани, а также в циркулирующих лимфоцитах и макрофагах [8]. Эстрадиол способствует устойчивости к инфекциям, усиливая цитотоксичность NK-клеток и стимулируя синтез провоспалительных цитокинов, таких как IL-1, IL-6 и TNF α [32, 33].Эстрадиол также подавляет продукцию IL-4, IL-10, трансформирующего фактора роста бета (TGF- β ) и гамма-интерферона (IFN- γ ) [34, 35]. Кроме того, эстрогены могут защищать иммунные клетки от апоптоза [36].
ER экспрессируются в различных клетках лимфоидной ткани, а также в циркулирующих лимфоцитах и макрофагах [8]. Эстрадиол способствует устойчивости к инфекциям, усиливая цитотоксичность NK-клеток и стимулируя синтез провоспалительных цитокинов, таких как IL-1, IL-6 и TNF α [32, 33].Эстрадиол также подавляет продукцию IL-4, IL-10, трансформирующего фактора роста бета (TGF- β ) и гамма-интерферона (IFN- γ ) [34, 35]. Кроме того, эстрогены могут защищать иммунные клетки от апоптоза [36].
PR были идентифицированы в эпителиальных клетках, тучных клетках, гранулоцитах, макрофагах и лимфоцитах [8]. Прогестерон обычно известен как иммунодепрессант, поскольку он ингибирует активацию NF κ B и увеличивает экспрессию супрессора сигнального белка цитокинов (SOCS1) в макрофагах [37].Прогестерон также снижает активность макрофагов и NK-клеток [33, 38, 39], а также продукцию антител B-клетками [40]. Повышенные концентрации прогестерона во время беременности подавляют развитие Th2-ответов (хелперные Т-клетки иммунного типа 1) и продукцию провоспалительных цитокинов, таких как IFN-γ , одновременно способствуя иммунным ответам Th3, включая синтез противовоспалительных цитокинов, таких как как ИЛ-4, ИЛ-5 и ИЛ-10 [41].
4. Влияние половых стероидных гормонов на бактериальные инфекции
Различные исследования свидетельствуют о том, что мужчины проявляют большую восприимчивость к бактериальному заражению, чем их сверстницы [42].Экспериментальные модели инфекции у кастрированных животных с гормональной заменой или без нее использовались для изучения роли половых гормонов в бактериальных инфекциях [43].
Примером для определения влияния половых гормонов на бактериальную инфекцию было введение липополисахарида эндотоксина (ЛПС) экспериментальным животным для воспроизведения сепсиса. Сепсис вызывается перепроизводством цитокинов, таких как TNF- α , IL-1 β и IL-6, макрофагами, которые обнаруживают бактерии и эндотоксины через TLR [44].Уровни циркуляции этих цитокинов выше у пациентов мужского пола и мышей с сепсисом, чем у их эквивалентов женского пола, в то время как уровни IL-10 выше у женщин, чем у пациентов мужского пола или мышей мужского пола, получавших LPS [45, 46].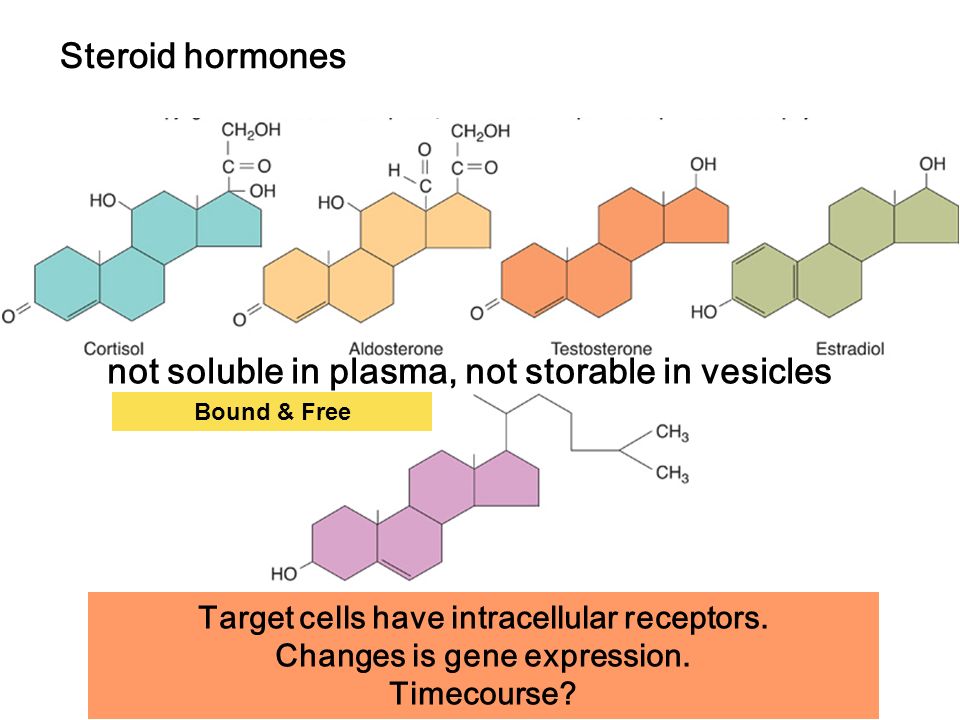 Имеются данные о том, что введение эстрадиола увеличивает выживаемость за счет снижения окислительного стресса в желудочно-кишечном тракте крыс после интраперитонеального введения ЛПС [47]. В соответствии с этим наблюдением, удаление эндогенных эстрогенов после овариэктомии увеличивает смертность, связанную с провокацией ЛПС у крыс, и этот эффект отменяется лечением эстрогенами.Кроме того, у андрогенизированных женщин выше уровень смертности после введения ЛПС [48].
Имеются данные о том, что введение эстрадиола увеличивает выживаемость за счет снижения окислительного стресса в желудочно-кишечном тракте крыс после интраперитонеального введения ЛПС [47]. В соответствии с этим наблюдением, удаление эндогенных эстрогенов после овариэктомии увеличивает смертность, связанную с провокацией ЛПС у крыс, и этот эффект отменяется лечением эстрогенами.Кроме того, у андрогенизированных женщин выше уровень смертности после введения ЛПС [48].
Микобактериальные инфекции чаще встречаются у мужчин, чем у женщин. Это случай Mycobacterium tuberculosis , который вызывает большее количество случаев туберкулеза у мужчин во всех регионах мира, явление, которое может быть связано с половыми гормонами [49]. Самцы мышей, инфицированные M. marinum , более восприимчивы, чем самки, к смертности и бактериальной колонизации легких и селезенки . Когда вводят экзогенный тестостерон, восприимчивость самок мышей к инфекции увеличивается, тогда как кастрация у самцов ослабляет инфекцию, демонстрируя, что тестостерон ответственен за повышенную восприимчивость к инфекции M. marinum [50].
Было продемонстрировано, что эстрадиол и прогестерон изменяют реакцию слизистой оболочки желудка на раннюю инфекцию H. pylori у овариэктомированных песчанок, изменяя обновление слизистой оболочки. Обработанные прогестероном песчанки реже вызывают гастрит, а синтетическое производное прогестерона (17- α -гидроксипрогестерона капроат) ухудшает жизнеспособность H.pylori [51].
Другой пример предрасположенности к инфекциям у мужчин наблюдается во время Ку-лихорадки, зоонозной инфекции, вызываемой Coxiella burnetti , которая считается потенциальным биологическим оружием. У мужчин чаще, чем у женщин, проявляются такие симптомы, как гриппоподобный синдром, пневмония, гепатит, миокардит, перикардит, менингит или энцефалит. Когда мышей инфицировали C. burnetii , было обнаружено, что бактериальная нагрузка и количество гранулем в селезенке были выше у самцов, чем у самок.У мышей, подвергнутых овариэктомии, обнаружена повышенная бактериальная нагрузка в селезенке и печени, тогда как лечение мышей, подвергшихся овариэктомии, эстрадиолом уменьшало ее [52].
Воздействие половых стероидных гормонов на заболевания, вызываемые бактериями, зависит от инфекционных видов и уровней половых стероидных гормонов. В отличие от данных, представленных выше, бактериальные инфекции чаще всего встречаются у женщин и на моделях женских животных. Например, у мышей, инфицированных Pseudomonas aeruginosa , такие показатели, как потеря веса, бактериальная нагрузка и медиаторы воспаления в легких, были выше у самок, чем у самцов, что позволяет предположить возможную роль эстрогенов в предрасположенности самок к инфекции P.aeruginosa [53]. В поддержку этой гипотезы было замечено, что введение эстрадиола мышам-самцам с пневмонией, вызванной P. aeruginosa , приводит к более тяжелому воспалению в легочной ткани и повышенной экспрессии IL-17 и IL-23 [54] .
Сообщалось, что предрасположенность самок к брюшному тифу обусловлена эстрогенами, поскольку лечение эстрадиолом увеличивает восприимчивость самок мышей к внутрибрюшинному заражению Salmonella typhimurium , тогда как лечение прогестероном увеличивает устойчивость к инфекции и время выживания. , предполагая дифференциальную роль половых гормонов яичников в этой инфекции [55].У беременных мышей, инфицированных сероваром Typhimurium S. enterica , наблюдалась более высокая бактериальная нагрузка в селезенке, чем у небеременных мышей, что коррелирует с уменьшенным набором дендритных клеток, нейтрофилов и NK-клеток в селезенке, снижением продукции IL-12 и увеличением уровни IL-6 [56].
Другой пример — восприимчивость женщин к инфекции Listeria monocytogenes во время беременности, когда уровни эстрадиола и прогестерона очень высоки [42]. Также во время беременности гингивит и пиогенная гранулема были связаны с повышенными концентрациями циркулирующих эстрогенов и прогестерона [57].Как можно наблюдать, существует явный половой диморфизм в восприимчивости и прогрессировании бактериальных инфекций у людей и моделей болезней на грызунах, которые связаны с действием половых стероидных гормонов [42, 58].
Помимо своей роли в модуляции иммунной системы, половые стероидные гормоны имеют прямое влияние на метаболизм, рост и экспрессию факторов вирулентности бактерий. Например, во время беременности доля определенных видов бактерий, связанных с микробиотой зубного налета, изменяется со значительным увеличением соотношения анаэробных и факультативных бактерий [59]. Prevotella intermediateus (ранее Bacteroides melaninogenicus subsp. intermediateus [60]) обнаруживается среди этих анаэробных бактерий , и, что интересно, поглощает эстрадиол и прогестерон, которые, в свою очередь, усиливают рост бактерий. Кроме того, эти половые гормоны могут действовать как заменители витамина К, важного фактора роста для P. intermediateus [59].
Также было продемонстрировано, что прогестерон (32–127 μ M) подавляет рост Neisseria gonorrhoeae и N.meningitidis . Этот эффект был бактериостатическим или бактерицидным, в зависимости от концентрации прогестерона [61]. Интересно, что было показано, что во время инфицирования первичных эпителиальных клеток шейки матки обработка прогестероном (30 нМ) увеличивает выживаемость и репликацию N. gonorrhoeae за счет нарушения активности серин-треонинкиназы Akt гонококковой фосфолипазой D [62]. Этот противоположный эффект прогестерона может быть связан с разными дозами гормона, используемыми в каждом исследовании.
Исследования с использованием моделей половых путей на мышах, крысах и морских свинках. Инфекция C. trachomatis предполагает, что гормональный статус эпителия половых путей влияет на исход инфекции Chlamydia trachomatis [63]. В модели in vitro инфицирования клеток HeLa C. trachomatis предварительная экспозиция клеток эстрадиолом усиливает адгезию хламидийных элементарных тел, а также развитие бактериальных включений [64].Недавно было продемонстрировано, что фенотип персистенции, определяемый как долговременная связь между Chlamydia и их клеткой-хозяином, в которой бактерии остаются жизнеспособными, но не культивируемыми, также возникает в ответ на высокие уровни половых гормонов, в частности эстрадиола, который регулирует экспрессия генов, связанных с настойчивостью. Например, воздействие эстрадиола приводит к активации гена trpB , маркера персистенции хламидий. Введение прогестерона привело к общей активации генов, кодирующих элементы метаболизма углеводов и аминокислот [63].Эти наблюдения представляют собой свидетельство прямого влияния половых стероидных гормонов на экспрессию факторов, участвующих в вирулентности бактериального патогена и, в частности, в развитии персистенции.
Недавно штамм P. aeruginosa , выделенный из легких женщины с муковисцидозом, показал повышенную продукцию альгината (внеклеточного полимера, участвующего в развитии биопленки) в присутствии эстрадиола, что коррелирует с обострением кистозного фиброза. фиброз, возникающий в конце фолликулярной фазы при высоком уровне эстрадиола [65].
Скорость прорастания спор Clostridium sordellii , бактерии, вызывающей геморрагический энтерит у некоторых животных, а также инфекции женских половых путей человека в послеродовой период, увеличивается в ответ на прогестерон. Напротив, он действует как ингибитор прорастания спор C. difficile , который является кишечным патогеном, связанным с диареей. В этом случае прогестерон конкурирует с таурохолатом желчной соли, который распознается как зародыш, вероятно, за счет связывания с теми же рецепторами, которые распознают таурохолат в C.difficile спор. Это пример того, как споры двух родственных видов по-разному реагируют на половые стероиды [66]. Эффекты половых стероидных гормонов на бактериальные инфекции суммированы на рисунке 2.
5. Бактериальный метаболизм половых стероидных гормонов
Бактерии способны метаболизировать половые стероидные гормоны за счет активности отдельных ферментов, таких как гидроксистероиддегидрогеназа (HSD) которые регулируют баланс между активными и неактивными стероидами.Биоинформатический анализ выявил гены, которые кодируют HSD в различных бактериальных геномах. Доминирующими типами, экспрессирующими эти ферменты, были Actinobacteria, Proteobacteria и Firmicutes. Большое количество бактерий, экспрессирующих HSD, составляет нормальную микробиоту желудочно-кишечного тракта, тогда как другая группа бактерий была изолирована из естественных мест обитания, таких как морская вода, почва и морские отложения [67].
В отношении патогенных бактерий: Prevotella intermediateus (ранее Bacteroides melaninogenicus subsp. Intermedius ), инфекционный агент десен, поглощает прогестерон и эстрадиол [59], в то время как Streptococcus mutans и Bacillus cereus метаболизируют тестостерон и прогестерон за счет активности 5 α -стероидредуктазы 3 β -, 17 β — и 20 α -HSD и стероид-гидроксилазы, продуцируемые B. cereus , тогда как S. mutans продуцируют 5 α — и 5 β -стероид редуктаз и 3 α -, 17 β — и 20 α -HSD [68]. Porphyromonas gingivalis и Actinobacillus actinomycetemcomitans также снижают уровень тестостерона до 5 α -дигидротестостерона [69].
Treponema denticola, другая десневая бактерия, связанная с пародонтитом, метаболизирует холестерин, прогестерон и тестостерон с использованием 5 α -редуктазы, 3 β — и 17 β -HSD [70]. Однако только холестерин вызывает рост бактерий, тогда как высокие концентрации прогестерона и тестостерона подавляют его.Отсутствие чувствительности T. denticola к низким концентрациям прогестерона и тестостерона (0,0001 μ г / мл) может быть связано с их активным удалением с помощью переносчика оттока АТФ-связывающей кассеты (ABC) [71].
Сообщалось, что половые стероидные гормоны являются субстратами насосов многократного оттока (MDE) E. coli , которые являются важными факторами устойчивости к желчным кислотам. Две из этих систем MDE, AcrAB-TolC и EmrAB-TolC, могут транспортировать эстрадиол и прогестерон за пределы бактериальной клетки.Кроме того, когда обе системы были мутированы, наблюдалось зависимое от стероидных гормонов подавление роста [72]. Аналогичным образом, в случае N. gonorrhoeae, было продемонстрировано участие эффлюксного насоса (MtrCDE) в транспорте половых гормонов, который придает устойчивость бактерий к прогестерону [73]. Мутанты гонококков с дефицитом оттока быстрее выводились из инфицированных интактных самок мышей, чем из овариэктомированных мышей, и были более чувствительны к прогестерону in vitro [73].Эти насосы могут быть важны для выживания бактерий в условиях присутствия стероидов, таких как желудочно-кишечный тракт, влагалище и мочевыводящие пути [72].
Патогенные бактерии также влияют на метаболизм половых гормонов хозяина. Например, инфекция S. enterica на мышиной модели снижает уровни стероидных гормонов, таких как прогестерон. Анализ уровней транскриптов генов, кодирующих несколько ферментов, участвующих в синтезе стероидных гормонов, показывает, что экспрессия некоторых HSD снижена [74].
Помимо патогенных бактерий, бактерии микробиоты человека играют важную роль в метаболизме половых гормонов. Микробиота имеет решающее значение для здоровья человека, поскольку она участвует в развитии иммунной системы, энергетическом гомеостазе и защите от патогенов. Более того, дисбаланс кишечной микробиоты также был связан с патологическими процессами [75]. Известной причиной изменения кишечной микробиоты является использование антибиотиков, которые могут повысить восприимчивость к кишечным инфекциям [76].В недавнем исследовании метаболомики было определено, что лечение мышей стрептомицином нарушает гомеостаз кишечника за счет уменьшения количества фекальных бактерий и, как следствие, воздействия на кишечную метаболому. 87% всех обнаруженных метаболитов, включая стероиды, были уменьшены, что позволяет предположить, что кишечная микробиота участвует в метаболизме стероидов [75].
Было замечено, что фекальные бактерии могут выполнять гидролитические, восстановительные и окислительные реакции андрогенов и эстрогенов [77].Ферменты, участвующие в 21-дегидроксилировании или 16 α -дегидроксилировании стероидов, таких как кортикостероиды и половые гормоны, были идентифицированы в кишечной микробиоте, и что интересно, эти ферменты не присутствуют в тканях млекопитающих [78]. Предполагается, что обратимое 17 β снижение андрогенов, осуществляемое кишечными микроорганизмами человека, играет роль в регуляции уровня тестостерона и высвобождении андрогенов у людей [78, 79].
Метаболизм половых стероидов осуществляется не только патогенными или микробиотическими бактериями, но и бактериями окружающей среды, такими как организмы, связанные с почвой, морскими водами и илами.Наиболее изученным примером стероидного метаболизма и стероид-зависимой регуляции генов у бактерий является почвенная бактерия Comamonas testosteroni (ранее Pseudomonas testosteroni ) [80]. C. testosteroni экспрессирует различные гены, которые отвечают на стероиды, включая рецепторы, такие как TeiR, а также активаторы (TesR) и репрессоры (RepA и RepB) гена, кодирующего 3 α -HSD / карбонилредуктазу (CR-), HSDA . Эти белки участвуют в адаптации бактерий к окружающей среде [81, 82].В частности, 3 α -HSD / CR представляет собой фермент, участвующий в метаболизме андрогенов, который опосредует восстановление оксида андростендиона, 5 α -дигидротестостерона и андростерона. Интересно, что экспрессия 3 α -HSD / CR сильно индуцируется в присутствии стероидных субстратов [67, 83].
Катаболический путь тестостерона, который отличается от пути, обнаруженного в C. testosteroni , был описан в Steroidobacter denitrificans [84], бактерии, выделенной из ила, которая способна метаболизировать эстрадиол и тестостерон [85].Эта бактерия окисляет тестостерон до 1-дегидротестостерона, который затем превращается в андроста-1,4-диен-3,17-дион, который, в свою очередь, претерпевает реакцию восстановления, происходящую в ее кольце A; вероятно, эта реакция осуществляется еще не идентифицированным 3 α -HSD [84]. Некоторые бактерии морской воды также могут разлагать стероиды, например морская бактерия H5, принадлежащая к роду Vibrio , может разлагать тестостерон и эстрогены. Кроме того, были идентифицированы два гена, индуцируемых эстрадиолом, кодирующие 3-кетостероид-1-дегидрогеназу и карбоксилэстеразу [86].
Поскольку природные и синтетические стероидные гормоны, выбрасываемые в окружающую среду, представляют собой потенциальный риск для здоровья людей и животных из-за вмешательства в половое развитие и размножение, помимо других функций, стероид-разлагающие бактерии могут быть полезны для биоремедиации загрязненной окружающей среды, а также известный как биоаугментация [67]. Последний успешно применялся в различных средах и при разложении различных загрязнителей, таких как углеводороды нефти, фенол и гербицид атразин [87].
Эстрадиол и его основной продукт разложения эстрон были обнаружены в поверхностных водах, грунтовых водах, животноводстве и бытовых отходах. Большинство бактерий, разлагающих эстрадиол, таких как Bacillus amyloliquefaciens, B. subtilis, и B. cereus , были выделены из ила и могут превращать эстрадиол в эстрон, но они не могут далее разлагать эстрон [88]. Другие бактерии, разлагающие эстрадиол, выделенные из активного ила очистных сооружений, которые могут использоваться для биоремедиации загрязненных сред, соответствуют родам Aminobacter , Brevundimonas , Escherichia , Flavobacterium , Microbacterium , Nocardioides. Rhodococcus, и Sphingomonas. Большинство этих штаммов не могут далее разлагать эстрон [89].
В Stenotrophomonas maltophilia , бактерии, разлагающей эстрадиол, было определено, что эстрон превращается в тирозин через расщепление его насыщенного кольца, эта аминокислота, в свою очередь, может использоваться в биосинтезе белка; однако фермент, ответственный за это превращение, не был идентифицирован [90]. Sphingomonas штамм KC8, последовательность генома которого была недавно опубликована [91], обладает способностью расщеплять различные стероиды, такие как эстрадиол, эстрон и тестостерон [92].Хотя механизм деградации, используемый этой бактерией, не был идентифицирован, ее геном содержит несколько генов, кодирующих ферменты, предположительно участвующие в деградации эстрогена, такие как HSD, 3-кетостероид-1-дегидрогеназа и катехол-2,3-диоксигеназа [91]. Другая бактерия семейства Sphingomonadaceae , названная EDB-LI1, образует биопленки и также разлагает эстрон [87].
Идентификация ключевых ферментов биодеградации может помочь обнаружить микробные пути разложения эстрогена и предложить биомаркеры для мониторинга деградации эстрогена микробным сообществом [90], которое может быть составлено смесью различных бактерий, способных разлагать различные классы стероидных гормонов. и их родственные соединения.
6. Выводы
Половые стероидные гормоны играют важную роль в различных функциях млекопитающих, таких как модуляция иммунного ответа. Тестостерон, эстрадиол и прогестерон могут по-разному регулировать реакцию против бактериальных инфекций и изменять метаболические пути патогенных бактерий и микробиоты. В целом тестостерон действует как иммуносупрессор, эстрадиол — как активатор, а прогестерон — как модулятор иммунной системы. Эти эффекты связаны с половым диморфизмом, обнаруживаемым при бактериальных инфекциях, когда мужчины и самцы животных во многих случаях более восприимчивы к бактериальным инфекциям, чем самки.Стадия менструального или полового цикла и беременность также определяет исход бактериальных инфекций из-за изменений уровня половых гормонов. В некоторых случаях введение половых гормонов может контролировать течение бактериальных инфекций, действуя как дополнение к терапии антибиотиками. В свою очередь, бактерии разработали механизмы для устранения или использования половых гормонов в своих интересах, используя их в качестве источников углерода и энергии, главным образом за счет их разложения или химической модификации.Интересно, что эту особенность можно использовать на благо человека, используя бактерии, способные разлагать и выводить стероидные гормоны из загрязненной окружающей среды. Знание конкретных ферментов и механизмов, участвующих в этих процессах, может быть полезным при выборе подходящих бактерий для использования в программах биоремедиации.
Выражение признательности
Работа в нашей группе поддерживается грантами от Генерального директората Асунтос дель Персональной Академии, UNAM (IN212911) B.Гонсалес-Педрахо и от Consejo Nacional de Ciencia y Tecnología (проект 100645) до И. Камачо-Арройо. Авторы выражают признательность Норме Эспиноза Санчес за критические комментарии к статье. Э. Гарсия-Гомес был научным сотрудником Consejo Nacional de Ciencia y Tecnología, регистрационный номер 17514 (проект 100645).
12.3: Эндокринные гормоны — Биология LibreTexts
Пролактин — это нестероидный эндокринный гормон, секретируемый гипофизом. Одна из функций пролактина — стимулировать молочные железы кормящей матери вырабатывать молоко.Регулирование пролактина у матери контролируется петлей положительной обратной связи, которая включает соски, гипоталамус, гипофиз и молочные железы. Положительная обратная связь начинается, когда ребенок сосет сосок матери. Нервные импульсы от соска достигают гипоталамуса, который стимулирует выработку пролактина гипофизом. Пролактин перемещается с кровью к молочным железам и стимулирует их выработку молока. Выделение молока заставляет ребенка продолжать сосать, что вызывает секрецию большего количества пролактина и производство большего количества молока.Петля положительной обратной связи продолжается до тех пор, пока ребенок не перестанет сосать грудь.
Особенность: миф против реальности
Анаболические стероиды — это синтетические версии встречающегося в природе мужского полового гормона тестостерона. Мужские гормоны обладают андрогенным или маскулинизирующим действием, но они также обладают анаболическим действием или эффектом наращивания мышечной массы. Анаболические эффекты являются причиной того, что синтетические стероиды используют спортсмены. Помимо наращивания мышц, они также ускоряют развитие костей и красных кровяных телец, повышают выносливость, поэтому спортсмены могут тренироваться усерднее и дольше, а также ускоряют восстановление мышц.К сожалению, за эти преимущества использования стероидов приходится платить. Если вы когда-нибудь задумывались о приеме анаболических стероидов для наращивания мышц и улучшения спортивных результатов, примите во внимание следующие мифы и соответствующие реальности.
Миф: Стероиды безопасны.
Реальность: Использование стероидов может вызвать несколько серьезных побочных эффектов. Продолжительное употребление может увеличить риск рака печени, сердечных заболеваний и высокого кровяного давления.
Миф: Стероиды не остановят ваш рост.
Реальность: Подростки, принимающие стероиды до того, как закончили рост в росте, могут задержать рост, поэтому на протяжении всей жизни они остаются короче, чем были бы в противном случае. Такая задержка роста происходит из-за того, что стероиды увеличивают скорость достижения зрелости скелета. Когда наступает зрелость скелета, дополнительный рост в высоту невозможен.
Миф: Стероиды не вызывают наркотической зависимости.
Реальность: Использование стероидов может вызвать зависимость, о чем свидетельствуют отрицательные эффекты прекращения использования стероидов.Эти негативные эффекты могут включать, среди прочего, бессонницу, усталость и подавленное настроение.
Миф: Не существует такого понятия, как «буйная ярость».
Реальность: Было доказано, что употребление стероидов увеличивает агрессивность у некоторых людей. Он также был замешан в ряде насильственных действий, совершенных людьми, которые не проявляли склонности к насилию, пока не начали использовать стероиды.
Миф: Стероиды принимают только мужчины.
Реальность: Хотя стероиды чаще употребляют мужчины, чем женщины, некоторые женщины также употребляют стероиды.Они используют их для наращивания мышц и улучшения физических показателей, как правило, либо для спортивных соревнований, либо для самообороны.
Рецепторы и регуляторы стероидных гормонов
Введение
Стероидный гормон — это стероид, который выполняет функцию гормона. Его можно разделить на две группы: кортикостероиды и половые стероиды. В рамках этих двух классов они делятся на пять типов в зависимости от их рецепторов: глюкокортикоиды, минералокортикоиды, андрогены, эстроген и прогестагены.В организме человека стероидные гормоны играют важную роль в обмене веществ, воспалении, иммунных функциях, солевом и водном балансе, развитии половых признаков и способности противостоять болезням и травмам. Природные стероидные гормоны обычно синтезируются из холестерина в гонадах и надпочечниках. Эти гормоны являются липофильными веществами. Они могут проходить через клеточную мембрану, поскольку являются жирорастворимыми, а затем связываются с рецепторами стероидных гормонов (которые могут быть ядерными или цитозольными в зависимости от стероидного гормона), вызывая изменения внутри клетки.Стероидные гормоны обычно переносятся в крови, связанными со специфическими белками-носителями, такими как глобулин, связывающий половые гормоны, глобулин, связывающий кортикостероиды, и альбумин. Связывание помогает улучшить растворимость гормонов в воде.
Большинство исследований говорят, что гормоны могут влиять на клетки, когда они не связаны белками сыворотки. Чтобы быть активными, стероидные гормоны должны освободиться от своих солюбилизирующих кровь белков и либо связываться с внеклеточными рецепторами, либо пассивно пересекать клеточную мембрану и связываться с ядерными рецепторами.Эта идея называется гипотезой свободных гормонов. Одно исследование показало, что эти комплексы стероид-носитель связываются мегалином, мембранным рецептором, а затем попадают в клетки посредством эндоцитоза. Один из возможных путей состоит в том, что, оказавшись внутри клетки, эти комплексы попадают в лизосому, где белок-носитель разрушается, а стероидный гормон высвобождается в цитоплазму клетки-мишени.
После того, как стероидные гормоны транспортируются к тканям и клеткам-мишеням, они связываются с соответствующими рецепторами гормонов.Рецепторы стероидных гормонов находятся в ядре, цитозоле, а также на плазматической мембране клеток-мишеней. Обычно они являются внутриклеточными рецепторами (обычно цитоплазматическими или ядерными) и инициируют передачу сигнала стероидных гормонов, что приводит к изменениям экспрессии генов в течение периода времени от часов до дней. Глюкокортикоидный рецептор (GR), минералокортикоидный рецептор (MR), рецептор прогестерона (PR) и андрогенный рецептор (AR) являются классическими членами надсемейства ядерных рецепторов, составляющих подсемейство 3C.Наиболее изученные рецепторы стероидных гормонов являются членами подсемейства ядерных рецепторов 3 (NR3), которое включает рецепторы эстрогена (группа NR3A) и 3-кетостероидов (группа NR3C). Помимо ядерных рецепторов, несколько рецепторов, связанных с G-белком, и ионных каналов действуют как рецепторы клеточной поверхности для определенных стероидных гормонов.
Рецепторы и регуляторы стероидных гормонов
По отдельности и в комбинации эти четыре рецептора играют решающую роль в некоторых из наиболее фундаментальных аспектов физиологии, таких как реакция на стресс, метаболизм, иммунная функция, гомеостаз электролитов, рост, развитие и размножение.Были установлены множественные сигнальные пути для всех четырех рецепторов и выявлено несколько общих механизмов. Один из основных сигнальных путей достигается за счет прямого связывания ДНК и регуляции транскрипции чувствительных генов. Другой достигается посредством белок-белковых взаимодействий, в основном с другими факторами транскрипции, такими как ядерный фактор-kB, активаторный белок-1 или преобразователь сигнала и активатор транскрипции, для регулирования паттернов экспрессии генов. Эти пути могут повышать или понижать экспрессию генов.И все они требуют активации рецептора лигандом и взаимодействия с множеством белковых факторов, таких как белки-шапероны и белки-ко-регуляторы.
GR, MR, PR и AR имеют общие структурные сходства, причем все они содержат три функциональных домена, то есть N-концевой домен трансактивации, за которым следует ДНК-связывающий домен (DBD) и C-концевой лиганд-связывающий домен (LBD). Шарнирная область связывает DBD и LBD. Эти четыре рецептора стероидных гормонов также демонстрируют огромную способность и точность механизмов модуляции эндокринной системы.Пациенты, несущие мутировавшие рецепторы, часто испытывают серьезные осложнения, а трансгенные животные, лишенные индивидуальных рецепторов, часто не могут воспроизводиться и / или выжить. Временно контролируемые паттерны распределения в тканях во время стадий развития, репродуктивных фаз и болезненных состояний вносят вклад в разнообразную активность этих рецепторов. GR экспрессируется почти во всех тканях, хотя регуляция уровней GR зависит от ткани и клеточного цикла. Глюкокортикоиды через ГР выполняют множество физиологических функций.Глюкокортикоиды являются важными регуляторами метаболизма углеводов, белков и жиров. Основным глюкокортикоидом у человека является кортизол, также называемый гидрокортизоном, тогда как у грызунов основным глюкокортикоидом является кортикостерон. Синтез и секреция глюкокортикоидов корой надпочечников строго регулируются гипоталамо-гипофизарно-надпочечниковой системой, которая чувствительна к отрицательной обратной связи со стороны циркулирующих гормонов и экзогенных глюкокортикоидов. MR экспрессируется в эпителиальных тканях, таких как дистальный отдел нефрона или толстой кишки.Альдостерон может регулировать потребление соли с пищей и баланс ионов соли, регулируя эпителиальный натриевой канал и гены субъединиц Na +, K + -АТФазы. Наиболее физиологически важным минералокортикоидом является альдостерон. Альдостерон синтезируется в коре надпочечников, главным образом, под регуляцией ренин-ангиотензиновой системы, калиевого статуса и АКТГ. Прогестерон — самый важный прогестин в организме человека. Он синтезируется в яичниках, семенниках и надпочечниках. Значительные количества также синтезируются и выделяются плацентой во время беременности.Помимо значительных гормональных эффектов, прогестерон служит предшественником синтеза эстрогенов, андрогенов и стероидов надпочечников. PR экспрессируется в женских половых путях, молочной железе, головном мозге и гипофизе. Во многих клетках эстроген индуцирует экспрессию PR, и его присутствие является общим маркером действия эстрогена как в исследованиях, так и в клинических условиях. Во многих биологических системах прогестин усиливает дифференцировку и противодействует действию эстрогена на пролиферацию клеток.У людей преобладающим андрогеном, секретируемым яичками или яичниками, и периферическим превращением андростендиона, продуцируемым надпочечниками, является тестостерон. Андрогены выполняют важные функции на разных этапах жизни у мужчин. Во время эмбриональной жизни андрогены вирилизируют урогенитальный тракт мужского эмбриона, и поэтому их действие важно для развития мужского фенотипа. В период полового созревания андрогены способствуют развитию вторичных половых признаков. Помимо стимуляции и поддержания сексуальной функции у мужчин, андрогены также могут частично отвечать за агрессивное поведение.Тестостерон и андростендион являются предшественниками биосинтеза эстрогенов. Тестостерон и 5-дигидротестерон также вызывают андрогенные эффекты через АР.
Факторы риска рака
Согласно предыдущим исследованиям, исследователи обнаружили, что глюкокортикоиды являются ключом к лечению определенных лейкозов и часто включаются в схемы химиотерапии из-за их противорвотных, противоотечных и паллиативных свойств. Исследование показало, что уровни кортизола в сыворотке крови у пациентов с раком простаты были значительно выше, чем у пациентов с гиперплазией простаты.Предоперационные уровни кортизола в крови в группе рака легких и в группе рака пищеварительного тракта были выше, чем в контрольной группе здоровых людей. Это может быть связано с аномальным метаболизмом самого рака и влиянием раковой ткани на организм, приводить к эндокринным или метаболическим нарушениям. В исследованиях рака молочной железы и рака яичников дексаметазон может быстро ингибировать активность ERK независимо от рецепторов глюкокортикоидов и может участвовать в процессе ингибирования пролиферации клеток в клеточных линиях рака молочной железы человека.В процессе подавления опухолей головного мозга обнаружено, что сочетание глюкокортикоидов и различных биологических эффектов может подавлять синтез и биологические эффекты фактора роста эндотелия сосудов (VEGF) в опухолевых клетках, подавлять действие свободных радикалов кислорода и действовать. на медиаторы воспаления и подавляют функцию продукции опухолевых клеток. И наличие PR действует как полезный прогностический маркер рака груди независимо от прогестивного статуса пациентки. Исследования показывают, что определенные схемы заместительной терапии прогестином и эстрогеном у женщин в постменопаузе могут увеличить заболеваемость раком груди.Кроме того, рецидивный рак предстательной железы, по-видимому, является результатом усиления передачи сигналов AR, вызванного повышенной экспрессией AR в присутствии или в отсутствие амплификации гена AR. Возникновение рецидивирующего рака простаты, по-видимому, связано с усилением передачи сигналов AR-зависимого фактора роста, которая преодолевает апоптоз, вызванный истощением андрогенов.
Артикул:
- Mangelsdorf DJ, и др. . Надсемейство ядерных рецепторов: вторая декада. Ячейка . 1995, 83: 835–839.
- Лонард Д.М., О’Мэлли Б.В., Расширение функционального разнообразия коактиваторов. Trends Biochem Sci . 2005, 30: 126–132.
- Мацумото Т., и др. . Изучение функций рецепторов андрогенов на генетических моделях. Дж Биохим . 2005,138: 105–110.
- Гудман Л.С., и др. . (2006) Goodman & Gilman’s The Pharmacological Basis of Therapeutics, McGraw-Hill, New York.
- Cidlowski JA, и др. . Новые антипептидные антитела к рецептору глюкокортикоидов человека: распознавание множественных форм рецепторов in vitro и четкая локализация цитоплазматических и ядерных рецепторов. Мол эндокринол . 1990, 4: 1427–1437.
- НИК З. ЛУ, и др. . Международный союз фармакологии. LXV. Фармакология и классификация надсемейства ядерных рецепторов: рецепторы глюкокортикоидов, минералокортикоидов, прогестерона и андрогенов. Фармакологические обзоры . 2006, 58: 782–797.
Твиттер Facebook
стероидов | Введение в химию
Цель обучения
- Опишите некоторые функции стероидов
Ключевые моменты
- Стероиды являются липидами, потому что они гидрофобны и нерастворимы в воде, но они не похожи на липиды, поскольку имеют структуру, состоящую из четырех конденсированных колец.
- Холестерин является наиболее распространенным стероидом и является предшественником витамина D, тестостерона, эстрогена, прогестерона, альдостерона, кортизола и желчных солей.
- Холестерин является компонентом бислоя фосфолипидов и играет роль в структуре и функции мембран.
- Стероиды обнаружены в головном мозге и изменяют электрическую активность мозга.
- Поскольку они могут ослаблять рецепторы, которые передают сообщения от нейромедиаторов, стероиды часто используются в анестетиках.
Условия
- осморегуляция: гомеостатическое регулирование осмотического давления в организме для поддержания постоянного содержания воды .
- нейротрансмиттерное вещество, такое как ацетилхолин или дофамин, отвечающее за передачу нервных сигналов через синапс между двумя нейронами
- гормон: Любое вещество, вырабатываемое одной тканью и переносимое кровотоком в другую для воздействия на физиологическую активность
Структура стероидных молекул
В отличие от фосфолипидов и жиров, стероиды имеют структуру конденсированного кольца.Хотя они не похожи на другие липиды, они сгруппированы с ними, потому что они также гидрофобны и нерастворимы в воде. Все стероиды имеют четыре связанных углеродных кольца, и многие из них, как и холестерин, имеют короткий хвост. Многие стероиды также имеют функциональную группу –ОН, и эти стероиды классифицируются как спирты, называемые стеролами.
Стероидные структуры Стероиды, такие как холестерин и кортизол, состоят из четырех конденсированных углеводородных колец.Холестерин
Холестерин — наиболее распространенный стероид, синтезируемый в основном в печени; это предшественник витамина D.Холестерин также является предшественником многих важных стероидных гормонов, таких как эстроген, тестостерон и прогестерон, которые секретируются гонадами и железами внутренней секреции. Следовательно, стероиды играют очень важную роль в репродуктивной системе организма. Холестерин также играет роль в синтезе стероидных гормонов альдостерона, который используется для осморегуляции, и кортизола, который играет роль в метаболизме.
Холестерин также является предшественником солей желчных кислот, которые способствуют эмульгированию жиров и их усвоению клетками.Это компонент плазматической мембраны клеток животных и фосфолипидного бислоя. Будучи самой внешней структурой в клетках животных, плазматическая мембрана отвечает за транспорт материалов и распознавание клеток; и он участвует в межклеточной коммуникации. Таким образом, стероиды также играют важную роль в структуре и функции мембран.


 По хим. строению и биол. действию разделяются на С 21 стероиды, обладающие скелетом прегнана ( гестагены и кортикоиды),С 19 стероиды со скелетом андростана ( андрогепы) и С 18 стероиды со… … Химическая энциклопедия
По хим. строению и биол. действию разделяются на С 21 стероиды, обладающие скелетом прегнана ( гестагены и кортикоиды),С 19 стероиды со скелетом андростана ( андрогепы) и С 18 стероиды со… … Химическая энциклопедия
 органы и ткани. Термин «Г.»… … Биологический энциклопедический словарь
органы и ткани. Термин «Г.»… … Биологический энциклопедический словарь