L-Глютамин Jarrow Formulas «L-Glutamine Powder» порошок (113 г), цена 409 грн.
L-Глютамин Jarrow Formulas «L-Glutamine Powder» — самая распространенная аминокислота в мышцах. Он формирует 61% аминокислотного профиля скелетных мышц. Глютамин на 19% состоит из азота, что делает его основным переносчиком азота в клетки мышц.
Глютамин играет ключевую роль в процессе белкового обмена, увеличении объема клеток и препятствовании катаболизму. Благодаря мощным анти-катаболическим свойствам глютамин предотвращает разрушение мышц. Это свойство бесценно в фазе сушки, особенно в летнее время, когда вы пытаетесь избавиться от жировых отложений без риска уменьшения мышц.
Глютамин необходим для обеспечения оптимального функционирования организма в целом. Большая часть глютамина требуется для нормальной работы тонкого кишечника, иммунная система также нуждается в этой аминокислоте. Атлеты зачастую более восприимчивы к болезням именно потому, что уровень глютамина истощается во время тренировок.
Одна из основных функций глютамина в организме – это поддержка детоксикации, очищения организма от высокого уровня аммиака. Он действует как буфер и преобразует избыток аммиака в другие аминокислоты, сахар и мочевину. Ко всему прочему, добавка L-глютамин способствует поддержанию положительного баланса азота и предотвращает потерю мышечной массы.
Полезные свойства глютамина:
- Является важным нейромедиатором мозга и помогает улучшить память и концентрацию
- Ускоряет обмен веществ и клеточную детоксикацию
- Борется с раком
- Стабилизирует уровень сахара в крови
- Поддерживает синтез белка. Он предотвращает катаболизм (разрушение мышц) и обеспечивает поступление глютамина в другие клетки организма
- Добавка L-глютамин помогает восполнить уровень глютамина в мышцах, который снижается во время интенсивных тренировок
- Глютамин стимулирует работу иммунной системы.
 Для атлетов это свойство крайне важно, так как тяжелые тренировки, как правило, сильно истощают уровень глютамина, а именно эта аминокислота является основным источником энергии для иммунной системы
Для атлетов это свойство крайне важно, так как тяжелые тренировки, как правило, сильно истощают уровень глютамина, а именно эта аминокислота является основным источником энергии для иммунной системы - Глютамин является одним из важнейших питательных веществ для оптимального функционирования кишечника
Другие ингредиенты:
Формулы Jarrow L-глутамин производятся путем микробиологической ферментации. Этот продукт представляет собой 100% L-глютамин и не содержит никаких других веществ.
Подходит для вегетарианцев / веганов.
Рекомендации по применению:
- Взрослым смешайте ½ чайной ложки (2 г) с 180-200 мл жидкости и пейте, когда желудок пуст или по назначению врача.
- Для спортсменов максимальные результаты будут получены при добавлении 2 г глютамина после тренировки.
Предупреждения:
Внимание: Только для взрослых.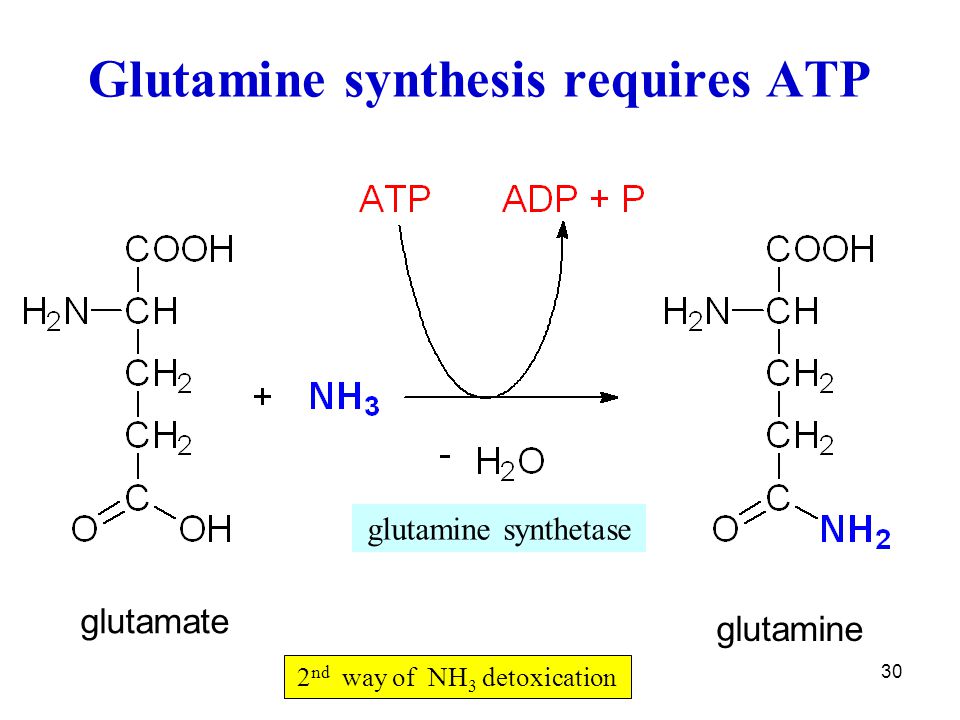 Перед началом применения во время беременности, в период лактации, при приеме лекарств или наличии каких-либо заболеваний следует проконсультироваться с врачом. Хранить в недоступном для детей месте.
Перед началом применения во время беременности, в период лактации, при приеме лекарств или наличии каких-либо заболеваний следует проконсультироваться с врачом. Хранить в недоступном для детей месте.
Силикагель нельзя употреблять в пищу. Хранить в упаковке.
После вскрытия упаковки хранить в сухом и прохладном месте.
| Информация о Добавках | ||
| Размер порции: | ||
| Количество порций: прибл. 56 | ||
| Количество на порцию | % DV | |
| L-Глютамин | 2 г | † |
| † Суточная доза не определена. | ||
NaturalSupp L-Glutamine 60caps — Бутик Спортивного Питания
Описание
NaturalSupp L-Glutamine — Л-глютамин аминокислота. В человеческом организме она считается одной из самых распространенных. В составе белков, которые имеют животное происхождение, глютамин также в приоритете. Если вы обратите внимание на состав сывороточных протеинов, заметите, что в них всегда присутствует высокое процентное содержание этой амино-молекулы. Также она регулярно поступает в наш организм с употребляемой едой.
В составе белков, которые имеют животное происхождение, глютамин также в приоритете. Если вы обратите внимание на состав сывороточных протеинов, заметите, что в них всегда присутствует высокое процентное содержание этой амино-молекулы. Также она регулярно поступает в наш организм с употребляемой едой.
NaturalSupp L-Glutamine относится к условно-незаменимым аминокислотам. Это означает, что он вырабатывается в организме человека, но значительную часть глютамина мы получаем из пищи, так как он является одной из самых распространенных протеиногенных аминокислот. Подсчитано, что глютамин составляет около 60 % от всех аминокислот, составляющих мышечные белки. В крови концентрация глютамина также превышает концентрацию любой другой аминокислоты.
В то же время, в период стресса или повышенных нагрузок, когда резко ускоряются все метаболические процессы, организм с большой скоростью расходует имеющиеся запасы необходимых веществ, в том числе и глютамина. Поэтому в период тяжелой работы, повышенных тренировочных нагрузок и стрессов, в том числе подготовки к соревнованиям, сушки и т.
Свойства Л-глютамина:
- Оказывает антикатаболическое действие. Под влиянием глютамина происходит подавление гормона стресса под названием кортизол. При достаточном поступлении в организм, этот компонент уменьшит распад мышц, что очень важно для людей во время диеты или заболевания.
- Способствует увеличению мышц и улучшает процесс белкового синтеза. Кроме влияния на процессы анаболизма глютамин также оказывает положительное влияние на уровень клеточной гидратации, а это важный фактор роста. По этой причине, Л-глютамин часто называют волюмизатором клетки (увеличителем ее объема).
- Обеспечивает детоксикацию в мозге аммиака, а также детоксикацию печени. Транспортирует аммиак (в нетоксичной форме) для его дальнейшей утилизации печени и почек. Глютамин, помимо этого, берет участие в процессе синтеза антиоксидантных веществ, которые защищают от токсического влияния печень.
- Иммуномодулирующий эффект.

- Оказывает положительное влияние на синтез АТФ и гликогена. Благодаря глютамину поддерживается нормальное количество в кровяном русле глюкозы. Также этот нутриент организм может использовать в качестве непосредственного источника АТФ на уровне с глюкозой. Именно благодаря данной особенности глютамин так популярен в спорте.
- Обеспечивает ускоренное жиросжигание. При дополнительном использовании глютамина в организме уменьшается инсулиновая резистентность, что положительно отображается на скорость набора мышечной массы, а также на процесс сжигания жировых клеток. Важно принимать глютамин во время диеты с пониженным количеством углеводов, потому что физическая активность при уменьшенном количестве глюкозы становится причиной развития дефицитного состояния глютамина.

- Влияет на увеличение естественного производства в организме такого важного гормона, как гормона роста, повышенный синтез которого происходит именно тогда, когда человек засыпает (в первые часы), а также во время тренировки и после нее.
Л-глютамин выступающие спортсмены определяют, как особо важную добавку. Он присутствует в рационе многих известных спортсменов.
Содержание в 1 порции:
Размер порции 2 капсулы
Порций в упаковке 60
Количество на порцию 1000 мг
Суточная норма не установлена
Применение: Принимать по 1 капсуле 1-2 раза в день, между приемами пищи.
Глютамин – уникальное вещество, относящееся к ряду аминокислот. Он играет важное значение в составе белка. На сегодняшний день именно глютамин является лидером среди свободных аминокислот. Глютамин способствует обеспечению нормального роста мышечной ткани. Таким образом, это вещество нередко принимают атлеты. ДостоинстваЕсть ряд достоинств, которыми отличается такое вещество:
О приемеПри приеме такого вещества следует отметить, что организм каждого человека имеет некоторые уникальные особенности. Поэтому следует учесть, что для каждого человека следует выбирать индивидуальный подход к применению таких веществ. Но в целом в сутки каждому человеку следует принимать от трех до восьми грамм за одни сутки. При приеме этого вещества в таких дозах, вы сможете добиться быстрого восстановления организма. Есть и те люди, которые утверждают, что дозы должны быть больше. Но это не так. Ведь в большом количестве глютамин может принести немало вреда организму. Кроме того, вы потратите зря немало денег. Прием глютамина не нужно прекращать даже в тех ситуациях, если вы пропустили тренировку. |
Структурные и динамические неоднородности на границе раздела глутамин – вода
rsc.org/schema/rscart38″> Поведение воды на поверхности твердых кристаллов аминокислот мало изучалось, несмотря на ее важность в процессах зародышеобразования. В этой работе мы делаем первый шаг, чтобы заполнить этот пробел, используя моделирование молекулярной динамики для изучения структурных и динамических свойств воды вблизи поверхностей (100), (010) и (001) кристаллов
У вас есть доступ к этой статье
Подождите, пока мы загрузим ваш контент… Что-то пошло не так. Попробуйте снова?границ | Боковые цепи и лестницы аспарагина и глутамина в амилоидных фибриллах HET (218–289), исследованные с помощью ЯМР с быстрым вращением под магическим углом
Введение
Концевая первичная амидная группа боковых цепей аспарагина и глутамина может действовать как донор водородных связей через группу NH 2 , так и как акцептор через карбонильную группу, и, таким образом, эти боковые цепи важны для стабильности белка (Vernet и другие.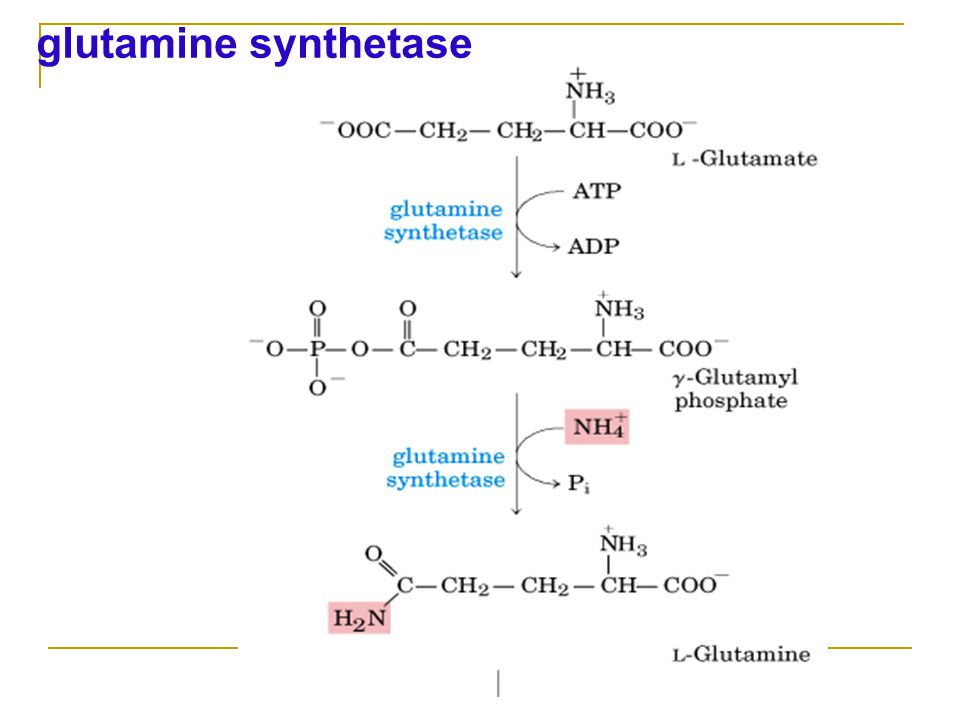 , 1995; Worth, Blundell, 2010), белок-белок (Van Melckebeke et al., 2010; Talavera et al., 2011; Wälti et al., 2016), белок-лиганд (Higman et al., 2004; Raymond et al., 2004) и взаимодействия белков РНК / ДНК (Luscombe et al., 2001; Lejeune et al., 2005). В амилоидах они могут образовывать лестницы аспарагин / глутамин (Wan and Stubbs, 2014; Riek and Eisenberg, 2016; Eisenberg and Sawaya, 2017; Kurt et al., 2017), например, в α-синуклеине (Guerrero-Ferreira et al., 2018, 2019), Aβ (1–42) (Colvin et al., 2016; Wälti et al., 2016), функциональный амилоид HET-s (218–289) (Wasmer et al., 2008; Van Melckebeke et al., 2010) и богатый полиглутамином Orb2 (Hervas et al., 2020) (для некоторых репрезентативных структур см. рисунок 1 и дополнительный рисунок S1). Такие боковые цепи также играют важную роль во многих других амилоидах, включая дрожжевой прион Sup35 (Luckgei et al., 2013), хантингтин (Hoop et al., 2016) и прионы (Kurt et al., 2017), где эти остатки образуют сердцевину фибриллы, лестницы и стерические застежки-молнии (Sawaya et al.
, 1995; Worth, Blundell, 2010), белок-белок (Van Melckebeke et al., 2010; Talavera et al., 2011; Wälti et al., 2016), белок-лиганд (Higman et al., 2004; Raymond et al., 2004) и взаимодействия белков РНК / ДНК (Luscombe et al., 2001; Lejeune et al., 2005). В амилоидах они могут образовывать лестницы аспарагин / глутамин (Wan and Stubbs, 2014; Riek and Eisenberg, 2016; Eisenberg and Sawaya, 2017; Kurt et al., 2017), например, в α-синуклеине (Guerrero-Ferreira et al., 2018, 2019), Aβ (1–42) (Colvin et al., 2016; Wälti et al., 2016), функциональный амилоид HET-s (218–289) (Wasmer et al., 2008; Van Melckebeke et al., 2010) и богатый полиглутамином Orb2 (Hervas et al., 2020) (для некоторых репрезентативных структур см. рисунок 1 и дополнительный рисунок S1). Такие боковые цепи также играют важную роль во многих других амилоидах, включая дрожжевой прион Sup35 (Luckgei et al., 2013), хантингтин (Hoop et al., 2016) и прионы (Kurt et al., 2017), где эти остатки образуют сердцевину фибриллы, лестницы и стерические застежки-молнии (Sawaya et al. , 2007).
, 2007).
Рис. 1. Аспарагиновые и глутаминовые лестницы в белковых структурах. Схематическое изображение амилоидных фибрилл (A – C) , выделяющих аспарагиновые и глутаминовые лестницы и богатый лейцином повторяющийся белок, в котором две боковые цепи аспарагина составляют вторую основную цепь (D) . Водородные связи выделены красными пунктирными линиями. Обратите внимание, что для (A) структура 16 структурного пучка с наименьшей энергией показана, поскольку она особенно хорошо иллюстрирует лестничный мотив (больше структур см. На дополнительном рисунке S1).
Спектроскопия ядерного магнитного резонанса в твердом состоянии (ЯМР) является подходящим методом для идентификации аспарагин / глутаминовых лестниц в амилоидных фибриллах: химические сдвиги 1 H являются чувствительными репортерами и менее экранированы. 1 H резонансы указывают на участие протон в водородной связи (Wagner et al., 1983), тогда как релаксационные свойства могут описывать динамические эффекты. Такая спектроскопическая информация расширяет структурную информацию ЯМР и крио-ЭМ (Gremer et al., 2017; Герреро-Феррейра и др., 2018, 2019; Коллмер и др., 2019; Schmidt et al., 2019; Hervas et al., 2020). Инфракрасная спектроскопия (ИК) также недавно использовалась для идентификации глутаминовых лестниц в амилоид-образующих пептидах (Wu et al., 2019), а ЯМР в растворе был использован для исследования свойств боковой цепи аспарагина, вовлеченной в плотную сеть водородных связей. в белках pp32 с богатыми лейцином повторами (LRR) (Klein et al., 2019) (см. также рисунок 1D). Обнаружение боковых цепей глутамина и аспарагина методом ЯМР-спектроскопии в растворе, e.g., в экспериментах 15 N, 1 H HSQC-типа, использовался в различных биологических контекстах для исследования их структурных и динамических свойств (Buck et al., 1995; Vance et al., 1997; Cai et al., 2001; Mulder et al., 2001; Higman et al., 2004; Klein et al., 2019). Мы показываем, что быстрое вращение под магическим углом (MAS) (Agarwal et al.
Такая спектроскопическая информация расширяет структурную информацию ЯМР и крио-ЭМ (Gremer et al., 2017; Герреро-Феррейра и др., 2018, 2019; Коллмер и др., 2019; Schmidt et al., 2019; Hervas et al., 2020). Инфракрасная спектроскопия (ИК) также недавно использовалась для идентификации глутаминовых лестниц в амилоид-образующих пептидах (Wu et al., 2019), а ЯМР в растворе был использован для исследования свойств боковой цепи аспарагина, вовлеченной в плотную сеть водородных связей. в белках pp32 с богатыми лейцином повторами (LRR) (Klein et al., 2019) (см. также рисунок 1D). Обнаружение боковых цепей глутамина и аспарагина методом ЯМР-спектроскопии в растворе, e.g., в экспериментах 15 N, 1 H HSQC-типа, использовался в различных биологических контекстах для исследования их структурных и динамических свойств (Buck et al., 1995; Vance et al., 1997; Cai et al., 2001; Mulder et al., 2001; Higman et al., 2004; Klein et al., 2019). Мы показываем, что быстрое вращение под магическим углом (MAS) (Agarwal et al. , 2014; Andreas et al., 2015, 2016; Böckmann et al., 2015; Sternberg et al., 2018; Stöppler et al., 2018; Malär) et al., 2019; Penzel et al., 2019; Vasa et al., 2019) может обнаруживать боковые цепи аспарагина и глутамина в спектрах протонов твердотельного ЯМР с кросс-поляризацией (CP) и, иногда, также в экспериментах на основе связывания J , в частности в экспериментах INEPT (Morris and Freeman, 1979), которые затем можно использовать для отличия двух протонных резонансов боковой цепи NH 2 от протонов амидного NH. В амилоидных фибриллах HET-s (218–289) нитчатого гриба Podospora anserina боковые цепи аспарагина видны в экспериментах на основе CP, но не в экспериментах INEPT при частоте MAS 110 кГц.Мы обсуждаем спектральные параметры ЯМР и параметры релаксации, определенные для боковых цепей аспарагина, образующих аспарагиновые лестницы, такие как высокочастотные смещенные протонные резонансы и небольшие константы скорости релаксации с вращающейся рамкой 15 N.
, 2014; Andreas et al., 2015, 2016; Böckmann et al., 2015; Sternberg et al., 2018; Stöppler et al., 2018; Malär) et al., 2019; Penzel et al., 2019; Vasa et al., 2019) может обнаруживать боковые цепи аспарагина и глутамина в спектрах протонов твердотельного ЯМР с кросс-поляризацией (CP) и, иногда, также в экспериментах на основе связывания J , в частности в экспериментах INEPT (Morris and Freeman, 1979), которые затем можно использовать для отличия двух протонных резонансов боковой цепи NH 2 от протонов амидного NH. В амилоидных фибриллах HET-s (218–289) нитчатого гриба Podospora anserina боковые цепи аспарагина видны в экспериментах на основе CP, но не в экспериментах INEPT при частоте MAS 110 кГц.Мы обсуждаем спектральные параметры ЯМР и параметры релаксации, определенные для боковых цепей аспарагина, образующих аспарагиновые лестницы, такие как высокочастотные смещенные протонные резонансы и небольшие константы скорости релаксации с вращающейся рамкой 15 N.
Результаты и обсуждение
Распределение остатков аспарагина и глутамина в HET-s (218–289)
Амидные протоны боковых цепей аспарагина (N) и глутамина (Q) можно наблюдать в быстрых экспериментах MAS с обнаружением протонов. Спектры корреляции CP hNH дейтерированных и 100% обратно обмененных, а также однородно меченных 13 C и 15 N фибрилл HET-s (218–289) (далее сокращенно DUL), записанные на частоте MAS 110 кГц, показаны на рисунке 2А.Боковые цепи N / Q резонируют в области, несколько более защищенной, чем амиды основной цепи, для сдвигов как 15, N, так и 1 H, хотя области перекрываются. Некоторые из наблюдаемых боковых цепей N / Q (например, Q240, N226, N262) приводят к двум пикам корреляции протонов с общей частотой 15 N, что указывает на отсутствие или только медленное вращение вокруг C γ -N δ2 (N) или C δ -N ε2 (Q) связь, как показано в экспериментах с состоянием раствора (Guenneugues et al. , 1997). Назначение боковой цепи основано на эксперименте NCOCX 3D, проведенном на полностью протонированном образце HET-s (218–289), показанном на дополнительном рисунке S2, который дает резонансы боковой цепи 15 N. Значения химического сдвига протонов извлекаются из 2D-спектра hNH (рис. 2А). В общей сложности четыре из пяти боковых цепей аспарагина (N226, N243, N262, N279) и две боковые цепи глутамина (Q240, Q259) были идентифицированы в спектре hNH, только самый C-концевой N289 отсутствует, вероятно, из-за к большой динамике (Van Melckebeke et al., 2010). Боковые цепи N243, Q259 и N279, однако, имеют более низкую интенсивность (дополнительный рисунок S3 для отношения сигнал / шум, извлеченный из 2D-спектров) и остаются необнаруженными в 3D-спектрах, обнаруженных протонами, и, таким образом, назначается только один протон NH 2 для N243 и N279. Обратите внимание, что второй резонанс NH 2 Q259 не виден в спектре CP, но может быть идентифицирован в спектре hNH на основе INEPT ( см.
, 1997). Назначение боковой цепи основано на эксперименте NCOCX 3D, проведенном на полностью протонированном образце HET-s (218–289), показанном на дополнительном рисунке S2, который дает резонансы боковой цепи 15 N. Значения химического сдвига протонов извлекаются из 2D-спектра hNH (рис. 2А). В общей сложности четыре из пяти боковых цепей аспарагина (N226, N243, N262, N279) и две боковые цепи глутамина (Q240, Q259) были идентифицированы в спектре hNH, только самый C-концевой N289 отсутствует, вероятно, из-за к большой динамике (Van Melckebeke et al., 2010). Боковые цепи N243, Q259 и N279, однако, имеют более низкую интенсивность (дополнительный рисунок S3 для отношения сигнал / шум, извлеченный из 2D-спектров) и остаются необнаруженными в 3D-спектрах, обнаруженных протонами, и, таким образом, назначается только один протон NH 2 для N243 и N279. Обратите внимание, что второй резонанс NH 2 Q259 не виден в спектре CP, но может быть идентифицирован в спектре hNH на основе INEPT ( см. Ниже ).
Ниже ).
Рисунок 2. Боковые цепи аспарагина и глутамина в фибриллах HET-s (218–289). (A) 1 H, 15 N CP-hNH-спектр фибрилл HET-s (слева) и 2D-плоскости 3D-спектров hNCOH, показывающие пространственную близость для N226, N262 и Q240 (справа, кросс-пики, упомянутые в текст выделен красными стрелками). Спектры регистрировали при частоте MAS 110 кГц и внешнем магнитном поле 20,0 Тл. Черные точки указывают на назначенные корреляции амидов основной цепи на основе кода доступа 26913 BMRB (Smith et al., 2017). (B) Схематический чертеж лестницы из аспарагина.Кружками обозначены связи, ожидаемые для 3D-экспериментов с hNCOH. (C) Аспарагиновые лестницы в HET, выделенные в структуре PDB (код доступа 2KJ3). (D) Ориентация боковой цепи Q240 по направлению к ароматическим остаткам в HET-s (218–289), выделенная на структуре PDB.
Далее мы рассмотрим вопрос, подходят ли эксперименты INEPT-hNH на основе J -связи для обнаружения боковых цепей N / Q, аналогичные экспериментам 15 N, 1 H HSQC, применяемым в ЯМР в растворе. Хорошо известные различия в кривых передачи намагниченности резонансов боковой цепи NH и NH 2 в перефокусированном эксперименте hNH на основе INEPT (Соренсен и Эрнст, 1983) можно затем использовать для различения протонных резонансов NH 2 боковых цепей N / Q из спектрально перекрывающихся резонансов NH основной цепи (химические структуры боковых цепей N / Q см. на рисунке 3A). Установив задержку INEPT τ N (дополнительный рисунок S4) на 2,7 мс (14JNH), резонансы NH 2 будут сильно подавлены при передаче INEPT; Напротив, при установке τ N близко к 1.Через 4 мс они появляются в спектрах (см. Рисунок 3B). Для HET-s (218–289) только две из семи пар NH 2 (отнесенных к Q240 и Q259) видны в экспериментах INEPT (см. Рисунок 3C). Ни один из пяти остатков аспарагина не обнаруживается, что указывает на то, что время жизни протонов на поперечной намагниченности слишком мало для обнаружения боковых цепей аспарагина HET-s (218–289) в INEPT.
Хорошо известные различия в кривых передачи намагниченности резонансов боковой цепи NH и NH 2 в перефокусированном эксперименте hNH на основе INEPT (Соренсен и Эрнст, 1983) можно затем использовать для различения протонных резонансов NH 2 боковых цепей N / Q из спектрально перекрывающихся резонансов NH основной цепи (химические структуры боковых цепей N / Q см. на рисунке 3A). Установив задержку INEPT τ N (дополнительный рисунок S4) на 2,7 мс (14JNH), резонансы NH 2 будут сильно подавлены при передаче INEPT; Напротив, при установке τ N близко к 1.Через 4 мс они появляются в спектрах (см. Рисунок 3B). Для HET-s (218–289) только две из семи пар NH 2 (отнесенных к Q240 и Q259) видны в экспериментах INEPT (см. Рисунок 3C). Ни один из пяти остатков аспарагина не обнаруживается, что указывает на то, что время жизни протонов на поперечной намагниченности слишком мало для обнаружения боковых цепей аспарагина HET-s (218–289) в INEPT. Мы связываем это с динамикой, как обсуждается ниже. Дейтерирование образца, используемое здесь, имеет решающее значение для экспериментов INEPT по продлению времени жизни поперечной намагниченности протонов.
Мы связываем это с динамикой, как обсуждается ниже. Дейтерирование образца, используемое здесь, имеет решающее значение для экспериментов INEPT по продлению времени жизни поперечной намагниченности протонов.
Рисунок 3. Боковые цепи аспарагина и глутамина, идентифицированные в экспериментах INEPT. (A) Химическая структура боковых цепей аспарагина и глутамина. (B) Зависимость увеличения ε INEPT от времени смешения τ N для спиновых пар NH (синий) и NH 2 (красный). τ H было установлено равным 2 мс, константа связи 15 N- 1 H J была принята равной 92 Гц, а эффекты релаксации не учитывались. (C) 15 N, 1 H Спектры INEPT-hNH фибрилл DUL HET-s (218–289), записанные при различных временах перемешивания τ N (τ H было установлено равным 2 мс). Область боковой цепи N / Q выделена оранжевым. (D) 15 N, 1 H INEPT-hNH спектры DUL DnaB с разными временами перемешивания τ N . Спектральная область N / Q выделена оранжевым. Спектры регистрировались при частоте МАС 110 кГц и внешнем магнитном поле 20.0 т.
Спектральная область N / Q выделена оранжевым. Спектры регистрировались при частоте МАС 110 кГц и внешнем магнитном поле 20.0 т.
Мы предполагаем, что такие эксперименты по фильтрации INEPT также могут быть полезны для больших белков для идентификации и дальнейшей характеристики соответствующей области боковой цепи N / Q в спектрах ЯМР с множеством скоплений. Чтобы проверить осуществимость такого подхода, мы записали спектры INEPT-hNH для гексамерного белка DnaB 354 кДа (Wiegand et al., 2019; Wiegand, 2020) (в комплексе с АДФ: AlF x , — и ДНК). На рисунке 3D показано сравнение спектров с τ N = 1.2 мс (голубой) и τ N = 2,7 мс (серый, для разностного спектра см. Дополнительный рисунок S5, а для других τ N — раз см. Дополнительные рисунки S6, S7) и действительно несколько N / Q боковые цепи идентифицируются на 110 кГц MAS. Мы отмечаем, что спектры INEPT этого белка с 488 остатками (с 24 остатками N и 23 Q) снова довольно редки, также для амидов основной цепи, поскольку этап INEPT отфильтровывает резонансы с короткими временами жизни намагниченности поперечных протонов, которые, с другой стороны, видны в спектрах CP-hNH (Wiegand et al. , 2020).
, 2020).
Лестницы из аспарагина
В амилоидных фибриллах HET-s (218–289) две аспарагиновые лестницы (одна содержит N226 и N262, а другая — N243 и N279) постулируются из структуры, полученной с помощью твердотельного ЯМР. N226 и N262 указывают на внутреннюю часть фибриллы и расположены рядом с гидрофобным ядром, тогда как N243 и N279 находятся вне ядра (см. Рисунок 2C; Wasmer et al., 2008). Структура ЯМР показывает хорошо сформированную лестницу для N226 / N262 в большинстве структур структурного пучка, тогда как N243 / N279 не образуют регулярной лестницы.На данный момент не ясно, a priori , является ли эта разница следствием ограниченной точности структуры ЯМР или отражает реальные структурные различия. Такие небольшие, но потенциально важные структурные особенности нелегко устранить с помощью крио-ЭМ или ЯМР-структур. Однако можно использовать спектроскопические особенности: протонный химический сдвиг сам по себе очень чувствителен к изменениям в окружающей среде и может использоваться в качестве индикатора водородных связей (Cordier and Grzesiek, 1999), характерных для лестниц (см. Рисунок 2).Как показано в расчетах функциональной теории плотности (DFT) на модели, состоящей из двух боковых цепей аспарагина, связанных водородной связью, см. Рисунок 4 и дополнительный рисунок S8, значительное снятие экранирования протона H Z (см. Вставку Рисунок 4 для номенклатуры), участвующих в водородной связи. В одном вычислении два фрагмента боковой цепи аспарагина перемещались относительно друг друга по вектору расстояния NH … O (рис. 4), тогда как во втором вычислении только протон H Z перемещался по этому вектору, а все остальные атомы двух фрагментов оставались фиксированными (дополнительный рисунок S8).Оба случая показывают, что чем короче водородная связь, тем больше разница в химическом сдвиге между протонами H Z и H E (Barfield, 2002). Мы предполагаем, что сценарий, описанный на рисунке 4, более вероятно, отражает ситуацию в аспарагиновой лестнице, хотя не только длина водородной связи влияет на прочность водородной связи и, следовательно, значения химического сдвига протона, наблюдаемые экспериментально, но также и валентный угол, безусловно, имеет влияние.
Рисунок 2).Как показано в расчетах функциональной теории плотности (DFT) на модели, состоящей из двух боковых цепей аспарагина, связанных водородной связью, см. Рисунок 4 и дополнительный рисунок S8, значительное снятие экранирования протона H Z (см. Вставку Рисунок 4 для номенклатуры), участвующих в водородной связи. В одном вычислении два фрагмента боковой цепи аспарагина перемещались относительно друг друга по вектору расстояния NH … O (рис. 4), тогда как во втором вычислении только протон H Z перемещался по этому вектору, а все остальные атомы двух фрагментов оставались фиксированными (дополнительный рисунок S8).Оба случая показывают, что чем короче водородная связь, тем больше разница в химическом сдвиге между протонами H Z и H E (Barfield, 2002). Мы предполагаем, что сценарий, описанный на рисунке 4, более вероятно, отражает ситуацию в аспарагиновой лестнице, хотя не только длина водородной связи влияет на прочность водородной связи и, следовательно, значения химического сдвига протона, наблюдаемые экспериментально, но также и валентный угол, безусловно, имеет влияние.
Рисунок 4. Протонный химический сдвиг — чувствительный инструмент для измерения силы водородных связей в аспарагиновой лестнице. Расчеты методом DFT (B3-LYP / def2-TZVP) значений химического сдвига 1 H в зависимости от длины водородной связи в модели, представляющей две боковые цепи аспарагина. Геометрия двух молекул была фиксированной, и два фрагмента перемещались относительно друг друга по вектору расстояния N-H … O, см. Вставку.
Экспериментально для N226 мы обнаруживаем большую разницу между двумя протонными резонансами, резонирующими на 8.4 и 6,5 м.д. Для N262 менее экранированное значение составляет 7,6 ppm по сравнению с 6,8 ppm для более экранированного. Таким образом, два протона NH 2 смещены в разных направлениях относительно их средних значений химического сдвига по всем осажденным остаткам аспарагина, извлеченным из базы данных BMRB (7,3 и 7,1 м.д.).
3D эксперименты с hNCOH (рис. 2В) не только идентифицируют два протона в одной группе NH 2 , но также исследуют пространственную близость между такими боковыми цепями. СР-стадию 9 мс 13 CO- 1 H использовали для достижения передачи поляризации к обоим протонам NH 2 соседней боковой цепи аспарагина в пределах одной и той же лестницы. Подобные эксперименты были недавно описаны для идентификации паттернов водородных связей скелета в Sh4 и GB1 (Friedrich et al., 2020). И действительно, плоскости 15 N при значении химического сдвига боковой цепи NH 2 N262 (112,7 ppm) и N226 (114,8 ppm) ясно показывают кросс-пики с протонными сдвигами группы NH 2 N226 и N262 соответственно (см. Рис. 2A, красные стрелки), указывающие на их пространственную близость.В HET-s (218–289) эта информация подтверждает известный регистр в β-листах, а в других системах с неизвестной структурой это может представлять еще больший интерес. Для остатков N243 / N279, которые образуют вторую лестницу аспарагина, сигналы не обнаруживаются в трехмерном спектре hNCOH на основе CP.
СР-стадию 9 мс 13 CO- 1 H использовали для достижения передачи поляризации к обоим протонам NH 2 соседней боковой цепи аспарагина в пределах одной и той же лестницы. Подобные эксперименты были недавно описаны для идентификации паттернов водородных связей скелета в Sh4 и GB1 (Friedrich et al., 2020). И действительно, плоскости 15 N при значении химического сдвига боковой цепи NH 2 N262 (112,7 ppm) и N226 (114,8 ppm) ясно показывают кросс-пики с протонными сдвигами группы NH 2 N226 и N262 соответственно (см. Рис. 2A, красные стрелки), указывающие на их пространственную близость.В HET-s (218–289) эта информация подтверждает известный регистр в β-листах, а в других системах с неизвестной структурой это может представлять еще больший интерес. Для остатков N243 / N279, которые образуют вторую лестницу аспарагина, сигналы не обнаруживаются в трехмерном спектре hNCOH на основе CP.
Однородные протонные ширины боковых цепей аспарагина и глутамина
Видимость протонных резонансов в экспериментах типа INEPT связана с однородной шириной протонной линии (Δ homo ), которая определяется геометрией протонной диполярной сетки (когерентный вклад; Зорин и др. , 2006; Штернберг и др., 2018; Malär et al., 2019), дополнительные аддитивные вклады, возникающие в результате релаксации типа Редфилда, вызванного стохастическим движением молекул (некогерентный вклад от анизотропных взаимодействий) и эффектами расширения химического обмена (некогерентные вклады от разностей изотропных химических сдвигов) (Sternberg et al. , 2018; Malär et al., 2019; Penzel et al., 2019). К сожалению, эти три вклада нелегко рассматривать по отдельности, и экспериментально наблюдается только их сумма.Ожидается, что когерентный и некогерентный вклад будет уменьшаться с более быстрым вращением (Lewandowski et al., 2011; Andreas et al., 2015; Böckmann et al., 2015; Sternberg et al., 2018; Malär et al., 2019; Penzel et al., 2015; Sternberg et al., 2018; Malär et al., 2019; Penzel et al. ., 2019), тогда как химический обмен в значительной степени не зависит от частоты MAS. Эксперименты по затуханию спинового эха позволяют определять времена релаксации протона T 2 ′ и значения Δ homo = R 2 ′ / π = 1 / (π T 2 ′).
, 2006; Штернберг и др., 2018; Malär et al., 2019), дополнительные аддитивные вклады, возникающие в результате релаксации типа Редфилда, вызванного стохастическим движением молекул (некогерентный вклад от анизотропных взаимодействий) и эффектами расширения химического обмена (некогерентные вклады от разностей изотропных химических сдвигов) (Sternberg et al. , 2018; Malär et al., 2019; Penzel et al., 2019). К сожалению, эти три вклада нелегко рассматривать по отдельности, и экспериментально наблюдается только их сумма.Ожидается, что когерентный и некогерентный вклад будет уменьшаться с более быстрым вращением (Lewandowski et al., 2011; Andreas et al., 2015; Böckmann et al., 2015; Sternberg et al., 2018; Malär et al., 2019; Penzel et al., 2015; Sternberg et al., 2018; Malär et al., 2019; Penzel et al. ., 2019), тогда как химический обмен в значительной степени не зависит от частоты MAS. Эксперименты по затуханию спинового эха позволяют определять времена релаксации протона T 2 ′ и значения Δ homo = R 2 ′ / π = 1 / (π T 2 ′). Последовательности импульсов, используемые для измерения значений Δ homo , показаны на дополнительном рисунке S9.
Последовательности импульсов, используемые для измерения значений Δ homo , показаны на дополнительном рисунке S9.
Для фибрилл HET-s (218–289) наблюдаются значения Δ homo между 80 и 160 Гц для протонов боковых цепей N226, N243 и N262 (см. Рисунки 5A, B), что объясняет, почему эти резонансы отсутствуют в Эксперименты INEPT (Δ homo 160 Гц, T 2 ′ ∼2 мс, приведут к ослаблению на ∼88% эффективности перефокусированного INEPT с задержками INEPT τ H = 2,0 мс и τ N = 1,2 мс). Δ homo для N279 еще больше (543 ± 140 Гц).Все эти значения значительно превышают соответствующие значения амидных протонов основной цепи, о которых сообщалось ранее, показывая в среднем 22 ± 1 Гц при 100 кГц MAS для DUL HET-s (218–289) (Smith-Penzel, 2019). . Боковые цепи глутамина, которые легко наблюдаются в INEPT-hNH, как и ожидалось, имеют меньшее значение Δ homo (<50 Гц). В качестве дополнительной ссылки мы также измерили ширину гомогенных протонных линий для боковых цепей аспарагина и глутамина в DnaB. В соответствии с экспериментальным наблюдением боковых цепей глутамина в спектрах INEPT, Δ homo действительно меньше и составляет в среднем 31 ± 5 Гц (дополнительный рисунок S10).
В соответствии с экспериментальным наблюдением боковых цепей глутамина в спектрах INEPT, Δ homo действительно меньше и составляет в среднем 31 ± 5 Гц (дополнительный рисунок S10).
Рис. 5. Ширина линий гомогенных протонов и 15 N и 1 H R 1 ρ константы скорости боковых цепей аспарагина и глутамина в фибриллах HET-s (218–289). Увеличьте изображение спектров INEPT-hNH (голубой) и CP-hNH (синий) фибрилл HET-s (218–289) (A) , показывающих область боковой цепи аспарагина и глутамина и некоторые резонансные соотношения. Однородные ширины протонных линий для аспарагиновых и глутаминовых боковых цепей фибрилл HET-s (218–289) приведены в (B) .Константы скорости релаксации спин-блокировки азота для боковых цепей аспарагина и глутамина показаны в (C) , времена релаксации спин-блокировки протона в (D) . Все показанные планки погрешностей соответствуют двум стандартным отклонениям. Константы скорости релаксации, приведенные на вертикальной оси, связаны соотношением Δ = R / π. Времена релаксации определялись при частоте МАС 105 кГц и внешнем магнитном поле 20,0 Тл.
Константы скорости релаксации, приведенные на вертикальной оси, связаны соотношением Δ = R / π. Времена релаксации определялись при частоте МАС 105 кГц и внешнем магнитном поле 20,0 Тл.
Чтобы исследовать, связаны ли большие, чем ожидалось, значения Δ homo , наблюдаемые для боковых цепей аспарагина, с механизмами когерентного уширения, мы численно смоделировали спектр твердотельного ЯМР 1 H, используя геометрию шести NH 2 спинов протонов N262-N226-N262, взятых из файла PDB (Рисунок 1, регистрационный номер PDB 2KJ3, выбранная геометрия взята из структуры 16, в которой наиболее четко видна аспарагиновая лестница N226 / N262, см. Также дополнительный рисунок S11A).Это моделирование дает значения Δ homo менее 5 Гц (см. Дополнительный рисунок S11B), что показывает, что основной вклад в Δ homo не связан с когерентными эффектами, возникающими из-за геометрии внутри аспарагиновой лестницы, даже если вклад от учитывается амид близлежащей основной цепи (дополнительный рисунок S12). Численно смоделированный профиль затухания спинового эха с использованием той же шестиспиновой системы показан на дополнительном рисунке S11C и также дает пренебрежимо малое значение Δ homo , равное 2 Гц.Не было обнаружено, что перекрестные члены между гетероядерными дипольными связями 15 N- 1 H и / или J и гомоядерными диполярными связями протонов вносят заметный вклад (дополнительный рисунок S11C).
Численно смоделированный профиль затухания спинового эха с использованием той же шестиспиновой системы показан на дополнительном рисунке S11C и также дает пренебрежимо малое значение Δ homo , равное 2 Гц.Не было обнаружено, что перекрестные члены между гетероядерными дипольными связями 15 N- 1 H и / или J и гомоядерными диполярными связями протонов вносят заметный вклад (дополнительный рисунок S11C).
15 N константы скорости релаксации вращающегося кадра, характеризующиеся R 1ρ , могут дать дополнительную информацию о динамике боковых цепей аспарагина и глутамина (последовательности импульсов см. На дополнительном рисунке S13, а для конкретных участков кривые распада (дополнительные рисунки S14, S15).В используемых экспериментальных условиях (110 кГц MAS, 13 кГц амплитуда ВЧ-поля для спиновой блокировки) эксперимент чувствителен к динамике с временами корреляции от сотен наносекунд до диапазона низких микросекунд (Lakomek et al. , 2017). На рис. 5C показаны экспериментальные константы скорости релаксации 15 N R 1ρ для фибрилл HET-s (218–289). Типичные атомы азота жесткой основной цепи обладают значениями R 1ρ около 2 с −1 (Schanda and Ernst, 2016; Lakomek et al., 2017). Значения для азота боковой цепи NH 2 N226 и N262 также составляют порядка 2 с –1 , что указывает на отсутствие динамики в этой шкале времени для азота боковой цепи (для получения подробной информации о релаксационных свойствах NH 2 спиновых систем см. Bull (1992). Интересно, что N243 и N279 показывают значительно большие 15 N R 1 ρ (> 25 с –1 ), что указывает на более высокую степень гибкости этой стороны -цепи.Основываясь на измеренных значениях R 1ρ , боковая цепь Q240 такая же жесткая, как N226 и N262, тогда как Q259 более гибкий и показывает более слабые корреляции в 3D-спектрах 13 C (см.
, 2017). На рис. 5C показаны экспериментальные константы скорости релаксации 15 N R 1ρ для фибрилл HET-s (218–289). Типичные атомы азота жесткой основной цепи обладают значениями R 1ρ около 2 с −1 (Schanda and Ernst, 2016; Lakomek et al., 2017). Значения для азота боковой цепи NH 2 N226 и N262 также составляют порядка 2 с –1 , что указывает на отсутствие динамики в этой шкале времени для азота боковой цепи (для получения подробной информации о релаксационных свойствах NH 2 спиновых систем см. Bull (1992). Интересно, что N243 и N279 показывают значительно большие 15 N R 1 ρ (> 25 с –1 ), что указывает на более высокую степень гибкости этой стороны -цепи.Основываясь на измеренных значениях R 1ρ , боковая цепь Q240 такая же жесткая, как N226 и N262, тогда как Q259 более гибкий и показывает более слабые корреляции в 3D-спектрах 13 C (см. Дополнительный рисунок S2) . В DnaB, который не содержит лестниц N / Q, константы скорости релаксации боковой цепи азота R 1ρ находятся в диапазоне от 10 до 32 с –1 (см. Дополнительный рисунок S10C) и, таким образом, больше чем для довольно жестких боковых цепей N226 / N262 фибрилл HET-s (218–289).
Дополнительный рисунок S2) . В DnaB, который не содержит лестниц N / Q, константы скорости релаксации боковой цепи азота R 1ρ находятся в диапазоне от 10 до 32 с –1 (см. Дополнительный рисунок S10C) и, таким образом, больше чем для довольно жестких боковых цепей N226 / N262 фибрилл HET-s (218–289).
Более высокая жесткость лестницы N226 / N262 по сравнению с N243 / N279 может быть следствием более высокой доступности воды для N243 / N279 в соответствии с их расположением вне гидрофобной сердцевины. Все остатки аспарагина влияют на стабильность фибрилл в присутствии гуанидина в качестве химического денатуранта, как показывает сайт-направленный мутагенез (Wan and Stubbs, 2014). Однако мутация N226 и N262 вызывает большую дестабилизацию, чем мутация N243 и особенно N279, в последнем мутанте наблюдалась аналогичная химическая стабильность, чем в фибриллах HET-s (218–289) дикого типа (Wan and Stubbs, 2014).
Поскольку до сих пор механизмы когерентного и некогерентного уширения не могут объяснить наблюдаемую протонную однородную ширину линии, мы также рассматриваем возможность уширения химического обмена, а именно медленного или промежуточного обмена (ниже коалесценции) в миллисекундном масштабе времени, чтобы объяснить более широкое, чем ожидалось линий. Такие процессы наблюдались для боковых цепей аспарагина в лизоциме Т4 (Mulder et al., 2001) или в гомодимерах со спиральной спиралью (Thomas et al., 2017) в растворе. Обмен, скорее всего, асимметричный с одним доминирующим конформером, который обнаруживается в наших спектрах.В нашей модели конформационные состояния представляют собой водородные связи боковых цепей аспарагина в виде лестницы (наиболее заселенное состояние, наблюдаемое экспериментально) и дополнительное пока ненаблюдаемое состояние. Мы выполнили 15 N экспериментов по переносу насыщения химическим обменом (CEST) (Vallurupalli et al., 2012), но не смогли наблюдать это состояние, требующее дальнейших экспериментальных работ. Константы скорости релаксации протонов NH 2 во вращающейся рамке, измеренные для боковых цепей аспарагина, больше по сравнению с амидами основной цепи, возможно, как следствие модуляции протонных гомоядерных диполярных связей в процессе обмена (см. Рисунок 5D и дополнительные Рисунок S16).
Такие процессы наблюдались для боковых цепей аспарагина в лизоциме Т4 (Mulder et al., 2001) или в гомодимерах со спиральной спиралью (Thomas et al., 2017) в растворе. Обмен, скорее всего, асимметричный с одним доминирующим конформером, который обнаруживается в наших спектрах.В нашей модели конформационные состояния представляют собой водородные связи боковых цепей аспарагина в виде лестницы (наиболее заселенное состояние, наблюдаемое экспериментально) и дополнительное пока ненаблюдаемое состояние. Мы выполнили 15 N экспериментов по переносу насыщения химическим обменом (CEST) (Vallurupalli et al., 2012), но не смогли наблюдать это состояние, требующее дальнейших экспериментальных работ. Константы скорости релаксации протонов NH 2 во вращающейся рамке, измеренные для боковых цепей аспарагина, больше по сравнению с амидами основной цепи, возможно, как следствие модуляции протонных гомоядерных диполярных связей в процессе обмена (см. Рисунок 5D и дополнительные Рисунок S16). Однако обменный вклад в измеренные значения протона R 1ρ пренебрежимо мал при спин-локальном поле 13 кГц, используемом в нашем эксперименте (Palmer and Massi, 2006). Независимо от того, является ли это наблюдение общей характеристикой лестниц N / Q, необходимо исследовать дальнейшие амилоидные фибриллы в будущей работе, однако интересно, что боковые цепи глутамина в HET-s (218–289) не проявляют этих эффектов, и их однородная ширина линии примерно в три раза меньше.
Однако обменный вклад в измеренные значения протона R 1ρ пренебрежимо мал при спин-локальном поле 13 кГц, используемом в нашем эксперименте (Palmer and Massi, 2006). Независимо от того, является ли это наблюдение общей характеристикой лестниц N / Q, необходимо исследовать дальнейшие амилоидные фибриллы в будущей работе, однако интересно, что боковые цепи глутамина в HET-s (218–289) не проявляют этих эффектов, и их однородная ширина линии примерно в три раза меньше.
Характеристика боковых цепей глутамина и ориентация Q240
Для двух глутаминовых боковых цепей HET-s (218–289) из структуры невозможно образование лестницы (Van Melckebeke et al., 2010). Боковые цепи глутамина NH 2 наблюдаются в CP- и INEPT-спектрах (Рисунки 2A, 3D). Для Q240 один протон смещается в более защищенную область (4,8 ppm), другой — при 7,8 ppm, что немного меньше экранировано по сравнению со средними значениями химического сдвига, взятыми из базы данных BMRB (7,22 / 7,04 ppm). Повышенное экранирование одного из протонов NH 2 Q240 может быть связано с эффектами кольцевого тока, поскольку Q240 указывает на гидрофобный карман, состоящий из ароматических остатков (F286 и W287, рисунок 2D; Van Melckebeke et al., 2010). Перекрестный сигнал между Q240 и W287 в эксперименте 3D hNCOH показывает, что боковая цепь Q240 действительно находится в пространственной близости от NH-группы боковой цепи W287 (рис. 2A).
Повышенное экранирование одного из протонов NH 2 Q240 может быть связано с эффектами кольцевого тока, поскольку Q240 указывает на гидрофобный карман, состоящий из ароматических остатков (F286 и W287, рисунок 2D; Van Melckebeke et al., 2010). Перекрестный сигнал между Q240 и W287 в эксперименте 3D hNCOH показывает, что боковая цепь Q240 действительно находится в пространственной близости от NH-группы боковой цепи W287 (рис. 2A).
Заключение
Мы обнаружили сигналы протонов боковых цепей аспарагина и глутамина NH 2 в быстрых MAS-спектрах HET-s (218–289) в его амилоидной форме. Описаны спектральные и релаксационные свойства, исследовано влияние образования лестниц. В таблице 1 приведены характеристики ЯМР таких боковых цепей.Следующие наблюдения были сделаны для аспарагинов, участвующих в хорошо сформированной лестнице: (i) сильное снятие экранирования протонного сдвига одного из протонов NH 2 , (ii) большая разница в химическом сдвиге между двумя протонами. , (iii) корреляции в трехмерных космических экспериментах hCONH, и (iv) малые 15 N R 1ρ константы скорости релаксации. Эти свойства характеризуют аспарагиновую лестницу N226-N262. Кроме того, были обнаружены (v) большая однородная ширина линии протонов и (vi) большие константы скорости релаксации 1 H R 1ρ . 15 N Константы скорости релаксации вращающейся рамки указывают на то, что боковые цепи, участвующие в лестнице аспарагина N226-N262, более жесткие, чем в лестнице N243-N279, которые кажутся более динамичными, не формируя сильную сдерживающую водородную сеть. Большая однородная ширина протонных линий для боковых цепей аспарагина, участвующих в лестнице, еще не полностью изучена, может быть связана с химическим обменом в миллисекундном масштабе времени, характерным для протонов, участвующих в аспарагиновой лестнице в фибриллах HET-s (218–289).Амидные протоны глутаминовой боковой цепи HET-s (218–289), не участвующие в таких взаимодействиях, имеют менее однородное уширение и ширину линий, сравнимую с шириной линии протонов NH основной цепи.
, (iii) корреляции в трехмерных космических экспериментах hCONH, и (iv) малые 15 N R 1ρ константы скорости релаксации. Эти свойства характеризуют аспарагиновую лестницу N226-N262. Кроме того, были обнаружены (v) большая однородная ширина линии протонов и (vi) большие константы скорости релаксации 1 H R 1ρ . 15 N Константы скорости релаксации вращающейся рамки указывают на то, что боковые цепи, участвующие в лестнице аспарагина N226-N262, более жесткие, чем в лестнице N243-N279, которые кажутся более динамичными, не формируя сильную сдерживающую водородную сеть. Большая однородная ширина протонных линий для боковых цепей аспарагина, участвующих в лестнице, еще не полностью изучена, может быть связана с химическим обменом в миллисекундном масштабе времени, характерным для протонов, участвующих в аспарагиновой лестнице в фибриллах HET-s (218–289).Амидные протоны глутаминовой боковой цепи HET-s (218–289), не участвующие в таких взаимодействиях, имеют менее однородное уширение и ширину линий, сравнимую с шириной линии протонов NH основной цепи. Таким образом, быстрые эксперименты с ЯМР MAS исследуют образование водородных связей в боковой цепи белка, в частности, в контексте образования аспарагиновой / глутаминовой лестницы. Хотя для полного понимания необходимо исследовать больше систем, результаты HET-s (218–289) ясно показывают потенциал этого подхода.
Таким образом, быстрые эксперименты с ЯМР MAS исследуют образование водородных связей в боковой цепи белка, в частности, в контексте образования аспарагиновой / глутаминовой лестницы. Хотя для полного понимания необходимо исследовать больше систем, результаты HET-s (218–289) ясно показывают потенциал этого подхода.
Таблица 1. Обзор спектральных и релаксационных свойств боковых цепей аспарагина и глутамина.
Материалы и методы
Белковые препараты
Препараты образцов DUL Hp DnaB: ADP: AlF 4 — : ДНК (Wiegand et al., 2019) и DUL HET-s (218–289) (Wasmer et al., 2008) подготовлен, как описано ранее. Короче говоря, белки рекомбинантно экспрессировались в D 2 O в присутствии дейтерированной 13 C-глюкозы (2 г / л) и 15 N-хлорида аммония (2 г / л) в качестве единственных источников углерода. 13 и азот-15.В случае HET-s (218–289) фибрилляцию проводили в протонированном растворителе (50 мМ лимонной кислоты при pH 5 в H 2 O) в течение 24 часов, что давало 100% фибриллы с обратным обменом (Smith et al., 2017). Для DnaB обратный обмен был достигнут путем очистки белка в протонированном буфере (2,5 мМ фосфат натрия, pH 7,5, 130 мМ NaCl). Образование комплекса с АДФ: AlF x — и ДНК (использовали одноцепочечную молекулу ДНК с 20 основаниями тимина, закупленную у Microsynth) описано в ссылке Wiegand et al.(2019). Фибриллы UL HET-s (218–289) получали идентично, но только с использованием H 2 O вместо D 2 O и протонированных 13 C-глюкозы (2 г / л) и 15 N-аммония. хлорид (2 г / л).
Твердотельный ЯМР
Спектры ЯМР в твердом состоянии регистрировали при напряженности статического магнитного поля 20,0 Тл с использованием зонда Bruker 0,7 мм. Частота MAS была установлена на 110 кГц. Обработка 2D-спектров проводилась в программе TOPSPIN (версия 3.5, Bruker Biospin) со смещенным (3.0) функция аподизации квадратного косинуса и автоматическая коррекция базовой линии в косвенных и прямых измерениях. Температура образца была установлена на уровне 293 К (Böckmann et al., 2009). Все спектры анализировали с помощью программного обеспечения CcpNmr (Fogh et al., 2002; Vranken et al., 2005; Stevens et al., 2011) и ссылались на 4,4-диметил-4-силапентан-1-сульфоновую кислоту (DSS). . Константы скорости релаксации, специфичные для сайта, были извлечены из экспериментов по релаксации 2D hNH с использованием программного обеспечения INFOS (Smith, 2017) (см. Дополнительные рисунки S14, S15 для моноэкспоненциальной аппроксимации всех кривых затухания релаксации для DUL HET-s).Планки погрешностей для всех данных релаксации были получены методами начальной загрузки с использованием 500 итераций и показаны как 2σ, где σ обозначает полученную ошибку. Для получения дополнительной информации см. Дополнительную таблицу S1. Спектры ЯМР доступны по адресу https://doi.org/10.3929/ethz-b-000430151.
Численное моделирование
Численное моделирование спектров MAS 1 H было выполнено с помощью SIMPSON (Bak et al., 2000) с использованием шести спинов протонов в геометрии, извлеченной из файла pdb 2JK3 (структура 16).Кривые затухания спинового эха были получены с использованием одной и той же протонной шестиспиновой системы с тремя спинами азота и без них. Моделирование проводилось в среде спинового моделирования GAMMA (Smith et al., 1994). Программный код для моделирования предоставлен в дополнительном материале.
Расчеты ДПФ
Расчеты DFT были выполнены с помощью TURBOMOLE (Ahlrichs et al., 1989) версии 6.4.0. Оптимизация геометрии была выполнена на уровне B3-LYP (Stephens et al., 1994) / def2-TZVP (Weigend and Ahlrichs, 2005) с использованием коррекции дисперсии D3 (Grimme et al., 2010). Во всех расчетах TURBOMOLE SCF использовался критерий сходимости энергии 10 –7 E h , а при оптимизации геометрии — критерий сходимости энергии 10 –6 E h . Сетка интеграции была установлена на m4. Магнитное экранирование было рассчитано в рамках GIAO на том же теоретическом уровне и преобразовано в значения химического сдвига в соответствии с δ = σ ref -σ, где σ ref — магнитное экранирование протонов TMS, рассчитанное на том же уровне теория (σ ref = 31.9 частей на миллион). Зависимость от ориентации значений химического сдвига 1 H была изучена путем перемещения двух молекул относительно друг друга по вектору расстояний NH … O (рисунок 4) или перемещения протона только вдоль этого вектора (дополнительный рисунок S8 ). Никакой дополнительной оптимизации геометрии не проводилось.
Заявление о доступности данныхВсе наборы данных, созданные для этого исследования, включены в статью / дополнительные материалы.
Авторские взносы
RC подготовил образцы.TW и AM провели ЯМР-эксперименты. TW, AM, ME, AB и BM проанализировали данные. TW и ME выполнили моделирование. TW, AB, ME и BM разработали и руководили исследованием. Все авторы внесли свой вклад в написание рукописи.
Финансирование
Эта работа была поддержана ETH Career SEED-69 16-1 (TW) и исследовательским грантом ETH ETH-43 17-2 (TW), грантом ERC Advanced (BM, грант № 741863, Faster), Швейцарский национальный научный фонд (BM, гранты № 200020_159707 и 200020-188711, ME, грант №200020_188988), Французское агентство Nationale de Recherche (AB, ANR-14-CE09-0024B) и LABEX ECOFECT (AB, ANR-11-LABX-0048) в рамках программы Лионского университета Investissements d’Avenir (AB, ANR -11-IDEX-0007).
Конфликт интересов
Авторы заявляют, что исследование проводилось при отсутствии каких-либо коммерческих или финансовых отношений, которые могут быть истолкованы как потенциальный конфликт интересов.
Благодарности
TW благодарит Дениса Лакабана за полезные обсуждения.
Дополнительные материалы
Дополнительные материалы к этой статье можно найти в Интернете по адресу: https://www.frontiersin.org/articles/10.3389/fmolb.2020.582033/full#supplementary-material
Сноски
Список литературы
Agarwal, V., Penzel, S., Szekely, K., Cadalbert, R., Testori, E., Oss, A., et al. (2014). Определение трехмерной структуры De Novo из образцов белка размером менее миллиграммов с помощью твердотельной спектроскопии MAS ЯМР 100 кГц. Angew.Chem. Int. Эд. 53, 12253–12256. DOI: 10.1002 / anie.201405730
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Альрихс, Р., Бэр, М., Хэзер, М., Хорн, Х., и Кёльмель, К. (1989). Расчеты электронной структуры на рабочих станциях ЭВМ: программная система турбомол. Chem. Phys. Lett. 162, 165–169. DOI: 10.1016 / 0009-2614 (89) 85118-8
CrossRef Полный текст | Google Scholar
Андреас, Л. Б., Яудземс, К., Станек, Дж., Лалли, Д., Бертарелло А., Ле Маршан Т. и др. (2016). Структура полностью протонированных белков с помощью детектируемого протонами ЯМР с вращением под магическим углом. Proc. Natl. Акад. Sci. США 113, 9187–9192.
Google Scholar
Андреас, Л. Б., Ле Маршан, Т., Яудземс, К., и Пинтакуда, Г. (2015). Протонно-детектируемый ЯМР белков с высоким разрешением при очень быстрой МАС. J. Magn. Резон. 253, 36–49. DOI: 10.1016 / j.jmr.2015.01.003
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Бак, М., Расмуссен, Дж. Т., и Нильсен, Н. К. (2000). SIMPSON: общая программа моделирования для твердотельной ЯМР-спектроскопии. J. Magn. Резон. 147, 296–330. DOI: 10.1006 / jmre.2000.2179
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Барфилд, М. (2002). Структурные зависимости скалярного взаимодействия между остатками h4JNC ‘и химических сдвигов донора 1H в областях водородных связей белков. J. Am. Chem. Soc. 124, 4158–4168. DOI: 10.1021 / ja012674v
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Бёкманн, А., Gardiennet, C., Verel, R., Hunkeler, A., Loquet, A., Pintacuda, G., et al. (2009). Характеристика различных водных бассейнов в твердотельных образцах белка ЯМР. J. Biomol. ЯМР 45, 319–327. DOI: 10.1007 / s10858-009-9374-3
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Бак, М., Бойд, Дж., Редфилд, К., Маккензи, Д. А., Джинес, Д. Дж., Арчер, Д. Б. и др. (1995). Структурные детерминанты динамики белка: анализ измерений релаксации 15N ЯМР для ядер основной и боковой цепи лизоцима белка куриного яйца. Биохимия 34, 4041–4055. DOI: 10.1021 / bi00012a023
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Bull, T. E. (1992). Релаксация во вращающейся рамке в жидкостях. Прог. Nucl. Magn. Резон. Spectrosc. 24, 377–410. DOI: 10.1016 / 0079-6565 (92) 80002-w
CrossRef Полный текст | Google Scholar
Цай М., Хуанг Ю. и Клор Г. М. (2001). Точная ориентация функциональных групп боковых цепей аспарагина и глутамина с использованием диполярных связей с одной и двумя связями. J. Am. Chem. Soc. 123, 8642–8643. DOI: 10.1021 / ja0164475
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Колвин, М. Т., Сильверс, Р., Ни, К. З., Джан, Т. В., Сергеев, И., Розай, М. и др. (2016). Структура атомного разрешения мономорфных амилоидных фибрилл Aβ42. J. Am. Chem. Soc. 138, 9663–9674. DOI: 10.1021 / jacs.6b05129
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Cordier, F., и Grzesiek, S. (1999).Прямое наблюдение водородных связей в белках с помощью скалярных связей между остатками 3hJNC ‘. J. Am. Chem. Soc. 121, 1601–1602. DOI: 10.1021 / ja983945d
CrossRef Полный текст | Google Scholar
Айзенберг, Д. С., Савая, М. Р. (2017). Структурные исследования амилоидных белков на молекулярном уровне. Annu. Rev. Biochem 86, 69–95. DOI: 10.1146 / annurev-biochem-061516-045104
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Фог, Р., Ionides, J., Ulrich, E., Boucher, W., Vranken, W., Linge, J.P., et al. (2002). Проект CCPN: промежуточный отчет о модели данных для сообщества ЯМР. Nat. Struct. Мол. Биол. 9, 416–418. DOI: 10.1038 / nsb0602-416
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Фридрих Д., Перодо Дж., Ньюкуоп А. Дж. И Ошкинат Х. (2020). MAS-ЯМР обнаружение водородных связей для характеристики вторичной структуры белка. J. Biomol. ЯМР 74, 247–256.DOI: 10.1007 / s10858-020-00307-z
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Gremer, L., Schölzel, D., Schenk, C., Reinartz, E., Labahn, J., Ravelli, R. B. G., et al. (2017). Структура фибрилл амилоида-β (1–42) с помощью криоэлектронной микроскопии. Наука 358, 116–119. DOI: 10.1126 / science.aao2825
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Гримме С., Энтони Дж., Эрлих С. и Криг Х. (2010). Последовательная и точная неэмпирическая параметризация коррекции дисперсии функциональной плотности (DFT-D) для 94 элементов H-Pu. J. Chem. Phys. 132: 154104. DOI: 10.1063 / 1.3382344
CrossRef Полный текст | Google Scholar
Guenneugues, M., Drevet, P., Pinkasfeld, S., Gilquin, B., Ménez, A., and Zinn-Justin, S. (1997). Пикосекундно-часовая динамика токсина «трех пальцев» во временной шкале: корреляция с его токсическими и антигенными свойствами. Биохимия 36, 16097–16108. DOI: 10.1021 / bi971293k
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Герреро-Феррейра, Р., Тейлор, Н.М.И., Артени, А.-А., Кумари, П., Мона, Д., Ринглер, П. и др. (2019). Две новые полиморфные структуры полноразмерных фибрилл альфа-синуклеина человека, решенные с помощью криоэлектронной микроскопии. eLife 8: e48907.
Google Scholar
Герреро-Феррейра Р., Тейлор Н. М. И., Мона Д., Ринглер П., Лауэр М. Э., Риек Р. и др. (2018). Крио-ЭМ структура фибрилл альфа-синуклеина. eLife 7: e36402.
Google Scholar
Хервас, Р., Rau, M.J., Park, Y., Zhang, W., Murzin, A.G., Fitzpatrick, J.A.J. и др. (2020). Крио-ЭМ структура нейронального функционального амилоида, участвующего в сохранении памяти у Drosophila . Наука 367, 1230–1234. DOI: 10.1126 / science.aba3526
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Хигман В. А., Бойд Дж., Смит Л. Дж. И Редфилд К. (2004). Конформация боковой цепи аспарагина и глутамина в растворе и кристалле: сравнение лизоцима куриного яйца и белка с использованием остаточных диполярных соединений. J. Biomol. ЯМР 30, 327–346. DOI: 10.1007 / s10858-004-3218-y
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Хооп, К. Л., Лин, Х. К., Кар, К., Мадьярфалви, Г., Ламли, Дж. М., Боатц, Дж. К. и др. (2016). Фибриллы экзона 1 Хантингтина содержат встречно-гребенчатое полиглутаминовое ядро на основе бета-шпильки. Proc. Natl. Акад. Sci. США 113, 1546–1551. DOI: 10.1073 / pnas.1521933113
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Кляйн, С.А., Маджумдар А., Баррик Д. (2019). Вторая основа: вклад скрытой аспарагиновой лестницы в глобальную и локальную стабильность богатого лейцином повторяющегося белка. Биохимия 58, 3480–3493. DOI: 10.1021 / acs.biochem.9b00355
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Коллмер М., Клоуз В., Функ Л., Расмуссен Дж., Бсоул А., Ширхорн А. и др. (2019). Крио-ЭМ структура и полиморфизм амилоидных фибрилл Aβ, очищенных из ткани мозга, вызванной болезнью Альцгеймера. Nat. Commun. 10: 4760.
Google Scholar
Курт Т. Д., Агилар-Кальво П., Цзян Л., Родригес Дж. А., Олдерсон Н., Айзенберг Д. С. и др. (2017). Аспарагиновые и глутаминовые лестницы способствуют межвидовой конверсии прионов. J. Biol. Chem. 292, 19076–19086. DOI: 10.1074 / jbc.m117.794107
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Лакомек, Н.-А., Пензель, С., Лендс, А., Кадальберт, Р., Эрнст, М., и Мейер, Б.Х. (2017). Микросекундная динамика в убиквитине исследована с помощью твердотельной спектроскопии ЯМР 15N в экспериментах по релаксации R1ρ в условиях быстрой МАС (60–110 кГц). Chem. Евро. J. 23, 9425–9433. DOI: 10.1002 / chem.201701738
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Lejeune, D., Delsaux, N., Charloteaux, B., Thomas, A., and Brasseur, R. (2005). Распознавание белков и нуклеиновых кислот: статистический анализ атомных взаимодействий и влияние структуры ДНК. Proteins Struct.Функц. Биоинформ. 61, 258–271. DOI: 10.1002 / prot.20607
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Левандовски, Дж. Р., Думез, Ж.-Н., Акбей, Ю., Ланге, С., Эмсли, Л., и Ошкинат, Х. (2011). Повышенное разрешение и время жизни когерентности в твердотельной ЯМР-спектроскопии пердейтерированных белков при сверхбыстром вращении под магическим углом. J. Phys. Chem. Lett. 2, 2205–2211. DOI: 10.1021 / jz200844n
CrossRef Полный текст | Google Scholar
Лакгей, Н., Schütz, A.K., Bousset, L., Habenstein, B., Sourigues, Y., Gardiennet, C., et al. (2013). Конформация прионного домена Sup35p изолированно и в полноразмерном белке. Angew. Chem. Int. Эд. 52, 12741–12744. DOI: 10.1002 / anie.201304699
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Ласкомб, Н. М., Ласковски, Р. А., и Торнтон, Дж. М. (2001). Аминокислотно-основные взаимодействия: трехмерный анализ взаимодействий белок-ДНК на атомном уровне. Nucleic Acids Res. 29, 2860–2874. DOI: 10.1093 / nar / 29.13.2860
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Малер, А.А., Донг, С., Кехр, Г., Эркер, Г., Мейер, Б.Х., и Виганд, Т. (2019). Характеристика продуктов h3-расщепления фрустрированных пар Льюиса: преимущество быстрого вращения под магическим углом. ChemPhysChem 20, 672–679. DOI: 10.1002 / cphc.201
6
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Малар, А.A., Smith-Penzel, S., Camenisch, G.M., Wiegand, T., Samoson, A., Bockmann, A., et al. (2019). Количественное определение ширины когерентной линии протонного ЯМР в белках в условиях быстрого MAS: подход второго момента. Phys. Chem. Chem. Phys. 21, 18850–18865. DOI: 10.1039 / c9cp03414e
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Моррис, Г. А., и Фриман, Р. (1979). Усиление сигналов ядерного магнитного резонанса за счет передачи поляризации. J. Am. Chem. Soc. 101, 760–762. DOI: 10.1021 / ja00497a058
CrossRef Полный текст | Google Scholar
Малдер, Ф.А.А., Скрынников, Н.Р., Хон, Б., Далквист, Ф.В., и Кей, Л.Э. (2001). Измерение медленной (мкс-мс) динамики временного масштаба в боковых цепях белка с помощью спектроскопии ЯМР с релаксационной дисперсией 15N: применение к остаткам Asn и Gln в полостном мутанте лизоцима Т4. J. Am. Chem. Soc. 123, 967–975. DOI: 10.1021 / ja003447g
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Палмер, А.Г. и Масси, Ф. (2006). Характеристика динамики биомакромолекул с помощью спектроскопии ЯМР спиновой релаксации с вращающейся рамкой. Chem. Ред. 106, 1700–1719. DOI: 10.1021 / cr0404287
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Penzel, S., Oss, A., Org, M.-L., Samoson, A., Böckmann, A., Ernst, M., et al. (2019). Вращение быстрее: ЯМР белков на частотах MAS до 126 кГц. J. Biomol. ЯМР 73, 19–29. DOI: 10.1007 / s10858-018-0219-9
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Раймонд, А.К., Райдаут, М. С., Стакер, Б., Хьеррилд, К., и Бургин, А. Б. (2004). Анализ каталитических остатков тирозил-ДНК фосфодиэстеразы I. J. Mol. Биол. 338, 895–906. DOI: 10.1016 / j.jmb.2004.03.013
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Савая М. Р., Самбашиван С., Нельсон Р., Иванова М. И., Сиверс С. А., Апостол М. И. и др. (2007). Атомные структуры амилоидных поперечных β-шипов обнаруживают различные стерические застежки-молнии. Природа 447, 453–457.DOI: 10.1038 / nature05695
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Шанда, П., и Эрнст, М. (2016). Изучение динамики методом твердотельной ЯМР-спектроскопии с вращением под магическим углом: принципы и приложения к биомолекулам. Прог. Nucl. Magn. Резон. Spectrosc. 96, 1–46. DOI: 10.1016 / j.pnmrs.2016.02.001
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Шмидт, М., Визе, С., Адак, В., Энглер, Дж., Агарвал, С., Фриц, Г., и другие. (2019). Крио-ЭМ структура амилоидной фибриллы, полученной из транстиретина, от пациента с наследственным амилоидозом ATTR. Nat. Commun. 10: 5008. DOI: 10.1038 / s41467-019-13038-z
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Смит А. А., Равотти Ф., Тестори Э., Кадальберт Р., Эрнст М., Бёкманн А. и др. (2017). Частично дейтерированные образцы фибрилл HET-s (218–289): отнесение и изотопный эффект дейтерия. J. Biomol. ЯМР 67, 109–119.DOI: 10.1007 / s10858-016-0087-0
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Смит, С. А., Леванте, Т. О., Мейер, Б. Х., и Эрнст, Р. Р. (1994). Компьютерное моделирование в магнитном резонансе. Объектно-ориентированный подход к программированию. J. Magn. Резон. Сер. А 106, 75–105. DOI: 10.1006 / jmra.1994.1008
CrossRef Полный текст | Google Scholar
Смит-Пензель, С. (2019). Твердотельный ЯМР при быстром вращении под магическим углом (90–150 кГц) для биологических применений. Цюрих: ETH Zürich.
Google Scholar
Соренсен О. В. и Эрнст Р. Р. (1983). Устранение спектральных искажений в экспериментах по передаче поляризации. Усовершенствования и сравнение методик. J. Magn. Резон. 51, 477–489. DOI: 10.1016 / 0022-2364 (83)
-1
CrossRef Полный текст | Google Scholar
Стивенс П. Дж., Девлин Ф. Дж., Чабаловски К. Ф. и Фриш М. Дж. (1994). Ab initio расчет спектров колебательного поглощения и кругового дихроизма с использованием силовых полей функционала плотности. J. Phys. Chem. 98, 11623–11627. DOI: 10.1021 / j100096a001
CrossRef Полный текст | Google Scholar
Штернберг, У., Виттер, Р., Купров, И., Ламли, Дж. М., Осс, А., Левандовски, Дж. Р. и др. (2018). Зависимость ширины линии 1H от скорости МАС в твердотельном ЯМР — сравнение эксперимента и моделирования. J. Magn. Резон. 291, 32–39. DOI: 10.1016 / j.jmr.2018.04.003
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Стивенс, Т., Fogh, R., Boucher, W., Higman, V., Eisenmenger, F., Bardiaux, B., et al. (2011). Программная среда для анализа данных твердотельного ЯМР MAS. J. Biomol. ЯМР 51, 437–447. DOI: 10.1007 / s10858-011-9569-2
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Stöppler, D., Macpherson, A., Smith-Penzel, S., Basse, N., Lecomte, F., Deboves, H., et al. (2018). Понимание связывания малых молекул с неонатальным рецептором Fc с помощью рентгеновской кристаллографии и ЯМР с вращением под магическим углом 100 кГц. PLoS Biol. 16: e2006192. DOI: 10.1371 / journal.pbio.2006192
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Талавера Д., Робертсон Д. Л. и Ловелл С. С. (2011). Характеристика интерфейсов межбелкового взаимодействия от одного вида. PLoS One 6: e21053. DOI: 10.1371 / journal.pone.0021053
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Thomas, F., Niitsu, A., Oregioni, A., Bartlett, G.J., и Вулфсон, Д. Н. (2017). Конформационная динамика аспарагина на границах раздела спиральная спираль. Биохимия 56, 6544–6554. DOI: 10.1021 / acs.biochem.7b00848
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Валлурупалли П., Бувиньи Г. и Кей Л. Э. (2012). Изучение «невидимых» возбужденных состояний белка при медленном обмене с конформацией основного состояния. J. Am. Chem. Soc. 134, 8148–8161. DOI: 10.1021 / ja3001419
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Ван Мелькебеке, Х., Wasmer, C., Lange, A., Ab, E., Loquet, A., Böckmann, A., et al. (2010). Трехмерная структура амилоидных фибрилл HET-s (218-289) с атомным разрешением по данным твердотельной ЯМР-спектроскопии. J. Am. Chem. Soc. 132, 13765–13775. DOI: 10.1021 / ja104213j
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Вэнс, К. К., Канг, Ю. М., и Миллер, А.-Ф. (1997). Селективное мечение 15N и прямое наблюдение с помощью ЯМР глутамина в активном центре Fe-содержащей супероксиддисмутазы. J. Biomol. ЯМР 9, 201–206. DOI: 10.1023 / A: 1018662421878
CrossRef Полный текст | Google Scholar
Ваза, С. К., Сингх, Х., Грох, К., и Линсер, Р. (2019). Оценка большого комплекса фермент-лекарство методом твердотельной ЯМР-спектроскопии с обнаружением протонов без дейтерирования. Angew. Chem. Int. Эд. Англ. 58, 5758–5762. DOI: 10.1002 / anie.201811714
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Vernet, T., Tessier, D.C., Chatellier, J., Plouffe, C., Lee, T. S., Thomas, D. Y., et al. (1995). Структурные и функциональные роли аспарагина 175 в цистеиновой протеазе папаина. J. Biol. Chem. 270, 16645–16652. DOI: 10.1074 / jbc.270.28.16645
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Вранкен, В. Ф., Баучер, В., Стивенс, Т. Дж., Фог, Р. Х., Пайон, А., Ллинас, М., и др. (2005). Модель данных CCPN для ЯМР-спектроскопии: разработка программного обеспечения. Белки 59, 687–696.DOI: 10.1002 / prot.20449
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Вагнер Г., Парди А. и Вютрих К. (1983). Длина водородной связи и химические сдвиги протонного ЯМР в белках. J. Am. Chem. Soc. 105, 5948–5949. DOI: 10.1021 / ja00356a056
CrossRef Полный текст | Google Scholar
Wälti, M.A., Ravotti, F., Arai, H., Glabe, C.G., Wall, J.S., Böckmann, A., et al. (2016). Структура атомного разрешения релевантной для заболевания амилоидной фибриллы Aβ (1–42). Proc. Natl. Акад. Sci. США 113, E4976 – E4984. DOI: 10.1073 / pnas.1600749113
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Ван В. и Стаббс Г. (2014). Грибковые прионы HET-s как модель структурной сложности и самораспространения в прионах. Proc. Natl. Акад. Sci. США 111, 5201–5206. DOI: 10.1073 / pnas.1322933111
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Wasmer, C., Lange, A., Van Melckebeke, H., Симер, А. Б., Рик, Р., Мейер, Б. Х. (2008). Амилоидные фибриллы приона HET-s (218-289) образуют β-соленоид с треугольным гидрофобным ядром. Наука 319, 1523–1526. DOI: 10.1126 / science.1151839
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Weigend, F., and Ahlrichs, R. (2005). Сбалансированные базисные наборы разделенной валентности, тройной дзета-валентности и качества четверной дзета-валентности для H to Rn: разработка и оценка точности. Phys. Chem. Chem.Phys. 7, 3297–3305. DOI: 10.1039 / b508541a
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Виганд Т. (2020). Ящик для инструментов твердотельного ЯМР для исследования белковых двигателей, работающих на АТФ. Прог. Nucl. Magn. Резон. Spectrosc. 117, 1–32. DOI: 10.1016 / j.pnmrs.2020.02.001
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Wiegand, T., Cadalbert, R., Lacabanne, D., Timmins, J., Terradot, L., Bockmann, A., et al.(2019). Конформационные изменения, связанные с гидролизом и транслокацией АТФ в бактериальной геликазе DnaB. Nat. Commun. 10:31. DOI: 10.1038 / s41467-018-07968-3
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Wiegand, T., Schledorn, M., Malär, A. A., Cadalbert, R., Däpp, A., Terradot, L., et al. (2020). Режимы связывания нуклеотидов в моторном белке, выявленные с помощью твердотельного ЯМР MAS, детектированного 31P и 1H. ChemBioChem 21, 324–330. DOI: 10.1002 / cbic.201
9PubMed Аннотация | CrossRef Полный текст | Google Scholar
Уорт, К. Л., и Бланделл, Т. Л. (2010). Об эволюционном сохранении водородных связей, образованных скрытыми полярными аминокислотами: скрытые балки, распорки и фермы белковой архитектуры. BMC Evol. Биол. 10: 161. DOI: 10.1186 / 1471-2148-10-161
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Wu, H., Saltzberg, D. J., Kratochvil, H. T., Jo, H., Sali, A., and DeGrado, W.Ф. (2019). Боковая цепь глутамина 13C-18O как непертурбативный ИК-зонд гидратации и сборки амилоидных фибрилл. J. Am. Chem. Soc. 141, 7320–7326. DOI: 10.1021 / jacs.9b00577
PubMed Аннотация | CrossRef Полный текст | Google Scholar
Зорин В. Е., Браун С. П., Ходжкинсон П. (2006). Истоки ширины линии в ЯМР с вращением под магическим углом h2. J. Chem. Phys. 125: 144508. DOI: 10.1063 / 1.2357602
CrossRef Полный текст | Google Scholar
Глютамин | Энциклопедия.com
Описание
У здоровых людей глютамин является нейтральной заменимой аминокислотой. Аминокислоты имеют решающее значение для человека, поскольку они образуют белки, которые являются строительными блоками для многих тканей тела, включая мышцы. Глютамин — самая распространенная аминокислота в нашем организме. Он выполняет несколько важных функций в организме, особенно при стрессе из-за определенных заболеваний или состояний. Глютамин может быть добавлен в организм с медицинской точки зрения врачами или с помощью пищевых добавок, которые люди покупают без рецепта.
Общее использование
Исследователи продолжают изучать свойства и эффекты глютамина. Это самая распространенная аминокислота в кровотоке, и организм продолжает ее вырабатывать, если не возникает какого-либо стресса. Рак, ожоги или травмы, чрезмерные нагрузки и некоторые другие стрессовые ситуации для организма могут вызвать снижение уровня глютамина.
Исследования показывают, что, когда уровень глютамина падает и не восстанавливается, нарушаются некоторые функции организма, особенно в пищеварительном тракте.Глютамин также считается важным для общего иммунитета или способности бороться с болезнями и инфекциями . В последние несколько десятилетий возрос интерес к использованию глутамина для помощи онкологическим больным. Продолжаются исследования по использованию глутаминовой терапии для помощи пациентам с сепсисом, ожогами, травмами, воспалительным заболеванием кишечника , синдромом приобретенного иммунодефицита ( AIDS ), трансплантатами костного мозга и другими потенциальными заболеваниями и состояниями.
В некоторых клинических исследованиях сообщалось, что глютамин помогал пациентам с множественными травмами и ожогами, помогая им бороться с инфекциями.Он может помочь пациентам со СПИДом набрать вес с гораздо меньшими затратами и с меньшим количеством осложнений, чем гормон роста человека. Спортсмены, которые перетренировались, имеют более высокий уровень инфекционных заболеваний и аллергии ; Считается, что диета с высоким содержанием глутамина может помочь улучшить иммунные функции этих спортсменов.
Поскольку все больше людей начали искать способы улучшить физическую форму, они обратились к протеиновым добавкам.
В 2003 году сообщалось, что более 1,2 миллиона спортсменов использовали какие-либо добавки для повышения производительности.Глютамин используется в фитнес-индустрии в качестве добавки для бодибилдеров, которые хотят уменьшить разрушение мышц, или для спортсменов-любителей, занимающихся интенсивными тренировками, которые чувствуют, что добавка подпитывает их иммунную систему.
Препараты
В качестве белка глутамин естественным образом содержится в некоторых продуктах питания, включая мясо, рыбу, бобовые, арахис, яйца, тофу и молочные продукты. Он также высококонцентрирован в сырой капусте и свекле. Приготовление пищи может разрушить глутамин, особенно в овощах.Большая часть потребностей человека в глютамине, даже при интенсивных тренировках, может поступать из пищевых источников. Порция мяса на 3 унции содержит примерно 3-4 грамма глютамина.
Добавки глутамина бывают нескольких видов. Некоторые производители продают таблетки, которые также содержат антиоксидантов и (витаминов). Наиболее распространенными формами добавок глютамина являются протеиновые порошки, которые можно добавлять в жидкости и готовые протеиновые напитки и коктейли. Другая аминокислота, называемая аланином, может сочетаться с глутамином.Комбинированная белковая добавка называется аланил-глутамин. Порошковая форма, вероятно, является наиболее удобной и наименее дорогой формой добавки. Когда глутамин используется в медицинских целях в условиях больницы, его можно вводить энтерально или через трубку непосредственно в кишечник.
В 2002 году порошок стоил около 10 центов за грамм, а капсулы стоили от 12 до 23 центов за грамм. Капсулы содержат меньше граммов глютамина, чем порошок, а глютамин в капсулах не всасывается так быстро, как в порошке.Сообщается, что порошок имеет мягкий вкус и незаметен при добавлении в любимые напитки.
Рекомендуемые дозы глутамина для фитнеса, например для бодибилдинга, различаются, но обычно составляют 8–20 граммов (г) в день и в среднем около 15 г в день. Больные раком, получающие глутамин, могут принимать более высокую дозу, около 30 г в день. Средняя суточная терапевтическая доза для населения составляет 1,5–6 г.
Меры предосторожности
Порошкообразная форма глутамина должна быть растворена в жидкости и быстро потреблена, прежде чем она распадется.В некоторых литературных источниках рекомендуется принимать глутамин непосредственно до или после еды или одновременно с потреблением белка, обычно два раза в день.
Глютамин продается как пищевая добавка, поэтому его продукты не регулируются так же, как отпускаемые по рецепту лекарства. Следует предостеречь тех, кто принимает глутамин, внимательно читать этикетки; некоторые добавки не такие, какими кажутся. В 2004 году Управление по санитарному надзору за качеством пищевых продуктов и медикаментов США (FDA) разработало новый процесс, направленный на повышение безопасности 29 000 пищевых добавок, представленных на американском рынке.Тем не менее, потребители все же должны быть осторожны в отношении содержания и заявлений о пищевых добавках. Также важно следовать указаниям по дозировке и / или проконсультироваться с врачом или другим сертифицированным практикующим врачом или специалистом по комплементарной медицине, чтобы убедиться, что принимается правильная доза. Наконец, хотя многие пропагандисты фитнеса рекламируют эффекты глютамина, некоторые исследователи не согласны с научными данными, лежащими в основе этих утверждений. Со временем все больше и больше клинических исследований смогут прояснить споры о способности глютамина увеличивать размер и силу мышц у спортсменов-любителей.
Побочные эффекты
По состоянию на май 2004 г. не сообщалось о каких-либо заметных отрицательных побочных эффектах глутамина в рекомендованных дозировках и препаратах. Однако долгосрочные исследования продолжаются.
Взаимодействия
По состоянию на май 2004 года не было показано, что глютамин взаимодействует с какими-либо конкретными лекарствами или другими добавками. Однако исследования добавок глютамина ограничены и продолжаются. Потребление капусты может усугубить зоб и состояние под названием гипотиреоз .Поскольку глютамин не является регулируемым веществом, лучше проконсультироваться с врачом при добавлении добавки к рациону и сообщить о регулярном приеме глютамина медицинскому работнику, когда он или она лечит пациента от нового заболевания или состояния, или добавляет или изменение медикаментозной терапии.
Ресурсы
ПЕРИОДИЧЕСКИЕ ДАННЫЕ
«Продвинутое питание: полезные материалы от Team FLEX». Flex (февраль 2003 г.): 183–191.
Кренкель, Джессика А. «Добавление глутамина при трансплантации костного мозга (BMT).» Topics in Clinical Nutrition (сентябрь 2002): 83–91.
Ник, Джина Л.» Влияние продуктов, богатых глутамином, на иммунную функцию (лечебные свойства цельных продуктов «. Письмо Таунсенда для врачей и медсестер ( Апрель 2002 г.): 148–157.
«Протеиновые добавки малопригодны, говорится в испытании». Nutraceuticals International (май 2001 г.).
Роули, Брайан. «Факты о глютамине (горячая линия: питание и добавки)» Muscle & Fitness (январь 2002 г.): 38–42.
Роули, Брайан. «Аминокислоты, необходимые для роста мышц. (Стопка месяца)». Muscle & Fitness (август 2003 г.): 184–185.
Йегер, Селена. «Возьми порошок. (Фитнес цыпленок)». Велосипед (август 2003 г.): 77–78.
ОРГАНИЗАЦИИ
Центр науки в интересах общества. 1875 Connecticut Avenue NW, Suite 300, Вашингтон, округ Колумбия, 20009. 202-332-9110.
ДРУГОЕ
Берд, Патрик Дж. Глютаминовые добавки и упражнения Университет Флориды. [цитировано 6 июня 2004 г.].
«Глютамин». QFAC Bodybuilding [цитируется 6 июня 2004 г.].
«Отчет предлагает научно обоснованный процесс и руководящие принципы для оценки безопасности пищевых добавок». Пресс-релиз национальных академий.
Тереза Г. Одле
Характеристика и улучшенные свойства глутамин синтетазы из Providencia vermicola с помощью сайт-направленного мутагенеза
% PDF-1.4 % 1 0 объект > эндобдж 2 0 obj > поток application / pdfdoi: 10.1038 / s41598-018-34022-5
Глутамин синтетаза — Chemistry LibreTexts
Глутамин синтетаза (GS) — это фермент, который отвечает за катализатор реакции синтеза глутамина из глутамата и аммиака, показанной на рисунке 1 ниже. 1 Кроме того, GS катализирует обратную реакцию глутамата на глутамин, «реакцию переноса 7-глутамила», которая переносит 7-глутамил с глутамина на гидроксиламин с образованием 7-глутамилгидроксамата и многое другое. 16 Эта статья будет посвящена синтезу глутамата в глутамин.
В конечном итоге GS регулирует уровни азота в таких молекулах, как ДНК и аминокислоты; он берет азот из глутамина, образующегося в реакции синтеза, и доставляет его к молекулам с дефицитом азота.GS также может замедлять перенос азота в молекулы, богатые азотом, а также регулировать выработку определенных аминокислот и нуклеотидов, таких как аденозинмонофосфат (АМФ), гистидин и аланин, за счет снижения синтеза этих молекул, когда они находятся в избыток. 2 GS присутствует как в растениях, так и в животных. В растениях GS детоксифицирует аммиак, а у животных он перерабатывает молекулы аминокислотных нейромедиаторов и детоксифицирует аммиак. 3
GS человека присутствует как в головном мозге, так и в печени.В человеческом мозге GS чаще всего обнаруживается в астроцитах, звездчатых глиальных клетках нервной системы. Астроциты отвечают за защиту нейронов от эксайтотоксичности (повреждения или гибели нервных клеток при стимуляции нейротрансмиттерами). Эта защита достигается за счет превращения избытка аммиака, который является токсичным, и глутамата, который является нейротоксичным, в глутамин, катализируемый GS. 4 И в головном мозге, и в печени роль GS человека аналогична бактериальному GS в том, что GS человека устраняет токсичный аммиак.Нарушение функции этого фермента в печени может привести к циррозу печени, хроническому гепатиту B и C, некоторым типам гиперплазии и некоторым новообразованиям. Что касается человеческого GS в головном мозге, он отслеживает токсичность глутамата, превращая глутамат в глутамин, который менее нейротоксичен (рис. 1). 15 Нарушение функции GS в головном мозге может привести к неврологическим заболеваниям, таким как болезнь Альцгеймера, эпилепсия, мультиформная глиобластома, тревога и депрессия. 11
Рисунок 1. Реакция глутамата на глутамин. Реакция глутамата с аммиаком (NH 3 ) и аденозинтрифосфатом (АТФ) с образованием глутамина, аденозиндифосфата (АДФ), фосфата (P i ) и ионов водорода ( H + ).
Хотя на рис. 1 показана общая реакция глутамата с образованием глутамина, предполагается, что эта реакция протекает в две стадии с тетраэдрическим промежуточным соединением.Предлагаемый двухступенчатый механизм показан на рисунке 2 ниже.
Рисунок 2, Двухступенчатый механизм. Предложен двухступенчатый механизм синтеза глутамата и аммиака с получением глутамина.
Общая структура бактериального GS представляет собой додекамер, образованный двумя расположенными лицом к лицу гексамерными кольцами субъединиц. Имеется двенадцать активных центров, по одному в каждом мономере. 5 На рисунке 3 ниже показана структура бактериальной глутамин синтетазы.
Рисунок 3, Бактериальный GS. Строение бактериальной глутамин синтетазы. Функциональная биологическая единица — гомододекомер (12 идентичных субъединиц). Выделенная зеленым область представляет собой одну из двенадцати субъединиц. (а) Вид сверху демонстрирует гексамерное кольцо и одну сторону додекамера. (b) Вид сбоку показывает два гексамерных кольца лицом к лицу. Этот рисунок был создан из PDB 1fpy с использованием программного обеспечения UCSF Chimera.
Каждый активный сайт можно описать как бифуннель, в которой АТФ связывается вверху, а глутамат — внизу.В центре каждого активного центра лежат два катиона металла. Фермент функционирует либо с Mg 2+ , либо с Mn 2+ в активном центре, однако Mn 2+ является более распространенным, несмотря на то, что он немного замедляет активность фермента GS. 5 GS катализ происходит быстрее с Mg 2+ , однако GS выбирает Mn 2+ , потому что он связывается с ферментом с более высоким сродством. 7 На рисунке 4 ниже показана структура одного активного сайта GS.В активных сайтах GS связано несколько лигандов. Ион металла Mn 2+ розового цвета, показанный ниже, связывается с двумя боковыми цепями глутамата аминокислот, боковой цепью гистидина и двумя молекулами воды. Синий ион металла Mn 2+ , показанный ниже, связывается с тремя боковыми цепями глутамата аминокислоты и двумя молекулами воды. На рисунке 4 также показано, что розовый Mn 2+ связывается с молекулой аденозиндифосфата (ADP), которая является обычным субстратом для GS, и что синий ион металла связывается с молекулой фосфинотрицина (PPT), которая является ингибитором GS, который связывается с ферментом в положении, аналогичном аминокислотному субстрату (глутамат или глутамин). 14 Это демонстрирует, что, хотя PPT и ADP не всегда связаны в активном центре, ионы металлов в GS способны связываться с шестью лигандами каждый. В конечном счете, GS является геометрически гибким, что позволяет субстратам как связываться, так и высвобождаться в / из активных сайтов; каталитическая функция зависит от его структуры. Этот активный центр не смог бы функционировать, если бы ион металла был координированно насыщенным, что означает, что все координационные центры заняты. Система должна иметь одну заменяемую координационную позицию, чтобы субстрат-лиганд мог взаимодействовать с металлом, реагировать, а затем позволять выпускать продукт или заменять его на новый субстрат.Известно, что GS имеет три различных сайта связывания субстрата: один для нуклеотида, один для иона аммония и один для аминокислот. 5 Он связывает свои субстраты рядом с двумя центрами ионов металла, однако порядок связывания остается неясным. 16 Связывание с аминокислотным субстратом очень специфично в бактериальных и эукариотических GS, тогда как сайт связывания нуклеотидов намного больше варьируется в зависимости от того, что он может связывать. Это привело к определению того, что сайты связывания нуклеотидов могут быть использованы для создания целевого лекарственного средства. 15
Рисунок 4, Бактериальный GS. На вставке в увеличенном масштабе показан единичный активный центр бактериального GS, в котором ионы марганца являются центрами ионов металлов. Розовый ион марганца представляет собой ион металла с низким сродством, который способствует стабилизации активного центра GS и связыванию хелата Mn-ATP. 1,5 На рисунке выше розовый ион Mn 2+ связан с двумя боковыми цепями глутамата аминокислоты, одной боковой цепью гистидина, дифосфатом аденозина ( ADP ) молекула, которая является обычным субстратом, вводимым в систему.Кроме того, молекула связана с двумя молекулами воды, не изображенными. Это приводит к октаэдрической форме иона металла розового Mn 2+ (шесть лигандов). Второй ион металлического марганца, окрашенный в синий цвет, считается каталитическим кофактором, обеспечивающим структуру и стабилизацию промежуточных продуктов в активном центре. 1 Этот ион Mn 2+ связан с тремя боковыми цепями глутамата аминокислот и фосфинотрицином ( PPT), который является ингибитором GS, который также был введен в систему. 14 Опять же, синий Mn 2+ также связан с двумя молекулами воды, не изображенными на рисунке, что также придает ему октаэдрическую геометрию. Этот рисунок был создан из PDB 1fpy с использованием программного обеспечения UCSF Chimera.
Хотя в этой статье основное внимание уделяется бактериальным GS и их функциям, интересно также отметить, что у людей обнаруживается еще одна форма GS. Структура GS человека незначительно отличается от бактериального GS.Он состоит из структуры гомодекамеров, организованных в два пентамерных кольца (в отличие от гексамерных колец), в которых активный центр все еще находится между соседними мономерами, образуя бифуннель. Это показано на рисунках 5 и 6 ниже. Он также отличается от бактериального GS тем, что в активном центре находятся три иона металла вместо двух. 15 В то время как сначала считалось, что функциональные и структурные свойства активного центра GS сохраняются у млекопитающих и растений, более поздние исследования показали, что кристаллические структуры GS человека фактически содержат три иона металла в каждом активном центре. 11,15
Рисунок 5, Human GS. (a) Вид сверху структуры человеческой глутаминсинтетазы, демонстрирует пентамерное кольцо и одну сторону гомодекамера (b) Вид сбоку структуры человеческой глутаминсинтетазы, показывает два пентамерных кольца лицом к лицу. Выделенная зеленым область представляет собой одну из десяти субъединиц. Этот рисунок был создан из PDB 2qc8 с использованием программного обеспечения UCSF Chimera.
Рисунок 6, Human GS. Увеличенное изображение одного активного центра человеческого GS, в котором три иона марганца являются металлическими центрами, показано фиолетовым цветом. Этот рисунок был создан из PDB 2qc8 с использованием программного обеспечения UCSF Chimera.
Как указано, в активных центрах бактериального GS есть два иона металла: один связывается с высоким сродством, а другой — с низким. 2 Сайт связывания металла с высоким сродством действует как каталитический кофактор, обозначенный ниже синим цветом, что означает, что для активности фермента необходим небелковый ион металла.Ион металла (Mn 2+ ) стабилизирует как электростатические взаимодействия, так и кислотный катализ Льюиса, обеспечивая структуру активного центра и стабилизацию промежуточных продуктов для реакции (рис. 7). 1 Ион металла с низким сродством способствует стабилизации активного центра GS и связыванию хелата Mn-ATP. 1,5 Общая реакция синтеза глутамина из глутамата через катализатор GS показана выше (Рисунок 1). 5 Эта реакция важна для поглощения азота органическими соединениями, поскольку глутамин служит строительным блоком для биосинтеза различных метаболитов. 8 Механизм превращения глутамата в глутамин показан ниже на Рисунке 7.
Рисунок 7. Механизм преобразования глутамата в глутамин. Предлагаемый механизм катализируемой реакции глутамата на глутамин. Каталитический кофактор представлен синим, а стабилизирующий ион — розовым. 1
Учитывая роль этих двух ионов металлов, важно знать о них больше, чтобы лучше понять, как функционирует GS.Оба иона металла имеют степень окисления +2. Чаще всего ионом металла является Mn 2+ , потому что GS имеет гораздо более высокое сродство связывания с Mn 2+ (300 — 1000x), чем с магнием (Mg 2+ ), который имеет второе по величине сродство. . 5 Из-за своего заряда +2 ион марганца (атомный номер 25) имеет пять d-электронов.
Селективное связывание Mn 2+ с GS можно объяснить несколькими теориями. В то время как ионы других металлов, включая Cd 2+ , Mg 2+ , Ca 2+ , Co 2+ и Zn 2+ , были протестированы на их сродство к GS, Mn 2+ оказался самым эффективным ионом металла, уступающим Mg 2+ .Что касается теории твердой-мягкой-кислотной основы (HSAB), имеет смысл, что GS связывается с ионами Mn 2+ . HSAB классифицирует металлы (кислоты) и лиганды (основания) по их плотности заряда, поляризуемости и характеру электростатического или ковалентного связывания. Чем сложнее что-то, тем менее поляризуемо. Обычно более твердые атомы связаны с электростатическими взаимодействиями, которые включают щелочные и щелочноземельные металлы, тогда как более мягкие атомы больше связаны с поляризуемостью и ковалентной связью с лигандами.Существует общее правило: твердые кислоты предпочитают связываться с твердыми основаниями, а мягкие кислоты предпочитают связываться с мягкими основаниями. Mn 2+ , Mg 2+ , Ca 2+ относятся к твердым кислотам. Однако Cd 2+ — это мягкая кислота, а Co 2+ и Zn 2+ — пограничные кислоты. Предполагается, что ионы металлов связываются с водой, с кислородом карбоксилата на глутамате и с азотом имидазола на гистидине. Донорные группы кислорода классифицируются как твердые основания, в то время как имидазол N является пограничным.Таким образом, этот сайт связывания имеет смешанный жесткий / пограничный характер, при этом большинство донорных групп вносят лиганды жесткого кислорода. Учитывая характер сайта связывания, мы можем применить теорию HSAB, чтобы предсказать, что ионы твердых металлов Mn 2+ , Mg 2+ , Ca 2+ и Co 2+ будут предпочтительнее в этом активном центре катиона GS. над мягкими и пограничными металлами, такими как Cd 2+ и Zn 2+ .
GS требует, чтобы ион металла был геометрически гибким, чтобы субстраты могли как связываться, так и оторваться от активного центра.Ион металла должен иметь от трех до пяти координатных геометрий. Co 2+ — это ион металла d 7 , что означает, что он имеет семь электронов в своей оболочке. Учитывая правило 18 электронов, потребуется пять или шесть лигандов для координационного насыщения примерно восемнадцатью электронами (на самом деле семнадцать или девятнадцать из-за нечетного числа d-электронов). Кроме того, LFSE заставляет Co 2+ иметь предпочтение шестикоординатной октаэдрической геометрии. Стабилизация поля лигандов (LFSE) определяется как полная энергия электронов относительно средней энергии орбиталей.Для октаэдрических комплексов LFSE зависит от числа электронов на более низких энергетических орбиталях (t 2g ) и электронов на более высоких энергетических орбиталях (e g ) относительно барицентра (центра масс двух или более тел, которые вращаются друг вокруг друга). LFSE октаэдрического комплекса можно рассчитать с помощью следующего уравнения:
(1)
Где x — количество электронов на орбиталях t 2g , а y — количество электронов на орбиталях e g .
Напротив, Ca 2+ имеет нулевые d-электроны (d 0 ), Mg 2+ имеет нулевые d-электроны (d 0 ), а Mn 2+ имеет пять d- электронов (d 5 ). Эти ионы металлов более геометрически гибки, потому что все они имеют нулевой LFSE, рассчитанный с использованием уравнения 1. Без стабилизации LFSE эти ионы не имеют предпочтения для определенной геометрии. Таким образом, они будут довольны привязкой к трех-пяти координатным геометриям, которые доступны в активном сайте GS.Поскольку Co 2+ предпочел бы октаэдрическую геометрию, а не геометрию с тремя-пятью координатами, он не является идеальным ионом металла для GS. Это оставляет три возможных иона металла: Ca 2+ , Mg 2+ и Mg 2+ . Другой фактор, который может повлиять на то, какой ион металла предпочитает GS, — это размер атома ионов. Ca 2+ имеет ионный радиус 100 мкм, тогда как Mg 2+ имеет ионный радиус 72 мкм, а Mn 2+ имеет ионный радиус 70 мкм. 13 Это объясняет, почему Ca 2+ не является предпочтительным ионом металла; он имеет гораздо больший ионный радиус, чем у Mg 2+ и Mn 2+ . Более мелкие ионы металлов предпочтительнее более крупных Ca 2+ . В результате остаются два оставшихся иона металла: Mg 2+ и Mn 2+ . Чтобы объяснить, почему Mn 2+ является предпочтительным ионом металла для GS в отличие от Mg 2+ , мы рассматриваем эффективный заряд ядра (Z eff ) в каждом случае.Как правило, Z eff увеличивается по строкам периодической таблицы и вниз по столбцам. Таким образом, Mn 2+ имеет большее значение Z eff , чем Mg 2+ , а это означает, что Mn 2+ с более высоким эффективным зарядом больше притягивается к электронной плотности лигандов, чем Mg 2+. . Это связано с известной серией Ирвинга-Вильямса. В конечном итоге имеет смысл, что Mn 2+ является предпочтительным ионом металла, связанным с активным центром глутамин синтетазы.
Хотя геометрия иона металлического марганца в GS является гибкой, когда он находится в своей октаэдрической координации, система, скорее всего, будет иметь высокий спин. Состояние с высоким спином заполняет каждую незанятую орбиталь одним электроном до того, как какие-либо орбитали заполняются двумя электронами; самое низкое энергопотребление имеет приоритет. Хотя это не совсем ясно, для целей данного обсуждения мы предполагаем, что Mn 2+ имеет октаэдрическую геометрию. Диаграмма расщепления поля для Mn 2+ в октаэдрической конфигурации может быть построена двумя способами: один для большого спина, а другой — для низкого.Оба они изображены на Рисунке 8 ниже. Так как Mn 2+ является металлом 3d 5 с зарядом +2 и имеет воду в качестве лиганда, он должен быть высокоспиновым. Кроме того, глутаматные аминокислоты являются пи-донорами, которые способствуют малой дельте (разрыв в энергии между t 2g и e g в октаэдрическом комплексе) и высоким спином. Гистидин может быть слабым акцептором пи, который обычно способствует низкому спину, однако это не увеличивает дельта настолько, чтобы способствовать низкому спину.Важно отметить, что молекула фосфинотрицина (PPT) связана с ионом марганца с низким сродством, представленным на рисунке 3 выше. Это ингибитор, который был экспериментально введен в систему, поэтому он не всегда присутствует в системе. Когда PPT связан с ионом металла с низким сродством (розовый n 1 Mn 2+ ), тогда этот ион Mn 2+ будет иметь октаэдрическую геометрию. Когда PPT не связан с ионом металла, существует открытый координационный сайт, с которым могут связываться молекулы воды или субстрата.
Рисунок 8: Диаграмма LFSE-расщепления для Mn 2+ . a) представляет диаграмму высокоспинового расщепления для октаэдрического комплекса, b) представляет диаграмму низкоспинового расщепления для октаэдрического комплекса.
Что касается кинетики, лабильность (или реакционная способность) означает скорость, с которой лиганды заменяются в координационных комплексах; как быстро разрываются связи металл-лиганд.Существует множество факторов, которые влияют на то, является ли соединение лабильным или инертным, включая конфигурацию d-электронов, заряд, LFSE, тип лиганда, радиус иона металла и заполнение антисвязывающей орбитали. Чем больше LFSE, тем менее лабильнее ион (тем меньше он захочет реагировать). Это имеет смысл, потому что чем выше энергия стабилизации поля лиганда, тем менее лабильный металл (потому что он более стабилен), следовательно, молекула более инертна. Поскольку Mn 2+ имеет LFSE, равный нулю, а орбитали e g (разрыхляющие орбитали) заняты электронами (высокоспиновая конфигурация), он считается кинетически лабильным ионом металла, который, опять же, является выгодным для связывание и высвобождение лиганда / субстрата в GS.В целом металлы с нулевым LFSE считаются наиболее лабильными.
Глутамин синтетаза — мультидентатный хелатор (лиганд, который связывается с металлом, имеющим более одного атома). Хелатный эффект считается энтропийным, что означает, что он увеличивает энтропию (беспорядок) координационной реакции и, таким образом, увеличивает свободную энергию Гиббса. Хелатный эффект возникает при связывании иона металла с мультидентатным лигандом; чем больше атомов лиганд использует для связывания с металлом, тем стабильнее получается комплекс.GS является мультидентатной системой, поскольку она обеспечивает более двух донорных групп для ионов металла Mn 2+ для связывания внутри активного центра. Более конкретно, это тридентатный хелатор, обеспечивающий три аминокислотных лиганда боковой цепи для каждого из ионов металла. Эти донорные группы находятся на боковых белковых цепях молекул глутамата, гистидина и воды. Это помогло бы объяснить, почему GS имеет высокое сродство к иону металла, который может иметь несколько координационных центров.
Это подводит нас к каталитической реакции.Как указывалось ранее, геометрия каждого иона металла считается псевдооктаэдрической. Каждый ион Mn 2+ связан с тремя боковыми цепями аминокислот и двумя молекулами воды, в которых одна из молекул воды используется совместно двумя ионами металлов. Известно, что белковые лиганды Mn 2+ (каталитический кофактор) представляют собой три глутаматные аминокислоты. Что касается второго иона марганца, с более низким сродством связывания, он также имеет три лиганда боковой цепи аминокислот, две аминокислоты глутамата и аминокислоту гистидин. 9 Пятикоординатная псевдооктаэдрическая геометрия оставляет ион металла с одним открытым координационным центром, который может приспособиться к связыванию лиганда. Предлагаемая геометрия и механизм координации изображены на Рисунке 9 ниже.
Рисунок 9, Каталитический механизм. Во-первых, АТФ и глутамат связываются с GS по порядку, поскольку связывание АТФ с GS усиливает связывание глутамата (а). Во-вторых, два связанных с ферментом иона металла, особенно ион n 2 , окрашенный в синий цвет, поляризуют 7-фосфат АТФ, который делает атом 7-фосфора более положительным, способствуя тому, что глутамат атакует и производит 7- глутамилфосфат.Два положительно заряженных иона металла и Arg-339 участвуют в переносе фосфорила (b). В-третьих, перемещение аминокислоты аспарагиновой кислоты соседней субъединицы индуцируется присутствием АДФ, образуя сайт связывания иона аммония. Боковая цепь аспарагиновой кислоты затем размещается так, чтобы принимать протон от связанного иона аммония, образуя аммиак. Затем он может атаковать 7-глутамилфосфат с образованием тетраэдрического промежуточного соединения. Этот тетраэдрический промежуточный продукт может стабилизировать остатки, образуя солевую связь с отрицательно заряженной боковой цепью Glu-327 из положительно заряженной 7-аминогруппы тетраэдрического промежуточного соединения.Это блокирует выход глутамата (c). Наконец, фосфатная группа переходного тетраэдрического промежуточного соединения уходит, и Glu-327 принимает протон, скорее всего, от 7-аминогруппы промежуточного соединения, с образованием глутамина. Амидный азот глутамина водородно связывается с ионом n 1 , окрашенным в розовый цвет, и P i (г). Отсутствие взаимодействия продукта глутамина с Glu-327 высвобождает гибкий сегмент, позволяя глутамину диффундировать из активного центра и позволяя глутамату войти в следующий каталитический цикл. 16
Когда комплекс поглощает свет с энергией, соответствующей дельта, электрон перемещается с одной d-орбитали на другую, что называется d-d переходом. Mn 2+ имеет частично заполненную d-орбиталь, d 5 . Следовательно, могут происходить dd-переходы или возбуждение электронов в пределах «d» -орбиталей (например, от t 2g до e g ), что может привести к возможным электронным поглощениям, которые можно наблюдать с помощью УФ-видимой спектроскопии. .Поскольку Mn 2+ является высокоспиновым ионом металла, он имеет небольшую дельту, что означает, что легче перемещать электроны от t 2g к e g . Маленькая дельта указывает на низкое энергопоглощение света. В этом металлическом комплексе также могут быть электронные переходы с переносом заряда, потому что, хотя нет лигандов-акцепторов пи, есть лиганды-доноры пи. Это означает, что перенос заряда может происходить от лиганда к металлу (LMCT). Исследования показали, что максимальное значение поглощения Mn 2+ достигается при длине волны обнаружения 553 нм. 17 Если Mn 2+ поглощает на длине волны 553 нм, это означает, что он выглядит красновато-пурпурным (пурпурным).
В настоящее время ведется много активных исследований по поиску ингибиторов GS. Ингибитор GS растений (глюфосинат) — один из наиболее широко используемых гербицидов на планете. Кроме того, было показано, что бактериальные GS могут применяться при разработке лекарств против туберкулеза, а также в терапии рака. 11,12 Еще многое предстоит узнать о GS, включая информацию о его структуре и геометрии, свойствах связывания ионов металлов, а также о его каталитических и ингибирующих механизмах. 11
Источники
- Бертини, Грей, Штифель и Валентайн. (2007). Биологические неорганические
- Химия . Книги университетских наук.
- Гудселл, Д.С. Глютамин-синтетаза. Банк данных белков RCSB 2002 .
- Лиав, С., Куо, И., и Айзенберг, Д. (1995). Обнаружение участка аммиачного субстрата на
- глутамин синтетаза, третий сайт связывания катионов. Protein Science, 4 , 2358-2365. Получено 4 марта 2018 г. с сайта https://www.ncbi.nlm.nih.gov/pmc/articles/PMC2143006/pdf/8563633.pdf.
- Суарес И., Бодега Г. и Фернандес Б. (2002). Глутаминсинтетаза в головном мозге: действие аммиака. Neurochemistry International, 41 (2-3), 123-142. DOI: 10.1016 / S0197-0186 (02) 00033-5
- Eisenberg, D .; Gill, H.S .; Pfluegl, G.M.U .; Ротштейн, С. Х. Структурно-функциональные отношения глутаминсинтетаз. Biochimica et Biophysica Acta (BBA) — Структура белка и молекулярная энзимология 2000 , 1477 (1), 122–145.
- Hunt, J. B .; Смирниотис, П. З .; Гинзбург, А .; Штадтман, Э. Р. Потребность в ионах металлов глутамин синтетазой Escherichia Coli в катализе переноса γ-глутамила. Архив биохимии и биофизики 1975 , 166 (1), 102–124.
- Гудселл, Д. (2002, июнь). Глютамин синтетаза. Получено 5 марта 2018 г. с сайта http://pdb101.rcsb.org/motm/30 .
- Schaller, C.P. (8 сентября 2017 г.). Хелатный эффект. Получено 6 марта 2018 г. с сайта https: // chem.libretexts.org/LibreTex…Chelate_Effect
- Ямасита, М. М., Алмасси, Р. Дж., Янсон, К. А., Кашио, Д., и Эйзенберг, Д. (1989). Уточненная атомная модель глутамин синтетазы при разрешении 3,5 A *. Журнал биологической химии, 264 (25 октября), 17681-17690. Проверено 14 февраля .
- 2018, с http: //www.jbc.org.proxy.library.nd….17681.full.pdf
- Hunt, J. B .; Смирниотис, П. З .; Гинзбург, А .; Штадтман, Э. Р. Потребность в ионах металлов глутамин синтетазой Escherichia Coli в катализе переноса γ-глутамила. Архив биохимии и биофизики 1975 , 166 (1), 102–124.
- Морейра К., Рамос М. Дж. И Фернандес П. А. (2017). Разъяснение каталитического механизма человеческой глутамин синтетазы: исследование QM / MM. Журнал физической химии B, 121 (26), 6313-6320. DOI: 10.1021 / acs.jpcb.7b02543
- Berlicki, Ł. Ингибиторы глутаминсинтетазы и возможности их применения в медицине. Mini Rev Med Chem 2008 , 8 (9), 869–878.
- Проводной химик. (нет данных). Получено 17 апреля 2018 г. с сайта http://www.wiredchemist.com/chemistr…metallic-radii .
- Gill, H. S .; Айзенберг, Д. Кристаллическая структура фосфинотрицина в активном центре глутаминсинтетазы освещает механизм ферментативного ингибирования † . Биохимия 2001 , 40 (7), 1903–1912.
- Krajewski, W. W .; Collins, R .; Holmberg-Schiavone, L .; Jones, T. A .; Карлберг, Т.; Моубрей, С.Л. Кристаллические структуры глутаминсинтетаз млекопитающих иллюстрируют конформационные изменения, вызванные субстратом, и открывают возможности для создания лекарств и гербицидов. Журнал молекулярной биологии 2008 , 375 (1), 217–228.
- Liaw, S. H .; Айзенберг, Д. Структурная модель механизма реакции глутамин синтетазы, основанная на пяти кристаллических структурах комплексов фермент-субстрат. Биохимия 1994 , 33 (3), 675–681.
- Ян, X., Ли, Г., Ян, X., Цзя, З., и Луо, Н. (нет данных). Определение марганца в образцах окружающей среды с помощью УФ-видимого излучения после экстракции точки помутнения. НЕОРГАНИЧЕСКАЯ ХИМИЯ, 52 (3), 1515-1524. DOI: 10.1021 / ic302268h
Автор
Первоначально эта работа была написана Кирстин Фаваццо , весна 2018 г .: Кирстин в настоящее время (по состоянию на 2018 г.) является младшим специалистом по химии в колледже Святой Марии в Нотр-Дам, штат Индиана. Изначально эта работа была отредактирована доктором Кэтрин Хаас (доцент), Мэдисон Сендзик (ассистент по преподаванию и исследованию) и доктором Дороти Фейгл (профессор) из колледжа Святой Марии.
Метаболизм глутамина необходим для стволовых мезенхимальных стволовых клеток костного мозга и костного гомеостаза
Скелет превратился в эндокринный орган, который одновременно способен регулировать энергетический обмен и быть его мишенью.Глютамин — самая распространенная и гибкая аминокислота в организме, которая обеспечивает клеткам потребность в аденозин-5-трифосфате (АТФ). Новые данные подтверждают, что глутамин, который действует как второй регулятор метаболизма после глюкозы, играет решающую роль в гомеостазе костей на клеточном уровне, включая выделение клонов и пролиферацию мезенхимальных стволовых клеток кости (BMSC), минерализацию матрикса остеобластов и биосинтез в хондроцитах. . Интегрированный механизм, состоящий из WNT, мишени рапамицина у млекопитающих (mTOR) и сигнального пути активных форм кислорода (ROS) в глутамин-зависимом паттерне, отвечает за регулирование сложного внутреннего биологического процесса, несмотря на то, что более обширные молекулы заслуживают выяснения в метаболизм глутамина в дальнейшем.Действительно, дисфункциональный метаболизм глутамина усиливает развитие дегенеративных заболеваний костей, таких как остеопороз и остеоартрит, а добавление глютамина или предшественников глутамина может частично восстанавливать дефекты костей, что может способствовать лечению заболеваний костей, хотя механизмы не совсем ясны. В этом обзоре мы обобщим и обновим результаты последних исследований и клинических испытаний, посвященных важнейшим регуляторным ролям метаболизма глутамина в BMSC и костных клетках, происходящих из BMSC, а также остеокластов, играющих важную роль в резорбции кости.
1. Введение
Кость — относительно динамичный орган, который обеспечивает жесткость, форму, поддержку и движение структур тела [1]. Он подвергается моделированию и постоянному ремоделированию на протяжении всей жизни, демонстрируя изменения структуры и формы. Моделирование костей происходит от рождения до зрелого возраста и отвечает за набор массы и изменение структуры скелета, примером чего является увеличение длины и диаметра кости. Ремоделирование костей, тесно связанное с резорбцией и формированием костей, заменяет старые ткани новыми костями, тем самым поддерживая минеральный гомеостаз и прочность [2].Остеобласты для образования кости и остеокласты для резорбции кости являются основными клетками, участвующими в ремоделировании кости; Между тем остеоциты, полученные из остеопрогениторов, также имеют решающее значение в этом биологическом процессе [3–6]. В последнее время появляются доказательства того, что кость является эндокринным органом и проявляет активный метаболизм, при этом биоэнергетика клеток играет важную роль в регулировании промежуточного метаболизма [1, 7]. Совместные сигнальные сети способствуют эффективному переходу организмов между анаболическим и катаболическим состояниями; таким образом, костные клетки способны выживать и расти в средах с различной доступностью питательных веществ.
Фактически, биосинтез требует количества экзогенного потребления топлива, которое может быть преобразовано в гидролиз аденозин-5-трифосфата (АТФ) внутри тела, чтобы позже управлять всеми клеточными процессами [8]. Источники топлива, содержащие глюкозу, свободные жирные кислоты и аминокислоты, являются отличными субстратами для генерации АТФ как в цитоплазме, так и в митохондриях посредством окислительного фосфорилирования [9–11]. Их потребление и катаболизм регулируются автоматически, чтобы соответствовать различным потребностям в энергии на различных стадиях, включая пролиферацию, дифференциацию и апоптоз, в которых внутриклеточные сигнальные молекулы служат контрольными точками для выбора, хранения, транспортировки и использования топлива [12].Кроме того, внешние факторы, такие как глюкокортикоиды, в результате также изменяют топливный метаболизм и биологическое поведение костных клеток [13].
Предыдущие исследования подтвердили, что метаболизм глутамина как регуляторный узел участвует во многих биологических процессах, включая образование сосудов, прогрессирование рака и иммунную регуляцию [14–16]. В последнее время концентрация глутамина в гомеостазе костей увеличивается, опосредуя пролиферацию, дифференцировку остеобластов и адипоцитов, иммунологические особенности клеточных BMSC [17].С другой стороны, биоэнергетика остеобластов, остеоцитов и даже адипоцитов также прямо или косвенно регулируется метаболизмом глутамина, который тесно связан с дегенеративными заболеваниями, такими как остеопороз. Механистически было выяснено, что передача сигналов WNT / β -катенин, мишень млекопитающих для передачи сигналов рапамицина (mTOR), индуцируемые гипоксией факторы транскрипции (HIF) и некоторые другие сигнальные пути участвуют в метаболической активности костных клеток [18–20] . В этой статье мы рассмотрели и обновили важнейшие регуляторные роли метаболизма глутамина в BMSC, происходящих из BMSC костных клетках и остеокластах, которые, как ожидается, предоставят новую терапевтическую перспективу для лечения деструктивных заболеваний костей.
2. Метаболизм глутамина
Глютамин, заменимая аминокислота (NEAA), состоящая из углерода (41,09%), водорода (6,90%), кислорода (32,84%) и азота (19,17%), в основном синтезируется ферментом. глутамин синтетаза (GS) с использованием глутамата и аммиака (NH 3 ) в качестве источника. Как самая распространенная и гибкая аминокислота в организме, она составляет около 20% от общего пула свободных аминокислот в крови и от 40% до 60% от общего пула аминокислот в некоторых тканях [21–23].Глутамин гидролизуется глутаминазой (GLS) до аммоний-иона (NH 4 ) и глутамата, последний впоследствии трансформируется в α -кетоглутарат ( α -KG), что происходит в виде трансаминирования или дезаминирования [24]. Затем α -KG вступает в цикл трикарбоновых кислот (цикл TCA) для генерации АТФ посредством производства никотинамидадениндинуклеотида (NADH) и флавинадениндинуклеотида (FADH 2 ) [25]. Вместо того, чтобы быть альтернативным источником топлива в цикле TCA, глутамин также используется в качестве субстрата для конструирования белков и нуклеотидов [26].Азот из глутамина благодаря применению аминотрансфераз поддерживает уровни многочисленных пулов аминокислот в клетке, как показано на примере более 50% NEAA, происходящих из глутамина, которые используются в синтезе белка в раковых клетках in vitro [27]. Показано, что в раковых клетках мутации ферментов цикла TCA, фумаратгидратазы (FH) и сукцинатдегидрогеназы (SDH) или комплексов цепи переноса электрона (ETC), таких как комплекс I и комплекс III, могут способствовать утилизации глутамина. .Другими словами, цикл TCA, FH, SDH и ETC участвуют в его участии в производстве заменимых аминокислот. Например, попадая в клетку через переносчик, глутамин дезаминируется до глутамата цитоплазматическим GLS1, переносится SLC25A11 в митохондриальный матрикс и превращается в α -KG. Затем α -KG следует стадиям цикла TCA до щавелевоуксусной кислоты, которая затем превращается в аспартат с помощью аспартаттрансаминазы (GOT2) и экспортируется в цитоплазму, что имеет решающее значение для биосинтеза пурина и пиримидина.После этого аспарат может быть преобразован в аспарагин и аргинин. Кроме того, глутамат в цитоплазме может превращаться в аргинин и пролин [28–30]. Кроме того, глутамин также способствует синтезу жирных кислот за счет восстановительного карбоксилирования [31].
Метаболизм глутамина был впервые предложен в 1935 году Гансом Кребсом, который сообщил, что кора головного мозга и сетчатка позвоночных, а также почки кроликов и морских свинок могут синтезировать глутамат в глутамин и гидролизовать глутамин до глутамата аммония [32].Со временем многое известно о важности метаболизма глутамина при патологических состояниях. Некоторые опухолевые клетки использовали глутамин для обеспечения никотинамидадениндинуклеотидфосфата (НАДФН) и углерода для биосинтеза липидов и глутатиона, а также азота для биосинтеза нуклеотидов, что было важно для контроля окислительного стресса и поддержки пролиферации [33, 34]. Более того, метаболизм глутамина также имеет решающее значение для трансдифференцировки от печени к поджелудочной железе, воспалительных реакций зрелых адипоцитов и функций иммунологических клеток [35–37].А метаболизм глутамина повлиял на эпигенетические состояния, а также на организацию генома через α -KG, в конечном итоге изменив решения о клеточной дифференцировке [38]. Более 30 лет назад Biltz et al. впервые сообщили об активном потреблении и метаболизме глутамина в изолированных сводах черепа и длинных костей [39]; впоследствии роль глютамина в костях привлекает все большее внимание.
3. Метаболизм глутамина в BMSC
BMSC, известные как негемопоэтические мультипотентные мезенхимные клетки, традиционно способны дифференцироваться в остеобласты, адипоциты и хондроциты, тем самым регулируя гомеостаз кости [40–42].В последнее время постоянно сообщается об энергетическом обмене, включая метаболизм глюкозы, метаболизм глутамина и жирных кислот в МСК в различных контекстах [43–45]. Глюкоза является основным источником энергии и углерода для клеток млекопитающих и известна как основное питательное вещество для остеобластов с начала 1960-х годов [46]. Вместо энергетической добавки аэробный гликолиз в остеобластах может быть связан с секрецией цитрата, который играет решающую роль в образовании нанокристаллов апатита в кости [47, 48].Терапевтические стратегии, направленные на метаболизм глюкозы, обычно применяются к пациентам с диагнозом системных заболеваний, таких как сахарный диабет 2 типа и хроническое заболевание почек [49, 50]. Более того, Thrailkill et al. предположили, что лечение одним инсулином только частично скорректировало как гипергликемию, так и диабетический фенотип костей у двенадцатинедельных мышей с диабетом, что означает, что требуются мишени терапии в другом метаболизме [51]. Жирные кислоты, образующиеся из хранящихся триацилглицеридов или жировых депо и высвобождаемые в кровоток, разлагаются в митохондриях с образованием АТФ в костных клетках, в то время как количество, которое используется для производства АТФ, в настоящее время неизвестно [52].Как и в случае с жирными кислотами, степень участия аминокислот в окислительном фосфорилировании в настоящее время остается неясной; тем не менее, количество исследований глутамина растет. Глутамин как второй критический регулятор после глюкозы оказывает существенное влияние на пролиферацию BMSC, выделение клонов, спецификацию остеобластов и даже иммуномодулирующие свойства.
3.1. Метаболизм глутамина при пролиферации BMSC
Что касается пролиферации клеток, Eagle et al.первоначально описал важность глутамина в пролиферации клеток in vitro, и чрезвычайно важный для пролиферации МСК [53]. В синхронизированных клетках HeLa глутамин, а также глюкоза необходимы для прохождения через точку ограничения в среднем или позднем G1. И глутамин является единственным существенным субстратом для перехода через S-фазу в клеточное деление, на что также указывает сочетание изотопного отслеживания на основе импульсной ЖХ-МС с вычислительной деконволюцией и моделированием метаболического потока в синхронизированных популяциях клеток [54, 55].Механически, глутамин, как сообщается, проходит через точку ограничения в средней и поздней фазе G1, а также через фазу выхода S, которая была эффективна для начала деления клеток [54]. Показано, что глутамин может усиливать экспрессию циклина D1 и D3 и регулировать циклин-зависимую киназу (CDK), которая способна стимулировать переход в S-фазу и подавлять экспрессию p21, ключевого регулятора контрольной точки цикла G1 / S [ 56]. И это явление может быть связано с GLS, поскольку глутамин увеличивал активность GLS и глутаматдегидрогеназы (GDH) через пути mTOR / S6 и MAPK в зависимости от дозы, что в конечном итоге способствовало пролиферации клеток [57].Однако конкретный механизм в настоящее время остается неясным. Кроме того, общепринято считать, что глутамин обеспечивает предшественников для последующих этапов синтеза, таких как репликация ДНК в S-фазе и синтез липидов в G2-фазе. И большая часть углерода TCA и азота некоторых NEAA происходит из деградированного глутамина в эндотелиальных клетках [15, 58]. Глюкоза является основным источником энергии и углерода для клеток млекопитающих и была известна как основное питательное вещество для остеобластов с начала 1960-х годов. Более того, глутамин также обеспечивает небольшое количество энергии, так как ферменты, потребляющие глутамин, находятся в основном в митохондриях и далеки от основной потребности в АТФ.Кроме того, группа Карнера обнаружила, что пролиферация BMSC и рост колоний в значительной степени коррелируют с зависимой от аминокислотной трансаминазы продукцией α -KG, что может частично объяснить негативное влияние снижения активности GLS на пролиферацию BMSC [17]. Однако вклад биосинтеза других аминокислот, происходящих из метаболизма глутамина, в пролиферацию BMSC еще не ясен [33, 59]. Что касается опухолевых клеток в других тканях, глутамин удовлетворяет биосинтетические и биоэнергетические потребности этих клеток посредством анаплеротического входа в цикл TCA и восстановительного карбоксилирования, регулируя таким образом выживаемость и пролиферацию клеток [60, 61].Напротив, скорость пролиферации скелетных клеток-предшественников казалась менее важной связью с глутамин-зависимым восстановительным карбоксилированием или анаплерозом цикла TCA, что предполагает отличительную роль метаболизма глутамина в разных типах клеток [19].
3.2. Метаболизм глутамина в дифференцировке BMSC
Остеогенная дифференцировка и дифференцировка адипоцитов являются основными обязательствами BMSC в развитии скелета. BMSC потребляют и метаболизируют значительное количество глутамина, поскольку они подвергаются дифференцировке в остеобласты, но не в клон адипоцитов.Поскольку BMSCs дифференцируются в сторону остеобластов, метаболизм глутамина обеспечивает АТФ через цикл TCA со сниженным вкладом в цитрат [17]. Более того, интегрированный механизм в глутамин-зависимом паттерне задействован для удовлетворения энергетических и синтетических потребностей во время дифференцировки BMSC (см. Рисунок 1).
3.2.1. GLS
Митохондрии — это центральное место, охватывающее многие сложные метаболические реакции [62]. GLS катаболизирует глутамин в глутамат, затем α -KG, который восполняет анаплероз промежуточных продуктов TCA для поддержания митохондриальной активности и снабжения промежуточными продуктами метаболизма для активного биосинтеза в остеогенезе [63].Экспериментальные данные свидетельствуют о том, что GLS является целевым ферментом метаболизма глутамина, который влияет на дифференцировку BMSC. Генетическое ингибирование метаболизма глутамина посредством делеции Gls в BMSCs привело к снижению общего количества остеобластов и способности передавать информацию о костях, что, в свою очередь, привело к снижению костной массы по сравнению с однопометниками дикого типа [17]. С другой стороны, miRNA в качестве важного регулятора была способна установить сложную цепь в гомеостазе кости, взаимодействуя с разными генами [64].Недавние данные показали, что miRNA-206 участвует в биоэнергетике BMSC, напрямую связываясь с 3-нетранслируемой областью (3-UTR) мРНК GLS, что приводит к подавлению экспрессии GLS и метаболизма глутамина и в конечном итоге ингибирует остеогенную дифференцировку BMSC [65] .
3.2.2. mTOR
mTOR — это датчик факторов роста, активация которого увеличивает ширину и массу кости в результате гиперпролиферированных МСК, но снижает длину кости и минеральное содержание из-за дефектной дифференцировки МСК [66].Механически mTOR является центральной мишенью внутреннего контроля в костных клетках, который объединяет различные молекулы, связанные с метаболизмом глутамина при дифференцировке BMSC. Предыдущие исследования показали, что передача сигналов WNT влияет на биологическое поведение остеобластов за счет увеличения как числа клеток, так и активности синтеза белка [67]. Важно отметить, что для удовлетворения возросшей потребности в энергии и синтетике анаболический механизм напрямую реагировал на передачу сигналов WNT, влияя на дифференцировку остеобластов BMSC. Передача сигналов WNT нацелена на мишень рапамицина 1 (mTORC1) млекопитающих, чтобы стимулировать вход глутамина в цикл TCA, что впоследствии снижает внутриклеточные уровни глутамина.Затем был запущен общий контроль недерепрессируемый 2-опосредованный (GCN2-опосредованный) путь интегрированного стрессового ответа (ISR) из-за WNT-индуцированного снижения глутамина, который стимулировал экспрессию генов, ответственных за транспорт аминокислот, аминоацилирование тРНК, и сворачивание белков [68]. Предыдущие исследования также показали, что активация mTORC1 стимулировала конверсию глутамата α -KG за счет активации GDH, тем самым способствуя пролиферации раковых клеток [69]. Активация сигнального пути mTOR, стимулированная сверхэкспрессией мембранного протеина 1 Гольджи (GOLM1) в BMSC, соответствовала таковой в раковых клетках, поведение которых ингибировало остеогенную дифференцировку BMSC из-за повышенной активности GDH и глутамина до конверсии α -KG.[20].
3.2.3. ERR
αРецептор, связанный с эстрогеном α (ERR α ), рецептор орфанного ядерного гормона, способный регулировать транскрипцию родственных генов. Предыдущие исследования показали, что ERR α положительно регулирует адипоцитарную и хондроцитарную дифференцировку МСК, в то же время оказывая двойное влияние на дифференцировку остеобластов в направлении Runx2- и / или WNT-мишени [70]. Недавно сообщалось о возрастном ограничении BMSCs как о существенном факторе дегенеративного прогресса костей из-за снижения остеогенной способности и несбалансированного распределения клонов [71, 72].А динамические паттерны экспрессии ERR α с возрастом были тесно связаны с дифференцировкой остеобластов BMSC. Исследование показало, что экспрессия ERR α была явно снижена у старших крыс, что согласуется с ухудшением остеогенной способности с возрастом [73]. Кроме того, ERR α не регулируется при таких возрастных заболеваниях, как остеоартрит и ревматоидный артрит [74, 75]. Что касается клеточного уровня, ERR α достиг пикового уровня экспрессии белка на ранней стадии дифференцировки остеобластов и снизился на стадии минерализации, в то время как уровни мРНК оставались стабильными.Это действительно поддерживало точку зрения, что ERR α инактивировалась после начала созревания остеобластов и регулирует дифференцировку остеобластов специфическим для времени образом [76]. Однако точный молекулярный механизм остается неясным. Нарушение регуляции функции митохондрий является общим признаком старения, и коактивация ERR α с активатором пролифератора гамма-рецептора 1- α (PGC-1 α ) регулирует митохондриальный биогенез за счет окисления жирных кислот и затрат энергии, связанных с РОС [77, 78].Связываясь со своим промотором, ERR α непосредственно регулирует экспрессию GLS, вызывая митохондриальный Gln-зависимый анаплероз, критический для цикла TCA и биосинтеза нуклеотидов и белков. Старение отрицательно влияет на этот сигнальный путь ERR α / GLS, а репарированная экспрессия ERR α и GLS может частично восстанавливать остеогенную способность МСК противостоять потере костной ткани [73]. Кроме того, главный регулятор синтеза mTOR модулирует передачу сигналов ERR α / GLS посредством воздействия на транскрипционную активность ERR α , что может быть таргетной терапией связанной со старением потери костной массы [73].
3.2.4. ROS
Активные формы кислорода (ROS) образуются в результате окисления промежуточных продуктов метаболизма ETC и обычно образуются в форме супероксида в митохондриях [79]. Комплексы дыхательной цепи в митохондриях являются основными центрами продукции АФК, особенно комплексов I и III. Кроме того, многие другие белки, такие как пируватдегидрогеназа (PDH) и флавопротеин с переносом электронов (ETF), также являются продуцентами АФК [80]. АФК являются не только следствием дифференцировки, но также являются критическими компонентами путей, регулирующих дифференцировку стволовых клеток [81].Они точно регулируются, чтобы предотвратить окислительное повреждение клеток в нормальных условиях; повышенные ROS в BMSCs с возрастом, как сообщается, разрушают выделение клонов, демонстрируя усиление адипогенеза и блокирование остеогенеза [82, 83]. Потенциальным механизмом может быть токсическое накопление α -KG при чрезмерном окислительном метаболизме. Повышенная активность PDH и потеря митохондриального мембранного потенциала (MMP) с переходом в цикл TCA, скорее всего, усиливают проникновение пирувата в митохондрии, накапливая токсичные метаболиты [84].Затем это привело к нуклеоцитоплазматической вакуолизации и конденсации хроматина, что, очевидно, препятствовало дифференцировке остеогенов и адипоцитов. Одновременно с этим сопутствующее повреждение ДНК, ингибирование ацетилирования гистона h4 (Lys27) и повышенная деградация HIF-1 α способствовали гибели BMSC [84]. Более того, в другом исследовании сообщается, что повышенное содержание глутатиона из глутамина важно для компенсации пагубного влияния АФК на судьбу остеобластов [17]. С другой стороны, по сравнению с положительной ролью ROS, глутамин был менее важным в дифференцировке адипоцитов BMSC.ROS, генерируемые митохондриями, усиливают дифференцировку адипоцитов по mTORC1-зависимому паттерну, что может объяснить феномен, согласно которому ни потребление глутамина, ни активность GLS не изменяются во время дифференцировки адипоцитов по сравнению с недифференцированными BMSCs [85, 86].
3.3. Метаболизм глутамина в BMSCs в остеоиммунологии
Известно, что помимо особенностей самообновления и многолинейной дифференцировки, МСК проявляют иммуносупрессивную модуляцию, экспрессируя молекулы адгезии и секретируя эффективные факторы, такие как цитокины, хемокины и факторы роста [87–89].Исследования метаболизма глутамина в иммунной системе в последние десятилетия также побудили к признанию его регулирующей роли в адаптивном иммунитете и врожденном иммунитете, включая лимфоциты, нейтрофилы и макрофаги, а также ряд цитокинов [90–92]. В BMSC концентрация глутамина соответствовала их иммунологическим свойствам. Высокая доза глутамина продемонстрировала усиление иммуносупрессивных свойств BMSC за счет воздействия на воспалительные цитокины, демонстрируя снижение уровней провоспалительных цитокинов, таких как интерлейкин-1 β (IL-1 β ) и IL-6, и повышение уровня противовоспалительных цитокинов. ИЛ-10 и трансформирующий фактор роста- β (TGF- β ) [93].Механически различная продукция провоспалительных цитокинов может быть связана со сниженной экспрессией фосфорилированного ядерного фактора каппа-B (NF- κ B) и высоким уровнем сигнального преобразователя и активатора (STAT-3) в BMSC, поскольку они контролируют продукцию цитокинов [94 ]. Кроме того, IL-10 имел решающее значение для иммунных ответов в отношении концентрации глутамина, поскольку они ингибировали активацию NF- κ B, таким образом модулируя продукцию цитокинов. Между тем, как IL-10, так и STAT-3 увеличиваются в BMSC с глутамином, что можно объяснить тем, что противовоспалительные эффекты IL-10 опосредованы STAT-3, и, в свою очередь, сообщалось, что IL-10 также способствует STAT. -3 для снижения количества провоспалительных цитокинов [95, 96].Кроме того, пролиферация лимфоцитов и макрофагов подавлялась при совместном культивировании с BMSC в среде с глутамином, что сопровождалось увеличением продукции IL-10 [97]. Повышенный уровень IL-10 может быть объяснен трансформацией макрофагов в противовоспалительный фенотип M2 с индукцией МСК [98], тогда как точный механизм иммуномодуляции в BMSC-опосредованном глутамине неясен.
4. Метаболизм глутамина в остеобластах
Остеобласты, являющиеся основными костными клетками, отвечают за производство большого количества как богатого коллагеном I костного матрикса, так и эктоферментов, контролирующих минерализацию матрикса.Они следуют своевременно запрограммированным шагам и экспрессируют определенные гены под контролем проостеогенных путей. Путь передачи сигналов WNT имеет решающее значение для обеспечения приверженности к остео / хондропрогениторам BMSCs, особенно на ранних стадиях дифференцировки остеобластов [99]. Предполагается, что передача сигналов WNT напрямую перепрограммирует клеточный метаболизм в клетках линии остеобластов, стимулируя аэробный гликолиз, катаболизм глутамина и окисление жирных кислот [67]. Кроме того, катаболизм глутамина был идентифицирован как решающий регуляторный шаг в удовлетворении как энергетических, так и синтетических требований, которые связаны с индуцированным WNT анаболизмом костей в незрелых остеобластах.
Karner et al. сообщили, что глутамин является одновременно источником энергии и реостатом трансляции белков, который реагирует на дифференцировку остеобластов [68], а нарушение дифференцировки остеобластов с возрастом в BMSCs может быть связано со снижением потребления глутамина [73]. Между тем, Brown et al. подтвердили, что глутамин значительно улучшает жизнеспособность остеобластов и увеличивает утилизацию глюкозы как в линиях остеобластоподобных клеток человека, так и в остеобластах черепа мыши, а более высокие уровни экспрессии остеокальцина благоприятны для минерализации матрикса [100].Более того, учитывая, что глутамин непосредственно стимулирует транскрипцию коллагена type1a1 в фибробластах, применение глутамина в отношении минерализации в культурах остеобластов может быть связано с влиянием на экспрессию коллагена [101]. Однако остается неизвестным, необходим ли глутаминовый анаплероз для физиологической активности остеобластов в формировании кости из-за отсутствия систематических анализов в остеобластах с истощением Gls [102].
5. Метаболизм глутамина в хондроцитах
Приверженность BMSC к хондрогенному клону является важным событием для инициирования эндохондрального окостенения, которое сначала дает начало незрелым хондроцитам и зачаткам хряща.Интегрированная передача сигналов между факторами роста и компонентами внеклеточного матрикса, содержащими коллагены, протеогликаны, гликозаминогликаны (ГАГ) и протеазы, совместно регулируют хондроциты, способствуя прогрессирующим изменениям в эндохондральной оссификации и формировании костей [103]. Первоначально было показано, что глутамин поддерживает синтез гликозаминогликанов и белка в качестве поставщика углерода и азота в метаболизме внеклеточного матрикса в хондроцитах [104]. Принимая во внимание особую бессосудистую среду хряща, было широко распространено мнение, что клетки внутри хряща гипоксичны, а гипоксия регулирует энергетическое состояние созревающих клеток [105].Однако чрезмерная гипоксическая среда была вредной для хондроцитов, и обычно за ней следовало снижение утилизации глутамина и снижение содержания глутатиона, что, возможно, было связано с подавлением функции митохондрий1 и ингибированием окислительного дезаминирования [105]. HIF-1 α представляет собой белок, экспрессирующийся в гипоксическом микроокружении, и более высокая экспрессия HIF-1 α в условиях гипоксии является большой необходимостью для выживания хондроцитов по внутреннему механизму [106, 107].Поскольку HIF-1 α опосредовал повышенную экспрессию GLS1, поток глутамина к α -KG был увеличен, чтобы способствовать α -KG-зависимому гидроксилированию пролина и лизина коллагена, и это было полезно для увеличения костной массы. путем придания устойчивости хрящевого матрикса к опосредованной протеазой деградации [108]. В некоторых патологических ситуациях глутамин также оказывал защитное действие на хондроциты. Например, глутамин повышает концентрацию глутатиона в хондроцитах для защиты клеток от повреждений при хирургических вмешательствах или инфекционных заболеваниях [109, 110].В стрессовых условиях глутамин проявлял хондропротекторный эффект, усиливая экспрессию белка теплового шока 70 (HSP70), который уменьшал апоптоз хондроцитов, предотвращая прогрессирование дегенерации хряща [111]. Важно отметить, что два энергозависимых анаболических процесса совместно регулируют биологическое поведение хондроцитов. Дисбаланс опосредованного глюкозой снижения синтеза коллагена и опосредованного глутамином увеличения костной массы в хондроцитах приведет к дисплазии скелета [108].
6. Метаболизм глутамина в остеокластах
Для поддержания архитектуры и прочности скелета необходим гомеостатический баланс между образованием новой кости и резорбцией старой или поврежденной кости. Остеокласты, происходящие от кроветворной линии, в основном разрушают костный матрикс и высвобождают кальций и фосфат, в конечном итоге проявляя регуляцию костной массы, а также качества [112]. Было высказано предположение, что L-глутамин оказывает значительное влияние на раннюю фазу дифференцировки остеокластов и стадию созревания [113].После поглощения через SLC1A5, Na + -зависимый переносчик L-глутамина [114–116], остеокласты превращают глутамин в глутамат, а затем в α -KG, который играет важную роль в качестве анаплеротического субстрата в дифференцировке остеокластов [117 ]. Кроме того, глутамин был важным топливом для приобретения костно-резорбирующей активности зрелых многоядерных остеокластов [113]. Morten et al. сообщили, что гипоксия стимулировала потребление глутамина в остеокластах, что было похоже на клетки нейробластомы SK – N – SH и аденокарциномы легкого A549 [118, 119].Повышенное поглощение глутамина может в основном способствовать биосинтезу, поскольку отмена глутамина не влияла ни на продукцию АТФ [61].
7. Терапевтический потенциал глутамина в лечении заболеваний костей
В последние десятилетия повышенное внимание уделяется энергетическому метаболизму, поскольку он регулирует доставку и использование питательных веществ в организме, а метаболическая негибкость связана с различными патологическими процессами [120 ]. В обновленных клинических испытаниях было проведено множество исследований для выяснения влияния глутамина на улучшение побочных реакций, вызванных лечением, и потенциальных применений в диагностике (см. Таблицу 1).Кроме того, глутамин имеет решающее значение как для производства энергии, так и для окислительно-восстановительного гомеостаза в гомеостазе костей, что может быть потенциальной стратегией при заболеваниях костей, таких как остеопороз и остеоартрит.
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
7.1. Остеопороз
Остеопороз, в основном встречающийся у женщин в постменопаузе и в старшей группе, характеризуется низкой костной массой и ухудшением костной микроархитектуры, что в конечном итоге ведет к повышенной подверженности переломам [151]. Предыдущие исследования показали, что связанные со старением изменения метаболизма глутамина при остеопорозе могут нарушить баланс между остеогенной и адипоцитарной дифференцировкой BMSC через разрушение ключевых ферментов в метаболизме глутамина или ухудшение метаболизма митохондрий [73, 84].Ранняя анаболическая терапия, связанная с глутамином, может быть хорошим способом лечения остеопороза с точки зрения этиологии. Было отмечено, что добавка глутамина (раствор L-глутамина / L-аланила (2,0 мл / кг) через хвостовые вены в первые 7 дней) позволяет быстрее и чаще получать первичную каллус и хрящевую мозоль за счет достижения положительного баланса азота у стандартизованных крыс-альбиносов. который сыграл важную роль в выздоровлении пациентов с переломами при остеопорозе [152], однако его влияние на улучшение качества заживления переломов в условиях стресса было незначительным, лишь оказав некоторое влияние на скорость заживления [152].Фактически, предшественник глютамина был исследован для применения в лечении остеопороза на животных моделях. Было установлено, что 2-оксоглутарат (2-Ox), предшественник глутамина, способствует увеличению толщины губчатого вещества кости, пластинки роста и суставного хряща в остеопении, вызванной фундэктомией [153]. Он также применялся при остеопорозе, вызванном лечением глюкокортикоидами у недоношенных детей с воспалительными и аутоиммунными заболеваниями, что привело к повышению уровня гормона роста и концентрации остеокальцина и сохранению микроархитектуры губчатой кости [154].
7.2. Остеоартрит
Остеоартрит, характеризующийся патологическим перерождением суставного хряща и субхондральной кости, часто диагностируется по симптомам боли, жесткости суставов и инвалидности [155]. У пациентов с остеоартритом воспалительные цитокины и АФК индуцируются нефизиологической механической нагрузкой и тепловым стрессом, которому способствуют девиантные движения суставов, что в конечном итоге способствует патологическому прогрессированию. Обработка хондроцитов глутамином защищала клетки от теплового стресса и NO-индуцированного апоптоза, тем самым предотвращая остеоартрит [111].Fujita et al. показали, что тепловая стимуляция и глутамин могут стимулировать экспрессию HSP70 в суставном хряще крысы in vivo , что может быть вовлечено в подавление прогрессирования остеоартрита [156]. Поскольку терапия на основе стволовых клеток является потенциальным подходом к лечению остеоартрита, исследования клеточного метаболизма в стволовых клетках способствуют применению клеточного лечения в целом. Stegen et al. предположили, что опосредованное HIF-1 α превращение глутамина в синтез глутатиона было полезным для поддержания окислительно-восстановительного гомеостаза при окислительном или питательном стрессе, что, следовательно, оказало положительное влияние на выживаемость клеток [19].Трансплантация полученных из жировой ткани мезенхимальных стволовых клеток (Ad-MSC) в 1 мл среды Игла, модифицированной Дульбекко (DMEM), была введена в область суставного дефекта кроликов, страдающих остеоартритом, и общая оценка заживления экспериментальных колен была выше, чем у экспериментальных коленных суставов. контрольная группа только что получила 1 мл DMEM, в которую было включено 2 мМ L-глутамина [157]. Кроме того, когда дело доходит до пациентов с остеоартритом, которые получали ТКА, добавление комбинации β -гидрокси- β -метилбутирата, L-аргинина и L-глутамина (HMB / Arg / Gln) во время послеоперационного восстановления. может подавить потерю мышечной силы [150].
8. Заключение
Недавние данные показали, что глутамин является критическим регулятором гомеостаза костей, поддерживая энергию в качестве замещающего источника углерода в цикле TCA и обеспечивая предшественники для синтеза белков и нуклеиновых кислот. На клеточном уровне метаболизм глутамина опосредует биоэнергетику костных клеток, включая BMSC, остеобласты, хондроциты и остеокласты, тем самым влияя на их способность к пролиферации, дифференцировке и минерализации. Аномальный метаболизм глутамина связан с клиническими расстройствами, такими как остеопороз и остеоартрит, и, как ожидается, предоставит новые рекомендации для лечения.В костных тканях интегрированная регуляторная сеть, в которой глутамин, выступающий в качестве мишени, участвует в дифференцировке BMSC, тогда как исследования последующих эффекторов метаболизма глутамина в настоящее время изучаются редко. Следовательно, механизм глутамина в гомеостазе костей, вероятно, многогранен, и вне всякого сомнения необходимы дополнительные фундаментальные исследования. Метаболизм глутамина по-разному влияет на другие клетки или ткани, например, он влияет на клеточную дифференцировку через эпигенетическую регуляцию в эмбриональных стволовых клетках [158]; тем не менее, это не было выяснено в костных клетках.В качестве альтернативы добавка глутамина применялась при лечении некоторых системных заболеваний и, как ожидается, восстановит нарушения, вызванные остеопорозом и остеоартритом. Фактически, мишени глутамина в терапии заболеваний костей малоизвестны. Следовательно, необходимы более фундаментальные и клинические исследования, чтобы глубоко изучить роль метаболизма глутамина в регуляции гомеостаза костей и предоставить новую стратегию клинического лечения заболеваний костей.
Конфликт интересов
Авторы заявляют об отсутствии конфликта интересов в отношении публикации этой статьи.
Вклад авторов
Тао Чжоу и Юцин Ян внесли одинаковый вклад.
Благодарности
Эта работа была поддержана грантами Национального фонда естественных наук Китая (NSFC, 81600842, 81621062 и 81520108009) и программы Innovative Spark Университета Сычуань (2018SCUH0056).
(PDF) Амилоидные свойства аспарагина и глутамина в прионоподобных белках
(17) Schneider, R., Schumacher, M.C., Mueller, H., Nand, D.,
Клаукиен, В., Хейзе, Х., Ридель, Д., Вольф, Г., Берманн, Э., Раунсер, С.,
Зайдель, Р., Энгельхард, М., и Бальдус, М. (2011) Структурная характеристика
фибрилл полиглутамина методом твердотельной ЯМР-спектроскопии. J. Mol.
Биол. 412, 121−136.
(18) Бьюкенен, Л. Е., Карр, Дж. К., Флюит, А. М., Хогансон, А. Дж., Моран,
С. Д., де Пабло, Дж. Дж., Скиннер, Дж. Л., и Занни, М. Т. (2014) Структурный
мотив полиглутаминового амилоида фибриллы, обнаруженные с помощью инфракрасной спектроскопии смешанных изотопов
.Proc. Natl. Акад. Sci. США. 111, 5796−801.
(19) Кар, К., Хуп, К.Л., Дромбоски, К.В., Бейкер, М.А., Кодали, Р.,
, Ардуини, И., ван дер Вел, П.К., Хорн, WS, и Ветцель, Р. ( 2013) β-
-опосредованная шпилькой нуклеация образования полиглутаминового амилоида. J.
Мол. Биол. 425, 1183−1197.
(20) Ман В. Х., Роланд К. и Сагуи К. (2015) Структурные
детерминанты протофибрилл и кристаллитов полиглутамина. ACS Chem.
Neurosci.6, 632−645.
(21) Прусинер С.Б. (1998) Прионы. Proc. Natl. Акад. Sci. США 95,
13363–13383.
(22) True, H. L. и Lindquist, S. L. (2000) Прион дрожжей обеспечивает механизм
для генетической изменчивости и фенотипического разнообразия. Nature 407,
477-83.
(23) Coustou, V., Deleu, C., Saupe, S., and Begueret, J. (1997) Белковый продукт
гена гетерокарионной несовместимости het-s гриба
Podospora anserina ведет себя как аналог приона.Proc. Natl. Акад.
Sci. США 94, 9773−9778.
(24) Sawyer, E. B., Claessen, D., Haas, M., Hurgobin, B., and Gras, S. L.
(2011) Сборка индивидуальных пептидов чаплина из Streptomyces
coelicolor в функциональные амилоидные фибриллы. PLoS One 6, e18839.
(25) Barnhart, M., and Chapman, M. R. (2006) Curli biogenesis
and function. Анну. Rev. Microbiol. 60, 131−47.
(26) Peters, T. W. и Huang, M. (2007) Агрегация белков и
клеточная токсичность, опосредованная полиаспарагином, в Saccharomyces cerevisiae.
Прион 1, 144-153.
(27) Michelitsch, M. D., and Weissman, J. S. (2000) Перепись
областей, богатых глутамином / аспарагином: последствия для их консервативной функции
и предсказание новых прионов. Proc. Natl. Акад. Sci. США.
97, 11910-11915.
(28) Халфманн, Р., Альберти, С., Кришнан, Р., Лайл, Н., О’Доннелл, CW,
Кинг, О. Д., Бергер, Б., Паппу, Р. В., и Линдквист, С. . (2011) Противодействие
эффектам глутамина и аспарагина, которые управляют образованием прионов
внутренне неупорядоченных белков.Мол. Ячейка 43,72-84.
(29) Miller, J., Arrasate, M., Shaby, BA, Mitra, S., Masliah, E., and
Finkbeiner, S. (2010) Количественные взаимосвязи между уровнями Хантингтина
, длиной полиглутамина, образование телец включения и гибель нейронов
дают новое представление о молекулярном патогенезе болезни Гентингтона
. J. Neurosci. 30, 10541-10550.
(30) Аррасате, М., Митра, С., Швейцер, Э. С., Сегал, М. Р., и
Финкбайнер, С.(2004) Образование тельца включения снижает уровни мутанта
хантингтина и риск гибели нейронов. Природа 431, 805-810.
(31) Росс, К. А. и Пуарье, М. А. (2005) Какова роль агрегации белка
в нейродегенерации? Nat. Rev. Mol. Cell Biol. 6, 891-898.
(32) Си К., Линдквист С. Л. и Кандел Е. Р. (2003) Нейрональная изоформа
аплизии CPEB обладает прионоподобными свойствами. Ячейка 115, 879−
891.
(33) Росс, Э.Д., Минтон А. и Викнер Р. Б. (2005) Прионные домены:
последовательностей, структур и взаимодействий. Nat. Cell Biol. 7, 1039-1044.
(34) Лу, X., и Мерфи, Р. М. (2015) Пептиды с аспарагиновыми повторами:
Кинетика агрегациии сравнение с глутаминовыми повторами. Био-
химия 54, 4784-94.
(35) Савая, М. Р., Самбашиван, С., Нельсон, Р., Иванова, М. И., Сиверс,
С. А., Апостол, М. И., Томпсон, М. Дж., Балбирни, М., Вильциус, Дж.J. W.,
McFarlane, H. T., Madsen, A. ø., Riekel, C., and Eisenberg, D. (2007)
Атомная структура амилоидных поперечных β-шипов показывает различные стерические застежки-молнии.
Природа 447, 453-457.
(36) Zhang, Y., and Sagui, C. (2015) Присвоение вторичной структуры
для конформационно нерегулярных пептидов: сравнение между DSSP,
STRIDE и KAKSI. J. Mol. Графическое моделирование. 55,72-84.
(37) Накано М., Эбина К. и Танака С. (2013) Изучение механизма агрегации полиглутаминовых пептидов
с использованием моделирования обменной молекулярной динамики реплики
.J. Mol. Модель. 19, 1627−
1639.
(38) Nelson, R., Sawaya, MR, Balbirnie, M., Madsen, AO, Riekel, C.,
Grothe, R., and Eisenberg, D. (2005 ) Структура перекрестного β-шиповника из
амилоидоподобных фибрилл. Природа 435, 773−778.
(39) Gsponer, J., Haberthür, U., and Caflisch, A. (2003) Роль
взаимодействий боковых цепей на ранних этапах агрегации: Molecular
моделирование динамики амилоид-образующего пептида из дрожжей
прион Sup35.Proc. Natl. Акад. Sci. США 100, 5154-5159.
(40) Vitagliano, L., Esposito, L., Pedone, C., and De Simone, A. (2008)
Стабильность однослойных агрегатов GNNQQNY, проанализированных с помощью реплики
Обменная молекулярная динамика: антипараллельная или параллельная ассоциация .
Biochem. Биофиз. Res. Commun. 377, 1036-1041.
(41) Balbirnie, M., Grothe, R., and Eisenberg, D. S. (2001) Пептид, образующий амилоид-
из дрожжевого приона Sup35, обнаруживает дегидратированную листовую структуру β-
для амилоида.Proc. Natl. Акад. Sci. США 98, 2375−2380.
(42) Shewmaker, F., Wickner, R. B., and Tycko, R. (2006) Амилоид
прионного домена Sup35p имеет регистрируемую параллельную структуру β-листов.
Proc. Natl. Акад. Sci. США 103, 19754−19759.
(43) Де Симоне, А., Эспозито, Л., Педоне, С., и Витальяно, Л. (2008)
Анализ стабильности и токсичности амилоидоподобных олигомеров с помощью анализа молекулярной динамики реплик
.Биофиз. J. 95, 1965–1973.
(44) Ричардсон, Дж. С. и Ричардсон, Д. С. (2002) Природный β-лист
Белкииспользуют негативный дизайн, чтобы избежать агрегации от края до края. Proc.
Нац. Акад. Sci. США 99, 2754–2759.
(45) Лайдман, Дж., Форс, Дж. Дж. И Йейтс, Т. О. (2006) Конформационное изменение
и сборка через краевые бета-цепи в транстиретине и
других амилоидных белках. В соотв. Chem. Res. 39, 576−583.
(46) Яги, Х., Ozawa, D., Sakurai, K., Kawakami, T., Kuyama, H.,
, Nishimura, O., Shimanouchi, T., Kuboi, R., Naiki, H., and Goto, Y.
(2010) Лазер-индуцированное распространение и разрушение фибрилл бета-амилоида
. J. Biol. Chem. 285, 19660.
(47) Кавасаки, Т., Фудзиока, Дж., Имаи, Т., и Цукияма, К. (2012)
Влияние излучения лазера на свободных электронах в средней инфракрасной области на рефолдинг амилоида
-подобные фибриллы лизоцима в нативную форму. Протеин Ж. 31, 710.
(48) Man, VH, Derreumaux, P., Li, MS, Roland, C., Sagui, C., и
Nguyen, P. (2015) Пикосекундная диссоциация амилоидных фибрилл с помощью инфракрасного лазера
: A исследование неравновесного моделирования. J. Chem. Phys. 143,
155101.
(49) Ман, В., Труонг, П., Дерремо, П., Ли, М., Роланд, К., Сагуи, К.,
,и Нгуен, П. (2015 г. ) Пикосекундное плавление пептидных нанотрубок с помощью инфракрасного лазера
: исследование неравновесности. Phys. Chem. Chem.Phys. 17,
27275-80.
(50) Данбрак, Р.

 Для атлетов это свойство крайне важно, так как тяжелые тренировки, как правило, сильно истощают уровень глютамина, а именно эта аминокислота является основным источником энергии для иммунной системы
Для атлетов это свойство крайне важно, так как тяжелые тренировки, как правило, сильно истощают уровень глютамина, а именно эта аминокислота является основным источником энергии для иммунной системы

 В то же время это вещество обладает рядом других положительных качеств, оказывающих благоприятное влияние на состояние организма. Этот вид аминокислот нередко встречается в составе протеинов. Для приобретения глютамина можете воспользоваться сайтом https://fitandpit.ru/catalog/glyutamin/optimum-nutrition, где такой товар представлен от известных производителей и соответственно вы как покупатель можете быть уверены в его высоком качестве.
В то же время это вещество обладает рядом других положительных качеств, оказывающих благоприятное влияние на состояние организма. Этот вид аминокислот нередко встречается в составе протеинов. Для приобретения глютамина можете воспользоваться сайтом https://fitandpit.ru/catalog/glyutamin/optimum-nutrition, где такой товар представлен от известных производителей и соответственно вы как покупатель можете быть уверены в его высоком качестве. С таким ощущением нередко сталкиваются профессиональные атлеты. Характеризуется перетренированность утратой сил, апатией и другими неприятными моментами;
С таким ощущением нередко сталкиваются профессиональные атлеты. Характеризуется перетренированность утратой сил, апатией и другими неприятными моментами;