Калий ⚗️ электронная конфигурация химического элемента, химические и физические свойства, способы применения и получения, взаимодействие с соединениями, польза и вред

История открытия
Атомный номер калия 19, что указывает на его расположение в химической таблице Менделеева.
Примерная молярная масса 39,1 г/моль.
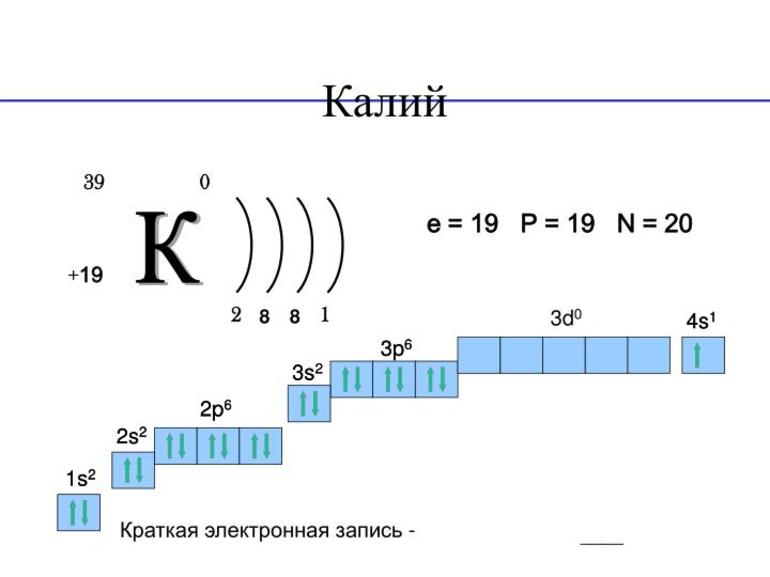
Электронная конфигурация калия 1s22s22p63s23p64s1

Единственная возможная степень окисления +1 (плюс один).
На внешнем энергетическом уровне имеется всего 1 электрон. Это значит, что максимальная валентность элемента 1.
Кристаллическая решётка простого вещества кубическая объёмно-центрированная.
В 1807 году английский химик Х. Дэви опытным путём получил потассий (латинское название — потассиум). Именно так изначально был назван калий. Проводя электролиз каустической воды и расплавов поташа, учёный заметил образование мягкого легкоплавкого металла. Такое достижение подтолкнуло его к новым открытиям и он стал изучать химические и физические свойства нового вещества.
Такая сенсация потрясла весь научный мир и зарубежные коллеги решили не оставаться в стороне. Уже через 2 года британский эксперт Л. В. Гилберт предложил название «Аль-кали», что в переводе с арабского означает «зола растений». И это не удивительно, ведь золу, которая оставалась после сжигания растений, обрабатывали водой, а полученную смесь выпаривали до сухого остатка. В далёкие времена это использовали как моющее средство. В 1831 году немецкий физик Г. И. Гесс, изучавший свойства нового вещества, предложил своё название для элемента, который также называли «Аль-калий».
Калий в природе

После многолетних поисков выяснилось, что в природе калий не находится в чистом виде. Он один из десяти элементов, которые составляют большую часть окружающего мира.
Калий — неотъемлемый элемент в составе клеток живых организмов. Также большое количество содержится в минералах и морской воде.
- Сильвинита KCl·NaCl.
- Карналлита KCl·MgCl 2 ·6H 2 O.
- Каинита KCl·MgSO 4 ·6H 2 O.
- Зола растений как поташ K 2 CO 3.
Способы получения
Современные условия позволяют учёным получать калий несколькими способами.
Уравнение взаимодействия с жидким натрием расплавленного основания при 380−450°C или хлорида при 760- 890 °C: Na + KOH = NaOH + K
Электролиз расплава хлорида в смеси с карбонатом калия при температуре около 700 °C:
2KCl = 2K + Cl 2.
Физические свойства
Легкоплавкий металл серебристого цвета. При надрезе быстро образует оксидную плёнку после нескольких секунд контакта с кислородом, что объясняет требования особых условий содержания в помещениях. Хранится только в посуде с керосином, силиконами или бензином. Обладает хорошей растворимостью при соединении со ртутью. Образует амальгамы.
Химические характеристики
Калий имеет много общего с натрием. Это обусловлено их расположением в периодической таблице химических элементов Д. И. Менделеева. Оба элемента — щелочные металлы, которые ярко выражают свои свойства. Однако у потассия металлические свойства проявляются сильнее, чем у натрия и кальция, но слабее, чем у рубидия.
Калию свойственно проявлять такие характеристики, которые делают его незаменимым для химической промышленности:
- Химически активен.
- Легко отдаёт электроны.
- Сильный восстановитель.
Оксиды или пероксиды
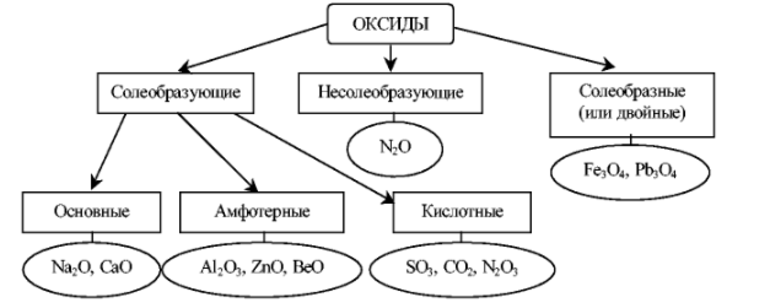
При взаимодействии с кислородом образует не оксид, а пероксид или супероксид, что заметно невооружённым глазом (очень быстро образует оксидную плёнку на поверхности).
Может образовать оксид только лишь при медленном нагревании до температуры меньше 180 °C при низком содержании кислорода в окружающей среде.
Оксиды ярко проявляют основные свойства. Как и сам металл, бурно реагируют с водой, кислотными оксидами и самими кислотами. Практического применения в промышленности они не нашли, используются для обучения в университетах.
Пероксиды — белые порошки с жёлтым тоном. Хорошо растворяются в воде, образуя щёлочи и пероксид водорода.
Сильные окислители, поэтому обрели популярность в текстильной промышленности как отбеливающее средство.
Гидроксиды калия
Гидроксиды калия и натрия имеют особые названия: едкий кали и едкий натри. Белые, твёрдые, непрозрачные вещества. Очень гигроскопичны, это значит, что быстро впитывают влагу и требуют особого внимания при работе с ними. Лаборанту необходимо надевать перчатки и защитные очки, иначе получит сильный ожог и раздражение слизистых оболочек. Кристаллы плавятся при температуре 360 °C. Гидроксиды относят к щелочам, они быстро растворяются в воде, выделяя большое количество тепла.
Сфера применения

Соединения калия используют в качестве удобрений, что свидетельствует о его ценных биологических характеристиках. Один из важнейших компонентов биосистемы вместе с азотом и фосфором. Помимо этого, необходим обмен элемента в натриево-калиевом насосе клетки любого живого организма.
Большую популярность приобрел в гальванотехнике. Соли металла быстро растворяются, по сравнению с солями натрия. Это свойство позволяет устанавливать высокие цены компаниям, которые занимаются обработкой калия.
Жидкий сплав калия и натрия используется в качестве теплоносителей в атомных установках. Необходимое условие: комнатная температура.
Особые соединения калия

Бромид используется в фармацевтике для изготовления успокоительных лекарств.
Карбонат, хлорид и нитрат пользуются популярностью у садоводов, так как представляют собой удобрения, обогащённые большим количеством полезных микроэлементов.
Перманганат применяется в химических лабораториях для получения кислорода, а также ранее широко применялся в быту благодаря своим антисептическим свойствам.
Пероксид и супероксид обеспечивают регенерацию воздуха на подводных лодках и противогазах, благодаря своей способности поглощать углекислый газ и выделять кислород.

Из описания характеристик калия с другими элементами становится понятно, что это крайне важная составляющая организма, которая должны взаимодействовать с другими металлами и неметаллами, чтобы обеспечить гармоничный рост и развитие организма. Норма потребления этого элемента для человека — 2040 мг в сутки.
Роль этого металла и реакций организма, в которых он принимает участие, имеют большое значение для строения клеток, из которых состоит любой живой организм. Благодаря образованию различных химических связей, калий помог человечеству добиться новых вершин в кораблестроении, садоводстве, фармацевтической промышленности.
Повсеместное нахождение в природе позволяет добывать металл и его соединения беспрерывно, а благодаря успехам учёных в области химии возможно регулировать плотность содержания калия в препаратах. При соблюдении правильных пропорций и составлении схем алгоритмов можно предугадать пользу или вред.
Калий может быть полезным, но также он способен обрекать людей на тяжкие мучения, такие как: ожоги рук, раздражение слизистых оболочек. Об этом следует помнить всем, кто стремится узнать больше о свойствах этого металла. Прежде чем начинать работу с опасными веществами, лучше узнать всё о многолетнем опыте предшественников, чтобы избежать печальных и необратимых последствий.
Цианид калия — Википедия
Материал из Википедии — свободной энциклопедии
Текущая версия страницы пока не проверялась опытными участниками и может значительно отличаться от версии, проверенной 13 марта 2018; проверки требует 31 правка. Текущая версия страницы пока не проверялась опытными участниками и может значительно отличаться от версии, проверенной 13 марта 2018; проверки требует 31 правка.Циани́д ка́лия, или циа́нистый ка́лий, — калиевая соль синильной кислоты, химическая формула KCN. Бесцветные кристаллы, по фактуре и размерам напоминающие сахарный песок. В больших концентрациях ядовит, как и все цианиды. Хорошо растворим в воде (41,7 % по массе при 25 °C, 55 % при 100 °C). Плохо растворим в этаноле, не растворяется в углеводородах.
Циановодород, выделяющийся при гидролизе цианида калия, для некоторых людей имеет запах горького миндаля, для некоторых остается без запаха. Предполагается, что это различие обусловлено генетически[2].
Цианид калия в лаборатории получают взаимодействием синильной кислоты с концентрированным гидроксидом калия:
- HCN+KOH→KCN+h3O{\displaystyle {\rm {{HCN}+{\rm {{KOH}\rightarrow {\rm {{KCN}+{\rm {H_{2}O}}}}}}}}}
Цианид калия можно получить реакцией амида калия с коксующимся углём при температуре 500-600 градусов[3].
- KNh3+C→KCN+h3↑{\displaystyle {\rm {{KNH_{2}}+{\rm {{C}\rightarrow {\rm {{KCN}+{\rm {{H_{2}}\uparrow }}}}}}}}}
Также цианид калия можно получить из хлороформа, аммиака и гидроксида калия:
- CHCl3+Nh4+4KOH→KCN+3KCl+4h3O{\displaystyle {\rm {{CHCl_{3}}+{\rm {{NH_{3}}+{\rm {{4KOH}\rightarrow {\rm {{KCN}+{\rm {{3KCl}+{\rm {4H_{2}O}}}}}}}}}}}}}
Цианистый калий выделил шведский аптекарь Карл Вильгельм Шееле в 1762 году.
Применяется в процессе добычи золота и серебра из руд (цианирование):
- 4Au+8KCN+O2+2h3O→4K[Au(CN)2]+4KOH{\displaystyle {\rm {{4Au}+{\rm {{8KCN}+{\rm {{O_{2}}+{\rm {{2H_{2}O}\rightarrow {\rm {{4K[Au(CN)_{2}]}+{\rm {4KOH}}}}}}}}}}}}},
а также в гальванотехнике цинка, кадмия, меди, серебра и золота, в том числе для ювелирного дела.
Так как синильная кислота, соответствующая цианид-иону, очень слабая, то она легко вытесняется из солей более сильными кислотами. Так, например, на воздухе цианид калия со временем превращается в нетоксичный карбонат калия (поташ) в результате реакции с углекислым газом и водой:
- 2KCN+CO2+h3O→K2CO3+2HCN↑{\displaystyle {\rm {{2KCN}+{\rm {{CO}_{2}+{\rm {{H_{2}O}\rightarrow {\rm {{K_{2}CO_{3}}+{\rm {{2HCN}\uparrow }}}}}}}}}}}
Формально в этом процессе принимает участие нестабильная слабая угольная кислота, которая вытесняет из соли синильную кислоту.
 Потенциально смертельная доза цианистого калия (140 мг)
Потенциально смертельная доза цианистого калия (140 мг)Сильнейший неорганический яд. При попадании через пищеварительный тракт смертельная доза для человека 1,7 мг/кг. В результате употребления клетки теряют способность усваивать кислород из крови и организм погибает от внутритканевого кислородного голодания.
Калий и его характеристики
Общая характеристика калия
Калий не встречается в природе в свободном состоянии. Наиболее важными минералами калия являются: сильвин KCl, сильвинит NaCl×KCl, карналлит KCl×MgCl2×6H2O, каинит KCl×MgSO4×3H2O.
В виде простого вещества калий представляет собой блестящий серебристо-серый металл (рис. 1) с объемно-центрированной кристаллической решеткой. Исключительно реакционноспособный металл: на воздухе быстро окисляется, образуя рыхлые продукты взаимодействия.
Рис. 1. Калий. Внешний вид.
Атомная и молекулярная масса калия
Относительной молекулярная масса вещества (Mr) – это число, показывающее, во сколько раз масса данной молекулы больше 1/12 массы атома углерода, а относительная атомная масса элемента (Ar) — во сколько раз средняя масса атомов химического элемента больше 1/12 массы атома углерода.
Поскольку в свободном состоянии калий существует в виде одноатомных молекул K, значения его атомной и молекулярной масс совпадают. Они равны 39,0983.
Изотопы калия
Известно, что в природе калий может находиться в виде двух стабильных изотопов 39Kи 41K. Их массовые числа равны 39 и 41 соответственно. Ядро атома изотопа калия 39K содержит девятнадцать протонов и двадцать нейтронов, а изотопа 41K – такое же количество протонов идвадцать два нейтрона.
Существуют искусственные изотопы калия с массовыми числами от 32-х до 55-ти, среди которых наиболее стабильным является 40K с периодом полураспада равным 1,248×109 лет.
Ионы калия
На внешнем энергетическом уровне атома калия имеется один электрон, который является валентным:
1s22s22p63s23p64s1.
В результате химического взаимодействия калий отдает свой единственный валентный электрон, т.е. является его донором, и превращается в положительно заряженный ион:
К0-1e → Л+.
Молекула и атом калия
В свободном состоянии калий существует в виде одноатомных молекул Л. Приведем некоторые свойства, характеризующие атом и молекулу калия:
|
Энергия ионизации атома, эВ |
4,34 |
|
Относительная электроотрицательность |
0,82 |
|
Радиус атома, нм |
0,235 |
Примеры решения задач
Гидроксид калия, характеристика, свойства и получение, химические реакции
Гидроксид калия, характеристика, свойства и получение, химические реакции.
Гидроксид калия – неорганическое вещество, имеет химическую формулу KOH.
Краткая характеристика гидроксида калия
Физические свойства гидроксида калия
Получение гидроксида калия
Химические свойства гидроксида калия
Химические реакции гидроксида калия
Применение и использование гидроксида калия
Краткая характеристика гидроксида калия:
Гидроксид калия – неорганическое вещество белого цвета.
Химическая формула гидроксида калия KOН.
Обладает высокой гигроскопичностью, но меньшей чем у гидроксида натрия. Активно поглощает пары воды из воздуха.
Хорошо растворяется в воде, при этом выделяя большое количество тепловой энергии.
Гидроксид калия – едкое, токсическое и коррозионно-активное вещество. Оно относится к веществам второго класса опасности. Поэтому при работе с ним требуется соблюдать осторожность. При попадании на кожу, слизистые оболочки и в глаза образуются серьёзные химические ожоги.
Физические свойства гидроксида калия:
| Наименование параметра: | Значение: |
| Химическая формула | KOН |
| Синонимы и названия иностранном языке | potassium hydroxide (англ.) едкое кали (рус.) калия гидроокись (рус.) |
| Тип вещества | неорганическое |
| Внешний вид | бесцветные моноклинные кристаллы |
| Цвет | белый, бесцветный |
| Вкус | —* |
| Запах | — |
| Агрегатное состояние (при 20 °C и атмосферном давлении 1 атм.) | твердое вещество |
| Плотность (состояние вещества – твердое вещество, при 20 °C), кг/м3 | 2044-2120 |
| Плотность (состояние вещества – твердое вещество, при 20 °C), г/см3 | 2,044-2,12 |
| Температура кипения, °C | 1327 |
| Температура плавления, °C | 380−406 |
| Гигроскопичность | высокая гигроскопичность |
| Молярная масса, г/моль | 56,1056 |
* Примечание:
— нет данных.
Получение гидроксида калия:
Гидроксид калия в промышленном масштабе получается в результате электролиза хлористого калия с твердым асбестовым катодом (диафрагменный метод производства), с полимерным катодом (мембранный метод производства), с жидким ртутным катодом (ртутный метод производства).
Основной тенденцией в мировом производстве гидроксида калия в последние 10 лет является переход производителей на мембранный метод электролиза.
Химические свойства гидроксида калия. Химические реакции гидроксида калия:
Гидроксид калия – химически активное вещество, сильное химическое основание.
Водные растворы KOH имеют сильную щелочную реакцию.
Химические свойства гидроксида калия аналогичны свойствам гидроксидов других щелочных металлов. Поэтому для него характерны следующие химические реакции:
1. реакция гидроксида калия с натрием:
KOH + Na → NaOH + K (t = 380-450 °C).
В результате реакции образуются гидроксид натрия и калий.
2. реакция гидроксида калия с хлором:
2KOH + Cl2 → KCl + KClO + H2O.
В результате реакции образуются хлорид калия, гипохлорит калия и вода. При этом гидроксид калия в качестве исходного вещества используется в виде холодного концентрированного раствора.
3. реакция гидроксида калия с йодом:
6KOH + 3I2 → 5KI + KIO3 + H2O (t = 80 °C).
В результате реакции образуются йодид калия, иодат калия и вода. При этом гидроксид калия в качестве исходного вещества используется в виде горячего концентрированного раствора.
4. реакция гидроксида калия с алюминием и водой:
2Al + 2KOH + 6H2O → 2K[Al(OH)4] + 3H2.
В результате реакции образуются тетрагидроксоалюминат калия и водород. При этом гидроксид калия в качестве исходного вещества используется в виде горячего концентрированного раствора.
5. реакция гидроксида калия с цинком и водой:
Zn + 2KOH + 2H2O → K2[Zn(OH)4] + H2.
В результате реакции образуются тетрагидроксоцинкат натрия и водород.
6. реакция гидроксида калия с ортофосфорной кислотой:
H3PO4 + KOH → KH2PO4 + H2O.
В результате реакции образуются дигидроортофосфат калия и вода. При этом в качестве исходных веществ используются: фосфорная кислота в виде концентрированного раствора, гидроксид калия в виде разбавленного раствора.
Аналогично проходят реакции гидроксида калия и с другими кислотами.
7. реакция гидроксида калия с сероводородом:
H2S + KOH → KHS + H2O.
В результате реакции образуются гидросульфид калия и вода. При этом гидроксид калия в качестве исходного вещества используется в виде разбавленного раствора.
8. реакция гидроксида калия с фтороводородом:
HF + KOH → KF + H2O,
2HF + KOH → KHF2 + H2O.
В результате реакции образуются в первом случае – фторид калия и вода, во втором – гидрофторид калия и вода. При этом гидроксид калия и фтороводород в первом случае в качестве исходного вещества используются в виде разбавленного раствора, во втором случае гидроксид калия и фтороводород используются в виде в виде концентрированного раствора.
9. реакция гидроксида калия с бромоводородом:
HBr + KOH → KBr + H2O.
В результате реакции образуются бромид калия и вода.
10. реакция гидроксида калия с йодоводородом:
HI + KOH → KI + H2O.
В результате реакции образуются йодид калия и вода.
11. реакция гидроксида калия с оксидом алюминия:
Al2O3 + 2KOH → 2KAlO2 + H2O (t = 900-1100 °C).
Оксид алюминия является амфотерным оксидом. В результате реакции образуются алюминат калия и вода. Реакция протекает при спекании исходных веществ.12. реакция гидроксида калия с оксидом алюминия и водой:
Al2O3 + 2KOH + 3H2O → 2K[Al(OH)4].
Оксид алюминия является амфотерным оксидом. В результате реакции образуется тетрагидроксоалюминат калия. При этом гидроксид калия в качестве исходного вещества используется в виде горячего концентрированного раствора.13. реакция гидроксида калия с оксидом углерода (углекислым газом):
KOH + CO2 → KHCO3,
2CO3 + KOH → KCO3 + H2O.
Оксид углерода является кислотным оксидом. В результате реакции образуются в первом случае – гидрокарбонат калия, во втором случае – карбонат калия и вода. Реакция в первом случае происходит в этаноле.
14. реакция гидроксида калия с оксидом серы:
SO2 + KOH → KHSO3,
2SO3 + KOH → K2SO3 + H2O.
Оксид серы является кислотным оксидом. В результате реакции образуются в первом случае – гидросульфит калия, во втором случае – сульфит калия и вода. Реакция в первом случае происходит в этаноле.
15. реакция гидроксида калия с оксидом кремния:
4KOH + 2SiO2 → K2SiO3 + K2Si4O5 + 2H2O (t = 900-1000 °C),
6KOH + 5SiO2 → K4SiO4 + K2Si4O9 + 3H2O.
В результате реакции образуются в первом случае – метасиликат калия, метатетрасиликат калия и вода, вот втором случае – ортосиликат калия, тетрасиликат калия и вода. При этом гидроксид калия в качестве исходного вещества используется во втором случае в виде концентрированного раствора.
16. реакция гидроксида калия с гидроксидом алюминия:
Al(OH)3 + KOH → KAlO2 + 2H2O (t = 1000 °C),
Al(OH)3 + KOH → K[Al(OH)4].
Гидроксид алюминия является амфотерным основанием. В результате реакции образуются в первом случае – алюминат калия и вода, во втором случае – тетрагидроксоалюминат натрия. При этом гидроксид калия в качестве исходного вещества используется во втором случае в виде концентрированного раствора.
17. реакция гидроксида калия с гидроксидом цинка:
Zn(OH)2 + 2KOH → K2[Zn(OH)4].
Гидроксид цинка является амфотерным основанием. В результате реакции образуется тетрагидроксоцинкат калия.
18. реакция гидроксида калия с сульфатом железа:
FeSO4 + 2KOH → Fe(OH)2 + K2SO4.
В результате реакции образуются гидроксид железа и сульфат калия.
19. реакция гидроксида калия с хлоридом меди:
CuCl2 + 2KOH → Cu(OH)2 + 2KCl.
В результате реакции образуются гидроксид меди и хлорид калия.
20. реакция гидроксида калия с хлоридом алюминия:
AlCl3 + 3KOH → Al(OH)3 + 3KCl.
В результате реакции образуются гидроксид алюминия и хлорид калия.
Аналогично проходят реакции гидроксида калия и с другими солями.
Применение и использование гидроксида калия:
Гидроксид калия используется во множестве отраслей промышленности и для бытовых нужд:
– в целлюлозно-бумажной промышленности – в производстве бумаги, картона, искусственных волокон, древесно-волоконных плит;
– для омыления жиров при производстве мыла, шампуня и других моющих средств;
– в химической и нефтехимической отраслях промышленности – как универсальное химическое соединение;
– для изготовления биодизельного топлива – получаемого из растительных масел и используемого для замены обычного дизельного топлива;
– в пищевой промышленности: для мытья и очистки фруктов и овощей от кожицы, в качестве регулятора кислотности. Зарегистрирован в качестве пищевой добавки E-525;
– в щелочных (алкалиновых) батарейках – в качестве электролита;
– в фотографии.
Примечание: © Фото //www.pexels.com, //pixabay.com




карта сайта
гидроксид калия реагирует кислота 1 2 3 4 5 вода
уравнение реакций соединения масса взаимодействие гидроксида калия
реакции с оксидом натрия
Коэффициент востребованности 1 338
свойства, получение и применение :: SYL.ru
Всего в природе существует три класса неорганических соединений: соли, оксиды и гидроксиды. Также в отдельный класс выделяют такие вещества, как СІ2, І2 и подобные им, состоящие только из одного химического элемента.
Классификация гидроксидов

Это один из трех существующих классов неорганических соединений. Они делятся на кислоты, основания и амфотерные вещества. Первые состоят из катиона Н+ и аниона в виде кислотного остатка, к примеру, СІ-. Структура вторых включает в себя катион какого-либо металла, например, Са+, а также анион в виде гидроксильной группы ОН-. Последние характеризуются тем, что одновременно обладают химическими свойствами, присущими кислотам и основаниям. К таким гидроксидам можно отнести соединения алюминия и железа. Основания, как и другие неорганические вещества, можно разделить на группы в зависимости от их химической активности. Самыми сильными в этом плане считаются гидроксид калия и натрия, которые еще называют щелочами. Они быстро вступают в реакцию с различными веществами.
Физические свойства
Данное вещество в нормальных условиях (при комнатной температуре и невысоком давлении) пребывает в твердом агрегатном состоянии. Оно выглядит как небольшого размера кристаллы, которые не имеют цвета и запаха, хорошо растворимы в воде. Эти кристаллы обладают чрезвычайно высокой гигроскопичностью. Пребывая долго на открытом воздухе, они расплываются и превращаются в раствор, поглощая из атмосферы влагу. Такое же явление наблюдается и с гидроксидом натрия, гигроскопичность которого еще выше.
Другие названия гидроксида калия
В просторечье данное вещество именуется едким калием, а также каустическим поташем и калиевым щёлоком.
Химические свойства
Рассматриваемое вещество обладает всеми особенностями, которые характерны для оснований. Его щелочные свойства очень ярко выражены, как и у гидроксида натрия. При горении гидроксид калия выделяется оксид данного металла и вода. К2О имеет светло-желтую окраску.
Взаимодействие с солями
Соли — вещества, состоящие из катиона какого-либо металла и аниона, представленного кислотным остатком. Образуются они в основном при взаимодействии активных металов с кислотами. Происходит реакция замещения, при которой кроме соли образуется водород, выделяющийся в виде газа. При реакции с веществами данного класса образуется уже другая соль с содержанием калия, а также гидроксид какого-либо металла. Например, при взаимодействии данного вещества с хлоридом меди образуется гидроксид меди и хлорид калия, выпадающий в осадок. Для того чтобы провести такого рода реакцию, необходимо взять щелочь и хлорид меди в таких пропорциях, чтобы на две молекулы первого вещества приходилась одна второго, то есть соотношение полученных веществ будет таким: на одну молекулу гидроксида купрума две хлорида калия. Такого рода взаимодействия называются реакциями обмена. Чтобы они могли осуществляться, нужно соблюсти следующие условия: один из продуктов взаимодействия должен либо выпадать в осадок, либо испаряться в виде газа, либо становиться водой. Металл, входящий в состав соли, должен быть менее химически активным, нежели калий (все, кроме лития).

Реакции с кислотами
Все основания, в том числе и гидроксид калия, способны взаимодействовать с кислотами. Самая распространенная и часто используемая реакция — та, в которой участвует рассматриваемое вещество и серная кислота. Гидроксид калия в таком случае нужен в таком количестве, чтобы на одну молекулу кислоты приходилось две — данного соединения. При подобного рода реакции образуются такие вещества, как сульфат калия и вода в молярном соотношении один к двум. Подобный химический процесс активно используется в промышленности, так как полученный продукт широко применяется повсеместно.
Что будет, если добавить его к оксиду?
В таком случае также произойдет, по сути, реакция обмена. К примеру, если смешать гидроксид калия и диоксид железа в молярном соотношении два к одному, можно получить гидроксид (ІІ) ферума, выпадающий в темно-зеленый осадок, а также оксид калия в таких пропорциях, что на одну молекулу первого вещества будет приходиться одна второго.
Основные способы получения гидроксида калия
В промышленности чаще всего его добывают путем электролиза раствора калий хлорида. Получение гидроксид калия — это процесс, при котором кроме добываемого вещества образуются Н2 и СІ2.

Использование в промышленности
В основном данное вещество используется в сфере изготовления мыла и других чистящих средств. В этом процессе используется реакция рассматриваемого соединения с каким-либо жиром. Для такой же цели можно использовать и гидроксид натрия. Также рассматриваемое в этой статье вещество широко применяется в химической промышленности для получения разнообразных соединений калия, в первую очередь — его сульфата.

Реакция, при которой он образуется, была рассмотрена нами выше. В этой же сфере его используют как соединение, поглощающее газы, такие как сероводород, диоксид серы, углекислый газ. Также он выступает в роли осушителя благодаря своим высоким гигроскопическим свойствам. Его можно использовать для определения уровня концентрации кислот в растворе. Кроме того, гидроксид применяется и в пищевой промышленности. Здесь его используют в качестве пищевой добавки Е525. Он выступает регулятором кислотности. Встретить его можно в составе какао, шоколада и других аналогичных продуктов. Применяют гидроксид калия при обработке целлюлозы, для получения вискозы, используют в щелочных аккумуляторах, добавляют в состав средств для мытья посуды или очистки разных поверхностей, для обработки хлопковой ткани и придания ей большей гигроскопичности.

Соединения калия, получаемые из его гидроксида, и их применение
Чаще всего рассматриваемое вещество используется для того, чтобы добыть сульфат калия, который применяется в качестве удобрения. Им подкармливают растения во время вегетационного периода. Также он применяется как эмульгатор в пищевой промышленности — он дает возможность получить однородную массу, состоящую из компонентов, которые не смешиваются при обычных условиях. Для его обозначения используют маркировку Е515. Также он может, как и гидроксид калия, выступать в качестве регулятора кислотности. Сульфат часто используют как заменитель соли. Кроме того, данное вещество находит свое применение в фармакологии при производстве биологически активных добавок, а также при изготовлении красителей. Кроме этого, его используют и в стекольной промышленности.
Гидроксид калия и человеческий организм
В виде концентрированного раствора данное химическое соединение является опасным для живых организмов. Попадание его на кожу или слизистые оболочки может привести к серьезным поражениям. Концентрированный раствор гидроксида калия причиняет более сильные ожоги, чем кислоты. Также он способен растворять многие органические соединения. Данное вещество относят ко второму классу опасности, то есть при работе с ним необходимо соблюдать особые правила. Избыточное количество гидроксид калия в организме приводит к возникновению новых кожных заболеваний или обострению хронических.

