Витамин В7 – биотин (витамин H, Vitamin B7, Biotin, Vitamin H)
Метод определения ВЭЖХ-МС/МС (высокоэффективная жидкостная хроматография с тандемной масс-спектрометрией).
Исследуемый материал Плазма крови (ЭДТА)
Доступен выезд на дом
Синонимы: Коэнзим R; Кофермент R.
В7; Coenzyme R.
Краткая характеристика определяемого вещества Витамин В7 – биотин
Биотин – известный также как витамин В7 и витамин H – водорастворимый витамин группы В, является кофактором пяти важнейших карбоксилаз, участвующих в синтезе и катаболизме жирных кислот, метаболизме аминокислот, глюконеогенезе. Присоединение биотина к этим карбоксилазам катализирует фермент синтаза голокарбоксилаз (Holocarboxylase synthetase – HLCS), а фермент биотинидаза освобождает биотин из продуктов распада карбоксилаз, делая его доступным для нового цикла.
Хорошими пищевыми источниками биотина служат субпродукты (печень, почки), яйца, дрожжи, молоко. В зерновых, фруктах, большинстве овощей и мясе его содержание меньше. Существенные количества биотина могут синтезироваться микрофлорой кишечника человека.
При каких состояниях может развиться дефицит витамина В7 в организме
Недостаток поступления витамина В7, связанный с диетой, и генетические дефекты ферментов, участвующих в его обмене (биотинидазы, реже – HLCS) могут приводить к дефициту биотина в организме. Нехватка этого витамина в организме отмечается нечасто.
Документированные клинические случаи описаны при длительном потреблении сырых яичных белков (которые содержат биотин-связывающий белок авидин) или при почти исключительно парентеральном питании без добавок биотина, а также у лиц с врожденными нарушениями его метаболизма. Пищевая нехватка витамина может усугубляться состоянием микрофлоры, которая продуцирует биотин, например, на фоне применения антибиотиков.
Как может проявляться дефицит витамина В7 в организме
Клинические проявления явного дефицита биотина включают анорексию, тошноту, рвоту; глосситы; дерматит; конъюнктивит; алопецию; атаксию; гипотонию; кетолактацидоз/органическую ацидурию; судороги; кожные инфекции; истончение волос; высыпания на коже вокруг глаз, носа и рта; нарушение иммунной функции; задержки развития у детей.
В каких случаях используют препараты витамина В7
Биотин применяют в клинической практике для лечения его дефицита при генетических нарушениях, высокодозовые добавки этого витамина могут применять при прогрессирующем рассеянном склерозе (механизмы его благоприятного действия при этой патологии еще устанавливаются).
Биотин набирает популярность и широко рекламируется в связи с его декларируемыми эффектами на здоровье волос и рост ногтей. Хотя благоприятное действие этого витамина на волосы и ногти действительно установлено для лиц с приобретенной или врожденной нехваткой данного витамина, нет достаточных данных о его пользе для здоровых людей при нормальном статусе биотина в организме. Лицам, использующим препараты биотина, следует учитывать, что фармакологические дозы биотина могут давать интерференции и искажения результатов различных лабораторных иммунохимических исследований (например, при иммуноферментном анализе – ИФА), использующих в реагентах биотин-стрептавидиновую систему (могут применяться при определении гормонов, маркеров различных заболеваний).
С какой целью определяют уровень витамина В7 в сыворотке крови
Тест применяют для оценки статуса витамина В7 (биотина) в организме.
Что может повлиять на результат теста «Витамин В7»
Концентрация биотина в плазме может колебаться в течение дня и не всегда служит надежным маркером статуса витамина.
Биотин (Витамин B7) — описание ингредиента, инструкция по применению, показания и противопоказания
Описание биотина
Биотин – водорастворимый витамин B₇. Иногда его называют коферментом R либо витамином H. Соединение участвует в процессах глюконеогенеза и обмена веществ, необходимо для полноценного функционирования нервной и сердечно-сосудистой систем, желудочно-кишечного тракта.
Внимание! Частично биотин синтезируется микрофлорой кишечника. Но этого количества витамина недостаточно для покрытия потребности в нем организма. Поэтому каждый человек должен позаботиться об его поступлении извне: с пищей или добавками.
Физико-химические свойства
Биотин хорошо растворим в воде и спиртах.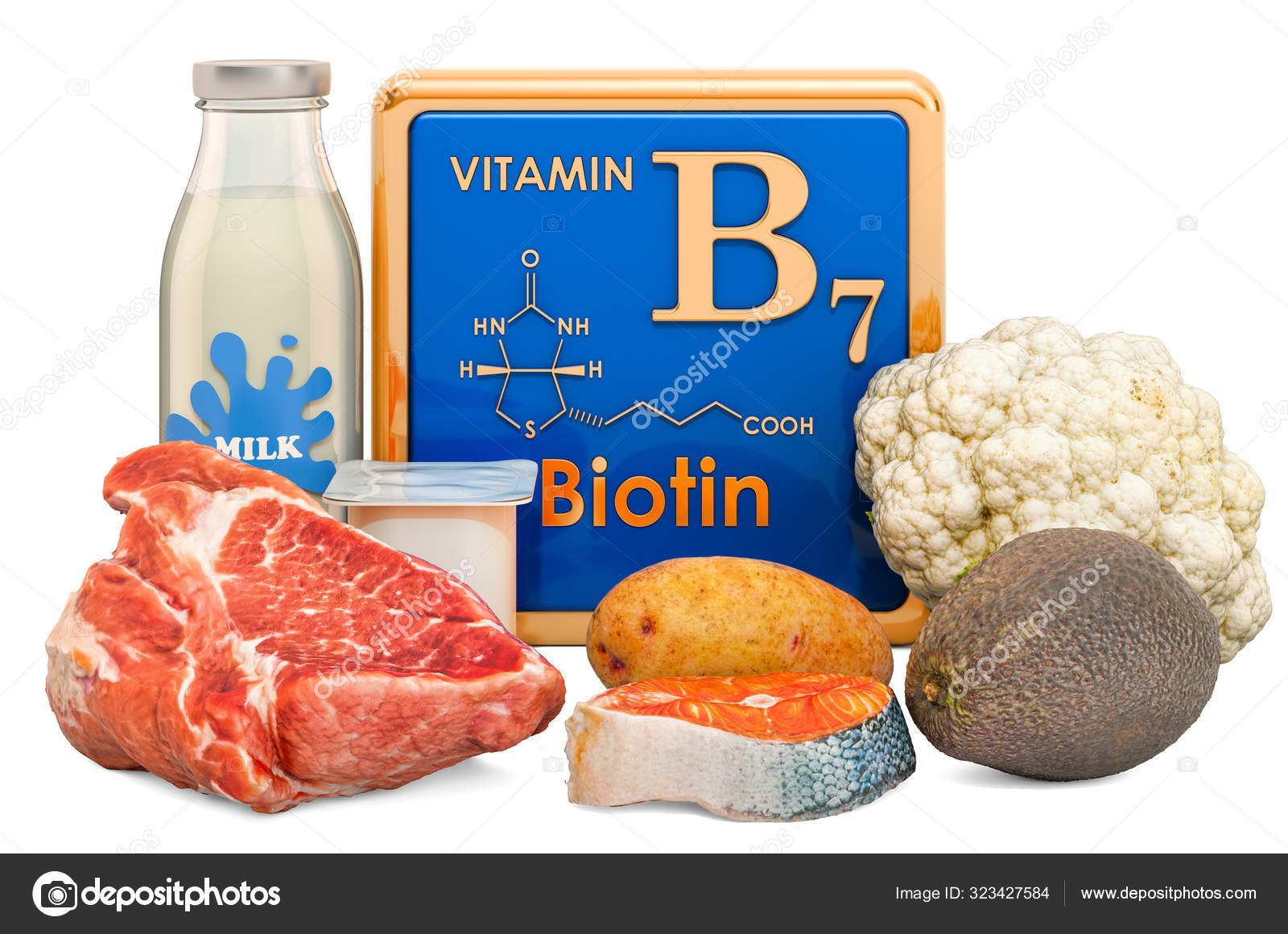 Плохо – в жирах и эфирах. Он не разрушается под УФ-лучами, но не устойчив при взаимодействии с едкими щелочами.
Плохо – в жирах и эфирах. Он не разрушается под УФ-лучами, но не устойчив при взаимодействии с едкими щелочами.
Влияние на организм и нормы
Витамин H необходим для правильного протекания энергетического метаболизма. Он регулирует уровень глюкозы в крови, защищает от разрушения клетки мозга, участвует в клеточном делении, поддерживает нормальное функционирование надпочечников, щитовидной железы, сердечно-сосудистой системы. Всего этого достаточно, чтобы осознать его важность для здоровья. Однако это лишь малая часть его функций.
Витамина B₇ регулирует протекание всех реакций в организме, контролирует уровень ферментов. Его используют для улучшения эффективности лечения псориаза, облысения, депрессии, экземы, сахарного диабета, истощения, психоневрологических нарушений.
Потребность в биотине рассчитывается индивидуально для каждого человека, исходя из количества потребляемых им калорий: на 1000 ккал требуется 100 мкг витамина. В среднем, для мужчин она составляет 300 мкг, а для женщин – 250 мкг. Но здесь важно учесть, что большая часть соединения, при условии полноценной работы ЖКТ, синтезируется в организме. То есть тем, у кого нет проблем со здоровьем, нужно получать дополнительно лишь ⅕ часть витамина от суточной нормы.
В среднем, для мужчин она составляет 300 мкг, а для женщин – 250 мкг. Но здесь важно учесть, что большая часть соединения, при условии полноценной работы ЖКТ, синтезируется в организме. То есть тем, у кого нет проблем со здоровьем, нужно получать дополнительно лишь ⅕ часть витамина от суточной нормы.
Дефицит биотина
Биотин синтезируется микрофлорой в кишечнике и усваивается полностью, поскольку не контактирует с соляной кислотой в желудке. Из этого следует вывод, что дефицит витамина в организме может возникнуть из-за дисбаланса микрофлоры. К другим причинам нарушения относят:
- прием антибиотиков;
- злоупотребление алкоголем;
- прием оральных контрацептивов;
- строгую диета и, как следствие, резкое похудение;
- недостаток биотинидазы, при котором снижается эффективность всасывания B₇;
- скудный рацион – биотин выводится с мочой и не откладывается на черный день.

При дефиците витамина наблюдаются дерматиты и судороги, ухудшается цвет кожи лица, повышается ломкость волос, возрастает уровень сахар в крови, возникает хроническая усталость, нарушается пищеварение, происходят резкие перепады настроения. Человек может впасть в депрессию. Иногда страдает память, развивается анемия, появляется ранняя седина.
Переизбыток биотина
Избыток биотина в организме – явление редкое, поскольку он выводится с мочой. Но возможно возникновение индивидуальной реакции на активное вещество.
Внимание! Длительный прием высоких доз кофермента чреват развитием аллергической реакции, учащением мочеиспускания, повышением потоотделения. В этом случае нужно немедленно прервать прием биотина, начать больше пить и принять энтеросорбент, к примеру, активированный уголь.
Оценка обеспеченности организма
Для определения уровня обеспеченности организма биотином проводится сравнительный анализ его выведения с мочой.
Пищевые источники
Биотин содержится в продуктах и растительного, и животного происхождения. К ним относят:
- свиную и говяжью печень;
- бобы и сою;
- миндаль;
- рисовые отруби;
- цельные зерна;
- желтки яиц;
- сардины;
- цветную капусту;
- грибы.
Внимание! Лучший источник витамина B₇ – кисломолочные продукты, обогащенные бифидодобавками. В них есть не только биотин, но и микроорганизмы, необходимые для поддержания здоровой микрофлоры, от которой зависит его естественный синтез.
Профилактическое и лечебное применение
Суточная норма биотина для взрослых – 20–30 мкг. При некоторых болезнях она может достигать 50 мкг. До 18 лет достаточно принимать по 5–12 мкг соединения.
Для профилактики можно принимать по 1 или 2 таблетки препарата биотина с дозировкой активного вещества, равной 5 мкг. При наличии проблем с волосами и ногтями можно увеличить дозу до 2,5 мг витамина в день. А при мальабсорбции – до 10 мг. Лечебную дозировку биотина должен определять врач. Принимают его в процессе или перед едой, обильно запивая водой.
МНОГОЛИКИЙ ВИТАМИН. КАК РАСПОЗНАТЬ НЕДОСТАТОК БИОТИНА В ОРГАНИЗМЕ
Историческая справка.
Биотин был открыт в 1901 году ученым Уильдерсом, который установил вещество для роста дрожжей и назвал его «биосом», что с греч. означает «жизнь».
Дальнейшие исследования биотина продолжил биолог Бетеман в 1916 году. Он кормил лабораторных крыс сырым яичным белком как основным источником протеинов, и в итоге заметил, что у животных выпадала шерсть, появились поражения кожи и нарушения мышечных функций. Затем он заменил свежий белок на варёный, что позволило избежать появления вышеперечисленных симптомов.
Дело в том, что сырые яйца содержат специфический белок — авидин, который связывает биотин и препятствует его всасыванию в кишечнике. Если же питаться не сырыми, а вареными яйцами, то недостатка в биотине не наблюдается, поскольку в результате тепловой денатурации авидин теряет способность связывать биотин.
Какую функцию в организме выполняет биотин?Биотин необходим для работы 9 ферментативных систем.
Он участвует в обмене углеводов, белков, жиров, обладает высокой активностью. С помощью биотина организм получает энергию из белков, жиров и углеводов. Биотин нужен для нормальной работы желудка и кишечника, он оказывает липотропное действие (способен уменьшать накопление жира в печени) и является фактором роста.
В биотине находится сера, важная для здоровья кожи, ногтей и волос — поэтому его прозвали «витамином красоты». Это витамин для кожи и волос, он предотвращает облысение и поседение.
По последним данным, биотин играет важную роль в углеводном обмене, взаимодействуя с гормоном поджелудочной железы инсулином. Кроме того, биотин участвует в производстве так называемой глюкокиназы, вещества, которое «запускает» обмен глюкозы. Глюкокиназа вырабатывается в печени, там же, где хранится биотин. Это особенно важно для диабетиков, у которых содержание глюкокиназы в печени понижено.
Кроме того, биотин участвует в производстве так называемой глюкокиназы, вещества, которое «запускает» обмен глюкозы. Глюкокиназа вырабатывается в печени, там же, где хранится биотин. Это особенно важно для диабетиков, у которых содержание глюкокиназы в печени понижено.
У биотина есть еще и другие задачи. Например, он помогает усваивать белок и в обмене веществ является важным союзником других витаминов группы B, таких как фолиевая и пантотеновая кислоты и витамин B12.
«Враги» биотина
Суточная потребность в биотине составляет 30–100 мкг для взрослых и от 10 до 50 мкг для детей. С пищей поступает достаточное для организма количество биотина. Помимо этого он частично синтезируется микрофлорой кишечника.
В то же время существуют так называемые враги биотина, которые препятствуют его синтезу и нормальному усвоению в организме. В частности, сырой яичный белок о котором мы говорили выше, содержит гликопротеид авидин, являющийся антагонистом биотина и обладающий способностью образовывать с ним в организме биологически неактивный комплекс. Соответственно при избытке авидина может развиться биотиновая недостаточность.
Соответственно при избытке авидина может развиться биотиновая недостаточность.
Несовместимы с биотином и продукты, которые содержат сернистые соединения в качестве консервантов. Дело в том, что сернистый ангидрид, образующийся при нагревании таких продуктов, а также при контакте их с воздухом, разрушает биотин.
Помимо этого, усвоению биотина препятствуют антибиотики, нарушающие баланс кишечной микрофлоры, нерациональное питание (изнурение диетами), нарушения пищеварения, злоупотребление алкоголем.
Дефицит биотина: тревожные признаки
Основные признаки недостаточности биотина в организме можно заметить невооруженным глазом. Поскольку данный витамин контролирует обмен жиров, он влияет на функцию сальных желез, поэтому при его дефиците кожа становится сухой, приобретает нездоровый оттенок и начинает шелушиться. Развивается дерматит на руках, ногах, щеках. Одновременно с этим снижается тургор кожи и образуются ранние морщины.
Волосы становятся тусклыми и ломкими, появляется перхоть. Более ломкими также становятся и ногти. О том, что организму не хватает биотина, могут свидетельствовать бледный гладкий язык, а также ощущение «песка» в глазах, слабая эрекция и раннее семяизвержение у мужчин. Также недостаток биотина может сопровождаться сонливостью, мышечной слабостью, депрессией, ухудшением памяти, потерей аппетита, гипергликемией и анемией.
Более ломкими также становятся и ногти. О том, что организму не хватает биотина, могут свидетельствовать бледный гладкий язык, а также ощущение «песка» в глазах, слабая эрекция и раннее семяизвержение у мужчин. Также недостаток биотина может сопровождаться сонливостью, мышечной слабостью, депрессией, ухудшением памяти, потерей аппетита, гипергликемией и анемией.
Продукты, содержащие Витамин Н
В малых количествах биотин содержится в подавляющем большинстве продуктов питания. При этом наиболее богаты биотином печень и почки крупных животных, дрожжи, бобовые (соя, арахис), цветная капуста, орехи, вареные яйца, шпинат, свекла.
Биотин содержится также в шампиньонах и белых грибах, листьях земляники и черники, фруктах.
Следует помнить, что биотин легко окисляется под действием кислорода, а процессы его усвоения нарушаются вследствие влияния жиров и масел при длительном воздействии воздуха или высокой температуры. Поэтому полезно употреблять в пищу сырые, или свежеприготовленные продукты, чтобы сохранить этот ценный витамин.
Если все-таки Вы ощущаете нехватку витамина и/или наблюдаете признаки, описанные выше, в помощь придут пищевые добавки, покрывающие суточную потребность Вашего организма в биотине.
Биотин
Обратно в Витамины и минералыКрасота и здоровье кожи
Иммунитет
Волосы и ногти
Обмен веществ
Дневная норма потребления
Мужчины | 50 | мкг | ||
Мужчины старше 60 лет | 50 | мкг | ||
Женщины | 50 | мкг | ||
Женщины старше 60 лет | 50 | мкг | ||
Беременные (2-я половина) | 50 | мкг | ||
Кормящие (1-6 мес. | 50 | мкг | ||
Кормящие (7-12 мес.) | 50 | мкг | ||
Дети (1-3 года) | 10 | мкг | ||
Дети (3-7 лет) | 15 | мкг | ||
Дети (7-11 лет) | 20 | мкг | ||
Мальчики (11-14 лет) | 25 | мкг | ||
Девочки (11-14 лет) | 25 | мкг | ||
Юноши (14-18 лет) | 50 | мкг | ||
Девушки (14-18 лет) | 50 | мкг |
Биотин был открыт в первые годы двадцатого века. Новое вещество получило название от слова «биос», от латинского слова «жизнь». Несколько лет спустя биотин открыли повторно, приняв его за новое вещество, названное «защитным фактором X», «коферментом R», «витамином Н», и только позже стало ясно, что исследователи имеют дело с одним и тем же веществом. Его переименовали в биотин и стали обозначать витамином Н.
Новое вещество получило название от слова «биос», от латинского слова «жизнь». Несколько лет спустя биотин открыли повторно, приняв его за новое вещество, названное «защитным фактором X», «коферментом R», «витамином Н», и только позже стало ясно, что исследователи имеют дело с одним и тем же веществом. Его переименовали в биотин и стали обозначать витамином Н.
Биотин входит в состав 9 ферментативных систем. Он обеспечивает обмен углеводов, белков, жиров, необходим для работы иммунной и нервной системы. Биотин важен для нормальной работы кожи и ее придатков, желудочно-кишечного тракта, служит фактором роста и оказывает липотропное действие.
Этот витамин устойчив к нагреву, воздействию щелочей, кислот и кислорода.
Потребность организма в биотине невелика, он считается одним из самых активных катализаторов.
Биотин частично синтезируется кишечной микрофлорой.
Чем полезен витамин H:
- Необходим для обмена никотиновой кислоты (витамина РР)
- снижает уровень сахара в крови (обладает инсулиноподобной активностью)
- Предотвращает болезни волос (облысение и поседение)
- Облегчает боли в мышцах
- Уменьшает выраженность кожных болезней (дерматита и экземы)
Какие продукты содержат витамин H:
Больше всего биотина в говяжьей печени, яичных желтках, молоке, орехах, фруктах.
Недостаточность витамина H:
Дефицит биотина встречается редко. Причинами возникновения его недостаточности служат: анацидный гастрит, заболевания кишечника, угнетение кишечной микрофлоры после приема антибиотиков и сульфаниламидных препаратов.
Пищевой Н-гиповитаминоз развивается при употреблении большого количества сырых яиц (10-12 штук в день на протяжении 3-10 недель).
Основные признаки недостаточности биотина: начинает шелушиться кожа, затем развивается дерматит на руках, ногах, щеках.
Переизбыток витамина H:
Биотин не оказывает отрицательного воздействия на организм человека даже в больших дозах.
Взаимодействие витамина H с другими веществами
Сырой яичный белок содержит особый белок — авидин. Это вещество является антивитамином по отношению к биотину. Авидин, связывая биотин, препятствует его всасыванию в кишечнике. При нагревании авидин в яичном белке разрушается, поэтому вареные или жареные яйца не затрудняют усвоение биотина.
Для перехода биотина в активную форму обязательно требуется магний, поэтому дефицит магния может привести к недостаточности биотина.
Способность усваивать биотин снижается при употреблении алкогольных напитков, поэтому злоупотребление спиртным также приводит к возникновению дефицита биотина.
Суточная потребность в витамине Н: 0,15-0,3 мг.
Обратно в Витамины и минералы
Как принимать биотин для роста волос
В переполненной области велнеса витаминами и пищевыми добавками вы, возможно, слышали или не слышали о биотине. Биотин, также известный как витамин B7 или витамин H, помогает организму преобразовывать потребляемые вами белки, жиры и углеводы в энергию. В последние годы биотин стал популярным, потому что некоторые люди утверждают, что прием дополнительного биотина может помочь замедлить выпадение волос, укрепить истончение волос или даже отрастить выпавшие волосы. Это утверждение, если оно будет правдой, обеспечило бы огромный рынок для этой конкретной таблетки.
По данным клиники Кливленда, половина мужчин испытывает заметное облысение — научное название — андрогенетическая алопеция или облысение по мужскому типу — к 50 годам. Около 70% всех мужчин в какой-то момент своей жизни теряют волосы. Женщины тоже не застрахованы от выпадения волос. По некоторым оценкам, 50% женщин будут испытывать выпадение волос, причем основной причиной также является андрогенетическая алопеция (так называемая потеря волос по женскому типу у женщин). По оценкам, от этого заболевания страдают около 30 миллионов женщин в США.С. в одиночку.
СВЯЗАННЫЙ: Почему мои волосы выпадают?
Действительно ли биотин работает на рост волос?
Хотя легко найти множество веб-сайтов, рекламирующих биотин для отрастания волос (а также способ улучшить кожу и ломкость ногтей), официальное заявление Управления диетических добавок Национального института здравоохранения США гласит, что «мало научных доказательств в поддержку эти утверждения »и« необходимы дополнительные исследования, прежде чем можно будет рекомендовать биотин при любом из этих состояний.”
«Раньше мы думали, что биотин влияет на рост волос, но сейчас наука более противоречива», — говорит Сандра Марчезе Джонсон, доктор медицины, FAAD, дерматолог, сертифицированный советом Johnson Dermatology в Форт-Смит, Арканзас. «Исследования показывают, что пользы нет».
Дейрдра Хупер, доктор медицинских наук, соучредитель Audubon Dermatology в Новом Орлеане, добавляет: «Хотя некоторые очень небольшие исследования показали некоторое улучшение при заболеваниях волос или ногтей с добавлением биотина … несколько исследований показали, что биотин влияет на многие анализы крови, в том числе щитовидную и сердечную. функциональные тесты.”
Однако не все настолько недовольны биотином. В статье, опубликованной в клинике Кливленда за 2019 год, утверждалось, что дерматологи незаметно прописывали биотин для лечения выпадения волос в течение многих лет, хотя исследования не доказали его пользу для здоровья. Почему? Потому что некоторые считают, что это работает, но не известно, что это вредно.
Сколько биотина нужно принимать?
Рекомендуемое количество биотина, необходимое вам каждый день, является предметом обсуждения и считается, что оно зависит от вашего возраста. Новорожденным младенцам нужно всего 5 микрограммов (мкг) в день, в то время как взрослые должны получать не менее 30 мкг, а кормящим женщинам следует принимать 35 мкг или более.Поскольку биотин содержится во многих продуктах питания, «низкое содержание биотина для кого-либо было бы необычным», — говорит доктор Джонсон.
Доктор Хупер добавляет: «Для взрослых потребление биотина 30 мкг в день легко достигается за счет хорошо сбалансированной диеты, включающей продукты, содержащие биотин, такие как мясо, яйца, рыба, орехи, семена и некоторые овощи, такие как сладкий картофель. , шпинат и брокколи ». Это подчеркивает, что человеку, соблюдающему сбалансированную диету, не нужны добавки биотина.
Если вы решите принимать добавки, биотин можно принимать отдельно или вместе с другими витаминами группы B в поливитаминной форме.Большинство веб-сайтов, рекламирующих биотин для роста волос, рекомендуют принимать 2-5 миллиграммов (2000-5000 мкг) биотина в форме добавок каждый день, и многие добавки продаются под названием Биотин 5000, что указывает на размер 5000 мкг (5 мг). Это намного больше, чем рекомендуют врачи, хотя для большинства людей дополнительный биотин не должен вызывать никаких проблем со здоровьем. Не было описано токсичности избыточного потребления биотина.
«Это витамин B, поэтому передозировка им затруднена — большинство людей будут мочиться то, что им не нужно», — говорит Джонсон.«С учетом сказанного, я предлагаю не принимать больше, чем рекомендованная суточная доза 30–100 мкг в день для взрослого».
В редких случаях люди могут страдать от дефицита биотина (недостаточного количества биотина) из-за генетической ошибки метаболизма, бактериального дисбаланса в желудочно-кишечном тракте или использования определенных лекарств, в том числе противоэпилептических, таких как карбамазепин, фенитоин и фенобарбитал. — и изотретиноин для лечения акне. У пожилых людей, алкоголиков, курильщиков и недоедающих детей также выше вероятность низкого уровня биотина.Обычно симптомы дефицита биотина лечат добавкой 5000 мкг независимо от причины.
Хотя биотин может влиять на некоторые анализы крови (включая тропонин, дигоксин, ферритин, тестостерон, натрийуретический пептид мозга и прогестерон). По данным Mayo Clinic, «побочных эффектов для биотина в дозах до 10 мг (10 000 мкг) в день не зарегистрировано». Тем не менее, многие веб-сайты утверждают, что слишком много биотина может ослабить иммунную систему, повлиять на неврологическую систему, способствовать высокому уровню глюкозы в крови и вызвать проблемы с пищеварением или кожную сыпь.Если вы принимаете биотин в качестве добавки и заметили какой-либо из этих симптомов, обратитесь к врачу. Также рекомендуется прекратить прием биотина за 72 часа до анализа крови, чтобы результаты были более точными.
Лучший биотин для роста волос
Если вы разговаривали с врачом и решили принимать добавку биотина в рамках своего режима ухода за волосами, вы, возможно, знаете, что рынок наводнен добавками биотина, которые все заявляют об одном и том же. Как узнать, какие из них самые лучшие? Ответ зависит от того, что вы ищете конкретно и что считаете важным.
Судя по отзывам, если вы просто хотите биотин без каких-либо других витаминов или питательных веществ, то мерибин высокой эффективности биотин в капсуле 5000 мкг — это надежное имя. Покупатели говорят, что еще один хороший и недорогой выбор — это мягкие капсулы с биотином Nature’s Bounty, которые выпускаются в размерах 5 000 мкг и 10 000 мкг. Если вы ищете немного меньше биотина, некоторые рекомендуют попробовать Solgar Biotin, таблетку на 3000 мкг, веганскую, без ГМО и без глютена. Если вы хотите чего-то, что можно жевать, людям нравятся жевательные конфеты Vitafusion Biotin, которые содержат 5000 мкг и приправлены натуральной черникой без кукурузного сиропа с высоким содержанием фруктозы.
Во многих случаях биотин упаковывают вместе с другими ингредиентами в поливитамины или добавки для роста волос. Они могут быть нацелены на повышение уровня витамина B по всем направлениям или на улучшение здоровья волос, кожи и ногтей. Одной из самых популярных добавок для здоровья волос на рынке является Country Life Maxi-Hair Plus, которая содержит 5000 мкг биотина, а также витамины A, C и E, кальций, фолиевую кислоту, цинк и многое другое. Пользователи говорят, что хорошим выбором для бустера витаминов B является Raw B-комплекс Garden of Life Vitamin Code, который содержит 325 мкг биотина и других витаминов, полученных из сырых, органических фруктов и овощей.
Другие популярные средства для роста волос:
- Zhou Hairfluence, который содержит 5000 мкг биотина, коллагена, гидролизованного кератина и других необходимых витаминов
- Витамины для волос Code Age, содержащие 10 000 мкг биотина и других полезных для волос ингредиентов
- MegaFood Skin, Nails & Hair, который содержит 300 мкг биотина и специальную поддерживающую смесь из органических растений.
- Nutrafol, который содержит 3000 мкг биотина, селена, йода и витаминов C, A и D
- Viviscal, который содержит 120 мкг биотина и запатентованный морской комплекс аминокислот
Домашние средства для роста волос
Независимо от того, принимаете ли вы биотин или нет, вы можете сделать несколько вещей дома, чтобы сделать волосы здоровыми.Возможно, лучше всего начать с изменения диеты или образа жизни. Употребление в пищу таких продуктов, как лосось, тунец и грецкие орехи, богатых омега-3 жирными кислотами, может улучшить здоровье волос. Отказ от сигарет может устранить вред, который курение наносит вашим волосам. А если вы сушите волосы феном или используете горячие инструменты для укладки, знайте, что тепло — частая причина сухих и ломких волос.
«Избегайте травм волос», — советует доктор Джонсон. «Держите кожу головы счастливой с помощью шампуней против перхоти и кондиционеров без воска, а также делайте все, что способствует общему здоровью: сон, ограничение стресса, хорошее питание, увлажнение, упражнения.”
Массаж кожи головы увеличивает приток крови к ней, что способствует росту волос. Вы можете сделать это пальцами или помассировать с помощью кремов или масел. Алоэ вера может помочь разблокировать закупоренные волосяные фолликулы, а кокосовое масло, рыбий жир или касторовое масло могут сделать ваши волосы более блестящими. Эфирные масла, такие как масло розмарина, масло герани и лимонное масло, могут способствовать росту волос, и даже луковый сок может стимулировать отрастание волос и лечить такие состояния, как очаговая алопеция (неоднородное выпадение волос), если вы можете переносить запах.
Чтобы побаловать свои волосы чем-то особенным, попробуйте маску для волос из яичных желтков и оливкового масла (или корицы и оливкового масла). Смешайте ингредиенты и нанесите их на волосы на 30-45 минут перед принятием душа. И каждый день будьте осторожны с волосами, когда расчесываете или укладываете их.
Было доказано, что некоторые лекарства способствуют выпадению волос, в том числе лекарства от артериального давления и холестерина, некоторые антидепрессанты и лекарства, связанные с гормонами, такие как противозачаточные средства и тестостерон.Если вы принимаете какие-либо из этих лекарств, проконсультируйтесь с врачом, прежде чем прекратить их использование, а если более простые меры не помогли, спросите своего врача о лекарствах, которые, как было доказано, помогают отращивать волосы.
«Миноксидил — отличный инструмент, подтверждающий его научными данными», — говорит Хупер. «Многие формы выпадения волос улучшатся с помощью миноксидила». Хупер рекомендует использовать более сильный и эффективный 5% раствор, а не 2% раствор, если только 5% раствор не раздражает вашу кожу или «если вы заметили, что волосы растут там, где вы не хотите, например, на лице.”
Когда обращаться к врачу при выпадении волос
Если вы заметили внезапное облысение, немедленно обратитесь к врачу. Внезапная потеря волос может быть признаком основного заболевания, такого как заболевание щитовидной железы, стригущий лишай, менопауза или беременность. Выпадение волос также может быть признаком реакции на лекарства, используемые для лечения рака, высокого кровяного давления, артрита, депрессии или проблем с сердцем.
Если вы постепенно теряете волосы или замечаете большую часть кожи головы, чем раньше, и у вас есть какие-либо опасения по этому поводу, скорее обратитесь к дерматологу.Выпадение волос может быть необратимым, поэтому чем раньше вы начнете лечить его, тем выше вероятность того, что вы добьетесь лучших результатов.
«Сертифицированный дерматолог является экспертом в диагностике и лечении выпадения волос», — говорит д-р Хупер. «Выпадение волос — это комплексный процесс, который часто имеет ряд причин. Ваш дерматолог поговорит с вами о том, сколько волос вы потеряли, осмотрит вашу кожу головы, кожу и ногти и, возможно, сделает анализ крови или биопсию, чтобы помочь диагностировать вашу проблему и составить план лечения ».
Что такое биотин? — Food Insight
Биотин (произносится как BYE-oh-tin) — это водорастворимый витамин, который необходим нашему организму для обеспечения нас энергией и поддержания здоровья наших волос, ногтей и кожи.Первоначально называемый витамином H, биотин теперь классифицируется как один из витаминов группы B (B7) и приобрел коммерческую популярность благодаря предполагаемым преимуществам для здоровья волос и ногтей.
БИОТИН И ЗДОРОВЬЕБиотин используется в качестве кофактора ферментов, расщепляющих углеводы, белки и жиры. Он также способствует экспрессии генов, функции нервной системы и эндокринной активности поджелудочной железы, щитовидной железы и надпочечников.
В исследовании 2007 года, опубликованном Американским журналом медицинских наук, было показано, что биотин снижает уровень глюкозы в крови натощак у людей с сахарным диабетом 2 типа в сочетании с пиколинатом хрома, добавкой хрома.Биотин доказал свою эффективность в улучшении регуляции уровня сахара в крови за счет усиления функции продуцирующих инсулин клеток поджелудочной железы.
Биотин широко рекламируется за его способность улучшать здоровье наших волос, ногтей и кожи. По данным Американской академии дерматологии, получение достаточного количества биотина с пищей или добавками может улучшить уход за ногтями и способствовать росту и утолщению волос. Систематический обзор влияния биотина на рост волос и ногтей предоставляет доказательства «клинического улучшения у пациентов, у которых была основная патология, связанная с плохим ростом волос или ногтей.Однако нет достаточных доказательств того, что биотин может быть добавлен здоровым людям.
РЕКОМЕНДУЕМЫЕ ПРИЕМЫЛюди не могут накапливать биотин, поэтому ежедневное употребление богатых биотином продуктов важно для получения адекватных количеств, необходимых для регуляции генов и метаболизма. Адекватное потребление (AI) биотина у взрослых в возрасте 19 лет и старше составляет 30 микрограммов (мкг) в день из всех источников, включая продукты питания и добавки. Детям и подросткам рекомендуется принимать от 5 до 25 мкг в день, а кормящим женщинам — 35 мкг в день.Когда биотин используется для ухода за волосами и ногтями, он обычно употребляется в виде пищевой добавки. FDA выпустило предупреждение о том, что было обнаружено, что слишком много биотина из пищевых добавок мешает определенным лабораторным тестам, поэтому важно потреблять близкие к рекомендуемым количествам и использовать любые добавки с одобрения поставщика медицинских услуг.
Достаточное поступление биотинаВозраст | Мужчина | Женский | 03 | От рождения до 6 месяцев 5 мкг 5 мкг | |||||
7-12 месяцев | 6 мкг | 6 мкг | 9011c98 мкг | 8 мкг | |||||
4–8 лет | 12 мкг | 9000–9 лет | 20 мкг | 20 мкг | 901 37 | ||||
14–18 лет | 25 мкг | 25 мкг | 30 мкг | 35 мкг | |||||
30 мкг | 30 мкг | 35 мкг |
* По материалам Совета по пищевым продуктам и питанию Национальной академии наук, инженерии и медицины.Однако есть несколько групп населения, которые могут быть более восприимчивыми к дефициту, в том числе:
- Беременные или кормящие женщины. У них повышенные потребности, и большинство витаминов для беременных не содержат биотина.
- Люди с диагностированной недостаточностью биотинидазы — редким генетическим заболеванием, при котором организм не может перерабатывать биотин. Легко поддается лечению, если выявляется в первые несколько недель жизни.
- Люди с алкогольной зависимостью. Алкоголь подавляет всасывание биотина.
- Люди, регулярно потребляющие сырые яйца (диетическая практика, которая не рекомендуется многими организациями по соображениям безопасности пищевых продуктов). Сырые яйца содержат белок авидин, который связывается с биотином и предотвращает его всасывание. Авидин денатурируется в процессе приготовления, поэтому употребление вареных яиц не подвергает человека риску дефицита биотина.
Пищевые источники биотина включают красное мясо, яйца, орехи, семена и некоторые овощи.Источники белка животного происхождения, такие как говяжья печень, куриная печень, лосось и яйца, имеют высокое содержание биотина. В меньших количествах он также содержится в овощах, таких как брокколи, сладкий картофель и шпинат, а также во многих типах орехов и семян. Хотя молочные продукты являются источником животного белка, они содержат лишь небольшое количество биотина. Биотин также широко доступен в форме добавок.
Продукты питания | Размер порции | мкг Биотина на порцию | |
3 000 унций 30 000 9123 902 901 9018 | |||
Яйцо вареное | 1 целое | 10,0 | |
Лосось, розовый, консервированный в воде | 5,0112 9 унций Свиная отбивная, приготовленная | 3 унции | 3,8 |
Семечки подсолнечника, жареные | чашки | 2.6 | |
Сладкий картофель, приготовленный | ½ стакана | 2,4 | |
Миндаль, жареный | 12 902 902 вареная | ½ стакана | 0,5 |
Брокколи, сырая | ½ стакана | 0,4 0 | |
| Обычный |
* Таблица адаптирована из информационного бюллетеня NIH Biotin Health Professional Fact Sheet. Национальная база данных по питательным веществам Министерства сельского хозяйства США (USDA) не перечисляет содержание биотина в пищевых продуктах и не предоставляет списки продуктов, содержащих биотин.
Заинтересованы в изучении основ других тем, касающихся продуктов питания, питания и здоровья? Ознакомьтесь с другими статьями из нашей серии «Что есть».
Это сообщение в блоге написано Рэйчел Миллер, стажером-диетологом из Фонда IFIC, при участии Али Вебстера, доктора философии, RD.
Биотин — обзор | Темы ScienceDirect
Введение
Биотин, также известный как витамин B 7 или витамин H, является важным витамином, поскольку он действует как кофактор для пяти биотин-зависимых карбоксилаз, которые играют решающую роль в промежуточном метаболизме глюконеогенеза, жирных кислот синтез и катаболизм аминокислот. 1 Фармакология и патофизиология биотина обсуждались в главе 2. Суточная потребность в биотине составляет всего 30 мкг как для мужчин, так и для женщин, в то время как суточная потребность в биотине намного меньше у младенцев и детей (Таблица 3.1). Многие продукты, включая мясные субпродукты, такие как печень, мясо, яйца, рыба, семена, орехи и некоторые овощи, такие как сладкий картофель, содержат биотин. Хотя в Соединенных Штатах нет репрезентативной оценки потребления биотина на национальном уровне, среднее потребление биотина с пищей у жителей западных стран оценивается в 35–70 мкг / день. 2
ТАБЛИЦА 3.1. Потребность в биотине у людей
| Возраст | Суточная потребность в биотине как у мужчин, так и у женщин (мкг) | |
|---|---|---|
| От рождения до 6 месяцев | 5 | |
| 7-12 месяцев | 1–3 года | 8 |
| 4–8 лет | 12 | |
| 9–13 лет | 20 | |
| 14–18 лет | 25 | |
| 19 ) | 30 a |
На основе информационных бюллетеней о биотине для медицинских работников.Национальный институт здоровья: Управление пищевых добавок.
Как и другие члены комплекса витаминов B, биотин растворим в воде и не токсичен. Составы поливитаминов обычно содержат около 30 мкг биотина. Дефицит биотина в питательных веществах встречается редко, но у здоровых беременных женщин может наблюдаться предельный дефицит биотина без каких-либо симптомов. В результате прием биотина беременным женщинам не рекомендуется в качестве стандартной терапии. Однако в последнее время наблюдается тенденция принимать мегадозы биотина для здорового роста волос, кожи и ногтей.Для этих целей люди часто принимают 5–10 мг биотина в день. Биотин в более высоких дозах может потребоваться для лечения врожденного дефицита биотина. Биотин в дозировке 100–300 мг в сутки используется для лечения симптомов рассеянного склероза.
Хотя нормальное поступление биотина с пищей, прием поливитаминных добавок, содержащих биотин, или прием биотиновых добавок, содержащих менее 5 мг биотина в день, не влияет на иммуноанализы, основанные на биотине, прием биотиновых добавок в более высоких дозах (5-10 мг в сутки) не влияет на результаты иммуноанализа. день) или фармацевтическая доза биотина (100–300 мг / день) может повлиять на результаты клинических лабораторных тестов с использованием иммуноанализов, в которых используются биотинилированные антитела.Обычно высокая концентрация биотина ложно увеличивает результаты тестов с использованием конкурентных иммуноанализов, но ложно снижает результаты тестов с использованием формата сэндвич-иммуноанализа. В литературе задокументирован неверный диагноз гипертиреоза из-за ложного повышения уровней свободного тироксина и свободного трийодтиронина, но ложно более низких уровней тиреотропного гормона. FDA сообщило о смерти человека из-за ложно более низких значений тропонина в результате приема биотина, что привело к пропущенному диагнозу инфаркта миокарда.Пожалуйста, см. Главу 4, где подробно обсуждается влияние биотина на результаты клинических лабораторных тестов с использованием иммуноанализов на основе биотина.
Биотиновые добавки, особенно в больших дозах, становятся все более популярными, поскольку примерно 15–20% людей в Соединенных Штатах употребляют биотинсодержащие добавки. 3 Как упоминалось в главе 4, розничные продажи биотиновых добавок выросли более чем на 260% в период с 2013 по 2016 год. Общие продажи, вероятно, намного выше, поскольку данные о продажах пищевых продуктов Nelson не включают продажи с оптовых складов.В этой главе основное внимание уделяется тому, почему люди принимают добавки биотина в высоких дозах, и есть ли какие-либо научные данные, подтверждающие, что добавка биотина полезна для здоровья волос, ногтей и кожи. Кроме того, многочисленные публикации указывают на полезную роль биотина в улучшении качества жизни пациентов, страдающих рассеянным склерозом. Более того, биотин также может быть полезен для поддержания здорового уровня глюкозы у пациентов с диабетом 2 типа, а также для улучшения липидного профиля и снижения веса.Биотин также может благоприятно влиять на иммунную функцию и снижать артериальную гипертензию. Все эти потенциальные преимущества биотина обсуждаются в этой главе.
Биотинилирование | Thermo Fisher Scientific
Взаимодействие биотин-авидин обычно используется для обнаружения и / или очистки белков из-за высокой специфичности этих двух молекул друг к другу. Биотинилирование — это процесс присоединения биотина к белкам и другим макромолекулам. Реагенты биотинилирования доступны для нацеливания на определенные функциональные группы или остатки, включая первичные амины, сульфгидрилы, карбоксилы и углеводы.Также доступны фотореактивные соединения биотина, которые неспецифически реагируют под воздействием ультрафиолетового (УФ) света и расширяют круг молекул, которые могут быть биотинилированы. Разнообразие реагентов для биотинилирования с различной специфичностью функциональных групп является чрезвычайно полезным, позволяя выбрать реагент, который не инактивирует целевую макромолекулу. Помимо специфичности к функциональным группам, доступны реагенты для биотинилирования с различными характеристиками растворимости, позволяющие направить биотинилирование на различные микросреды внутри или вне клеток.Расщепляемые или обратимые реагенты для биотинилирования обеспечивают специфическое элюирование биотинилированных молекул из биотин-связывающих белков. Разнообразие этих реагентов существенно расширяет область применения химии авидин-биотин.
Просмотр и выбор продуктов
Введение в биотинилирование
Взаимодействие авидина и биотина
Взаимодействие между биотином (витамином H) и авидином является полезным инструментом в нерадиоактивных методах очистки, обнаружения, иммобилизации, мечения, нацеливания на вирусные векторы и нацеливания на лекарства.Необычайное сродство авидина к биотину является одним из самых сильных известных нековалентных взаимодействий белка и лиганда (Ka = 10 15 M -1 ) и позволяет биотин-содержащим молекулам в сложной смеси дискретно связываться с авидином. конъюгаты. Образование связи между биотином и авидином происходит очень быстро, и после образования на него не влияют экстремальные значения pH, температуры, органических растворителей и других денатурирующих агентов.
Химическая структура биотина. Биотин, также известный как B-витамин B7 (ранее витамин H и кофермент R), растворим в воде. Молекула состоит из кольца уреидо, соединенного с кольцом тетрагидротиофена. Кофермент ферментов карбоксилазы биотин необходим для синтеза жирных кислот, изолейцина и валина. Биотин также участвует в глюконеогенезе.
Технический справочник по авидин-биотину
В нашем 48-страничном техническом справочнике по авидин-биотину собрано все необходимое для биотинилирования, очистки или обнаружения белков.Предлагаемые продукты включают наборы для биотинилирования и очистки белков клеточной поверхности, маркировку антител и новые реагенты для фотореактивного биотинилирования. Это руководство включает множество ссылок, а также протоколы, советы по устранению неполадок, руководства по выбору и полный список доступных инструментов.
Маркировка биотина
Белки, меченные биотином (т.е. биотинилированные), обычно выявляются или очищаются с помощью конъюгатов авидина во многих приложениях для исследования белков, включая иммуноферментный анализ (ELISA), вестерн-блоттинг, иммуногистохимию (IHC), иммунопреципитацию (IP) и другие методы аффинной очистки, мечения клеточной поверхности и проточной цитометрии / сортировки клеток с активацией флуоресценции (FACS).
Помимо сильного сродства к авидину, биотин обладает двумя характеристиками, которые делают молекулу идеальной для мечения белков и макромолекул. Во-первых, биотин сравнительно меньше глобулярных белков, что сводит к минимуму любое значительное вмешательство во многие белки и позволяет конъюгировать несколько молекул биотина с одним белком для максимального обнаружения авидином. Во-вторых, как показано на диаграмме ниже, биотин имеет боковую цепь валериановой кислоты, которая легко дериватизируется и конъюгируется с реакционноспособными фрагментами и химическими структурами, не влияя на его функцию связывания авидина.Эта функция позволяет создавать множество полезных реагентов для биотинилирования.
Биоцитин — это производное биотина, обнаруженное в сыворотке и моче, которое имеет добавленную лизиновую группу, связанную в боковой цепи ε-аминокислоты с боковой цепью валериановой кислоты. Как показано ниже, биоцитин длиннее биотина, что делает молекулу полезной для изготовления длинноцепочечных реагентов для биотинилирования. Биоцитин также может быть использован для получения трифункциональных сшивающих реагентов из-за наличия свободной карбоксилатной группы и α-амина.
Сравнение биотина и биоцитина. Биоцитин отличается от биотина добавлением лизиновой группы, присоединенной к боковой цепи валериановой кислоты.
Биотинилирование, также называемое меткой биотина, чаще всего выполняется химическими средствами, хотя также доступны ферментативные методы. Химические методы обеспечивают большую гибкость в выборе типа биотинилирования, чем ферментативные подходы, и могут выполняться как in vitro , так и in vivo . Ферментативные методы требуют совместной экспрессии бактериальной биотинлигазы и экзогенно экспрессируемого представляющего интерес белка, который модифицирован для переноса пептида-акцептора биотина, который обеспечивает более равномерное биотинилирование, чем химические методы, и может быть специфичным для клеточного компартмента.Однако из-за большей доступности реагентов для химического биотинилирования и индивидуальной настройки в этой статье основное внимание уделяется химическим методам биотинилирования.
Все реагенты для биотинилирования имеют сходные характеристики, как показано на диаграмме ниже, и вариации этих характеристик придают реагентам для биотинилирования отличные характеристики, которые идеально подходят для различных типов экспериментов. Ключевым отличием является реактивная составляющая или группа (обозначенная красным), которая сшивает реагент биотинилирования либо с отдельными функциональными группами аминокислот, либо с неотличимыми доменами, доступными для всех аминокислот; реакционная способность данного реагента зависит от используемой реакционноспособной группы.Расстояние между этим реактивным фрагментом и молекулой биотина (обозначено синим) также можно регулировать, чтобы увеличить доступность биотина для связывания авидина, повысить растворимость реагента или сделать биотинилирование обратимым. Структура от места связывания аминокислоты, которая зависит от типа реакционноспособного фрагмента, до конца молекулы биотина называется спейсерным плечом; расстояние между этими промежуточными ответвлениями варьируется в зависимости от реагентов для биотинилирования.
Основные характеристики реагентов биотинилирования. Биотин (синий) конъюгирован с реактивной группой (красный) либо напрямую, либо с дополнительными химическими структурами (черный) для увеличения длины спейсера. Показанный реагент — это NHS-LC-биотин.
Определение подходящего реагента для биотинилирования для конкретного применения и представляющего интерес белка зависит от ряда факторов, которые необходимо тщательно учитывать и оптимизировать, в том числе:
- Растворимость — Изменения растворимости реагента для биотинилирования позволяют получить доступ к белки-мишени в гидрофобной или гидрофильной среде и влияют на растворимость биотинилированного белка.
- Длина спейсерного плеча — Доступность биотина для связывания авидина зависит от длины спейсера.
- Расщепляемость / обратимость — Захваченные биотинилированные белки можно выделить или очистить путем отщепления молекулы биотина от целевого белка или обращения ослабленных взаимодействий биотин-авидин.
- Функциональная группа — Специфические реактивные части связываются с любыми аминокислотами или с функциональными группами определенных аминокислот для неселективного или целевого биотинилирования соответственно.
Растворимость реагента биотинилирования
Растворимость реагента биотинилирования сильно влияет на способность метить целевые белки или другие макромолекулы. Белки имеют гидрофобные и гидрофильные области на основе боковых цепей аминокислот и конформации белка, и эти области могут способствовать или ограничивать биотинилирование на основе растворимости реагента. Кроме того, гидрофобность микроокружения целевого белка может либо предотвратить, либо позволить биотинилирование в зависимости от растворимости реагента.Например, поверхностное биотинилирование, которое является распространенным методом изучения экспрессии или эндосомного переноса поверхностных молекул, требует, чтобы реагент биотинилирования был гидрофильным, чтобы предотвратить его прохождение через гидрофобную клеточную мембрану, тем самым ограничивая мечение биотина на поверхности клетки. Следовательно, выбор подходящего реагента для биотинилирования зависит как от целевых аминокислот, так и от микроокружения белка или макромолекулы.
Растворимость реагента для биотинилирования основана на растворимости реакционноспособного фрагмента, спейсерного плеча или их комбинации.Некоторые реакционноспособные группы изначально заряжены и поэтому водорастворимы, в то время как незаряженные группы требуют модификации (например, сульфирования; см. Раздел, посвященный сложным эфирам NHS ниже). Распространенный метод обеспечения растворимости распорок — это включение полиэтиленгликоля или ПЭГ (см. Рисунок ниже), который хорошо растворим и эластичен. Спейсерные ответвления, состоящие из PEG, могут сделать реагенты для биотинилирования с незаряженными реакционноспособными группами растворимыми или реагенты с заряженными реактивными группами более растворимыми. Кроме того, повышенная растворимость, обусловленная ПЭГ-содержащими биотиновыми метками, помогает предотвратить агрегацию биотинилированного белка во время длительного хранения по сравнению с небиотинилированными белками.
Поли (этиленгликоль) увеличивает растворимость реагентов биотинилирования. Цепь из четырех этиленгликоля (PEG4) была конъюгирована на спейсерное плечо между реакционноспособным фрагментом (красный) и биотином (синий). Показанный реагент — это Thermo Scientific EZ-Link NHS-PEG4-Biotin.
Способность авидина связываться с молекулами биотина на биотинилированных белках зависит от доступности биотина без стерических препятствий со стороны нескольких биотинов на одном и том же белке.Более длинные спейсерные ответвления могут повысить чувствительность обнаружения целевого белка, поскольку для связывания конъюгированного с репортером авидина доступно больше молекул биотина. Определение спейсерного плеча в контексте биотинилирования не следует путать с определением спейсерного плеча, используемого с бифункциональными сшивающими агентами. Спейсер, используемый для перекрестного связывания, определяется как расстояние между двумя реакционноспособными фрагментами. Для биотинилирования спейсер определяется как расстояние от конца конъюгированной аминокислоты до конца молекулы биотина.Таким образом, длина спейсерного плеча реагента биотинилирования может быть разницей между сильным детектированием / очисткой белка и слабым детектированием / очисткой или отсутствием его из-за доступности или недоступности биотина для связывания с конъюгатами авидина, соответственно.
Как показано на рисунке ниже, длина спейсера варьируется при конструировании реагентов для биотинилирования путем добавления или удаления химических структур между биотином и реакционноспособным фрагментом. Функциональная длина спейсера зависит как от длины добавленных химических структур, так и от природы реакционноспособного фрагмента.Длина плеча спейсера регулируется углеводородами, ПЭГ или дисульфидными связями, которые делают возможным расщепление биотина.
Примеры переменной длины распорки. Химические группы (черные) изменяют расстояние между реактивным компонентом (красный) и биотином (синий), чтобы регулировать длину спейсера. Показаны следующие реагенты: (A) NHS-биотин Thermo Scientific EZ-Link, (B) NHS-LC-биотин и (C) сульфо-NHS-LC-LC-биотин.
Расщепляемые и обратимые биотиновые реагенты
Сила взаимодействия авидин-биотин и его устойчивость к диссоциации влияет на способность элюировать биотинилированные белки с иммобилизованного авидином носителя или удалять конъюгированные с авидином репортерные зонды из биотинилированного образца.Жесткие денатурирующие условия (8M гуанидин • HCl, pH 1,5 или кипячение в SDS-буфере для загрузки образца) требуются для эффективной диссоциации комплексов авидин-биотин, которые повреждают основу и денатурируют белки, так что они не поддерживают какую-либо биологическую активность. Чтобы преодолеть это ограничение, на протяжении многих лет были разработаны различные усовершенствования. Один из подходов заключается в использовании модифицированных версий биотина, таких как расщепляемый биотин, иминобиотин и дестиобиотин. Другой подход заключается в модификации смолы авидин / стрептавидин, чтобы она проявляла более низкое сродство к биотину.
Реагенты для мечения расщепляемого биотина
Расщепляемые реагенты для биотинилирования позволяют очищать биотинилированные белки после захвата или удаления белка, конъюгированного с авидином, из биотинилированного образца. Как показано ниже, расщепляемые реагенты для биотинилирования разработаны с дисульфидными связями в спейсерном плече. В восстанавливающих условиях (50 мМ дитиотреитол, 10 мМ 2-меркаптоэтанол или 1% боргидрид натрия) дисульфидные связи расщепляются, высвобождая биотиновую метку и любой связанный с ней конъюгат авидина.
Расщепляемые реагенты для биотинилирования. Эти реагенты разработаны с дисульфидной связью, которая расщепляется в восстанавливающих условиях (пунктирная линия) для высвобождения биотиновой метки (синий) из меченого белка (зеленый; без масштабирования).
Реагенты для биотинилирования пиридилдисульфидов, такие как Thermo Scientific EZ-Link HPDP-Biotin, активируются для мечения сульфгидрильных групп за счет образования дисульфидной связи. Таким образом, восстановление дисульфидной связи не только освобождает однажды меченый белок от авидина, но и полностью меняет реакцию мечения.
Иминобиотин
Альтернативой использованию расщепляемых реагентов биотинилирования для высвобождения очищенных белков является их мечение модифицированными версиями биотина. Иминобиотин представляет собой циклический гуанидино-аналог биотина, который выделяется из авидина из-за его значительно более слабой аффинности связывания с авидином (Ka = 10 8 M -1 против Ka = 10 15 M -1 , соответственно), что зависит от pH. Белки, меченные иминобиотином, связываются с конъюгатами авидина при pH 9, но комплексы авидин-иминобиотин диссоциируют при pH 4, что позволяет очищать захваченный белок без денатурации.Хотя очищенные белки все еще биотинилированы, этот метод высвобождает биологически функциональные белки из конъюгатов авидина.
Химическая структура иминобиотин агарозы . Каждая пористая гранула агарозы имеет диаметр от 45 до 165 мкм и содержит триллионы иминобиотиновых групп.
Дестиобиотин
Дестиобиотин — это не содержащий серы аналог биотина с одним кольцом, который связывается со стрептавидином с почти такой же специфичностью, но с меньшим сродством, чем биотин (Ka = 10 11 M -1 vs.Ka = 10 15 M -1 соответственно). Следовательно, дестиобиотинилированные белки-приманки и их взаимодействующие партнеры могут быть легко и конкретно элюированы из аффинной смолы со стрептавидином в мягких условиях, основанных на конкурентном замещении свободным биотином. Для экспериментов по анализу методом «выталкивания» с биологическими образцами эта характеристика мягкого высвобождения дестиобиотина также помогает минимизировать совместную очистку эндогенных биотинилированных молекул, которые остаются связанными со стрептавидином после элюирования целевых белковых комплексов со свободным биотином.Модифицированная система аффинности авидин-биотин также устраняет необходимость использования жестких условий элюирования, которые могут диссоциировать комплексы и / или повредить целевой белок или клетку. Методы на основе дезтиобиотина идеальны при использовании нативных или рекомбинантных белков, которые не экспрессируются с помощью тега слияния, и при выделении захваченных белков в нативных условиях, таких как нацеливание на интактные клетки или белки клеточной поверхности.
Химическая структура EZ-Link Sulfo-NHS-LC-Desthiobiotin. Не содержащее серы производное биотина с одним кольцом (справа) обеспечивает мягкое высвобождение из белков авидина и стрептавидина.
Характеристики мягкого высвобождения дестиобиотина, указанные выше, реагентов сводят к минимуму изоляцию естественно биотинилированных молекул, которые могут повлиять на результаты, а также исключает использование жестких условий элюирования, которые могут диссоциировать комплексы и / или повредить целевой белок или клетку. Различные варианты мягкого выпуска использовались для разработки протоколов для различных приложений (например,g., зонды активного центра, выпадение РНК-белка).
Функциональная групповая ориентация
Цель биотинилирования — пометить интересующий белок таким образом, чтобы нормальная биологическая функция белка существенно не нарушалась. Несмотря на то, что биотин невелик, биотинилирование может мешать нормальной функции белка, если реагент биотинилирования конъюгирован с аминокислотами, которые регулируют активность белка, такую как связывание с субстратами. Доступно множество различных реакционноспособных группировок для уменьшения потенциального вмешательства путем нацеливания на различные специфические функциональные группы аминокислот, в том числе:
- Первичные амины (-Nh3) — Эта группа расположена на N-конце каждой полипептидной цепи и сбоку. цепь остатков лизина (Lys, K).
- Сульфгидрилы (-SH) — Эта группа расположена в боковой цепи цистеина (Cys, C). Часто, как часть вторичной или третичной структуры белка, цистеины соединяются друг с другом посредством дисульфидных связей (–S – S–) между своими боковыми цепями.
- Карбоксилы (-COOH) — Эта группа расположена на С-конце каждой полипептидной цепи и в боковых цепях аспарагиновой кислоты (Asp, D) и глутаминовой кислоты (Glu, E).
- Карбонилы (-CHO) — Эта альдегидная группа может быть создана путем окисления углеводных групп в гликопротеинах.
Реагенты для неселективного биотинилирования также доступны для мечения белков или макромолекул, не содержащих доступных первичных аминов, сульфгидрилов, карбоксилов или карбонилов.
Как показано на диаграмме антител ниже, белки обычно содержат сайты для нескольких реактивных групп. Следовательно, выбор правильного реактивного фрагмента имеет решающее значение для достаточного мечения, которое не влияет на функцию белка.
Мишени функциональной группы белка расположены на репрезентативном белке. На этой иллюстрации изображена обобщенная структура белка иммуноглобулина (IgG). Тяжелые и легкие цепи удерживаются вместе за счет комбинации нековалентных взаимодействий и ковалентных межцепочечных дисульфидных связей, образуя двустороннюю симметричную структуру. V-области H- и L-цепей содержат антигенсвязывающие сайты молекул иммуноглобулина (Ig). Каждый мономер Ig содержит два антигенсвязывающих сайта и считается двухвалентным. Шарнирная область — это область H-цепей между первым и вторым доменами C-области, которая удерживается вместе дисульфидными связями.Этот гибкий шарнир (обнаруженный в IgG, IgA и IgD, но не в IgM или IgE) позволяет изменять расстояние между двумя антигенсвязывающими сайтами. Также показаны несколько функциональных групп, которые являются выбираемыми мишенями для практического биоконъюгирования.
Реактивные группы, перечисленные в нижеследующем разделе, обычно используются для всех применений сшивания и подробно описаны в отдельном разделе «Сшивание» библиотеки методов белков. Поэтому в этом разделе обсуждается только краткое обсуждение механизма каждой реакционноспособной группировки, с большим акцентом на эти реактивные группы в контексте реакций биотинилирования.
Методы биоконъюгирования, 3-е издание
Методы биоконъюгирования, 3-е издание (2013) Грега Т. Хермансона — крупное обновление книги, которая широко известна как исчерпывающее справочное руководство в области биоконъюгирования.
Bioconjugate Techniques — это полный учебник и руководство по протоколам для ученых-биологов, желающих изучить и освоить методы биомолекулярного сшивания, маркировки и иммобилизации, которые составляют основу многих лабораторных приложений.Книга также является исчерпывающим и надежным справочником для исследователей, стремящихся разработать новые стратегии конъюгации для совершенно новых приложений. Он также содержит обширное введение в область биоконъюгирования, которое охватывает все основные приложения технологии, используемые в различных научных дисциплинах, а также советы по созданию оптимального биоконъюгата для любых целей.
Первичные амины
Амины представляют собой наиболее часто используемые функциональные группы для биотинилирования из-за большого количества ε-аминов боковой цепи лизина и N-концевых α-аминов.Сложные эфиры N-гидроксисукцинимида (NHS) легко образуют стабильные связи с первичными аминами, а реакционноспособная группа легко включается и стабилизируется в различные полезные, готовые к использованию реагенты для биотинилирования. NHS-эфиры не несут заряда и должны быть сначала растворены в органическом растворителе, а затем разбавлены водной реакционной смесью. Эти реагенты могут пересекать гидрофобную клеточную мембрану для конъюгирования и, следовательно, биотинилирования белков, ограниченных внутриклеточными компартментами или в гидрофобных микроокружениях.
Сложные эфиры NHS можно модифицировать, чтобы они стали водорастворимыми, путем сульфирования кольца N-гидроксисукцинимида с образованием сложных эфиров сульфо-NHS, которые не требуют использования органических растворителей в водных реакциях. Реагенты биотинилирования на основе сульфо-NHS-эфиров несут заряд и поэтому не могут проникать через неповрежденные клеточные мембраны; Эксперименты по поверхностному биотинилированию полагаются на эту характеристику, чтобы ограничить биотинилирование только внеклеточными белками.
Сложные эфиры тетрафторфенила (TFP) содержат обычно используемую амино-реактивную группу, которая имеет аналогичную реакционную способность с первичными аминами, но является более гидрофобной, чем NHS.Реагенты для биотинилирования TFP могут действовать при немного более щелочном pH, чем сложные эфиры NHS, и проявлять большую устойчивость к гидролизу в водных растворах.
Аминно-реактивные группы. Сложные эфиры NHS, сульфо-NHS и сложные эфиры TFP (все отмечены красным) являются наиболее распространенными амино-реактивными группами, используемыми для мечения белков биотином (синий). Показаны следующие реагенты: (A) Thermo Scientific EZ-Link NHS-Biotin , (B) сульфо-NHS-биотин и (C) TFP-PEG3-биотин.
Сульфгидрилы
Сульфгидрильные группы, которые обнаруживаются в открытых остатках цистеина, являются второй наиболее частой мишенью для биотинилирования.Поскольку сульфгидрилы обычно менее распространены в белках, они часто становятся мишенью для биотинилирования, когда первичные амины расположены в активных сайтах белка; это обычно приводит к более ограниченному мечению, чем при биотинилировании первичных аминов, но биологическая функция белка может быть сохранена.
Реагенты для биотинилирования, реагирующие с сульфгидрилом, требуют наличия свободных сульфгидрильных групп. Дисульфиды не будут реагировать с этими реагентами до тех пор, пока сульфгидрильные группы не будут освобождены в восстановительных условиях.В качестве альтернативы лизины можно модифицировать свободными сульфгидрильными группами с использованием реагентов тиолирования, таких как реагент Траута, SATP, SAT (PEG) 4 или SATA. Поскольку эти реагенты нацелены на свободные сульфгидрилы, реакции биотинилирования необходимо проводить в буферах, в которых отсутствуют восстановители. EDTA также может быть включен в состав буфера для хелатирования следов металлов, которые способствуют образованию дисульфидной связи.
В то время как гидрофобные сложные эфиры NHS можно модифицировать, чтобы сделать их водорастворимыми, реагенты для биотинилирования, реагирующие с сульфгидрилами, могут стать растворимыми в воде только при добавлении гидрофильного спейсера.
Малеимидные группы обладают высокой реакционной способностью по отношению к сульфгидрильным группам при pH от кислого до нейтрального. BMCC-биотин (1-биотинамидо-4- [4 ‘- (малеимидометил) циклогексан-карбоксамидо] бутан) представляет собой реагент биотинилирования, который имеет малеимидный фрагмент и циклогексановое кольцо для большей стабильности во время конъюгирования и увеличения длины спейсера. Галоацетилы, такие как иодацетильные группы, также обладают высокой реакционной способностью по отношению к сульфгидрильным группам, но при более высоком pH, чем малеимид (pH 7,5-8,5).
Пиридилдисульфиды отличаются от других сульфгидрильных групп, поскольку реакция приводит к образованию дисульфидной связи, которая может быть расщеплена для высвобождения биотинового спейсерного плеча и очистки белка, свободного от биотина.Кроме того, в результате реакции сшивания высвобождается пиридин-2-тион, который можно обнаружить, чтобы контролировать развитие реакции.
Сульфгидрильные реактивные группы. Малеимидная, йодацетильная и пиридилдисульфидная группы (все отмечены красным) являются наиболее распространенными сульфгидрильными группами, используемыми для мечения белков биотином (синий). Показаны следующие реагенты: (A) Thermo Scientific EZ-Link BMCC-биотин, (B) йодацетил-LC-биотин и (C) HPDP-биотин (пунктирная линия обозначает сайт расщепления тиоловым восстановителем).
Карбоксилы
Карбоксильные группы находятся на карбоксиконцевых концах белков, а также на аспаратных и глутаматных боковых цепях. Однако в отличие от реагентов для биотинилирования, которые непосредственно взаимодействуют с первичными аминами и сульфгидрилами, для реагентов, нацеленных на карбоксильные группы, требуется сшивающий агент нулевой длины, такой как EDC (карбодиимид), для конъюгирования с первичными аминами на реагентах для биотинилирования. Таким образом, хотя амины на карбоксильных реактивах для биотинилирования не являются реакционноспособными per se , они являются местом конъюгации с белками-мишенями.Помимо аминов, реагенты биотинилирования с гидразидными фрагментами также могут использоваться с EDC для взаимодействия с карбоксильными группами.
EZ-Link Amine-PEG11-Biotin. Thermo Scientific EZ-Link Amine-PEG11-Biotin будет реагировать с промежуточным соединением изомочевины EDC с карбоновой кислотой, нанося биотин на молекулу.
Конъюгация через EDC происходит при pH 4,5–5,5 и требует буферов, лишенных первичных аминов (например, трис, глицин) и карбоксилов (например, ацетата, цитрата).Одним из немногих буферов, отвечающих этим критериям, является буфер 2- [морфолино] этансульфоновой кислоты (MES). Использование EDC в реакциях биотинилирования может вызвать полимеризацию, если целевой белок содержит как карбоксилы, так и первичные амины; таким образом, требуется оптимизация концентраций EDC и реагента биотинилирования. Кроме того, выход биотинилирования может быть значительно увеличен с помощью сульфо-NHS, который стабилизирует промежуточные продукты.
Карбонилы
Хотя карбонилы не всегда присутствуют в белках, углеводные остатки на гликопротеинах можно модифицировать до альдегидов, чтобы пометить их реагентами для биотинилирования гидразида или производного алкоксиамина.Альдегиды этих гликопротеинов образуются в результате окисления углеводных сиаловых кислот с использованием периодата натрия. Затем альдегиды подвергаются специфической реакции с гидразидом или алкоксиамином при pH 4–6 с образованием стабильной связи.
Остатки сиаловой кислоты также могут быть биотинилированы производными гидразида или алкоксиамина путем предварительной обработки нейраминидазой для образования групп галактозы. Остатки галактозы и N-ацетилгалактозамина на целых клетках могут быть селективно биотинилированы этими реагентами путем дальнейшей обработки галактозооксидазой, которая превращает первичные гидроксильные группы этих сахаров в их соответствующие альдегиды.
Мягкое окисление иммуноглобулина периодатом натрия дает реактивные альдегиды из углеводных фрагментов Fc-части антитела, которые затем могут быть алкилированы гидразидом. Этот подход выгоден для использования с антителами, потому что они становятся биотинилированными таким образом, чтобы поддерживать иммунологическую реактивность. Это идеальный метод биотинилирования поликлональных антител, поскольку они сильно гликозилированы. У моноклональных антител может быть дефицит гликозилирования, и поэтому успех этого метода будет зависеть от степени гликозилирования конкретного антитела.
Температура, pH окисления и концентрация периодата влияют на реакцию с гидразидными производными биотина. Кроме того, поскольку гликозилирование зависит от каждого белка, оптимальные условия должны быть определены для каждого гликопротеина. Каждый препарат гликопротеина имеет оптимальный pH для окисления и биотинилирования, опосредованного гидразидами. Трис или другие буферы, содержащие первичный амин, не рекомендуются для использования на стадиях окисления или биотинилирования, поскольку эти буферы реагируют с альдегидами и, таким образом, гасят их реакцию с гидразидами и алкоксиаминами.
Карбоксильные и карбонильные группы. Реагенты с этими реактивными группами (красные) маркируют карбоксильные группы биотином (синий) при использовании с EDC. Гидразиды и алкоксиамины также можно использовать для мечения альдегидов на углеводах гликопротеинов после окисления периодатом. Показаны следующие реагенты: (A) Thermo Scientific EZ-Link амин-PEG2-биотин, (B) гидразид-биотин и (C) алкойксамин-PEG4-биотин.
Неселективный
Неселективные фотореактивируемые реагенты для биотинилирования доступны для маркировки целевых белков без доступных аминов, сульфгидрилов, карбоксилов и углеводов.Большинство фотореактивных реагентов для биотинилирования основаны на арилазидах, которые активируются УФ-светом (> 350 нм) и инициируют реакцию присоединения для вставки в сайты C-H и N-H. Последующее расширение кольца запускает реакцию в направлении связывания с нуклеофилами, такими как первичные амины. Эти реагенты можно использовать в самых разнообразных буферах, хотя кислый pH и восстанавливающие условия инактивируют арилазид.
Обычно фотоактивируемые реагенты выбирают, когда первичные амины и другие функциональные группы отсутствуют или когда начало конъюгации необходимо приурочить к определенной точке в период инкубации (т.е.е. воздействием УФ-излучения).
Неселективные фотоактивируемые группы. Реактивная группа (красная) активируется УФ-светом, а затем неселективно связывается с аминокислотами, маркируя белок биотином (синий). Показанный реагент: Thermo Scientific EZ-Link TFPA-PEG3-Biotin
Количественное определение биотинилирования
Определение степени модификации биотина после реакции биотинилирования может помочь в оптимизации конкретной системы анализа авидин-биотин и обеспечить воспроизводимость процесса биотинилирования.Наиболее распространенный метод измерения степени биотинилирования образца — использование красителя 4′-гидроксиазобензол-2-карбоновой кислоты (HABA), который нековалентно связывается с авидином в отсутствие биотина. При связывании с авидином HABA демонстрирует оптическую плотность при длине волны 500 нм (A500), которая пропорциональна количеству связанной HABA. Когда биотинилированный образец смешивают с раствором комплекса HABA-авидин, биотин замещает HABA для связывания с авидином, потому что константа ассоциации взаимодействия авидин-биотин намного больше, чем для HABA-авидина (6 x 10 6 M -1 ).Поскольку поглощение HABA пропорционально его связыванию с авидином, количество биотина, присутствующего в растворе, можно рассчитать на основе снижения сигнала A500.
В последние годы были разработаны более чувствительные анализы, основанные на том же принципе замещения HABA, но использующие флуоресцентные репортеры. Флуоресцентный анализ биотина значительно более чувствителен и требует меньшего количества биотинилированного образца, чем традиционные методы HABA. Для флуоресцентного обнаружения требуется флуоресцентный ридер для планшетов, в то время как нефлуоресцентные методы могут выполняться с помощью стандартного спектрофотометра.
- Барат Б., Ву А.М. (2007) Метаболическое биотинилирование рекомбинантного антитела биотинлигазой, удерживаемой в эндоплазматическом ретикулуме. Biomol Eng 24: 283–91.
- Emerman AB et al. (2010) Биотинилирование с ограничением по компартментам выявляет новые особенности метаболизма прионных белков in vivo. Mol Biol Cell 21: 4325–37.
- Hermanson GT (2008) Методы биоконъюгирования, 2-е издание . Сан-Диего (Калифорния): Academic Press.
- Hofmann K et al.(1980) Аффинные колонки с иминобиотином и их применение для извлечения стрептавидина. Proc Natl Acad Sci U S A 77: 4666–8.
- Sugawara K et al. (2005) Вольтамперометрический анализ гомогенного связывания биотина без стадии разделения с использованием иминобиотина, меченного электроактивным соединением. Anal Sci 21: 897–900.
- Hirsch J et al. (2002) Легко обратимое связывание дестиобиотина со стрептавидином, авидином и другими биотин-связывающими белками: использование для маркировки, обнаружения и выделения белков. Аналитическая биохимия 308: 343–357.
- Hofmann K et al. (1982) Связывание авидином карбоксилзамещенного биотина и аналогов. Биохимия 21: 978–984.
Биохимическая и структурная характеристика фермента BioZ, участвующего в пути синтеза бактериального биотина
Потребность в биотине для роста
A. tumefaciensОперон bioBFDA A. tumefaciens кодирует последние четыре фермента синтеза биотина, обеспечивая физиологическую потребность в биотине (рис.1а). Предположительно, удаление этого оперона ухудшает его способность к синтезу биотина, давая биотин-ауксотрофный штамм Δ bioBFDA (рис. 1a). Следовательно, целесообразно провести биоанализ DTB / биотина с мутантом Δ bioBFDA в качестве индикаторного штамма. Как и ожидалось, мутант Δ bioBFDA не может появиться на минимальной среде M9 без биотина в этом анализе биотина (рис. 1b). Нарушение роста этого мутанта было значительно восстановлено экзогенным добавлением биотина (2–10 пмоль, рис.1b), а не его предшественник DTB (рис. 1c). Неспособность DTB поддерживать рост бактерий Δ bioBFDA связана с отсутствием BioB, важного биотин-превращающего фермента из DTB (рис. 1a). На основе анализа DTB / биотина также были проведены эксперименты по перекрестному кормлению с участием двух различных комбинаций (донор и реципиент). А именно, (i) штамм A. tumefaciens дикого типа, NTL4 является продуцентом DTB / биотина, а в мутанте Δ bioBFDA действует как штамм-реципиент; (ii) бесклеточные бактериальные супернатанты ( A.tumefaciens и Klebsiella pneumoniae Kp24) служат донорами DTB / биотина, тогда как штамм ER90 (Δ bioFCD ) штамма E. coli функционирует как датчик DTB / биотина. Неудивительно, что штамм A. tumefaciens NTL4 (2 мкл культуры в лог-фазе) может перекрестно питаться биотин-ауксотрофным штаммом Δ bioBFDA , обеспечивая его рост в непермиссивных условиях (рис. 1d). Это указывает на то, что заметный уровень DTB / биотина выводится через A.tumefaciens NTL4 в среду его роста. Фактически, мы обнаружили, что бесклеточный супернатант штамма NTL4 (~ 5 мкл) поддерживает устойчивый рост ER90, как это делает биотин (5 пмоль) (рис. 1e). Однако явного роста не было обнаружено, несмотря на культуральную среду (5 мкл) штамма K. pneumoniae Kp24. Очевидно, это наблюдение подтверждает, что (i) биотин является важным питательным микроэлементом для роста A. tumefaciens ; и (ii) штамм NTL4 A. tumefaciens может секретировать в питательную среду больше DTB, чем K.pneumoniae Kp24 делает.
Рис. 1: Потребность в биотине для роста Agrobacterium .a Схематическое изображение биотин-ауксотрофного штамма A. tumefaciens (Δ bioBFDA ). Удаление оперона биотина bioBFDA из A. tumefaciens NTL4 прерывает путь синтеза биотина A. tumefaciens и, следовательно, препятствует росту бактерий в этом состоянии без добавления экзогенного биотина. b Спасение роста мутанта Δ bioBFDA путем добавления экзогенного биотина. c В отличие от биотина, его предшественник детиобиотин (DTB) не позволяет мутанту Δ bioBFDA появляться в условиях запрета роста без какого-либо биотина. d Рост мутанта Δ bioBFDA на среде без биотина восстанавливается путем перекрестного кормления штаммом A. tumefaciens NTL4 дикого типа. e Бесклеточная культура роста (т.е., супернатант) A. tumefaciens NTL4 (а не отрицательный контроль, штамм 24 Klebsiella pneumoniae ) перекрестно скармливает биотин-ауксотрофу ER90 (Δ bioFCD ) E. coli . Здесь A. tumefaciens NTL4 гранулировали, а затем суспендировали с 1 × PBS. Он показал, что A. tumefaciens NTL4 секретирует биотин (в основном его предшественник DTB) в питательную среду / среду 39 . Штамм FYJ283 (Δ bioBFDA ) 39 появился как индикаторный штамм в биотесте на биотин (DTB) ( b — c ), а также выступал в качестве штамма-реципиента в эксперименте по перекрестному кормлению A. .tumefaciens NTL4 ( d ). Биологический анализ биотина / DTB обычно выполняли, как описано ранее 20,39 . В Agrobacterium tumefaciens, Kp24 Klebsiella pneumoniae , штамм 24.
Функциональная замена BioC-BioH на BioZ
В контексте липидного метаболизма тип α-протеобактерий, такой как A. tumefaciens , имеет более высокую частоту. дупликации и амплификации гена по сравнению с E. coli (дополнительный рис.1) 2 . На двух хромосомах А . tumefaciens , массив повторяющихся локусов, связанных с fab , рассредоточен (дополнительный рисунок 1), который включает два гена fabI [ fabI1 ( atu0149 ) и fabI2 9058u075] (905 4 гена fabF [ fabF1 ( atu1097 ) до fabF4 ( atu4216 )] и 4 гена acpP [ acpP1 ( atu105886 ) до .Аналогичное распределение наблюдается у Brucella melitensis 36 и Rhizobium sp. IRBG74 37,38 . В то время как fabG присутствует в виде единственной копии в A. tumefaciens , он появляется в виде пяти копий в B. melitensis и семи копий в Rhizobium sp. IRBG74 (дополнительный рисунок 1). Интересно, что вторая копия гена fabH , который предположительно кодирует β-кетоацил-ACP-синтазу III (KAS III) синтеза жирных кислот, последовательно интегрирована в единственный оперон синтеза биотина bioBFDAZ у определенных видов α-протеобактерий, как А.tumefaciens (дополнительные рисунки 1-2) 2 . Поэтому он получил название bioZ ( fabh3 ), в A. tumefaciens 39 , B. melitensis 36 и Rhizobium 37,38 (дополнительный рисунок 1). Более раннее генетическое исследование, проведенное Салливаном и соавторами 38 , продемонстрировало, что основанная на транспозоне инактивация bioZ нарушает рост Mesorhizobium sp. штамм R7A на среде без биотина и комплементация гена bioZ в мутант bioH E.coli восстанавливала свою жизнеспособность на среде без биотина.
Чтобы функционально охарактеризовать BioZ в метаболизме биотина, мы клонировали bioZ из трех разных видов в индуцируемую арабинозой плазмиду pBAD24 (дополнительная таблица 1). Затем мы проанализировали in vivo роль BioZ, используя биотин-ауксотрофных штаммов E. coli (Δ bioH , Δ bioC или двойной мутант Δ bioH / Δ bioC ) (дополнительные рисунки 2- 5а). Как и предполагалось, введение Brucella bioZ может спасти рост бактерий как Δ bioH , так и Δ bioC в условиях отсутствия биотина и недопустимости роста (дополнительный рис.3). Кроме того, экспрессия bioZ обеспечивает эффективный рост двойного мутанта Δ bioH / Δ bioC на биотин-дефицитной среде (дополнительный рис. 3). Аналогичные результаты были получены с A. tumefaciens и Rhizobium bioZ (дополнительный рис. 4). Следовательно, BioZ (Fabh3) обходит роль «BioC-BioH» на канонических более ранних этапах синтеза предшественника биотина. С эволюционной точки зрения этот результат предполагает, что BioZ был одомашнен из прототипа синтетического фермента жирных кислот, чтобы получить дополнительную роль в синтезе биотина.Таким образом, BioZ может задействовать третий путь, по которому пимелат-предшественник биотина синтезируется в α-протеобактериях, особенно. А. tumefaciens .
Происхождение и филогения BioZ
Для выяснения возможного происхождения BioZ был проведен поиск BLAST по всей базе данных против GenBank с ручной сортировкой. Большинство полученных белков-кандидатов принадлежат к семейству ферментов KAS: KAS I (FabF), KAS II (FabB) и KAS III (Fabh2 и Fabh3). Поиск BLAST дал почти 150 совпадений, в том числе 41 FabF, 15 FabB, 50 FabH и 43 BioZ (рис.1а). Поскольку эти кандидаты сильно различались при поиске гомологии, мы, таким образом, переоценили их гомологичные домены через сервер Pfam (https://pfam.xfam.org/). В отличие от локусов fab , разбросанных по хромосомам, fabH -подобный локус bioZ часто локализуется в кластере генов синтеза биотина (дополнительный рис. 1). Эти результаты, взятые в генетическом контексте соседних генов, позволили предположить, что bioZ , вероятно, возник в результате недавних событий интеграции.
Как показано на неукорененном дереве, присутствуют две отдельные клады (FabF и FabH) (рис. 2a). Кладу FabH, по-видимому, можно разделить на три подгруппы, одна из которых принадлежит к BioZ (рис. 2а). Очевидно, BioZ, вероятно, произошел от FabH у некоторых видов Rhizobiales . Во время процесса одомашнивания с неизвестным давлением отбора такие предки FabH могут быть случайно использованы или захвачены для участия в синтезе биотина, несмотря на его относительно низкую начальную эффективность.Аналогично, FabB представлен как подклан в группе FabF, сильно отличающийся от прежней линии передачи FabH (рис. 2a). Это говорит о том, что FabF может быть предком FabB. Примечательно, что A. tumefaciens C58 развил все гомологи вышеупомянутых субкладов (рис. 2a), специализированные роли которых могут способствовать эволюционной адаптивности и метаболической пригодности Agrobacterium .
Рис. 2: Филогения BioZ и его паралогов.a Некорневое дерево белков BioZ и его предполагаемых гомологов (FabH, FabB и FabF).Филогенетическое дерево было создано с помощью программного обеспечения MEGA7 с использованием метода NJ (бутстрап: 1000 повторов). Показаны две основные клады ферментов KAS: FabF красным цветом и FabH оранжевым. Напротив, FabB (показан серым) филогенетически позиционируется как субветвь клады FabF, а BioZ локализован в подобласти клады FabH. Поэтому мы предположили, что FabB происходит от FabF (KAS II), а недавний предок BioZ происходит от FabH, фермента KAS III в пан-семействе KAS. b Филогенетические взаимоотношения паралогов БиоЗ.Филогения была построена с использованием программного обеспечения MEGA7 с использованием метода NJ (бутстрап: 1000 повторов, значения начальной загрузки указаны в виде круга). BioZ Agrobacterium и Brucella melitensis окрашены в красный и синий цвета соответственно.
Филогения гомологов BioZ также сделала вывод об их потенциальной эволюционной корреляции между разными видами (рис. 2b). Интересно, что три очень похожих гена bioZ (mll9094, mll5827 и mlr6070) были обнаружены в Mesorhizobium japonicum MAFF303099, что указывает на то, что возникновение и эволюция BioZ связаны с дупликацией гена или горизонтальным переносом (рис.2б). Вкратце, mll9094, переносимый плазмидой pMLa, на 91,74% похож на хромосомный mll5827 на уровне аминокислотной последовательности. А mlr6070 на 86,52% идентичен mll5827, последовательность которого имеет размер 118 аминокислот, что значительно короче, чем у прототипа BioZ (> 300 аминокислот). Однако основные домены этой усеченной химеры и mll5827 являются показателями ферментов типа BioZ. В частности, мы наблюдали, что локусы, смежные с mlr6070 (т.е. mll6064, mll6066-mll6068, mlr6069 и mll6075 ) кодируют ряд транспозиционных элементов 40,41 .Это подчеркнуло возможность продолжающегося распространения / вариации гена bioZ . Укороченная версия mlr6070 является остатком или дегенеративной при одомашнивании / эволюции bioZ , или, альтернативно, этот гомологичный ген может обеспечивать сайты встраивания фрагментов. Таким образом, эти наблюдения подтверждают наше предположение, что bioZ происходит от Rhizobiales (рис. 2b). Таким образом, bioZ может подвергаться независимой диверсификации, а не совместной эволюции с другими генами, связанными с синтезом биотина.
Биохимическое понимание действия BioZ
Чтобы решить проблему его биохимической активности, мы экспрессировали BioZ из различных организмов, используя систему прокариотической экспрессии (дополнительный рис. 5a). Среди трех исследованных нами конструкций с вставкой bioZ только AtBioZ мог сверхэкспрессироваться в форме частично растворимого белка, проявляя кажущуюся массу ~ 36 кДа (дополнительный рис. 5b). Чистоту рекомбинантного белка AtBioZ определяли с помощью градиентного PAGE (дополнительный рис.5б). Затем масс-спектрометрия подтвердила его полипептидный отпечаток с охватом последовательности 44% (дополнительный рис. 5c). Эксперименты по гель-фильтрации и химическому сшиванию AtBioZ показали, что структура его раствора имеет димерную стехиометрию (дополнительный рис. 5b, d). Несмотря на свою способность дополнять мутант E. coli Δ bioH (дополнительные рисунки 3-4), AtBioZ не может высвобождать метильную группу из парадигмального субстрата BioH, метил-пимелоил-ACP, с образованием пимелоил-ACP. в ферментативной системе in vitro (дополнительный рис.6а-б). Используя восстановленную in vitro систему синтеза DTB / биотина, продукт, полученный BioJ, восстановил рост биотин-ауксотрофного штамма ER90 в условиях отсутствия биотина и запрета на него 27,42 , тогда как не для AtBioZ (дополнительный рис. 6c). -d). Это подчеркнуло, что BioZ представляет собой ранее неизвестный механизм и требует дальнейшего экспериментального определения.
Учитывая, что AtBioZ происходит из FabH, мы затем задали два вопроса: (i) сохраняет ли он активность β-кетоацил-ACP-синтазы III; (ii) как специфичность субстрата праймера различается между AtBioZ (AtFabh3) и AtFabh2.Таким образом, мы очистили ферменты синтеза жирных кислот и воссоздали систему FAS II in vitro (дополнительные рисунки 7 и 8a). Что касается начальной реакции синтеза жирных кислот, различные ферменты FabH могут распознавать ацил-CoAs с разной длиной углеродной цепи (дополнительный рис. 8). Следует отметить, что конденсация праймерного субстрата с помощью FabH с малонил-ACP происходит посредством последовательной активности FabG, FabZ (FabA) и FabI с использованием NADH и NADPH в качестве коферментов. Как и ожидалось, фермент E. coli FabH (EcFabH, контроль) лигировал исключительно ацетил-КоА с малонил-АСР с образованием ацетоацетил-АСР, который вступает в цикл FAS II, давая бутирил-АСР (C4-ACP ) (Инжир.3а и дополнительный рис. 8б). AtFabh2 был обнаружен активным по крайней мере с двумя субстратами, ацетил-КоА (C2-CoA) и бутирил-КоА (C4-CoA), что указывает на его ферментативную неразборчивость (дополнительный рис. 8c-d). В отличие от сценария с AtFabh2, казалось вероятным, что AtBioZ катализирует конденсацию праймерного субстрата глутарил-CoA с малонил-ACP, продуцируя пул C7-ACP (дополнительные рис. 8e и 9). Полученная смесь продуктов показала сходную подвижность пимелоил-АСР (положительный контроль), немного выше голо-АСР и малонил-АСР при разделении конформационно-чувствительным, 0.5 М мочевина / ПААГ (17,5%, pH 9,5) (рис. 3а). Положительный контроль пимелоил-АСР, использованный в нашем анализе, был получен в нашей лаборатории путем деметилирования метилового эфира пимелоил-АСР с использованием фермента BioJ (дополнительный рис. 7b). Неудивительно, что мы также наблюдали, что BioZ обладает активностью в отношении глутарил-АСР наряду с малонил-АСР, давая продукт C7-ACP (дополнительные фиг. 10a-b). Фактически, наш результат изотермической калориметрии титрования (ITC) подтвердил эффективное связывание BioZ с глутарил-ACP со стехиометрией N = 0.978 ± 0,028 и Kd = 6,167 ± 0,068 мкМ (дополнительный рисунок 11). Это может быть связано с тем, что ацильные производные CoA и ACP обычно имитируют друг друга в контексте системы FAS II. Кроме того, было обнаружено, что AtBioZ сохраняет активность в отношении бутирил-КоА (C4-CoA), которая в целом согласуется с активностью AtFabh2, но не EcFabH (рис. 3a и дополнительный рис. 8b-d).
Рис. 3: Роль BioZ в биосинтезе биотина с участием FAS II.a Биосинтез пимелоил-ACP и / или его предшественников in vitro.Используя систему FAS II, BioZ катализирует реакцию синтеза пимелоил-ACP из малонил-ACP и глутарил-CoA (ACP). Реакционную смесь разделяли конформационно-чувствительным электрофорезом в полиакриламидном геле мочевины (PAGE). Репрезентативный результат дается из трех испытаний. Примечание: здесь использовали 17,5% PAGE (pH 9,5), содержащий 0,5 М мочевины. Два контроля (C4-ACP и C6-ACP) служили стандартами / маркерами для этого конформационно-чувствительного геля мочевины. C7-ACP обозначает четыре вида ACP, присоединенных к ацильной семиуглеродной жирной ацильной цепи, а именно 5-кетопимелоил-ACP, 5-гидроксил-пимелоил-ACP, еноил-пимелоил-ACP и пимелоил-ACP.b МС / МС идентификация 5-кетопимелоил-АСР, первичного продукта реакции BioZ, связанного с FAS II, с использованием глутарил-КоА и малонил-АСР в качестве субстратов. Использование МС / МС позволило нам обнаружить присутствие четырех разновидностей C7-ACP в указанной выше реакционной системе. Что касается исходного продукта реакции BioZ, 5-кетопимелоил АСР, представлен представляющий интерес пептидный фрагмент из 15 остатков. Модификация C7-жирного ацила с высокой надежностью локализована на консервативном серине 36 ACP. Два пика пептидных фрагментов, обозначенные розовыми стрелками, использовали для определения ацильной модификации C7.Полученная масса составляла 498,1533, что близко к теоретической массе (498,143) кетопимелоильного фрагмента, связанного с Ппаном. Следует отметить, что она может быть не такой стабильной, как пимелиновая кислота. c Карикатура на структуру пимелоил-ACP. Он был получен из сложной структуры метилпимелоил-ACP и BioH (PDB: 4ETW) с соответствующими модификациями. d Схема для BioZ в обход канонических ранних стадий синтеза биотина. В отличие от парадигмального механизма синтеза биотина «BioC-BioH» (над пунктирной линией), реакция BioZ обходит более ранние этапы «BioC-BioH» в биосинтезе биотина (под пунктирной линией).Недавно установлено, что глутарил-КоА физиологически возникает в результате катаболизма лизина у Agrobacterium видов 47 . Обозначения: C4-ACP бутаноил-ACP, C6-ACP гексаноил-ACP, Mal-ACP малонил-ACP, Glu-ACP глутарил-ACP, Pim-ACP пимелоил-ACP.
Затем была применена МС / МС высокого разрешения для дальнейшего подтверждения образования продукта C7-ACP (такого как пимелоил-ACP) в результате реакции, катализируемой BioZ, в сочетании с восстановленным in vitro путем синтеза жирных кислот с помощью FabGAI (и / или бесклеточный неочищенный экстракт).Во-первых, в системе экстракта BioZ / At был обнаружен ряд коротких C7-жирных ацил-модифицированных пептидов ACP. Среди них фрагмент длиной 15aa, рассчитанный с помощью MS / MS, обладал массовой добавкой 498,1533 с высокой надежностью, что почти идентично теоретической массе (498,1430) фосфопантетеина (Ppan), присоединенного кетопимелоильным фрагментом (рис. 3б). Эта модификация 5-кетопимелоильного фрагмента была далее локализована в серине 36 (S36) голо-АСР (рис. 3b). В частности, данные MS / MS перенастроили несколько пептидов ACP, имеющих пимелоильную модификацию на остатке S36 (рис.3b и дополнительный рис. 10c). Аналогичным образом, используя систему BioZ / FabGAI, нам посчастливилось отследить массив пептидов ACP на сайте S36, в котором происходят три типа различных модификаций C7-жирного ацила (дополнительные рисунки 12-14). А именно, они включали 5-кетопимелоильный фрагмент (идеальная масса против фактической массы: 498,143 против 498,89 на дополнительном рисунке 12), 5-гидроксил-пимелоильный фрагмент (идеальная масса против фактической массы: 500,159 против 500,147 на дополнительном рисунке 13), и еноилпимелоиловый фрагмент (идейная масса против фактической массы : 482.1488 против 482,576 на дополнительном рисунке 14). В принципе, эти три промежуточных продукта C7 не так стабильны, как конечный продукт — пимелиновая кислота. Эти данные доказали, что AtBioZ катализирует конденсацию праймерного субстрата глутарил-CoA (возможно, ACP) с малонил-ACP с образованием 5-кетопимелоил-ACP. После связывания с путем FAS II этот нестабильный промежуточный продукт может быть преобразован в продукт пимелоил-АСР, то есть первый предшественник для последних стадий (BioF / A / D / B) синтеза биотина (дополнительный рисунок 9).Таким образом, мы предложили рабочую модель, согласно которой α-протеобактериальный фермент BioZ ведет себя как атипичный член β-кетоацил-ACP-синтазы III для синтеза C7-жирной ацильной части, минуя канонические более ранние этапы образования пимелата «BioC-BioH» (рис. . 3d).
Структурная характеристика BioZ
Используя рентгеновскую кристаллографию, мы кристаллизовали и решили структуру AtBioZ с разрешением 1,99 Å (таблица 1 и дополнительный рисунок 15). Димерная природа белка AtBioZ принадлежит пространственной группе P 2 1 2 1 2 1 и содержит два протомера на асимметричную единицу (ASU) (дополнительный рис.16a), статистика уточнения которых приведена в таблице 1. AtBioZ на 33% идентичен EcFabH 43 , а 21% и 18% — с EcFabB 44 и EcFabF 45 соответственно. Несмотря на то, что сходство последовательностей низкое среди этих KAS синтаз, они, по-видимому, имеют общую архитектуру, состоящую из двух отдельных доменов: крышки и корового домена (Рис. 4). Крышка домена AtBioZ содержит четыре α -спирали и два β-листа, которые покрывают основной домен «α / β / α / β / α» (дополнительный рис.15а). Основной домен AtBioZ представляет собой трехуровневый сэндвич, образованный девятью β-листами и десятью α -спиралями. Вкратце, β-слои β1 и β4 – β7 зажаты между спиралями α3 – α5 и α6 вместе со спиралями α13 – α14, чтобы сформировать первый слой, в то время как листы β8 – β11 зажаты между спиралями α9 – α12 и α6 вместе со спиралью α13 – α14 образуют другой слой «сэндвича» (дополнительный рис. 15a-b). Интересно, что предполагаемая каталитическая триада (C115, h355 и N285, дополнительные рис.15 и 19c-d) центрируется в основном домене AtBioZ (рис. 4d, 5d).
Таблица 1 Сбор и уточнение данных рентгеновской кристаллографии. Рис. 4: Структурное сравнение четырех ферментов типа FAS.a Ленточное представление структуры E. coli FabB (PDB: 1G5X). b Ленточная структура FabF E. coli (PDB: 2GFW). c Ленточное представление структуры FabH E. coli (PDB: 1HN9). d Лента, изображающая структуру A. tumefaciens BioZ (PDB: 6KUE). Крышки в EcFabB ( a ), EcFabF ( b ) и EcFabH ( c ) отдельно окрашены в зеленый, голубой и желтый цвета соответственно. При этом основные домены окрашены в серебристо-серый цвет. Что касается AtBioZ, домен крышки показан красным, а его основной домен — синим ( d ). Три остатка каталитической триады обозначены розовыми буквами.
Фиг.5: Структурный и функциональный анализ каталитической триады BioZ.a Структурный снимок каталитической триады (C163, h398 и h433) EcFabB. b Структурный анализ каталитической триады (C164, h404 и h441) EcFabF. c Структурное представление каталитической триады (C112, h344 и N274) EcFabH. d Структурная иллюстрация каталитической триады (C115, h355 и N285) AtBioZ. Фигуры конструкций были созданы с помощью программы PyMol. e Функциональные анализы BioZ и его мутантов каталитической триады с использованием биотин-ауксотрофного штамма Δ bioH . Тестируемые штаммы выращивали на непермиссивных минимальных средах M9, лишенных биотина. Кривые роста были построены из трех независимых экспериментов и отображены в виде среднего ± стандартное отклонение (SD).
Структурное выравнивание показало, что r oot- m ean- s quare d eviation (rmsd) атомов Cα AtBioZ составляет 2,8,2.7 и 1,2 Å по сравнению с FabB, FabF и FabH соответственно (рис. 4a, d), тогда как среднеквадратичное значение между FabB и FabF составляет 1,4 Å (рис. 4a, b). В соответствии с эволюционным расположением, наблюдаемым в наших филогенетических исследованиях (рис. 2a), структура AtBioZ (PDB: 6KUE) похожа на FabH (PDB: 1HN9), тогда как FabB (PDB: 1G5X) структурно больше связана с FabF. (PDB: 2GFW) (рис. 4a, d). Несмотря на то, что основной домен и активный сайт являются высококонсервативными (рис.4 и 5a, d), lid домены сильно различаются у четырех разных членов ферментов семейства KAS (рис.4а, г). Вкратце, домен крышки FabB в основном состоит из пяти α-спиралей и двух β-листов, а аналог FabF образован четырьмя α-спиралями и двумя β-листами (Fig. 4a, b). Однако домен крышки FabH / BioZ состоит из двух частей: одна часть представляет собой длинную петлю между β8 и α9 от первого слоя «сэндвича», а другая часть содержит две области (β1 – α3 и β6 – β7. ) на втором слое «бутерброда» (рис. 4в, г и дополнительный рис. 15). Взятые вместе, наши результаты обеспечивают возможное объяснение разнообразия субстратной специфичности / узнавания среди ферментов семейства KAS.
Каталитическая триада ферментов BioZ
FAS обладает эволюционно-консервативным каталитическим центром. Каталитическая триада (C163, h398 и h433) EcFabB почти структурно идентична таковой EcFabF (C164, h404 и h441) (рис. 5a, b). Напротив, остатки активного сайта AtBioZ соответствуют C115, h355 и N285, которые очень похожи на остатки EcFabH (C112, h344 и N274) (рис. 5c, d). Чтобы проверить функцию предполагаемых остатков каталитического центра AtBioZ, мы провели сайт-направленный мутагенез (C115A, h355A и N285A) с последующими анализами комплементации в условиях непермиссивного роста без биотина.Экспериментально биотин-ауксотрофный штамм Δ bioH трансформировали плазмидой bioZ дикого типа или мутантной и анализировали на рост в жидкой минимальной среде M9, не содержащей биотина (фиг. 5e). Как и предполагалось, штамм Δ bioH устойчиво рос при дополнении штамма bioZ дикого типа. В то время как штаммы, дополненные мутантами (C115A или N285A), утратили способность к росту, как показано на кривых роста (рис. 5e). Следует отметить, что мутант h355A сохраняет низкую активность, что способствует некоторому росту (рис.5д). Этот результат также соответствовал сценариям, наблюдаемым на чашках с агаром с минимальной средой M9. В заключение, это функционально определяет каталитическую триаду (C115, h355 и N285) BioZ и подчеркивает различную роль вышеупомянутых трех остатков в каталитической активности.
Взаимодействие между малонил-ACP и BioZ
Поскольку биохимически подтверждено, что BioZ активен в отношении малонил-ACP и глутарил-КоА (ACP), мы задали вопрос, как этот фермент BioZ взаимодействует с двумя вышеупомянутыми субстратами.Хотя наши предыдущие усилия не смогли сокристаллизовать AtBioZ в комплексе с малонил-ACP или глутарил-ACP (CoA), недавняя доступность кристаллической структуры FabB, сшитого с ACP 46 , позволила нам исследовать взаимодействие между малонил-ACP ( или его фрагмент ACP) и BioZ. Таким образом, мы использовали структуру комплекса FabB-ACP (2: 1) для руководства построением модели BioZ-ACP (рис. 6a, d). В отличие от канала загрузки субстрата FabB (PDB: 5KOF), который имеет закрытое дно, карман для связывания субстрата AtBioZ открыт с обоих концов (дополнительный рис.17а, г). Диаметр входа в субстрат как для AtBioZ, так и для FabH составляет около 5 Å (дополнительный рис. 17a, c). Глубина туннеля загрузки подложки в AtBioZ составляет 20 Å, что значительно больше, чем у аналога (15 Å) FabB (дополнительный рис. 17b, d).
Фиг. 6: Структурный и функциональный анализ связывания BioZ с малонил-АСР.Структура поверхности ( a ) и иллюстрация ленты ( c ) димера FabB, поперечно сшитого с ACP. Он был создан с помощью PyMol с использованием кристаллической структуры FabB-ACP (PDB: 5KOF).Структура поверхности ( b ) и ленточное изображение ( d ) димерного BioZ в комплексе с малонил-ACP. e Использование калориметрии изотермического титрования (ITC) для исследования взаимодействия между малонил-ACP и BioZ. Показан репрезентативный результат ITC, а результирующие значения стехиометрии (N и Kd) из трех независимых экспериментов даны в виде среднего значения ± стандартное отклонение. Предполагаемый способ связывания BioZ с его субстратом малонил-АСР (и / или глутарил-АСР) был создан посредством структурной суперпозиции.Стехиометрия (малонил-ACP: BioZ) составляет 1: 1, при этом измеренное молярное соотношение составляет ~ 0,996. Параметр сродства связывания (Kd) составляет 24,133 ± 0,602 мкМ.
В отличие от кармана связывания субстрата FabB, вход которого находится близко к границе раздела димеров (рис. 6a, c), вход кармана связывания субстрата AtBioZ находится относительно далеко от границы раздела димеров (рис. 6b, d). . В случае FabB-ACP (дополнительный рис. 19a-b) белок ACP в основном взаимодействует с одним мономером, в то время как ацильная группа на ACP вставляется в субстрат-связывающий карман другого мономера (рис.6а, в). Другими словами, оба мономера димера FabB взаимодействуют для связывания белка ACP и ацильной группы. Молекулярный докинг на основе ClusPro выявил предполагаемый интерфейс между BioZ и его родственным ACP (дополнительные рисунки 18a и 19c, d). В отличие от его относительно слабого сродства с одним только ACP, имеющим стехиометрию (N = 1,00 ± 0,17, Kd = 0,33 ± 0,25 мМ, на дополнительном рисунке 18b), мутантный фермент BioZ (C115A), как было обнаружено, связывает умеренно малонил-ACP. в наших экспериментах ITC (N = 0,996 ± 0.096, Kd = 24,133 ± 0,602 мкМ, на рис. 6д). Поэтому мы предложили модель «один к одному» для взаимодействия BioZ-ACP, в которой белок ACP может связываться только с одним мономером BioZ, а малонильная группа ACP взаимодействует с тем же мономером BioZ (рис. 6b, d). Предположительно, интерфейс FabB-ACP в основном полагается на электростатическое взаимодействие между отрицательно заряженными остатками на ACP и положительно заряженными остатками на FabB (рис. 7a) 46 . В нижней части спирали II ACP Asp35 и Asp38 взаимодействуют с Arg62, Lys63 и Arg66 на FabB, в то время как Glu47 на вершине спирали II взаимодействует с Arg124 и Lys127 на FabB (рис.7б) 46 . Точно так же поверхность вокруг входа в карман BioZ обогащена положительно заряженными аминокислотами, а именно Arg39, Arg153, Arg221 и Arg260 (рис. 7c, d). Среди них также предполагалось, что R39 и R153 будут взаимодействовать с грузом CoA. Вероятно, что эти остатки играют определенную роль во взаимодействии BioZ с отрицательно заряженными остатками на белке ACP.
Рис. 7: Структурные данные о распознавании малонил-ACP ферментом BioZ.a Структурное отображение фрагмента ACP ацил-ACP субстрата, связанного с парадигмальным ферментом FAS I, E.coli FabB. b Увеличенный вид взаимодействующего с ACP интерфейса FabB, который состоит из шести положительно заряженных остатков. Изображение создается путем поворота на 90 ° против часовой стрелки области с прямоугольными пунктирными линиями ( a ). c Модель связывания глутарил-ACP с положительно заряженной поверхностью AtBioZ. ACP представлен в ленточной структуре серого цвета, состоящей из четырех α-спиралей (от спирали-1 до спирали-4). Интерфейс FabB ( a ) [и / или BioZ ( c )], взаимодействующий с группой ACP, проиллюстрирован электростатической структурой поверхности.Синий означает положительный заряд, а красный — отрицательный. d Визуализация предполагаемого АСР-связывающего домена BioZ. Предположительно, он содержит четыре основных остатка, а именно R39, R153, R221 и R260. Это изображение получается путем поворота на 90 ° против часовой стрелки области, обозначенной квадратными штрихами ( c ). e Анализ на основе кривой роста для исследования роли предполагаемого четырехосновного интерфейса связывания АСР, содержащего четыре основных остатка, в функции BioZ. Используемые здесь штаммы были перечислены в дополнительной таблице 1, а кривая роста построена, как показано на рис.5e. Был дан репрезентативный результат.
Чтобы проверить эту гипотезу, мы создали ряд мутантов BioZ (дополнительная таблица 1) и исследовали их in vivo. Эти мутанты BioZ делятся на 4 группы: (i) четыре одиночных мутанта (R39A, R153A, R221A и R260A), (ii) шесть наборов двойных мутантов (R39A / R153A, R39A / R221A, R39A / R260A, R153A / R221A, R153A / R260A и R221A / R260A), (iii) четыре тройных мутанта (R39A / R153A / R221A, R39A / R153A / R260A, R39A / R221A / R260A и R153A / R221A / R260A) и (iv) а четверной мутант (R39A / R153A / R221A / R260A).Затем была проведена генетическая комплементация биотин-ауксотрофного штамма Δ bioH с использованием мутантов bioZ , переносимых pBAD24 (фиг. 7e). В результате (i) только один из четырех одиночных мутантов bioZ (т.е. R260A) потерял полную активность, как показано на кривых фенотипического роста Δ bioH ; (ii) почти все шесть двойных мутантов bioZ проявляли плохую активность; (iii) все четыре тройных мутанта bioZ были функционально нарушены; и, наконец, четверной мутант bioZ (R39A / R153A / R221A / R260A) оказался неактивным (рис.7д). Вместе с нашими структурными данными эти результаты in vivo определили функциональный интерфейс между BioZ и малонил-ACP, который важен для обхода канонических ранних этапов синтеза биотина.
Распознавание праймера глутарил-КоА с помощью BioZ
Биохимические данные показали, что BioZ использует глутарил-КоА и глутарил-АСР как субстраты праймера в восстановленной in vitro реакционной системе FAS (фиг. 3 и дополнительный фиг. 10). В отличие от малонил-АПФ (рис.6e) и только голо-АСР (дополнительный рис. 18), глутарил-АСР проявлял более прочное связывание с мутантным ферментом AtBioZ (C115A), как было определено в экспериментах ITC со стехиометрией N = 0,978 ± 0,028 и Kd = 6,167 ± 0,068. мкМ (дополнительный рисунок 11). Казалось вероятным, что фермент BioZ может регулировать (возможно, расширять) конфигурацию туннеля загрузки праймера для размещения праймерного субстрата ацил-ACP (CoA) с более длинной цепью. Чтобы решить эту проблему, мы применили молекулярную стыковку на основе AutoDock Vina. Как и ожидалось, удаленный АСР глутарильный фрагмент (т.е.е., глутарат), который мы выбрали, хорошо стыковался с ферментом AtBioZ (дополнительный рис. 16a-b). Структурная суперпозиция показала, что этот карман, занятый глутаратом, консервативен среди ферментов BioZ и его предков FabH (дополнительный рис. 16c). Это указывает на то, что туннель для загрузки праймеров на BioZ является эволюционным реликтом. Совсем недавно Ху и Кронан сообщили о генетических доказательствах происхождения глутарил-КоА в результате бактериального катаболизма лизина и аргументировали возможность использования глутарил-АПФ в качестве физиологического праймера для BioZ 47 .Поскольку и КоА, и АСР представляют собой кислые молекулы, несущие гибкую часть Рпан, не является необычным, что КоА и АСР имитируют друг друга в качестве неузнаваемых субстратов в контексте метаболизма жирных кислот. Если это так, это может объяснить, почему два вышеуказанных C5-тиоэфира (C5-CoA и C5-ACP) могут распознаваться BioZ in vitro и проявлять сопоставимое ферментативное сродство.
Поскольку глутарил-КоА является наиболее вероятным внутриклеточным праймером / лигандом, мы затем задаемся вопросом, насколько толерантен субстрат-туннель со своей свободной заряженной ω-карбоксильной группой.Впоследствии был проведен молекулярный докинг интактного глутарил-КоА в AtBioZ (рис. 8а). Это позволило нам визуализировать тонкий туннель загрузки субстрата, доступный для глутарил-КоА (рис. 8b). Неудивительно, что наши ITC-анализы продемонстрировали эффективное связывание глутарил-КоА с BioZ, в котором стехиометрия выглядит следующим образом: N = 0,80 ± 0,01 и Kd = 2,64 ± 0,23 мкМ (фиг. 8c). Это было очень похоже на сценарий, наблюдаемый с глутарил-ACP (дополнительный рис. 11). Действительно, это, в свою очередь, подтвердило надежность молекулярного стыковки BioZ / глутарил-КоА.Структурный анализ поверхности туннеля BioZ выявил три представляющих интерес остатка, которые могут взаимодействовать / нейтрализовать свободную карбоксильную группу субстрата глутарил-КоА. Они включали серин 84 (S84), аргинин 147 (R147) и серин 287 (S287) соответственно (фиг. 9a). Более того, выравнивание последовательностей показало, что все три предполагаемых сайта чрезвычайно консервативны для разных гомологов BioZ у всех α-протеобактерий (фиг. 9b). После этого мы применили замену аланином для создания трех одиночных мутантов (S84A, R147A и S287A) и протестировали роль in vivo в обходе необходимости BioH в деметилировании метилпимелоил-ACP в E.coli . Хотя мутант R147A bioZ сохранил частичную активность, два других мутанта (S84A и S287A) не могут позволить биотин-ауксотрофному штамму Δ bioH появиться в непермиссивных условиях, минимальных биотин-дефицитных чашках с минимальным агаром M9 (рис. 9в). Похожий сценарий наблюдался с кривыми роста вышеупомянутых штаммов в жидкой среде M9 без биотина (рис. 9d). Кроме того, наши функциональные анализы на основе структуры продемонстрировали, что четыре дополнительных остатка (E152, T216, M217 и N258) играют роль в переходных перекрестных помехах / стабилизации BioZ с грузом CoA.Взятые вместе, эти результаты составляют функциональное определение туннеля загрузки субстрата праймера внутри фермента AtBioZ.
Рис. 8: Биохимическое свидетельство того, что BioZ связывается со своим субстратом глутарил-КоА.a Молекулярная стыковка BioZ с глутарил-КоА. b Структурный снимок туннеля загрузки субстрата глутарил-КоА в ферменте BioZ. c Использование ITC для измерения связывания глутарил-КоА с белком BioZ. Отображается репрезентативный результат ITC из трех независимых экспериментов.Таким образом, значения стехиометрии (N и Kd) выражаются в виде среднего значения ± стандартное отклонение. Предполагается, что стехиометрия связывания глутарил-КоА с ферментом BioZ составляет 1: 1, при этом измеренное молярное соотношение составляет около 0,8. Параметр сродства связывания (Kd) составляет 2,64 ± 0,23 мкМ.
Рис. 9: Функциональное рассечение туннеля загрузки субстрата глутарил-КоА внутри фермента BioZ.a Предлагаемые критические остатки BioZ, способствующие нейтрализации свободных карбоксильных групп глутарил-КоА.Три остатка, которые могут нейтрализовать заряд свободной карбоксильной группы глутарил-КоА, определяются с помощью молекулярного стыковки, чтобы локализоваться на дальнем конце кармана загрузки субстрата (рис. 8a, b). А именно, это серин 84 (S84), аргинин 147 (R147) и серин 287 (S287) соответственно ( a ). b Три возможных нейтрализующих остатка (S84, R147 и S287) консервативны для всех гомологов BioZ от различных α-протеобактерий. Логотип последовательности был сгенерирован с использованием сервера WebLogo (http: // weblogo.berkeley.edu/logo.cgi). c Использование сайт-направленного мутагенеза для анализа различных ролей трех предполагаемых нейтрализующих заряд остатков в активности BioZ. d Кривые роста штаммов Δ bioH , несущих либо bioZ дикого типа, либо его точечные мутанты. Производные биотин-ауксотрофного штамма Δ bioH (дополнительная таблица 1) анализировали в условиях недопустимости роста минимальной среды M9 без какого-либо биотина. Добавление 0.2% арабиноза индуцировала экспрессию pBAD24-переносимого bioZ (и / или его точечных мутантов).
Помогает ли биотин при росте или выпадении волос? Ответы дерматолога
В мире косметических добавок биотин считается волшебным средством — как косметический эквивалент перезагрузки телефона. Волосы кажутся тонкими? Возьми биотин! Ломкие ногти? Попробуйте биотин! Кожа выглядит бла? Б-И-О-Т-И-Н. Вы слышите об этом так часто, что, вероятно, даже не думаете подвергать это сомнению.
Но если вы давно принимаете биотин для улучшения волос и заметили абсолютно нулевую разницу в его длине и толщине, вы можете задаться вопросом, не является ли это просто капсулой, полной лжи.Итак, я обратился за фактами к сертифицированному дерматологу Дхавалу Дж. Бханусали, доктору медицины, и трихологу Бриджит Хилл из салона Paul Labrecque и спа-салона по уходу за кожей.
Этот контент импортирован из {embed-name}. Вы можете найти тот же контент в другом формате или найти дополнительную информацию на их веб-сайте.
Что такое биотин?
Возможно, вы знаете его как биотин, или, может быть, вы слышали, что он называется витамином B7 или витамином H, оооо, или, может быть, вы просто называете его лучшей добавкой для кожи, волос и ногтей.Называйте это как хотите, но вот суть: это водорастворимый витамин B, обнаруженный в нашем организме, который превращает жиры, углеводы и белки в энергию.
Когда ваше тело испытывает дефицит биотина, доктор Бханусали говорит, что это может привести к истончению волос и ломкости ногтей (среди прочего, по данным Национального института здоровья), но поскольку он также содержится во многих продуктах питания, таких как мяса, яиц, рыбы, орехов и некоторых молочных продуктов вы, вероятно, получаете достаточное количество в своем рационе. Другими словами, вероятность того, что у вас будет дефицит биотина, довольно мала.
Биотин действительно работает?
Хорошо, давайте перейдем к делу: простая истина заключается в том, что недостаточно научных доказательств того, что биотин является ключом к действительно-очень длинному росту ваших волос. «Раньше считалось, что добавки биотина необходимы для роста сильных и здоровых волос, но на самом деле мало доказательств того, что это имеет большое значение», — говорит доктор Бханусали. « Большинство дерматологов согласны с этим — хотя, вероятно, это не повредит, но прием биотина может не сильно повлиять на состояние ваших волос.
А помните, как я сказал, что биотин растворим в воде? Это означает, что любое избыточное количество его в вашем организме вымывается с мочой, поэтому, к сожалению, загрузка биотина не даст вам хороших результатов. «Биотин может влиять на рост волос только в том случае, если существует дефицит биотина», — добавляет Хилл. « Прием дополнительных биотиновых добавок не приводит к дополнительному росту волос на основе питательных веществ. .∏
Сколько времени требуется биотину, чтобы воздействовать на волосы?
Доктор Бханусали говорит, что если у вас , на самом деле дефицит (он указывает на некоторые доказательства того, что у женщин может быть умеренный дефицит биотина во время беременности или кормления грудью, но вам понадобится анализ крови, чтобы точно определить какой-либо дефицит), это Пройдет еще несколько месяцев, прежде чем вы увидите результаты от приема биотина для улучшения волос.В противном случае, если есть какие-либо улучшения, видимые результаты будут в лучшем случае незаметными.
Каковы побочные эффекты биотина?
Если вы наполовину полны стакана, вы слышите слова «может не сработает» и цепляетесь за слово «может», и в этом случае вы, вероятно, все равно попробуете биотин. Но есть несколько потенциальных побочных эффектов от приема биотина, о которых вам следует знать в первую очередь.
Как объясняет доктор Бханусали, биотин может изменять точность определенных лабораторных тестов , таких как исследования щитовидной железы (что они также рассматривают как ключ к потере волос) и тропонин (который используется для мониторинга потенциального сердечного приступа), Это означает, что прием биотина без необходимости и без разрешения врача может замаскировать серьезное состояние здоровья.
Не только это, но также было сказано, что биотин способствует возникновению прыщей . Гав. «Предполагаемый патогенез заключается в том, что он предотвращает адекватное всасывание витамина B5, что может привести к нарушению кожного барьера», — говорит д-р Бханусали. «При этом я не видел никаких хороших исследований, подтверждающих эту связь, но это определенно нужно учитывать, если вы заметите больше высыпаний при начале приема добавки».
Какой биотин лучше всего подходит для роста волос?
Если вы все еще хотите попробовать биотин (вы, но в идеале, не предварительно посоветовавшись с врачом или дерматологом), несмотря на вероятность того, что это может не сработать, у вас есть несколько вариантов.Биотин можно использовать местно с шампунем для роста волос или загущающим шампунем или, как мы уже упоминали, принимать в качестве пероральной добавки, как в одном из этих лучших вариантов ниже.
FYI: это добавки для волос в Интернете
<3sДобавка для здоровья волос Viviscal Advanced
Добавки для роста волос Nutrafol для женщин
Movita Beauty Bottle Витамины для волос, ногтей и кожи
movitaorganics.ком26,50 долл. США
Добавки для тонких волос Ouai
Доктор Бханусали обычно рекомендует принимать биотин как часть поливитаминов, а не через продукт для местного применения (который еще менее эффективен для чего-либо). Своим пациентам с выпадением волос он рекомендует принимать в пищу еще один укрепляющий волосы ингредиент, витамин D, но есть и другие факторы питания, важные для волос, поэтому, как всегда, лучше всего проконсультироваться с врачом, чтобы оценить ваше конкретное состояние волос для волос. правильная комбинация процедур .Понял? Хороший.
Брук Шунатона Брук Шунатона — писатель для Cosmopolitan.com.Этот контент создается и поддерживается третьей стороной и импортируется на эту страницу, чтобы помочь пользователям указать свои адреса электронной почты. Вы можете найти больше информации об этом и подобном контенте на сайте piano.io.
Биотиновая сыворотка Boldify преобразует истонченные и ломкие пряди
Каждый продукт, который мы представляем, был независимо выбран и рецензирован нашей редакционной группой.Если вы совершите покупку по включенным ссылкам, мы можем получать комиссию.
Проблема выпадения волос может вызывать тревогу, особенно если вы ежедневно замечаете все более резкие изменения в ваших прядях. Этот вызывающий беспокойство опыт встречается чаще, чем можно было бы подумать — такие факторы, как стресс, послеродовое выпадение волос, генетика и выбор образа жизни, могут способствовать истончению кожи головы. К счастью, существуют доступные средства по уходу за волосами, которые помогут обратить вспять повреждение и вернуть ломким волосам здоровое и объемное состояние.
Сыворотка для утолщения волос с биотином Boldify 3X — яркий тому пример; Продукт 3-в-1 действует как средство для длительного роста волос, сыворотка для увеличения объема и несмываемый кондиционер. С самого первого применения пользователи сразу заметили разницу в толщине прядей; один рецензент сообщил, что их волосы сохраняли полноту в течение трех дней сразу после использования сыворотки. Даже те, кто потерял огромное количество волос, утверждают, что сыворотка сделала их «тонкие соломенные волосы более густыми [и] блестящими», а фото свидетельства, которыми поделились некоторые, действительно доказывают «удивительные преобразования», которые может обеспечить сыворотка (см. Здесь , здесь и здесь).
Хотя биотин является ключевым ингредиентом формулы, стимулирующей рост волос, кокосовое масло и экстракт лемонграсса играют важную роль в улучшении общего состояния здоровья кожи головы. «И кокосовое масло, и экстракт лемонграсса используются многими пациентами для улучшения здоровья волос», — говорит Эндрю Кашиан, основатель Solve Clinics, отмеченной наградами клиники по пересадке волос в Чикаго. «Многие пациенты отмечают, что волосы становятся более здоровыми и блестящими после использования этих типов натурального масла в качестве местного лечения», — говорит он.«Они также могут увлажнять и увлажнять кожу головы, что создает хорошую, богатую питательными веществами среду для роста волос».
И результаты: Сыворотка для роста волос получила более 5 000 пятизвездочных оценок от покупателей Amazon, которые сочли ее «надеждой на безнадежные волосы». Даже те, у кого ломкие волосы, напоминающие «стог сена», утверждают, что нелипкая, нежирная формула полностью меняет правила игры.


 )
)