В чем польза и где содержатся жирные кислоты омега-3 и -6
Возможно, вы слышали, что рыбий жир полезен для организма из-за содержания омега-3. Однако это не единственная жирная кислота, которая важна для здоровья человека.
Рассказываем, чем отличаются между собой эти жирные кислоты, какие функции они выполняют и где содержатся.
Омега-3
Омега-3 — самая популярная из жирных кислот, и часто ее принимают в виде биологически активных добавок. Существует несколько видов омега-3 жирных кислот, но исследования сосредоточены на главных трех: альфа-линоленовой (ALA), эйкозапентаеновой (EPA) и докозагексаеновой кислоте (DHA).
Омега-3 жирные кислоты содержатся в клеточной мембране всех клеток тела человека.
Докозагексаеновой кислоты много в мембране клеток сетчатки, мозга и спермы. Эйкозапентаеновая и докозагексаеновая кислоты помогают коже нормально функционировать и поддерживают структуры клеточных мембран.
Омега-3 обеспечивают организм энергией и используются для образования сигнальных молекул, которые поддерживают работу сердечно-сосудистой, легочной, иммунной и эндокринной системы. Также они могут регулировать работу генов, отвечающих за реакцию на оксидативный стресс, которая повышает риск воспалительных процессов в мозге и связанных с ними заболеваний, например депрессии.
Также они могут регулировать работу генов, отвечающих за реакцию на оксидативный стресс, которая повышает риск воспалительных процессов в мозге и связанных с ними заболеваний, например депрессии.
Омега-6 обладают провоспалительными функциями, о которых мы напишем ниже, а омега-3 (эйкозапентаеновая и докозагексаеновая кислота) конкурируют с ними за включение в клеточные мембраны. Из-за этого омега-3 имеют противовоспалительные свойства.
Недостаток омега-3 в организме и избыток омега-6 ведет к дисбалансу и увеличивает риск различных воспалительных процессов.
В каких продуктах содержатся омега-3 жирные кислоты?
Эйкозапентаеновая и докозагексаеновой кислота участвуют в противовоспалительных процессах, и они необходимы организму человека больше, чем альфа-линоленовая кислота. Чтобы получать необходимое их количество, рекомендуется несколько раз в неделю включать в рацион жирную рыбу.
Чтобы получать необходимое их количество, рекомендуется несколько раз в неделю включать в рацион жирную рыбу.
Организм человека умеет создавать из альфа-линоленовой докозагексаеновую и эйкозапентаеновую кислоты, но этого недостаточно, чтобы поддерживать противовоспалительные функции.
Биологически активные добавки не дают той же пользы, что и сбалансированный рацион, богатый омега-3 жирными кислотами. Однако они могут помочь, если по каким-то причинам вы не можете есть продукты-источники омега-3.
Жирные кислоты омега-3 и генетика
Уровень жирных кислот омега-3 в организме человека зависит от вариантов некоторых генов. Ген FADS1 кодирует фермент, который регулирует образование ненасыщеных жирных кислот из других полиненасыщенных жирных кислот в организме.
От варианта гена FADS1 зависит, как хорошо и плохо ваш организм будет производить эйкозапентаеновую и докозагексаеновую кислоту из растительных источников.
Развитие сельского хозяйства среди людей 10 тысяч лет назад и увеличение растительной пищи в рационе привело к распространению варианта гена FADS1, который помогает синтезировать жирные кислоты при отсутствии мясной пищи.
Ученые предполагают, что жители Европы таким образом эволюционно адаптировались к растительной диете. Жители Африки, Индии и Южной Азии тоже генетически склонны эффективнее производить омега-3 жирные кислоты. Скорее всего, это связано с преобладанием растительной пищи в рационе.
Исследования показывают, что у вегетарианцев и веганов организм лучше синтезирует докозагексаеновую и эйкозапентаеновую кислоты из растительных продуктов, чем у других, что тоже говорит об адаптации организма к диете.
С Генетическим тестом Атлас вы узнаете свою предрасположенность к низкому или высокому уровню омега-3 жирных кислот.
Мы исследуем варианты следующих генов:
| Кислота | Гены |
|---|---|
| Альфа-линоленовая | FADS1 |
| Докозагексаеновая | FADS1, ELOVL2 и GCKR |
| Эйкозапентаеновая | FADS1 и ELOVL2 |
Если Генетический тест Атлас покажет генетическую предрасположенность к низкому уровню той или иной омега-3 жирной кислоте, мы порекомендуем употреблять больше жирной рыбы или добавки с омега-3.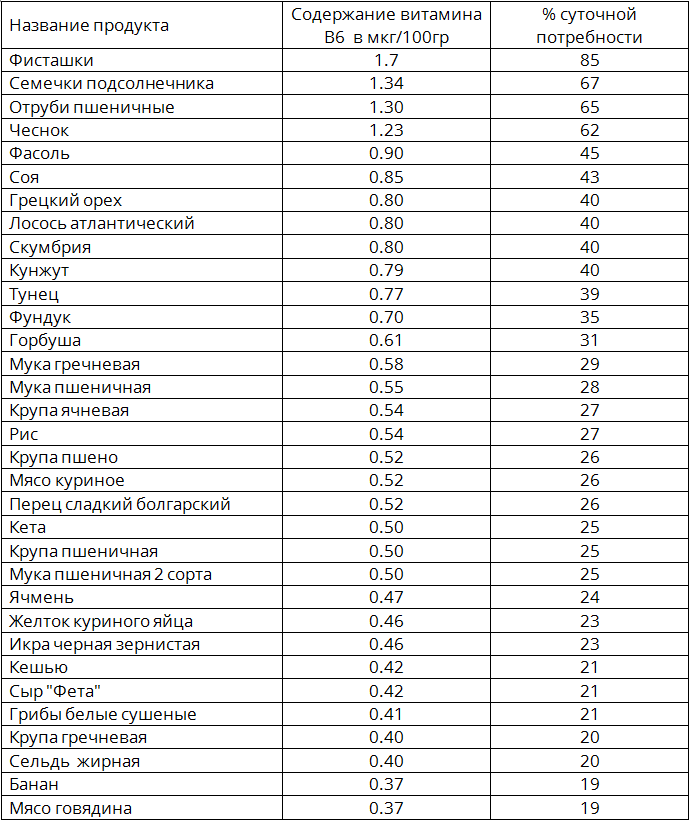
Чтобы узнать, есть ли у вас предрасположенность к хорошему синтезу омега-3 жирных кислот из растительной диеты, откройте признак по любой из них и проверьте данные по варианту гена FADS1. Вариант Т связан с более активной работой фермента и синтезом омега-3.
Омега-6
Как мы писали выше омега-6 обладают провоспалительными функциями. Сейчас объясним, что это значит. Под воспалением часто понимают острую фазу заболевания.
На самом деле, воспаление — реакция иммунитета. Она может быть вызвана патогеном, травмой или нарушением работы иммунной системы.
Когда вы в очередной раз ударяетесь мизинцем о мебель, организм синтезирует простагландины — сигнальные молекулы, которые запускают реакцию воспаления и отвечают за боль в месте ушиба. Для синтеза этих молекул организм использует омега-6 или омега-3 (эйкозапентаеновую) жирные кислоты, которые содержатся в клетках.
Воспалительная реакция будет зависеть от соотношения разных типов кислот, так как простагландины, полученные из омега-6, действуют гораздо эффективнее простагландинов, полученных из омега-3 жирных кислот. Получается, чем больше в клетке омега-3 и меньше омега-6 — тем ниже вероятность запуска слишком сильной воспалительной реакции, которая может навредить организму.
Без реакции воспаления наш организм не мог бы справиться с инфекциями, порезами и ушибами. С другой стороны, когда иммунная система чрезмерно активна, а организм склонен к воспалениям — повышается риск различных хронических заболеваний, например сахарного диабета 2 типа, атеросклероза и ожирения.
Провоспалительные жирные кислоты омега-6 нужны организму, но в небольшом количестве, чтобы запускать реакцию воспаления в нужное время и в нужном месте. Иначе организм будет страдать либо от системного воспаления, либо от неспособности защитить себя от инфекций.
Существует 5 основных видов кислот, относящихся к омега-6:
- Линолевая
- Арахидоновая
- Гамма-линоленовая
- Дигомо-гамма линоленовая
- Докозатетраеновая кислота
В каких продуктах содержатся омега-6 жирные кислоты?
Омега-6 жирные кислоты содержатся в сое, кукурузе, подсолнечном масле, орехах и семенах, мясе, рыбе и яйцах, а также в составе жирных соусов на основе майонеза и выпечке на маргарине.
Омега-6 жирные кислоты и генетика
Уровень омега-6 жирных кислот также зависит от вариантов генов. Например, ген NTAN1 кодирует фермент, который принимает участие в процессе деградации белка в организме, что связан с метаболизмом омега-6 жирных кислот.
| Кислота | Гены |
|---|---|
| Арахидоновая | FADS1 и NTAN1 |
| Гамма-линоленовая | FADS1 и NTAN1 |
| Дигомо-гамма-линоленовая | FADS1 и NTAN1 |
| Докозатетраеновая | FADS1 |
| Линоленовая | FADS1, NTAN1 и NRBF2 |
Если Генетический тест Атлас покажет генетическую предрасположенность к высокому уровню той или иной жирной кислоте, мы порекомендуем ограничить продукты с высоким содержанием омега-6.
Чтобы узнать, как ваши варианты генов влияют на уровень жирных кислот в организме, закажите Генетический тест Атлас. Помимо этих признаков в тест входят риски заболеваний и спортивных травм, склонность к непереносимости лактозы и глютена, отчеты по некоторым витаминам и гормонам, а также информация о происхождении.
- Surette ME. The science behind dietary omega-3 fatty acids. Canadian Medical Association Journal. 2008;178(2):177-180.
- Omega-3 Fatty Acids. Fact Sheet for Health Professionals
- Borsini A, Stangl D, Jeffries AR, Pariante CM, Thuret S. The role of omega-3 fatty acids in preventing glucocorticoid-induced reduction in human hippocampal neurogenesis and increase in apoptosis. Transl Psychiatry. 2020;10(1)
- Modern European genes may favor vegetarianism
- Ameur A, Enroth S, Johansson Å, et al. Genetic Adaptation of Fatty-Acid Metabolism: A Human-Specific Haplotype Increasing the Biosynthesis of Long-Chain Omega-3 and Omega-6 Fatty Acids. The American Journal of Human Genetics. 2012;90(5):809-820
- Welch AA, Bingham SA, Khaw KT. Estimated conversion of -linolenic acid to long chain n-3 polyunsaturated fatty acids is greater than expected in non fish-eating vegetarians and non fish-eating meat-eaters than in fish-eaters. Journal of Human Nutrition and Dietetics.
 2008;21(4):404-404.
2008;21(4):404-404. - Innes JK, Calder PC. Omega-6 fatty acids and inflammation. Prostaglandins, Leukotrienes and Essential Fatty Acids. 2018;132:41-48
- Bagga D, Wang L, Farias-Eisner R, Glaspy JA, Reddy ST. Differential effects of prostaglandin derived from -6 and -3 polyunsaturated fatty acids on COX-2 expression and IL-6 secretion. Proceedings of the National Academy of Sciences. 2003;100(4):1751-1756
- Guan W, Steffen BT, Lemaitre RN, et al. Genome-Wide Association Study of Plasma N6 Polyunsaturated Fatty Acids Within the Cohorts for Heart and Aging Research in Genomic Epidemiology Consortium. Circ Cardiovasc Genet. 2014;7(3):321-331
Цинк: чем полезен, в каких продуктах содержится? Отвечает диетолог
https://rsport.ria.ru/20210203/tsink-1595866437.html
Цинк: чем полезен, в каких продуктах содержится? Отвечает диетолог
Цинк: чем полезен, в каких продуктах содержится? Отвечает диетолог — РИА Новости Спорт, 19.03. 2021
2021
Цинк: чем полезен, в каких продуктах содержится? Отвечает диетолог
Цинк — один из важнейших для здоровья микроэлементов: он снабжает организм энергией, поддерживает иммунную систему, улучшает пищеварение и обмен веществ,… РИА Новости Спорт, 19.03.2021
2021-02-03T15:25
2021-02-03T15:25
2021-03-19T20:42
зож
питание
здоровье
/html/head/meta[@name=’og:title’]/@content
/html/head/meta[@name=’og:description’]/@content
https://cdn25.img.ria.ru/images/150680/11/1506801151_0:254:640:614_1920x0_80_0_0_1ce3155a85b5fd31e7ed65ace030e040.jpg
МОСКВА, 3 фев — РИА Новости. Цинк — один из важнейших для здоровья микроэлементов: он снабжает организм энергией, поддерживает иммунную систему, улучшает пищеварение и обмен веществ, рассказала диетолог и доктор медицинских наук Синтия Сасс. Оказывается, цинк положительно влияет и на состояние мозга. Согласно результатам исследования, опубликованным в 2017 году в Международном журнале молекулярных наук, изменение баланса цинка в мозге связано с болезнью Альцгеймера, снижением когнитивной функции и депрессией. Еще одна важная роль цинка — в восстановлении организма, а также поддержании здоровья кожи и слизистых оболочек, способствующих быстрому заживлению ран. Нехватка цинка влияет и на аппетит, утверждает эксперт. В каких продуктах содержится цинк Цинк легко найти как в продуктах животного, так и растительного происхождения. Основные источники животного происхождения: устрицы (чемпион по содержанию цинка), говядина, крабы, лобстеры, свинина и йогурт. К растительным источникам относятся: запеченные бобы, семена тыквы, семена кунжута, кешью, нут, чечевица, киноа, овсяные хлопья и злаки. Суточная потребность взрослого мужчины (от 19 лет) в цинке составляет 11 миллиграммов в день, у женщин — 8 миллиграммов. Для беременных и кормящих женщин доза должна быть увеличена на три-четыре миллиграмма. Например, в одной чашке запеченной фасоли содержит 5,8 миллиграмма цинка.
Еще одна важная роль цинка — в восстановлении организма, а также поддержании здоровья кожи и слизистых оболочек, способствующих быстрому заживлению ран. Нехватка цинка влияет и на аппетит, утверждает эксперт. В каких продуктах содержится цинк Цинк легко найти как в продуктах животного, так и растительного происхождения. Основные источники животного происхождения: устрицы (чемпион по содержанию цинка), говядина, крабы, лобстеры, свинина и йогурт. К растительным источникам относятся: запеченные бобы, семена тыквы, семена кунжута, кешью, нут, чечевица, киноа, овсяные хлопья и злаки. Суточная потребность взрослого мужчины (от 19 лет) в цинке составляет 11 миллиграммов в день, у женщин — 8 миллиграммов. Для беременных и кормящих женщин доза должна быть увеличена на три-четыре миллиграмма. Например, в одной чашке запеченной фасоли содержит 5,8 миллиграмма цинка.
https://rsport.ria.ru/20210202/sukhofrukty-1595701511.html
https://rsport.ria.ru/20210202/vitaminy-1595583349.html
РИА Новости Спорт
internet-group@rian. ru
ru
7 495 645-6601
ФГУП МИА «Россия сегодня»
https://xn--c1acbl2abdlkab1og.xn--p1ai/awards/
2021
РИА Новости Спорт
7 495 645-6601
ФГУП МИА «Россия сегодня»
https://xn--c1acbl2abdlkab1og.xn--p1ai/awards/
Новости
ru-RU
https://rsport.ria.ru/docs/about/copyright.html
https://xn--c1acbl2abdlkab1og.xn--p1ai/
РИА Новости Спорт
7 495 645-6601
ФГУП МИА «Россия сегодня»
https://xn--c1acbl2abdlkab1og.xn--p1ai/awards/
https://cdn25.img.ria.ru/images/150680/11/1506801151_0:80:640:560_1920x0_80_0_0_4e3478d499ca1c8004bea83800e86dc5.jpgРИА Новости Спорт
7 495 645-6601
ФГУП МИА «Россия сегодня»
https://xn--c1acbl2abdlkab1og.xn--p1ai/awards/
РИА Новости Спорт
7 495 645-6601
ФГУП МИА «Россия сегодня»
https://xn--c1acbl2abdlkab1og. xn--p1ai/awards/
xn--p1ai/awards/
питание, здоровье
Полезные омега-3 и омега-6 жирные кислоты содержатся и в пчелином хлебе
При современном стремительном ритме жизни трудно получить все необходимые организму вещества. В том числе и важные для организма омега-3 и омега-6 жирные кислоты, которые необходимы для создания новых и восстановления имеющихся клеток, развития кровеносных сосудов и нервов, а также для сохранения структуры кожи.
Наше тело не может самостоятельно произвести омега-3 и омега-6 жирные кислоты, поэтому важно получать их с пищей.
Какие функции выполняет каждая из этих жирных кислот?
Омега-3 и омега-6 принадлежат к полиненасыщенным жирным кислотам. Они играют важную роль в нормальном течении воспалительных процессов и формировании нормальных иммунных реакций, так как эти кислоты стабилизируют мембраны клеток иммунной системы. Абсолютно необходимыми незаменимыми полиненасыщенными жирными кислотами являются линолевая кислота (омега-6), линоленовая кислота (омега-3) и олеиновая кислота (омега-9).
Остальные длинные ненасыщенные жирные кислоты, необходимые человеческому организму, образуются из упомянутых жирных кислот или поступают с пищей. Поэтому важно следить за тем, чтобы в рационе присутствовали омега-3 и омега-6 жирные кислоты.
Омега-3 жирные кислоты поддерживают эластичность мембраны, здоровье сердечно-сосудистой системы, а также уменьшают воспаление. На самом деле, они оказывают положительное влияние на весь организм, начиная с развития плода и заканчивая правильным функционированием сетчатки глаза. Прием омега-3 жирных кислот также улучшает работу мозга и настроение. Кроме того, снижается риск развития неврологических заболеваний.
Омега-6 жирные кислоты, в свою очередь, оказывают благоприятное действие на здоровье сердечно-сосудистой системы, укрепляют иммунитет, а также участвуют в процессах обмена веществ в организме. Они также необходимы для нормальной работы мозга и роста волос и ногтей.
Важна пропорция омега-3 и омега-6 жирных кислот.

Так как в нашем теле нет энзимов, которые могли бы произвести эти жирные кислоты, мы можем полагаться только на питание, с помощью которого можно обеспечить правильный баланс омега-3 и омега-6 в организме.
В наши дни большая часть популяции принимает с продуктами питания в основном омега-6 жирные кислоты, а количество омега-3 остается беспримерно маленьким. Наши организмы приспособлены к соотношению омега жирных кислот 1:4 – 1:6 (омега-3 : омега-6), где соответственно количество омега-6 в 4-6 раз превышает количество омега-3. Но современная реальность относительно нашего ежедневного питания на самом деле способствует непропорциональному содержанию омега-3 и омега-6 – 1:10, а в Соединенных Штатах Америки даже до 1:20.
Чрезмерное количество омега-6 жирных кислот или, точнее говоря, неадекватное соотношение омега-3 и омега-6 жирных кислот может способствовать развитию воспалительных процессов в организме, оказывать негативное влияние на функцию внутреннего слоя кровеносных сосудов и уменьшать концентрацию холестерина высокой плотности («хорошего» холестерина). Также чрезмерное употребление омега-3 продлевает время кровотечения.
Также чрезмерное употребление омега-3 продлевает время кровотечения.
Что нарушает нужную пропорцию жирных кислот?
Развитие общества в индустриальном направлении является основной причиной того, что соотношение омега-3 и омега-6 так резко изменилось.
Усиленное потребление растительных масел (рапсового, соевого, подсолнечного и др.), а также чрезмерное употребление в пищу колбас, сладостей и кондитерских изделий увеличивает удельный вес омега-6 жирных кислот в организме.
К сожалению, и наш образ жизни усиленно выжигает омега-3 жирные кислоты (стресс, большое потребление сахара и др.), которые мы получаем с пищей. Также проблему усиливает и то, что мы все меньше включаем в свой рацион продукты, богатые омега-3 жирными кислотами.
Как можно дополнительно получить обе жирные кислоты?
Омега-3 жирные кислоты принадлежат к группе незаменимых жирных кислот, то есть организм не может произвести их самостоятельно, поэтому эти жирные кислоты нужно получать с пищей.
Зная о том, что большинство людей получают намного меньше омега-3 жирных кислот, чем омега-6, следует позаботиться о том, чтобы в рацион чаще включались продукты,
богатые омега-3 жирными кислотами.
Наиболее известными продуктами, богатыми длинными жирными кислотами группы омега-3, являются лосось, сельдь, скумбрия, салака, форель и треска.
В свою очередь, продуктами, в которых содержится много коротких жирных кислот группы омега-3, являются льняное, рапсовое, соевое и подсолнечное масло, а также арахис. Но мы нашли менее известную альтернативу, которая способна обеспечить организм всеми тремя жирными кислотами и другими необходимыми организму веществами – пчелиный хлеб.
Возможно, свое название пчелиный хлеб получил именно из-за того, что пчелы с его помощью обеспечивают свой организм белками, углеводами, витаминами и другими важными питательными веществами.
Для того чтобы сделать пчелиный хлеб, пчелы сначала собирают цветочную пыльцу, доставляют ее в улей и складывают в пустые соты из пчелиного воска. Далее цветочная пыльца смешивается со слюной и нектаром, что обеспечивает правильные условия для ферментации.
Далее цветочная пыльца смешивается со слюной и нектаром, что обеспечивает правильные условия для ферментации.
После того, как цветочная пыльца законсервирована, начинается процесс ферментации, конечным продуктом которого является пчелиный хлеб.
Оказывается, пчелы начали использовать процесс ферментации намного раньше, чем мы, люди. Полученный продукт намного полезнее цветочной пыльцы, так как многие содержащиеся в нем питательные вещества становятся более доступными нашему организму в результате их расщепления.
Также по сравнению с цветочной пыльцой пчелиный хлеб не вызывает аллергии.
Особый состав пчелиного хлеба
Пчелиный хлеб – это созданный пчелами продукт с впечатляющим разнообразием биологически активных веществ.
Благодаря процессу ферментации пчелиный хлеб имеет в 2-3 раза большую пищевую ценность и обладает более сильным антибактериальным действием, чем цветочная пыльца.
Пчелиный хлеб содержит комплекс омега-3-6-9, при этом в очень хорошем соотношении, чтобы можно было получать больше омега-3, а не омега-6 жирных кислот.
В его состав также входят витамины A, B1, B2, B3, B6, C, PP, E, D, K и H. В пчелином хлебе есть также железо, магний, кальций, калий, а также многие другие минеральные вещества.
А еще в пчелином хлебе намного больше белка, чем, например, в мясе, рыбе или молоке. Дополнительную добавочную ценность пчелиному хлебу придает процесс его создания – он получается экологически чистым способом.
10 продуктов, которые обеспечат вас магнием
Зачем вам нужен магний
Это один из важнейших минералов , без которых ваше тело жить не может. В прямом смысле.
Магний — ключевой участник более чем 300 химических реакций, благодаря которым происходит обмен веществ. Он обеспечивает подвижность и правильную работу мышц. Благодаря ему нервная система корректно передаёт сигналы от мозга к различным органам и тканям и обратно. Внутри мозга, впрочем, тоже.
Внутри мозга, впрочем, тоже.
Магний помогает поддерживать стабильный сердечный ритм и сбалансированный уровень сахара в крови. Также минерал принимает непосредственное участие в синтезе белков и ДНК, то есть помогает организму восстанавливаться, сохранять здоровье и молодость.
Откуда берётся магний и сколько его нужно
Несмотря на столь высокую важность, наше тело не умеет производить магний самостоятельно — мы получаем его из пищи. Женщинам от 19 лет и старше, чтобы оставаться здоровыми, необходимо 310 мг магния в день (беременным — до 350 мг), мужчинам до 30 лет — 400 мг, старше 30 лет — 420 мг.
Альтернативный вариант — получать магний из поливитаминов и биодобавок. Однако в этом случае есть риск перестараться. Переизбыток магния проявляет себя тошнотой, спазмами желудка, диареей, а в некоторых случаях может привести к сердечной аритмии и даже остановке сердца.
Поэтому ни в коем случае не принимайте биодобавки с магнием, если у вас есть:
- проблемы с сердцем;
- почечная недостаточность;
- непроходимость кишечника;
- миастения.

Обычная пища — куда более безопасный способ получить ежедневную дозу магния. Даже если вы съедите чересчур много продуктов, которые содержат этот минерал, почки выведут избыток с помощью мочи. И вы не получите ничего, кроме пользы.
В каких продуктах магния содержится больше всего
1. Чёрный шоколад
Фото: Vie Studio / PexelsВ одной 100‑граммовой плитке содержится до 200 мг магния — то есть как минимум половина рекомендуемой дневной дозы.
Также шоколад богат железом, медью, марганцем и антиоксидантами — веществами, которые защищают клетки организма от разрушительного воздействия свободных радикалов. Чтобы получить из шоколада максимум пользы, выбирайте продукт, содержащий не менее 70% какао.
2. Авокадо
Фото: Dream79 / Depositphotos58 мг магния на один фрукт средних размеров (или около 30 мг на 100 г) — очень неплохой результат. Кроме того, в авокадо много калия, витаминов группы В, витамина К и мононенасыщенных жиров, крайне полезных для сердечно‑сосудистой системы.
Отдельная тема — клетчатка. Авокадо ею буквально переполнено: 13 из 17 г углеводов, приходящихся на средний фрукт, — это она, полезная. Клетчатка улучшает пищеварение, способствует снижению уровня сахара в крови и позволяет надолго сохранить чувство сытости после еды. Всё это делает авокадо не только полезным, но и диетическим продуктом, помогающим контролировать вес.
3. Орехи
Кешью. Фото: tookapic / PixabayМагний содержится практически во всех видах орехов, но особенно богаты им миндаль, кешью и бразильский орех. Например, 100 г кешью обеспечат вашему организму почти 300 мг минерала.
Также большинство орехов являются хорошим источником белка, всё той же полезной клетчатки и мононенасыщенных жиров.
4. Бобовые
Фото: artverau / PixabayЧечевица, фасоль, нут, горох, соя — выбирайте любой из этих продуктов: в них всех не менее 30 мг магния на 100 г. Чемпион — чёрная фасоль, в 100 г которой содержится 70 мг жизненно важного минерала.
5. Тофу
Фото: Polina Tankilevitch / PexelsСоевый сыр тофу — отличный заменитель мяса, поскольку содержит огромное количество белка. Но и магния в нём немало — 53 мг на 100‑граммовую порцию. Также знаменитый соевый творог — щедрый источник кальция, железа, марганца и селена.
6. Киноа
Фото: pictavio / PixabayВ популярной крупе содержится больше белка, чем в любых других зерновых. Ещё в киноа много железа, фолиевой кислоты (витамина В9), меди, марганца… И, конечно, магния : 64 мг на 100‑граммовую порцию готовой каши.
7. Жирная рыба
Лосось. Фото: congerdesign / PixabayОсобенно богаты магнием лосось, палтус, атлантическая скумбрия, минтай. Например, в небольшом 100‑граммовом кусочке филе минтая важного минерала около 30 мг .
Тот же кусочек обеспечит вас 20 г высококачественного белка, а также приличными дозами калия, селена, витаминов группы В и незаменимыми жирными кислотами омега‑3.
8. Шпинат
Фото: ponce_photography / Pixabay88 мг магния на каждые 100 г сырого или приготовленного (например в качестве начинки для пирога) шпината. Несколько меньшее, но тоже заметное количество минерала содержится и в другой листовой зелени — капусте, зелени репы и горчицы.
Несколько меньшее, но тоже заметное количество минерала содержится и в другой листовой зелени — капусте, зелени репы и горчицы.
9. Цельнозерновые каши, отруби, хлеб из цельнозерновой муки
Фото: Couleur / PixabayПшеница, овёс, ячмень, а также псевдозерновая культура гречка тоже богаты магнием. Например, в гречке его — более 230 мг на 100 г. А в цельнозерновой муке — около 140 мг на тот же вес.
10. Бананы
Фото: Martina Bulková / PixabayОдин крупный банан весом чуть более 200 г обеспечит вашему организму примерно 60 мг магния. Это делает бананы чемпионами среди фруктов по содержанию данного минерала.
Читайте также 🍎🥕🥑
Нурофен детский сироп со вкусом клубники (суспензия): инструкция, цена, состав, противопоказания
© 2021 Рекитт Бенкизер Хэлскэр. Все права защищены ООО «Рекитт Бенкизер Хэлскэр», 115114, г. Москва, Шлюзовая наб. 4, этаж 3. Тел. горячей линии: 8 800 200 82 20 (звонок по России бесплатный). 18+ Рег. уд. ЛСР — 005587/10, П N014560/01, ЛП-001910, ЛП – 001984, П N013012/01, П N015794/01, П N016033/01,
4, этаж 3. Тел. горячей линии: 8 800 200 82 20 (звонок по России бесплатный). 18+ Рег. уд. ЛСР — 005587/10, П N014560/01, ЛП-001910, ЛП – 001984, П N013012/01, П N015794/01, П N016033/01,
ЛСР — 006017/08, П N014745/01, ЛП-003836.
1 Согласно инструкции по медицинскому применению Нурофен® в форме таблеток, покрытых оболочкой (200 мг), РУ П N013012/01. Согласно инструкции по медицинскому применению Нурофен® Форте, таблетки, покрытые оболочкой (400 мг). РУ П N016033/01. Согласно инструкции по медицинскому применению Нурофен® Экспресс, 200 мг, РУ П N014560/01. Согласно инструкции по медицинскому применению Нурофен® Экспресс Форте, капсулы (400 мг). РУ ЛСР-005587/10. Согласно инструкции по медицинскому применению Нурофен® Интенсив, таблетки, покрытые пленочной оболочкой. РУ ЛП-003836. Согласно инструкции по медицинскому применению Нурофен® Экспресс Леди, таблетки, покрытые оболочкой (400 мг). РУ ЛП-001984. Согласно инструкции по медицинскому применению препарата Нурофен® для детей, суспензия для приема внутрь [апельсиновая, клубничная]. РУ П N014745/01. Согласно инструкции по медицинскому применению препарата Нурофен® 12+, таблетки, покрытые оболочкой, 200 мг. РУ ЛП-001910.
РУ П N014745/01. Согласно инструкции по медицинскому применению препарата Нурофен® 12+, таблетки, покрытые оболочкой, 200 мг. РУ ЛП-001910.
2 Согласно данным базы ООО «АЙКЬЮВИА Солюшнс» «Фарматренд ГЛС и БАД в РФ», по итогам периода январь – ноябрь 2020 года бренд Нурофен® является лидером по объему продаж в упаковках и в рублях в розничных ценах в группе 02 «Анальгетики» в России (классификация «Consumer Healthcare»).
3 Планируемые изменения в инструкции по медицинскому применению в соответствии с письмом Минздрава России №20-3/2565 от 23.11.2020.
*Согласно инструкции по медицинскому применению. Полный спектр показаний к применению указан в инструкции по медицинскому применению препарата.
Arpimed
Вождение автотранспорта и управление механизмами
Этот препарат может вызвать наступление побочных эффектов, которые могут повлиять на Вашу способность водить автотранспорт или управлять механизмами. Перед тем, как сесть за руль или приступить к управлению механизмами, убедитесь в том, что Ваши реакции соответствуют норме.
Важная информация о некоторых ингредиентах, входящих в состав Альбендазола
Альбендазол содержит моногидрат лактозы. Если врач сказал, что у Вас имеется непереносимость к некоторым видам сахаров, то посоветуйтесь со своим врачом, прежде чем начинать прием этого препарата.
В препарате содержится достаточное количество натрия, следует учитывать данный факт, если Вы на натриевой диете.
Как принимать Албендазол
Альбендазол следует принимать в точности так, как предписано врачом. Если у Вас есть какие-либо сомнения по поводу приема препарата, то Вам следует проконсультироваться с лечащим врачом или фармацевтом
Рекомендуемая доза:
Кишечные инфекции и кожный синдром Larva Migrans
| Инфекция | Возраст | Продолжительность приема |
| Энтеробиоз, анкилостомидоз, аскаридоз, трихоцефалез некатороз, | Взрослые и дети старше 6 лет | 400 мг 1 раз/сут однократно |
| Стронгилоидоз, тениоз, гименолепидоз | Взрослые и дети старше 6 лет | 400 мг 1 раз/сут в течение 3 дней. При гименолепидозе рекомендуется повторный курс лечения продолжительностью от 10 дней до 21 дня. При гименолепидозе рекомендуется повторный курс лечения продолжительностью от 10 дней до 21 дня. |
| Клонорхоз, описторхоз | Взрослые и дети старше 6 лет | 400 мг 2 раза/сут в течение 3 дней |
| Кожный синдром Larva Migrans | Взрослые и дети старше 6 лет | 400мг 1раз/сут. Продолжительность приема от 1 дня до 3 дней |
| Лямблиоз | Только дети от 6 до 12 лет | 400 мг 1 раз/ в течение 5 дней |
Системные гельминтные инфекции (продолжительное лечение более высокими дозами)
Режим дозирования устанавливается индивидуально в зависимости от возраста, массы тела, а также от степени тяжести инфекции.
| Инфекция | Продолжительность приема |
| Кистозный эхинококкоз | 28 дней. При неоперабельной форме рекомендуется три 28-дневных цикла лечения, разделенных 14-дневным перерывом в приеме препарата. Перед операцией рекомендовано два 28-дневных цикла, разделенных 14-дневным перерывом в приеме препарата. Если дооперационный курс меньше 14 дней или найдены жизнеспособные кисты, то после операции проводят два цикла по 28 дней, разделенных 14-дневным перерывом в приеме препарата При неоперабельной форме рекомендуется три 28-дневных цикла лечения, разделенных 14-дневным перерывом в приеме препарата. Перед операцией рекомендовано два 28-дневных цикла, разделенных 14-дневным перерывом в приеме препарата. Если дооперационный курс меньше 14 дней или найдены жизнеспособные кисты, то после операции проводят два цикла по 28 дней, разделенных 14-дневным перерывом в приеме препарата |
| Альвеолярный эхинококкоз | 28 дней. Второй 28- дневный курс повторяют после двухнедельного перерыва в приеме препарата. Лечение может быть продолжено в течение нескольких месяцев или лет. |
| Нейроцистицеркоз | Продолжительность приема от 7 дней до 31 дня. Второй курс можно повторить после двухнедельного перерыва в приеме препарата. |
| Гепатиколез | 400 мг 1 раз/сут в течение 10 дней. |
| Гнатостомоз | 400 мг 1 раз/сут в течение 10-20 дней. |
| Трихинеллез, токсокароз | 400 мг 2 течение 5-10 дней. |
Как принимать:
Альбендазол принимают перорально, во время еды. Рекомендуется принимать таблетки в одно и тоже время каждый день (например: утром и вечером). Если Вы испытываете трудности при проглатывании таблетки, то можно их сначала разжевать/измельчить, а затем запить водой.
Если Вы приняли больше Альбендазола, чем Вам рекомендовано:
Если Вы приняли слишком много таблеток, немедленно свяжитесь с врачом или обратитесь в ближайшую больницу или в отделение неотложной помощи. Возьмите с собой этот листок-вкладыш и все таблетки Альбендазола, которые у Вас остались.
Если Вы забыли принять Альбендазол:
Если Вы забыли принять очередную дозу препарата, принимайте ее сразу, как только вспомнили. Если подошло время для принятия следующей дозы, пропущенную дозу не стоит принимать.
Если подошло время для принятия следующей дозы, пропущенную дозу не стоит принимать.
Не следует принимать двойную дозу препарата, чтобы компенсировать пропущенную дозу.
Если у Вас возникли дополнительные вопросы по Альбендазолу, обратитесь к своему лечащему врачу или фармацевту.
Возможные побочные эффекты
Как и все лекарства, Альбендазол может вызвать побочные эффекты, однако они возникают не у каждого пациента.
При развитии каких-либо из следующих побочных реакций, следует прекратить прием Альбендазола и немедленно обратиться к врачу, или в ближайшую больницу и отделение скорой помощи:
Следующие побочные эффекты являются очень редкими и могут наблюдаться не более чем у 1 пациента из 10000)
- Кожные реакции:
Многоформная экссудативная эритема, характеризующаяся зудящими, красновато-фиолетовыми пятнами, располагающимися преимущественно на коже стоп и ладонях, половых органах, на слизистых оболочках глаз и полости рта. Элементы сыпи, могут возвышаться над уровнем кожи.
Элементы сыпи, могут возвышаться над уровнем кожи.
Для многоформной экссудативной эритемы характерны также такие симптомы, как слабость и лихорадка.
- Другие симптомы тяжелых кожных реакций
Изменения цвета кожи, образование пузырей и узелков, пустулы, шелушение, покраснение, боль, зуд, сыпь может носить распространенный характер. Данные явления могут сопровождаться лихорадкой, головной и суставной болью.
Обратите внимание на более серьезные симптомы
У пациентов, которые проходят курс лечения от паразитарных инфекций, может быть обнаружено редкое, но очень серьезное заболевание, которое называется нейроцистицеркоз. При этом больной может не догадываться о своем состоянии.
Развивается нейроцистицеркоз в результате попадания паразита в личиночной стадии в мозг человека. При данной болезни Альбендазол также показан к применению.
Немедленно сообщите врачу если Вы замечаете следующие симптомы:
- Невыносимая головная боль,которую невозможно терпеть
- Тошнота и приступы рвоты
- Судороги (припадки)
- Нарушения зрения
Еще одним редким, но серьезным побочным эффектом, который может вызвать Альбендазол являются:
- Потемнение цвета мочи или обесцвечивание кала
- Пожелтение кожи и белков глаз
Немедленно сообщите врачу если Вы заметили у себя эти симптомы.
Другие возможные побочные эффекты:
Очень частые побочные эффекты (более чем у 1 из 10 пациентов)
- Головная боль
- Изменение картины анализа крови. Если Вам необходимо сдать кровь на анализ, предупредите своего врача о том, что принимаете Альбендазол
Частые побочные эффекты (более чем у 1 из 100 пациентов, но менее чем у 1 из 10)
- Лихорадка
- Головокружение
- Расстройство желудка, тошнота, рвота или желудочные боли
- Истончение или выпадение волос. Однако после прекращения приема Альбендазола волосы восстанавливаются.
Нечастые побочные эффекты (более чем у 1 из 1000, но менее чем у 1 из 100)
- Заболевания печени
- Заболевания со стороны системы кроветворения: лейкопения с последующим развитием различных инфекций (симптомы: лихорадка, озноб, боль в горле или язвы в ротовой полости).

Очень редкие побочные эффекты (менее чем у 1 из 10000)
- Заболевания со стороны системы кроветворения, которые могу вызвать такие симптомы как: усталость, одышку, гематому, или обильные кровотечения (например, носовое кровотечение).
Если Вы отметили какие-либо побочные эффекты, сообщите об этом своему лечащему врачу или фармацевту, в том числе и о побочных эффектах, не перечисленных в этом листке-вкладыше. Также Вы можете сообщить о побочных эффектах непосредственно в Научный центр экспертизы лекарств и медицинских технологий им.академика Э.Габриеляна, переходя на сайт: www.pharm.am в раздел “Сообщить о побочном эффекте лекарства” и заполнить форму “Карта сообщений о побочном действии лекарства”. Телефон горячей линии: +37410237665; +37498773368.
Как хранить Альбендазол
- Не принимать Альбендазол по истечении срока годности, указанного на упаковке препарата.
 При указании срока годности имеется в виду последний день указанного месяца.
При указании срока годности имеется в виду последний день указанного месяца. - Хранить при температуре не выше 250С, в сухом и защищенном от света месте.
- Хранить в недоступном для детей месте.
- Срок годности — 3 года.
Не следует спускать лекарства в сточные воды или в канализацию. Спросите у фармацевта, как распорядиться с препаратом, который Вы больше не будете применять. Эти меры направлены на защиту окружающей среды.
Содержимое упаковки и дополнительная информация
Что содержит Альбендазол
- Активное вещество: альбендазол – 400.0 мг в каждой таблетке;
- Другие компоненты: микрокристаллическая целлюлоза, лактоза моногидратная, повидон, магния стеарат, натрия крахмала гликолат, крахмал кукурузный, натрия лаурил сульфат, краситель красный Е129, натрия сахарин, натрия карбоксиметилцеллюлоза, малиновый ароматизатор.

- Информацию о некоторых компонентах, входящих в состав Альбендазола можно найти в разделе 2
Как выглядит Альбендазол и содержимое упаковки:
Круглые таблетки, с фаской, розового цвета, с вкраплениями и со специфическим ароматом малины.
Описание упаковки
4 таблетки в пластиковом флаконе вместе с листком–вкладышем помещены в картонную упаковку.
Условия отпуска
Отпускается по рецепту.
В каких продуктах содержится омега-6?
Множество внутренних процессов в организме проходит благодаря полиненасыщенным жирным кислотам. Одна из них, омега-6, представляет собой соединение с уникальными молекулами. Она необходима для сбалансированной работы всех внутренних органов и систем. Однако получить ее можно только из определенной пищи.
Организм самостоятельно не вырабатывает линолевую кислоту, поэтому важно побеспокоиться о ее поступлении с пищей для поддержания хорошего самочувствия. При этом важно не переусердствовать, чтобы ее количество не стало избыточным.
При этом важно не переусердствовать, чтобы ее количество не стало избыточным.
Польза омега-6
Наличие в организме жирных кислот этого типа дает человеку энергию, силу, крепкое здоровье. Вещества участвуют в процессе выработки простагландинов, которые отвечают за все действия в теле человека.
Омега-6 – это главная подзарядка для правильной работы сердечно-сосудистой системы. Она отвечает за желудочно-кишечный тракт и репродуктивные органы. На ней лежит ответственность за терморегуляцию и потоотделение человека. Также омега-6 влияет на:
- передачу нейронных импульсов;
- развитие нервной системы;
- формирование плода у беременной женщины;
- «строительство» клеток организма;
- уровень холестерина;
- артериальное давление;
- работу ЖКТ, почек, сердца.
Внимание! Омега-6 необходимо принимать во время гормональных сбоев или физиологических процессов, протекающих в организме.Это может быть беременность, менопауза, предменструальный синдром.
Жирные кислоты также способны создавать липоксин, который является отличным противовоспалительным средством. Это главные составляющие крепкого здоровья, а также красоты и молодости всего тела. Благодаря им волосы, ногти, состояние кожи улучшаются в разы. Омега-6 – главный борец с лишним весом.
Где содержится омега-6?
Получить необходимую дозу полезных жирных кислот можно только из продуктов животного и растительного происхождения. Так как организм сам не вырабатывает омега-6, важно вовремя пополнять ее запас.
Большое количество этого вещества находится в мясе животных и птице. Очень полезным является утиный, куриный и гусиный жир. Большая концентрация омега также присутствует в телятине, постной свинине, куриных яичных желтках, печени. Полезными будут и мясные изделия из страуса и индейки. Полный перечень источников омега-6 можно найти в специальных таблицах.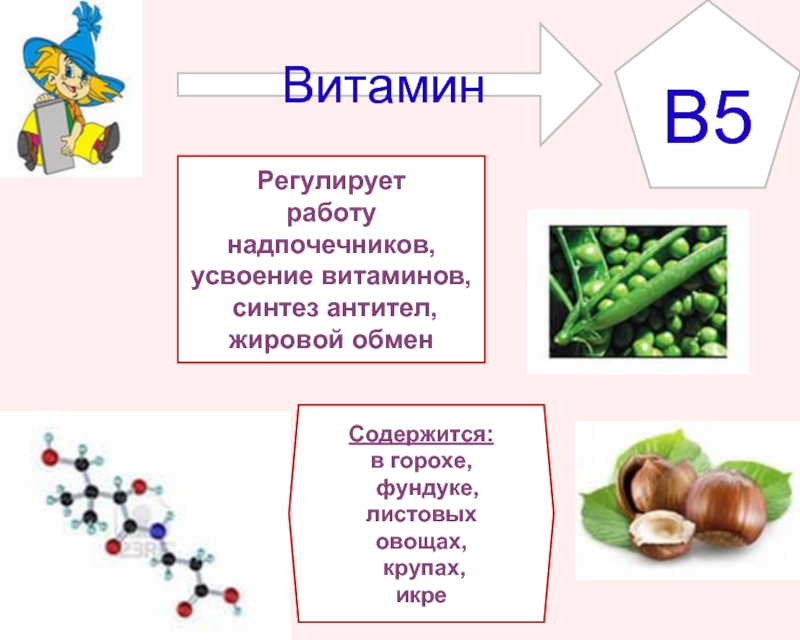
Полезными растительными продуктами принято считать натуральные масла. Самые полезные из них производят из виноградных косточек, сои, подсолнечника, рапса и пальмы. Линолевую кислоту также содержит масло примулы, мака, тыква.
Большие запасы жирных веществ можно найти в семенах, орехах и ягодах. Для поддержания баланса в организме подойдут также фисташки, рисовые отруби, кукуруза, зерновой хлеб, арахис.
Внимание! Лучше поддерживать гармоничный баланс омега-6 и омега-3, вводя в рацион рыбу, морепродукты, водоросли.
Может ли омега-6 навредить?
Польза омега-6 научно доказана специалистами и докторами. Сбалансированное питание позволит сохранять баланс жирных кислот, который положительно сказывается на функционировании всего организма.
Вред может наступить только из-за передозировки, однако случается это очень редко. Избыток жирных кислот может приводить к плохой свертываемости крови и нервным нарушениям (стресс, депрессия).
Избыток жирных кислот может приводить к плохой свертываемости крови и нервным нарушениям (стресс, депрессия).
Необходимо грамотно корректировать свой рацион, вводя в него здоровую растительную пищу высокого качества. Сбалансированное питание будет давать необходимую дозу полезных веществ для крепкого здоровья на долгие годы.
Крот | Химия для неосновных
- Определить моль.
- Определите номер Авогадро.
Есть ли более простой способ загрузить этот грузовик?
В хорошую погоду многие люди начинают работать над своими дворами и домами. Для многих проектов песок необходим в качестве основы для прогулки или для добавления к другим материалам. Вы можете заказать двадцать миллионов песчинок, и люди действительно будут смотреть на вас.Вы можете заказать за фунт, но это займет много времени, чтобы взвесить. Лучше всего заказывать по двору, то есть кубическому ярду. Погрузчик может легко собрать все, что вам нужно, и положить прямо в грузовик.
Номер Авогадро
Определенно легко сосчитать бананы или сосчитать слонов (если вы не мешаете им). Однако вам придется долго-долго считать сахарные зерна из своей канистры. Атомы и молекулы чрезвычайно малы — намного меньше, чем крупинки сахара.Считать атомы или молекулы не только неразумно, но и совершенно невозможно. Одна капля воды содержит около 10 22 молекул воды. Если бы вы считали 10 молекул каждую секунду в течение 50 лет без остановки, вы бы насчитали только 1,6 × 10 10 молекул. Другими словами, при такой скорости счета вам потребуется более 30 триллионов лет, чтобы подсчитать молекулы воды в одной крошечной капле.
Химикам требовалось название, которое могло бы обозначать очень большое количество предметов.Амедео Авогадро (1776 — 1856), итальянский ученый, назвал именно такое число. Он отвечает за счетную единицу измерения, называемую кротом. моль (моль) — это количество вещества, которое содержит 6,02 × 10 23 репрезентативных частиц этого вещества. Моль — это единица СИ для количества вещества. Как и «дюжина» и «брутто», это имя обозначает число. Следовательно, в моль молекул воды имеется 6,02 × 10 23 молекул воды.Также было бы 6,02 × 10 23 бананов в моле бананов, если бы когда-либо существовало такое огромное количество бананов.
Моль — это единица СИ для количества вещества. Как и «дюжина» и «брутто», это имя обозначает число. Следовательно, в моль молекул воды имеется 6,02 × 10 23 молекул воды.Также было бы 6,02 × 10 23 бананов в моле бананов, если бы когда-либо существовало такое огромное количество бананов.
Рисунок 10.1
Итальянский ученый Амедео Авогадро, работа которого привела к концепции моль как счетной единицы в химии.
Число 6,02 × 10 23 называется числом Авогадро , числом типичных частиц в кроте. Это экспериментально определенное число.Типичная частица — это наименьшая единица, в которой вещество существует в природе. Для большинства элементов характерной частицей является атом. Железо, углерод и гелий состоят из атомов железа, углерода и гелия соответственно. В природе существует семь элементов в виде двухатомных молекул: H 2 , N 2 , O 2 , F 2 , Cl 2 , Br 2 и I 2 . Типичной частицей этих элементов является молекула.Точно так же все молекулярные соединения, такие как H 2 O и CO 2 , существуют в виде молекул, и поэтому молекула является их типичной частицей. Для ионных соединений, таких как NaCl и Ca (NO 3 ) 2 , типичной частицей является формульная единица. Моль любого вещества содержит число Авогадро (6,02 × 10 23 ) репрезентативных частиц.
Типичной частицей этих элементов является молекула.Точно так же все молекулярные соединения, такие как H 2 O и CO 2 , существуют в виде молекул, и поэтому молекула является их типичной частицей. Для ионных соединений, таких как NaCl и Ca (NO 3 ) 2 , типичной частицей является формульная единица. Моль любого вещества содержит число Авогадро (6,02 × 10 23 ) репрезентативных частиц.
Рисунок 10.2
Животный крот сильно отличается от счетной единицы крота.Тем не менее химики сделали крота своим неофициальным талисманом. Национальный день кротов — это праздник химии, который проводится 23 октября (23 октября) каждого года.
Сводка
- Моль любого вещества содержит число Авогадро (6,02 × 10 23 ) репрезентативных частиц.
Практика
Вопросы
Воспользуйтесь ссылкой ниже, чтобы ответить на следующие вопросы:
http: //www. scientificamerican.ru / article.cfm? id = how-was-avogadros-number
scientificamerican.ru / article.cfm? id = how-was-avogadros-number
- Какова была гипотеза Авогадро?
- Кто первым вычислил это число?
- Кто придумал термин «число Авогадро»?
- Какой вклад внес Роберт Милликен в определение значения числа?
Обзор
Вопросы
- Что такое единица СИ для количества вещества?
- Что представляет собой репрезентативная частица для элемента?
- Формульная единица — репрезентативная частица для чего?
- Число Авогадро: Число репрезентативных частиц в кроте, 6.02 × 10 23 .
- моль (моль): количество вещества, которое содержит 6,02 × 10 23 типичных частиц этого вещества.
- репрезентативная частица : наименьшая единица, в которой вещество существует в природе.
- Выполните вычисления, включающие преобразования между числом молей и числом атомов или молекул.

Большие числа или маленькие числа?
Вы ненавидите набирать нижние и верхние индексы? Даже с хорошей программой обработки текстов необходимость щелкнуть значок, чтобы получить верхний индекс, а затем не забыть щелкнуть после ввода числа, может быть настоящей проблемой.Если бы мы не знали о молях и просто знали о количестве атомов или молекул (те большие числа, которые требуют большого количества надстрочных индексов), жизнь была бы намного сложнее, и мы допустили бы намного больше ошибок при вводе.
Преобразования между молями и атомами
Преобразование между молями и числом частиц
Используя наши методы преобразования единиц измерения, мы можем использовать метку «моль» для преобразования числа частиц в число молей и обратно.
Пример задачи 1: преобразование числа частиц в моли
Углерод существует в двух основных формах: графит и алмаз.Сколько молей атомов углерода составляет 4,72 × 10 24 атомов углерода?
Шаг 1: Составьте список известных количеств и спланируйте проблему.
Известно
- количество атомов C = 4,72 × 10 24
- 1 моль = 6,02 × 10 23 атомов
Неизвестно
Один коэффициент преобразования позволит нам преобразовать количество атомов углерода в моль атомов углерода.
Шаг 2: Рассчитать.
Шаг 3. Подумайте о своем результате.
Указанное число атомов углерода было больше числа Авогадро, поэтому число молей атомов углерода превышает 1 моль. Поскольку число Авогадро представляет собой измеряемую величину с тремя значащими цифрами, результат вычисления округляется до трех значащих цифр.
Предположим, вы хотите знать, сколько атомов водорода содержится в одном моле молекул воды. Во-первых, вам нужно знать химическую формулу воды: H 2 O. В каждой молекуле воды есть два атома водорода.Сколько атомов водорода было бы в двух молекулах воды? Было бы 2 × 2 = 4 атома водорода. Как насчет дюжины? В этом случае дюжина равна 12, так что 12 × 2 = 24 атома водорода в дюжине молекул воды. Чтобы получить ответы (4 и 24), вам нужно было умножить данное количество молекул на два атома водорода на молекулу. Таким образом, чтобы найти количество атомов водорода в одном моле молекул воды, проблему можно решить, используя коэффициенты пересчета.
Чтобы получить ответы (4 и 24), вам нужно было умножить данное количество молекул на два атома водорода на молекулу. Таким образом, чтобы найти количество атомов водорода в одном моле молекул воды, проблему можно решить, используя коэффициенты пересчета.
Первый коэффициент преобразования конвертирует из молей частиц в количество частиц.Второй коэффициент преобразования отражает количество атомов, содержащихся в каждой молекуле.
Рисунок 10.3
Две молекулы воды содержат 4 атома водорода и 2 атома кислорода. Моль молекул воды содержит 2 моля атомов водорода и 1 моль атомов кислорода.
Пример задачи 2: атомы, молекулы и молекулы
Серная кислота имеет химическую формулу H 2 SO 4 . В определенном количестве серной кислоты содержится 4.89 × 10 25 атомов кислорода. Сколько молей серной кислоты в образце?
Шаг 1: Составьте список известных количеств и спланируйте проблему.
Известно
- 4,89 × 10 25 = атомы O
- 1 моль = 6,02 × 10 23 молекул H 2 SO 4
Неизвестно
- моль H 2 SO 4 молекул
Будут использоваться два коэффициента преобразования.Сначала превратите атомы кислорода в молекулы серной кислоты. Затем преобразуйте молекулы серной кислоты в моль серной кислоты.
Шаг 2: Рассчитать.
Шаг 3. Подумайте о своем результате.
Первоначальное количество атомов кислорода было примерно в 80 раз больше, чем число Авогадро. Поскольку каждая молекула серной кислоты содержит 4 атома кислорода, имеется около 20 молей молекул серной кислоты.
Сводка
- Описаны методы превращений между молями, атомами и молекулами.
Практика
Прочтите соответствующие части следующей статьи и выполните задачи 3, 5, 9, 13 и 18. Не беспокойтесь о расчетах, связанных с преобразованием молярной массы (это будет дальше).
http://faculty.rcc.edu/freitas/1AWorksheets/14GramsToMolesToMolecules.pdf
Обзор
Вопросы
- Какое важное число нам нужно знать, чтобы выполнять эти преобразования?
- Я хочу преобразовать атомы в моли.Мой друг говорит мне умножить количество атомов на 6,02 × 10 23 атомов / моль. Это верно?
- Почему я должен знать формулу молекулы, чтобы вычислить количество молей одного из атомов?
- Определите молярную массу.
- Выполните вычисления с использованием молярной массы.
Как мне узнать, сколько каждого вещества добавить при создании раствора?
Я хочу приготовить решение, содержащее 1.8 моль дихромата калия. У меня нет весов, откалиброванных в молекулах, но у меня есть весы, калиброванные в граммах. Если я знаю соотношение между родинками и количеством граммов в родинке, я могу использовать весы, чтобы отмерить необходимое количество материала.
Молярная масса
Молярная масса определяется как масса одного моля типичных частиц вещества. Посмотрев на таблицу Менделеева, можно сделать вывод, что молярная масса лития составляет 6,94 г, молярная масса цинка — 65.38 г, а молярная масса золота 196,97 г. Каждая из этих величин содержит 6,02 × 10 23 атомов этого конкретного элемента. Единицы измерения молярной массы — граммы на моль или г / моль.
Молярные массы соединений
Молекулярная формула соединения двуокиси углерода CO 2 . Одна молекула углекислого газа состоит из 1 атома углерода и 2 атомов кислорода. Мы можем вычислить массу одной молекулы углекислого газа, сложив вместе массы 1 атома углерода и 2 атомов кислорода.
Молекулярная масса соединения — это масса одной молекулы этого соединения. Молекулярная масса диоксида углерода составляет 44,01 а.е.м.
Молярная масса любого соединения — это масса в граммах одного моля этого соединения. Один моль молекул диоксида углерода имеет массу 44,01 г, а один моль формульных единиц сульфида натрия имеет массу 78,04 г. Молярные массы составляют 44,01 г / моль и 78,04 г / моль соответственно. В обоих случаях это масса 6,02 × 10 23 репрезентативных частиц.Типичная частица CO 2 — это молекула, а для Na 2 S — формульная единица.
Один моль молекул диоксида углерода имеет массу 44,01 г, а один моль формульных единиц сульфида натрия имеет массу 78,04 г. Молярные массы составляют 44,01 г / моль и 78,04 г / моль соответственно. В обоих случаях это масса 6,02 × 10 23 репрезентативных частиц.Типичная частица CO 2 — это молекула, а для Na 2 S — формульная единица.
Задача с образцом: молярная масса соединения
Нитрат кальция, Ca (NO 3 ) 2 , используется в качестве компонента удобрения. Определите молярную массу нитрата кальция.
Шаг 1: Составьте список известных и неизвестных количеств и спланируйте проблему.
Известно
- формула = Ca (NO 3 ) 2
- молярная масса Ca = 40.08 г / моль
- молярная масса N = 14,01 г / моль
- молярная масса O = 16,00 г / моль
Неизвестно
Сначала нам нужно проанализировать формулу. Поскольку у Ca отсутствует нижний индекс, на формульную единицу приходится один атом Ca. Число 2 за скобками означает, что на формульную единицу приходится два нитрат-иона, и каждый нитрат-ион состоит из одного атома азота и трех атомов кислорода. Следовательно, всего на формульную единицу приходится 1 × 2 = 2 атома азота и 3 × 2 = 6 атомов кислорода.Таким образом, 1 моль нитрата кальция содержит 1 моль атомов Ca, 2 моль атомов N и 6 моль атомов O.
Число 2 за скобками означает, что на формульную единицу приходится два нитрат-иона, и каждый нитрат-ион состоит из одного атома азота и трех атомов кислорода. Следовательно, всего на формульную единицу приходится 1 × 2 = 2 атома азота и 3 × 2 = 6 атомов кислорода.Таким образом, 1 моль нитрата кальция содержит 1 моль атомов Ca, 2 моль атомов N и 6 моль атомов O.
Шаг 2: Рассчитать.
Используйте молярные массы каждого атома вместе с числом атомов в формуле и сложите.
Сводка
- Расчеты описаны для определения молярной массы атома или соединения.
Практика
Прочтите материал по ссылке ниже и решите задачи в конце:
http: // misterguch.brinkster.net/molarmass.html
Обзор
Вопросы
- Какова молярная масса Pb?
- Почему нам нужно включать единицы измерения в наш ответ?
- Я хочу рассчитать молярную массу CaCl 2 . Сколько молей Cl содержится в одном моле соединения?
- Сколько молей H содержится в соединении (NH 4 ) 3 PO 4 ?
- молярная масса : масса одного моля типичных частиц вещества.

- молекулярная масса : масса одной молекулы этого соединения.
- Выполните вычисления, касающиеся преобразования между молями и массой.
Как получить больше продукции?
Химические заводы всегда стремятся улучшить свои производственные процессы. Один из способов достижения этого улучшения — измерение количества материала, образующегося в результате реакции. Зная, сколько производится, ученые и инженеры могут пробовать разные способы получения большего количества продукции с меньшими затратами.
Преобразование молей в массу
Молярная масса любого вещества — это масса одного моля репрезентативных частиц этого вещества в граммах. Типичные частицы могут быть атомами, молекулами или формульными единицами ионных соединений. Это соотношение часто используется в лаборатории. Предположим, что для определенного эксперимента вам нужно 3,00 моль хлорида кальция (CaCl 2 ). Поскольку хлорид кальция является твердым веществом, было бы удобно использовать весы для измерения необходимой массы.Молярная масса CaCl 2 составляет 110,98 г / моль. В таком случае коэффициент преобразования, который можно использовать, основан на том, что 1 моль = 110,98 г CaCl 2 . Анализ размеров позволит вам рассчитать массу CaCl 2 , которую вы должны измерить.
Поскольку хлорид кальция является твердым веществом, было бы удобно использовать весы для измерения необходимой массы.Молярная масса CaCl 2 составляет 110,98 г / моль. В таком случае коэффициент преобразования, который можно использовать, основан на том, что 1 моль = 110,98 г CaCl 2 . Анализ размеров позволит вам рассчитать массу CaCl 2 , которую вы должны измерить.
Когда вы измеряете массу 333 г CaCl 2 , вы получаете 3,00 моля CaCl 2 .
Рисунок 10.4
Хлорид кальция используется в качестве осушителя и антиобледенителя.
Пример задачи: преобразование молей в массу
Хром металлический применяется для декоративной гальваники автомобильных бамперов и других поверхностей. Найдите массу 0,560 моль хрома.
Шаг 1: Составьте список известных количеств и спланируйте проблему.
Известно
- молярная масса Cr = 52,00 г моль
- 0,560 моль Cr
Неизвестно
Один коэффициент преобразования позволит нам преобразовать из молей Cr в массу.
Шаг 2: Рассчитать.
Шаг 3. Подумайте о своем результате.
Поскольку желаемое количество составляло чуть больше половины моля, масса должна быть чуть больше половины молярной массы. Ответ состоит из трех значащих цифр из-за 0,560 мол.
Аналогичный коэффициент преобразования, использующий молярную массу, можно использовать для преобразования массы вещества в моль. В лабораторных условиях вы можете провести реакцию и произвести определенное количество продукта, которое можно массировать.Часто бывает необходимо определить количество молей образовавшегося продукта. Следующая проблема иллюстрирует эту ситуацию.
Пример задачи: преобразование массы в моли
Определенная реакция дает 2,81 г гидроксида меди (II), Cu (OH) 2 . Определите количество молей, образующихся в реакции.
Шаг 1: Составьте список известных количеств и спланируйте проблему.
Известно
Неизвестно
Один коэффициент преобразования позволит нам преобразовать массу в моль.
Шаг 2: Рассчитать.
Сначала необходимо вычислить молярную массу Cu (OH) 2 из молярных масс Cu, O и H. Молярная масса составляет 97,57 г / моль.
Шаг 3. Подумайте о своем результате.
Относительно небольшая масса образующегося продукта приводит к небольшому количеству молей.
Сводка
- Описываются расчеты, включающие преобразования между молями материала и массой этого материала.
Практика
Прочтите материал по ссылке ниже и решите задачи в конце.
http://www.occc.edu/kmbailey/chem1115tutorials/Stoichiometry_Molar_Mass_Calculations.htm
Обзор
Вопросы
- Зачем нужно рассчитывать массу материала?
- Зачем вам определять, сколько молей материала вы образовали в результате реакции?
- У вас есть 19,7 грамма материала и вы задаетесь вопросом, сколько родинок образовалось.Ваш друг говорит вам умножить массу на грамм / моль. Ваш друг прав?
- Выполнять вычисления с преобразованием массы и количества частиц.
Сколько там газа?
Авогадро интересовался газами. Он предположил, что равные объемы газов при одинаковых условиях содержат одинаковое количество частиц. Другие исследователи изучали, сколько частиц газа содержится в определенном объеме газа.В конце концов, ученые смогли установить взаимосвязь между числом частиц и массой, используя идею молей.
Преобразование между массой и числом частиц
В разделе «Преобразования между молями и массой» вы узнали, как преобразовывать туда и обратно между молями и количеством типичных частиц. Теперь вы увидели, как переводить между молями и массой вещества в граммах и обратно. Мы можем объединить два типа проблем в одну. И масса, и количество частиц связаны с граммами.Чтобы преобразовать массу в число частиц или наоборот, сначала потребуется преобразование в моль.
Рисунок 10,5
Для преобразования количества частиц в массу или из массы в количество частиц требуется два шага
Пример задачи: преобразование массы в частицы
Сколько молекул в 20,0 г газообразного хлора, Cl 2 ?
Шаг 1: Составьте список известных количеств и спланируйте проблему.
Известно
- молярная масса Cl 2 = 70,90 г / моль
- 20,0 г Cl 2
Неизвестно
- количество молекул Cl 2
Используйте два коэффициента преобразования. Первый преобразует граммы Cl 2 в моль. Второй преобразует моли Cl 2 в количество молекул.
Шаг 2: Рассчитать.
Задача решается с использованием двух последовательных коэффициентов пересчета.Нет необходимости явно рассчитывать моль Cl 2 .
Шаг 3. Подумайте о своем результате.
Поскольку данная масса меньше половины молярной массы хлора, результирующее количество молекул будет меньше половины числа Авогадро.
Сводка
- Проиллюстрированы расчеты для преобразования между массой и количеством частиц.
Практика
Прочтите материал по ссылке ниже, а затем выполните задачи на странице 9 и задачу на странице 17 (не вдавайтесь в подробности, пока не попробуете задачи).
http://schools.fwps.org/decatur-old/staff/adewaraja/chemistry/curriculum%20units/chapter%2010/Lesson5/particle_mole_mass_calcu.pdf
Обзор
Вопросы
- Почему мы не можем напрямую преобразовать количество частиц в граммы?
- Сколько атомов хлора присутствует в указанной выше задаче?
- Согласно периодической таблице, атомный вес хлора равен 35,5. Почему я не могу использовать это значение в своих расчетах?
- Государственная гипотеза Авогадро.
- Определите стандартные температуру и давление.
- Определите молярный объем.
Как аквалангисты узнают, кончится ли у них бензин?
Знание того, сколько газа доступно для погружения, имеет решающее значение для выживания дайвера. Баллон на спине дайвера оборудован датчиками, показывающими, сколько газа присутствует и какое давление. Базовые знания о поведении газа позволяют дайверу оценить, как долго оставаться под водой, не создавая проблем.
Гипотеза Авогадро и молярный объем
Объем — это третий способ измерения количества вещества после подсчета и массы предметов. Объем жидкостей и твердых тел сильно зависит от плотности вещества. Это связано с тем, что твердые и жидкие частицы упакованы близко друг к другу, а между частицами очень мало места. Однако газы в основном состоят из пустого пространства между собственно частицами газа (см. , рис. ниже).
Рисунок 10.6
Частицы газа очень маленькие по сравнению с большим количеством пустого пространства между ними.
В 1811 году Амедео Авогадро объяснил, что объемы всех газов можно легко определить. Гипотеза Авогадро утверждает, что равные объемы всех газов при одинаковой температуре и давлении содержат одинаковое количество частиц. Поскольку общий объем, занимаемый газом, состоит в основном из пустого пространства между частицами, фактический размер самих частиц почти ничтожен.Данный объем газа с небольшими легкими частицами, такими как водород (H 2 ), содержит такое же количество частиц, как такой же объем тяжелого газа с крупными частицами, такими как гексафторид серы, SF 6 .
Газы сжимаются, а это означает, что под высоким давлением частицы сближаются друг с другом. Это уменьшает количество пустого пространства и уменьшает объем газа. На объем газа также влияет температура. Когда газ нагревается, его молекулы движутся быстрее, и газ расширяется.Из-за изменения объема газа из-за изменений давления и температуры сравнение объемов газа необходимо проводить при одной стандартной температуре и давлении. Стандартная температура и давление (STP) определяется как 0 ° C (273,15 K) и давление 1 атм. Молярный объем газа — это объем одного моля газа на STP. В STP один моль (6,02 × 10 23 репрезентативных частиц) любого газа занимает объем 22,4 л ( Рисунок ниже).
Рисунок 10.7
Моль любого газа занимает 22,4 л при стандартной температуре и давлении (0 ° C и 1 атм).
Рисунок ниже показывает, как можно увидеть молярный объем при сравнении различных газов. Образцы гелия (He), азота (N 2 ) и метана (CH 4 ) находятся на СТП. Каждый содержит 1 моль или 6,02 × 10 23 частиц. Однако масса каждого газа разная и соответствует молярной массе этого газа: 4.00 г / моль для He, 28,0 г / моль для N 2 и 16,0 г / моль для CH 4 .
Рисунок 10.8
Гипотеза Авогадро утверждает, что равные объемы любого газа при одинаковой температуре и давлении содержат одинаковое количество частиц. При стандартной температуре и давлении 1 моль любого газа занимает 22,4 л.
Сводка
- Одинаковые объемы газов при одинаковых условиях содержат одинаковое количество частиц.
- Определены стандартные температура и давление.
Практика
Вопросы
Воспользуйтесь ссылкой ниже, чтобы ответить на следующие вопросы:
http://chemed.chem.purdue.edu/demos/main_pages/4.6.html
- Каков был объем каждого взвешенного газа?
- Что обнаружил эксперимент?
- Какая связь между массой газа и молекулярной массой?
Обзор
Вопросы
- Что мы знаем о пространстве, фактически занимаемом газом?
- Почему нам нужно проводить все сравнения при одинаковых температуре и давлении?
- Как мы можем использовать эту информацию?
- Гипотеза Авогадро: Равные объемы всех газов при одинаковой температуре и давлении содержат равное количество частиц.
- мольный объем: Объем одного моля газа на STP.
- стандартные температура и давление (STP): 0 ° C (273,15 K) и давление 1 атм.
- Преобразование объема газа в количество молей этого газа.
Как узнать, сколько газа в этих баллонах?
Небольшие газовые баллоны часто используются для подачи газов для химических реакций. Газомер даст некоторую информацию о том, сколько находится в резервуаре, но необходимы количественные оценки, чтобы реакция могла продолжаться до завершения.Знание того, как рассчитать необходимые параметры для газов, очень полезно, чтобы не закончиться слишком рано.
Преобразование молей в объем газа
Молярный объем в STP можно использовать для преобразования из молей в объем газа и из объема газа в моли. Равенство 1 моль = 22,4 л является основанием для коэффициента преобразования.
Пример первой задачи: преобразование объема газа в моль
Многие металлы реагируют с кислотами с образованием газообразного водорода. Определенная реакция производит 86.5 л газообразного водорода на СТП. Сколько молей водорода было произведено?
Шаг 1: Составьте список известных количеств и спланируйте проблему.
Известно
- 86,5 л В 2
- 1 моль = 22,4 л
Неизвестно
Примените коэффициент преобразования для перевода литров в моль.
Шаг 2: Рассчитать.
Шаг 3. Подумайте о своем результате.
Объем произведенного газа почти в четыре раза превышает молярный объем.Тот факт, что газ является водородом, не играет роли в расчетах.
Пример второй задачи: преобразование молей в объем газа
Какой объем занимает 4,96 моль O 2 на СТП?
Шаг 1: Составьте список известных количеств и спланируйте проблему.
Известно
- 4,96 моль O 2
- 1 моль = 22,4 л
Неизвестно
Шаг 2: Рассчитать.
Шаг 3. Подумайте о своем результате.
Объем кажется правильным с учетом количества молей.
Пример задачи 3: преобразование объема в массу
Если мы знаем объем пробы газа на STP, мы можем определить ее массу. Предположим, у нас есть 867 литров N 2 на STP. Какова масса газообразного азота?
Шаг 1: Составьте список известных количеств и спланируйте проблему.
Известно
- 867 L N 2
- 1 моль = 22.4 л
- молярная масса N 2 = 28,02 г / моль
Неизвестно
Шаг 2: Рассчитать.
Начнем с определения количества присутствующих молей газа. Мы знаем, что 22,4 литра газа на СТП равны одному моль, поэтому:
Нам также известна молекулярная масса N 2 (28,0 г / моль), поэтому мы можем рассчитать вес газообразного азота в 867 литрах:
Шаг 3. Подумайте о своем результате.
В многоэтапной задаче убедитесь, что проверяют блоки.
Сводка
- Показаны преобразования между молями и объемом газа.
Практика
Выполните практические задания по ссылке ниже. Сосредоточьтесь на преобразованиях между объемом и молями, но попробуйте другие:
http://www.sciencegeek.net/Chemistry/taters/Unit4GramMoleVolume.htm
Обзор
Вопросы
- Почему газы должны быть на СТП?
- Когда идентичность газа становится важной?
- Выполните расчеты молярной массы и плотности газа.
Почему углекислый газ опускается в воздух?
Когда мы запускаем реакцию по выделению газа, мы ожидаем, что он поднимется в воздух. Многие студенты проводили эксперименты, в которых образуются такие газы, как водород. Газ может быть захвачен в пробирке, перевернутой над реакцией. С другой стороны, углекислый газ тонет при высвобождении. Двуокись углерода имеет плотность больше, чем воздух, поэтому она не поднимается, как другие газы.
Плотность газа
Как известно, плотность определяется как масса единицы объема вещества.Поскольку все газы занимают один и тот же объем на моль, плотность конкретного газа зависит от его молярной массы. Газ с небольшой молярной массой будет иметь меньшую плотность, чем газ с большой молярной массой. Плотность газа обычно указывается в г / л. Плотность газа можно рассчитать по молярной массе и молярному объему.
Рисунок 10.9
Воздушные шары, наполненные газом гелием, плавают в воздухе, потому что плотность гелия меньше плотности воздуха.
Пример первой проблемы: плотность газа
Какова плотность газообразного азота на СТП?
Шаг 1: Составьте список известных количеств и спланируйте проблему.
Известно
- N 2 = 28,02 г / моль
- 1 моль = 22,4 л
Неизвестно
Молярная масса, разделенная на молярный объем, дает плотность газа в STP.
Шаг 2: Рассчитать.
При установке с коэффициентом преобразования, моль отменяется, оставляя г / л в качестве единицы в результате.
Шаг 3. Подумайте о своем результате.
Молярная масса азота немного больше молярного объема, поэтому плотность немного больше 1 г / л.
В качестве альтернативы, молярная масса газа может быть определена, если плотность газа в STP известна.
Пример второй задачи: молярная масса от плотности газа
Какова молярная масса газа, плотность которого составляет 0,761 г / л при STP?
Шаг 1: Составьте список известных количеств и спланируйте проблему.
Известный
- N 2 = 28,02 г / моль
- 1 моль = 22,4 л
Неизвестно
Молярная масса равна произведению плотности на молярный объем.
Шаг 2: Рассчитать.
Шаг 3. Подумайте о своем результате.
Поскольку плотность газа меньше 1 г / л, молярная масса меньше 22,4.
Сводка
- Приведены расчеты, показывающие преобразования между молярной массой и плотностью для газов.
Практика
Вопросы
Воспользуйтесь ссылкой ниже, чтобы ответить на следующие вопросы:
http://employees.oneonta.edu/viningwj/sims/gas_de density_s.html
- Какой из газов имеет самую высокую плотность?
- Какой газ имеет самую низкую плотность?
- Можно ли ожидать, что у азота плотность выше или ниже, чем у кислорода? Почему?
Обзор
Вопросы
- Как рассчитывается плотность?
- Как рассчитывается молярная масса?
- Какой бы объем 3.5 молей газа?
- Выполнение расчетов, включающих взаимное преобразование массы, молей и объема газа.
Как мне добраться отсюда туда?
Если я хочу посетить город Мантео, Северная Каролина, на побережье, мне понадобится карта, как туда добраться. У меня может быть распечатанная карта или я могу загрузить маршруты из Интернета, но мне нужно что-то, что поможет мне двигаться в правильном направлении. Дорожные карты по химии служат той же цели.Как вести себя с определенным типом расчетов? Есть процесс и набор инструкций, которые могут помочь.
Mole — дорожная карта
Ранее мы видели, как преобразование между массой и количеством частиц требует двух шагов, с промежуточными молями. Теперь эту концепцию можно расширить, включив также объем газа на СТП. Полученная диаграмма называется «дорожной картой» (см. , рис. ниже).
Рисунок 10.10
Дорожная карта крота показывает коэффициенты пересчета, необходимые для взаимного преобразования между массой, количеством частиц и объемом газа.
Моль находится в центре любого расчета количества вещества. Приведенный ниже пример проблемы является одной из многих различных проблем, которые можно решить с помощью дорожной карты крота.
Пример проблемы 1: Дорожная карта Mole
Какой объем неонового газа на СТП составляет 79,3 г?
Шаг 1: Составьте список известных количеств и спланируйте проблему.
Известно
- Ne = 20,18 г / моль
- 1 моль = 22,4 л
Неизвестно
Коэффициенты пересчета будут: граммы → моль → объем газа.
Шаг 2: Рассчитать.
Шаг 3. Подумайте о своем результате.
Данная масса неона равна примерно 4 молям, в результате получается объем примерно в 4 раза больше, чем молярный объем.
Сводка
- Приведен общий процесс расчетов, включающих моль, граммы и объем газа.
Практика
Воспользуйтесь ссылкой ниже, чтобы выполнить некоторые практические расчеты. Выполните задачи 1, 2 и 5 (вы можете попробовать другие, если чувствуете себя особенно храбрым):
http: // www.docbrown.info/page04/4_73calcs/MVGmcTEST.htm
Обзор
Вопросы
- Какова формула веса неона в приведенной выше задаче?
- Какая стоимость находится в центре всех расчетов?
- Если бы у нас было 79,3 грамма Xe, ожидали бы мы объем больше или меньше, чем полученный с неоном?
- Определите процентный состав.
- Выполните расчет процентного состава.
Есть ли в этой банке что-нибудь полезное?
Упакованные продукты, которые вы едите, обычно содержат информацию о пищевой ценности на этикетке.Этикетка на банке с арахисовым маслом (показанная выше) показывает, что размер одной порции составляет 32 г. На этикетке также указаны массы различных типов соединений, которые присутствуют в каждой порции. Одна порция содержит 7 г белка, 15 г жира и 3 г сахара. Вычисляя долю белка, жира или сахара в одной порции арахисового масла и переводя его в процентные значения, мы можем определить состав арахисового масла в процентах по массе.
Процентный состав
Химикам часто нужно знать, какие элементы присутствуют в соединении и в каком процентном соотношении.Состав на процентов. — это массовые проценты каждого элемента в соединении. Он рассчитывается аналогично тому, как мы только что указали для арахисового масла.
Процентный состав по массовым данным
Пример задачи ниже показывает расчет процентного состава соединения на основе данных о массе.
Пример первой задачи: процентный состав от массы
Известно, что недавно синтезированное соединение содержит элементы цинк и кислород.Когда 20,00 г образца разлагается, остается 16,07 г цинка. Определите процентный состав соединения.
Шаг 1: Составьте список известных количеств и спланируйте проблему.
Известно
- масса соединения = 20,00 г
- масса Zn = 16,07 г
Неизвестно
- процентов Zn =? %
- процентов O =? %
Вычтите, чтобы найти массу кислорода в соединении. Разделите массу каждого элемента на массу соединения, чтобы найти процент по массе.
Шаг 2: Рассчитать.
Шаг 3. Подумайте о своем результате.
Расчеты имеют смысл, потому что сумма двух процентов в сумме дает 100%. По массе это преимущественно цинк.
Процентный состав химической формулы
Процентный состав соединения также можно определить по формуле соединения. Нижние индексы в формуле сначала используются для расчета массы каждого элемента в одном моль соединения.Это делится на молярную массу соединения и умножается на 100%.
Процентный состав данного соединения всегда один и тот же, если соединение чистое.
Пример второй задачи: процентный состав химической формулы
Дихлоргептоксид (Cl 2 O 7 ) представляет собой высокореактивное соединение, используемое в некоторых реакциях органического синтеза. Рассчитайте процентный состав дихлоргептоксида.
Шаг 1: Составьте список известных количеств и спланируйте проблему.
Известно
- Масса Cl в 1 моль Cl 2 O 7 = 70,90 г
- масса O в 1 моль Cl 2 O 7 = 112,00 г
- молярная масса Cl 2 O 7 = 182,90 г / моль
Неизвестно
- процентов Cl =? %
- процентов O =? %
Рассчитайте массовый процент каждого элемента, разделив массу этого элемента в 1 моль соединения на молярную массу соединения и умножив на 100%.
Шаг 2: Рассчитать.
Шаг 3. Подумайте о своем результате.
Сумма процентов составляет 100%.
Процентный состав также можно использовать для определения массы определенного элемента, который содержится в любой массе соединения. В предыдущем примере задачи было обнаружено, что процентный состав дихлоргептоксида составляет 38,76% Cl и 61,24% O. Предположим, вам нужно знать массы хлора и кислорода, присутствующие в 12.50 г образца дихлоргептоксида. Вы можете установить коэффициент преобразования, основанный на массовых процентах каждого элемента.
Сумма двух масс составляет 12,50 г, что соответствует массе пробы.
Сводка
- Описаны процессы расчета процентного состава материала на основе массы или химического состава.
Практика
Воспользуйтесь ссылкой ниже, чтобы просмотреть материал и произвести расчеты. Прочтите обе части урока и сделайте столько расчетов, сколько у вас будет времени.
http://www.chemteam.info/Mole/Percent-Composition-Part1.html
Обзор
Вопросы
- Какая формула для расчета процентного состава?
- Какая информация вам нужна для расчета процентного состава по массе?
- О чем говорят индексы в химической формуле?
- процент состава: Массовый процент каждого элемента в соединении.
- Определите гидрат.
- Рассчитайте процентное содержание воды в гидрате, если предоставите соответствующие данные.
Почему меняется цвет?
Если вы посмотрите на обычную бутылку медного купороса, она будет голубовато-зеленой. Если кто-то скажет вам, что сульфат меди имеет белый цвет, вы им не поверите. Вы оба правы; это просто зависит от сульфата меди. К вашему сине-зеленому сульфату меди присоединено несколько молекул воды, в то время как сульфат меди вашего друга безводный (без воды).В чем разница? Молекулы воды взаимодействуют с некоторыми d-электронами в ионе меди и создают цвет. Когда вода удаляется, электронная конфигурация меняется, и цвет исчезает.
Процент воды в гидрате
Многие ионные соединения в природе содержат воду как часть кристаллической решетки. Гидрат представляет собой соединение, которое имеет одну или несколько молекул воды, связанных с каждой формульной единицей. Ионные соединения, содержащие переходный металл, часто сильно окрашены.Интересно, что гидратированная форма соединения обычно имеет другой цвет, чем безводная форма , которая не содержит воды в своей структуре. Гидрат обычно можно превратить в безводное соединение нагреванием. Например, безводный хлорид кобальта (II) имеет синий цвет, а гидрат — характерный пурпурный цвет.
Рисунок 10.11
Слева — безводный хлорид кобальта (II), CoCl 2 .Справа представлена гидратированная форма соединения, называемого гексагидратом хлорида кобальта (II), CoCl 2 • 6H 2 O.
Гидратированная форма хлорида кобальта (II) содержит шесть молекул воды в каждой формульной единице. Название соединения — гексагидрат хлорида кобальта (II), а его формула — CoCl 2 • 6H 2 O. Формула воды выделяется в конце формулы точкой, за которой следует коэффициент, представляющий количество молекул воды на формульную единицу.
Полезно знать процент воды, содержащейся в гидрате. В приведенном ниже примере проблемы демонстрируется процедура.
Пример первой задачи: процент воды в гидрате
Найдите процент воды в гексагидрате хлорида кобальта (II), CoCl 2 • 6H 2 O.
Шаг 1: Составьте список известных количеств и спланируйте проблему.
Масса воды в гидрате — это коэффициент (6), умноженный на молярную массу H 2 O.Молярная масса гидрата равна молярной массе CoCl 2 плюс масса воды.
Известно
- Масса H 2 O в 1 моль гидрата = 108,12 г
- молярная масса гидрата = 237,95 г / моль
Неизвестно
Рассчитайте массовый процент воды, разделив массу H 2 O в 1 моль гидрата на молярную массу гидрата и умножив на 100%.
Шаг 2: Рассчитать.
Шаг 3. Подумайте о своем результате.
Почти половина массы гидрата состоит из молекул воды внутри кристалла.
Сводка
- Описан процесс расчета процента воды в гидрате.
Практика
Воспользуйтесь следующей ссылкой, чтобы попрактиковаться в вычислении процента воды в гидрате:
http://www.sd84.k12.id.us/shs/departments/science/martz/2007_ssem2/Chemistry/hydrate.htm
Обзор
Вопросы
- Что такое гидрат?
- Как превратить гидрат в безводное соединение?
- Что означает гексагидрат?
- Безводный: Без воды.
- Гидрат: Соединение, которое имеет одну или несколько молекул воды, связанных с каждой формульной единицей
- Определите эмпирическую формулу.
- Рассчитайте эмпирическую формулу соединения, используя элементный анализ соединения.
Что происходит на этой картинке?
На заре химии было мало инструментов для детального изучения соединений. Большая часть информации о составе соединений пришла из элементного анализа неорганических материалов. «Новая» область органической химии (изучение соединений углерода) столкнулась с проблемой невозможности полностью охарактеризовать соединение. Относительные количества элементов можно было определить, но очень многие из этих материалов содержали углерод, водород, кислород и, возможно, азот в простых соотношениях.Мы не знали точно, сколько этих атомов на самом деле было в конкретной молекуле.
Определение эмпирических формул
Эмпирическая формула — это формула, которая показывает наименьшее целочисленное отношение элементов в соединении. Поскольку структура ионных соединений представляет собой расширенную трехмерную сеть положительных и отрицательных ионов, все формулы ионных соединений являются эмпирическими. Однако мы также можем рассмотреть эмпирическую формулу молекулярного соединения.Этен представляет собой небольшое углеводородное соединение с формулой C 2 H 4 (см. Рисунок ниже). В то время как C 2 H 4 является его молекулярной формулой и представляет его истинную молекулярную структуру, он имеет эмпирическую формулу CH 2 . Простейшее отношение углерода к водороду в этене составляет 1: 2. Это соотношение можно посмотреть двумя способами. Рассматривая одну молекулу этена, соотношение составляет 1 атом углерода на каждые 2 атома водорода.Рассматривая один моль этена, соотношение составляет 1 моль углерода на каждые 2 моля водорода. Таким образом, нижние индексы в формуле представляют мольное соотношение элементов в этой формуле.
Рисунок 10.12
Шариковая модель этена, C 2 H 4 .
В процедуре под названием элементный анализ неизвестное соединение может быть проанализировано в лаборатории, чтобы определить процентное содержание каждого элемента, содержащегося в нем.Эти проценты можно преобразовать в мольное соотношение элементов, что приводит к эмпирической формуле. Шаги, которые необходимо предпринять, изложены ниже.
- Предположим, что образец соединения 100 г, так что данные проценты могут быть напрямую преобразованы в граммы.
- Используйте молярную массу каждого элемента, чтобы перевести граммы каждого элемента в моль.
- Чтобы найти целочисленное отношение, разделите моли каждого элемента на то, какое из молей из шага 2 является наименьшим.
- Если все моль в этой точке являются целыми числами (или очень близкими), эмпирическая формула может быть записана с молями в качестве нижнего индекса каждого элемента.
- В некоторых случаях один или несколько молей, вычисленных на шаге 3, не будут целыми числами. Умножьте каждую из родинок на наименьшее целое число, которое превратит каждую из них в целое число. Напишите эмпирическую формулу.
Пример первой задачи: определение эмпирической формулы соединения
Соединение железа и кислорода проанализировано и обнаружено, что оно содержит 69.94% железа и 30,06% кислорода. Найдите эмпирическую формулу соединения.
Шаг 1: Составьте список известных количеств и спланируйте проблему.
Известно
- % Fe = 69,94%
- % O = 30,06%
Неизвестно
- Эмпирическая формула = Fe ? O ?
Действия, которые необходимо выполнить, изложены в тексте.
Шаг 2: Рассчитать.
1. Возьмем образец весом 100 г.
2. Перевести в моли.
3. Разделите обе родинки на наименьшее из результатов.
4/5. Поскольку количество молей O, по-прежнему не является целым числом, оба мола можно умножить на 2, округлив при этом до целого числа.
Эмпирическая формула соединения: Fe 2 O 3 .
Шаг 3. Подумайте о своем результате.
Нижние индексы представляют собой целые числа и представляют мольное соотношение элементов в соединении.Соединение представляет собой ионное соединение оксида железа (III).
Сводка
- Описан процесс расчета эмпирической формулы для соединения на основе процентного состава этого соединения.
Практика
Воспользуйтесь ссылкой ниже, чтобы прочитать о вычислении эмпирических формул и попрактиковаться в решении некоторых задач:
http://www.chemteam.info/Mole/EmpiricalFormula.html
Обзор
Вопросы
- Что такое эмпирическая формула?
- Что вам говорит эмпирическая формула?
- О чем он вам не говорит?
- элементный анализ: Определяет процентное содержание каждого элемента в соединении.
- эмпирическая формула: Показывает наименьшее целочисленное отношение элементов в соединении.
- Определите молекулярную формулу.
- Определите молекулярную формулу, указав эмпирическую формулу и молярную массу соединения.
Как определить разницу между этими двумя молекулами?
Выше мы видим два углевода: глюкозу и сахарозу. Сахароза почти в два раза больше глюкозы, хотя их эмпирические формулы очень похожи.Некоторые люди могут различить их на основе вкуса, но не рекомендуется пробовать химические вещества на вкус. Лучший способ — определить молекулярную массу — этот подход позволяет легко определить, какое соединение является каким.
Молекулярные формулы
Молекулярные формулы определяют вид и количество атомов каждого элемента, присутствующего в молекулярном соединении. Во многих случаях молекулярная формула совпадает с эмпирической формулой. Молекулярная формула метана — CH 4 , и поскольку он содержит только один атом углерода, это также его эмпирическая формула.Однако иногда молекулярная формула представляет собой простое целое число, кратное эмпирической формуле. Уксусная кислота — это органическая кислота, которая является основным компонентом уксуса. Его молекулярная формула: C 2 H 4 O 2 . Глюкоза — это простой сахар, который клетки используют в качестве основного источника энергии. Его молекулярная формула: C 6 H 12 O 6 . Структуры обеих молекул показаны на рисунке ниже. Это очень разные соединения, но оба имеют одну и ту же эмпирическую формулу CH 2 O.
Рисунок 10.13
Уксусная кислота (слева) имеет молекулярную формулу C 2 H 4 O 2 , а глюкоза (справа) имеет молекулярную формулу C 6 H 12 O 6 . Оба имеют эмпирическую формулу CH 2 O.
Эмпирические формулы могут быть определены на основе процентного содержания соединения. Чтобы определить его молекулярную формулу, необходимо знать молярную массу соединения.Химики используют инструмент, называемый масс-спектрометром, для определения молярной массы соединений. Чтобы перейти от эмпирической формулы к молекулярной формуле, выполните следующие действия:
- Рассчитайте массу по эмпирической формуле (EFM) , которая является просто молярной массой, представленной эмпирической формулой.
- Разделите молярную массу соединения на массу, полученную по эмпирической формуле. Результат должен быть целым числом или очень близким к целому числу.
- Умножьте все индексы в эмпирической формуле на целое число, полученное на шаге 2.Результатом является молекулярная формула.
Пример первой задачи: определение молекулярной формулы соединения
Эмпирическая формула соединения бора и водорода: BH 3 . Его молярная масса составляет 27,7 г / моль. Определите молекулярную формулу соединения.
Шаг 1: Составьте список известных количеств и спланируйте проблему.
Известно
- эмпирическая формула = BH 3
- молярная масса = 27.7 г / моль
Неизвестно
Действия, которые необходимо выполнить, изложены в тексте.
Шаг 2: Рассчитать.
1. Эмпирическая формула массы (EFM) = 13,84 г / моль
2.
3.
Молекулярная формула соединения: B 2 H 6 .
Шаг 3. Подумайте о своем результате.
Молярная масса молекулярной формулы соответствует молярной массе соединения.
Сводка
- Описана процедура, позволяющая вычислить точную молекулярную формулу соединения.
Практика
Используйте ссылку ниже, чтобы получить доступ к практическим задачам. Попробуйте столько, сколько у вас есть на:
http://chemistry.about.com/od/chemistry-test-questions/tp/Molecular-Formula-Practice-Test-Questions.htm
Обзор
Вопросы
- В чем разница между эмпирической формулой и молекулярной формулой?
- Что нужно знать, помимо элементного анализа, для расчета молекулярной формулы?
- Что вам говорит эмпирическая формула массы?
- эмпирическая формула масса (EFM): Молярная масса, представленная эмпирической формулой.
- Молекулярная формула: Указывает тип и количество атомов каждого элемента, присутствующего в молекулярном соединении.
химических формул | Химия
ЦЕЛИ ОБУЧЕНИЯ
К концу этого раздела вы сможете:
- Обозначьте состав молекул, используя молекулярные формулы и эмпирические формулы
- Изобразите расположение связей атомов в молекулах, используя структурные формулы
Молекулярная формула — это представление молекулы, в которой используются химические символы для обозначения типов атомов, за которыми следуют нижние индексы, чтобы показать количество атомов каждого типа в молекуле.(Нижний индекс используется только в том случае, если присутствует более одного атома данного типа.) Молекулярные формулы также используются в качестве сокращений для названий соединений.
Структурная формула для соединения дает ту же информацию, что и его молекулярная формула (типы и количество атомов в молекуле), но также показывает, как атомы связаны в молекуле. Структурная формула метана содержит символы для одного атома C и четырех атомов H, обозначающих количество атомов в молекуле (рис. 1).Линии представляют собой связи, удерживающие атомы вместе. (Химическая связь — это притяжение между атомами или ионами, которое удерживает их вместе в молекуле или кристалле.) Мы обсудим химические связи и посмотрим, как предсказать расположение атомов в молекуле позже. А пока просто знайте, что линии указывают на то, как атомы связаны в молекуле. Модель шара и палки показывает геометрическое расположение атомов с атомными размерами не в масштабе, а модель заполнения пространства показывает относительные размеры атомов.
Рис. 1. Молекула метана может быть представлена в виде (а) молекулярной формулы, (б) структурной формулы, (в) шаровой модели и (г) модели заполнения пространства. Атомы углерода и водорода представлены черными и белыми сферами соответственно.
Хотя многие элементы состоят из отдельных отдельных атомов, некоторые существуют в виде молекул, состоящих из двух или более атомов элемента, химически связанных вместе. Например, большинство образцов элементов водорода, кислорода и азота состоят из молекул, каждая из которых содержит по два атома (называемых двухатомными молекулами), и поэтому имеют молекулярные формулы H 2 , O 2 и N 2 , соответственно.Другими элементами, обычно встречающимися в виде двухатомных молекул, являются фтор (F 2 ), хлор (Cl 2 ), бром (Br 2 ) и йод (I 2 ). Наиболее распространенная форма элемента сера состоит из молекул, состоящих из восьми атомов серы; его молекулярная формула S 8 (рис. 2).
Рис. 2. Молекула серы состоит из восьми атомов серы и поэтому записывается как S 8 . Его можно представить в виде (а) структурной формулы, (б) модели шара и ручки и (в) модели заполнения пространства.Атомы серы представлены желтыми сферами.
Важно отметить, что нижний индекс после символа и число перед символом не представляют одно и то же; например, H 2 и 2H представляют собой совершенно разные виды. H 2 — это молекулярная формула; он представляет собой двухатомную молекулу водорода, состоящую из двух атомов элемента, которые химически связаны друг с другом. Выражение 2H, с другой стороны, указывает на два отдельных атома водорода, которые не объединены в единое целое.Выражение 2H 2 представляет две молекулы двухатомного водорода (рис. 3).
Рис. 3. Символы H, 2H, H 2 и 2H 2 представляют собой очень разные объекты.
Соединения образуются при химическом соединении двух или более элементов, в результате чего образуются связи. Например, водород и кислород могут реагировать с образованием воды, а натрий и хлор могут реагировать с образованием поваренной соли. Иногда мы описываем состав этих соединений с помощью эмпирической формулы , которая указывает типы присутствующих атомов, а — простейшее целочисленное отношение числа атомов (или ионов) в соединении .Например, диоксид титана (используемый в качестве пигмента в белой краске и в толстом, белом блокирующем типе солнцезащитного крема) имеет эмпирическую формулу TiO 2 . Это идентифицирует элементы титана (Ti) и кислорода (O) как составляющие диоксида титана и указывает на присутствие в два раза большего количества атомов кислорода элемента, чем атомов элемента титана (рис. 4).
Рис. 4. (a) Белое соединение диоксида титана обеспечивает эффективную защиту от солнца. (б) Кристалл диоксида титана TiO 2 содержит титан и кислород в соотношении 1: 2.Атомы титана серые, а атомы кислорода красные. (кредит а: модификация работы «osseous» / Flickr)
Как обсуждалось ранее, мы можем описать соединение с молекулярной формулой, в которой нижние индексы указывают фактических чисел атомов каждого элемента в молекуле соединения. Во многих случаях молекулярная формула вещества получается из экспериментального определения как его эмпирической формулы, так и его молекулярной массы (суммы атомных масс всех атомов, составляющих молекулу).Например, экспериментально можно определить, что бензол содержит два элемента, углерод (C) и водород (H), и что на каждый атом углерода в бензоле приходится один атом водорода. Таким образом, эмпирическая формула CH. Экспериментальное определение молекулярной массы показывает, что молекула бензола содержит шесть атомов углерода и шесть атомов водорода, поэтому молекулярная формула бензола C 6 H 6 (рис. 5).
Рис. 5. Бензол, C 6 H 6 , производится при переработке нефти и имеет множество промышленных применений.Молекула бензола может быть представлена в виде (а) структурной формулы, (б) шаровой модели и (в) модели заполнения пространства. (d) Бензол — прозрачная жидкость. (кредит d: модификация работы Сахара Атвы)
Если мы знаем формулу соединения, мы можем легко определить эмпирическую формулу. (Это в некотором роде академическое упражнение; в реальной практике обычно используется обратная хронология.) Например, молекулярная формула уксусной кислоты, компонента, придающего уксусу его острый вкус, составляет C 2 H 4 O 2 .Эта формула показывает, что молекула уксусной кислоты (рис. 6) содержит два атома углерода, четыре атома водорода и два атома кислорода. Соотношение атомов 2: 4: 2. Деление на наименьший общий знаменатель (2) дает простейшее целочисленное отношение атомов 1: 2: 1, поэтому эмпирическая формула CH 2 O. Обратите внимание, что молекулярная формула всегда является целым числом, кратным эмпирическая формула.
Рис. 6. (a) Уксус содержит уксусную кислоту, C 2 H 4 O 2 , которая имеет эмпирическую формулу CH 2 O.Его можно представить в виде (б) структурной формулы и (в) как шаровой модели. (кредит а: модификация работы «HomeSpot HQ» / Flickr)
Пример 1
Эмпирические и молекулярные формулыМолекулы глюкозы (сахара в крови) содержат 6 атомов углерода, 12 атомов водорода и 6 атомов кислорода. Каковы молекулярные и эмпирические формулы глюкозы?
Решение
Молекулярная формула: C 6 H 12 O 6 , потому что одна молекула фактически содержит 6 атомов C, 12 H и 6 O.Простейшее целочисленное отношение атомов C к H и O в глюкозе составляет 1: 2: 1, поэтому эмпирическая формула CH 2 O.
Проверьте свои знанияМолекула метальдегида (пестицида, используемого для улиток и слизней) содержит 8 атомов углерода, 16 атомов водорода и 4 атома кислорода. Каковы молекулярные и эмпирические формулы метальдегида?
Ответ : Молекулярная формула, C 8 H 16 O 4 ; эмпирическая формула, C 2 H 4 O
Портрет химика: Ли Кронин
Рисунок 7.Химик Ли Кронин был назван одним из 10 самых вдохновляющих ученых Великобритании. (кредит: изображение любезно предоставлено Ли Кронином)
Чем занимаются химики? По словам Ли Кронина (рис. 7), химики создают очень сложные молекулы путем «измельчения» небольших молекул и «обратного проектирования» их. Он задается вопросом, можем ли мы «сделать действительно крутой универсальный химический набор» с помощью того, что он называет «прикладной» химией. Можем ли мы «приложить» химию?
В своем выступлении на TED в 2012 году Ли описывает одну интересную возможность: объединить набор химических «чернил» с 3D-принтером, способным создать реакционный аппарат (крошечные пробирки, химические стаканы и т. Д.) Для создания «универсального химического набора инструментов». .Этот набор инструментов можно использовать для создания индивидуальных лекарств для борьбы с новой супербактерийной микробной инфекцией или для «печати» лекарств, персонально настроенных в соответствии с вашим генетическим составом, окружающей средой и состоянием здоровья. Кронин говорит: «То, что Apple сделала для музыки, я хотел бы сделать для открытия и распространения рецептурных лекарств». Посмотреть его полный доклад можно на сайте TED.
Важно знать, что одни и те же атомы могут быть расположены по-разному: соединения с одинаковой молекулярной формулой могут иметь разные межатомные связи и, следовательно, разные структуры.Например, может ли существовать другое соединение с той же формулой, что и уксусная кислота, C 2 H 4 O 2 ? И если да, то какова будет структура его молекул?
Если вы предсказываете, что может существовать другое соединение с формулой C 2 H 4 O 2 , то вы продемонстрировали хорошее химическое понимание и правы. Два атома C, четыре атома H и два атома O также могут быть скомпонованы с образованием метилформиата, который используется в производстве в качестве инсектицида и для быстросохнущих отделочных материалов.Молекулы метилформиата имеют один из атомов кислорода между двумя атомами углерода, что отличается от расположения в молекулах уксусной кислоты. Уксусная кислота и метилформиат являются примерами изомеров — соединений с той же химической формулой, но с разными молекулярными структурами (рис. 8). Обратите внимание, что эта небольшая разница в расположении атомов имеет большое влияние на их соответствующие химические свойства. Вы, конечно, не захотите использовать раствор метилформиата вместо раствора уксусной кислоты (уксуса) при приготовлении заправки для салатов.
Рис. 8. Молекулы (а) уксусной кислоты и метилформиата (б) являются структурными изомерами; они имеют одинаковую формулу (C 2 H 4 O 2 ), но разную структуру (и, следовательно, разные химические свойства).
Существует множество типов изомеров (рис. 9). Уксусная кислота и метилформиат являются структурными изомерами, соединениями, молекулы которых различаются тем, как атомы связаны друг с другом. Существуют также различные типы пространственных изомеров , в которых относительная ориентация атомов в пространстве может быть разной.Например, составной карвон (содержащийся в семенах тмина, мяты и кожуре мандарина) состоит из двух изомеров, которые являются зеркальным отображением друг друга. S — (+) — карвон пахнет тмином, а R — (-) — карвон пахнет мятой.
Рис. 9. Молекулы карвона являются пространственными изомерами; они отличаются только относительной ориентацией атомов в пространстве. (кредит внизу слева: модификация работы «Miansari66» / Wikimedia Commons; кредит внизу справа: модификация работы Фореста и Ким Старр)
Выберите эту ссылку на New Jersey Star-Ledger, чтобы просмотреть объяснение изомеров, пространственных изомеров и почему они имеют разные запахи (выберите видео под названием «Mirror Molecule: Carvone»).
Ключевые концепции и резюме
В молекулярной формуле используются химические символы и индексы для обозначения точного числа различных атомов в молекуле или соединении. Эмпирическая формула дает простейшее целочисленное отношение атомов в соединении. Структурная формула указывает на расположение атомов в молекуле. Шаровидные модели и модели, заполняющие пространство, показывают геометрическое расположение атомов в молекуле. Изомеры — это соединения с одной и той же молекулярной формулой, но с различным расположением атомов.
Химия: упражнения в конце главы
- Объясните, почему символ атома элемента кислорода и формула молекулы кислорода различаются.
- Объясните, почему символ элемента сера и формула молекулы серы различаются.
- Напишите молекулярные и эмпирические формулы следующих соединений:
- Напишите молекулярные и эмпирические формулы следующих соединений:
- Определите эмпирические формулы для следующих соединений:
- кофеин, C 8 H 10 N 4 O 2
- фруктоза, C 12 H 22 O 11
- перекись водорода, H 2 O 2
- глюкоза, C 6 H 12 O 6
- аскорбиновая кислота (витамин C), C 6 H 8 O 6
- Определите эмпирические формулы для следующих соединений:
- уксусная кислота, C 2 H 4 O 2
- лимонная кислота, C 6 H 8 O 7
- гидразин, N 2 H 4
- никотин, C 10 H 14 N 2
- бутан, C 4 H 10
- Напишите эмпирические формулы для следующих соединений:
- Откройте имитацию «Построить молекулу» и выберите вкладку «Большие молекулы».Выберите соответствующий набор атомов, чтобы построить молекулу с двумя атомами углерода и шестью атомами водорода. Перетащите атомы в пространство над «Набором», чтобы образовать молекулу. Имя появится, когда вы создадите настоящую существующую молекулу (даже если это не та, которую вы хотите). Вы можете использовать ножницы для разделения атомов, если хотите изменить связи. Нажмите «3D», чтобы увидеть молекулу, и посмотрите на возможности заполнения пространства и шарика и палки.
- Нарисуйте структурную формулу этой молекулы и укажите ее название.
- Можете ли вы как-нибудь расположить эти атомы, чтобы получить другое соединение?
- Воспользуйтесь имитацией «Построение молекулы», чтобы повторить упражнение 8, но постройте молекулу с двумя атомами углерода, шестью атомами водорода и одним кислородом.
- Нарисуйте структурную формулу этой молекулы и укажите ее название.
- Можете ли вы расположить эти атомы так, чтобы образовалась другая молекула? Если да, нарисуйте его структурную формулу и назовите его название.
- Как молекулы, изображенные на (а) и (б), одинаковы? Чем они отличаются? Как они называются (тип взаимоотношений между этими молекулами, а не их названия).
- Воспользуйтесь имитацией «Построение молекулы», чтобы повторить упражнение 8, но постройте молекулу с тремя атомами углерода, семью атомами водорода и одним хлором.
- Нарисуйте структурную формулу этой молекулы и укажите ее название.
- Можете ли вы расположить эти атомы так, чтобы образовалась другая молекула? Если да, нарисуйте его структурную формулу и назовите его название.
- Как молекулы, изображенные на (а) и (б), одинаковы? Чем они отличаются? Как они называются (тип взаимоотношений между этими молекулами, а не их имена)?
Избранные ответы
1.Символ кислородного элемента, O, представляет как элемент, так и один атом кислорода. Молекула кислорода O 2 содержит два атома кислорода; индекс 2 в формуле должен использоваться, чтобы отличать двухатомную молекулу от двух одиночных атомов кислорода.
3. (а) молекулярный CO 2 , эмпирический CO 2 ; (б) молекулярный C 2 H 2 , эмпирический CH; (в) молекулярный C 2 H 4 , эмпирический CH 2 ; (г) молекулярная H 2 SO 4 , эмпирическая H 2 SO 4
5.а) C 4 H 5 N 2 O; (б) C 12 H 22 O 11 ; (c) HO; (d) CH 2 O; (e) C 3 H 4 O 3
7. (а) CH 2 O; (б) C 2 H 4 O
9. (а) этанол
(b) метоксиметан, более известный как диметиловый эфир
(c) Эти молекулы имеют одинаковый химический состав (типы и количество атомов), но разные химические структуры.Это структурные изомеры.
Глоссарий
эмпирическая формула
формула, показывающая состав соединения, заданная как простейшее целочисленное отношение атомов
изомеры
соединения с одинаковой химической формулой, но разной структурой
молекулярная формула
формула, указывающая состав молекулы соединения и дающая фактическое количество атомов каждого элемента в молекуле соединения.
пространственные изомеры
соединения, в которых взаимная ориентация атомов в пространстве различается
структурная формула
показывает атомы в молекуле и то, как они связаны
2.2: Атомный номер, массовое число и единица атомной массы
Атомный номер и массовое число
Когда вы изучаете таблицу Менделеева, первое, что вы можете заметить, — это число, расположенное над символом.Это число известно как атомный номер , который определяет количество протонов в ядре ВСЕХ атомов в данном элементе. Символ атомного номера обозначается буквой Z . Например, атомный номер (z) натрия (Na) равен 11. Это означает, что все атомы натрия имеют 11 протонов. Если вы измените атомный номер на 12, вы больше имеете дело не с атомами натрия, а с атомами магния. Следовательно, атомный номер определяет рассматриваемый элемент.
Напомним, что ядра большинства атомов содержат нейтроны, а также протоны.В отличие от протонов, количество нейтронов для большинства элементов не является абсолютно фиксированным. Атомы, которые имеют одинаковое количество протонов и, следовательно, один и тот же атомный номер, но разное количество нейтронов, называются изотопами . Все изотопы элемента имеют одинаковое количество протонов и электронов, что означает, что они обладают одинаковым химическим составом. Поскольку разные изотопы одного и того же элемента имеют разное количество нейтронов, каждый из этих изотопов будет иметь разное массовое число (A) , которое является суммой количества протонов и количества нейтронов в ядре атома.
Массовое число (A) = Число протонов + Число нейтронов
Элемент углерод (C) имеет атомный номер 6, что означает, что все нейтральные атомы углерода содержат 6 протонов и 6 электронов. В типичном образце углеродсодержащего материала 98,89% атомов углерода также содержат 6 нейтронов, поэтому каждый имеет массовое число 12. Изотоп любого элемента может быть однозначно представлен как A Z X, где X — атомный символ элемента, A — массовое число, а Z — атомный номер.Изотоп углерода с 6 нейтронами, следовательно, равен 12 6 C. Нижний индекс, обозначающий атомный номер, на самом деле является избыточным, потому что атомный символ уже однозначно определяет Z. Следовательно, он чаще записывается как 12 C, что читается как «углерод-12». Тем не менее, значение Z обычно включается в обозначение ядерных реакций, поскольку эти реакции включают изменения Z.
Рисунок 2.12 : Формализм, используемый для идентификации конкретного нуклида (любого конкретного типа ядра)
Единица атомной массы
Атомная единица массы (u или а.е.м.) — это относительная единица, основанная на атоме углерода-12 с шестью протонами и шестью нейтронами, которому приписывается точное значение 12 а.е.м. (u). Это стандартная единица для атомной или молекулярной массы, и 1 а.е.м., таким образом, составляет 1/12 th массы атома 12 C. Это явно очень маленький
1 а.е.м. = 1.66054×10 -27 кг = 1,66054×10 -24 г
В результате этого стандарта масса всех других элементов периодической таблицы определяется относительно углерода-12. Например, экспериментально установлено, что атом азота-14 с 7 протонами и 7 нейтронами имеет массу, в 1,1672 раза превышающую массу углерода-12. Итак, масса атома азота-14 должна быть 14,00643 ед. Как вы могли догадаться, если бы в качестве эталона был выбран другой элемент, массы элементов были бы совершенно другими!
Изотопные распределения
Хотя углерод-12 является наиболее распространенным изотопом углерода, это не единственный изотоп.В дополнение к 12 C, типичный образец углерода содержит 1,11% 13 C с 7 нейтронами и 6 протонами и след 14 C с 8 нейтронами и 6 протонами. Однако ядро 14 C нестабильно, но подвергается медленному радиоактивному распаду, что является основой метода датирования углерода-14, используемого в археологии. Многие элементы, кроме углерода, имеют более одного стабильного изотопа; олово, например, имеет 10 изотопов. Свойства некоторых распространенных изотопов приведены в таблице 2.1.3. (Примечание: мы обсудим вывод атомной массы в следующем разделе).
| Элемент | Символ | Атомная масса (а.е.м.) | Массовое число изотопа | Изотопные массы (а.е.м.) | Процент изобилия (%) |
|---|---|---|---|---|---|
| водород | H | 1.0079 | 1 | 1,007825 | 99.9855 |
| 2 | 2,014102 | 0,0115 | |||
| бор | B | 10,81 | 10 | 10.012937 | 19,91 |
| 11 | 11.009305 | 80.09 | |||
| углерод | С | 12.011 | 12 | 12 (определено) | 99,89 |
| 13 | 13.003355 | 1,11 | |||
| кислород | O | 15,9994 | 16 | 15.994915 | 99.757 |
| 17 | 16.999132 | 0,0378 | |||
| 18 | 17.999161 | 0,205 | |||
| утюг | Fe | 55,845 | 54 | 53.939611 | 5,82 |
| 56 | 55. 8 | 91.66 | |||
| 57 | 56. | 2,19 | |||
| 58 | 57. | 0,33 | |||
| уран | U | 238,03 | 234 | 234.040952 | 0,0054 |
| 235 | 235.043930 | 0.7204 | |||
| 238 | 238.050788 | 99,274 |
Источники изотопных данных: Г. Ауди и др., Nuclear Physics A 729 (2003): 337–676; Дж. К. Котц и К. Ф. Перселл, Химия и химическая реакционная способность, 2-е изд., 1991.
Пример 2.2.1
Элемент с тремя стабильными изотопами состоит из 82 протонов. Отдельные изотопы содержат 124, 125 и 126 нейтронов. Определите элемент и напишите символы для изотопов.
Дано : количество протонов и нейтронов
Запрошено : элемент и атомный символ
Стратегия :
- Обратитесь к таблице Менделеева и используйте количество протонов, чтобы идентифицировать элемент.
- Вычислите массовое число каждого изотопа, сложив количество протонов и нейтронов.
- Укажите символ каждого изотопа с массовым числом в качестве верхнего индекса и числом протонов в нижнем индексе, оба написанных слева от символа элемента.
Решение :
A Свинец с 82 протонами (атомный номер 82): Pb.
B Для первого изотопа A = 82 протона + 124 нейтрона = 206. Аналогично, A = 82 + 125 = 207 и A = 82 + 126 = 208 для второго и третьего изотопов соответственно. Обозначения для этих изотопов: 206 82 Pb, 207 82 Pb и 208 82 Pb, которые также могут обозначаться как Pb-206, Pb-207 и Pb-208. .
Упражнение \ (\ PageIndex {1} \)
Какое массовое число у атома фосфора с 16 нейтронами
- Ответ
31
Упражнение \ (\ PageIndex {2} \)
Сколько протонов, нейтронов и электронов в атоме As-74?
- Ответ
33 протона, 41 нейтрон, 33 электрона
Упражнение \ (\ PageIndex {3} \)
Фактическая масса Ас-74 — 73.924 а.е.м.
А) Какая масса Ас-74 в граммах?
Б) Какова масса атома мышьяка относительно атома углерода-12?
- Ответ
A) Масса As-74 = (73,924 а.е.м.) x (1,66054 x 10 -24 г / а.е.м.) = 1,2275 x 10 -22 г
B) Масса As-74 / Масса C-12 = 73,924 а.е.м. / 12 а.е.м. = 6,1603 … Таким образом, масса атома As-74 примерно в шесть раз больше, чем масса атома C-12.
Авторы
- Аноним
- Изменено Джошуа Халперн, Скотт Синекс и Скотт Джонсон
- Боб Белфорд (UALR) и Ноябрь Палмер (UALR)
- Рония Каттум (UALR)
Если 1 моль натрия содержит 6 x 1023 атомов, сколько атомов.{c} \)
\ (a_ {b} \)
\ (\ sqrt {a} \)
\ (\ sqrt [b] {a} \)
\ (\ frac {a} { b} \)
\ (\ cfrac {a} {b} \)
\ (+ \)
\ (- \)
\ (\ times \)
\ (\ div \)
\ (\ pm \)
\ (\ cdot \)
\ (\ amalg \)
\ (\ ast \)
\ (\ barwedge \)
\ (\ bigcirc \)
\ ( \ bigodot \)
\ (\ bigoplus \)
\ (\ bigotimes \)
\ (\ bigsqcup \)
\ (\ bigstar \)
\ (\ bigtriangledown \)
\ (\ bigtriangleup \)
\ (\ blacklozenge \)
\ (\ blacksquare \)
\ (\ blacktriangle \)
\ (\ blacktriangledown \)
\ (\ bullet \)
\ (\ cap \)
\ (\ cup \)
\ (\ circ \)
\ (\ circledcirc \)
\ (\ dagger \)
\ (\ ddagger \)
\ (\ diamond \)
\ (\ dotplus \)
\ (\ lozenge \)
\ (\ mp \)
\ (\ ominus \)
\ (\ oplus \)
\ (\ oslash \)
\ (\ otimes \)
\ (\ setminus \)
\ ( \ sqcap \)
\ (\ sqcup \)
\ (\ square \)
\ (\ star \)
\ (\ треугольник \)
\ (\ triangledown \)
\ (\ треугольник влево \)
\ (\ Cap \)
\ (\ Cup \)
\ (\ uplus \)
\ (\ vee \)
\ (\ veebar \)
\ (\ wedge \)
\ (\ wr \)
\ (\ следовательно \)
\ (\ left (a \ right) \)
\ (\ left \ | a \ right \ | \)
\ (\ left [a \ right] \)
\ (\ left \ {a \ right \} \)
\ (\ left \ lceil a \ right \ rceil \)
\ (\ left \ lfloor \ right \ rfloor \)
\ (\ left (a \ right) \)
\ (\ vert a \ vert \)
\ (\ leftarrow \)
\ (\ leftharpoondown \)
\ (\ leftharpoonup \)
\ (\ leftrightarrow \)
\ (\ leftrightharpoons \)
\ (\ mapsto \)
\ (\ rightarrow \)
\ (\ rightharpoondown \)
\ (\ rightharpoonup \)
\ (\ rightleftharpoons \)
\ (\ to \)
\ (\ Leftarrow \)
\ (\ Leftrightarrow \)
\ (\ Rightarrow \ )
\ (\ overset {a} {\ leftarrow} \)
\ (\ overset {a} {\ rightarrow} \)
\ (\ приблизительно \)
\ (\ asymp \)
\ (\ cong \)
\ (\ dashv \)
\ (\ doteq \)
\ (= \)
\ (\ Equiv \)
\ (\ frown \)
9000 8 \ (\ geq \)\ (\ geqslant \)
\ (\ gg \)
\ (\ gt \)
\ (| \)
\ (\ leq \)
\ (\ leqslant \)
\ (\ ll \)
\ (\ lt \)
\ (\ models \)
\ (\ neq \)
\ (\ ngeqslant \)
\ (\ ngtr \)
\ (\ nleqslant \)
\ (\ nless \)
\ (\ not \ Equiv \)
\ (\ overset {\ подмножество {\ mathrm {def}} {}} {=} \)
\ (\ parallel \)
\ (\ perp \)
\ (\ prec \)
\ (\ prevq \)
\ (\ sim \)
\ (\ simeq \)
\ (\ smile \)
\ (\ succ \)
\ (\ successq \)
\ (\ vdash \)
\ ( \ in \)
\ (\ ni \)
\ (\ notin \)
\ (\ nsubseteq \)
\ (\ nsupseteq \)
\ (\ sqsubset \)
\ (\ sqsubseteq \)
\ (\ sqsupset \)
\ (\ sqsupseteq \)
\ (\ subset \)
\ (\ substeq \)
\ (\ substeqq \)
\ (\ supset \)
\ (\ supsete q \)
\ (\ supseteqq \)
\ (\ emptyset \)
\ (\ mathbb {N} \)
\ (\ mathbb {Z} \)
\ (\ mathbb {Q} \)
\ (\ mathbb {R} \)
\ (\ mathbb {C} \)
\ (\ alpha \)
\ (\ beta \)
\ (\ gamma \)
\ (\ delta \)
\ (\ epsilon \)
\ (\ zeta \)
\ (\ eta \)
\ (\ theta \)
\ (\ iota \)
\ ( \ kappa \)
\ (\ lambda \)
\ (\ mu \)
\ (\ nu \)
\ (\ xi \)
\ (\ pi \)
\ (\ rho \)
\ (\ sigma \)
\ (\ tau \)
\ (\ upsilon \)
\ (\ phi \)
\ (\ chi \)
\ (\ psi \)
\ (\ omega \)
\ (\ Gamma \)
\ (\ Delta \)
\ (\ Theta \)
\ (\ Lambda \)
\ (\ Xi \)
\ (\ Pi \)
\ (\ Sigma \)
\ (\ Upsilon \)
\ (\ Phi \)
\ (\ Ps i \)
\ (\ Omega \)
\ ((a) \)
\ ([a] \)
\ (\ lbrace {a} \ rbrace \)
\ (\ frac {a + b} {c + d} \)
\ (\ vec {a} \)
\ (\ binom {a} {b} \)
\ ({a \ brack b} \)
\ ({a \ brace b} \)
\ (\ sin \)
\ (\ cos \)
\ (\ tan \)
\ (\ cot \)
\ (\ sec \)
\ (\ csc \)
\ (\ sinh \)
\ (\ cosh \)
\ (\ tanh \)
\ (\ coth \)
\ (\ bigcap {a} \)
\ (\ bigcap_ {b} ^ {} a \)
\ (\ bigcup {a} \)
\ (\ bigcup_ {b} ^ {} a \)
\ (\ coprod {a} \)
\ (\ coprod_ {b} ^ {} a \)
\ (\ prod {a} \)
\ (\ prod_ {b} ^ {} a \)
\ (\ sum_ { a = 1} ^ b \)
\ (\ sum_ {b} ^ {} a \)
\ (\ sum {a} \)
\ (\ underset {a \ to b} \ lim \)
\ (\ int {a} \)
\ (\ int_ {b} ^ {} a \)
\ (\ iint {a} \)
\ (\ iint_ {b} ^ {} a \)
\ (\ int_ {a} ^ {b} {c} \)
\ (\ iint_ {a} ^ {b} {c} \)
\ (\ iiint_ {a} ^ { b} {c} \)
\ (\ oint {a} \)
\ (\ oint_ {b} ^ {} a \)
Моль — Формула массы и расчет молей — GCSE Chemistry (Single Science) Редакция — Другое
Химики измеряют количество вещества в единице, называемой « моль ».Это удобный способ подсчета атомов. Это позволяет химикам делать прогнозы о массах различных веществ, участвующих в реакциях.
Один моль — это число Авогадро частиц (атомов, молекул, ионов или электронов) в веществе .
Число Авогадро
Один моль атомов содержит 6 x 10 23 атомов, независимо от того, какой это элемент. Это очень большое число: это 6 с 23 нулями после него. Он известен как Авогадро номер .
Это число используется в химии, потому что если бы вы могли сосчитать такое количество атомов углерода, общая масса углерода у вас была бы 12 г. С другой стороны, взвешивание 12 г углерода позволяет узнать, сколько у вас атомов.
Моль элементов
Один моль атомов углерода имеет массу ровно 12 г. Поскольку каждый атом магния имеет вдвое большую массу атомов углерода ( 24 Mg по сравнению с 12 C), один моль магния имеет массу 24 г. Фактически, один моль любого элемента имеет массу в граммах, равную его относительной атомной массе .Один моль железа имеет массу 56 г .
Молей соединений
Моль молекулярного соединения содержит 6 x 10 23 молекул. Он имеет массу , что равняется его относительной формульной массе . Итак, моль воды (H 2 O) имеет массу 18 г. Моль диоксида углерода (CO 2 ) имеет массу 44 г. Это также работает для ионных соединений, поэтому моль хлорида натрия (NaCl) имеет массу 58,5 г.
Этот подход также можно использовать для элементов, состоящих из молекул.Например, газообразный кислород O 2 составляет двухатомных (каждая молекула содержит два атома), поэтому его относительная формульная масса равна 32. Таким образом, один моль молекулы кислорода будет иметь массу 32 г. Один моль кислорода атома (если бы вы могли когда-нибудь их выделить) имел бы массу 16 г.
Различный объем веществ
Атомный Строение
A. Атомный номер равен электронам или протонам
У каждого элемента есть атомный номер.Атомные номера перечислены вместе с названиями и символами элементов на внутренней стороне обложки текста. Атомный номер равен заряду ядра. Следовательно, он также равен количеству протонов в ядре, а также численно равен количеству электронов в нейтральном атоме. Атомный номер имеет символ Z.
У разных элементов разные атомные номера; следовательно, атомы разных элементов содержат разное количество протонов (и электронов).Кислород имеет атомный номер 8; его атомы содержат 8 протонов и 8 электронов. Уран имеет атомный номер 92; его атомы содержат 92 протона и 92 электрона.
Связь между атомным номером и числом протонов или электронов можно сформулировать следующим образом:
| Атомный номер | = количество протонов на атом |
| = количество электронов на нейтральный атом |
Б.Массовое число равно протонам и нейтронам
У каждого атома также есть массовое число, обозначаемое символом A. Массовое число атома равно количеству протонов плюс количество нейтронов, которые он содержит. Другими словами, количество нейтронов в любом атоме — это его массовое число за вычетом атомного номера.
Количество нейтронов = массовое число — атомный номер
или
Массовое число = количество протонов + количество нейтронов
Атомный номер и массовое число атома элемента можно указать, написав перед символом элемента массовое число в качестве верхнего индекса и атомное число в качестве нижнего индекса:
| массовое число атомный номер | Обозначение элемента | или | А Я | Х |
Например, атом золота (символ Au) с атомным номером 79 и массовым числом 196 обозначается как:
С.Изотопы
Хотя все атомы данного элемента должны иметь один и тот же атомный номер, не обязательно, чтобы все они имели одно и то же массовое число. Например, некоторые атомы углерода (атомный номер 6) имеют массовое число 12, другие имеют массовое число 13, а третьи имеют массовое число 14. Эти разные виды одного и того же элемента называются изотопами.
Изотопы — это атомы, которые имеют одинаковый атомный номер (и, следовательно, принадлежат к одному элементу), но разные массовые числа.Состав атомов встречающихся в природе изотопов углерода показан в таблице 4.2.
| ТАБЛИЦА 4.2 Встречающиеся в природе изотопы углерода | |||
| Изотоп | Протоны | Электронов | Нейтроны |
|---|---|---|---|
| 6 | 6 | 6 | |
| 6 | 6 | 7 | |
| 6 | 6 | 8 | |
Различные изотопы элемента могут быть обозначены с помощью верхних и нижних индексов, чтобы показать массовое число и атомный номер.Их также можно идентифицировать по названию элемента с массовым числом конкретного изотопа. Например, как альтернатива
мы можем писать углерод-12, углерод-13 и углерод-14.
Около 350 изотопов встречаются на Земле в естественных условиях, а еще 1500 изотопов были произведены искусственно. Изотопы данного элемента ни в коем случае не одинаково многочисленны. Например, 98,89% всего углерода, встречающегося в природе, составляет углерод-12, 1,11% — углерод-13, и только следовые количества — углерод-14.Некоторые элементы содержат только один изотоп природного происхождения. В таблице 4.3 перечислены встречающиеся в природе изотопы нескольких общих элементов, а также их относительное содержание.
|
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
D. Внутренняя структура атома
До сих пор мы обсуждали электроны, протоны и нейтроны и способы определения
сколько каждого конкретного атома содержит.Остается вопрос: это
частицы, хаотично распределенные внутри атома, как черника в булочке,
или у атома есть какая-то организованная внутренняя структура? В начале
ХХ века ученые пытались ответить на этот вопрос. Различные теории
был предложен, но ни один из них не был подтвержден экспериментально. В нашем обсуждении
истории науки мы предположили, что на различных этапах ее развития
наука отметила время, пока кто-нибудь не проведет ключевой эксперимент, который обеспечил
новые идеи.В истории изучения атомов был проведен ключевой эксперимент.
в 1911 году Эрнестом Резерфордом и его коллегами.
1. Силы между телами
Наше понимание выводов, сделанных из эксперимента Резерфорда, зависит от знания сил, действующих между телами. Поэтому, прежде чем обсуждать его эксперимент, необходимо сделать краткий обзор этих сил. Во-первых, сила
гравитация, существующая между всеми телами. Его величина зависит от соответствующих масс и расстояния между центрами тяжести двух взаимодействующих тел.Вы знакомы с гравитацией; он действует, чтобы держать ваши ноги на земле, а луну на орбите.
Электрические силы также существуют между заряженными частицами. Величина электрической силы между двумя заряженными телами зависит от заряда каждого тела и от расстояния между их центрами. Если заряды одного знака (положительные или отрицательные), тела отталкиваются друг от друга; если заряды противоположного знака, тела притягиваются друг к другу.
Магнитные силы, третий тип, подобны электрическим силам.У каждого магнита два полюса — северный и южный. Когда два магнита сводятся вместе, возникает сила отталкивания между одинаковыми полюсами и сила притяжения между разными полюсами. В заряженном теле могут взаимодействовать магнитные и электрические силы. Эти три силы были известны в конце девятнадцатого века, когда структура атома стала предметом интенсивного изучения.
2. Эксперимент Резерфорда
Опишем эксперимент Резерфорда:
В 1911 году было общепризнано, что атом содержит электроны и протоны, но, вероятно, они не расположены в каком-либо определенном порядке.Резерфорд хотел установить, существует ли закономерность. Он надеялся получить эту информацию, изучая, как протоны в атоме отклоняют путь другой заряженной частицы, проходящей через атом. Для своей второй частицы он выбрал альфа
() частицы. Альфа-частица содержит два протона и два нейтрона, что дает ей относительную массу 4 а.е.м. и заряд +2. Альфа-частица достаточно близка по массе и заряду к протону, поэтому ее путь изменится, если она пройдет близко к протону.В эксперименте луч альфа-частиц направлялся на кусок золотой фольги, такой тонкий, чтобы быть прозрачным и, что более важно для Резерфорда, толщиной всего в несколько атомов. Фольга была окружена экраном из сульфида цинка, который вспыхивал при каждом ударе альфа-частицы. Построив местоположение вспышек, можно было бы определить, как путь альфа-частиц через атом был изменен протонами в атоме.
Три пути, показанные на рисунке 4.2 (пути A, B и C) представляют наблюдаемые. Большинство альфа-частиц следовали по пути A; они проходили прямо через фольгу, как будто ее и не было. Некоторые были слегка отклонены от первоначального пути, как на пути B; и еще меньшее количество отскочило от фольги, как если бы они ударились о твердую стену (путь C).
| РИСУНОК 4.2 (a) Поперечное сечение аппарата Резерфорда. |
| РИСУНОК 4.2 (b) Увеличенное поперечное сечение золотой фольги в приборе, показывающее отклонение альфа-частиц ядрами атомов золота. |
Хотя вы можете быть удивлены, что через золотую фольгу прошли какие-либо альфа-частицы, Резерфорд — нет. Он ожидал, что многие пройдут прямо (путь А). Он также ожидал, что из-за присутствия в атоме положительно заряженных протонов некоторые альфа-частицы будут следовать по слегка отклоненному пути (путь B).Тот факт, что некоторые альфа-частицы отскакивают назад (путь C), поразил Резерфорда и его сотрудников. Путь C предполагал, что частицы врезались в область плотной массы и отскочили обратно. Если использовать аналогию Резерфорда, возможность такого отскока была столь же маловероятна, как отскок пушечного ядра о кусок папиросной бумаги.
3. Результаты эксперимента.
Тщательное рассмотрение результатов и, в частности, пути C убедило Резерфорда (и научное сообщество) в том, что атом содержит очень маленькое плотное ядро и большой объем внеядерного пространства.Согласно теории Резерфорда, ядро атома содержит всю массу атома и, следовательно, все протоны. Протоны придают ядру положительный заряд. Поскольку одинаковые заряды отталкиваются друг от друга, положительно заряженные альфа-частицы, проходящие близко к ядру, отклоняются (путь B). Ядро, содержащее все протоны и нейтроны, массивнее альфа-частицы; следовательно, альфа-частица, ударяющаяся о ядро атома золота, отскакивает от столкновения, как и те, которые следовали по пути C.
Вне ядра, в относительно огромном внеядерном пространстве атома, находятся крошечные электроны. Поскольку электроны настолько малы по сравнению с пространством, которое они занимают, внеядерное пространство атома по существу пусто. В эксперименте Резерфорда альфа-частицы, встречаясь с этой частью атомов в золотой фольге, проходили через фольгу без отклонения (путь A).
Если ядро содержит практически всю массу атома, оно должно быть чрезвычайно плотным.Его диаметр составляет примерно 10 -12 см, что составляет примерно 1/10 000 диаметра всего атома. Согласно этой модели, если бы ядро было размером с мрамор, атом с его внеядерными электронами имел бы 300 м в диаметре. Если бы мрамор имел ту же плотность, что и ядро атома, он бы весил 3,3 X 10 10 кг.
Эта модель ядра требует введения силы, отличной от обсуждаемой ранее, такой, которая позволит протонам с их взаимно отталкивающими положительными зарядами плотно упаковываться в ядре, разделенных только незаряженными нейтронами.Эти ядерные силы, кажется, зависят от взаимодействий между протонами и нейтронами. Некоторые из них слабые, а некоторые очень сильные. Вместе они удерживают ядро, но они еще не поняты.
Модель атома, основанная на работе Резерфорда, конечно, не более чем модель; мы не можем видеть эти субатомные частицы или их расположение внутри атома. Однако эта модель действительно дает нам представление об атоме, которое совпадает с наблюдениями, сделанными относительно его свойств.Теперь мы можем определить не только, какие субатомные частицы содержат конкретный атом, но и находятся ли они в его ядре. Например, атом углерода-12
содержит 6 протонов и 6 нейтронов в ядре и 6 электронов вне ядра.
У нас есть две отдельные части атома — ядро и внеядерное пространство. Ядро атома не играет никакой роли в химических реакциях, но участвует в радиоактивных реакциях.(Такие реакции обсуждаются позже в этой главе.) Химический состав атома зависит от его электронов — их количества и того, как они расположены во внеядерном пространстве.
Назад & nbsp Домой & nbsp Далее
| Декабромдифениловый эфир (DecaBDE) | ДекаБДЭ используется в качестве антипирена в пластиковых корпусах для телевизоров, компьютеров, аудио- и видеооборудования, текстильных изделий и мягкой мебели, проводов и кабелей для коммуникационного и электронного оборудования, а также для других применений.ДекаБДЭ также используется в качестве антипирена для различных применений в аэрокосмической и автомобильной технике, включая запасные части для самолетов и автомобилей. Узнайте больше об использовании DecaBDE. Выявленные опасности — ДекаБДЭ токсичен для водных организмов беспозвоночных, рыб и наземных беспозвоночных. Данные указывают на возможность развития, неврологических и иммунологических эффектов, общую токсичность на развитие, воздействие на печень и канцерогенность.Хотя многие виды применения декаБДЭ прекратились, EPA пришло к выводу, что люди или окружающая среда, вероятно, подвергаются воздействию декаБДЭ в условиях использования, указанных в окончательном правиле. | EPA запрещает производство (включая импорт), переработку и коммерческое распространение декаБДЭ и продуктов, содержащих декаБДЭ, для всех видов использования, за исключением следующих:
|
Фенол, изопропилированный фосфат (3: 1) | PIP (3: 1) используется в качестве пластификатора, антипирена, противоизносной присадки или присадки, препятствующей сжиманию, в гидравлической жидкости, смазочных маслах, смазках и консистентных смазках, различных промышленных покрытиях, клеях, герметиках и пластмассах. статьи.Как химическое вещество, которое может выполнять несколько функций одновременно, иногда в экстремальных условиях, оно имеет несколько отличительных применений. Узнайте больше об использовании PIP (3: 1). Выявленные опасности — PIP (3: 1) токсичен для водных растений, водных беспозвоночных, донных беспозвоночных и рыб. Данные указывают на возможность воздействия на репродуктивную функцию и развитие, неврологические эффекты и воздействие на системные органы, в частности, на надпочечники, печень, яичники, сердце и легкие. | EPA запрещает переработку и коммерческое распространение ГПГ (3: 1) и продуктов, содержащих химическое вещество, для всех видов использования, за исключением следующего:
EPA также запрещает сбросы в воду из оставшихся производств, переработки и распределения в коммерческой деятельности и требует от коммерческих пользователей продуктов, содержащих PIP (3: 1) и PIP (3: 1), следовать существующим нормам и передовой практике, чтобы предотвращать попадание в воду во время использования. |
| 2,4,6-Трис (трет-бутил) фенол (2,4,6-ТТБФ) | 2,4,6-TTBP используется в качестве промежуточного продукта / реагента при переработке и включается в составы, предназначенные для топлива и связанных с ним присадок, а также в составы, предназначенные для технического обслуживания или ремонта автомобилей и оборудования, в том числе в масла и смазки. Узнайте больше об использовании 2,4,6-TTBP. Выявленные опасности — 2,4,6-TTBP токсичен для водных растений, водных беспозвоночных и рыб.Данные обследованных животных указывают на возможность воздействия на печень и развитие. Исследования, представленные в этом документе, демонстрируют эти опасные конечные точки. EPA пришло к выводу, что воздействие 2,4,6-TTBP в условиях использования вероятно. | EPA запрещает коммерческое распространение 2,4,6-TTBP и продуктов, содержащих 2,4,6-TTBP в концентрациях выше 0,3% по весу в любом контейнере объемом менее 35 галлонов, чтобы эффективно предотвратить использование 2,4,6-ТТБП в качестве присадки к топливу или очистителя топливных форсунок потребителями и небольшими коммерческими предприятиями (например,г., автомастерские, причалы). EPA также запрещает переработку и продажу 2,4,6-TTBP и продуктов, содержащих 2,4,6-TTBP, для использования в качестве присадки к маслам или смазочным материалам в концентрациях выше 0,3% по весу независимо от размера контейнера. |
| Гексахлорбутадиен (ГХБД) | ГХБД используется в качестве галогенированного алифатического углеводорода, который образуется как побочный продукт при производстве хлорированных углеводородов , в частности перхлорэтилена, трихлорэтилена и четыреххлористого углерода, и впоследствии сжигается как отработанное топливо.Узнайте больше об использовании ГХБД. Выявленные опасности — ГХБД токсичен для водных беспозвоночных, рыб и птиц и был идентифицирован как возможный канцероген для человека. Данные указывают на возможность воздействия на почки, репродуктивную функцию и развитие. | EPA запрещает производство (включая импорт), переработку и коммерческое распространение ГХБД и продуктов или изделий, содержащих ГХБД, за исключением непреднамеренного производства ГХБД в качестве побочного продукта при производстве хлорированных растворителей, а также переработку и распространение в торговля ГХБД для сжигания в качестве отработанного топлива. |

 2008;21(4):404-404.
2008;21(4):404-404.

 При указании срока годности имеется в виду последний день указанного месяца.
При указании срока годности имеется в виду последний день указанного месяца.
 Это может быть беременность, менопауза, предменструальный синдром.
Это может быть беременность, менопауза, предменструальный синдром.

