Нарушение водного обмена — причины появления, при каких заболеваниях возникает, диагностика и способы лечения
ВАЖНО!
Информацию из данного раздела нельзя использовать для самодиагностики и самолечения. В случае боли или иного обострения заболевания диагностические исследования должен назначать только лечащий врач. Для постановки диагноза и правильного назначения лечения следует обращаться к Вашему лечащему врачу.
Нарушение водного обмена: причины, заболевания, при которых развивается, методы диагностики и лечения.Определение
Больше всего воды содержится в организме младенцев – до 86%. Затем ее уровень постепенно начинает снижаться, достигая минимума у людей пожилого возраста.
Вода работает как растворитель, составляет основу биологических сред, является участником различных биохимических реакций, терморегуляции и выполняет множество других функций.
Каждую секунду наш организм теряет определенное количество воды с дыханием в виде паров.
Однако наибольшее количество воды у здорового человека выводится из организма почками.
В процессе прохождения крови через почки в мочу поступает вода, минеральные и органические вещества, которые не требуются организму по причине своей вредности или избыточности.Для компенсации потерь жидкости организму требуется ее поступление извне. Естественное восполнение воды происходит за счет питья и еды. Внутривенное введение используют при тяжелом обезвоживании для быстрого восполнения потерь жидкости или невозможности употребления воды и пищи через рот.
Жидкость в нашем организме условно подразделяется на внутриклеточную и внеклеточную. Внутриклеточная жидкость, как следует из названия, присутствует внутри клетки и отграничена полупроницаемой мембраной от окружающего клетку пространства. Вне клетки жидкость находится в межклеточном пространстве и внутри кровеносных и лимфатических сосудов.
Под водным балансом в организме следует понимать не просто общее количество воды, но и ее распределение между перечисленными структурами, что напрямую влияет на жизнедеятельность органов и тканей человека.
В зависимости от общего содержания воды в организме человека нарушения водного обмена можно разделить на дегидратацию (уменьшение общего количества воды) и гипергидратацию (избыток воды).
Дегидратация проявляется уменьшением количества отделяемой мочи, сухостью слизистых оболочек, часто сопровождается выраженным чувством жажды, снижением эластичности кожи, в более тяжелых случаях развивается клиническая картина поражения тех или иных органов, в первую очередь – нервной системы в виде общей слабости, сонливости, нарушения или потери сознания.
Избыток воды в организме, напротив, проявляется образованием периферических отеков, в первую очередь – отека подкожно-жировой клетчатки, а также накоплением жидкости в клетках, межклеточном пространстве и различных полостях организма: в плевральной полости, брюшной и т.
Отдельно выделяют изменение количества воды в сосудистом русле: состояния гиповолемии (недостаточного объема крови) и гиперволемии (избыточного объема крови).
Возможные причины нарушения водного обмена
Выше были рассмотрены основные пути поступления и выведения жидкости из организма. Исходя из этого, становится понятно, что заболевания почек, сопровождающиеся повышенным мочеотделением, приводят к дегидратации, а поражения почек с невозможностью выполнения ими функции фильтрации – к гипергидратации.
Поражения желудочно-кишечного тракта, которые протекают с выраженной многократной рвотой и диареей, могут стать причиной нарушения водного баланса из-за избыточной потери жидкости.
В регуляции водного обмена важную роль играет эндокринная система. Так, повышение концентрации антидиуретического гормона приводит к задержке жидкости в организме, а увеличение выработки предсердного натрийуретического гормона – к ее усиленному выведению. Помимо этого, опосредованно через изменение концентрации солей в организме на водный баланс влияют и другие гормоны, например альдостерон.
Помимо этого, опосредованно через изменение концентрации солей в организме на водный баланс влияют и другие гормоны, например альдостерон.
Важно помнить, что глюкоза является осмотически активным веществом, способным притягивать воду. В случае избыточного количества глюкозы в крови, например при сахарном диабете, она начинает выделяться с мочой и увлекает за собой воду, что также приводит к развитию выраженного обезвоживания.
При каких заболеваниях развиваются нарушения водного обмена
Нарушения водного обмена могут возникать при различных заболеваниях почек и, как правило, являются признаками почечной недостаточности. При остро развившемся нарушении функции почек, например, при шоке, отравлении химическими веществами, некоторых воспалительных заболеваниях происходит, как правило, задержка воды в организме (гипергидратация). В то время как хронически развивающиеся болезни почек могут сопровождаться как гипергидратацией, так и гипогидратацией (в зависимости от стадии процесса).
Одной из частых причин хронической болезни почек является артериальная гипертензия и сахарный диабет.
К другим эндокринным заболеваниям, приводящим к выраженной дегидратации, относится несахарный диабет – группа заболеваний, в основе которых лежит нарушение работы в системе антидиуретического гормона. Врожденная дисфункция коры надпочечников, или адреногенитальный синдром может сопровождаться выраженными нарушениями баланса солей в организме и нарушением обмена жидкостей.К каким врачам обращаться при появлении симптомов нарушения водного обмена
Среди заболеваний, приводящих к нарушению жидкостного обмена, присутствуют расстройства самых различных органов и систем, требующие конкретных видов обследования и лечения.
Диагностика и обследования при нарушениях водного обмена
В основе первичной диагностики заболеваний, вызывающих нарушения водного обмена, лежит тщательно собранная история развития патологического состояния. Врач проводит опрос пациента, в ходе которого уточняет возможные причины, сроки, течение заболевания, проводившееся лечение и т.д.
После клинического обследования различных органов и систем, как правило, требуется лабораторно-инструментальное подтверждение диагноза. Пациенту назначают исследование концентрации глюкозы в крови с целью исключения сахарного диабета.
Как влияют растворенные в воде вещества на организм
Содержащиеся в воде органические соединения и их воздействие на организм человекаВсе органические соединения, находящиеся в воде, можно условно разделить на мелкие (размер молекулы — меньше 100 килодальтон) и крупные (размер молекулы — от 100 килодальтон). Наиболее опасны для человека крупные органические соединения, которые на 90% являются канцерогенами или мутагенами. Наиболее опасны хлорорганические соединения, образующиеся при кипячении хлорированной воды(см. концентрация хлора), т.к. они являются сильными канцерогенами, мутагенами и токсинами. Остальные 10% крупной органики в лучшем случае нейтральны в отношении организма. Полезных для человека крупных органических соединений, растворенных в воде, всего 2-3 (это ферменты, необходимые в очень малых дозах). Воздействие органики начинается непосредственно после питья. В зависимости от дозы это может быть 18-20 дней или, если доза большая, 8-12 месяцев.
Тяжелые металлы, попадая в наш организм, остаются там навсегда, вывести их можно только с помощью белков молока и белых грибов.
 Достигая определенной концентрации в организме, они начинают свое губительное воздействие — вызывают отравления, мутации. Кроме того, что сами они отравляют организм человека, они еще и чисто механически засоряют его — ионы тяжелых металлов оседают на стенках тончайших систем организма и засоряют почечные каналы, каналы печени, таким образом снижая фильтрационную способность этих органов. Соответственно, это приводит к накоплению токсинов и продуктов жизнедеятельности клеток нашего организма, т.е. самоотравление организма, т.к. именно печень отвечает за переработку ядовитых веществ, попадающих в наш организм, и продуктов жизнедеятельности организма, а почки — за их выведение наружу.
К тяжелым металлам относятся Pb (свинец), Al (алюминий), Mn (марганец), Si (кремний), Fe (железо), Se (селен), Zn (цинк), Hg (ртуть), Cd (кадмий).
Достигая определенной концентрации в организме, они начинают свое губительное воздействие — вызывают отравления, мутации. Кроме того, что сами они отравляют организм человека, они еще и чисто механически засоряют его — ионы тяжелых металлов оседают на стенках тончайших систем организма и засоряют почечные каналы, каналы печени, таким образом снижая фильтрационную способность этих органов. Соответственно, это приводит к накоплению токсинов и продуктов жизнедеятельности клеток нашего организма, т.е. самоотравление организма, т.к. именно печень отвечает за переработку ядовитых веществ, попадающих в наш организм, и продуктов жизнедеятельности организма, а почки — за их выведение наружу.
К тяжелым металлам относятся Pb (свинец), Al (алюминий), Mn (марганец), Si (кремний), Fe (железо), Se (селен), Zn (цинк), Hg (ртуть), Cd (кадмий).Марганец забивает канальцы нервных клеток. Снижается проводимость нервного импульса, как следствие повышается утомляемость, сонливость, снижается быстрота реакции, работоспособность, появляются головокружение, депрессивные, подавленные состояния. Особенно опасны отравления марганцем у детей и эмбрионов (когда женщина беременна) — приводит к идиотии. Из 100 детей, матери которых во время беременности подверглись отравлению марганцем, 96-98 рождаются идиотами. Есть также теория, что токсикозы на ранних и поздних сроках беременности вызываются марганцем. В водопроводной воде — избыток марганца. Кроме воды марганец содержится в воздухе из-за производственных выбросов. В природе марганец затем накапливается в грибах и растениях, попадая таким образом в пищу. Марганец почти невозможно вывести из организма; очень тяжело диагностировать отравление марганцем, т.к. симптомы очень общие и присущи многим заболеваниям, чаще же всего человек просто не обращает на них внимания.
Особенно опасны отравления марганцем у детей и эмбрионов (когда женщина беременна) — приводит к идиотии. Из 100 детей, матери которых во время беременности подверглись отравлению марганцем, 96-98 рождаются идиотами. Есть также теория, что токсикозы на ранних и поздних сроках беременности вызываются марганцем. В водопроводной воде — избыток марганца. Кроме воды марганец содержится в воздухе из-за производственных выбросов. В природе марганец затем накапливается в грибах и растениях, попадая таким образом в пищу. Марганец почти невозможно вывести из организма; очень тяжело диагностировать отравление марганцем, т.к. симптомы очень общие и присущи многим заболеваниям, чаще же всего человек просто не обращает на них внимания.
Алюминий так же оказывает общее отравляющее и засоряющее действие на организм человека. В водопроводной воде его избыток связан с тем, что излишки железа на водозаборе удаляют сульфатом алюминия. Реагируя с ионами железа, сульфат алюминия дает нерастворимый осадок, в который выпадает, в принципе и железо, и алюминий, но в реальности в воде остается и железо, и алюминий.
Селен не содержится в природной воде Новосибирска. Селен необходим человеку в очень малых дозах, при малейшем превышении дозы он превращается в канцероген, мутаген и токсин. Человеку можно безопасно восполнить недостаток селена с помощью специальных минеральных комплексов; селен также содержится в морской капусте.
Железо бывает в природе в трех состояниях — молекулярное железо F0(когда оно куском), Fe2+ — необходимо в организме человека как переносчик кислорода (в молекуле гемоглобина 4 иона F2+) и F3+ — вредное для человека — оно и есть ржавчина. Железо необходимо организму человека, но только в определенной пропорции и в виде иона F2+. В водопроводной воде большой избыток железа, т.к. в природной воде Новосибирска его много, плюс ржавые трубы, по которым течет вода к потребителям.
Кальций необходим в организме человека для строения костной ткани (зубы, кости), мышечной ткани (мышцы, мышца сердца), поддержания проводящей функции нервной ткани. При избытке кальций нейтрален по отношению к организму человека, однако, это снижает качество воды — соли кальция образуют накипь и мутность воды. Кроме того, соли кальция и магния формируют постоянную жесткость воды.
Кроме того, соли кальция и магния формируют постоянную жесткость воды.
Магний необходим для нормальной деятельности нервных клеток. Однако, его количество в воде должно быть ограниченно, т.к. при избытке он действует на подобие марганца — засоряет канальцы нервных клеток, только он менее активен и проще выводится из организма.
Калий также необходим для нормальной жизнедеятельности организма, т.к. является компонентом калий-натриевого насоса. Калий-натриевый насос — это структура на мембране каждой клетки, благодаря которой в клетку проникают вещества из межклеточной жидкости, а из клетки выводятся продукты ее жизнедеятельности. Кроме того, особенно важен калий для сердечно-сосудистой деятельности, т.к. он нормализует давление крови и работу сердца.
>.
Приборы для измерения растворенных веществ (солемеры):
Десять продуктов, которые нейтрализуют никотин в организме
Для быстрого выведения этого химического вещества из организма, медики рекомендуют ввести их в ежедневное меню.

Первое, на что обращают внимание медики, когда говорят о вреде сигарет, это то, что из-за никотина наблюдается витаминный дефицит, а значит, ослабленный организм не может бороться с различными заболеваниями. Поэтому они рекомендуют, как можно чаще употреблять в пищу те фрукты и овощи, которые содержат необходимые элементы.
И первый помощник в этом списке – брокколи. Известно, что овощ содержит огромное количество витаминов В5, С и В, которые отвечают за важные процессы в человеческом организме. Употребляя брокколи в любом виде, вы не только наполните свой организм необходимыми витаминами, но и повысите метаболизм. Продукт содержит ген NRF2, который способен справиться с избытком вредоносных веществ.
Если вы хотите быстрее избавиться от никотина и укрепить свой иммунитет, то на вашем столе обязательно должны присутствовать цитрусовые.
Довольно часто те, кто привержен к пагубной привычке, и те, кто недавно отказался от курения, жалуются на частую бессонницу. Поэтому чем быстрее вы поможете ему избавиться от никотина, тем лучше будете себя чувствовать. В апельсине и лимоне содержится большое количество витамина С – он поможет вам избавиться от стресса и нервозности.
Поэтому чем быстрее вы поможете ему избавиться от никотина, тем лучше будете себя чувствовать. В апельсине и лимоне содержится большое количество витамина С – он поможет вам избавиться от стресса и нервозности.
Если вы хотите избавиться от абстинентного синдрома, который влияет на психическое и эмоциональное состояние, и может возникнуть после отказа от курения, вам просто необходимо употреблять шпинат. Фолиевая кислота или водорастворимый витамин B9, которые содержатся в этой пище, необходимы для нормальной работы иммунной и кровеносной систем. Чаще употребляйте салат из шпината – он способен очень быстро вывести нейротоксин из вашего организма.
Имбирь – очень полезный продукт. Он пользуется большой популярностью у кондитеров. А также славится своими лечебными свойствами – борется с симптомами простуды, снимает воспаление. Для курильщиков имбирь хорош тем, что вещества, содержащиеся в нем, помогают снизить уровень липидов в крови. Это оказывает положительное воздействие на всю сердечно-сосудистую и иммунную системы человека, которым сложно восстановится после долгих лет регулярного отравления.
Это оказывает положительное воздействие на всю сердечно-сосудистую и иммунную системы человека, которым сложно восстановится после долгих лет регулярного отравления.
Клюква для бросивших курить – настоящая помощница. Дело в том, что никотин опасен еще и тем, что увеличивает уровень сахара в крови. А кислота, которая содержится в клюкве, выводит его из крови быстрее, чем другие ягоды. И помогает избавиться от тяги к курению.
При нехватке витаминов А, С и К в организме начинают погибать нервные клетки, нарушается циркуляция крови и, как следствие, нормальное функционирование мозга. И здесь на помощь придет обычная морковь. Содержание бета-каротина – эффективного лекаря при различных заболеваниях, которого в моркови много, обладает иммуностимулирующим свойством. Ешьте морковь, и вы укрепите естественную защиту вашего организма.
Курение наносит большой вред организму: сердцебиение, скачки давления, аритмия, снижение уровня содержания кислорода и крови.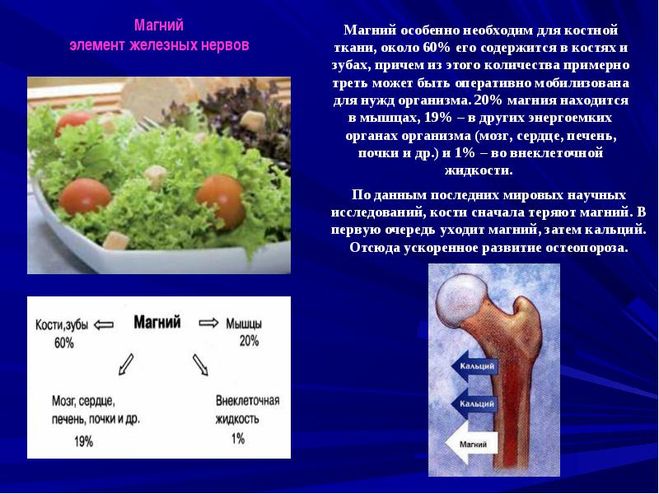 Отличными восстановительными свойствами обладает гранат. Благодаря содержащимся в нем микроэлементам, он прекрасно очищает сосуды. Наполнит организм кальцием, магнием, калием, марганцем и натрием. Сок граната медики прописывают больным малокровием и при расстройствах ЖКТ, которыми любители подымить нередко страдают.
Отличными восстановительными свойствами обладает гранат. Благодаря содержащимся в нем микроэлементам, он прекрасно очищает сосуды. Наполнит организм кальцием, магнием, калием, марганцем и натрием. Сок граната медики прописывают больным малокровием и при расстройствах ЖКТ, которыми любители подымить нередко страдают.
Беда курильщиков со стажем — тугие кровеносные сосуды. Для возврата эластичности — необходим витамина Е. Чтобы получить его в достаточном количестве лучше всего употреблять в пищу ростки пшеницы. Вырастить их можно дома: зерна хорошо промыть, засыпать в емкость с плоским дном и залить водой таким образом, чтобы верхний слой зерен был покрыт не полностью. Емкость закрыть хлопчатобумажной или полотняной салфеткой. Оставить на сутки в теплом месте. Употребляя пророщенную пшеницу, вы сможете улучишь эластичность сердечно-сосудистой системы.
Капусту диетологи и врачи, рекомендуют включать в меню как можно чаще. Этот овощ может защитить организм от онкологических заболеваний. Во всяком случае является хорошей профилактикой. Также капуста – естественный источник изотиоцианатов и других антиоксидантов, которые помогут избавиться от нежелательного никотина в организме.
Во всяком случае является хорошей профилактикой. Также капуста – естественный источник изотиоцианатов и других антиоксидантов, которые помогут избавиться от нежелательного никотина в организме.
| Острый перец | Нежирное мясо, рагу, помидоры, персики, яблочное пюре, клюквенный соус, подливы, нежирное мясо |
| Миндальный экстракт | Пудинги фруктовые |
| Тмин | Постное мясо, рагу, супы, салаты, хлеб, капуста, спаржа, лапша |
| Зеленый лук | Салаты, соусы, супы, нежирные мясные блюда, овощи |
| Уксус яблочный | Салаты, овощи, соусы |
| Корица | Фрукты, хлеб, пирожные |
| Карри в порошке | Постное мясо (особенно баранина), телятина, курица, рыба, помидоры, томатный суп, майонез, |
| Укроп | рыбные соусы, супы, помидоры, капуста, морковь, цветная капуста, стручковая фасоль, огурцы, картофель, салаты, макароны, баранина |
| Чеснок (без чесночной соли) | Постное мясо, рыба, супы, салаты, овощи, помидоры, картофель |
| имбирь | Курица, фрукты |
| Лимонный сок | Постное мясо, рыба, птица, салаты, овощи |
| Булава | Горячий хлеб, яблоки, фруктовые салаты, морковь, цветная капуста, кабачки, картофель, телятина, баранина |
| Горчица (сухая) | нежирное фарш, нежирное мясо, курица, рыба, салаты, спаржа, брокколи, брюссельская капуста, капуста, майонез, соусы |
| Мускатный орех | Фрукты, тесто для пирога, лимонад, картофель, курица, рыба, нежирный мясной рулет, тосты, телятина, пудинг |
| Луковый порошок | Постное мясо, рагу, овощи, салаты, супы |
| Паприка | Постное мясо, рыба, супы, салаты, соусы, овощи |
| Петрушка | Постное мясо, рыба, супы, салаты, соусы, овощи |
| Экстракт мяты перечной | Пудинги фруктовые |
| Pimiento | Салаты, овощи, запеканки |
| Розмарин | Курица, телятина, нежирный мясной рулет, нежирная говядина, нежирная свинина, соусы, начинки, картофель, горох, фасоль Лима |
| Шалфей | Нежирное мясо, рагу, печенье, помидоры, стручковая фасоль, рыба, фасоль лима, лук, нежирная свинина |
| Несладкий | Салаты, нежирная свинина, нежирное фарш, супы, стручковая фасоль, кабачки, помидоры, фасоль лима, горох |
| Тимьян | Постное мясо (особенно телятина и нежирная свинина), соусы, супы, лук, горох, помидоры, салаты |
| Куркума | Постное мясо, рыба, соусы, рис |
Функционирование калия и магния в фотосинтезе, транслокации фотосинтата и фотозащите — Tränkner — 2018 — Physiologia Plantarum
Введение
Почти все виды растений на Земле являются автотрофами и производят сложные углеродные соединения в процессе фотосинтеза, в котором улавливается солнечная энергия. Улавливание солнечной энергии является основой продуктивности, а чистое количество углерода, которое фотосинтетически ассимилируется растительностью в течение 1 года, так называемая чистая первичная продукция, предполагается равным 104,9 Пг (Поле 1998) (1 Пг = 10 15 г). Чистая первичная продукция считается доступным количеством энергии, которое может быть передано от растений на другие уровни трофических сетей в экосистемах (Haberl et al. 2007), например человеческое потребление сельскохозяйственных товаров. Предполагается, что сельскохозяйственное производство вырастет на 60–100% в следующие четыре десятилетия (Krausmann et al.2013), подчеркивая важность фотосинтеза и последующих процессов. Для неослабевающего фотосинтеза необходимы оптимальные условия, включающие оптимальное поступление питательных веществ. Калий и магний являются важными минеральными питательными веществами для растений, которые вносят решающий вклад в процесс фотосинтеза и последующий перенос фотоассимилятов на большие расстояния.
Улавливание солнечной энергии является основой продуктивности, а чистое количество углерода, которое фотосинтетически ассимилируется растительностью в течение 1 года, так называемая чистая первичная продукция, предполагается равным 104,9 Пг (Поле 1998) (1 Пг = 10 15 г). Чистая первичная продукция считается доступным количеством энергии, которое может быть передано от растений на другие уровни трофических сетей в экосистемах (Haberl et al. 2007), например человеческое потребление сельскохозяйственных товаров. Предполагается, что сельскохозяйственное производство вырастет на 60–100% в следующие четыре десятилетия (Krausmann et al.2013), подчеркивая важность фотосинтеза и последующих процессов. Для неослабевающего фотосинтеза необходимы оптимальные условия, включающие оптимальное поступление питательных веществ. Калий и магний являются важными минеральными питательными веществами для растений, которые вносят решающий вклад в процесс фотосинтеза и последующий перенос фотоассимилятов на большие расстояния. Среди минеральных питательных веществ растениям обычно требуется в наибольшем количестве азот (N), за ним следуют калий (K), фосфор (P), кальций (Ca) и магний (Mg).Растения усваивают как минерал Mg, так и K только в катионной форме (как Mg 2+ и K + ). Высокие концентрации K в почвенном растворе ингибируют поглощение Mg и могут вызывать дефицит Mg у растений (Salmon 1963, Heenan and Campbell 1981).
Среди минеральных питательных веществ растениям обычно требуется в наибольшем количестве азот (N), за ним следуют калий (K), фосфор (P), кальций (Ca) и магний (Mg).Растения усваивают как минерал Mg, так и K только в катионной форме (как Mg 2+ и K + ). Высокие концентрации K в почвенном растворе ингибируют поглощение Mg и могут вызывать дефицит Mg у растений (Salmon 1963, Heenan and Campbell 1981).
Внутри растений наиболее метаболически активный Mg связывается или включается в клеточные компартменты (Waters 2011), с самыми высокими концентрациями в хлоропластах (Karley and White 2009). Значительная доля Mg в листьях связана в качестве центрального атома в тетрапиррольном кольце молекул хлорофилла a и b , которые являются основными пигментами для фотосинтетического поглощения света (Wilkinson et al.1990). Напротив, K не является частью органических макромолекул и присутствует исключительно в своей ионной форме (K + ) или в слабых комплексах, из которых он легко заменяется (Marschner 2012). В клетках K + присутствует в двух основных пулах, вакуоли и цитозоле. Во втором случае наиболее распространенным катионом является K + . K и Mg взаимно участвуют в ряде физиологических процессов, включая активацию множества ферментов и регуляцию катион-анионного баланса (Marschner 2012).K + служит наиболее важным неорганическим осмотическим соединением в растительных клетках, и, таким образом, достаточное поступление K имеет решающее значение для регуляции тургорных процессов, таких как движение устьиц (Fischer 1968) и удлинение клеток (Mengel and Arneke 1982). K способствует диффузии CO 2 из атмосферы в хлоропласты (Jákli et al., 2017). K и Mg дополнительно участвуют в опосредованном флоэмой транспорте сахарозы и распределении фотоассимилятов в растении.
В клетках K + присутствует в двух основных пулах, вакуоли и цитозоле. Во втором случае наиболее распространенным катионом является K + . K и Mg взаимно участвуют в ряде физиологических процессов, включая активацию множества ферментов и регуляцию катион-анионного баланса (Marschner 2012).K + служит наиболее важным неорганическим осмотическим соединением в растительных клетках, и, таким образом, достаточное поступление K имеет решающее значение для регуляции тургорных процессов, таких как движение устьиц (Fischer 1968) и удлинение клеток (Mengel and Arneke 1982). K способствует диффузии CO 2 из атмосферы в хлоропласты (Jákli et al., 2017). K и Mg дополнительно участвуют в опосредованном флоэмой транспорте сахарозы и распределении фотоассимилятов в растении.
Как K, так и Mg играют важную роль в процессах, которые тесно связаны с фотосинтезом и транслокацией фотосинтеза (Рис. 1). До сих пор роль калия и магния в фотосинтезе и связанных процессах не была рассмотрена во всестороннем обзоре. Многие обзоры посвящены перемещению K или Mg в растениях (Shaul 2002, Gierth and Mäser 2007, Britto and Kronzucker 2008, Szczerba et al. 2009), а также вкладу этих элементов (особенно K) в снятие стресса (Cakmak 2005, Wang et al.2013) или, в несколько более широких подходах, об их статусе в мировом сельском хозяйстве (Römheld and Kirkby 2010, Cakmak 2013, Gransee and Führs 2013, Zörb et al. 2014). Таким образом, наша основная цель состоит в том, чтобы восполнить этот пробел, предоставив всесторонний обзор процессов, на которые влияют, облегчают и регулируют Mg и K в фотосинтезе, транслокации фотоассимилятов и фотозащите.
Многие обзоры посвящены перемещению K или Mg в растениях (Shaul 2002, Gierth and Mäser 2007, Britto and Kronzucker 2008, Szczerba et al. 2009), а также вкладу этих элементов (особенно K) в снятие стресса (Cakmak 2005, Wang et al.2013) или, в несколько более широких подходах, об их статусе в мировом сельском хозяйстве (Römheld and Kirkby 2010, Cakmak 2013, Gransee and Führs 2013, Zörb et al. 2014). Таким образом, наша основная цель состоит в том, чтобы восполнить этот пробел, предоставив всесторонний обзор процессов, на которые влияют, облегчают и регулируют Mg и K в фотосинтезе, транслокации фотоассимилятов и фотозащите.
Локализация анатомических, физиологических и биохимических реакций растений на дефицит калия и магния, связанных с фотосинтезом и транслокацией фотоассимилятов.1) Дефицит калия изменяет анатомию листа и, таким образом, диффузию мезофилла CO 2 . 2) Дефицит калия и магния изменяет ультраструктуру хлоропластов. 3) Mg является центральным атомом пигмента хлорофилла и также необходим для его биосинтеза. 4) И K, и Mg снижают количество и активность Rubisco, а Mg дополнительно действует при активации Rubisco. 5) K и Mg необходимы для транслокации фотоассимилятов источник-сток, так как они выполняют важные функции в апопластной загрузке флоэмы сахарозы.
4) И K, и Mg снижают количество и активность Rubisco, а Mg дополнительно действует при активации Rubisco. 5) K и Mg необходимы для транслокации фотоассимилятов источник-сток, так как они выполняют важные функции в апопластной загрузке флоэмы сахарозы.
Сначала мы выделим роль Mg и K в светонезависимых и светозависимых фотосинтетических процессах, включая (1) диффузию CO 2 через пограничный слой листа, устьица и мезофилл, (2) ультраструктуру хлоропластов, (3) синтез хлорофилла и (4) активация и активность Rubisco (рис. 1A – D). Затем мы оценим роль Mg и K в транслокации фотоассимилятов (Fig. 1E). Наконец, мы выделим светозащитные реакции, включая нефотохимическое тушение (NPQ), удаление активных форм кислорода (ROS), фотодыхание, движение хлоропластов и движение листьев.
K и участие Mg в фотосинтезе
Скорость фотосинтетической ассимиляции CO 2 стабильна в широком диапазоне концентраций K и Mg в листьях. Однако давно признано, что для поддержания фотосинтетической активности сельскохозяйственных культур необходимо адекватное питание K и Mg (например, Cooper et al. 1966, Terry and Ulrich 1973, Peoples and Koch 1979). Ниже определенного порога для листа K скорость ассимиляции резко падает.Концентрация K в тканях, которая имеет решающее значение для фотосинтетического функционирования сельскохозяйственных культур (т.е. концентрация K в тканях, при которой нетто-ассимиляция составляет 95% от максимального значения в экспериментальных условиях), составляет от 12,5 до 14,0 мг K · г -1 сухого вещества в масличном рапсе ( Лу и др., 2016a), 13,0 мг г -1 в сое (Singh and Reddy 2017), 22,3 мг г -1 в подсолнечнике (Jákli et al. 2017) и 26,0 мг г -1 в хлопке ( Gerardeaux et al.2010) (критические значения для Singh and Reddy (2017), Jákli et al.(2017) и Gerardeaux et al. (2010) рассчитаны по модельным уравнениям, представленным в соответствующих публикациях, описывающих взаимосвязь между концентрацией K в листьях и чистой ассимиляцией).
Однако давно признано, что для поддержания фотосинтетической активности сельскохозяйственных культур необходимо адекватное питание K и Mg (например, Cooper et al. 1966, Terry and Ulrich 1973, Peoples and Koch 1979). Ниже определенного порога для листа K скорость ассимиляции резко падает.Концентрация K в тканях, которая имеет решающее значение для фотосинтетического функционирования сельскохозяйственных культур (т.е. концентрация K в тканях, при которой нетто-ассимиляция составляет 95% от максимального значения в экспериментальных условиях), составляет от 12,5 до 14,0 мг K · г -1 сухого вещества в масличном рапсе ( Лу и др., 2016a), 13,0 мг г -1 в сое (Singh and Reddy 2017), 22,3 мг г -1 в подсолнечнике (Jákli et al. 2017) и 26,0 мг г -1 в хлопке ( Gerardeaux et al.2010) (критические значения для Singh and Reddy (2017), Jákli et al.(2017) и Gerardeaux et al. (2010) рассчитаны по модельным уравнениям, представленным в соответствующих публикациях, описывающих взаимосвязь между концентрацией K в листьях и чистой ассимиляцией). О критических концентрациях Mg в листьях для фотосинтеза не сообщалось, но для достижения 90% максимального урожая могут потребоваться концентрации 0,7 мг г -1 сухого вещества листа (Smith et al. 1985).
О критических концентрациях Mg в листьях для фотосинтеза не сообщалось, но для достижения 90% максимального урожая могут потребоваться концентрации 0,7 мг г -1 сухого вещества листа (Smith et al. 1985).
Ограничения по CO
2 диффузияВ светонезависимых фотосинтетических реакциях атмосферный CO 2 фиксируется посредством ферментативного карбоксилирования.Скорость фиксации CO 2 во время этого процесса зависит не только от био- и фотохимических процессов, но и от количества CO 2 , доступного для Rubisco в строме хлоропласта. Ряд сопротивлений ограничивает диффузию CO 2 из атмосферы во внутреннее воздушное пространство листа и далее через клеточную стенку, плазматическую мембрану, цитозоль, оболочку хлоропласта и строму (рис. 1A).
Диффузия пограничного слоя Первое сопротивление движению CO 2 из атмосферы к поверхности листа создает пограничный слой листа. В этом тонком слое, прилегающем к поверхности листа, турбулентный обмен подавлен, и перенос молекул характеризуется диффузией (Schuepp 1993). Толщина пограничного слоя и, следовательно, его проводимость к диффузии CO 2 , определяется энергетическим балансом листа (Woodrow et al. 1990), а не биохимическими параметрами и, следовательно, вряд ли напрямую зависит от статуса питательных веществ в листьях. . Поэтому в исследованиях влияния питательных веществ на обмен CO 2 ему в значительной степени пренебрегали.Однако из-за своих осмотических свойств дефицит калия вызывает потерю тургорного потенциала (Carroll et al. 1994), что может существенно повлиять на наклон листьев растений. Проводимость пограничного слоя зависит как от перехвата излучения, так и от скорости ветра (Martin et al. 1999). Таким образом, изменение среднего наклона листа в условиях дефицита K может существенно повлиять на свойства пограничного слоя и, таким образом, изменить его проводимость на молекулярную диффузию, что повлияет на фотосинтез, транспирацию и эффективность использования воды (Collatz et al.
В этом тонком слое, прилегающем к поверхности листа, турбулентный обмен подавлен, и перенос молекул характеризуется диффузией (Schuepp 1993). Толщина пограничного слоя и, следовательно, его проводимость к диффузии CO 2 , определяется энергетическим балансом листа (Woodrow et al. 1990), а не биохимическими параметрами и, следовательно, вряд ли напрямую зависит от статуса питательных веществ в листьях. . Поэтому в исследованиях влияния питательных веществ на обмен CO 2 ему в значительной степени пренебрегали.Однако из-за своих осмотических свойств дефицит калия вызывает потерю тургорного потенциала (Carroll et al. 1994), что может существенно повлиять на наклон листьев растений. Проводимость пограничного слоя зависит как от перехвата излучения, так и от скорости ветра (Martin et al. 1999). Таким образом, изменение среднего наклона листа в условиях дефицита K может существенно повлиять на свойства пограничного слоя и, таким образом, изменить его проводимость на молекулярную диффузию, что повлияет на фотосинтез, транспирацию и эффективность использования воды (Collatz et al. 1991, Schuepp 1993, Bridge et al. 2013). Этот эффект, по-видимому, уникален для дефицита K и вряд ли является результатом дефицита Mg, поскольку Mg не способствует осморегуляции. Однако нам не известны какие-либо исследования, напрямую связывающие питание калия или магния с проводимостью пограничного слоя, но следует учитывать его общую концепцию при переносе результатов измерений в листовой камере, где эффекты пограничного слоя в значительной степени устраняются за счет сильного перемешивания воздуха, в поле.
1991, Schuepp 1993, Bridge et al. 2013). Этот эффект, по-видимому, уникален для дефицита K и вряд ли является результатом дефицита Mg, поскольку Mg не способствует осморегуляции. Однако нам не известны какие-либо исследования, напрямую связывающие питание калия или магния с проводимостью пограничного слоя, но следует учитывать его общую концепцию при переносе результатов измерений в листовой камере, где эффекты пограничного слоя в значительной степени устраняются за счет сильного перемешивания воздуха, в поле.
CO 2 попадает в лист через устьичные поры.Их отверстие опосредуется замыкающими клетками устьиц, которые создают первые активно регулируемое сопротивление движению CO 2 в листья. Важная роль K + для регуляции замыкающих клеток устьиц и эффективности движения устьиц хорошо задокументирована (Fischer 1968, Humble and Raschke 1971). K + — это основной неорганический осмолит, управляющий изменениями тургора замыкающих клеток, необходимыми для движения устьиц. Динамическое регулирование устьичной апертуры требует быстрого обмена большого количества K + между апопластом, цитозолем и вакуолями замыкающих клеток устьиц (Roelfsema and Hedrich 2002, Andrés et al.2014). Транспорт K + через плазматическую мембрану замыкающих клеток устьиц опосредуется регулируемыми по напряжению внутренними выпрямляющими каналами K + и сопровождается притоком противоионов (NO 3 — , Cl — ) и синтез малата в цитозоле. Повышенные концентрации ионов уменьшают водный потенциал замыкающих клеток и вызывают приток воды. В результате увеличивается объем замыкающих клеток и открываются устьицы.
Динамическое регулирование устьичной апертуры требует быстрого обмена большого количества K + между апопластом, цитозолем и вакуолями замыкающих клеток устьиц (Roelfsema and Hedrich 2002, Andrés et al.2014). Транспорт K + через плазматическую мембрану замыкающих клеток устьиц опосредуется регулируемыми по напряжению внутренними выпрямляющими каналами K + и сопровождается притоком противоионов (NO 3 — , Cl — ) и синтез малата в цитозоле. Повышенные концентрации ионов уменьшают водный потенциал замыкающих клеток и вызывают приток воды. В результате увеличивается объем замыкающих клеток и открываются устьицы.
Из-за осмотической роли К в регуляции замыкающих клеток неудивительно, что устьичная проводимость часто снижается в условиях дефицита К (например,грамм. Терри и Ульрих 1973, Чжао и др. 2001, Якли и др. 2017). Тем не менее, независимо от важности K + в регуляции замыкающих клеток, изменения устьичной проводимости не ограничивают преимущественно фотосинтез, даже когда общие концентрации K в листьях ниже критического уровня для фотосинтеза (Sen Gupta et al. 1989, Zhao et al. др. 2001, Джин и др. 2011). Вклад устьичных ограничений в общее ограничение фотосинтеза у подсолнечника оценивается примерно в 15% (Jákli et al.2017) и не увеличивались даже при сильном дефиците К. Доля устьичных ограничений даже снизилась с 55 и 50% до 36 и 20%, соответственно, у двух сортов К-дефицитного масличного рапса (Lu et al. 2016a).
1989, Zhao et al. др. 2001, Джин и др. 2011). Вклад устьичных ограничений в общее ограничение фотосинтеза у подсолнечника оценивается примерно в 15% (Jákli et al.2017) и не увеличивались даже при сильном дефиците К. Доля устьичных ограничений даже снизилась с 55 и 50% до 36 и 20%, соответственно, у двух сортов К-дефицитного масличного рапса (Lu et al. 2016a).
Имеются данные о том, что скорость, с которой устьица реагируют на экологические или биохимические обратные связи, снижена у люцерны с дефицитом калия (Lindhauer 1983) и оливкового дерева (Erel et al. 2013). Erel et al. (2013) предположили, что функциональная замена K + на Na + может быть ответственной за изменения скорости движения устьиц у оливок, поскольку транспорт Na + через клеточные мембраны медленный по сравнению с транспортом К + .
В некоторых сообщениях указывается, что при комбинированном дефиците K и ограничении воды устьичный контроль может быть потерян у выращиваемых перлитом подсолнечника и оливковых растений, что приводит к ингибированию закрытия устьиц, вызванного засухой (Fournier et al. 2005, Arquero et al. 2006). , Benlloch-González et al. 2008, 2010). В соответствии с общей концепцией, авторы связывают свои результаты не с потерей осмотического контроля устьиц, а с ингибированием сигнального пути ABA за счет чрезмерной продукции этилена в листьях.Эти результаты не подтверждаются выводами Jákli et al. (2017), которые сообщают о снижении показателей устьичной проводимости у подсолнечника, лишенного калия и стресса ПЭГ, выращенного в питательном растворе, и Erel et al. (2013), которые не обнаружили какого-либо влияния дефицита калия на устьичную проводимость оливок, выращенных на перлите, подвергшихся воздействию засухи.
2005, Arquero et al. 2006). , Benlloch-González et al. 2008, 2010). В соответствии с общей концепцией, авторы связывают свои результаты не с потерей осмотического контроля устьиц, а с ингибированием сигнального пути ABA за счет чрезмерной продукции этилена в листьях.Эти результаты не подтверждаются выводами Jákli et al. (2017), которые сообщают о снижении показателей устьичной проводимости у подсолнечника, лишенного калия и стресса ПЭГ, выращенного в питательном растворе, и Erel et al. (2013), которые не обнаружили какого-либо влияния дефицита калия на устьичную проводимость оливок, выращенных на перлите, подвергшихся воздействию засухи.
Происхождение этого противоречия остается спекулятивным, а эффект взаимодействия дефицита калия и ограничения воды все еще обсуждается.В условиях хорошо обводненной воды общее мнение по-прежнему заключается в том, что устьичное функционирование хорошо сохраняется, даже когда концентрация калия в листьях ниже критических значений для фотосинтеза. Jákli et al. (2017) предположили, что снижение устьичной проводимости в условиях дефицита калия является реакцией на низкие скорости ассимиляции CO 2 с целью максимизации эффективности использования воды.
Jákli et al. (2017) предположили, что снижение устьичной проводимости в условиях дефицита калия является реакцией на низкие скорости ассимиляции CO 2 с целью максимизации эффективности использования воды.
В отличие от K, Mg не выполняет активной функции по контролю устьиц.Следовательно, причинно-следственная связь, предложенная Sun et al. (2001), которые объяснили снижение ассимиляции CO 2 у Mg-дефицитного Pinus radiata снижением устьичной проводимости, представляется весьма маловероятным. Снижение чистой ассимиляции, которое обычно наблюдается при дефиците Mg, вызвано, скорее, неустотными факторами. Это предположение подтверждается многочисленными исследованиями, в которых сообщается об отсутствии влияния дефицита Mg на устьичную проводимость или концентрации CO 2 внутри листа (например,Lasa et al. 2000, Tang et al. 2012 г., Ян и др. 2012). Однако, в отличие от K (Lu et al. 2016a, 2016b, Jákli et al. 2017), количественный анализ фотосинтетических ограничений у Mg-дефицитных растений до сих пор не опубликован.
2017), количественный анализ фотосинтетических ограничений у Mg-дефицитных растений до сих пор не опубликован.
После проникновения в лист через устьичную пору ряд сопротивлений дополнительно препятствует движению CO 2 через мезофилл листа и, следовательно, влияет на концентрацию CO 2 в хлоропластах.Эти сопротивления суммируются как (их обратная) «проводимость мезофилла» диффузии CO 2 и суммированы в недавнем обзоре Berghuijs et al. (2016). После диффузии через внутреннее воздушное пространство листа CO 2 растворяется в апопластной воде клеточных стенок. Находясь в жидкой фазе, CO 2 присутствует в виде растворенного CO 2 или HCO 3 — и далее диффундирует через поры клеточной стенки, плазматическую мембрану, цитозоль, оболочку хлоропласта и строма хлоропласта, в которой происходит ферментативная фиксация CO 2 .
Существует общепринятое мнение, что проводимость мезофилла снижается при низком содержании K, что чаще всего связано с анатомическими изменениями листа. Ограничения фотосинтеза, которые происходят из-за ограниченной диффузии CO 2 , связаны с мезофиллом, а не с устьичной проводимостью (например, Terry and Ulrich 1973, Jin et al. 2011, Battie-Laclau et al. 2014). Jákli et al. (2017) сообщили, что доля общего ограничения фотосинтеза, связанная с проводимостью мезофилла, увеличилась с 45 до 64% на бессимптомной площади листьев подсолнечника с недостатком калия по сравнению с растениями с достаточным количеством калия, а Lu et al.(2016a) показали увеличение ограничения мезофилла с 28 до 50% в K-неэффективном масличном рапсе при низком предложении K. Однако они не обнаружили значительного влияния дефицита К на ограничения мезофилла у К-эффективных сортов масличного рапса. Battie-Laclau et al. (2014) также не смогли показать влияние дефицита К на ограничения мезофилла в эвкалипте, хотя абсолютные значения проводимости мезофилла снизились, что указывает на видоспецифичную совместную регуляцию между мезофиллом и биохимическими ограничениями фотосинтеза.
Многие переменные влияют на диффузию CO 2 внутри листьев. Газовая диффузия в значительной степени определяется анатомическими свойствами листа, такими как толщина листа и объемное отношение внутреннего воздушного пространства листа к клеткам мезофилла, которые оба влияют на удельную массу листа (SLM). Многочисленные исследования показывают, что дефицит калия значительно увеличивает SLM (O’Toole et al. 1980, Cakmak et al. 1994b, Pettigrew 1999, Gerardeaux et al. 2010, Jin et al. 2011, Lu et al.2016b). SLM листьев с дефицитом калия усиливается за счет уменьшения толщины листа (O’Toole et al. 1980, Battie-Laclau et al. 2014) и уменьшения внутреннего воздушного пространства листа (Zhao et al. 2001, Battie-Laclau et al. 2014) . Более того, K является осмотическим драйвером роста клеток, а дефицит K приводит к уменьшению размера клеток мезофилла (Mengel and Arneke 1982, Claussen et al. 1997). Уменьшение толщины листа, внутреннего воздушного пространства листа и размера клеток уменьшают площадь поверхности хлоропласта, открытую для внутреннего воздушного пространства листа (Giuliani et al. 2013) и, следовательно, проводимость мезофилла. Кроме того, Лу и соавт. (2016b) наблюдали большее расстояние между хлоропластами и клеточными стенками у K-дефицитных Brassica napus , увеличивая общую длину пути диффузии жидкой фазы CO 2 и, таким образом, проводимость мезофилла.
2013) и, следовательно, проводимость мезофилла. Кроме того, Лу и соавт. (2016b) наблюдали большее расстояние между хлоропластами и клеточными стенками у K-дефицитных Brassica napus , увеличивая общую длину пути диффузии жидкой фазы CO 2 и, таким образом, проводимость мезофилла.
Помимо влияния анатомических свойств, увеличение SLM также может быть связано с увеличением неструктурных углеводов в листьях с дефицитом калия (Cakmak et al.1994b, Gerardeaux et al. 2010). Gerardeaux et al. (2010) сообщают, что 15% увеличения SLM при дефиците K было связано с увеличением концентрации растворимого сахара. На основании чисто физических исследований Carroll et al. (2014), Hölttä et al. (2017) предположили, что увеличение концентрации сахара может снизить скорость диффузии жидкой фазы CO 2 . Таким образом, повышенные концентрации сахаров в жидкой фазе мезофилла листа могут способствовать снижению проводимости мезофилла при дефиците калия.
Проводимость мезофилла не только чувствительна к анатомическим особенностям листа и концентрациям растворенных веществ, но может дополнительно зависеть от экспрессии белков, таких как аквапорины, которые способствуют диффузии CO 2 внутри листа. Kanai et al. (2011) продемонстрировали важность адекватного питания калием для функционирования аквапоринов для поглощения и транспортировки воды. Имеются убедительные доказательства того, что транспорт не только воды, но и CO 2 через плазматические и хлоропластные мембраны в значительной степени поддерживается аквапоринами, и сообщается, что снижение экспрессии аквапорина табака NtAQP1 может вызвать 20% -ное снижение проводимость мезофилла (Flexas et al.2006 г., Uehlein et al. 2008 г.). Хотя прямые экспериментальные доказательства все еще отсутствуют, возможно участие аквапориновой активности в общем снижении проводимости мезофилла при дефиците K.
Кроме того, диффузии CO 2 через цитозоль и строму хлоропластов, вероятно, будет способствовать активность карбоангидраз, группы ферментов, которые катализируют взаимное превращение между CO 2 и HCO 3 — и могут поэтому увеличьте скорость доставки CO 2 в Рубиско (Berghuijs et al. 2017). Повышенные концентрации К в листьях усиливали активность углеангидразы в листьях Brassica juncea (Mohammad and Naseem 2006), но общие доказательства связи между активностью карбоангидразы и проводимостью мезофилла в условиях дефицита К пока отсутствуют.
2017). Повышенные концентрации К в листьях усиливали активность углеангидразы в листьях Brassica juncea (Mohammad and Naseem 2006), но общие доказательства связи между активностью карбоангидразы и проводимостью мезофилла в условиях дефицита К пока отсутствуют.
Подводя итог влиянию дефицита K на проводимость мезофилла, мы заключаем, что снижение фотосинтеза при дефиците K может быть в значительной степени связано с увеличением внутренней устойчивости листа к переносу CO 2 , что приводит к низкой проводимости мезофилла.Повышенные концентрации сахара и SLM, скорее всего, способствуют общему снижению проводимости мезофилла. Уменьшение площади поверхности хлоропластов, открытой для внутреннего воздушного пространства листа, и увеличение длины внутриклеточного пути диффузии жидкой фазы, по-видимому, являются наиболее важными факторами, ограничивающими диффузию мезофилла CO 2 . Вклад различных признаков в общее снижение проводимости мезофилла сильно зависит от вида (Tomás et al. 2013) и также может варьироваться между разновидностями одного и того же вида (Lu et al.2016а, 2016б).
2013) и также может варьироваться между разновидностями одного и того же вида (Lu et al.2016а, 2016б).
В отличие от K, не существует исследований связи между питанием Mg и проводимостью мезофилла. Следовательно, мы можем только предполагать возможное влияние Mg на диффузию CO 2 через мезофилл листа. Подобно дефициту К, повышенная SLM наблюдается для листьев растений с дефицитом Mg (Cakmak et al.1994b, Li et al.2017), что объясняется накоплением растворимых углеводов в результате нарушенной загрузки флоэмы (например.грамм. Cakmak et al. 1994b, Lavon et al. 1995). Как обсуждалось выше, повышенные концентрации сахаров в жидкой фазе мезофилла листа могут влиять на его проводимость по диффузии CO 2 . Однако, как упоминалось ранее, для количественной оценки вклада устьичных ограничений и ограничений мезофилла в фотосинтез Mg-дефицитных растений необходим систематический анализ ограничений.
Ультраструктура хлоропласта
Ультраструктура хлоропластов образована организацией внутренней мембранной системы.Часть мембран складывается в цилиндрические структуры, которые образуют так называемые граны, в то время как часть мембран остается разложенной, ламеллы стромы. K + и Mg 2+ способствуют хорошо структурированной организации ламелл граны и стромы, поэтому поддерживают целостность хлоропластов, эффективность поглощения света, диффузию Рубиско и, как следствие, ассимиляцию углерода. В условиях дефицита Mg и K наблюдалось повреждение ультраструктуры хлоропластов как таковое: структура ламелл была нерегулярной, рыхлой и частично диспергированной в цитоплазме, а количество гран и ламелл было уменьшено (Hall et al.1972 г., Чжао и др. 2001, Цзя и др. 2008 г.). Напротив, увеличение концентрации Mg привело к появлению многих известных многослойных мембран (Rumak et al. 2010). Укладка граны в основном зависит от сил притяжения Ван-дер-Ваальса и электростатического отталкивания (Puthiyaveetil et al., 2017). Электростатическое отталкивание контролируется поверхностными зарядами мембраны и концентрацией ионов в среде, окружающей тилакоидные мембраны. Экранирование чистых отрицательных поверхностных зарядов K + в качестве одновалентного катиона и более эффективно Mg 2+ в качестве двухвалентного катиона снижает силу электростатического отталкивания.Puthiyaveetil et al. (2017) показали, что при низкой активности K + накопление затруднено, поскольку преобладают силы отталкивания. Напротив, при высоких концентрациях K + и Mg 2+ (> 100 мМ K + и 5 мМ Mg 2+ ) укладка гран была хорошо развита. Кроме того, предполагается, что изменения латеральной микроорганизации LHCII и последующее разделение двух фотосистем (ФС) происходит при низких концентрациях Mg 2+ (Stys 1995, Stoitchkova et al.2006 г.). Однако для укладки граны требуются более высокие концентрации Mg 2+ , чем для сегрегации PSs (Stoitchkova et al. 2006).
Образование граны увеличивает объем стромы, тем самым генерируя больше пространства для свободной диффузии макромолекул в густо переполненной строме (Anderson et al. 2008). Увеличение объема стромы может уменьшить скопление макромолекул и, таким образом, способствовать диффузии Rubisco и способствовать высокой скорости фиксации углерода (Anderson et al.2008 г.).
Хлорофилл
Хлорофилл a и b — основные пигменты для поглощения световой энергии, и для синтеза обоих пигментов требуется Mg. Обычной реакцией на дефицит Mg является снижение концентрации хлорофилла, что продемонстрировано в многочисленных исследованиях (Mengutay et al. 2013, Faust and Schubert 2016, Tränkner et al. 2016). Однако, если рассматривать хлорофилл a и b по отдельности, ответ не является однородным.В сахарной свекле концентрации хлорофилла a и b снижались при дефиците Mg (Hermans et al. 2004). Для кофе реакция зависит от сорта, поскольку не было изменений в соотношении хлорофилла a / b у сорта. Катуай (Да Силва и др., 2014), тогда как в cv. Концентрации хлорофилла Acaiá a / b колебались в течение эксперимента без четкой корреляции с дефицитом Mg.
Биосинтез хлорофилла начинается с встраивания Mg в протопорфирин IX (рис.1С). Встраивание Mg катализируется Mg-хелатазой, ферментом, состоящим из субъединиц 40, 70 и 140 кДа, обозначенных субъединицами ChlI, ChlD и ChlH соответственно. Для встраивания Mg в протопорфирин IX каталитический цикл Mg-хелатазы проходит две стадии (Masuda 2008). Первым этапом является этап активации, на котором субъединицы I и D образуют комплекс с АТФ и Mg 2+ . Субъединица H связывается с протопорфирином IX и Mg 2+ и предположительно содержит активный сайт для хелатирования.Второй этап включает хелатирование Mg в протопорфирин IX, что требует гидролиза АТФ. Исследования in vitro показали, что хелатирование 1 магния требует гидролиза 15 АТФ, что делает хелатирование магния дорогой реакцией, сопряженной с гидролизом АТФ (Reid and Hunter 2004). Активность хелатазы Mg чувствительна к концентрации свободного Mg и, таким образом, зависит от суточного цикла. При освещении концентрация свободного Mg в строме хлоропласта может увеличиваться до 6 мМ, обеспечивая приток в путь биосинтеза хлорофилла (Reid and Hunter 2004). Vicia faba Растения , выращенные в условиях дефицита Mg, показали снижение количества транскриптов субъединицы H хелатазы Mg даже в тканях, где концентрации Mg не опускались ниже критического уровня (Neuhaus et al. 2013). Следовательно, анализ обилия транскриптов Mg-хелатазы H может служить ранним индикатором дефицита Mg.
При биосинтезе хлорофилла в основном образуется хлорофилл a . Часть хлорофилла a окисляется до хлорофилла b хлорофиллидом a оксигеназой, но хлорофилл b может восстанавливаться обратно до хлорофилла a .Для разложения хлорофилла хлорофилл b сначала должен быть преобразован в хлорофилл a , поскольку производные хлорофилла b не катализируются в последующем пути. Таким образом, соотношение обоих пигментов строго регулируется взаимным превращением хлорофилла a и b (цикл хлорофилла) (Blankenship 2014, Sato et al. 2014). Хлорофилл a и b связаны со стабильностью светособирающего комплекса II (LHCII), а хлорофилл b имеет решающее значение для накопления LHCII (Sato et al.2015). Распад хлорофилла b запускает деградацию LHCII и, таким образом, участвует в регуляции светособирающей способности растений и подавлении фотоповреждений. Он также способствует ремобилизации питательных веществ, поскольку LHCII является белком, который содержится в большом количестве в хлоропласте и служит резервуаром питательных веществ в условиях дефицита (Sato et al. 2015). Таким образом, деградация хлорофилла в условиях дефицита Mg может функционировать для высвобождения Mg и защиты клеток от фотоповреждения, запуская деградацию LHCII.
Аналогичным образом, общая концентрация хлорофилла часто снижается при дефиците калия (Longstreth and Nobel 1980, Bednarz and Oosterhuis 1999, Zhao et al. 2001, Lu et al. 2016b). Было высказано предположение, однако, что дегенерация хлорофилла не является первичным эффектом дефицита К, а скорее связана с чрезмерным производством АФК (Cakmak 2005), на что будет ссылаться далее в тексте.
Активация и активность Rubisco
Магний имеет решающее значение для фиксации CO 2 , поскольку он непосредственно участвует в активации и активности Rubisco.Кроме того, Mg имеет решающее значение для синтеза белка, который влияет на изобилие белка Rubisco и, таким образом, косвенно влияет на фиксацию CO 2 . Было показано, что при дефиците Mg концентрация белка снижается в сахарной свекле (Faust and Schubert, 2016), пшенице (Mengutay et al. 2013) и кукурузе (Mengutay et al. 2013). Более низкие концентрации белка при дефиците Mg могут быть связаны с участием ионов Mg в ассоциации и активности рибосомных субъединиц (Yamamoto et al. 2010). Кроме того, предполагается, что Mg контролирует структурную гибкость многих рибосомных белков (Yamamoto et al.2010). Более 100 ионов магния связаны с большой рибосомной субъединицей (Петров и др., 2012), а часть ионов Mg формирует микрокластер магния, который содержит два тесно связанных иона Mg. Предполагается, что микрокластеры магния обеспечивают структурную целостность большой рибосомной субъединицы и помогают в поддержании компактной нативной структуры сборки (Petrov et al. 2012). Самый распространенный белок на Земле — это Рубиско, и около 30% общего белка в листьях растений (Jensen 2000) и примерно 40% всех стромальных белков составляет Рубиско (Hazra et al.2015). С помощью протеомного анализа Peng et al. (2015) показали, что содержание белка активазы Rubisco и Rubisco (Rca) снижалось при дефиците Mg у Citrus sinensis , что указывает на влияние количества и активности Rubisco, что согласуется с 88% снижением скорости ассимиляции в Mg-дефицитных листьях. . Однако фиксация CO 2 скорее контролируется количеством активного Rubisco, чем общим количеством белка Rubisco (Taylor and Andersson 1996).
АктивностьRubisco обычно измеряется в анализах in vitro, тогда как определение скорости ассимиляции CO 2 in vivo может служить мерой активности Rubisco.Многочисленные исследования показывают снижение активности Rubisco или скорости ассимиляции CO 2 при дефиците Mg у различных видов растений, таких как шпинат (Yuguan et al. 2009), цитрусовые (Tang et al. 2012, Li et al. 2017), кукуруза (Jezek et al. al.2015), подсолнечник (Lasa et al. 2000) и P. radiata (Laing et al. 2000, Sun et al. 2001). Активность Rubisco чувствительна к статусу Mg, что наблюдается по снижению скорости ассимиляции CO 2 у Mg-дефицитной сахарной свеклы и ячменя уже через 7 и 8 дней, соответственно, после начала дефицита Mg в испытаниях питательных растворов (Terry and Ulrich 1974, Tränkner et al.2016). Рубиско катализирует карбоксилирование и / или оксигенацию рибулозо-1,5-бисфосфата (RuBP) и тем самым инициирует путь производства сахара или светодыхательные пути. Для проявления каталитической активности остаток лизина в активном центре фермента должен быть карбамилирован активатором, не являющимся субстратом молекулы CO 2 , а лабильная карбаматная группа впоследствии стабилизируется ионом Mg до связывания субстрата RuBP. (Тейлор и Андерссон 1997, Портис 2003). Однако потеря активатора CO 2 и иона Mg может привести к прочному связыванию субстрата RuBP или других сахарных фосфатов без предварительного карбамилирования, ингибируя его активность (Taylor and Andersson 1997).Ким и Портис (2006) показывают, что низкие концентрации Mg резко увеличивают скорость дезактивации Rubisco и связывают это с декарбамилированием активных центров и более сильным связыванием RuBP с некарбамилированной формой Rubisco. Высвобождение связанного RuBP и других сахарных фосфатов достигается с помощью каталитического шаперона Rca (Kuriata et al. 2014). Rca обладает гидролитической АТФазной активностью, которая необходима для активирующей активности Rubisco. Когда Mg отсутствовал в среде для анализа, ферментативный оборот прекращался в изолированном Rca табака (Hazra et al.2015). Точно так же активность Rca была снижена в шпинате с дефицитом Mg (Yuguan et al. 2009). Hazra et al. (2015) предполагают, что существует второй сайт связывания магния на основе белка, который служит коактиватором, опосредуя контакт между субъединицами. Т.о., необходим и Mg, координированный с ATP и Mg для обеспечения сборки субъединиц, и полностью активированный комплекс лучше всего представлен Rca • Mg • ATP • Mg (Hazra et al. 2015). Каталитическая активация Rca специфична для Mg, поскольку замена Mg 2+ на Mn 2+ привела к 32-кратному снижению скорости оборота.
Высокие концентрации цитозольной сахарозы в Mg-дефицитных листьях, что является обычным явлением при дефиците Mg в результате снижения скорости экспорта флоэмы (Cakmak et al. 1994a), также должны подавлять экспрессию генов, участвующих в фотосинтезе (Neales и Incoll 1968, Jang and Sheen 1994, Sheen 1994).
Аналогичным образом, дефицит K снижает активность карбоксилирования Rubisco в хлоропластах. Это было показано измерениями in vitro (Weng et al.2007, Ху и др. 2015, Захур и др. 2017), а также оценками максимальной скорости карбоксилирования Rubisco, V c, max , на основе комбинированных измерений газообмена листьев и флуоресценции хлорофилла (Jin et al.2011, Battie-Laclau et al.2014, Erel et al. 2015, Якли и др., 2017). Иногда утверждают, что дефицит K ингибирует активацию Rubisco (Oosterhuis et al. 2013), что приводит к снижению скорости карбоксилирования RuBP. В более раннем отчете по этому вопросу Peoples и Koch (1979) четко утверждают, что в очищенном экстракте Rubisco из K-дефицитной и K-достаточной люцерны специфическая активность RuBPc (= RuBP-карбоксилазы ), выделенной из сильно K-дефицитные и K-достаточные створки существенно не различались, что позволяет предположить, что K не участвует в активности RuBPc ».Напротив, при измерении активности карбоксилирования в неочищенном экстракте авторы обнаружили значительно повышенную активность Rubisco, экстрагированного из листьев с достаточным содержанием калия. Они пришли к выводу, что биосинтез Рубиско заметно подавляется при недостаточном поступлении калия. Это снова было показано на семядолях огурца (Ohya et al. 1986). Как правило, синтез белка, по-видимому, чувствителен не только к Mg, но и к дефициту K, потому что K + участвует в рибосомной трансляции (Nissen 2000, Austin and First 2002).Следовательно, концентрация растворимых белков в тканях растений снижается при дефиците К, тогда как концентрация свободных аминокислот увеличивается (Besford 1975, Cakmak et al. 1994a, Li et al. 1997, Faust and Schubert 2016). Как следствие, количество Rubisco снижается в листьях с дефицитом калия. Более низкое содержание Rubisco (на основе площади листа) также было показано в листьях сои с дефицитом K (Wang et al., 2015), но ни общий растворимый белок, ни содержание Rubisco не зависели от статуса K в листьях цитрусовых (Lavon et al.1999). Авторы, однако, сообщают о более высоком общем содержании аминокислот и активности карбоксилирования Рубиско. Тем не менее, влияние K на количественные характеристики Rubisco, по-видимому, зависит от изучаемых видов и соответствующей стадии роста (Osaki et al. 1993).
Помимо количества Rubisco, поставка K может косвенно влиять на деятельность Rubisco. Оптимальные концентрации хлоропластов K + (т.е. в диапазоне цитозольных концентраций K + около 100 мМ) вызывают более широкий диапазон оптимума pH для функционирования Rubisco, чем при дефиците K (Mengel and Kirkby 2001).Кроме того, подавление активности Rubisco может происходить при низких концентрациях CO 2 в хлоропласте (Galmés et al.2011), что является результатом снижения скорости переноса CO 2 в тканях мезофилла с дефицитом K (Jákli et al., 2017). По сравнению с дефицитом Mg, снижение скорости экспорта флоэмы приводит к высоким концентрациям цитозольной сахарозы (Cakmak et al. 1994a), что может вызывать ингибирование активности Rubisco по обратной связи (Goldschmidt and Huber 1992).
Кроме того, Jin et al.(2011), Battie-Laclau et al. (2014) и Erel et al. (2015) сообщают о снижении максимальной скорости транспорта электронов (J max ) через ФС гикори, эвкалипта и оливковых листьев с дефицитом калия. J max связан с регенерацией RuBP, потребляющей АТФ и НАДФН (Farquhar et al. 1980), что подразумевает меньшее количество акцепторных молекул для фиксации CO 2 .
Подводя итог, нет никаких доказательств того, что K + участвует в активации Rubisco, а скорее регулирует активность Rubisco, влияя на его количество, его pH-оптимум и доступность субстрата (CO 2 и, возможно, RuBP).
УчастиеK и Mg в транслокации фотоассимилятов
Рост и метаболизм растений требуют транслокации углеводов из фотосинтетически активных тканей в приемные органы, такие как корни, цветы и семена. Загрузка сахарозы — основной формы транспорта углеводов в растениях — во флоэму существенно зависит от питания K и Mg (рис. 1E), и нехватка любого из этих элементов может существенно повлиять на эффективность переноса углерода на большие расстояния в пределах растения.Согласно гипотезе напорного потока, первоначально разработанной Мюнхом (1930), движение растворенных веществ во флоэме следует за градиентом гидростатического давления, который возникает из-за различий в концентрациях растворенных веществ. K + является наиболее распространенным катионом во флоэме и вместе с сахарозой и амино-N соединениями является наиболее важным осмотическим соединением сока флоэмы. Следовательно, он вносит свой вклад в скорость транспорта флоэмы (Lalonde et al. 2003), и концентрация K + в соке флоэмы Ricinus communis положительно коррелирует с уровнем внешнего поступления калия (Mengel and Haeder 1977).
При апопластной загрузке флоэмы сахароза должна активно транспортироваться против своего градиента концентрации через плазматические мембраны клеток-компаньонов флоэмы и ситовые элементы с помощью транспортеров сахарозы. Необходимая энергия генерируется H + -АТФазами, которые создают градиент протонов через плазматическую мембрану (Michelet and Boutry, 1995). Низкие клеточные концентрации Mg могут приводить к диссоциации комплекса Mg • ATP и к снижению активности H + -АТФаз плазматической мембраны (Hanstein et al.2011). Как следствие, трансмембранный протонный градиент не может быть установлен, скорость экспорта флоэмы снижается и сахароза накапливается в ткани листа.
Помимо Mg, K играет решающую роль в загрузке сахарозы. Исследование нокаут-мутантов Arabidopsis akt2 / 3-1 показало, что трансмембранный потенциал, устанавливаемый H + -ATPases, регулируется внутренним выпрямляющим калиевым каналом AKT2 / 3 (Deeken et al. 2002). Таким образом, AKT2 / 3 способствует основной загрузке и разгрузке сахарозы во флоэму и из нее.Путем множественных шагов посттрансляционной модификации он может быть преобразован в не выпрямляющий канал, который способствует быстрому оттоку K + из комплекса ситовых элементов / компаньонов (Gajdanowicz et al. 2011, Sandmann et al. 2011). Установленный градиент K + обеспечивает энергию, которая используется другими транспортерами для загрузки флоэмы. Этот механизм, так называемая «калиевая батарея», служит мобильным источником энергии для преодоления местного дефицита АТФ и поддержания эффективности системы транспортировки на большие расстояния (Gajdanowicz et al.2011 г., Дрейер и др. 2017).
Нарушение распределения углерода от источника к поглотителю при дефиците Mg было показано на многих растениях, таких как сахарная свекла (Hermans et al. 2005), кукуруза (Mengutay et al. 2013), фасоль (Cakmak et al. 1994a) и соя ( Ян и др., 2017). Помимо сахарозы, крахмал может накапливаться в хлоропласте при дефиците Mg (Lavon et al. 1995, Ceylan et al. 2016, Yang et al. 2017). Молекулярная регуляция, лежащая в основе накопления углерода при дефиците Mg, все еще неоднозначна.У сахарной свеклы количество транскриптов специфического H + / симпортера сахарозы BvSUT1 было выше в Mg-дефицитных листьях, но содержание сахарозы было увеличено (Hermans et al. 2005). У V. faba, количество транскриптов изоформ H + -АТФазы плазматической мембраны снижалось, когда растения выращивали в условиях дефицита Mg (Neuhaus et al. 2013). Однако это было не для всех исследованных изоформ. Одна изоформа показала несколько увеличенное количество транскриптов при дефиците Mg, а другая изоформа могла быть обнаружена только при лечении с дефицитом Mg и отсутствовала при контроле поставки Mg (Neuhaus et al.2013).
Подобно Mg, у K-дефицитных Phaseolus vulgaris наблюдались сдвиг в распределении ассимилятов с повышением концентрации углеводов в первичных листьях и снижением концентраций в корнях, а также снижение скорости экспорта сахарозы из флоэмы (Cakmak et al. al. 1994a, 1994b). Аналогичным образом, концентрация сахарозы была увеличена в функциональных листьях хлопчатника с дефицитом калия (Bednarz and Oosterhuis 1999, Hu et al.2015, Zahoor et al.2017).
Эти исследования ясно показывают сильное влияние Mg и K на ассимиляцию и выделение углерода. Однако остается неясным, как связаны статус Mg и K, накопление углеводов и вызванная углеводами обратная связь при фотосинтезе в физиологических и молекулярных аспектах.
K и участие Mg в фотозащите
Как указано в предыдущих параграфах, K и Mg влияют на фотосинтетическую способность, а дефицит одного из двух питательных веществ снижает ассимиляцию CO 2 (рис.2). При таком ограничении фотосинтетической способности поглощенная световая энергия превышает то, что может быть использовано в процессах фотосинтеза, что приводит к усиленному производству АФК, и растения страдают от окислительного стресса (Nishiyama et al. 2006, Takahashi and Badger 2011). АФК ингибируют восстановление фотоповрежденных PSII, преимущественно белка D1 в реакционном центре PSII, вызывая фотоингибирование (Takahashi and Badger 2011, Järvi et al. 2013). На фотоингибирование может указывать параметр флуоресценции хлорофилла F v / F m (Niyogi 1999), который описывает максимальную эффективность, при которой свет, поглощенный ФСII, используется для восстановления Q A , первичного акцептора электронов хинона. в PSII (Baker 2008).Дефицит Mg и K вызывает неоднородные ответы у F v / F m . В цитрусовых с дефицитом Mg и сахарной свекле F v / F m было снижено (Hermans et al. 2004, Tang et al. 2012, Yang et al. 2012), тогда как у Mg-дефицитного подсолнечника и Sulla carnosa , F v / F m не был затронут (Lasa et al. 2000, Farhat et al. 2015). Изменения в F v / F m при дефиците Mg были связаны с повреждением выделяющего кислород комплекса на ФСII или с накоплением восстановленного Q A (Yang et al.2012). Дефицит K вызвал уменьшение F v / F m у двух сортов хлопка (Wang et al. 2012), риса (Jia et al. 2008), оливкового (Erel et al. 2015) и кукурузы (Qu и др. 2013), тогда как у ели обыкновенной и подсолнечника снижение F против / F m не наблюдалось (Barnes et al. 1995, Jákli et al. 2017). Два сорта сои, являющиеся толерантными и чувствительными к дефициту K, соответственно, по-разному реагировали на дефицит K: толерантный сорт не показал измененных значений F v / F m , тогда как чувствительный сорт показал значительное снижение F v / F m (Wang et al.2015). В заключение следует отметить, что дефицит Mg и K обычно не вызывает фотоингибирование, которое может зависеть от величины дефицита Mg и K в ткани листа, специфических реакций сорта и условий окружающей среды и экспериментов.
Влияние дефицита калия и магния на процессы, связанные с фотосинтезом, транслокацией фотоассимилятов и фотозащитой. Первичные эффекты — это прямые анатомические, физиологические или биохимические реакции на дефицит K и / или Mg.Вторичные эффекты являются немедленными последствиями после первичных эффектов и в конечном итоге подавляют фотосинтетическую ассимиляцию CO 2 . Третичные эффекты являются результатом ингибирования ассимиляции CO 2 и только косвенно связаны с дефицитом K и / или Mg. Существуют сложные петли обратной связи и взаимодействия. Анатомия листа, транслокация фотоассимилятов, синтез белка, активность Rubisco, ультраструктура хлоропластов, синтез и изобилие хлорофилла напрямую зависят от дефицита Mg и / или K.Измененная анатомия листа препятствует диффузии CO 2 через мезофилл и тем самым снижает концентрацию CO 2 в хлоропластах, что, в свою очередь, ограничивает ассимиляцию CO 2 прямо или косвенно, влияя на активность Rubisco. Нарушение транслокации фотоассимилятов приводит к накоплению сахарозы, которая напрямую влияет на активность Rubisco через ингибирование обратной связи и косвенно влияет на диффузию мезофилла CO 2 . Снижение активности Rubisco в конечном итоге ограничивает ассимиляцию CO 2 .Нарушенная ультраструктура хлоропластов и низкое содержание хлорофилла снижают общую фотосинтетическую способность, снова препятствуя ассимиляции. Как следствие, устьичная проводимость активно регулируется до низких скоростей ассимиляции CO 2 , чтобы повысить эффективность фотосинтетического использования воды. Низкая фотосинтетическая способность вызывает чрезмерное производство АФК и фотоокисление, например, хлорофилл. Как следствие, активируются фотозащитные механизмы.
Удаление АФК
АФК, которые продуцируются в тилакоиде, должны быть немедленно детоксифицированы, прежде чем они диффундируют из места своего образования и повреждают молекулы-мишени (Asada 2006).Детоксикация хлоропласта достигается с помощью антиоксидантов, таких как аскорбатпероксидаза (APX), Fe- и CuZn-супероксиддисмутаза (SOD) и глутатионредуктаза (GR). Взаимодействие между образованием ROS и детоксикацией ROS строго контролируется и необходимо для неограниченной фотохимии. Дефицит Mg и K вызывает обычно повышенный уровень ROS и повышенную активность фермента, детоксифицирующего ROS. При низком содержании калия и магния повышенные концентрации H 2 O 2 или O 2 — были зарегистрированы на многих видах растений, таких как арабидопсис, кукуруза, рис, хлопок и кофе (Shin and Schachtman 2004, Weng и другие.2007, Ху и др. 2016, Да Силва и др. 2017). К-неэффективный сорт хлопка увеличивал концентрации O 2 — и H 2 O 2 в листьях и повышал активность SOD и APX, тогда как K-эффективный сорт хлопка увеличивал только APX, но не активность SOD, и ни H 2 , O 2 , ни O 2 — концентрации не были затронуты (Wang et al. 2012). Озгюр Узильдай и др. (2017) показали явное влияние статуса Mg на генерацию АФК.Когда Mg отсутствовал в питательном растворе или подавался только с 75 мкМ, концентрация H 2 O 2 в листьях хлопчатника увеличивалась на 29 и 33% соответственно, но когда добавка Mg была увеличена до 150 мкМ, H 2 O 2 концентрация увеличилась на 13%. Аналогичным образом, листья ячменя, страдающие тяжелым дефицитом магния, имели на 55% более высокую концентрацию H 2 O 2 по сравнению с контролем, хотя активность APX, GR и SOD была значительно увеличена.При легком дефиците активность APX, GR и SOD все еще увеличивалась, но концентрация H 2 O 2 снижалась до того же уровня, что и в контроле, что указывает на то, что при тяжелом дефиците Mg степень H 2 O 2 продукции превысили производительность по улавливанию (Трэнкнер и др., 2016).
В заключение, дефицит K и Mg вызывает окислительный стресс, на что указывает повышение уровней H 2 O 2 и O 2 —, но в ответ на это усиливается активность антиоксидантного фермента, что выводит токсины на часть АФК.Однако не всегда удается снизить АФК до уровней, сопоставимых с уровнями у нестрессированных растений, в зависимости от уровня стресса, вызванного дефицитом калия и магния.
Нефотохимическая закалка
Нефотохимическое рассеяние избыточной поглощенной световой энергии в виде тепла, обычно определяемое как NPQ, расположенное в антенне LHCII, является важным фотозащитным механизмом (Ruban 2016). Рассеяние тепловой энергии как фотозащитный механизм может рассеивать до 75% поглощенной световой энергии (Niyogi 1999).Растения увеличивают рассеяние энергии в виде тепла в ответ на дефицит Mg и K, чтобы защитить PS от повреждений и поддерживать фотосинтетические характеристики. У трех сортов Citrus , подверженных дефициту Mg (Tang et al. 2012, Yang et al. 2012), и двух сортов риса (Jia et al. 2008) и подсолнечника, подверженных дефициту K (Jákli et al. 2017), NPQ был увеличен. Напротив, у S. carnosa NPQ не подвергался влиянию, даже если Mg был исключен из питательного раствора (Farhat et al.2015). Поскольку Mg- и K-дефицитные растения обладают ограниченной способностью преобразовывать световую энергию в химическую энергию, высокая интенсивность света увеличивает образование NPQ, как показано в Mg-дефицитном P. radiata (Laing et al. 2000).
Фотодыхание
Помимо карбоксилирования, Rubisco катализирует оксигенацию RuBP, что приводит к фотодыханию. Фотодыхание считается важным фотозащитным механизмом, который может облегчить чрезмерное восстановление цепи переноса электронов и, таким образом, помогает предотвратить фотоингибирование и чрезмерное образование АФК (Lima Neto et al.2017). У хлопка реакция фотодыхания на дефицит K была специфичной для сорта и привела к увеличению фотодыхания у K-эффективных var. Liaomian18 и контрастное снижение фотодыхания у K-неэффективной вар. NuCOTN99 (Ван и др., 2012). Абсолютные значения фотодыхания также снизились у K-дефицитных листьев люцерны (Peoples, Koch, 1979). Интересно, что фотодыхание относительно увеличилось с 26 до 34% чистой ассимиляции, что указывает на сдвиг в специфичности карбоксилирования / оксигенации Rubisco.Прямое участие K в фотодыхании сомнительно, и изменения при дефиците K, скорее всего, являются результатом неспецифических фотозащитных реакций. Однако фотодыхание не реагировало на интенсивность света выше 400 мкмоль м 2 с -1 плотность потока фотосинтетических фотонов (PPFD) у K-дефицитных оливок, тогда как она увеличивалась с увеличением PPFD у достаточно снабженных растений (Erel et al. 2015 ).
Хлоропласт механизм
Светособирающие комплексы и ФС расположены в хлоропластах клеток мезофилла.Изменения в расположении и структуре хлоропластов влияют на сбор света и фотосинтез. Расположение хлоропластов в зависимости от интенсивности света было предложено Kasahara et al. (2002) в качестве фотозащитного средства, что было признано в обзоре Такахаши и Баджера (2011). При слабой интенсивности света хлоропласты накапливаются у клеточной стенки в вертикальном направлении к свету, чтобы эффективно поглощать слабый свет. При высокой интенсивности света хлоропласты располагаются на клеточных стенках параллельно свету, чтобы минимизировать поглощение избыточного света и максимизировать поглощение CO 2 из межклеточных воздушных пространств (Takahashi and Badger 2011).В листьях B. napus хлоропласты ответили на дефицит калия увеличением своего расстояния от клеточной стенки (Lu et al. 2016b). Обычно хлоропласты выделяются на поверхности клетки для поглощения CO 2 и света. Однако исследование Lu et al. (2016b) фокусируется на диффузионной проводимости CO 2 в мезофилле и не учитывает поглощение света. Тем не менее, он выявил измененную организацию хлоропластов при дефиците K, но необходимы дальнейшие исследования, чтобы описать этот эффект в отношении фотозащиты.То же самое относится и к Mg, где исследования движения хлоропластов в ответ на дефицит Mg полностью отсутствуют в настоящей литературе.
Движение листа
Парагелиотропное движение листьев — это механизм, с помощью которого предотвращается поглощение избыточного света и, как следствие, избыточное давление возбуждения на реакционные центры. У Robinia pseudoacacia парагелиотропное движение листьев привело к эффективному средству для снижения стресса из-за сильного света на ФСII (Arena et al.2008 г.). Уровень F v / F m , измеренный ближе к вечеру, был сопоставим с уровнем утром, тогда как в листьях, у которых ось была зафиксирована для предотвращения движения листьев и листочков, F v / F m был сокращен ближе к вечеру. Авторы предполагают, что отсутствие восстановления указывает на повреждение PSII, предполагая, что F v / F m является хорошим индикатором фотоингибирования (Arena et al. 2008). Точно так же у молодых листьев сои изменения угла черешка и средней жилки снижали интенсивность света на поверхности листа и помогали защитить листья от сильного излучения (Jiang et al.2006 г.). Было показано, что парагелиотропизм является стратегией защиты от фотоингибирования у культур фасоли, подверженной водному стрессу (Pastenes et al. 2004) и Vitis california (Gamon and Pearcy 1989). Мы наблюдали сильные гелиотропные движения листьев у подсолнечника, выращенного в условиях дефицита калия (неопубликованные данные). Мы предполагаем, что помимо вышеупомянутого воздействия движения листьев на микроклимат, парагелиотропизм может играть роль в защите листьев подсолнечника от чрезмерного света. Показателем является то, что участки листьев, демонстрирующие симптомы дефицита К, почти затенены от любого падения света.Однако у подсолнечника это явление, по-видимому, является K-специфическим, поскольку Mg-дефицитные растения не проявляли такого поведения. Насколько нам известно, исследований парагелиотропизма при дефиците калия и его вклада в фотозащиту не проводилось. Необходимо провести дальнейшие исследования, чтобы выяснить, является ли парагелиотропное движение листьев активной стратегией фотозащиты или это реакция на снижение тургора в условиях дефицита К. Если это активная стратегия при низкоклеточном статусе K + , движение листьев может быть предпочтительной стратегией, поскольку это управляемый тургором процесс и, следовательно, процесс, требующий K (Oosterhuis et al.2014), следовательно, ионы K + предпочтительно должны быть размещены в местах, где регулируется угол наклона листа.
Сводка
Mg и K прямо или косвенно участвуют во многих физиологических процессах, связанных с фотосинтезом (рис. 2). Снижение скорости чистой ассимиляции углерода наблюдается, когда какое-либо из питательных веществ не может быть поглощено растениями в достаточном количестве, а его концентрация в тканях листа падает ниже критического значения.Первичные эффекты дефицита калия, которые могут быть связаны со снижением фотосинтетической способности или ассимиляции CO 2 , включают (1) снижение синтеза белка и, следовательно, количества Rubisco, (2) анатомические изменения в структуре листа, снижающие проводимость мезофилла и, следовательно, концентрация хлоропласта CO 2 и (3) ультраструктура хлоропласта. Хотя K участвует в осморегуляции замыкающих клеток устьиц, дефицит K не препятствует функционированию устьиц и оптимизации эффективности фотосинтетического использования воды.Первичные эффекты дефицита Mg также включают синтез белка и Rubisco, а также ультраструктуру хлоропластов. В отличие от K, Mg непосредственно участвует в синтезе хлорофилла и активации Rubisco, но о влиянии дефицита Mg на анатомию листа или проводимость мезофилла не сообщается. И K, и Mg напрямую влияют на загрузку сахарозы во флоэме, а дефицит этих питательных веществ приводит к накоплению сахарозы в исходных тканях, вызывая дальнейшее подавление активности Rubisco. Фотозащитные механизмы реагируют на дефицит как калия, так и магния, с потенциалом снижения F v / F m и повышением NPQ, активности антиоксидантных ферментов и фотодыхания.Разнообразные эффекты анатомии, физиологии и биохимии растений на фотосинтез, транслокацию фотосинтата и фотозащиту в условиях дефицита K и Mg характеризуются сложными взаимодействиями и межрегулирующими механизмами, и многие вопросы все еще остаются нерешенными.
Вклад авторов
M.T. и Б.Дж. разработали, отредактировали и отформатировали рукопись в равных долях. M.T. написал разделы, связанные с дефицитом магния.E.T. написал разделы, связанные с АФК и антиоксидантами. Б.Дж. написал разделы, связанные с дефицитом К.
Благодарности
Мы благодарим Клауса Диттерта, Андреаса Гранзее и Исмаила Чакмака за их постоянную поддержку и творческий вклад в нашу научную работу. Мы благодарим дипл. Инж. агр. Хенрик Кирбаум из k1 mediendesign для индивидуальной разработки и производства графики.
Как калий попадает в клетки?
Сбалансированное калийное домашнее хозяйство имеет решающее значение для выживания как людей, так и бактерий.Поскольку бактерии подвержены гораздо большим колебаниям условий окружающей среды, контролируемое потребление калия часто представляет собой особую проблему. Поскольку клеточная мембрана непроницаема для ионов калия, она должна перемещаться через определенные мембранные транспортные белки.
С одной стороны, калиевые каналы обеспечивают быстрый, но пассивный приток ионов калия. Это прекращается, как только достигается электрохимическое равновесие между клеткой и окружающей средой.Чтобы достичь внутриклеточных концентраций сверх этого, калий активно транспортируется в клетку через калиевые насосы, при этом энергия расходуется в форме АТФ.
Поскольку оба семейства белков — каналы и насосы — выполняют очень разные функции, они всегда описывались как отдельные друг от друга. Этому, однако, противоречит наблюдение, что KdpFABC, высокоаффинная, активная система бактерий, поглощающая калий, не представляет собой простой насос, а состоит из четырех различных белков.Один из них является производным от обычного насоса, а другой похож на калиевый канал.
Инга Хенельт, доцент кафедры биохимии в Университете Гете, и ее коллега Кристина Паулино из Университета Гронингена, Нидерланды, поэтому решили поближе взглянуть на мембранный белок KdpFABC через микроскоп, или, точнее, криоэлектрон. микроскоп. Результат их удивил: «Все предыдущие гипотезы были ошибочными», — утверждает Инга Хенельт.«Несмотря на то, что перед нами были все данные, нам потребовалось время, чтобы понять, каким образом калий проходит через комплекс в клетку».
Во-первых, канальный белок связывает калий и транспортирует его через первый туннель к насосу. По прибытии первый туннель, обращенный наружу, закрывается, а второй туннель, обращенный внутрь, открывается. Этот туннель также проходит между обоими белками и в конечном итоге заканчивается внутри клетки. «Этот комплекс, по сути, сочетает в себе лучшие качества обоих семейств белков», — объясняет Шарлотт Сток, докторант исследовательской группы Инге Хэнельт.«Каналоподобный белок связывает калий, сначала очень специфично и с высоким сродством, в то время как помпа обеспечивает активный транспорт, который может обогатить калий в клетке в 10 000 раз».
Данные, недавно опубликованные в журнале Nature Communications , впечатлили ученых тем, насколько разнообразным может быть перенос через мембраны. «Мы узнали, что при исследовании различных белков мембранного транспорта мы не должны полагаться на кажущиеся неопровержимыми механизмы, но должны быть готовы к сюрпризам», — резюмирует Инга Хенельт.
###
Публикация: Charlott Stock, Lisa Hielkema, Igor Tascon, Dorith Wunnicke, Gert T. Oostergetel, Mikel Azkargorta, Cristina Paulino, Inga Hänelt, Крио-ЭМ структуры KdpFABC предполагают механизм транспорта K + через два межсубъединичных полуканала, в : Nature Communications , 10.1038 / s41467-018-07319-2
Изображение можно загрузить по адресу: http://www.uni-frankfurt.de/75137139
Подпись: Наружные и внутренние открывающиеся структуры KdpFABC в клеточной мембране.Предоставлено: исследовательская группа Инги Ханельт.
Дополнительная информация: д-р Инга Ханельт, Институт биохимии, факультет 14, кампус Ридберг, телефон: +49 69 798-29262, [email protected].
Текущие новости науки, образования и общества в GOETHE-UNI онлайн (http://www.aktuelles.uni-frankfurt.de)
Университет Гете — научно-исследовательский университет в европейском финансовом центре Франкфурта. Университет был основан в 1914 году за счет частных средств, в основном еврейских спонсоров, и с тех пор добился новаторских достижений в области социальных наук, социологии и экономики. медицина, квантовая физика, исследования мозга и трудовое право.1 января 2008 года он получил уникальный уровень автономии, вернувшись к своим историческим корням как «университет-основатель». Сегодня он входит в десятку лучших по внешнему финансированию и входит в тройку крупнейших университетов Германии с тремя кластерами передового опыта в области медицины, наук о жизни и гуманитарных наук. Вместе с Техническим университетом Дармштадта и Университетом Майнца он выступает в качестве партнера межгосударственного стратегического альянса Рейн-Майн университетов. Интернет: http: //www.uni-frankfurt.de
Издатель: президент Университета Гете Редактор: доктор Энн Харди, референт отдела научных коммуникаций, PR и коммуникаций, Теодор-В.-Адорно-Платц 1, 60323 Франкфурт-на-Майне, тел .: (069) 798-13035 , Факс: (069) 798-763 12531
Журнал
Nature Communications
Заявление об ограничении ответственности: AAAS и EurekAlert! не несут ответственности за точность выпусков новостей, размещенных на EurekAlert! участвующими учреждениями или для использования любой информации через систему EurekAlert.
7 Сульфат | Нормы потребления воды, калия, натрия, хлоридов и сульфатов с пищей
EPA. 2002b. Стандарты питьевой воды и рекомендации по охране здоровья 2002 г. . EPA 822 / R / 02/038. Вашингтон, округ Колумбия: Управление водных ресурсов, EPA.
Эстебан Э., Чемпион Рубина, МакГихин М.А., Фландрия В.Д., Бейкер М.Дж., Раковины TH. 1997. Оценка детской диареи, связанной с повышенным уровнем сульфатов в питьевой воде: исследование случай-контроль в Южной Дакоте. Int J Occup Environ Health 3: 171–176.
Поле CW. 1972. Сера: элемент и геохимия. В: Fairbridge RW, ed. Энциклопедия геохимии и наук об окружающей среде . Нью-Йорк: Ван Ностранд Рейнхольд. Стр. 1142–1148.
Флорин THJ, Гибсон Г.Р., Нил Дж., Каммингс Дж. Х. 1990. Роль сульфатредуцирующих бактерий при язвенном колите? Гастроэнтерология 98: A170.
Флорин Т., Нил Дж., Гибсон Г. Р., Кристл С. С., Каммингс Дж. Х.1991. Метаболизм диетического сульфата: абсорбция и выведение в организме человека. Кишечник 32: 766–773.
Флорин THJ, Нил Дж., Горецкий С., Каммингс Дж. Х. 1993. Содержание сульфатов в пищевых продуктах и напитках. J Food Comp Anal 6: 140–151.
Garcia RAG, Stipanuk MH. 1992. Внутренние органы, печень и почки играют уникальную роль в метаболизме серосодержащих аминокислот и их метаболитов у крыс. J Nutr 122: 1693–1701.
Gomez GG, Sandler RS, Seal E.1995. Высокий уровень неорганического сульфата вызывает диарею у новорожденных поросят. J Nutr 125: 2325–2332.
Gordon RS, Sizer IW. 1955. Способность сульфата натрия стимулировать рост цыплят. Наука 122: 1270–1271.
Greer FR, McCormick A, Loker J. 1986. Повышенная экскреция неорганического сульфата с мочой у недоношенных детей, которых кормили белком коровьего молока. J Pediatr 109: 692–697.
Hamadeh MJ, Hoffer LJ. 2001. Использование производства сульфатов в качестве меры краткосрочного катаболизма аминокислот серы у людей. Am J Physiol Endocrinol Metab 280: E857 – E866.
Health Canada. 2002. Краткое руководство по качеству питьевой воды в Канаде . Онлайн. Доступно на http://www.hc-sc.gc.ca/waterquality. Доступ 25 февраля 2003 г.
Heizer WD, Sandler RS, Seal E Jr, Murray SC, Busby MG, Schliebe BG, Pusek SN. 1997. Кишечные эффекты сульфата в питьевой воде на нормальных людей. Dig Dis Sci 42: 1055–1061.
Hoffer LJ.2002. Методы измерения метаболизма серных аминокислот. Curr Opin Clin Nutr Metab Care 5: 511–517.
Hoffer LJ, Kaplan LN, Hamadeh MJ, Grigoriu AC, Baron M. 2001. Сульфат может опосредовать терапевтический эффект сульфата глюкозамина. Метаболизм 50: 767–770.
Холмс JH, Миллер ES, Hlad CJJ. 1960. Изменения сульфата сыворотки и мочи при уремии. Trans Am Soc Artif Intern Organs 6: 163–175.
Hoppe B, Roth B, Bauerfeld C, Langman CB.1998. Концентрация оксалатов, цитратов и сульфатов в грудном молоке по сравнению с смесями: влияние на экскрецию анионов с мочой. J Pediatr Gastroenterol Nutr 27: 383–386.
Houterman S, van Faassen A, Ocke MC, Habets LHM, van Dieijen-Visser MP, Bueno-de-Mesquita BH, Janknegt RA. 1997. Является ли сульфат мочи биомаркером потребления животного белка и мяса? Cancer Lett 114: 295–296.
Ikem A, Odueyungbo S, Egiebor NO, Nyavor K.2002. Химическое качество бутилированной воды из трех городов восточной Алабамы. Sci Total Environ 285: 165–175.
IOM (Институт медицины). 2002/2005. Нормы потребления энергии, углеводов, клетчатки, жиров, жирных кислот, холестерина, белков и аминокислот с пищей . Вашингтон, округ Колумбия: The National Academies Press.
Что калий делает в вашем организме?
Вы, наверное, слышали, что бананы полезны, потому что в них есть калий.Но что такое калий и что он делает с вашим телом?
Что такое калий?Из класса естественных наук вы можете вспомнить калий из Периодической таблицы элементов с символом K и атомным номером 19. Калий, микроминерал, представляет собой серебристо-белый металл, который содержится во многих продуктах, помимо бананов. Это также электролит, минерал, который проводит электрические импульсы по всему телу и растворяется в жидкостях организма. Другие электролиты — это кальций, магний и фосфат.Электролиты помогают в нескольких важных функциях вашего тела. Работа почек — поддерживать необходимое количество калия в организме.
Что калий делает для вашего тела?Калий помогает вашему организму 6 способами.
- Помогает регулировать баланс жидкости — Тело на 60% состоит из воды, и 40% этой воды находится внутри клеток. Калий помогает сбалансировать жидкость внутри и снаружи клеток, чтобы поддерживать целостность клеток. Очень важно поддерживать правильный водный баланс, так как плохой водный баланс может привести к обезвоживанию и другим проблемам со здоровьем.
- Играет роль в нервной системе — Нервная система отвечает за передачу сообщений посредством импульсов между мозгом и телом. Эти импульсы помогают регулировать мышечные сокращения, рефлексы и другие функции.
- Поддерживает сердечный ритм — В связи с вышеизложенным, мышца с наибольшим сокращением — это ваше сердце, которое бьется примерно 100 000 раз в день! Калий необходим для поддержания стабильного и регулярного сердцебиения.
- Может поддерживать здоровье костей — Несколько небольших исследований показали, что богатая калием диета может поддерживать плотность костей за счет уменьшения количества кальция, который теряется с мочой.
- Перемещает питательные вещества в клетки и выводит продукты жизнедеятельности — Это важно для общего здоровья и хорошего самочувствия.
- Противодействует воздействию натрия , который влияет на артериальное давление
Менее 5% американцев соблюдают рекомендуемую суточную дозу 2300 мг!
Какие продукты содержат калий?Нет недостатка во вкусных продуктах, богатых калием, в том числе:
- Авокадо
- Бананы
- Говядина
- Свекла
- Брокколи
- Фасоль
- Канталупа
- Финики
- Рыба
- Орехи 908 908 Сладкие Орехи
- Апельсины 9090 Сладкие апельсины 9090 Апельсины 9090 Сладкие апельсины 9090
- Помидоры
- Индейка
- Белый картофель
- Ямс
Лучший способ получить нужное количество калия — это ежедневный рацион.Если необходима добавка, всегда сначала проконсультируйтесь с врачом. И затем обязательно поищите высококачественную добавку калия из проверенного источника.
Эти утверждения не были проверены Управлением по санитарному надзору за качеством пищевых продуктов и медикаментов. Эти продукты не предназначены для диагностики, лечения или предотвращения каких-либо заболеваний. Индивидуальные результаты могут отличаться.
Вот как бананы натощак влияют на наш организм
Есть определенные продукты, которые не рекомендуется есть натощак, в то время как другие рекомендуется есть натощак.Это случай банана . Этот фрукт имеет ряд преимуществ, таких как высокое содержание калия и клетчатки, которые повышают ценность рациона и здоровья нашего организма .
Мы должны помнить, что завтрак — это самый важный прием пищи в течение дня, поэтому здоровой диеты является ключом к энергии и благополучию, в которых нуждается наш организм.
Бананы — отличный источник магния и фосфора для нашего организма. Кроме того, он содержит витамины А и С, которые помогают предотвратить простуду и болезни.
На самом деле, многие диетологи отмечают, что банан — это фрукт, который не может отсутствовать в нашем рационе. Это также потому, что он служит для улучшения кишечного транзита. Так что, если у вас есть проблемы с посещением ванной комнаты, знайте, что этот фрукт может помочь.
Банан выполняет ряд функций, помогающих нашему организму:
- Детоксифицирует наш организм от внешних вредных агентов.
- Ускорить похудание
- Увеличение энергии
- Для восстановления состояния мышц после интенсивных тренировок.
- Улучшить иммунную систему
- Предотвратить начало болезни
Преимущества и недостатки бананов натощак
Далее мы собираемся открыть для нашего организма преимущества и недостатки приема бананов натощак.
Мы начинаем с положительной стороны, а это означает, что бананы улучшают пищеварительную систему и предотвращают запоры, как мы упоминали выше.
Кроме того, он укрепляет иммунную систему благодаря содержанию витаминов А и С.Банан — это фрукт с высокой питательной ценностью и низким содержанием калорий, так как он содержит всего 90 калорий на 100 граммов с 0% жира.
Великие источники калия
Банан — это фрукт, богатый калием, важным минералом для нашего организма. Калий отвечает за несколько действий в организме:
- Ответственный за сокращение мышц
- Уменьшает задержку жидкости
- Уравновешивает уровень сахара в крови
- Противодействует натрию
- Ответственный за воду в организме
Этот фрукт дает прилив энергии, что является ключевым моментом во время голодания, поскольку он позволяет нам быть жизненно важными с начала дня.Кроме того, при употреблении натощак он быстро попадает в желудок и тонкий кишечник. Это облегчает усвоение питательных веществ.
Наконец, бананов содержат триптофан , одну из незаменимых аминокислот для баланса серотонина. Он используется для снятия стресса, беспокойства, нервозности и бессонницы.
