Биологическая роль витамина B12
- Подробности
- 24.08.2015
Витамин B12 — кобальтсодержащее комплексное соединение. Он регулирует процесс кроветворения, процесс трансметилирования холина, метионина, креатина, нуклеиновых кислот и нуклеотидов, а также способствует накоплению в эритроцитах соединений, содержащих сульфгидрильные группы.
Витамин B12 оказывает метионинсберегающее действие и способствует повышению биологической ценности растительных рационов (способствует лучшему усвоению аминокислот растительных белков).
В присутствии витамина B12 улучшается биосинтез и использование аминокислот (особенно метионина), ускоряется включение их в белковую молекулу. Цианакобаламин оказывает липотропное действие, снижает содержание жира в печени и улучшает ее метилирующую функцию. Однако, при высоком содержании жира в рационе он не проявляет липотропного действия.
При обеспечении животных витамином B12 каротин лучше всасывается и исполь-зуется организмом.
Витамин B12 необходим для нормальной репродукции у свиноматок. Обеспеченность им предотвращает аборты, позволяет получать здоровых, хорошо развитых поросят.
Причины недостаточности
Недостаточность витамина B12 у животных чаще возникает из-за различных нарушений его всасывания и процесса усвоения. Для всасывания в кишечнике требуемых животным небольших физиологических доз витамина B12 необходим так называемый внутренний фактор или антианемический фактор, связанный с отсутствием в желудочном соке особого полисахарида. Он может проявляться по разным причинам, в частности, в результате приема животным больших доз витамина B12.
Он может проявляться по разным причинам, в частности, в результате приема животным больших доз витамина B12.
Помимо действия антианемического фактора, вызывающего признаки недостаточности витамина B12, его дефицит может возникнуть при скармливании птице только растительных кормов или, наоборот, при высоком уровне белка в рационе. Недостаточность витамина B12 может также возникнуть от его разрушения окислительными и восстановительными веществами, солями тяжелых металлов или от действия природных аналогов кобаламина, проявляющих к нему антагонистические действия.
Внешними признаками недостаточности витамина B12 являются: потеря аппетита, замедление роста и снижение привесов, худшее использование корма, особенно, белкового, повышенная возбудимость, поносы, ухудшение состояния оперения у птицы, воспаления слизистой оболочки мускульного желудка, перозис и анемия.
Основными физиологическими внутренними проявлениями недостаточности витамина B12, являются нарушения процессов кроветворения, приводящие к гиперхромной мегалобластичекой (пернациозной) анемии, нейротропении, тром-боцитонемии и изменению в спинном мозге. При дефиците витамина В12 накапливается метималоновая кислота, токсичная для нервной системы
При дефиците витамина В12 накапливается метималоновая кислота, токсичная для нервной системы
Препараты и другие источники
Синтез витамина B12 осуществляется исключительно простейшими организмами -бактериями и актиномецетами. Витамин B12 синтезируется в почве, навозе и помете птицы. У животных в толстом отделе кишечника также продуцируется витамин B12 микроорганизмами. Организмом животных поглощается только часть образовавшегося витамина B12, значительные его количества выделяются с их экскрементами.
Витамин B12 неустойчив в щелочных растворах: при РН 8,0 за 2-3 часа нагревания при 100°С он разрушается на 90% . Гидролиз разбавленными или слабыми кислотами также разрушает витаминB12. При гидролизе аскорбиновой кислотой цианокабаламин восстанавливается до неактивного продукта.
Контроль обеспеченности
Дефицит витамина B12 выявляется по его содержанию в крови и по выделению метилмалоновой кислоты с экскрементами. При нормальной обеспеченности животных витамином B12 он обнаруживается в определенном количестве в печени, селезенке, костном мозге, почках и коже.
Кобаламин (витамин В12) (Доклад) — TopRef.ru
Кобаламин (витамин В12)
Суточная потребность и основные источники поступления:
3мкг
Говядина, камбала, молоко, сардины,
сельдь, скумбрия, устрицы, яйца.
Злокачественная анемия (болезнь
Аддисона-Бирмера) оставалась смертельным
заболеванием до 1926г. когда впервые для
ее лечения применили сырую печень.
Поиски содержащегося в печени
антианемического фактора привело к
успеху, и в 1955 г. Дороти Ходжкин расшифровала
структуру этого витамина с помощью
рентгеноструктурного анализа.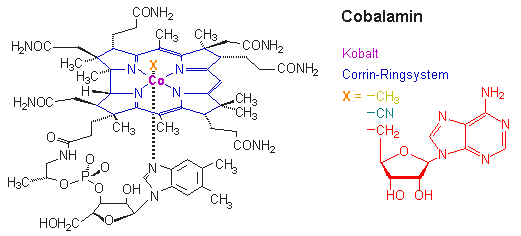
Функции:
Витамин В12 необходим для формирования кровяных телец, оболочки нервных клеток и различных белков. Он также участвует в метаболизме жиров и углеводов и важен для нормального роста. В число реакций, включающих метилкобаламин, входят биосинтез метионина, метана и ацетата. Есть свидетельства того, что витамин В12 требуется для синтеза фолатных полиглутаматов (активных коферментов, необходимых для формирования нервной ткани) и в регенерации фолиевой кислоты при формировании красных кровяных телец. Проявляется синергизм с фолиевой кислотой, А, В, В6, ниацином, биотином, пантотеновой кислотой
Преобразование и распределение:
во всех клетках
Клинические проявления и влияние на структуры организма.
Проявления недостаточности:
Мегалобластическая анемия, Невропатия,
Симптомы недостаточности выражаются
в слабости, утомляемости, возникновении
одышки при физических усилиях, покалывании
и онемении в конечностях (парестезии),
воспалении языка (глоссите), потере
аппетита и веса, потере чувства обоняния
и вкуса, импотенции, психических
расстройствах, выпадение волос.
Проявления избытка: аллергические реакции, нервное возбуждение, тахикардия, повышение свертываемости крови, нарушения со стороны красного кровяного ростка.
Список литературы
Для подготовки данной работы были использованы материалы с сайта http://medicinform.net/
Кольца, за которые держится жизнь – Наука – Коммерсантъ
Технологический прогресс, основанный на достижениях прежде всего физики — фундамент развития человеческой цивилизации. От открытия колеса к созданию паровых двигателей, двигателей внутреннего сгорания и автомобилей, от открытия электричества к созданию компьютеров, человечество шло по пути понимания и использования законов природы. Все эти открытия формировали этапы развития технологической цивилизации. Сейчас человечество находится на этапе, связанном с развитием нанотехнологий — способов управления материей на молекулярном уровне. Достижения в этой области определяют, в частности, и современный цифровой мир.
Технологическое развитие цивилизации основано, конечно, на успехах физических и инженерных наук, но не следует забывать, что за каждой новой технологией стоит химия как способ конструирования и изучения новых веществ и новых материалов. А многие из достижений химии основаны на исследованиях процессов, протекающих в живой природе, поэтому вдохновение, подчерпнутое у молекул жизни, может стать основой новых технологий.
Одно кольцо, чтобы править всеми
Белки, липиды и углеводы как строительные материалы и энергоносители клеток и живых тканей, а также нуклеиновые кислоты — хранители и переносчики генетической информации — это известные из школьных биологии и химии важнейшие классы органических молекул, на которых базируется функционирование всех живых существ.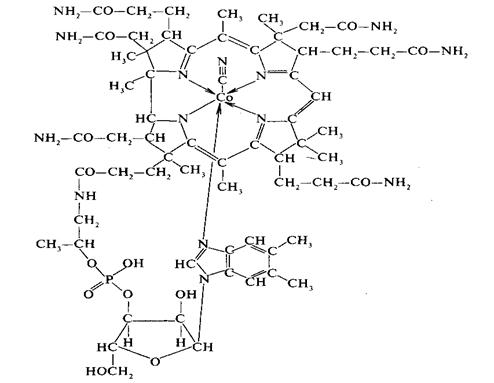 Однако перечень молекул жизни будет неполным без еще одного семейства веществ — порфиринов.
Однако перечень молекул жизни будет неполным без еще одного семейства веществ — порфиринов.
Само это слово, происходящее от греческого πορφυρα — пурпурный, не на слуху, хотя представители порфиринов также хорошо известны. Прежде всего, это содержащие магний зеленые пигменты растений — хлорофиллы, вещества, играющие одну из ключевых ролей в процессе фотосинтеза. Другой пример — содержащий железо красный пигмент крови — гем b. В составе белка гемоглобина гем переносит кислород, а в составе других белков — цитохромов — гем отвечает за важные процессы метаболизма. Содержащий кобальт витамин В12 действует как переносчик групп между молекулами органических веществ в биосинтезе, его недостаток в организме вызывает тяжелые анемические заболевания.
Общий структурный фрагмент всех этих соединений — это макрокольцо, состоящее из четырех пиррольных групп — собственно, порфирин, также называемый тетрапиррольным макроциклом, а в центре этого кольца располагается атом металла. В молекуле витамина B12 тетрапиррольное кольцо немного модифицировано, но тоже вполне узнаваемо. Несмотря на такое структурное родство, функции порфиринов в природе очень разнообразны, именно это разнообразие и стало источником вдохновения для химиков, использующих тетрапиррольную платформу для создания новых материалов и технологий.
Несмотря на такое структурное родство, функции порфиринов в природе очень разнообразны, именно это разнообразие и стало источником вдохновения для химиков, использующих тетрапиррольную платформу для создания новых материалов и технологий.
Непростое украшение
Создание материалов на основе тетрапирролов включает как синтез непосредственно макроциклов, так и получение комплексов, в том числе и с металлами, которые не нашли применения в живой природе — сейчас известны порфириновые комплексы практически со всеми металлами периодической таблицы, вплоть до радиоактивных трансурановых элементов. Некоторые из полученных химиками соединений представляют чисто фундаментальный интерес, но ряд веществ используется в уже существующих технологических процессах или может стать основой новых технологий. Среди таких соединений особое внимание привлекают синтетические аналоги порфиринов — фталоцианины.
Образование этих соединений как яркоокрашенных примесей в синтезе производных фталевой кислоты наблюдали различные исследователи, однако никто не придавал им внимания, пока сотрудники компании Scottish Dyes Ltd, занимавшейся получением пигментов, не разглядели в этих красивых темно-синих веществах коммерческий потенциал.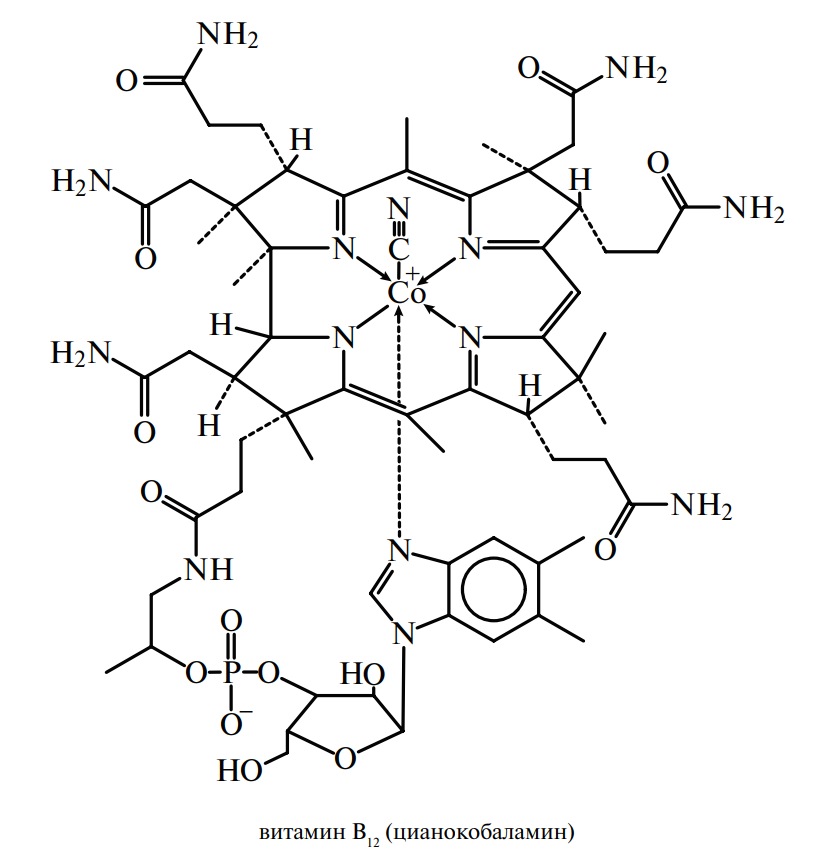 К 1928 году были разработаны методы получения, выделения и использования таких пигментов, и хотя их химическое строение оставалось неизвестным, эти технологические процессы были запатентованы. Но по-настоящему химия фталоцианинов начала развиваться лишь в 1934 году, когда ею занялся британский исследователь сэр Патрик Линстед, который установил их структуру и отметил ее удивительное сходство со строением природных порфиринов. Он же и предложил название этого нового класса соединений, соединив греческие корни ναφθα — нефть и κυανος — темно-синий.
К 1928 году были разработаны методы получения, выделения и использования таких пигментов, и хотя их химическое строение оставалось неизвестным, эти технологические процессы были запатентованы. Но по-настоящему химия фталоцианинов начала развиваться лишь в 1934 году, когда ею занялся британский исследователь сэр Патрик Линстед, который установил их структуру и отметил ее удивительное сходство со строением природных порфиринов. Он же и предложил название этого нового класса соединений, соединив греческие корни ναφθα — нефть и κυανος — темно-синий.
Фундаментальное свойство всех порфиринов и их производных, отраженное даже в их названиях — яркая окраска, именно это свойство определяет использование тетрапирролов в качестве светочувствительных компонентов в самых различных областях. Так, фталоцианины относятся к наиболее важным синим и зеленым пигментам для окрашивания текстиля, кожи, стройматериалов и т. п., а названия комплексов меди «фталоцианиновый синий» и «фталоцианиновый зеленый» закреплены за строго определенными цветами. По объемам ежегодного производства с фталоцианинами как с продуктами промышленного органического синтеза могут соперничать разве что полимеры.
По объемам ежегодного производства с фталоцианинами как с продуктами промышленного органического синтеза могут соперничать разве что полимеры.
Другие области применения тетрапирролов основаны на процессах, которые происходят после того, как молекулы вещества получат энергию от квантов света и перейдут в так называемое возбужденное состояние. Находясь в этом состоянии, молекулы могут отдавать электроны другим молекулам — акцепторам, и при определенных условиях движение электронов в таких системах становится привычным нам электрическим током. Это свойство роднит синтетические тетрапирролы с их природными предшественниками — хлорофиллами. Разница лишь в том, что при фотосинтезе энергия Солнца конвертируется в энергию химических связей, а синтетические порфирины используют в качестве компонентов солнечных батарей, использующих свет для получения электроэнергии.
Наконец, способность тетрапирролов переносить энергию возбуждения на другие молекулы лежит в основе применения этих соединений в качестве фотосенсибилизаторов в фотодинамической терапии — методе лечения, введенном в стандарты медицинской помощи при лечении ряда онкозаболеваний в России.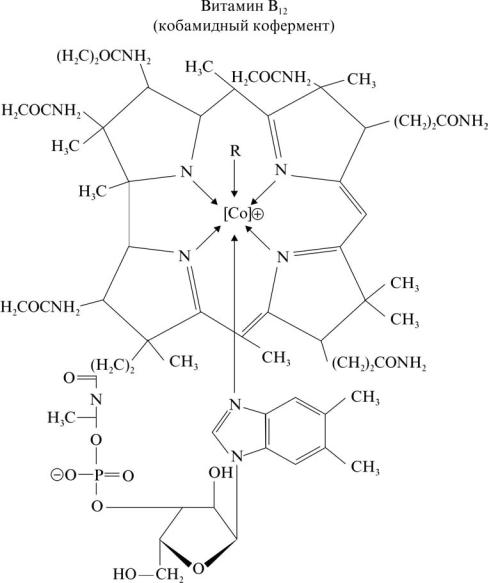 Принцип применения основан на том, что поглотившая свет молекула сенсибилизатора переносит приобретенную энергию на молекулу кислорода, переводя его в реакционноспособную форму — так называемый синглетный кислород. Некоторые тетрапирролы при введении в организм имеют склонность накапливаться в раковых клетках, поэтому облучение светом опухоли, накопившей такой фотосенсибилизатор, приводит к гибели раковых клеток из-за их повреждения синглетным кислородом. Следует отметить отечественные разработки в этой области — применяемые в клинической практике фотосенсибилизаторы порфиринового ряда, например, Фотодитазин и водорастворимый фталоцианинат алюминия — Фотосенс.
Принцип применения основан на том, что поглотившая свет молекула сенсибилизатора переносит приобретенную энергию на молекулу кислорода, переводя его в реакционноспособную форму — так называемый синглетный кислород. Некоторые тетрапирролы при введении в организм имеют склонность накапливаться в раковых клетках, поэтому облучение светом опухоли, накопившей такой фотосенсибилизатор, приводит к гибели раковых клеток из-за их повреждения синглетным кислородом. Следует отметить отечественные разработки в этой области — применяемые в клинической практике фотосенсибилизаторы порфиринового ряда, например, Фотодитазин и водорастворимый фталоцианинат алюминия — Фотосенс.
По аналогичному принципу возможно использование тетрапирролов для фотоинактивации патогенных микроорганизмов, в том числе и антибиотик-резистентных. В настоящее время эта актуальная тематика активно развивается во всем мире, в ИФХЭ РАН поиск новых эффективных фотосенсибилизаторов и изучение молекулярных механизмов их воздействия на патогенные микроорганизмы ведутся при поддержке Российского научного фонда под руководством члена-корреспондента РАН Юлии Горбуновой (грант №19-13-00410).
Наконец, порфирины и фталоцианины можно использовать для получения других веществ по аналогии с метаболическими процессами с участием гема и витамина B12. Одна из таких возможностей уже реализована в промышленном масштабе — фталоцианинат кобальта используют в мерокс-процессе — окислении кислородом серосодержащих соединений для их удаления из нефтепродуктов.
Когда сумма больше слагаемых
Наконец, тетрапирролы вполне могут стать основой технологий будущего. Чтобы понять, как это возможно, нужно снова вернуться к тому, как порфирины функционируют в природе. Можно заметить, что эти молекулы никогда не работают в одиночку. Так, гем в принципе способен переносить кислород и участвовать в окислении органических веществ, но он делает это гораздо эффективнее, когда связан с молекулами белка, образуя таким образом гемоглобин или цитохромы. Этот пример показывает, насколько шире могут стать возможности новых технологий, если перейти от самостоятельных тетрапирролов к гибридным материалам.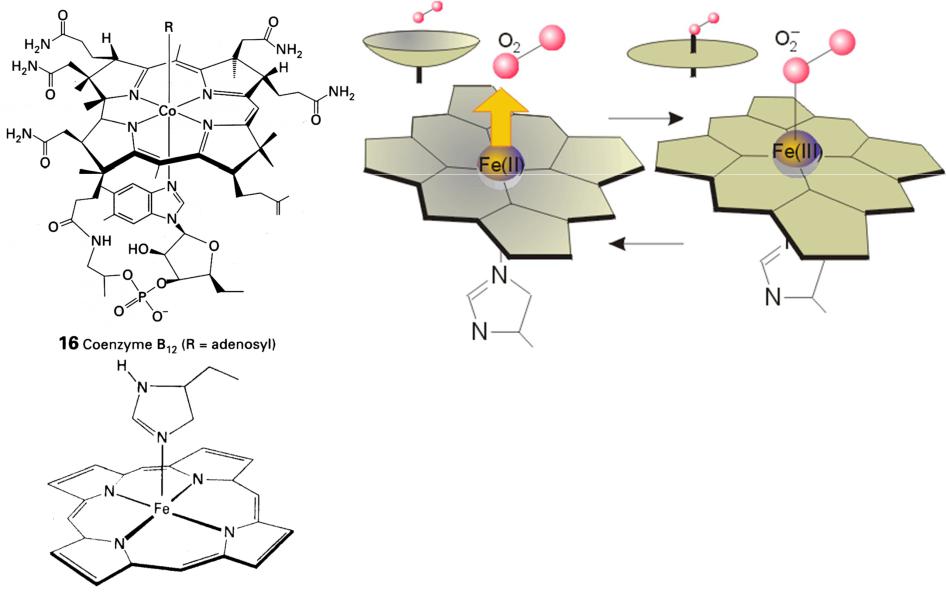 В них каждый из компонентов отвечает за свою функцию, но совокупный функционал гибридного материала — это больше, чем сумма отдельных функций. Например, связывание тетрапиррольных фотосенсибилизаторов с другими функциональными молекулами позволяет создавать так называемые тераностические агенты для одновременного проведения терапии и диагностики. Так, фотоактивные тетрапиррольные комплексы, связанные с магнитоконтрастными комплексами гадолиния или наночастицами, могут быть использованы для проведения фотодинамической терапии под контролем распределения вещества в организме с помощью метода магнитно-резонансной томографии — МРТ.
В них каждый из компонентов отвечает за свою функцию, но совокупный функционал гибридного материала — это больше, чем сумма отдельных функций. Например, связывание тетрапиррольных фотосенсибилизаторов с другими функциональными молекулами позволяет создавать так называемые тераностические агенты для одновременного проведения терапии и диагностики. Так, фотоактивные тетрапиррольные комплексы, связанные с магнитоконтрастными комплексами гадолиния или наночастицами, могут быть использованы для проведения фотодинамической терапии под контролем распределения вещества в организме с помощью метода магнитно-резонансной томографии — МРТ.
Взаимодействия, которые удерживают порфирины в сложных фото- и биосинтетических системах, подобны тем, что удерживают вместе спирали ДНК. Изучением этих слабых, но очень важных для биологии взаимодействий занимается один из самых молодых, но быстро развивающихся разделов современной химии — супрамолекулярная химия. Использование подходов этой химии к конструированию материалов на основе тетрапирролов позволяет создавать «умные материалы» — молекулярные переключатели, меняющие свои свойства под действием внешних факторов, таких как облучение, воздействие электрического тока или взаимодействие с другими веществами.
Так, на основе порфиринов и фталоцианинов создают высокочувствительные сенсорные системы, в которых эти соединения меняют цвет в присутствии солей тяжелых металлов, например, высокотоксичной ртути. Изменение оптических свойств комплексов под действием света может быть использовано для создания материалов для записи и хранения информации. С этой же целью активно исследуются соединения, проявляющие так называемый молекулярный магнетизм — способности отдельных молекул под действием магнитного поля приобретать намагниченность и сохранять ее продолжительное время. То есть такие элементы становятся отдельными элементами памяти, наименьшими из возможных! Одним из самых ярких достижений в этой области стало открытие молекулярного магнетизма у так называемого сэндвичевого, или двухпалубного комплекса, образованного именно фталоцианиновыми макроциклами. Кстати, впервые такие комплексы были получены советскими исследователями в 1960-х годах (И. С. Кириным и П. Н. Москалевым из Института ядерной физики им. Б. П. Константинова). А в настоящее время исследования молекулярного магнетизма активно развиваются в ИФХЭ РАН при поддержке Российского научного фонда в рамках гранта поддержки группы молодых исследователей под моим руководством (грант №18-73-10174).
Б. П. Константинова). А в настоящее время исследования молекулярного магнетизма активно развиваются в ИФХЭ РАН при поддержке Российского научного фонда в рамках гранта поддержки группы молодых исследователей под моим руководством (грант №18-73-10174).
А. Г. Мартынов, доктор химических наук, старший научный сотрудник лаборатории новых физико-химических проблем, Институт физической химии и электрохимии им. А. Н. Фрумкина Российской академии наук
Витамин B₁₂: кобаламин — Chemistry LibreTexts
Кобаламин, или витамин B 12 , является самым большим и сложным из всех типов витаминов. Кобаламин был открыт, когда ученые пытались найти лекарство от злокачественной анемии, анемического заболевания, вызванного отсутствием внутреннего фактора в желудке. Кобаламин был изучен, очищен и собран в маленькие красные кристаллы, а его кристаллическая структура была определена в ходе эксперимента по рентгеновскому анализу, проведенного ученым Ходкиным.Молекулярная структура кобаламина проста, но содержит множество различных разновидностей и комплексов, как показано на рисунке 1. Изучение молекулярной структуры витамина помогает ученым лучше понять, как организм использует витамин B 12 для создания красного цвета. клетки крови и профилактика синдромов злокачественной анемии.
Изучение молекулярной структуры витамина помогает ученым лучше понять, как организм использует витамин B 12 для создания красного цвета. клетки крови и профилактика синдромов злокачественной анемии.
Рисунок 1
Металлоферментная структура кобаламина представляет собой корриновое кольцо с кобальтом, единственным металлом в молекуле, расположенное прямо в центре структуры четырьмя координированными связями азота из четырех пиррольных групп.Эти четыре группы субъединиц равномерно разделены на одной плоскости, прямо напротив друг друга. Они также связаны друг с другом метиленовым звеном C-CH 3 на других сторонах, C-H на одной стороне и двумя непосредственно соединяющимися пирролами. Вместе они образуют идеальное корриновое кольцо, как показано на рисунке 2. Пятый лиганд, связанный с кобальтом, представляет собой азот, исходящий из 5,6-диметилбензимидазола. Он представляет собой осевую линию, идущую прямо вниз от кобальта прямо под корринговым кольцом. Этот бензимидазол также связан с пятиуглеродным сахаром, который в конечном итоге присоединяется к фосфатной группе, а затем связывается с остальной структурой. Поскольку ось растянута полностью вниз, связь между кобальтом и 5,6-диметилбензимидазолом является слабой и иногда может быть заменена родственными молекулами, такими как 5-гидрозилбензимидазол, аденин или любая другая подобная группа. В шестой позиции над кольцом Коррина активный центр кобальта может напрямую связываться с несколькими различными типами лигандов.Он может соединяться с CN с образованием цианокобаламина, с метильной группой с образованием метилкобаламина, с 5’-дезокси-аденозной группой с образованием аденозилкобаламина и OH, гидроксикобаламином. Кобальт всегда готов окислиться от изменения 1+ до 2+ и 3+, чтобы соответствовать этим R-группам, которые с ним связаны. Например, гидроксокобаламин содержит кобальт с зарядом 3 + , в то время как метиладенозил содержит кобальт с зарядом 1 + .
Этот бензимидазол также связан с пятиуглеродным сахаром, который в конечном итоге присоединяется к фосфатной группе, а затем связывается с остальной структурой. Поскольку ось растянута полностью вниз, связь между кобальтом и 5,6-диметилбензимидазолом является слабой и иногда может быть заменена родственными молекулами, такими как 5-гидрозилбензимидазол, аденин или любая другая подобная группа. В шестой позиции над кольцом Коррина активный центр кобальта может напрямую связываться с несколькими различными типами лигандов.Он может соединяться с CN с образованием цианокобаламина, с метильной группой с образованием метилкобаламина, с 5’-дезокси-аденозной группой с образованием аденозилкобаламина и OH, гидроксикобаламином. Кобальт всегда готов окислиться от изменения 1+ до 2+ и 3+, чтобы соответствовать этим R-группам, которые с ним связаны. Например, гидроксокобаламин содержит кобальт с зарядом 3 + , в то время как метиладенозил содержит кобальт с зарядом 1 + .
Рисунок 2
Конфигурация группы точек Кобаламина — C 4v . Чтобы определить эту симметрию, нужно увидеть, что конструкция способна повернуться четыре раза и в конечном итоге вернется в исходное положение. Кроме того, нет плоскости сигма h и перпендикуляра C 2 ax. Однако, поскольку существуют плоскости сигма v, которые разрезают молекулы на ровные части, ясно, что структура кобаламина представляет собой C 4v . Поскольку кобальт является центральным металлом молекулы, кобаламин имеет искаженную октаэдрическую конфигурацию.Осевая линия, соединяющая кобальт с 5,6-диметилбензимидазолом, протянута полностью вниз. Его расстояние в несколько раз больше, чем расстояние от Кобальта и прикрепленной к нему группы R. Иногда это также называют тетрагональной структурой. Вся форма в целом похожа на октаэдрическую, но две осевые группы различны и разделены на неравные расстояния. Поскольку в системе имеется только один металлоферментный центр, указанная точечная группа и конфигурация также относятся к структуре в целом.Поскольку структура металлокофермента растянута, она довольно слабо координирована и может быть разрушена или заменена другими группами, как указано выше.
Чтобы определить эту симметрию, нужно увидеть, что конструкция способна повернуться четыре раза и в конечном итоге вернется в исходное положение. Кроме того, нет плоскости сигма h и перпендикуляра C 2 ax. Однако, поскольку существуют плоскости сигма v, которые разрезают молекулы на ровные части, ясно, что структура кобаламина представляет собой C 4v . Поскольку кобальт является центральным металлом молекулы, кобаламин имеет искаженную октаэдрическую конфигурацию.Осевая линия, соединяющая кобальт с 5,6-диметилбензимидазолом, протянута полностью вниз. Его расстояние в несколько раз больше, чем расстояние от Кобальта и прикрепленной к нему группы R. Иногда это также называют тетрагональной структурой. Вся форма в целом похожа на октаэдрическую, но две осевые группы различны и разделены на неравные расстояния. Поскольку в системе имеется только один металлоферментный центр, указанная точечная группа и конфигурация также относятся к структуре в целом.Поскольку структура металлокофермента растянута, она довольно слабо координирована и может быть разрушена или заменена другими группами, как указано выше.
Ученые показали, что для определения структуры молекулы использовались как ИК-спектроскопия, так и спектроскопия комбинационного рассеяния. Это определяется путем наблюдения за таблицами характеров точечной группы C 4v , симметрии точечной группы кобаламина. На стороне IR можно увидеть, что есть такие группы, как drz, (x, y), (rz, ry). С другой стороны, на стороне Рамана есть такие группы, как x квадрат + y квадрат, z квадрат, x квадрат — y квадрат, xy, xz, yz.Рамановская сторона указывает на то, что в молекуле присутствуют режимы растяжения, и это относится к растяжению аксиальной оси 5,6-диметилбензимидазола, которая связана непосредственно под металлическим кобальтом. Растяжение показано на Рисунке 3.
Рисунок 3
Ферменты кобаламина могут катализировать несколько различных типов реакций. Одна из них — реакция внутримолекулярных перегруппировок. Во время этой перегруппировки кофермент обменивается на две группы, присоединенные к соседним атомам углерода.Другая реакция включает перенос метильной группы в определенных реакциях метилирования, таких как превращение гомоцистеина в метионин, биосинтез холина и тимина и т. Д. Эти взаимодействия могут принести пользу биологическим телам.
Кобаламин имеет множество положительных эффектов в отношении биологического существования. Они играют роль в поддержании здоровья системы организма и помогают в производстве генетического материала организма. Цианокобаламин, один из видов кобаламина, способствует образованию красных кровяных телец и лечит множество различных повреждений нервной системы.Кобаламин также играет жизненно важную роль в метаболизме жирных кислот, необходимых для поддержания миелина. Исследования показали, что у людей с дефицитом витамина B 12 обнаруживается нерегулярное разрушение миелиновой оболочки, что приводит к параличу и смерти. Некоторые из других симптомов нехватки кобаламина — замедленный рост, мегалобластический костный мозг, изменения желудочно-кишечного тракта, лейкопения и гиперсегментированные нутрофиллы, дегенеративные изменения спинного мозга и нервной системы и выделение метилмалоновой кислоты и гомоцистина с мочой.
На протяжении многих лет было доказано, что витамин B 12 необходим для функционирования нервной системы и производства красных кровяных телец. Исследование, проведенное учеными из Национального института здоровья Тринити-колледжа в Дублине, показало, что дефицит витамина B 12 может увеличить риск дефекта нервных трубок у детей (Миллер). Таким образом, изучая структуру и функцию кобаламина, ученые могут экспериментировать и получать витамин B 12 в своих лабораториях и служить обществу в целом.
Функциональная и структурная характеристика ABC-транспортера ECF-типа для витамина B12
Сравнительные исследования геномики идентифицировали широкий спектр семейств транспортеров ECF вместе с их предполагаемой субстратной специфичностью, опосредованной их S-компонентами (Rodionov et al., 2009). Основываясь на его генетической организации и отсутствии гомолога переносчика BtuCDF в геномах Lactobacillales , было предсказано, что CbrT является S-компонентом, специфичным для витамина B12 (Родионов и др., 2009). У L. delbrueckii , который, как было показано, является ауксотрофным по витамину B12 (Kusaka and Kitahara, 1962), CbrT встречается в кластере генов nrdJ – cbrS – cbrT – pduO . Эта генетическая организация строго подразумевает участие субстрат-связывающего белка CbrT в поглощении Cbl: во-первых, nrdJ аннотируется как зависимая от аденозилкобаламина рибонуклеотидредуктаза, требующая витамина в качестве кофактора. Во-вторых, PduO представляет собой аденозилтрансферазу Cbl, которая превращает Cbl в Ado-Cbl, делая его доступным для NrdJ.Мы показали, что ECF-CbrT не только транспортирует Cbl, но также опосредует поглощение Cbi (Рисунок 3a). Следовательно, ожидается, что L. delbrueckii будет обладать генетическим репертуаром для синтеза Cbl с использованием Cbi в качестве предшественника. Однако мы не смогли найти гомологов ферментов CobS, CobU и CobT, которые, как известно, превращают Cbi в кобаламин в E. coli (Lawrence and Roth, 1995). Возможно, другие белки могут функционально компенсировать их отсутствие, что было показано для тиаминкиназы YcfN, которая может заменять CobU в Salmonella typhimurium (Otte et al., 2007). Однако также возможно, что L. delbrueckii CbrT бесполезно связывает Cbi, и в этом случае Cbi будет транспортироваться, но не использоваться в качестве субстрата для какого-либо фермента. Наконец, предсказанные гомологи CbrT в Lactobacillales демонстрируют высокую степень идентичности последовательностей, варьирующуюся от 25% до 60% по сравнению с L. delbrueckii CbrT. Таким образом, мы предполагаем, что эти гомологи CbrT обладают одинаковой функцией и представляют собой субстрат-связывающие белки как для Cbl, так и для Cbi.
Наши результаты показывают, что ECF-CbrT — это новый транспортер витамина B12, который способен восстанавливать зависимый от Cbl и Cbi рост в E. coli ΔFEC (рис. 2c). Дальнейшая характеристика с использованием экспериментов по захвату с очищенным комплексом ECF-CbrT (рис. 3a) и исследования связывания на CbrT показывают, что переносчик является неразборчивым по отношению к β-лиганду Cbl, а также принимает Cbi в качестве субстрата (рис. 3b). Аналогичное поведение наблюдалось и для BtuCDF (Mireku et al., 2017).
Все три встречающихся в природе варианта Cbl, OH-Cbl, Ado-Cbl и Met-Cbl, ингибируют поглощение радиоактивно меченного циано-Cbl (рис. 3b).В то время как почти полное ингибирование наблюдалось при 250-кратном избытке OH-Cbl, CN-Cbl и Met-Cbl, Ado-Cbl ингибировал только до 25%. Это может быть связано с более объемным β-лигандом и, как следствие, стерическими затруднениями. Тем не менее, анализ показывает, что ECF-CbrT неразборчив в отношении β-аксиального лиганда витамина B12. Как правило, полиспецифичность к Cbl (и производным Cbl, см. Ниже) и Cbi, по-видимому, является неотъемлемой чертой белков, связывающих витамин B12, что характерно для BtuF, человеческих Cbl-носителей, а также CbrT (Fedosov et al., 1995; Mireku et al., 2017). У человеческих Cbl-носителей, которые обладают сходной неразборчивостью, сторона β-лиганда связанного субстрата частично экспонируется растворителем (Furger et al., 2013; Mathews et al., 2007; Wuerges et al., 2007). В CbrT более широкая субстратная специфичность может быть связана с гибкостью петель 1 и 3, которые являются воротами CbrT и могут контактировать с различными β-аксиальными лигандами.
В других ECF-транспортерах S-компоненты проявляют замечательное высокое сродство к своим соответствующим субстратам со значениями K d в низком наномолярном диапазоне (Slotboom, 2014).Измерения ITC с CbrT в отсутствие модуля ECF также показывают высокоаффинное связывание CN-Cbl, OH-Cbl, Met-Cbl и Cbi (рис. 4b, c и e). Немного более низкое сродство к Cbi (4-кратное), вероятно, связано с отсутствием α-иганда (Рисунок 1 — рисунок в приложении 1), что приводит к меньшему количеству возможных взаимодействий белок-субстрат.
Поразительно, константы аффинного связывания для CN-Cbl и Cbi находятся в том же диапазоне, что и соответствующие аффинности, определенные для BtuF (Cbl 9,1 нМ и Cbi 40 нМ) (Mireku et al., 2017), что может означать, что Cbl-транспортеры эволюционировали, чтобы приобретать субстраты с аналогичной эффективностью. Вместе с нашим определением V max и K M (Рисунок 3 — рисунок в приложении 1) мы дополнительно показываем, что этапом ограничения скорости является транслокация субстрата, что означает, что наблюдаемое сродство, вероятно, оптимизировано для эффективного субстрата. уборка мусора, за которым следует этап медленной транслокации. Человек-носитель достигает еще более высокого сродства к Cbl (в субпикомолярном диапазоне) (Fedosov et al., 1995), но в этих случаях скорость от практически равна нулю, и высвобождение субстрата требует протеолиза, который не является механизмом (ABC-) транспортеров.
Хотя уже давно было известно, что должно существовать множество не охарактеризованных систем захвата витамина B12 прокариотами, только комплекс BtuCDF был подробно охарактеризован. Это несколько удивительно, учитывая потенциальную значимость бактериального транспорта витамина B12 для фармацевтического применения.Например, учитывая рост устойчивости к антибиотикам и серьезную угрозу для здоровья населения (Alós, 2015), совершенно необходимо найти и охарактеризовать новые белковые мишени для разработки лекарств. Некоторые патогенные бактерии, такие как Streptoccoccus pyogenes и Clostridium tetani , несут ген cbrT , не имеют гомолога BtuCDF и являются Cbl-ауксотрофами, что делает их строго зависимыми от специальных переносчиков для удаления витамина B12 или его предшественников. из окружающей среды.Поскольку люди используют эндоцитоз для поглощения Cbl (Quadros, 2010), Cbl-специфические прокариотические переносчики являются потенциальными мишенями для лекарств для ауксотрофных патогенов витамина B12.
Витамин B12 или кобаламин | Подкаст
Бен Валслер
Сейчас январь. Новый год и новое начало — может быть, даже новый ты? Возможно, вы начали ходить в спортзал, взяли в руки музыкальный инструмент, к которому разучились, или решили почаще печь. И подобно тому пробному периоду скидок в тренажерном зале, многие люди используют это время обновления и самосовершенствования, чтобы попробовать изменить образ жизни.Набирает популярность сухой январь, когда люди на месяц отказываются от алкоголя — возможно, как противоядие от праздничных излишеств. И я, вместе с примерно 350 тысячами других людей, подписался на веганарианство — отказался от всех продуктов животного происхождения и перешел на веганскую диету в течение месяца.
Сказать людям, что вы соблюдаете веганскую диету, — отличный способ получить нежелательные — пусть и из лучших побуждений — советы по питанию, и наиболее частым комментарием было желание убедиться, что я получаю достаточно витамина B12. Это одно из очень немногих питательных веществ, необходимых для питания человека, которое вообще не производится растениями, поэтому веганам важно найти альтернативный источник.
Витамин B12 или кобаламин — это группа соединений, синтезируемых только некоторыми видами микроорганизмов. Есть несколько различных типов этого витамина, все с чрезвычайно сложной химической структурой, но общим для всех и определяющим их семейные отношения является кобальтовое ядро в центре гемоподобного кольца. Их биологические роли одинаково сложны: кобаламины играют роль ферментов и коферментов, помогая пищеварительной системе усваивать питательные вещества и способствуя выработке как красных кровяных телец, так и оболочек, обволакивающих наши нервы.
Таким образом, дефицит может привести к усталости, анемии, проблемам с пищеварением и неврологическим нарушениям — вы можете понять, почему мои друзья были обеспокоены. К счастью, человеческая печень очень эффективно обрабатывает витамин — она поглощает примерно половину B12, который мы потребляем, и накапливает достаточно, чтобы обеспечить нашу рекомендуемую суточную норму (RDA) в течение примерно трех-пяти лет. Если предположить, что в декабре у меня был хороший запас, то в этом месяце я определенно не должен видеть никаких симптомов.
Однако есть некоторые международные разногласия по поводу RDA.В Великобритании это 1,5 мкг / день. Но в США отмечают, что значительное количество будет выведено, прежде чем оно сможет абсорбироваться, и устанавливают дневное значение 6 мкг / день. Но употребление такого количества за один прием может привести к получению мочи, богатой питательными веществами, поскольку наша способность поглощать B12 ограничена белком, который называется внутренним фактором желудка или GIF.
Вырабатываемый в пищеварительной системе, GIF связывается с B12 и помогает ему попасть в кровоток. Нормальное производство GIF-изображений человека ограничивает наше потребление B12 примерно до 2 мкг за один прием пищи, поэтому, если вы не распределяете дозу на весь день, любые излишки просто выводятся из организма.Имея это в виду, дневная норма в США должна упасть до 2,4 мкг в 2020 году. Отсутствие этого внутреннего фактора — из-за генетических причин или такого заболевания, как злокачественная анемия — может привести к дефициту B12, даже если в вашем рационе много.
Плотоядные животные, теоретически, получают B12 из продуктов животного происхождения. Основным источником является печень и мясо внутренних органов, меньшее количество которого содержится в мышечной ткани, яйцах и молочных продуктах. Порция говяжьей печени в 85 г может содержать 70 мкг B12 (помните, что рекомендуемая суточная норма потребления в Великобритании всего 1.5 мкг), но такое же количество куриной грудки содержит всего 0,3 мкг. Молочные продукты немного лучше — примерно 1,2 мкг на стакан молока, а некоторые морепродукты — даже больше: моллюски содержат даже больше, чем говяжья печень.
Конечно, это зависит от того, что животное имеет достаточный контакт с бактериями, которые продуцируют B12 — животным, интенсивно выращиваемым на фермах, которые едят обработанный корм и лечатся антибиотиками, на самом деле нужно давать такие же добавки B12, которые рекомендуется принимать веганам.Мясо может не быть ответом в этом случае, поскольку исследование Framlingham Offspring, долгосрочный исследовательский проект, основанный на жителях Фрамлингема, штат Массачусетс, показал, что добавки B12, обогащенные злаки и молоко играют более значительную роль.
Так откуда же веганам взять B12? Многие злаки уже обогащены, и добавки легко доступны. Самым популярным предложением являются пищевые дрожжи — сушеные деактивированные дрожжи, которые придают продуктам ореховый и сырный вкус.Он содержит полноценный белок, что означает, что он содержит все незаменимые аминокислоты, которые человеческий организм не может производить, и богат другими витаминами группы B, поэтому является стоящим дополнением к любой диете. Но пищевые дрожжи, или нуч, на самом деле должны быть обогащены B12 — дрожжи не входят в число избранных микроорганизмов, которые производят B12 естественным путем.
Буду ли я придерживаться веганской диеты после января? Я не уверен. Но я, безусловно, буду лучше осведомлен о том, откуда берется мой B12, и у меня будет несколько полезных советов по диете, которые я не запрашивал, для всех, кто скажет мне, что они рассматривают веганскую диету.
На следующей неделе мы исследуем еще одно соединение кобальта, которое вы, возможно, бессознательно использовали в праздничный период, если выпили стакан хереса.
Майк Фримантл
Например, хересHarveys Bristol Cream продается в бутылках из бристольского синего стекла с 1990-х годов. Студенты-химики могут вспомнить, как использовали кобальтово-синее стекло в тестах на пламя, чтобы отфильтровать ярко-желтый свет натриевого пламени.
Бен Валслер
Присоединяйтесь к Майку Фримэнтлу на следующей неделе с оксидом кобальта.А пока дайте мне знать, есть ли какие-либо соединения, которые вы хотели бы, чтобы мы рассмотрели, — напишите по адресу [email protected] или напишите в Твиттере @chemistryworld.
Вы можете найти все наши предыдущие подкасты и быть в курсе последних новостей химии на сайте chemistryworld.com. Спасибо за внимание!
Коэнзим витамина B12 и его модельные соединения
Витамин B12 или цианокобаламин впервые был выделен как фактор, препятствующий пагубной анемии. Он давно восхищает химиков своей уникальной сложной структурой и разнообразной каталитической активностью.Витамин B12 является биологически неактивным, и его активные формы известны как коферменты или кофакторы B12, которые играют важную роль в основных ферментативных реакциях, связанных с синтезом нуклеиновых кислот, белков и липидов. Витамин B12 вырабатывается микроорганизмами (бактериями / грибами), и это единственный витамин, содержащий металл (кобальт). Растения не производят и не содержат витамин B12, а его источники пищи включают яйца, мясо, рыбу, молоко и другие молочные продукты.
Ленхерт и Кроуфут-Ходжкин в 1961 году обнаружили, что кофермент B12 содержит аденозильную группу, связанную с центром кобальта прямой связью CCo, что впервые указывает на наличие связи металл-углерод в биологических системах (рис. .1). Связь CoC в коферменте B12 считается одной из самых стабильных σ-органокобальтовых связей, о которых когда-либо сообщалось. Было замечено, что система макроциклических лигандов в витамине B12 на самом деле влияет и значительно изменяет свойства кобальта, позволяя ему образовывать высокостабильную связь Co – C. Кроуфут-Ходжкин был награжден Нобелевской премией по химии (1964) за определение сложной твердотельной структуры витамина B12 (наряду со структурами других молекул, имеющих биологическое значение, таких как пенициллин и холестерин) с помощью дифракции рентгеновских лучей. спектроскопия.
Рисунок 1: Коэнзим B12
Известные коферменты / кофакторы B12 представляют собой алкилкобаламины (RCbl), состоящие из кобальтового комплекса тетрапиррольного макроциклического лиганда (корриновое кольцо) с боковым нуклеотидом (внутримолекулярно связанным 5,6-диметилбензимидазолом), который занимает пять координационных центров октаэдрический Co (III), а шестую позицию занимают разные группы R в разных кофакторах, метилкобаламин (MeCbl, R = Ch4) и кофермент B12 (5′-дезоксиаденозилкобаламин, AdoCbl, R = 5′-дезоксиаденозил).В витамине B12 шестую позицию занимает лиганд CN (цианокобаламин, CNCbl, R = CN) и это биологически неактивный вид. Кольцевая система коррина в коферментах витамина B12 является примерно плоской, и короткие боковые цепи (ацетамид) проходят над плоскостью кольца коррина, в то время как длинные боковые цепи (пропионамид) проходят ниже плоскости кольца. С химической точки зрения алкилкобаламины являются стабильными и кислотоустойчивыми, но термо- и фотолабильными органокобальтовыми комплексами. Коферменты витамина B12 проявляют высокую реактивность только в присутствии соответствующих апоферментов, и их скорость лабилизации связи Co – C может быть увеличена в 1013 раз, это указывает на то, что конформационные изменения белка играют важную роль в стабильности и реактивности связи Co – C.
Все известные реакции B12-зависимых ферментов включают образование и разрыв связи Co – C. Различные способы расщепления σ-связей CoC были постулированы для двух коферментов витамина B12, AdoCbl и MeCbl. Ферменты, содержащие кофермент аденозилкобаламина (AdoCbl), требуют гомолитического расщепления связи Co – C, что приводит к образованию cob (II) аламина и 5′-дезоксиаденозильного радикала, например ферментов изомеразы и мутазы, которые катализируют внутримолекулярный 1,2-сдвиг атом водорода и электроотрицательная группа.
Рисунок 2: Реакция, катализируемая AdoCbl
Метилкобаламин (MeCbl) является кофактором ферментов метилтрансферазы, которые требуют гетеролитического расщепления связи Co – C, оставляя оба электрона на кобальте, что приводит к образованию метилкарбокатиона и Co (I) аламина. Эти ферменты участвуют в реакциях переноса метила, например метионинсинтаза. (Рис. 3).
Рисунок 3: Реакция, катализируемая MeCbl
Модели коферментов с витамином B12
После пионерской работы Ходжкина было сообщено о большом количестве кобальтовых соединений, и некоторые из этих соединений были предложены в качестве моделей витамина B12.G. N. Schrauzer и Kohnle в 1964 году сообщили, что реакцию кофермента B12 можно моделировать с помощью гораздо более простых комплексов Co (III) с моноанионным диметилглиоксимом (dmgH), группой R и B. (рис. 4).
Рисунок 4: Кобалоксим
Здесь R представляет собой органическую группу, σ-связанную с кобальтом, например, алкилы, и B представляет собой нейтральный лиганд аксиального основания, транс к связи Co – C, например, пиридин, h3O и т. Д. Эти соединения были названы «кобалоксимами». чтобы подчеркнуть их сходство с кобаламинами. Многочисленные кобалоксимы с различными экваториальными диоксимами и аксиальными лигандами (R и B) были синтезированы для изучения влияния стерической и электронной природы лигандов на стабильность связи Co – C.Кроме того, многие другие аналоги витамина B12 были синтезированы с различными лигандами типа основания Шиффа, например, BAE и SALEN (рис. 5a и 5b). О комплексах типа [RCoIII ((DO) (DOH) pn) B] + (фиг. 5c) с моноанионным тетрадентатным лигандом сообщалось Costa et al. Комплексы кобальта с порфиринами и тетрааза-макроциклическими лигандами (1,4,8,11-тетраазациклотетрадекан) (рис. 5г) также были изучены в качестве модельных соединений B12.
Рисунок 5
Кобалоксим как лучшая модель кофермента B12
Хотя сообщается о многих модельных соединениях, было замечено, что простые кобалоксимы более точно моделируют реакции коферментов витамина B12.Экваториальные диоксимы моделируют корринговое кольцо коферментов B12, а имеющиеся кристаллографические данные по кобаламинам позволяют предположить, что структурные эффекты изменения аксиальной группы R аналогичны эффектам, обнаруженным в кобалоксимах. Теоретические расчеты также показали близкое сходство между кобаламином и кобалоксимами. При двухэлектронном восстановлении кобалоксима [ClCo (dmgH) 2py] образуется Co (I) в качестве супернуклеофила, который после реакции с Ch4I дает [Ch4Co (dmgH) 2py]. Эта реакция очень похожа на химию кофермента B12.Кроме того, исследования эффектов, налагаемых экваториальными диоксимами и осевым основанием на свойства связи Co – C, дают представление о гомолизе и гетеролизном расщеплении связи Co¬ – C в коферментах B12. Помимо этого, кобалоксимы можно легко синтезировать одностадийным алкилированием Со (I), полученного in situ из легкодоступных и недорогих исходных материалов (диметилглиоксима и пиридина), тогда как для большинства других хелатных систем требуется синтез лиганда с последующим комплексообразование металлов.
В алкилкобалоксим легко включить лиганды с различными свойствами, и это не может быть так легко введено в другие модельные системы. Что еще более важно, кобалоксимы являются идеальной системой для определения структуры с помощью ЯМР-спектроскопии. Все эти преимущества привели к обширному изучению свойств кобалоксимов, имитирующих характеристики коферментов B12. Однако недавние исследования кобалоксимов показали, что они перестали быть актуальными в качестве модели B12.Они приобрели независимую область исследований из-за их богатого химического состава и универсального применения в качестве прекурсоров в органическом синтезе и в качестве катализаторов в различных реакциях органического превращения, включая реакции полимеризации.
Артикул:
- Википедия и другие интернет-источники.
- Введение в витамин B12: Ссылка
- Нобелевская премия по химии 1964 г. Ссылка
- Г. Н. Шраузер, Органокобальтовая химия модельных соединений витамина B12 (кобалоксимов), Acc.Chem. Res.1968, 1497-103
- a и в модельных соединениях витамина B12, Angew. Chem. 1976, 15 (7), 417-426
- К. Х. Редди, Координационные соединения в биологии, Резонанс, июнь 1999 г. Ссылка
- Синтез производных кобалоксима: Ссылка
Структура бета-домена транскобаламина человека в четырех различных состояниях
Abstract
Витамин B12 (цианокобаламин, CNCbl) является важным кофактором-предшественником двух биохимических реакций у человека.При проглатывании кобаламины (Cbl) транспортируются через многоступенчатую транспортную систему в кровоток, где растворимый белок транскобаламин (TC) связывает Cbl, и комплекс попадает в клетки через рецептор-опосредованный эндоцитоз. Кристаллические структуры ТК в комплексе с CNCbl решены ранее. Однако первые шаги сборки голо-ТС остались неуловимыми. Здесь мы представляем четыре кристаллические структуры бета-домена человеческого TC (TC-beta) в различных состояниях, связанных с субстратом.К ним относятся состояния, связанные с apo и CNCbl, что дает представление о ранних этапах сборки holo-TC. Мы обнаружили, что in vitro сборка TC-альфа и TC-бета в комплекс была Cbl-зависимой. Мы также определили структуру TC-бета в комплексе с кобинамидом (Cbi), альтернативным субстратом, проливая свет на специфичность TC. Мы наконец определили структуру TC-бета в комплексе с ингибирующим антивитамином B12 (анти-B12). Мы использовали эту структуру для моделирования связывания анти-B12 с полноразмерным голо-TC и могли исключить, что ингибирующая функция анти-B12 была основана на неспособности образовывать функциональный комплекс с TC.
Образец цитирования: Bloch JS, Ruetz M, Kräutler B, Locher KP (2017) Структура бета-домена транскобаламина человека в четырех различных состояниях. PLoS ONE 12 (9): e0184932. https://doi.org/10.1371/journal.pone.0184932
Редактор: Пермяков Евгений Александрович, РАМН, РОССИЙСКАЯ ФЕДЕРАЦИЯ
Поступила: 23 июня 2017 г .; Принята к печати: 2 сентября 2017 г .; Опубликован: 14 сентября 2017 г.
Авторские права: © 2017 Bloch et al.Это статья в открытом доступе, распространяемая в соответствии с условиями лицензии Creative Commons Attribution License, которая разрешает неограниченное использование, распространение и воспроизведение на любом носителе при условии указания автора и источника.
Доступность данных: Все кристаллические структуры будут доступны для загрузки в PDB (http://www.rcsb.org/pdb/home/home.do) под следующими кодами доступа: 5NO0 (apo TC-beta) , 5NP4 (связанный с CNCbl TC-бета), 5NRP (связанный с Cbi TC-бета), 5NSA (связанный с F2PhEtyCbl TC-бета).
Финансирование: Финансирование предоставлено SNF 310030B_166672 для K.P.L., http://www.snf.ch/en/Pages/default.aspx. Спонсор не имел никакого отношения к дизайну исследования, сбору и анализу данных, принятию решения о публикации или подготовке рукописи.
Конкурирующие интересы: Авторы заявили об отсутствии конкурирующих интересов.
Введение
Витамин B12 (цианокобаламин, CNCbl) необходим для человека, так как по крайней мере два биохимических пути зависят от B12 [1–4]: он является предшественником кофермента цитоплазматической метионинсинтазы и митохондриальной метилмалонил-КоА мутазы.Поскольку только некоторые прокариоты способны синтезировать кобаламины (Cbls), люди зависят от потребления витамина B12 с пищей [5]. При попадании внутрь водорастворимый витамин транспортируется через многоступенчатую транспортную систему через подвздошную кишку в кровоток [6]. Там 10–30% общих Cbls связаны с транскобаламином (TC). Остальные аналоги Cbl и Cbl связаны с гаптокоррином (HC) [7]. Несмотря на более высокое сродство к Cbls [8], HC имеет более низкую субстратную специфичность, чем TC, и способен связывать различные аналоги Cbl с аналогичным сродством [9].Поглощение Cbls клетками происходит через рецептор-опосредованный эндоцитоз голо-ТС с помощью рецептора CD320 [10]. Недавно была определена структура внеклеточного домена CD320 в комплексе с голо-ТС [11]. Раковые клетки, испытывая повышенную потребность в Cbls, сверхэкспрессируют белок CD320 [12]. Это делает TC: CD320-опосредованное поглощение Cbls интересной целью для онкологических исследований. TC состоит из двух доменов (альфа и бета), соединенных гибким линкером. Оба домена вносят вклад в связывание Cbl, что приводит к субпикомолярному сродству (Рис. 1A) [8, 13].Было высказано предположение, что два домена собираются только при связывании Cbls с любым из двух доменов (Рис. 1B) [13, 14].
Рис. 1. Cbl индуцировал сборку индивидуально экспрессируемых доменов TC.
(A) Запись PDB 4ZRP, holo-TC с альфа-доменом (синий) и бета-доменом (голубой) в мультипликационном изображении и CNCbl в изображении палочек (углеродный лосось) (рецептор CD320 не показан). Конструкция TC-beta, используемая в этом исследовании, начинается с Q307 и содержит дополнительные N-концевые остатки из сайта расщепления TEV.(B) Гипотетические стадии сборки TC-альфа, TC-бета при добавлении Cbl, зеленые прямоугольники указывают на новые, красные прямоугольники, ранее опубликованные кристаллические структуры. (C) Кумасси окрашенный SDS-PAGE анализ очистки TC-бета. (D) Профиль SEC (эксклюзионной хроматографии) (колонка TSK-G3000) смеси TC-alpha: CD320, TC-beta в присутствии (красный) или отсутствии (черный) CNCbl в соотношении 1: 4: 16 (TC-альфа: TC-beta: CNCbl). (E) Окрашенный серебром SDS-PAGE пик фракций из SEC.
https: // doi.org / 10.1371 / journal.pone.0184932.g001
Чтобы ответить на вопрос о том, как происходит сборка TC, опосредованная Cbl, мы определили кристаллические структуры апо TC-beta и TC-beta в комплексе с Cbl, предположительно представляя первые шаги TC. сборка. Кроме того, мы определили структуру TC-beta в комплексе с аналогом субстрата Cbi.
Антивитамины B12 представляют собой модифицированные Cbls, которые структурно подобны CNCbl, причем β-аксиальный лиганд заменен инертными лигандами, такими как дифторфенилэтинил (S1 Fig) [15-17].При введении мышам анти-B12 соединение 4-этилфенил-кобаламин (EtPhCbl) вызывало выраженный дефицит Cbl [18]. Таким образом, использование молекул анти-B12 обеспечивает более эффективный подход к изучению эффектов дефицита Cbl, чем кормление лабораторных животных питанием без Cbl, поскольку последнее зависит от медленного истощения запасов Cbl в печени [19]. Повышенные уровни Cbl в крови мышей, которым вводили EtPhCbl, предполагают вмешательство в клеточный захват Cbls.Молекулярная основа этой интерференции неизвестна, поскольку было продемонстрировано, что анти-B12 может связываться с TC и попадать в клетки [18]. Чтобы проверить, влияет ли анти-B12 на поглощение Cbl через его взаимодействие с TC, мы определили сокристаллическую структуру TC-бета, связанного с Co-β- [2- (2,4-дифторфенил) этинил] кобаламином (F2PhEtyCbl) при высоких разрешающая способность.
Результаты
Экспрессия человеческого TC-бета и Cbl-зависимая сборка holo-TC
Субпикомолярное сродство TC к Cbl [6, 20] и присутствие Cbls в эукариотической экспрессионной среде затрудняло получение апо TC без денатурирования белка.Мы экспрессировали два домена TC по отдельности в клетках насекомых, что снизило сродство к Cbls при сохранении структурной целостности доменов, поскольку не требовалось денатурации для создания доменов, свободных от Cbl. TC-бета экспрессировался как белок слияния с белком, связывающим мальтозу (MBP). Для полного удаления всех связанных Cbl требовалось тщательное промывание иммобилизованного слитого белка. После протеолитического расщепления MBP и дальнейшей аффинной очистки мы получили чистый, свободный от субстрата TC-бета (рис. 1C).ТС-альфа коэкспрессировался с растворимыми / внешними доменами CD320, так как это увеличивало стабильность и выход чистого белка. TC-альфа: CD320 не содержал связанных CbI после очистки, о чем свидетельствует отсутствие пика при 361 нм в видимом спектре.
В полноразмерном TC альфа- и бета-домены связаны гибким линкером. В структуре TC, связанных с CNCbl, альфа- и бета-домены имеют очень маленький интерфейс связывания [13]. Поэтому мы хотели проверить гипотезу, что два домена будут собираться только при связывании Cbl (Рис. 1B).Подобная зависимость наблюдалась ранее с альфа- и бета-доменами структурно подобного внутреннего фактора белка [21].
Мы инкубировали TC-beta с TC-alpha: CD320 в присутствии или в отсутствие CNCbl. Последующая эксклюзионная хроматография и SDS-PAGE анализ пиковых фракций показали, что TC-бета и TC-альфа: CD320 совместно элюируются только при наличии CNCbl (фиг. 1D и 1E). Напротив, домены оставались разделенными, когда не было добавлено CNCbl.
Кристаллические структуры TC-beta в апо- и CNCbl-связанной форме
Сначала мы определили кристаллическую структуру TC-beta, связанную с CNCbl, на 1.Разрешение 43 Å (рис. 2А, таблица 1). Он выявил очень похожую структуру по сравнению с бета-доменом в полноразмерном голо-TC [11] (rmsd = 0,39 Å для 97 C α -атомов, Таблица 2). Однако мы наблюдали, что CNCbl был повернут из кармана для связывания на 9,2 ° по сравнению с holo-TC (рис. 3A). Как следствие, не все водородные связи, наблюдаемые в TC, связанных с CNCbl, образовывались. Например, Н-связь от фосфата к основной цепи L358 отсутствовала в структуре TC-beta, связанной с CNCbl.
Рис 2.Кристаллические структуры TC-бета связаны с различными субстратами и в апо-форме.
Кристаллические структуры TC-beta в четырех различных конформациях, таких как TC-beta, связанный с CNCbl (A), апо TC-beta (B), Cbi-связанный TC-beta (C) и связанный с B12 TC-beta (D). Все 3 лиганда связываются в одном и том же сайте TC-beta примерно в одинаковой ориентации. В структуре связанного с Cbi TC-бета дополнительный Cbi связан с поверхностью TC-бета.
https://doi.org/10.1371/journal.pone.0184932.g002
Рис. 3. Сравнение позиционирования лиганда в связанном с CNCbl TC-beta и полноразмерном TC.
(A) Наложенные структуры Cbl-связанного TC: CD320 (вход PDB 4ZRP, альфа-домен синий, бета-домен голубой, CNCbl оранжевый, CD320 не показан), CNCbl-связанный TC-бета (зеленый, показан только Cbl) и связанный с анти-B12 TC-бета (розовый, показаны только анти-B12). В отсутствие TC-alpha, CNCbl и anti-B12 поворачиваются примерно на 10 ° (обозначено красными пунктирными линиями). (B, C) Сравнение структур TC-beta, связанного с CNCbl (B) (голубой, зеленый) и связанного с B12 TC-beta (C) (голубой, розовый), с выделенными полярными контактами кристаллов (пунктирные красные линии ) для CNCbl и anti-B12 (симметрия оранжевого цвета).
https://doi.org/10.1371/journal.pone.0184932.g003
Затем мы определили кристаллическую структуру апо TC-бета с разрешением 1,57 Å (рис. 2B, таблица 1), которая, насколько нам известно, представляет собой первую структуру ТС напоминает предполагаемое частичное апо-состояние ТС в апо-форме (т.е. ТС-альфа и ТС-бета не связаны друг с другом). Структура очень похожа на связанное с Cbl состояние TC-бета (среднеквадратичное значение = 0,41 Å для 97 C α -атомов, таблица 2), с незначительными изменениями, очевидными в нескольких боковых цепях по сравнению с TC-бета, связанным с CNCbl.
Кристаллическая структура Cbi-связанного TC-beta
Совместная кристаллизация TC-beta с Cbi дала кристаллы, дифрагирующие с разрешением 1,57 Å (рис. 2C, таблица 1). Используемое соединение представляло собой дициано-Cbi, который при растворении в воде превращается в стабильный моноциано-Co (III) кобинамид. К нашему удивлению, в структуре обнаружены две связанные молекулы Cbi (Cbi1 и Cbi2). Cbi1 располагался в связывающем кармане, был связан таким же образом, как CNCbl в holo-TC. Примечательно, что корринговое кольцо / плоскость Cbi1 не вращалась по сравнению со структурой полноразмерного TC, связанного с CNCbl.Мы наблюдали большой пик электронной плотности (S2 фиг.) В пространстве, занимаемом 5,6-диметилбензимидазольной (DMB) составляющей в Cbl-связанном TC. Эта плотность была приписана N-концу связанной с симметрией молекулы TC-beta в кристаллической решетке, с центральным атомом кобальта Cbi1, координирующим боковую цепь His305. Цианидный лиганд, связанный с центральным атомом кобальта Cbi1, также может быть смоделирован (противоположная сторона His305).
Вторая молекула Cbi (Cbi2) была обнаружена прикрепленной к поверхности TC-beta.Его центральный атом кобальта был скоординирован с боковой цепью открытого His345. Здесь гистидин координировался с противоположной стороны корринового кольца по сравнению с Cbi1. Помимо Н-связи с карбонилом основной цепи Tyr352, это был единственный контакт Cbi2 с TC-beta. Однако Cbi2 также контактировал с партнером симметрии TC-beta. Дополнительные взаимодействия, вероятно, привели к упорядочению и хорошему разрешению Cbi2. Для Cbi2 не наблюдалось электронной плотности связанного цианидного лиганда, что позволяет предположить, что он диссоциировал.Насколько нам известно, это первое сообщение о молекуле Cbi, неспецифически связанной с поверхностью белка.
Кристаллическая структура TC-beta, связанного с B12
Затем мы определили кристаллическую структуру TC-бета в комплексе с ингибирующим аналогом B12 F2PhEtyCbl (S1 Fig) [17] с разрешением 1,27 Å (Fig 2D, Table 1). Как видно из статистики (высокое значение I / σ, но низкая полнота), кристалл, вероятно, дифрагировал бы с более высоким разрешением. Однако сбор данных ограничивался минимальным расстоянием детектора на линии луча.Структура и режим связывания TC-beta, связанного с анти-B12, были аналогичны TC-beta, связанному с CNCbl (то есть анти-B12 был повернут на 11,4 ° таким же образом, как CNCbl в TC-beta) (фиг. 3A). F2Ph-группа анти-B12 была четко видна по электронной плотности. Вероятно, он был хорошо разрешен из-за взаимодействий с симметричным матом в кристалле (S3, рис.). Группа F2Ph повернута на 90 ° по сравнению с кристаллической структурой малых молекул F2PhEty-Cbl [17]. Суперпозиция анти-B12-связанной структуры TC-beta с кристаллической структурой CNCbl-связанного TC: CD320 [11] предполагает, что анти-B12 может связываться с TC так же, как CNCbl, и не будет вызывать стерических конфликтов с F2Ph- β-коаксиальный лиганд (рис. 4).
Рис. 4. Модель анти-B12, связанного с TC.
Составная модель структуры связанного с B12 TC-бета (лосось, зеленый), наложенного на CNCbl-связанный TC: CD320 (запись PDB 4ZRP, показан только альфа-домен, синий). (A) Модель показывает, что анти-B12, связанный с TC, не будет конфликтовать с белком. (B) Стерео представление (в глаза), с остатками, которые не идентичны между человеческим и мышиным TC, выделены красным.
https://doi.org/10.1371/journal.pone.0184932.g004
Обсуждение
Когда мы очищали полноразмерный TC, экспрессированный в клетках насекомых, белок оставался связанным с Cbl даже после обширной промывки на аффинных колонках (результат не показан). Для структурных исследований состояния апо денатурация представляет собой потенциальную угрозу потери структурной целостности. В ранее описанной кристаллической структуре человеческого TC дисульфидный мостик между Cys65 и Cys78 в альфа-домене отсутствовал [13]. Вполне возможно, что денатурирующий протокол в этом исследовании мог привести к дисульфидному разрушению.Чтобы избежать таких осложнений, TC-альфа: CD320 и TC-бета экспрессировались индивидуально в клетках насекомых.
Наши эксперименты демонстрируют, что holo-TC может быть собран из разделенных альфа- и бета-доменов только после добавления Cbl. Это согласуется с ранее предложенным механизмом сборки holo-TC [13, 14] и с более ранним открытием, что структурно родственный белок внутренний фактор (IF) собирается только при добавлении CNCbl [21].
Структуры apo TC-beta и TC-beta, связанные с CNCbl, обеспечивают понимание различных состояний сборки holo-TC.Они демонстрируют структурную целостность apo TC-beta и Cbl-связанного TC-beta и, следовательно, дополнительно консолидируют гипотетический механизм Cbl-зависимой сборки голо-TC. Фактически не происходит никаких структурных изменений в TC-beta при связывании Cbl, что свидетельствует против механизма индуцированной подгонки в отношении этого домена TC.
Ранее было показано, что Cbi может связываться с TC и транспортироваться в клетки посредством CD320-зависимой интернализации [22]. HC структурно связан с TC и связывает Cbi с гораздо более высоким сродством: константы скорости диссоциации были представлены как k -Cbi > 5 * 10 -2 с -1 для TC и k -Cbi <1 * 10 −5 с -1 для HC [8].В HC отсутствующий фрагмент DMB заменяется на Arg-357 [23]. Наша структура демонстрирует, что моноциано-Cbi связывается с TC-beta так же, как CNCbl. Более низкое сродство TC к Cbi [20], скорее всего, вызвано уменьшенным числом взаимодействий белок-лиганд, учитывая, что кобинамиды не содержат фрагмент DMB.
В Cbi-связанном TC-beta обе молекулы Cbi скоординированы с гистидином, что приводит к расположению, в котором боковая цепь гистидина принимает на себя роль и положение DMB-фрагмента в Cbl.Мы предполагаем, что кобинамиды обладают потенциалом неспецифического связывания со многими белками, если они содержат гистидины, подверженные воздействию растворителя.
Когда мы наложили структуру связанного с B12 TC-beta и Cbl-связанного полноразмерного TC [11], стало очевидно, что анти-B12 не будет конфликтовать с TC-alpha (Рис. 4). Нет структуры CNCbl или связанного с B12 ТС мыши, однако сайт связывания Cbl ТС человека и мыши является высококонсервативным (фиг. 4B). Поскольку сайт связывания рецептора удален от сайта связывания субстрата, мы полагаем, что анти-B12 не может препятствовать опосредованному CD320 захвату TC.Однако анти-B12 будет конкурентно ингибировать связывание Cbl с TC, что должно приводить к снижению клеточного поглощения Cbl. Молекулы анти-B12 были синтезированы с «верхним» осевым заместителем, инертным по отношению к Cbl-восстанавливающему ферменту метилмалоновой ацидурии и белку гомоцистинурии типа C (CblC) [17, 24, 25]. Остается неясным, влияет ли химическая инертность молекул анти-B12 на клеточное поглощение Cbl, такое как, например, подавление экспрессии CD320. Поворот на 90 ° F2Ph-группы в нашей структуре анти-B12-TC-биений по сравнению с конформацией, наблюдаемой в чистом соединении, предполагает, что этот лиганд свободно вращается и что нековалентные контакты, что обеспечивается симметричным матом TC- beta в нашей структуре, определим его конформацию (S2 рис.).
В структурах TC-beta, связанных с CNCbl и анти-B12, плоскости коррина лигандов повернуты относительно CNCbl в полноразмерном голо-TC на ~ 10 °. Мы предполагаем, что во время сборки holo-TC TC-alpha проталкивает субстрат глубже в связывающий карман. Смещение кристаллического контакта этих структур маловероятно, потому что, хотя оба лиганда участвуют в решеточных контактах, два белковых комплекса кристаллизовались в разных пространственных группах и имеют разные решеточные контакты (рис. 3B и 3C, таблица 1).
Наконец, наши кристаллические структуры обеспечивают визуализацию предполагаемых ранних этапов сборки голо-ТС и сродства ТС к подложке. Со структурой связанного с B12 TC-бета мы смогли пролить свет на механизм опосредованного анти-B12 ингибирования захвата Cbl. Наконец, мы продемонстрировали, что производство апо ТС-бета является надежным методом исследования взаимодействия ТС с альтернативными субстратами, поскольку его легко производить и совместно кристаллизовать с различными субстратами.Это может быть очень полезным для разработки лекарств, направленных на TC: CD320-опосредованное поглощение Cbl. Например, меченые технецием-99m аналоги Cbl были синтезированы в прошлом для нацеливания на опосредованное TC поглощение Cbl у мышей, и связывание соединений с TC, а также мечение опухоли было успешно продемонстрировано [26].
Экспериментальные процедуры
Экспрессия и очистка TC-beta
Все белки рекомбинантно экспрессируются в клетках SF21, как описано ранее для TC: CD320 [11].TC-beta был слит с N-концевой 9-гистидиновой меткой, за которой следовали мальтозо-связывающий белок и сайт расщепления TEV (N-9His-MBP-TEV_cleavage_site-ValAspHisMet-TC-beta (Gln307-W409)). Белки очищали, как описано ранее для holo-TC: CD320 [11]. Для TC-beta была введена дополнительная стадия промывки во время иммобилизации Ni-NTA для удаления всего связанного Cbl: после промывки иммобилизованного 9His-MBP-TC-beta 10 объемами колонки промывочного буфера (300 мМ NaCl, 40 мМ имидазол, pH 8,0). , 20 мМ hepes pH 7.0, 0,5 мМ CaCl 2 ) белок промывали «обессоливающим буфером» (500 cv 150 мМ NaCl, 20 мМ Трис-HCl pH 7,5, 0,5 мМ CaCl 2) .
Сборка TC-alpha: CD320 и TC-beta
10 мкМ TC-alpha: CD320 в обессоливающем буфере смешивали с 40 мкМ апо TC-beta с или без 160 мкМ CNCbl. Все компоненты хранили в обессоливающем буфере. Смеси инкубировали в течение ночи при 4 ° C. Эксклюзионную хроматографию смесей проводили на колонке TSK-G3000 с использованием системы ВЭЖХ 1260 Infinity от Agilent Technologies .Фракции пиков впоследствии анализировали с помощью SDS-PAGE и окрашивания Silver Stain Plus из Biorad .
Кристаллизация, сбор и обработка данных
TC-beta концентрировали в обессоливающем буфере и затем кристаллизовали с использованием диффузии пара в сидячих каплях. Кристаллы были заморожены в 25% глицерине. Дифракционные данные были собраны в швейцарском источнике света (SLS) на линиях пучка X06SA (апо TC-beta, Cbi-связанный TC-beta, детектор EIGER 16M) и X10SA (связанный с CNCbl TC-beta и связанный с анти-B12 TC-beta, детектор PILATUS 6M) на 1.0 Å. Данные обрабатывались с помощью XDS [27]. Построение модели было выполнено в Coot [28], а уточнения выполнялись в итерационных циклах с использованием PHENIX [29]. Первоначально были уточнены координаты XYZ, занятость и индивидуальные B-факторы. После каждого раунда доработки структуры вручную улучшались в Coot [28]. Вода добавлялась сначала автоматически, а затем вручную. Одна молекула глицерина добавлялась вручную к структурам TC-beta: B12 и апо TC-beta. На заключительных этапах уточнения проводилось уточнение анизотропного B-фактора для всех структур.Кроме того, были оптимизированы веса рентгеновских лучей / стереохимии, а также веса рентгеновских лучей / ADP.
Apo TC-beta концентрировали до 5 мг / мл и смешивали в соотношении 2: 1 с 0,2 М хлоридом натрия, 20% мас. / Об. Полиэтиленгликоля 3350. Структура была решена путем молекулярной замены (MR) на PHENIX Phaser-MR [29] с использованием усеченной версии TC (PDB ID: 4ZRP) в качестве модели поиска. Таким образом, остатки с 1 по 306, а также белок CD320 были удалены из модели.
Для кристаллизации TC-beta: CNCbl, TC-beta был смешан с 1.5 молярный избыток CNCbl до конечной концентрации 5 мг / мл и затем был смешан 1: 1 с 0,15 M дигидратом формиата магния, 22,5% мас. / Об. Полиэтиленгликоля 1000. Структура была решена MR с использованием той же усеченной версии TC, которая использовалась для решения структуры APO TC-beta в качестве модели поиска. Лиганд, а также геометрические ограничения заменены файлами из PDB ID 1CCW [30].
Для кристаллизации TC-beta: Cbi 2 , TC-beta был смешан с 1,5 молярным избытком дициано-Cbi до конечной концентрации 5 мг / мл и затем смешан 1: 1 с 0.1 М малонат натрия pH 7,0, 12% полиэтиленгликоля 3,350 (мас. / Об.). Структура была решена MR с использованием той же усеченной версии TC, которая использовалась для решения структуры APO TC-beta в качестве модели поиска. Файлы структуры лиганда и геометрических ограничений были загружены с PDB ID 5M29 [31]. В структуру TC-beta: AntiB12 была помещена одна молекула кальция, координированная одним His305 и его амидом основной цепи, который является частью гибкого N-конца, а также двумя молекулами воды и открытой поверхностью His345 симметрии партнера. .Сильный пик электронной плотности, который все еще виден при> 18 σ, указывает на необходимость размещения иона в этом положении. Все другие ионы, которые присутствовали в буфере, либо конфликтовали с координирующими атомами из-за слишком большого атомного радиуса, либо содержали слишком много электронов, что наблюдалось по большому пику отрицательной электронной плотности после уточнения.
Для кристаллизации TC-beta: anti-B12 TC-beta смешивали с 1,5 молярным избытком F2PhEtyCbl до конечной концентрации 5 мг / мл и затем смешивали 1: 1 с 0.3 M формиат калия, 17% мас. / Об. Полиэтиленгликоля 3350. Структура была определена с помощью MR с использованием кристаллической структуры апо TC-beta (PDB ID: 5NO0) в качестве модели поиска. Файлы структуры лиганда и геометрических ограничений были загружены с PDB ID 5UOS [17].
Все вычисления суперпозиции были выполнены с использованием CCP4 Superpose [32] с опцией «наложение с использованием сопоставления вторичной структуры». Для вычислений суперпозиции и среднеквадратичного отклонения мы всегда использовали остатки с 312 по 409 (человеческие TC и TC-бета имеют одинаковую нумерацию).
Дополнительная информация
S2 Рис. Связывание Cbi с гистидинами в TC-beta.
TC-beta в комплексе с Cbi, взаимодействующим с элементами симметрии в кристаллической решетке. Синяя сетка представляет собой составную карту пропусков с контуром 1 σ. (A) Cbi1 (розовый) в кармане связывания TC-beta (розовый), координированный с боковой цепью His305 партнера по симметрии (голубой). (B) Cbi2 (лосось), прикрепленный к поверхности TC-бета (голубой), координированный с боковой цепью His345. Сопряжения симметрии, контактирующие с Cbi2, показаны зеленым и оранжевым.
https://doi.org/10.1371/journal.pone.0184932.s002
(TIF)
S3 Рис. Кристаллические контакты анти-B12, связанные с TC-beta.
(A) Взаимодействие TC-beta: анти-B12 (голубой, лососевый) с симметричным элементом (оранжевый) в кристалле. Β-Коаксиальный лиганд анти-B12 участвует в контакте с кристаллами. Это взаимодействие, вероятно, приводит к упорядочению DFP-группы в кристалле. (B) Стерео-представление TC-beta: anti-B12. Две молекулы TC-beta показаны в виде палочек, вид как на A.Синяя сетка представляет собой составную карту исключения электронной плотности 2Fo-Fc с контуром 2 σ и показана только вокруг молекулы анти-B12.
https://doi.org/10.1371/journal.pone.0184932.s003
(TIF)
Благодарности
Мы благодарим сотрудников швейцарского источника света в Институте Пауля Шеррера в Виллигене за большую помощь в сборе данных. Работа поддержана Швейцарским национальным научным фондом (SNF 310030B_166672, K.П.Л.). Коды доступа PDB: 5NO0 (апо TC-бета), 5NP4 (связанный с CNCbl TC-бета), 5NRP (связанный с Cbi TC-бета), 5NSA (связанный с F2PhEtyCbl TC-бета).
Список литературы
- 1. Канната Дж. Дж., Фочези младший, Мазумдер Р., Уорнер Р. К., Очоа С. Метаболизм пропионовой кислоты в тканях животных. Xii. Свойства метилмалонил-кофермента а-мутазы млекопитающих. J Biol Chem. 1965; 240: 3249–57. pmid: 14321360.
- 2. Тейлор Р.Т., Вайсбах Х. N5-метилтетрагидрофолат-гомоцистеинтрансметилаза.Характеристики пропилирования с использованием системы химического восстановления и очищенного фермента. J Biol Chem. 1967. 242 (7): 1509–16. pmid: 6023219.
- 3. Banerjee R, Ragsdale SW. Многоликость витамина B-12: Катализ кобаламин-зависимыми ферментами. Анну Рев Биохим. 2003. 72: 209–47. pmid: 14527323
- 4. Мэтьюз Р.Г., Кутмос М., Датта С. Кобаламин-зависимые и кобамид-зависимые метилтрансферазы. Curr Opin Struct Biol. 2008. 18 (6): 658–66. pmid: 104; Идентификатор PubMed Central PMCID: PMCPMC2639622.
- 5. Мартенс Дж. Х., Барг Х., Уоррен М. Дж., Ян Д. Микробное производство витамина B12. Appl Microbiol Biotechnol. 2002. 58 (3): 275–85. pmid: 11935176.
- 6. Нильсен MJ, Расмуссен MR, Андерсен CBF, Nexo E, Moestrup SK. Транспорт витамина B-12 из пищи в клетки организма — сложный, многоэтапный путь. Nat Rev Gastro Hepat. 2012. 9 (6): 345–54. pmid: 22547309
- 7. Quadros EV. Достижения в понимании ассимиляции и метаболизма кобаламина.Brit J Haematol. 2010. 148 (2): 195–204. pmid: 19832808
- 8. Федосов С.Н., Берглунд Л, Федосова Н.У., Нексо Э., Петерсен Т.Э. Сравнительный анализ кинетики связывания кобаламина и лигандной защиты для внутреннего фактора, транскобаламина и гаптокоррина. J Biol Chem. 2002. 277 (12): 9989–96. pmid: 11788601.
- 9. Колхаус Дж. Ф., Аллен Р. Х. Поглощение, перенос плазмы и удерживание в клетках аналогов кобаламина у кролика. Доказательства существования множества механизмов, предотвращающих абсорбцию и распространение в тканях аналогов кобаламина природного происхождения.J Clin Invest. 1977; 60 (6): 1381–92. pmid: 915005; Идентификатор PubMed Central PMCID: PMCPMC372496.
- 10. Quadros EV, Nakayama Y, Sequeira JM. Белок и ген, кодирующие рецептор клеточного поглощения транскобаламина связанного кобаламина. Кровь. 2009. 113 (1): 186–92. pmid: 18779389
- 11. Алам А., Ву Дж. С., Шмитц Дж., Принц Б., Рут К., Чен Ф и др. Структурные основы распознавания транскобаламина рецептором CD320 человека. Nat Commun. 2016; 7: 12100. pmid: 27411955; Идентификатор PubMed Central PMCID: PMCPMC4947154.
- 12. Flodh H, Ullberg S. Накопление меченого витамина B12 в некоторых пересаженных опухолях. Int J Cancer. 1968; 3 (5): 694–9. pmid: 5724527.
- 13. Wuerges J, Garau G, Geremia S, Fedosov SN, Petersen TE, Randaccio L. Структурные основы транспорта витамина B12 транскобаламином у млекопитающих. Труды Национальной академии наук Соединенных Штатов Америки. 2006. 103 (12): 4386–91. pmid: 16537422; PubMed Central PMCID: PMC1450181.
- 14.Федосов С.Н., Федосова Н.У., Краутлер Б, Нексо Э, Петерсен Т.Э. Механизмы различения кобаламинов и их природных аналогов во время их связывания со специфическими белками, транспортирующими B12. Биохимия-Ус. 2007. 46 (21): 6446–58. pmid: 17487979.
- 15. Ruetz M, Salchner R, Wurst K, Fedosov S, Kräutler B. Phenylethinylcobalamin: ein radikalsynthetisch hergestelltes, lichtstabiles und hitzeresistentes Metallorganisches B12-Derivat. Angewandte Chemie. 2013. 125 (43): 11617–20.
- 16. Краутлер Б. Концепция, основанная на структуре и реакционной способности антивитаминов B12 -A. Химия. 2015. pmid: 26139567.
- 17. Рютц М., Шанмуганатан А., Герасим С., Карасик А., Салхнер Р., Кенингер С. и др. Антивитамин B12 Ингибирование человеческого B12-обрабатывающего фермента CblC: кристаллическая структура неактивного тройного комплекса с глутатионом в качестве косубстрата. Angew Chem Int Ed Engl. 2017; 56 (26): 7387–92. pmid: 28544088.
- 18. Mutti E, Ruetz M, Birn H, Krautler B, Nexo E.4-Этилфенил-кобаламин ухудшает усвоение тканями витамина B-12 и вызывает дефицит витамина B-12 у мышей. Plos One. 2013; 8 (9). АРТН e75312 pmid: 24073261
- 19. Rappazzo ME, Salmi HA, зал CA. Содержание витамина B12 в тканях взрослого человека и плода: сравнительное исследование. Br J Haematol. 1970. 18 (4): 425–33. pmid: 5420591.
- 20. Федосов С.Н., Петерсен Т.Е., Нексо Э. Связывание кобаламина и кобинамида с транскобаламином из коровьего молока. Биохимия-Ус. 1995. 34 (49): 16082–7.
- 21. Федосов С.Н., Федосова Н.У., Берглунд Л, Моэструп С.К., Нексо Э., Петерсен Т.Э. Сборка доменов внутреннего фактора и олигомеризация белка в присутствии кобаламина. Биохимия-Ус. 2004. 43 (47): 15095–102. pmid: 15554717
- 22. Lildballe DL, Mutti E, Birn H, Nexo E. Максимальная нагрузка на транспортную систему витамина B12: исследование на мышах, получавших в течение четырех недель высокие дозы витамина B12 или кобинамида. Plos One. 2012; 7 (10): e46657. pmid: 23049711; Идентификатор PubMed Central PMCID: PMCPMC3462184.
- 23. Furger E, Frei DC, Schibli R, Fischer E, Prota AE. Структурная основа универсального распознавания корриноидов гаптокоррином транспортного белка кобаламина. J Biol Chem. 2013. 288 (35): 25466–76. pmid: 23846701
- 24. Герасим С., Лофгрен М., Банерджи Р. Путешествие по дороге B (12): ассимиляция, доставка и нарушения кобаламина. J Biol Chem. 2013. 288 (19): 13186–93. pmid: 23539619; Идентификатор PubMed Central PMCID: PMCPMC3650358.
- 25. Рютц М., Герасим К., Грубер К., Федосов С., Банерджи Р., Краутлер Б.Доступ к металлоорганическим арилкобальткорринам посредством радикального синтеза: 4-этилфенилкобаламин, потенциальный «антивитамин B (12)». Angew Chem Int Ed Engl. 2013. 52 (9): 2606–10. pmid: 23404623; PubMed Central PMCID: PMC3843227.
- 26. Вайбель Р., Трайхлер Х., Шефер Н.Г., ван Ставерен Д.Р., Мундвилер С., Кунце С. и др. Новые производные витамина B12 оказывают преимущественное воздействие на опухоли. Cancer Res. 2008. 68 (8): 2904–11. pmid: 18413759.
- 27. Kabsch W. Xds. Акта Кристаллогр Д.2010; 66: 125–32. pmid: 20124692
- 28. Эмсли П., Каутан К. Кут: инструменты построения моделей для молекулярной графики. Acta Crystallogr D. 2004; 60: 2126–32. pmid: 15572765
- 29. Адамс П.Д., Афонин П.В., Бункочи Г., Чен В.Б., Дэвис И.В., Эчолс Н. и др. PHENIX: комплексная система на основе Python для решения макромолекулярных структур. Acta Crystallographica Раздел D. 2010; 66 (2): 213–21. pmid: 20124702
- 30. Reitzer R, Gruber K, Jogl G, Wagner UG, Bothe H, Buckel W и др.Глутаматмутаза из Clostridium cochlearium: структура кофермента B12-зависимого фермента дает новые представления о механизме. Состав. 1999; 7 (8): 891–902. pmid: 10467146.
- 31. Mireku SA, Ruetz M, Zhou T, Korkhov VM, Krautler B, Locher KP. Конформационное изменение остатка триптофана в BtuF способствует связыванию и транспорту кобинамида транспортером витамина B12 BtuCD-F. Научный доклад 2017; 7: 41575. pmid: 28128319; Идентификатор PubMed Central PMCID: PMCPMC5269720.
- 32.Криссинель Э., Хенрик К. Сопоставление вторичной структуры (SSM), новый инструмент для быстрого выравнивания структуры белка в трех измерениях. Acta crystallographica Раздел D, Биологическая кристаллография. 2004; 60 (Pt 12 Pt 1): 2256–68. pmid: 15572779.
Разница между витамином B и витамином B12
Основное различие — витамин B и B12
Кажется, существует большая путаница в отношении разницы между витамином B и витамином B 12 . Витамин B представляет собой водорастворимый витаминный комплекс и представляет собой группу пищевых органических соединений, в которую входят витамины B1, B2, B3, B5, B6, B7, B9 и B12. Комплекс витаминов B особенно важен для клеточного метаболизма в организме человека. Напротив, витамин B12 является одним из восьми комплексов витаминов группы B, и он также известен как кобаламин. Это в основном жизненно важно для образования красных кровяных телец и функции мозга и нервной системы. В этом главное отличие между витамином B и витамином B12.В этой статье давайте подробно рассмотрим разницу между витамином B и витамином B12 с точки зрения их предполагаемого использования и других химических характеристик.
Что такое витамин B
Витамины группы В — это группа водорастворимых незаменимых органических соединений, которые играют важную роль в клеточном метаболизме. Хотя эти витамины имеют более или менее похожие названия, исследования показывают, что это химически разные витамины, которые часто встречаются в одинаковых продуктах питания. Все витамины группы B и их альтернативные названия перечислены ниже;
Витамин B1 или тиамин
Витамин B2 или рибофлавин
Витамин B3, ниацин или никотиновая кислота
Витамин B5 или пантотеновая кислота
Витамин B6, пиридоксин, пиридоксаль или пиридоксамин
Витамин B7 или биотин
Витамин B9 или фолиевая кислота
Витамин B12 или различные кобаламины, такие как цианокобаламин или метилкобаламин
Что такое витамин B12
Витамин B12, также известный как кобаламинов , также является водорастворимым витамином.Он принадлежит к витаминным комплексам B, и его основная роль заключается в том, чтобы способствовать нормальному функционированию нервной и мозговой системы, а также синтезировать эритроциты. Кроме того, витамин B12 также участвует во всех без исключения путях клеточного метаболизма в организме человека, поскольку он необходим для синтеза и регулирования ДНК, метаболизма аминокислот и жирных кислот. Люди, другие животные или растения не могут производить витамин B12. Только бактерии и археи могут синтезировать витамин B12. Это самый крупный и структурно сложный витамин среди всех витаминов.Он состоит из очень редкого в биохимическом отношении компонента кобальта, находящегося в центре тетра-пиррольного кольца структуры витамина B12, также известного как кольцо коррина.
Разница между витамином B и витамином B12
Разницу между витамином B и витамином B12 можно разделить на следующие категории. Они есть;
Группа витаминов
Витамин B — водорастворимый витаминный комплекс, состоящий из восьми различных витаминов.
Витамин B12, , также известный как кобаламин, обычно представляет собой один из типов витаминов в комплексе витаминов B.
Химическая структура
Разные витамины В, имеют разную структуру. В качестве примера ниже приводится структура витаминов B1 (тиамин) и B2 (рибофлавин).
Витамин B12 имеет очень сложную структуру и основан на кольце коррина. Центральный ион металла в этом кольце — кобальт. В этом кольце шесть координационных центров (R — на рисунке 2), а шестой координационный центр представляет собой цианогруппу (-CN), гидроксильную группу (-OH), метильную группу (-Ch4) или 5-ю группу. ‘-Деоксиаденозильная группа
Источник
Богатые источники витамина B включают бобовые, цельнозерновые, картофель, бананы, перец чили, темпе, пищевые дрожжи, пивные дрожжи и патоку.Помимо этих растительных источников, витамины группы B в основном сконцентрированы в мясе, например, в индейке, тунце и печени. Витамины группы В можно найти в цельнозерновых злаках; обработанные зерна, как правило, имеют более низкое содержание витамина B, чем их необработанные аналоги. В результате витамины группы B иногда после обработки обогащаются тиамином, рибофлавином, ниацином и фолиевой кислотой, и они известны как обогащенная мука. Хотя пиво является естественным источником витаминов группы B, его биодоступность очень низкая, поскольку употребление этанола подавляет абсорбцию тиамина, рибофлавина, ниацина, биотина и фолиевой кислоты.
Витамин B12 Богатыми источниками являются в основном продукты животного происхождения, такие как рыба, моллюски, мясо, печень, яйца, молоко и молочные продукты. Иногда сухие завтраки, соевые продукты, энергетические батончики и пищевые дрожжи обогащены витамином B12. Витамин B12 недоступен из растительных продуктов.
Дополнения
Добавки с витамином B могут содержать либо все восемь комплексов витаминов B, включая поливитамины, либо отдельные добавки с витамином B.
Витамин B12 используется в качестве добавки ко многим обработанным пищевым продуктам, а также доступен в форме витаминных таблеток, назального спрея или инъекций. Витамин B12 также является обычным компонентом энергетических напитков. Эти добавки необходимы для предотвращения дефицита, особенно у вегетарианцев. Промышленный B12 производится путем бактериальной ферментации избранных микроорганизмов.
Значение
В комплексе разные типы витамина B играют разные роли в организме человека.Вот некоторые из их основных ролей.
Витамин B1, B2, B3 и B5: образуют коферменты и участвуют в производстве энергии для цепи переноса электронов, цикла лимонной кислоты, а также в окислении жирных кислот и углеводов
Витамин B6 — кофактор метаболизма аминокислот
Биотин — участвует в метаболизме липидов, белков и углеводов
Фолиевая кислота действует как кофермент и участвует в делении клеток, развитии нервной трубки и производстве красных кровяных телец
Витамин B12 выполняет несколько функций, а именно:
Участвует в клеточном метаболизме углеводов, белков и липидов
Производство клеток крови в костном мозге
Действует как кофермент промежуточного метаболизма для реакции метионинсинтазы
Побочные эффекты
Избыточное потребление добавок витамина B может вызвать временные побочные эффекты, такие как беспокойство, тошнота и бессонница.
Высокий уровень витамина Уровень B12 у пожилых людей может защитить от болезни Альцгеймера и нарушения когнитивных функций. Однако чрезмерное потребление добавок витамина B12 может вызвать поражения кожи и позвоночника или угревую сыпь.
Дефицит
Различные типы дефицит витамина B могут вызывать некоторые из следующих заболеваний.
- Дефицит тиамина вызывает авитаминоз.
- Дефицит рибофлавина вызывает арибофлавиноз.
- Дефицит ниацина вызывает пеллагру.
Дефицит витамина B12 вызывает макроцитарную анемию, повышенный уровень гомоцистеина, периферическую невропатию, потерю памяти и другие когнитивные нарушения.
Рекомендуемое потребление
Различные типы Витамин B имеют разные рекомендуемые уровни потребления.
Диетическая норма Потребление витамина B12 для взрослого составляет от 4 до 7 мкг в день. Однако потребность беременных женщин в витамине B12 составляет 2.6 мкг в сутки, а у кормящих женщин — 2,8 мкг в сутки.
В заключение, комплекс витаминов B является важным питательным веществом для человеческого организма. Витамин B12 — важный водорастворимый витамин, который также входит в комплекс витаминов B.
Каталожные номера:
5’-дезоксиаденозилкобаламин и метилкобаламин в качестве источников витамина B12, добавленного в качестве питательного вещества в пищевые добавки — Научное заключение Научной группы по пищевым добавкам и источникам питательных веществ, добавленным в пищу (2008).EFSA Journal 815 , 1–21.
Батлер, К. С. (2006). Пероральный витамин B12 по сравнению с внутримышечным витамином B12 при дефиците витамина B12: систематический обзор рандомизированных контролируемых исследований. Семейная практика 23 (3), 279.
Национальная академия наук. Институт медицины. Совет по продовольствию и питанию., Изд. (1998). Рекомендуемая диета для тиамина, рибофлавина, ниацина, витамина B6, фолиевой кислоты, витамина B12, пантотеновой кислоты, биотина и холина.Вашингтон, округ Колумбия, National Academy Press.
Изображение предоставлено:
«Кобаламин», автор — Ymwang42 (разговор). Первоначально загрузчик был Ymwang42 в en.wikipedia — перенесен из en.wikipedia (общественное достояние) через Commons
«Рибофлавин» от Calvero . — Самостоятельное создание с помощью ChemDraw. (Общественное достояние) через Wikimedia Commons
«Тиамин» от NEUROtiker — Собственная работа. (Общественное достояние) через Commons
Разбитые функциональные группы витамина B12
Tutor HuntResources Химические ресурсы
Как компоненты витамина B12 влияют на его активность и использование в организме
Дата : 09.07.2015
Загружено пользователем : Ihsaan
Загружено : 07/09/2015
Тема : Химия
Витамин B12 можно разделить на группу из 4 корриноидов с похожей структурой, все с суффиксом кобаламин.Он широко считается наиболее сложным витамином и был выделен только в 1948 году, но не был синтезирован до 1973 года. Он, как правило, стабилен и подчиняется правилу 18 электронов. Все структурные компоненты сосредоточены на атоме кобальта в ядре, с его 6 координационными центрами в октаэдрическом центре, что дает много места; четыре сайта заняты корриновым кольцом (красный), еще один — группой 5,6-диметилбензимидазола (DMB) (синий), а шестой координационный сайт (желтый) имеет четыре возможности, где R = OH, Me, CN или 5 -деоксиаденозил — которые создают различные формы кобаламина.К части корринового кольца присоединена нуклеотидная группа, которая содержит азотистое основание, фосфатную группу (обе зеленые) и соединение сахара. Множественные боковые амидные цепи, окружающие кольцо, играют большую роль в одной из многих ролей связывания B12 с белком; именно металлоорганическая природа витамина, в частности его связь металл-углерод, придает ему основные свойства. Это необычно для витаминов, ведь только B12 содержит металлический компонент. Основная причина стабильности этой молекулы, без которой мы не могли бы применять ее в качестве лекарственного средства и транспортировать по всему телу, — это стабилизированная пи-система, созданная расширенной сопряженной системой двойных связей в кольце коррина.Все они находятся на близком расстоянии друг от друга и могут вызывать резонансные формы. Эта низкоэнергетическая система приводит к тому, что активный центр кобальта является предпочтительной мишенью для переноса функциональных групп между различными формами B12. Из четырех типов B12 — метилобаламина (MeCobl), аденозилкобаламина (AdCobl), гидроксокобаламина (HCobl) и цианокобаламина (CyCobl) — только первые два являются активными коферментами и играют роль в основном использовании B12 — метаболизме в организме. Это стало возможным благодаря «удаляемой лигандной группе на металлическом активном центре» (1) кобальта.Попав внутрь организма, есть два способа расщепления этой кобальт-углеродной полосы, которые вызывают различные реакции, катализируемые ферментами; Изомеразы Для них требуется аденозилкобаламин в качестве кофактора фермента метилмалонил-КоА-мутазы для получения сукцинил-КоА для извлечения энергии и производства гемоглобина. Гомолитический разрыв связи Co-C приводит к появлению свободного радикала, который «позволяет атому водорода мигрировать с углерода субстрата на соседний углерод» (2) в обмен на другую группу.Очевидно, аденозилкобаламин — единственная молекула с лигандом, способная это делать; таким образом, принимает участие конкретная форма B12. Металлический кобальт может обратимо изменяться между состояниями окисления Co (II) и Co (III), в то время как в активном центре образуется больше 5-дезокси-5-аденозильных радикалов. Метилтрансферазы Метилкобаламин является кофактором фермента метионинсинтазы, который способствует превращению аминокислоты гомоцистеина в метионин, химическое вещество, необходимое для метилирования ДНК и образования красных кровяных телец.Он гетеролитически расщепляется в активном центре, и оба электрона переходят на кобальт. Катион метила впоследствии может высвобождаться из витамина и передаваться другой молекуле. Связь металл-углерод является основой некоторых из наиболее важных функций кобаламина, связанных с кровью и ДНК внутри тела, и энтальпия его слабой связи является основным фактором для этого. Дефицит B12 может вызвать анемию с такими симптомами, как усталость, головные боли и проблемы с подвижностью и зрением.HCobl и CyCobl были бы неэффективны в этих двух процессах, и если бы они были единственными формами B12, анемия была бы неизбежной. Огромных различий в свойствах кобаламина в зависимости от одного лиганда -R достаточно, чтобы оказывать значительное влияние на человеческий организм. Самая стабильная и дешевая форма B12 — CyCobl. Именно эта форма наиболее широко распространена в поливитаминах и пищевых добавках, хотя она не может использоваться организмом для обмена веществ. Он должен быть преобразован в MeCobl в печени, где его цианидный лиганд заменен метильной группой.HCobl также преобразуется в другие формы с той же целью. Его основное применение в качестве лекарственного средства — лечение отравления цианидом, поскольку «соединения кобальта обладают способностью связывать и выводить токсины из цианида» (3). Он способен прикрепляться к цианиду до такой степени, что он может «вытягивать цианид из митохондрий клетки с образованием цианокобаламина» (4) вместо гидроксид-лиганда. В настоящее время это основа одного из наиболее успешных методов лечения отравления цианидом, механизм действия которого основан на силе лигандов -R в двух формах B12 и их стабильности с цианидом и без него.Превращение введенного в организм HCobl и его сродство к цианиду привело к эффективному использованию. CyCobl и все следы цианида безопасно смываются с минимальными побочными эффектами. Семь амидных цепей — три ацетамида и четыре пропионамида — прикрепленные к корриновому кольцу, увеличивают структуру и могут быть превращены в сложные эфиры путем гидролиза вначале до кислот. Это обеспечивает дополнительные атомы кислорода, которые увеличивают способность молекулы связывать водород и играют «ключевую роль в том, как кобаламины взаимодействуют с белками» (5) в организме.Это увеличивает растворимость и облегчает транспортировку и доступ по кровотоку. Полиамиды также вытянуты и удлинены с двумя или тремя атомами углерода, чтобы потенциально захватить молекулы при прохождении реакции. Одним из компонентов, который играет решающую роль в роли витаминов в создании нуклеиновой кислоты, является нуклеотидная цепь, связанная с седьмым амидом на кольце коррина, выделенным зеленым на рисунке 1. Она состоит из фосфатной группы, сахара и азотистого основания.Они специально используются в качестве мономеров ДНК, как уже было замечено ранее в метитрансферазах. Нуклеотид присоединяется к диметилбензимидазолу, который, в свою очередь, соединяется в качестве лиганда с центром кобальта; из-за этого требуется строгое ограничение положения, которое снижает стабильность молекулы и делает ее уязвимой для атаки. Однако диметилбензимидазольная группа, хотя и не связана напрямую с корриновым кольцом, оказывает умеренное усиливающее действие на конъюгированную систему, что увеличивает стабильность молекулы.
Ресурс загрузил: Ihsaan
.